456
A HibUl. IM1U.1 .Vv,« r ), buui :uO
ISBN D4H1II t-7. © l>. WN TOS >«}
456 15 ZWIĄZKI KOORDYNACYJNE
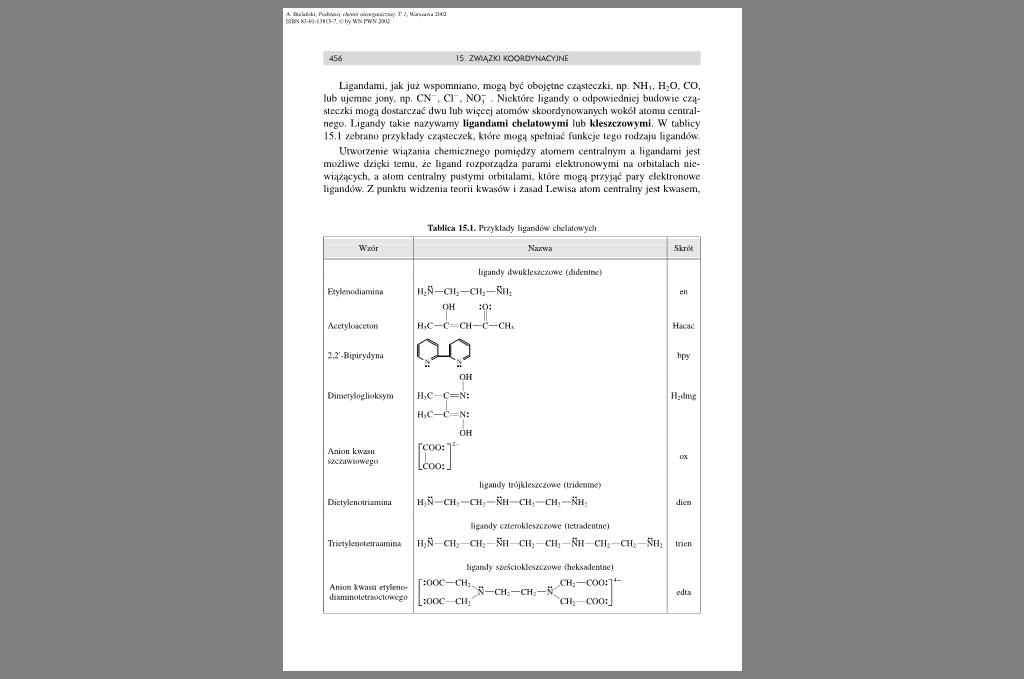
Ugandami, jak już wspomniano, mogą być obojętne cząsteczki, np. NH«. H:0. CO. lub ujemne jony, np. CN . Cl . NO7 Niektóre ligandy o odpowiedniej budowie cząsteczki mogą dostarczać dwu lub więcej atomów skoordynowanych wokół atomu centralnego. Ligandy takie nazywamy Ugandami chclatowymi lub kleszczowymi. W tablicy 15.1 zebrano przykłady cząsteczek, które mogą spełniać funkcje tego rodzaju ligandów.
Utworzenie wiązania chemicznego pomiędzy atomem centralnym a ligamlami jest możliwe dzięki temu. żc Ugand rozporządza parami elektronowymi na orbitalach niewiążących. a atom centralny pustymi orbitalami, które mogą przyjąć pary elektronowe ligandów. 7. punktu widzenia teorii kwasów i zasad Lewisa atom centralny jest kwasem.
Tablica 15.1. Przykłady ligandów dKliiluwych
|
Wzór |
Nazwa |
Skrót |
|
ligandy dwukleszcziww (didenltKl | ||
|
Etylenodiamina |
n.fi—ol—cif.—Rh. oh :o: |
cn |
|
Acctyloaccton |
H,C—C=CH—C—CH, |
Hasać |
|
2.2'-Bipirydyna |
0-0 |
hpy |
|
OH | ||
|
Dimciytoglioksym |
HiC—C=N: |
lł:dmg |
|
H,C—C=N: | ||
|
Anion kwatu szczawiowego |
OH rrr Lcoo:J |
1>X |
|
ligandy trójklctzczowe (uriiknmc) | ||
|
Diciylcnoir lanuna |
H.N—CH,— Ol—NH—CH. — CH; — NU- |
dien |
|
ligandy cztcrokieizczowe fictradcninc) | ||
|
Trietylcnotetniainina |
11.R—ciij—chj—Rh ch.-ch. nu—ciu—cil—Rh. |
irien |
|
Amon kwsui etyteno-tliiuiunoieliaioelinwgo |
ligandy szedciokleszczowe llieksadentnej pOOC—CH:V„ „ CH;-COOn4-N—CH;—CH;—N [_:OOC CII, Clt.—COO:J |
edta |
Wyszukiwarka