463

A HibUl. IM1U.1 ,Vvu :u, r ), buui :uO
ISBN D4H1II © l>. »N TOS >*}
15 4 RÓWNOWAGI V/ ROZTWORACH ZWIĄZKÓW KOMPLEKSOWYCH 463
Na zakończenie tego paragrafu omówimy jeszcze kilka przykładów stereoizomern kompleksów oklacdrycznych (LK 6) zawierających ligandy proste i ligandy chela-towc. Izomeria geometryczna z odmianami cis i trans, różniącymi się barwą, pojawia się w przypadku jonu tetraaminadichlorokobal(U(TTI), ICoCIjlNHjlJ1. Strukturę obu izomerów, fioletowego cis i zielonego trans przedstawiono na rys. I5.ó. Przykładem izomerii optycznej kompleksu oktacdryczncgo jest izomeria kompleksu chdatowcgo tris(etylenodiamina)kobaltu<!TI) [Co(H,N CH>-CH, NH,)j]v". Jak wskazuje lys. 15.7, na którym cząsteczkę etylenodiaminy H:N CH, • CH. • NH- zaznaczono skrótem "en", kompleks ten nie itui płaszczyzn symetrii ani środka symetrii i z lego powodu jest optycznie czynny. Stanowi on natomiast ciekawy przypadek kompleksu zawierającego tylko jedna oś dwukrotną (grupa punktowa C2).
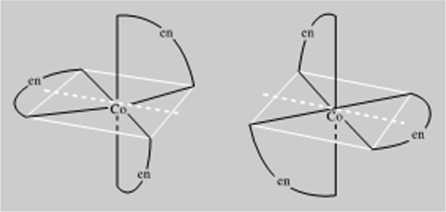
Rys. 15.7. I/ctncria optyczna jonu Imtclylcmuliaininalfciibiillutlll) Dwukrolna oi symetrii zaznaczona
luna białą przerywaną
15.4. RÓWNOWAGI W ROZTWORACH ZWIĄZKÓW KOMPLEKSOWYCH
Większość reakcji prowadzących do utworzenia związków koordynacyjnych przeprowadzamy w roztworach wodnych. Tworzenie się kompleksów w takich roztworach ma duzc znaczenie nic tylko w chemii nieorganicznej. lecz. również w biochemii, chemii analitycznej, metalurgu itd. Kationy w roztworze wodnym występują — jak juz wiadomi! — w postaci uwodnionej i traktujemy je jako kationy kompleksowe, akwakationy. Tworzenie się kompleksów w roztworze jest w rezultacie w swojej istocie wymianą ligandów H<0 na inne ligandy, np. NH>, wprowadzone do roztworu Podstawienie nowych ligandów odbywa się stopniowo. Ustala się przy tym szereg równowag zależnych od stężenia wprowadzonego ligamlu. Jako przykład rozpatrzymy tworzenie się kom plcksu aminaniklu(II) przez stopniową eliminacje cząsteczek wody z akwakomplcksu
(NilHiO)*)2*:
[Ni(H,OMł> + NH. ^ |Ni(H:0),NH,):‘ + H,0 (a)
[NiłH;OMNHi)|?* + NH, ** INi(H:OUNH,),lH + H:Q ibl
Wyszukiwarka