467
A HibUl. IM1U.1 ,Vv»« --u, r ), buui :uO
ISBN D4H1II ł-7. © l>. »N TOS >*}
15 5 STAŁE TRWAŁOŚCI KOMPLEKSÓW W ROZTWORACH WODNYCH Zó7
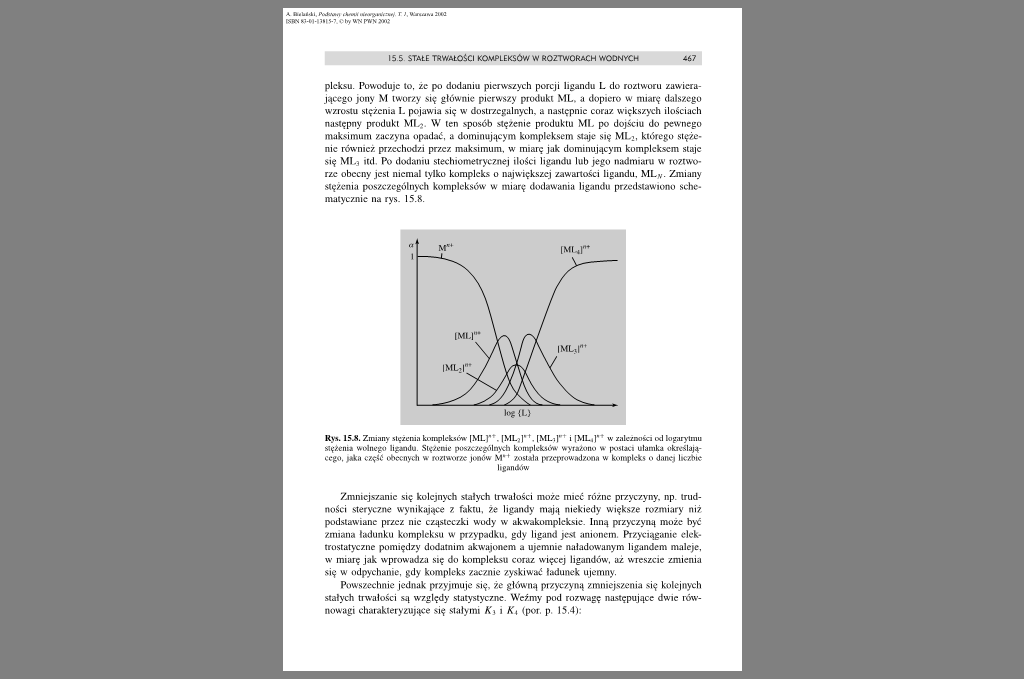
plck.su. Powoduje to. ze po dodaniu pierwszych porcji ligandu L do roztworu zawierającego jony M tworzy się głównie pierwszy pruduki ML. a dopiero w miarę dalszego wzrostu stężenia I. pojawia się w dostrzegalnych, a następnie coraz większych ilościach następny produkt ML*. W len sposób stężenie produktu ML po dojściu do pewnego maksimum zaczyna opadać, a dominującym kompleksem staje się ML., którego stężenie również przechodzi przez maksimum, w miarę jak dominującym kompleksem staje się ML) ud Po dodaniu stechiometrycznej ilości ligandu lub jego nadmiam w roztworze obecny jest niemal tylko kompleks o największej zawartości ligandu. MLV. Zmiany stężenia poszczególnych kompleksów w miarę dodawania ligandu przedstawiono schematycznie na rys. 15.8.
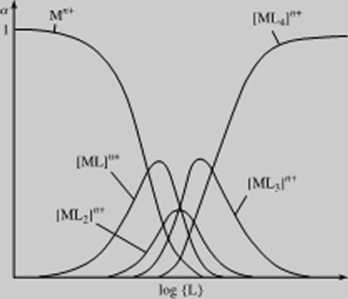
Rys. 15Ji. Zmiany stężenia kompleksów- |ML)*T. |MLj|,ł. |ML-.|''' i |.ML,|" w zależności od logarylmu stężenia wolnego ligandu Stężenie poszczególnych kompleksów wyłażono w postaci ułamka określającego. jaku część obecnych w roziworzc jonów M* * została przeprowadzona w kompleks o danej liczbie
ligamłów
Zmniejszanie się kolejnych stałych trwałości może mieć różne przyczyny, np. trudności eteryczne wynikające z faktu, ze ligandy mają niekiedy większe rozmiary niż podstawiane przez mc cząsteczki wody w akwakomplcksic. Inną przyczyną może być zmiana ładunku kompleksu w przypadku, gdy ligand jest anionem. Przyciąganie elektrostatyczne pomiędzy dodatnim akwąjonem a ujemnie naładowanym ligandem maleje, w miarę jak wprowadza się do kompleksu coraz więcej ligandów. az wreszcie zmienia się w odpychanie, gdy kompleks zacznie zyskiwać ładunek ujemny.
Powszechnie jednak przyjmuje się, że główną przyczyną zmniejszenia się kolejnych stałych trwałości są względy statystyczne. Weźmy pod rozwagę następujące dwie równowagi charakteryzujące się stałymi Ki i K, (por. p 15.4):
Wyszukiwarka