skanuj0019
|
jonu + f i |
do jonu + 4 |
ci© ę |
O |
'©000 |
|
JL X i * |
X A-**- |
i y— ^ is— v & | ||
|
f > jonis -(• — I™"-™ |
do ■'**' jonu |
O 0 |
o | |
|
- przyciąganie ć-X ” uwspólnione elektrony |
\ / powłoki elektronowe—V | |||
b) ^ „
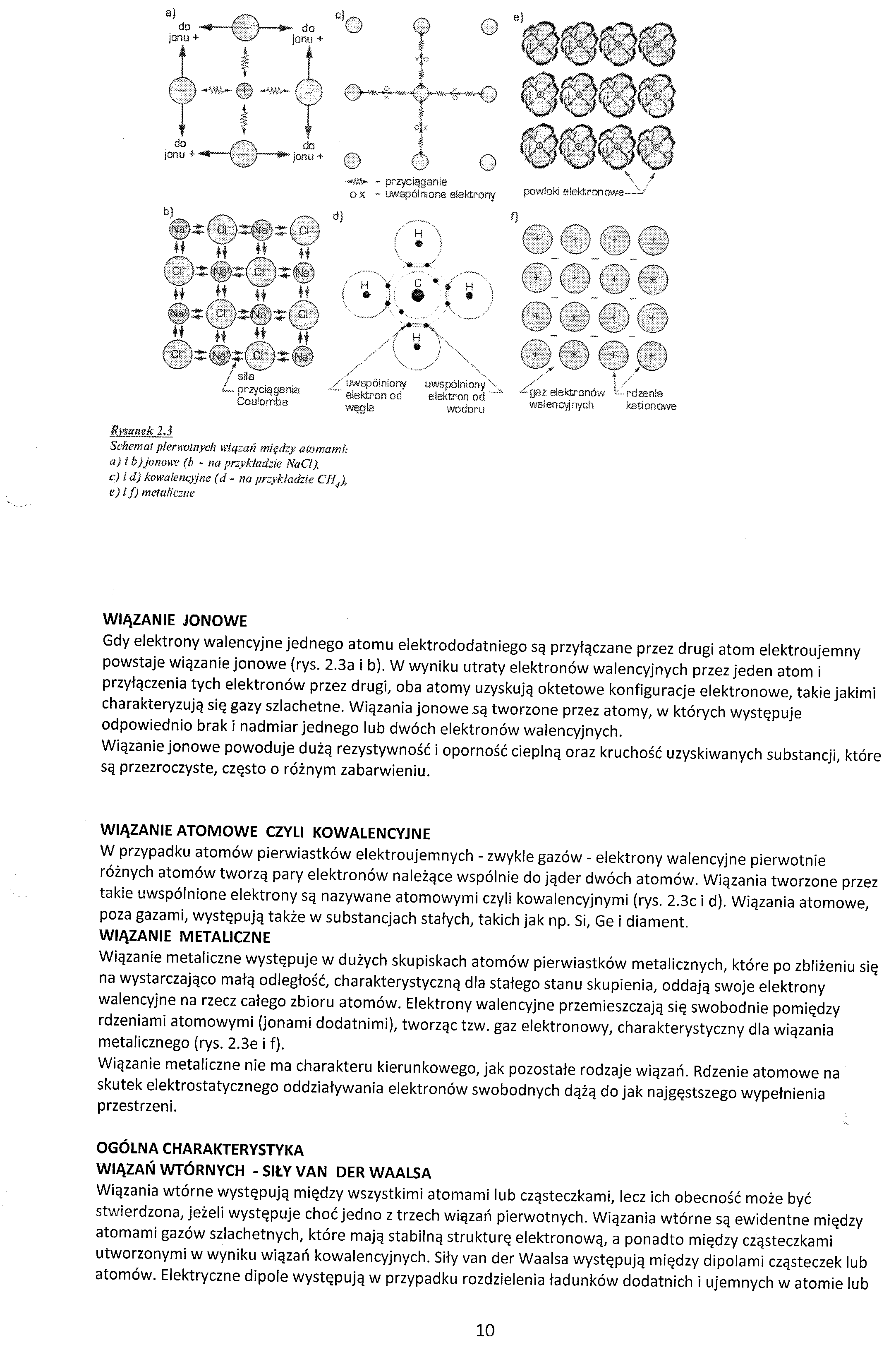
Rysunek 23
Schemat pierwotnych wiązań między atomami: a) i h) jonowe (b - na przykładzie Nad), c.) i d) kowalencyjne (d - na przykładzie C114), e) i f) metaliczne
WIĄZANIE JONOWE
Gdy elektrony walencyjne jednego atomu elektrododatniego są przyłączane przez drugi atom elektroujemny powstaje wiązanie jonowe (rys. 2.3a i b). W wyniku utraty elektronów walencyjnych przez jeden atom i przyłączenia tych elektronów przez drugi, oba atomy uzyskują oktetowe konfiguracje elektronowe, takie jakimi charakteryzują się gazy szlachetne. Wiązania jonowe są tworzone przez atomy, w których występuje odpowiednio brak i nadmiar jednego lub dwóch elektronów walencyjnych.
Wiązanie jonowe powoduje dużą rezystywność i oporność cieplną oraz kruchość uzyskiwanych substancji, które są przezroczyste, często o różnym zabarwieniu.
WIĄZANIE ATOMOWE CZYLI KOWALENCYJNE
W przypadku atomów pierwiastków elektroujemnych - zwykle gazów - elektrony walencyjne pierwotnie różnych atomów tworzą pary elektronów należące wspólnie do jąder dwóch atomów. Wiązania tworzone przez takie uwspólnione elektrony są nazywane atomowymi czyli kowalencyjnymi (rys. 2.3c i d). Wiązania atomowe, poza gazami, występują także w substancjach stałych, takich jak np. Si, Ge i diament.
WIĄZANIE METALICZNE
Wiązanie metaliczne występuje w dużych skupiskach atomów pierwiastków metalicznych, które po zbliżeniu się na wystarczająco małą odległość, charakterystyczną dla stałego stanu skupienia, oddają swoje elektrony walencyjne na rzecz całego zbioru atomów. Elektrony walencyjne przemieszczają się swobodnie pomiędzy rdzeniami atomowymi (jonami dodatnimi), tworząc tzw. gaz elektronowy, charakterystyczny dla wiązania metalicznego (rys. 2.3e i f).
Wiązanie metaliczne nie ma charakteru kierunkowego, jak pozostałe rodzaje wiązań. Rdzenie atomowe na skutek elektrostatycznego oddziaływania elektronów swobodnych dążą do jak najgęstszego wypełnienia przestrzeni.
OGÓLNA CHARAKTERYSTYKA
WIĄZAŃ WTÓRNYCH - SIŁY VAN DER WAALSA
Wiązania wtórne występują między wszystkimi atomami lub cząsteczkami, lecz ich obecność może być stwierdzona, jeżeli występuje choć jedno z trzech wiązań pierwotnych. Wiązania wtórne są ewidentne między atomami gazów szlachetnych, które mają stabilną strukturę elektronową, a ponadto między cząsteczkami utworzonymi w wyniku wiązań kowalencyjnych. Siły van der Waalsa występują między dipolami cząsteczek lub atomów. Elektryczne dipole występują w przypadku rozdzielenia ładunków dodatnich i ujemnych w atomie lub
ą łł W M
[z N^i
łł Ii łf ^
*K°***f°'
ii, H ii V
(V):£: (Na}j:(cr) x ^
/ siSa
L~. przyciągania Coulornba
H
' uwspólniony uwspólniony v ' elektron od elektron od węgla wodoru
/rz\ ysm,,
; i [ j i j
dgaz elektronów E-.-rdzenie walencyjnych kationowe
10
Wyszukiwarka
Podobne podstrony:
skanuj0016 tif koniec lat 90’tych wartość ta wzrosła do sporo ponad 1,000 miliardów dziennie (do 1,2
80911 skanuj0009 (144) ! do pKctuteioaMk. i^jfcusiecb 4O-OIa Ob to?53^ ^PS&h(
skanuj0010 m&k*Q 3h lOurwk/ XkoAaaow Ci 1 4) 35cSoo 1 H} wo.cco JM • (0. ODO 55(2] OOOn
skanuj0011 (67) Do gładzenia wstępnego stosowane są osełki o wielkości ziarna 100-r F240/45 i twardo
skanuj0012 (405) Do socjologii wprowadził to pojęcie Milton M. Gordon i zdefiniował je następująco:
skanuj0013 (29) I I drgania o częstotliwości 20 000 herców. Powstają wówczas siły kawitacyjne rzędu
skanuj0015 (290) Do zbrojenia betonu należy stosować pręty ze stali o dużej ciągliwości tj. - stal k
więcej podobnych podstron