Obraz (2646)

1.1. Literatura uzupełniająca
1. J. Koryta, J. Dvorak, V. Bohaćkova, Elektrochemia, PWN. Warszawa 1980.
2. 2. G a 1 us, Metody instrumentalne w analizie chemicznej, PWN, Warszawa 1979.
3. W. Libuś, Z. Libuś, Elektrochemia, PWN, Warszawa 1975.
4. M. Pourbaix, Wykłady z korozji elektrochemicznej, PWN, Warszawa 1978.
5. G. W. Ewing, Metody instrumentalne w analizie chemicznej, PWN, Warszawa 1980.
1.2. Literatura zalecana
1. Z. G a 1 u s, Teoretyczne podstawy elektroanalizy chemicznej, PWN, Warszawa 1977.
2. Z. G a 1 u s, Fundamentals of Electrochemical Analysis, 2nd Edition, Ellis Horwood, PWN, Warszawa 1994.
3. M. M. Baizer, Organie Electrochemistry, Plenum Rosetta, New York 1973.
4. J. 0*M. Bockris, J. K. M. Reddy, Modem Electrochemistry, Plenum Rosetta, New York 1973.
5. B. W. Ross i ter, J. F. Hamilton, Physical Methods of Chemistry, vol. n, Electrochemical Methods, J. Wiley, 1986.
6. H. Scholl, Solwatacja i procesy elektrochemiczne w rozpuszczalnikach niewodnych, Wyd. Uniwersytetu Łódzkiego, Łódź 1992.
7. B. B. Damaskin, O. A. Petrij, Wwiedienije w elektrochimiczeskuju kinetiku. Nauka, Moskwa 1975.
8. J. 0’M. Bockris, Shahed U. M. Khan, Surface Electrochemistry, Plenum Press, New York 1993.
2. RÓWNOWAGI TERMODYNAMICZNE W ROZTWORACH ELEKTROLITÓW
2.1. Termodynamiczne właściwości roztworów: definicje i podstawo* c zależności
Podobnie jak w przypadku dowolnych roztworów, podstawowa termodynamiczna charakterystyka roztworów elektrolitów wymaga znajomość, wartości absolutnych lub względnych cząstkowych molowych funke . termodynamicznych. Wymieńmy najważniejsze ze względnych funkcji (uzupełnić przypomnieniem kursu podstawowego z chemii fizycznej):
1. Cząstkowa molowa energia Gibbsa, czyli potencjał chemiczny:
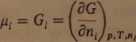
(LI ■
Pamiętajmy, że G„ Hi są wielkościami, których wartości bezwzględnej nie można wyznaczyć. Z reguły posługujemy się wartościami przyrostów tych funkcji względem ich wartości w stanie standardowym.
Oliver W. GIBBS (1822-1908). profesor chemii fizycznej City College oj New York, a później Harvard University (USA). Zajmował się podstawomi termodynamiki (energia swobodna Gibbsa) i problemami adsorpcji na powierzchni elektrod. Biografowie powiadają, że objęcie wysokich funkcji administracyjnych Uniwersytetu w Harwardzie przerwało naukową karierę Gibbsa.
2. Cząstkowa molowa entalpia:
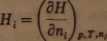
(2-2)
3. Cząstkowa molowa entropia, której przyrosty wyznacza się doświadczalnie:
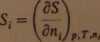
(2.3
Wyszukiwarka
Podobne podstrony:
16. Literatura uzupełniająca: 1. Patkowski S.: Konstrukcje stalowe, Wyd. PWN, Warszawa 2001. 2. Boru
-6- LITERATURA UZUPEŁNIAJĄCA Halliday D., Resnick R., Fizyka Tom 2, PWN, Warszawa 1974, s.268
Literatura uzupełniająca 1. Minczewski J., Marczenko Z., Chemia analityczna, PWN,
Literatura uzupełniająca 1 Czapów Cz., Jedlewski S., Pedagogika resocjalizacyjna. Warszawa
Literatura uzupełniająca: A. Kalisz, A. Zienkiewicz, Mediacja sądowa i pozasądowa. Warszawa 2009,
Scholar Literatura uzupełniająca: Aronson, E. (2000). Człowiek istota społeczna. Warszawa:
czworownow2 bmp a« literatura Atabiekow G.I., Teoria liniowych obwodów elektrycznyeh, WIT, Warszawa
img093 Literatura [1] Fichtcncholz G. M.: Rachunek różniczkowy i całkowy, 1.1, II,
img134 Literatura 1. Berman G.N. : 2biór zddań z analizy matematycznoj PWN. Warsza
IMGC78 Literatura W S lądecki L, 200". Histona ogrodów 11. PWN Warszawa 5 Majdecki L., 2008. Hi
Literatura [1] Ralston A.: Wstęp do analizy numerycznej. PWN Warszawa 1975. [2]
więcej podobnych podstron