skan0306

Elektrochemia 309
^ ^o\ Gcd ^rcd ^
ox
i związana jest z gęstością prądową / [A • m 2]:
(6.89)
j ą Fv F(kOK cred A'rej cox),
gdzie crcd i cox są stężeniami postaci zredukowanej i utlenionej na powierzchni elektrody. Wymiar heterogenicznej stałej szybkości reakcji anodowej i katodowej [m ■ s"1] określony jest równaniem (6.89) i w oczywisty sposób różni się od wymiaru homogenicznej stałej szybkości reakcji I rzędu w kinetyce chemicznej [s-1].
Gęstość prądu dla reakcji (6.87) związana jest z nadpotencjałem za pomocą równania Butlera-Volmera
j =jo
exp
(1 ~P)F RT
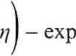
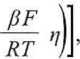
(6.90)
gdziej0 jest gęstością prądu wymiany (6.83), zaś - współczynnikiem (0 < /3< 1), wyrażającym symetrię bariery energii potencjalnej między substratami i produktami reakcji redukcji1.
Dla >/ > 0 (przez powierzchnię elektrody przepływa wyłącznie prąd anodowy) możemy zaniedbać drugi człon równania (6.90), a gęstość prądu anodowego opisuje wyrażenie
A =7oexP (U ~/t)F (E - £,)) = Ekoxcred. (6.91)
Potencjał równowagowy elektrody Er jest dany równaniem Nemsta (zgodnie z konwencją sztokholmską wartości potencjałów' standardowych elektrod podawane są dla reakcji redukcji):
(6.92)
_ „ RT t ared RT t cred
Ex = E°- —In = Ef - —ln
F F c„v
Badania kinetyki procesów' elektrodowych prowadzi się zwykle w' obecności elektrolitu pomocniczego o tak dużym stężeniu, aby siła jonowa roztworu pozostawała stała. Pozwala to włączyć współczynniki aktywności do E° - z utworzeniem standardowego potencjału formalnego, Ef:
);red
7ox
RT
E? = E°- — ln F
Po uwzględnieniu (6.92) w równaniu (6.91) otrzymujemy
A. Kiszą, Elektrochemia. cz. 2. Elektrodyka, WNT, Warszawa 2001, s. 112.
Wyszukiwarka
Podobne podstrony:
37125 skan0308 Elektrochemia 311 Tabela 6.18 E - Er [V] A ox [m-s ]] *red [m-s ]] j ■ 10"4 [A
skrypt128 131 2.2. PRZEWODNOŚĆ ELEK TRYCZNA Przewodność elektryczna materiałów izolacyjnych związana
elektrycznej oraz sanitarnej. Wymienione powyżej działania związane są z koniecznością wniesienia pr
27 (57) SCHEMATY OBWODÓW WYPOSAŻENIA ELEKTRYCZNEGO 309 entylator chłodnicy ilnik 1,4 dm3, bez wspoma
skan0302 Elektrochemia 305 Rozwiązanie. Wprowadzając oznaczenie x = [Cl ]/c® możemy ułożyć 4 równani
skan0316 Elektrochemia 319 Rys. 6.11. Chronowoltampcrometria: a) przyłożony do elektrody badanej imp
więcej podobnych podstron