skanuj0071

i.|; n,
yjy^ ......................“'i-i........1.....................................
Przewodnictwo elektryczne elektrolitów polega na ruchu jonów dodatnich (kationów) ku elektrodzie ujemnej (katodzie), a jonów ujemnych (anionów) ku elektrodzie dodatniej (anodzie). Ładunki jonów po dojściu do anody i katody ulegają zobojętnieniu i na elektrodach wydzielają się pierwiastki w czystej chemicznie postaci, bądź wchodzą w reakcje z atomami elektrod lub innymi atomami otoczenia. Przewodnictwo elektryczne elektrolitów rośnie ze wzrostem temperatury (przeciwnie niż w metalach), ponieważ rośnie stopień dyso-ojacji i ruchliwości jonów.
Przepływ prądu przez elektrolity i towarzyszące mu reakcje chemiczne określa sięmianem elektrolizy.
Wspomniane już wydzielanie się substancji chemicznych na elektrodach podlega prawom Faraday’a. Pierwsze z nich mówi, że masa substancji wydzielonej na każdej z elektrod jest proporcjonalna do wartości ładunku przeniesionego przez elektrolit:
m = k-Q = k-I■ r,
(4)
gdzie: k to równoważnik elektrochemiczny, Q - ładunek elektryczny (Q-I t), /-natężenie stałego prądu, r- czas elektrolizy. Równoważnik elektrochemiczny A: jest równy liczbowo masie substancji wydzielonej przy przepływie przez elektrolit ładunku 1 C.
Drugie prawo elektrolizy Faraday’a podaje, że masy substancji wydzielonych na różnych elektrodach przy przepływie tego samego ładunku, są proporcjonalne do odpowiednich gramorównoważników chemicznych tych substancji:
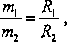
(5)
gdzie: R = M/z to gramorównoważnik chemiczny substancji, M - masa atomowa (molowa) substancji, z - wartościowość jonów.
Z równań (4) i (5) wynika, że stosunek gramorównoważnika chemicznego do elektrochemicznego jest wielkością stałą:
/cj k2 ’ k z-k
gdzie: F jest stałą Faraday'a. Przepływ takiego ładunku przez elektrolit powoduje wydzielenie 1 gramorównoważnika chemicznego substancji.
Można obliczyć, że stała Faraday’a jest równa iloczynowi ładunku elementarnego e i liczby Avogadra Na-
F = e-NA = .96 484 C mol'1 - 96 500 C mol'1 (7)
2. Metoda pomiaru
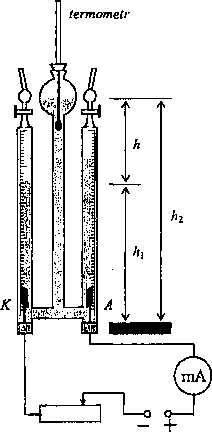
Rys. 1. Schemat układu pomiarowego z aparatem Hofmanna
2.1. Wyznaczania równoważnika elektrochemicznego wodoru
Do tego celu często używamy aparatu Hofmanna. Są to trzy szklane naczynia połączone ze sobą (rys.l). W dwóch biuretach, zaopatrzonych w szczelne korki, zbierają się gazowe produkty elektrolizy. Platynowe płytki, zamocowane w gumowych korkach zamykających od dołu biurety, służą jako elektrody. Środkowa rurka, zakończona otwartą bańką, służy do zbierania wypieranej cieczy i daje możliwość pomiaru ciśnienia hydrostatycznego wywieranego przez elektrolit na gazy.
Aparat zasilany jest z zasilacza prądu stałego (12 V) poprzez regulowany opornik R, służący do ustalania stałej wartości prądu (0,2+1,0 A). Aparat wypełniony jest 10% roztworem kwasu siarkowego (H2SO4). Podczas elektrolizy na elektrodzie dodatniej wydziela się tlen, a na ujemnej wodór. Możemy jednak wyznaczyć tylko równoważnik elektrochemiczny wodoru, ponieważ tlen w znacznym stopniu rozpuszcza się w roztworze.
Wyszukiwarka
Podobne podstrony:
skanuj0003 (34) 03 fcOSLINYm : i* f & f i IdjbJj Ii M I yjy
skanuj0008 (396) I UMIEJĘTNOŚĆI Stawianie Grota Etap 3Postaw fok i przygotuj do stawiania grota.Usta
skanuj0008 (398) Wstęp 14 oszczędzania wysiłku artykulacyjnego, do ekonomii w tworzeniu wypowiedzi,
skanuj0008 (405) 4- 20 KHz ózfśwdwłfpó hUfij ralaml mechantażnymł o czestfftetoah powiej 20kHz lalam
skanuj0008 (40) kkk >14 . 3 vL 1^ iiX p ? -1 r /K-u 1^ V —.. i,
więcej podobnych podstron