Adam Wasilewski 27.03.2002
Rok 1 gr. 8
Wydział IiKŚ
Sprawozdanie z ćwiczenia 40
1.Teoria
Elektrolit jest to roztwór zawierający oprócz cząsteczek obojętnych również jony. Źródłem jonów mogą być cząsteczki kwasów, zasad, soli, które ulegają dysocjacji (rozpadowi cząsteczek na jony) w rozpuszczalniku o dużej przenikalności dielektrycznej.
Natężenie I prądu jest wprost proporcjonalne do:
natężenia pola elektrycznego E
powierzchni przekroju S strumienia nośników prądu
![]()
Współczynnik proporcjonalności ![]()
nazywany jest przewodnością właściwą elektrolitu. Jednostką ![]()
jest simens na metr, [S/m] ( simens jest odwrotnością oma). Przewodność właściwa i opór właściwy ![]()
spełniają zależność.
![]()
Ze względu na równoczesne przenoszenie masy i ładunku, zdolność przewodzenia prądu przez elektrolity jest dużo mniejsze niż w przypadku przewodnictwa elektronowego w metalach. Przewodność właściwa zależy od rodzaju rozpuszczanej substancji, jej stężenia, temperatury oraz rodzaju rozpuszczalnika.
Stosunek odległości między elektrodami do powierzchni przekroju strumienia nośników prądu dla danego układu elektrod w naczyniu elektrolitycznym jest stały i nazywamy pojemnością oporową naczynia C. Jednostką C jest 1/m.
2. Cel i etapy wykonywana ćwiczenia
Celem ćwiczenia było wyznaczenie przewodności właściwej elektrolitu.
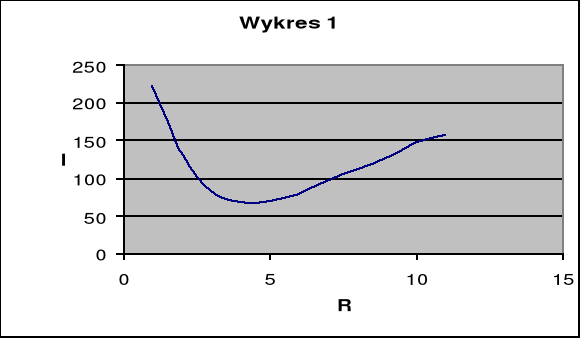
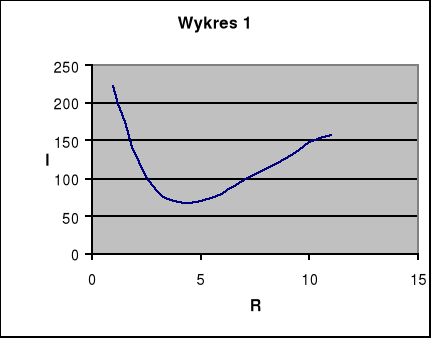
Pierwszym etapem ćwiczenia było wyznaczenie pojemności naczynia elektrolitycznego C. Opór elektrolitu R możemy wyznaczyć posługując się mostkiem Wheatstone'a. Układ mostkowy złożony jest z 4 oporów. Najpierw wlaliśmy do naczynia elektrolitycznego pięcioprocentowy roztwór NaCl. Następnie połączyliśmy odpowiednio obwód i zmierzyliśmy temperaturę początkową elektrolitu. Włączyliśmy obwód do prądu. Następnie przy pomocy opornicy dekadowej zmienialiśmy tak opór aby uzyskać najmniejszą wartość natężenia prądu. Na podstawie uzyskanych wyników sporządziliśmy wykres zależności natężenia od oporu. Po wyłączeniu zasilacza zmierzyliśmy temperaturę końcową elektrolitu. Na podstawie uzyskanych wyników obliczamy pojemność oporową naczynia elektrolitycznego C.
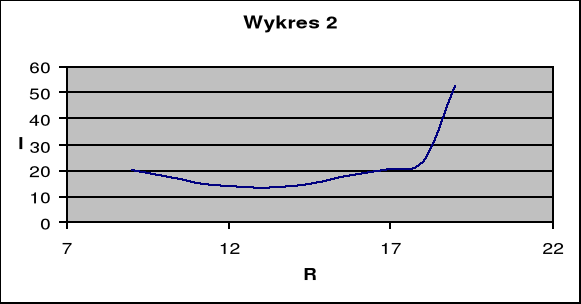
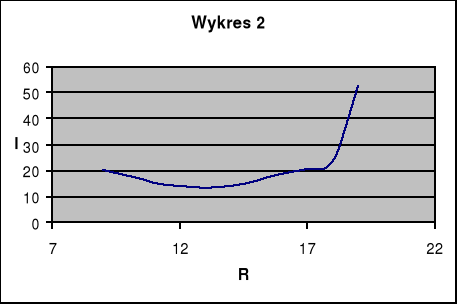
Drugim etapem było wyznaczenie przewodności właściwej elektrolitu. Tym razem wzięliśmy do ćwiczenia piętnastoprocentowy roztwór CuSO(4). Następnie identycznie jak z roztworem pięcioprocentowym doprowadziliśmy do uzyskania wykresu zależności natężenia do oporu.
3. Obliczenia
a) Wyznaczanie pojemności oporowej naczynia elektrolitycznego
Opór RD [Ω] |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
I [mA] |
222,5 |
130 |
82,5 |
67,5 |
70 |
80 |
97,5 |
112,5 |
127,5 |
147,5 |
157,5 |
Opór Roztworu |
Temperatura roztworu [ºC] |
Pojemność oporowa |
||
R1 [Ω] |
tp |
tk |
t1 |
C [m-1] |
4 |
20,4 |
22,6 |
21,5 |
28,9 |
b) Wyznaczanie przewodności właściwej elektrolitu
Opór RD [Ω] |
9 |
10 |
11 |
12 |
13 |
14 |
15 |
16 |
17 |
18 |
19 |
I [mA] |
20,25 |
17,75 |
15,25 |
14 |
13,25 |
14,25 |
16,25 |
18,5 |
20,75 |
23,25 |
52,5 |
Opór roztworu |
Temperatura roztworu [ºC] |
Przewodność właściwa [S/m] |
|||
R2 |
tp |
tk |
t2 |
w temp. t2 σ2 |
w 18ºC σ02 |
13 |
20,2 |
21,5 |
20,85 |
2,22 |
1,938 |
a) Pojemność oporowa : ![]()
Rachunek błędu: ![]()
![]()
13,5%
b)Przewodność właściwa: ![]()
Przewodność właściwa w temperaturze pokojowej.
![]()
Rachunek błędu: ![]()
![]()
4.Wykresy
5.Wnioski
Na dokładność pomiarów miały wpływ następujące czynniki:
trudności przy pomiarze natężenia ( galwanometr pokazywał coraz to nowe wartości).Należało długotrwale obserwować wartości wskazywane przez galwanometr i przyjmować wartości, które utrzymywały się najdłużej.
brak idealnej styczności na końcach przewodów.
- elektrolit przez cały czas nie był w idealnym spoczynku ( elektrody były niejednakowo znużone podczas kolejnych pomiarów).
Wyszukiwarka
Podobne podstrony:
Ćwiczenie 73, Ćwiczenie 73 (3), Adam Wasilewski
Ćwiczenie 1, Ćwiczenie 1 (1), Adam Wasilewski
Cwiczenie 1 Zakres obliczeń modelowych 27.02.2013, Polibuda, OŚ, Semestr VI, Gospodarka odpadami
RF Cwiczenia 2010 10 20 27
Cwiczenie 1 Zakres obliczeń modelowych 27.02.2013, Polibuda, OŚ, Semestr VI, Gospodarka odpadami
Cwiczenie 40 (13), 2.Elektryczność
45 Arkuszy ćwiczeniowych Matura angielski rozmowy sterowane, Arkusz ćwiczeniowy 40, Arkusz ćwiczenio
Ćwiczenie nr 40-cd, Błędy mierników:
Ćwiczenie nr 40-cd, Błędy mierników:
ćwiczenia ujędrniajace dla kobiet po 40 roku życia, E-boki różne
Cwiczenie 40 (6), Towaroznawstwo SGGW, Rok I, Semestr I, fizyka
Nowy folder, Ćwiczenie 40
cwiczenie 40, UWM Geodezja GiSzN, Fizyka
więcej podobnych podstron