67020 img358 (4)

.-•„Z JC - i '>.5Ks*3S?IJSKWa*?1.'-«
■; - .*srs3v:“■
-
.' ^ ‘Który z wymienionych jonów nic jest k«aS(!m w Mjc<;iM loor.i Oroostedo:
W) HCOO : O/ HS ; C/ HSO" ; O/
H PO
4 —
E' HCO
3 ’
~ stała dysoojocji l;wnsu: <J^y ^ — stopień dysocjacjl kwasu; c^ — Gl^zci'(e"
1 0 K(ore x podanych ^ra/.Cfi porwała no obliczenie spienia Jonów wodorowych hydronowych) w niezbyt rozcieńczonych roztworach wodnych Gtobych kwasów
kwasu),
*-/k
-*3~^VX ś
^ [h;]'[oh-] - Kj : 3/ (h j - ck - Kk : c/ Xk'LH+j “ *S
°/ ■ k,c “ [«3 M -• ’ /Qlh3 -
WylcreS; przedstawia miareczkowanie: • /a/ Inoęncgo kwasu roocńą Zasadej . C

słabego kwasu mocnĄ-zaaad^ . o
c/ mocriego kwasu> sło.tx\ ‘zasadą y>-
D/ słabej zasady- mocnym kwasem ^ - & S/ wykres nio przedstąv«a•'żadnej /-f _ /__
- c.
zQ3aeio
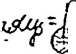
M
a HSO, -t- H O
^ _ o. 3a x:
H_SO^ 4- HO * W podań oj redkojl krw<3JS<xrnX
Cmó^?.c J
r-
-A| H2S04 -I HSOj. ; I HoO+ ; . C/ HSOj-i.H^O* I -
I_J a ^ 4-’ 4 * “3V ' - _ 4 .‘•'*■*3'
:SO“ i H O ;
E/ H2S04 i H20
.ardziej' poprawny zapis reakcji hydro!.- NH^Cl o'brązuje równanie:
NK4OH + HC1
A/ NH^Cl -t- K^O
, +- - — +■..-■ +
3 - MH ,-b Cl 2H O --. NH - -e OH + H-O + Cl
"4> -* _ • 2 , — .. . <Ł A -3
Ir
C/-NrlJ" -e Cl + 2H^O ,
HPt>/ NK.+ + HO
k 4 2
±= l^H^OH + H^Ck V Ci
NH -ł-'H O-1 3 3
3l NK 4- Cl + HO 4 2
NH3 + Cl + OH
J v •
! *" OsolcI elektrolitu typu MeR wytrącą się wówczas,' ' gdy obecne W roztworze ;ony- Spełniają Warunek:
MeR
*-CR1 > Wr ■ BltM3 * IXK'(
R lM<i\ * [r] - Im«R :- D/ LKel *0] - CeR : Eń[M*l2 * W2 -<M
roztwory Izotonlcżne tó""roztwory różnych substancji
o Jednakowym stężeniu procento-rrym w sto-łej temperaturze, ..wywierające jednakowe ciśnienie osmotyczne w stałej temperaturze, C/ o jednakowej ekstynkcji, . . ; y '
•-'I o stałym ciśnieniu .osóotycznym niezależnym od temperatury, "
nie ulegających dysocjacji‘ elektrolitycznej o dowolnych stężeniach.
Wyszukiwarka