67020 Wodór (7)
• Inne grupy takie jak P-H; S-H; Cl-H i Br-H, także - mogą oddziaływać jako donowy protonu, a nawet
C-H pod warunkiem, że wiązanie C-H jest relatywnie polarne np. HCCI3 lub gdy may do czynienia z hybrydyzacją sp na atomie węgla jak HCN czy RCzCH.
• Atomami akceptorowymi mogą być w tym przypadku N;0;F;Cl;Br;I;S czy P.
•Należy zauważyć, że pewnych związkach organometalicznych metali przejściowych oddziaływania typu C-H—M mogą również zachodzić.
wąctoar ■ Metr KirwtnKWjT
Techniki detekcji wiązania -H
1. IR-wiązanie wodorowe jest łatwo obserwowalne & poprzez przesunięcie w kierunku niższy wartości liczby falowej i poszerzenie pasma drgań rozciągających oscylatora A-H
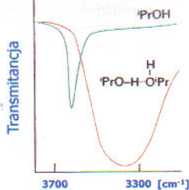
Niesymetryczne wiązanie wodorowe A-H—A; A-H—B
grupa A-H należy do cząsteczki donora protonu B - stanowi zasadowe centrum cząstki akceptora protonu
Symetryczne wiązanie wodorowe A—H—A ;
atom wodoru znajduje się między dwoma identycznymi elektroujemnymi atomami
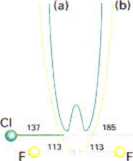
ci
O
Jon [CIHCI]' ale atom H nie jest w połowie odległości między atomami Cl.
Dla kontrastu w jonie [FHF]‘ jest w połowie odległości pomiędzy atomami F. 226 pm jest nieznacznie mniejsze niż 2 x r van der Waals'a atomu F (2 x 135 pm)
Rząd energii wiązania siły van der Waalsa 0,5-4 kJ/mol
-&----wiązanie wodorowe 4-40 kJ/mol
atomowe lub jonowe 40 -500 kJ/mol
Istota wiązania specyficzne oddziaływanie protonu z dwoma elektroujemnymi atomami w polu potencjału.
Tworzy się :
• kiedy istnieje wystarczająco duży cząstkowy ładunek dodatni
• atom akceptora dysponuje wolną parą elektronową zdolną do związania protonu
Wykłady - Ptotr Kirszensitejn
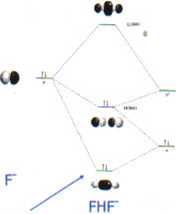
Diagram generowany na podstawie połączenia orbitali MO HF I F\
Orbitale p, I p, z wolnymi parami e jonu F-1 HF są pominięte ze względu na brak pasujących orbitali H.
•• Kształt pozostałych orbitali jest odpowiedni dla wytworzenia wiązań.
_ -nałożenie orbltalu n F- z orbitalami ^ a I <r* HF prowadzi do wytworzenia 3 orbitali. Wszystkie one są symetryczne HF wokół centralnego Jądra H.
• Orbltal najniższy jest wyraźnie wiążący w odniesieniu do wszystkich trzech partycypujących w jego tworzeniu orbitali wyjściowych -brak węzłów pomiędzy atomami
• Orbltal środkowy (HOMO) jest zasadniczo niewiążący z węzłami pomiędzy każdym jądrem
•Orbita najwyższy (UJMO) Jest antywląźący z węzłami pomiędzy każdą parą
8
Wyszukiwarka