3582403092
4
Egzamin maturalny z chemii Poziom rozszerzony_
Zadanie 4. (1 pkt)
W poniższej tabeli przedstawiono masy atomowe i zawartość procentową trwałych izotopów galu występujących w przyrodzie.
|
Symbol |
Masa atomowa izotopu, u |
Zawartość procentowa, % |
|
6<)Ga |
68.9 |
60,1 |
|
7lGa |
70,9 |
39,9 |
Na podstawie: J. Sawicka, A. Janich-Kilian. W. Cejner-Mania, G. Urbańczyk, Tablice chemiczne, Gdańsk 2001.
Oblicz masę atomową galu. Wynik zaokrąglij do pierwszego miejsca po przecinku.
Obliczenia
Odpowiedź: cjtczHco q~ql ty&JjA ^J^yYLo yi ^ % 7^ U.
Zadanie 5. (1 pkt)
Radioaktywny izotop galu o liczbie masowej równej 67 jest stosowany w medycynie nuklearnej. Otrzymuje się go w reakcji zachodzącej podczas bombardowania protonami jąder izotopu cynku o liczbie masowej równej 68.
Napisz równanie opisanego procesu, uzupełniając poniższy schemat.
|
0 |
1 | ||
|
0 |
Ga |
+ 2 0 |
VL |
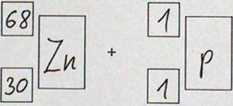
Zadanie 6. (1 pkt)
W stanie podstawowym atom galu ma jeden niesparowany elektron.
Uzupełnij zdania. Wybierz i podkreśl symbol typu pod powłoki oraz wartość głównej i pobocznej liczby kwantowej spośród podanych w nawiasach.
Niesparowany elektron atomu galu w stanie podstawowym należy do podpowłoki typu (s / p / d). Główna liczba kwantowa n opisująca stan tego elektronu wynosi (2 / 3 / 4), a poboczna liczba kwantowa/jest równa (0 / 1 / 2 / 3).
Wyszukiwarka
Podobne podstrony:
Egzamin maturalny z biologii Poziom rozszerzony Zadanie 6.(1 pkt) Na wykresie przedstawiono zmiany c
CCF20130510�002 4 Egzamin maturalny z matematyki _Poziom rozszerzony_ Zadanie 3. (3 pkt) Oblicz, ile
5 Egzamin wstępny : chemii Poziom rozszerzony Zadanie 8. (2 pkt) W celu określenia charakteru chemic
CCF20130510�000 2 Egzamin maturalny z matematyki Poziom rozszerzony Zadanie 1. (4 pkt) Rozwiąż nier
CCF20130510�003 Egzamin maturalny z matematyki Poziom rozszerzony Zadanie 4. (4 pkt) Rozwiąż równani
Egzamin maturalny z chemii Poziom rozszerzony Zadanie 1. (3pkt) Z konfiguracji elektronowej atomu w
13 Egzamin maturalny z chemii Poziom rozszerzony Zadanie 23. (2pkt) a) Napisz wzory półstrukturalne
Egzamin maturalny z chemii Poziom rozszerzony Zadanie 17. (4pkt) W wyniku reakcji litowców z wodorem
11 Egzamin maturalny z biologii Poziom rozszerzonyZadanie 21. (1 pkt) Na schemacie przedstawiono
13 Egzamin maturalny z biologii Poziom rozszerzonyZadanie 26. (1 pkt) Na schemacie przedstawiono fag
18 Egzamin maturalny z biologii Poziom rozszerzonyZadanie 39. (1 pkt) Na wykresie przedstawiono wyni
więcej podobnych podstron