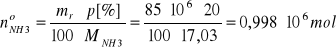
Rozwiązania wybranych zadań - temat 10
21/82
MCaCO3 = 100,09 g/mol; MMgCO3 = 84,33 g/mol
mmieszaniny = 1,250 g mieszaniny CaCO3 i MgCO3
VCO2 = 350 cm3 zmierzona w T = 298 K i p = 100 kPa
CaCO3 = CaO + CO2↑ (1)
MgCO3 = MgO + CO2↑ (2)
Równań reakcji (1) i (2) nie wolno dodawać stronami, ponieważ zachodzą one równocześnie i są od siebie niezależne!
mmieszaniny = mCaCO3 + mMgCO3 = nCaCO3∙MCaCO3 + nMgCO3∙MMgCO3
nCO2 = nCaCO3 + nMgCO3
nCO2 = (pVCO2)/RT = (100∙103∙350∙10-6)/8,314∙298 = 0,01413 mol CO2
Stąd mamy do rozwiązania uklad dwóch równań liniowo niezależnych:
nCaCO3∙MCaCO3 + nMgCO3∙MMgCO3 = 1,250 /MCaCO3
nCaCO3 + nMgCO3 = 0,01413
nCaCO3 + (84,33/100,09)· nMgCO3= (1,250/100,09)
nCaCO3 + nMgCO3 = 0,01413
nCaCO3 + 0,8425∙ nMgCO3 = 0,01249
nCaCO3 + nMgCO3 = 0,01413
Po odjęciu stronami otrzymujemy:
0,1575∙ nMgCO3 = 0,001640
nMgCO3 = 0,01041mol
mMgCO3 = 0,01041∙84,33 = 0,8879 g MgCO3
p[%]MgCO3 = (0,8779/1,250)·100 = 70,2% (trzy cyfry znaczące!)
p[%]CaCO3 = 29,8% (trzy cyfry znaczące)
Uwaga: odpowiedzi na końcu skryptu (odpowiednio 70 i 30%) są niepoprawne.
23/83
MFe2O3 = 159,69 g/mol; M MgO = 40,30 g/mol
mmieszaniny = 4,00 g
VHCl = 300 cm3 0,600 M roztworu kwasu solnego
Fe2O3 + 6HCl = 2FeCl3 + 6H2O (1)
MgO + 2HCl = MgCl2 + H2O (2)
Równań reakcji (1) i (2) nie wolno dodawać stronami, ponieważ zachodzą one równocześnie i są od siebie niezależne!
Całkowita liczność kwasu kwasu solnego (nHCl = VHCl·cHCl) zużywa się na roztworzenie obydwu składników w 4,00 g mieszaniny tlenków Fe2O3 (n') i MgO (n”).
Ze stechiometrii reakcji (1) i (2) mamy:
n'HCl : n*Fe2O3 = 6:1 i n''HCl : n*MgO = 2:1, stąd
nHCl = n'HCl + n''HCl = 0,300·0,600 = 0,1800 mol (cztery cyfry znaczące)
lub inaczej:
6 *nFeO3 + 2n* MgO = 0,1800
Ponadto mamy:
mmiezaniny = mFe2O3 + mMgO = n*Fe2O3·MFe2O3 + n*MgO = 4,00,
lub inaczej:
159,69 n*Fe2O3 + 40,30 n*MgO = 4,00.
Zatem, mamy do rozwiązania układ dwóch równań liniowo niezależnych:
159,69 n*Fe2O3 + 40,30 n*MgO = 4,00/:40,30
6 *nFeO3 + 2n* MgO = 0,180/:2
3,963 n*Fe2O3 + n*MgO = 0,09926
3,000 n*Fe2O3 + n*MgO = 0,09000
Po odjęciu stronami otrzymujemy:
0,9630 n*Fe2O3 = 0,00926
n*Fe2O3 = 0,009260/0,9630 = 0,009616 mol Fe2O3 w 4,00 g mieszaniny tlenków.
mFe2O3 = n*Fe2O3· MFe2O3 = 0,009616·159,69 = 1,536 g
p[%]Fe2O3 = 100· (mFe2O3/ mmieszaniny) = 100(1,536/4,00) = 38,4%
p[%]MgO = 61,6%
Uwaga: odpowiedzi na końcu skryptu (odpowiednio 38 i 62%) są niepoprawne.
30*/83
mstop = 5,24 g, p[%]Ag = 90,0% Ag; MAg = 107,870 g/mol
3 Ag + 4 HNO3 = 3 AgNO3 + NO↑ + 2 H2O (1)
Liczności przereagowanego srebra n*Ag i powstałego azotanu(V) srebra n*AgNO3 są
w stosunku 1:1.
VAgNO3 = 250 cm3, cAgNO3 = 0,155 mol/dm3
Liczność srebra w stopie:
mAg = mstop · p[%]Ag/100 = 4,716 g
noAg = mAg/MAg = 4,716/107,870 =0,04372 mol
Liczność azotanu(V) srebra w roztworze:
n*AgNO3 =n*Ag = VAgNO3 · cAgNO3 = 0,250 · 0,155 = 0,03875 mol
Wydajność reakcji roztwarzania srebra:
η = 100(n*Ag/noAg) = 100·0,03875/0,04372 = 88,6% (trzy cyfry znaczące)
31*/83
K2Cr2O7 → 2 KCr(SO4)2 · 12H2O (1)
Zgodnie ze schematem (1), liczności dichromianu(VI) potasu i ałunu pozostają
w stosunku stechiometrycznym 1:2.
n*K2Cr2O7 = ½ n*ałun
małun = 50 kg, Małun = 499.42 g/mol
n*ałun = 100 mol
n*K2Cr2O7 = 50,0 mol
Wydajność procesu: η = 72%
η = 100(n*K2Cr2O7/noK2CrO7)
noK2CrO7 = 100 · n*K2Cr2O7/η = 100·50,0/72 = 69,4 mol
MK2Cr2O7 = 294,21 g/mol
mK2Cr2O7 = noK2CrO7 · MK2Cr2O7 = 69,4·294,21 =20,4 kg
mK2Cr2O7 = 20 kg (dwie cyfry znaczące)
41*/92
5 As2O3 + 4 KMnO4 + 6 H2SO4 + 9 H2O = 10 H3AsO4 + 4 MnSO4 + 2 K2SO4 (1)
Zgodnie z równaniem reakcji, arszenik i manganian(VII) potasu reaguja w stosunku molowym n*arszenik : n*manganian = 5 : 4, zatem
n*arszenik = 1,25 n*manganian
marszenik = 0,1122 g As2O3, Marszenik = 197,82 g/mol
n*arszenik = marszenik/Marszenik = 0,1122/197,82 = 5,6718·10-4 mol
n*manganian = 5,6718·10-4/1,25 = 4,5374·10-4 mol
Vmanganian = 27,35 cm3
cmanganian = n*manganian/Vmanganian = = 4,5374·10-4/0,02735 = 0,01659 mol/dm3 (cztery cyfry znaczące)
18*/82
Fe + H2SO4 = FeSO4 + H2↑ (1)
Fe2O3 + 3 H2SO4 = Fe2(SO4)2 + 3 H2O (2)
Wodór jest produktem tylko reakcji (1). Zgodnie ze stechiometrią mamy
n*Fe : n*H2 = 1:1.
mmieszanina = 5,60 g
VH2(gaz) = 1,50 dm3, T = 298 K, p = 100 kPa
pVH2 = n*H2RT
n*H2 = pVH2/RT = (100·103·1,50·10-3)/(8,1314·298) = 0,06054 mol
n*Fe = 0,06054 mol, MFe = 55,847 g/mol
mFe = n*Fe· MFe = 0,06054·55,847 = 3,381 g
p[%]Fe = 100 mFe/mmieszanina = 100·3,381/5,60 = 60,4% (trzy cyfry znaczące)
19*/82
MgCO3 = MgO + CO2↑ (1)
MgO - bez zmian w trakcie prażenia
Zgodnie z równaniem (1) liczności węglanu magnezu i ditlenku węgla pozostają
w stosunku n*węglan : ntlenek = 1:1.
mmieszanina ≡ 100 g
Ubytek masy mieszaniny w wyniku prażenia:
Δm = mCO2 = 5,00 g, MCO2 = 44,01 g/mol
n*tlenek = mCO2/MCO2 = 5,00/44,01 = 0,1136 mol
n*węglan = 0,1136 mol, MMgCO3 = 84,33 g/mol
mwęglan = n*węglan · MMgCO3 = 0,1136·84,33 = 9,580 g
p[%]węglan = 9,58% (trzy cyfry znaczące)
p[%]tlenek = 100 - 9,58 = 90,42%
12/112
Al + 3HCl = AlCl3 + 3/2H2↑
n*HCl : n*Al = 3 : 1
V = 250,0 cm3, p[%] = 15,0% HCl, d = 1,060 g/cm3
pcHk = 0,349, [H+]k = 10-0,349·co = 0,4477 mol/dm3 → cHCl, k = 0,4477 mol/dm3
MHCl = 36,453 g/mol; MAl = 26,982 g/mol
noHCl = (V·d·p[%])/100·MHCl = (250·15,0·1,050)/100·36,453 = 1,090 mol
nHCl = V· cHCl, k = 0,2500·0,4477 = 0,1119 mol
n*HCl = noHCl - nHCl = 1,090 - 0,1119 = 0,9781 mol
noAl = n*Al = n*HCl/3 = 0,9781/3 = 0,3260 mol
mAl = noAl ·MAl = 0,3260·26,982 = 8,80 g Al
18/112
2H2S + H2SO3 = 3S + 3H2O (1)
mS = 0,06412g, nS = 0,06412/32,06 = 2,000∙10-3 mol
p[%]H2SO3 = 1,50%, d = 1,00 g/cm3, V = ?
MS = 32,06 g/mol
MH2SO3 = 82,08 g/mol
nH2SO3 : nS = 1:3
nH2SO3 = nS/3 = 6,667∙10-4 mol
η = 90,0% → η = 0,900
n'H2SO3 = nH2SO3/η =7,407∙10-4 mol
mH2SO3 = n'H2SO3∙ MH2SO3 = 0,06088 g
V = 100∙ mH2SO3/p[%]∙d = 6,088/1,50 = 4,05 cm3
32/83
Metoda Solvaya produkcji sody (Na2CO3) zachodzi w trzech etapach zgodnie
z równaniami następujących reakcji następczych:
1) NH3(aq ) + CO2 + H2O = NH4HCO3; η1 = 70% (lub 0,70);
2) NH4HCO3 + NaCl = NaHCO3 + NH4Cl; η2 = 78% (lub 0,78)
3) 2NaHCO3 = Na2CO3 + CO2 + H2O; η3 = 82% (lub 0,82).
mr = 85 Mg 20,0% wodnego roztworu NH3
mNaCl = 135 Mg stałego NaCl
mNa2CO3 = ?
MNH3 = 17,03 g/mol, MNaCl = 58,44 g/mol, MNa2CO3 = 105,99 g/mol.
W obliczeniach bierzemy pod uwagę, stechiometrię reakcji (1), (2) i (3)
z uwzględnieniem ich wydajności. Obliczamy poczatkową liczność amoniaku:
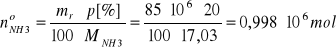
Całkowita wydajność obydwu reakcja (1) i (2) względem otrzymanego NaHCO3 jest równa ilocznynowi wydajności każdej z nich, czyli: η1·η2 = 0.70·0,78 = 0,546.
Stąd liczność otrzymanego NaHCO3:
![]()
Liczność prereagowanego NaHCO3 zgodnie równaniem i wydajnością reakcji (3):
![]()
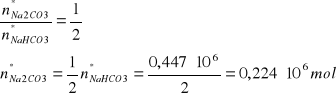
mNa2CO3 = 0,224·106·105,99 = 23,7 Mg
mNa2CO3 = 24 Mg (z dokładnością do dwóch cyfr znaczących)