BADANIE RÓWNOWAGI FAZOWEJ W UKŁADZIE TRÓJSKŁADNIKOWYM CH3COOH-H2O-CHCl3
Maksymalna liczba faz w układzie trójskładnikowym wynosi 5. Jako pięciofazowy układ może istnieć jedynie w ściśle sprecyzowanych warunkach temperatury i ciśnienia. Jeżeli dodatkowo ustali się arbitralnie wartość temperatury, liczba faz, jakiej możemy się spodziewać w układzie, zmniejszy się do trzech. Istnienie w układzie trójskładnikowym czterech czy pięciu faz jest możliwe w pewnych szczególnych przypadkach; zazwyczaj będziemy mieli do czynienia z układem jedno-, dwu- lub trójfazowym.
Skład układu trójskładnikowego przedstawia się zazwyczaj posługując się trójkątnym układem współrzędnych, zaproponowanym przez Gibbsa. Wykres ma postać trójkąta równobocznego, którego wierzchołki reprezentują czyste składniki, boki-układy dwuskładnikowe, a pole trójkąta-układy trójskładnikowe.
Mówimy, że trzy ciecze wykazują całkowitą rozpuszczalność wzajemną (lub całkowitą mieszalność), jeżeli zmieszane w jakimkolwiek stosunku tworzą jedną fazę ciekłą-roztwór trójskładnikowy. W takim przypadku dowolny punkt w polu trójkąta stężeń, lub na jego bokach, przedstawia układ jednofazowy.
W wielu układach występuje jedynie ograniczona rozpuszczalność. Zazwyczaj spośród trzech cieczy, nazwijmy je A, B, i C, ograniczoną rozpuszczalność przejawia bądź jedna para cieczy (A i B), bądź dwie pary cieczy (np. A i B oraz A i C), bądź też zachodzi ona w obrębie każdej z trzech par (A i B, B i C oraz A i C).
Zagadnienie składu dwóch współistniejących faz ciekłych w układzie trójskładnikowym jest przedmiotem prawa podziału podanego przez W. Nernsta. Niech dwie ciecze, 1 i 2, zupełnie wzajemnie nierozpuszczalne tworzą po zmieszaniu dwie warstwy ciekłe, będące praktycznie czystymi cieczami 1 i 2. Jeżeli do układu tego dodamy pewną ilość (A1) trzeciego składnika, ciekłego lub stałego, rozpuszczalnego w obu cieczach, pojawi się on w obu warstwach tworząc roztwory A'1 i A”2. Stężenie składnika 3 w tych roztworach będzie określone konodą przechodzącą przez punkt A1. Dla innej ilości dodanego składnika 3 (A2, A3,...) składy otrzymanych roztworów będą inne (A'2, A2, A'3,A3,...). Załóżmy, że roztwory składnika 3 w cieczach 1 i 2 można traktować jako roztwory idealne, rozcieńczone. Warunkiem równowagi między roztworami A' i A" jest równość potencjału chemicznego składnika 3 w obu fazach:
![]()
Po odpowiednich przekształceniach otrzymujemy:
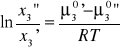
WYKONANIE ĆWICZENIA
Do czystych i osuszonych butelek dodajemy wody i kwasu octowego w następujących proporcjach:
Woda [cm3] |
10 |
9 |
8 |
7 |
6 |
5 |
4 |
3 |
2 |
1 |
Kwas octowy [cm3] |
- |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
Pomiary wykonywano w 25 oC. Następnie miareczkowano roztwory wodne kwasu octowego chloroformem, aż do pojawienia się pierwszego trwałego zmętnienia.
WNIOSKI
W doświadczeniu, które wykonano w ramach laboratorium badano wzajemną rozpuszczalność trzech cieczy: chloroform -woda -kwas octowy. Dwie z nich a mianowicie chloroform i woda są cieczami o ograniczonej wzajemnej rozpuszczalności natomiast kwas octowy jest w nich nieograniczenie rozpuszczalny. Dodatek tego trzeciego, czyli kwasu octowego do mieszaniny powoduje, że wzajemna rozpuszczalność wody w chloroformie i odwrotnie zwiększa się. Jednak w pewnym momencie przy określonej zawartości kwasu octowego dochodzimy do punktu homogenizacji, w którym skład obu faz pozostających w równowadze są równe.
Dzięki temu, że znamy poszczególne stosunki objętościowe, czy wagowe oraz objętość zużytego chloroformu, do momentu pojawienia się trwałego zmętnienia mieszaniny, jesteśmy w stanie wartości te przedstawić na trójkącie Gibbsa, dzięki któremu możemy określić liczbę faz przy zadanych ilościach składników, a także skład faz pozostających w równowadze przy danych proporcjach.
Wyszukiwarka
Podobne podstrony:
8.3 inne, Badanie równowagi fazowej w układzie trójskładnikowym 8.3, Badanie równowagi fazowej w ukł
Badanie równowagi fazowej w układzie trójskładnikowym 8.3, Technologia chemiczna, Chemia fizyczna, l
Badanie równowagi fazowej w układzie trójskładnikowym 8 3
Badanie równowagi fazowej w układzie trójskładnikowym 8 3
Badanie równowagi fazowej w układzie trójskładnikowym 8 3(1)
Badanie równowagi fazowej w układzie trójskładnikowym 8 3
Badanie równowagi fazowej w układzie trójskładnikowym 8 3
Badanie równowagi fazowej w układzie trójskładnikowym 8 3
Badanie równowagi fazowej w układzie trójskładnikowym 8 3
9.RÓWNOWAGI FAZOWE W UKŁADACH TRÓJSKŁADNIKOWYCH, Politechnika Łódzka, Technologia Żywności i Żywieni
7 uklady rownowagi fazowej id 4 Nieznany
11 Silnik indukcyjny pierścieniowy SUHf, Szkoła, Politechnika 1- 5 sem, SEM IV, Maszyny Elektryczne.
chem.fiz.równowagi fazowe, Inżynieria środowiska, inż, Semestr III, Chemia fizyczna, laboratorium
Badanie transformatora 1 fazowego p, Elektrotechnika, SEM4, Teoria Pola Krawczyk, wnioski
Badanie pętli fazowej PLL, INSTYTUT TELEKOMUNIKACJI I AKUSTYKI
6 RÓWNOWAGA W UKŁADZIE TRÓJSKŁADNIKOWYM EKSTRAKCJA
Badanie 3-fazowego silnika klatkowego, Polibuda, IV semestr, SEM IV, Maszyny Elektryczne. Laboratori
więcej podobnych podstron