6295505333
Egzamin maturalny z chemii Poziom podstawowy
Zadanie 10. (2pkt)
Uzupełnij współczynniki stechiometryczne w podanym równaniu reakcji. Zastosuj metodę bilansu elektronowego.
3 CuS + 8 HN03 -» 3 Cu(N03)2 + 3 S + 2 NO + 4 H20
Bilans elektronowy:
CuS->Cu2+ +S + 2e~ x3
NOs~ + 4tC + 3e ->NO + 2H20 x 2
Zadanie 11. (3 pkt)
Przeprowadzono reakcją zobojętniania zilustrowaną równaniem:
Ca(OH)2 + 2HCI -»■ CaC/2 + 2H20
Oblicz, jaką objętość kwasu solnego o stężeniu 0,5 mol/dm3 należy użyć do całkowitego zobojętnienia 100 cm3 roztworu Ca(OH)2 o stężeniu 0,2 mol/dm3.
Obliczenia:
Obliczenie liczby moli Ca(OH)2 w roztworze:
nćmom ^0,2^i-0,ldm3-0,02mola Ca(OHh dm3
Obliczenie liczby moli HCl na podstawie równania reakcji:
1 mol Ca(OH)2 - 2 mole HCl
0,02 mola Ca(OH)2 - x moli HCl x = 0,04 mola HCl
Obliczenie objętości kwasu solnego:
0,04 mol nno , 3 on 3
v„r,=--=0,08 dm =80 cm
HC mol 0,5——r dm
Odpowiedź: Należy użyć 80 cm3 kwasu solnego._
Zadanie 12. (1 pkt)
Przeprowadzono następujące doświadczenia:

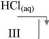
Na(s)
K2S(aq) H20
Na2C03(aq) CaC2(S)
Wskaż numer probówki, w której wydzielił się trujący gaz o charakterystycznym, przykrym zapachu.
A. I B. II C. III D. IV
|
Wypełnia egzaminator! |
Nr zadania |
7.1 |
7.2 |
8 |
9.1 |
9.2 |
9.3 |
10 |
11 |
12 |
suma |
|
Maks. liczba pkt |
1 |
1 |
1 |
1 |
1 |
2 |
2 |
3 |
1 |
13 | |
|
Uzyskana liczba pkt |
Wyszukiwarka
Podobne podstrony:
Egzamin maturalny z chemii Poziom podstawowyZadanie 7. (2pkt) Napisz równanie reakcji magnezu z parą
Egzamin maturalny z biologii Poziom rozszerzonyZadanie 10. (2pkt) Woda jest związkiem chemicznym, kt
Egzamin maturalny z chemii Poziom podstawowyZadanie 23. (1 pkt) Do naczynia zawierającego tłuszcz do
Egzamin maturalny z chemii Poziom podstawowyInformacja do zadania 1. i 2. Poniższy wykres przedstawi
Egzamin maturalny z chemii Poziom podstawowyZadanie 4. (1 pkt) Pierwiastek E tworzy wodorek o wzorze
Egzamin maturalny z chemii Poziom podstawowyZadanie 13. (1 pkt) W kolumnie I przedstawiono nazwy wyb
Egzamin maturalny z chemii Poziom podstawowyZadanie 15. (2 pkt) Przeprowadzono reakcją zobojętniania
Egzamin maturalny z chemii Poziom podstawowyZadanie 18. (2 pkt) Wpisz znak X w odpowiednie pola obok
Egzamin maturalny z chemii Poziom podstawowyZadanie 20. (2 pkt) Oblicz, jaką objętość wodoru, w prze
2 Egzamin maturalny- z biologii Poziom podstawowy Zadanie 1. (2pkt) Wapń jest pierwiastkiem niezbędn
5 Egzamin maturalny z biologii Poziom podziałowyZadanie 10. (2pkt) W tabeli przedstawiono prędkość
11 Egzamin maturalny z biologii Poziom podstawowyZadauie 22. (2pkt) Nadciśnienie tętnicze jest choro
8 Egzamin maturalny- z geopąfii Poziom podstawowyZadanie 14. (2pkt) Na rysunku przedstawiono
Egzamin maturalny z biologii Poziom podstawowyZadanie 10. (2 pkt) W tabeli przedstawiono prędkość
Egzamin maturalny z filozofii Poziom podstawowyZadanie 12. (2pkt) Rozpoznaj filozofa zajmującego cen
Egzamin maturalny z biologu Poziom podstaw owyZadanie 8. (2pkt) W organizmie człowieka występują róż
4 Egzamin maturalny z chemii _Poziom podstawowy_0 Informacja do
2 Egzamin maturalny z chemii Poziom podstawowyZadanie 1. (1 pkt) Przeanalizuj położenie hromu w ukła
więcej podobnych podstron