Ćwiczenie nr 1. (2 godz.)
wymagany kalkulator oraz układ okresowy pierwiastków
1. Budowa i właściwości materii.
Ilościowy opis materii.
Chemiczne jednostki miar.
Jednostki miar SI i ich wielokrotności.
Obliczenia stechiometryczne dla związków i równań chemicznych.
Utrwalenie podstawowych pojęć i praw chemicznych
Podstawowe
Przedmiot chemii:
chemia jest nauką badającą i opisującą materię - jej właściwości, strukturę oraz przemiany, którym ulega.
Materia i energia:
Pojęciami pierwotnymi (niedefiniowalnymi) w chemii są materia i energia. Nazywa się je po prostu formami istnienia obiektywnej rzeczywistości. Podstawową wymierną cechą materii jest jej masa (jak zdefiniować masę? niech będzie to współczynnik reprezentujący ciało materialne (co to jest ciało?) w II prawie Newtona - F = m a), a związek pomiędzy masą a zasobem energetycznym układu (ciało lub zespół ciał poddawanych obserwacji) opisuje słynne równanie Einsteina (1905): E = mc2, gdzie E jest energią [J] (jak zdefiniować energię? najprościej jako zdolność do wykonania pracy), m - masa [kg], c - prędkością światła (3 108 m/s). Równanie Einsteina pozwala uznać materię i energię za całkowicie równorzędne.
Przykład 1.1
Podczas wybuchu 1 kg TNT wydziela się 4,6 106 J. Ile wyniesie masa produktów detonacji? m= E/c2 = 4,6 106/9 1016 = ~0,5 10-10 kg.
Masa produktów wyniesie: 0,99999999995 kg.
Przykład 1.2
Gdy 1 kg uranu 235U ulega rozszczepieniu jądrowemu, w bombie atomowej wydziela się energia 8,23 1013 J. Jaka jest masa produktów reakcji?
m=E/c2 = 8,23 1013/9 1016 = 0,0009144 kg
Masa produktów wyniesie: 0,999086 kg.
Prawo zachowania materii (energii):
Materia (energia) spełnia najważniejsze prawo przyrodoznawstwa, tzn. prawo zachowania materii (masy i energii): „w żadnym procesie materia (masa+energia) nie ginie ani nie powstaje z niczego, jedynie jej postacie przechodzą w inne, lecz jej ilość nie ulega zmianie”
Ilość materii (energii) można wyrażać w jednostkach masy [kg] (dla dużych ilości) lub energii [J; 1 J = 1 kg m2 s-2] (dla małych ilości)
Rodzaje materii i energii:
Energia mechaniczna (kinetyczna i potencjalna), cieplna, chemiczna, elektryczna, jądrowa.
Energia kinetyczna ciała jest energią jaka ma to ciało w wyniku swego ruchu. Dla ciała o masie m poruszającego się z prędkością v, energia kinetyczna wynosi Ek = 0,5mv2, z czego wynika że energia kinetyczna ciała o dużej masie i poruszającego się ze znaczna prędkością jest duża. Energia potencjalna ciała jest z kolei energia wynikającą z jego położenia. Wybór poziomu zerowego energii potencjalnej jest sprawą umowną - np. energia potencjalna ciała znajdującego się na powierzchni Ziemi jest przyjmowana za zerową (Ep=mgh), a zero energii potencjalnej dwóch naładowanych cząstek odpowiada nieskończonej odległości pomiędzy nimi. W chemii większe znaczenie ma energia potencjalna naładowanego ciała w sąsiedztwie innego naładowanego ciała (pole elektryczne działa wyłącznie na ładunek). Jeśli w próżni cząsteczka o ładunku q1 znajduje się w odległości r od innej cząsteczki o ładunku q2 to energia potencjalna dana jest wzorem: Ep = (q1 q2)/(40r).
Przykład 1.3
Ile wynosi masa elektronu poruszającego się z prędkością 0,9 prędkości światła? Masa spoczynkowa elektronu jest równa 9,1 10-31 kg.
m=m0/(1-(0,9c/c)2)0,5 = 2,09 10-30 kg.
Substancja chemiczna:
to wyodrębniona czysta postać materii. Dzieli się je na substancje proste (pierwiastki chemiczne) i złożone (związki chemiczne). Pierwiastek chemiczny zawiera wyłącznie atomy o takiej samej liczbie atomowej, czyli identycznej liczbie protonów w jądrze. Jądra tych samych pierwiastków mogą zawierać różną liczbę neutronów. Nazywa się je wówczas izotopami. Liczbę wszystkich nukleonów (protonów i neutronów) w jadrze atomu nazywa się liczbą masową pierwiastka. Różne pierwiastki, ale o tej samej liczbie masowej noszą nazwę izobarów.
Przykład 1.4
Podać skład jądra każdego z trzech izotopów magnezu (Z = 12): 24Mg, 25Mg i 26Mg
Jednostką masy atomowej,
oznaczaną małą literą u, jest 1/12 część masy izotopu węgla 12C. W skali bezwzględnej u wynosi zaledwie 1,6605 10-24 g. Masę atomową (cząsteczkową) wyraża liczba określająca ile razy masa atomu (cząsteczki) jest większa od u. Odwrotnością jednostki masy atomowej jest stała Avogadra NA, czyli 6,02 1023 mol-1. Stała Avogadra NA nie jest liczbą, lecz wielkość mianowaną [mol-1].
Przykład 1.5
Obliczyć wielkość średniej masy atomowej z czterech liczb masowych czterech izotopów siarki, jeżeli ich procentowy udział jest następujący: 32S - 95,02%, 33S - 0,75%, 34S - 4,21%, 35S - 0,02%.
M = 32*0,9502 + 33*0,0075 + 34*0,0421 + 35*0,0002 = 32,096
Ilość substancji w makroskopowych próbkach podajemy w chemii w jednostkach zwanymi molami. Formalna definicja mola określa, że jest to taka ilość substancji, w której liczba obiektów (atomów cząsteczek, jonów) jest równa liczbie atomów zawartych dokładnie w 12 gramach izotopu węgla 12C, czyli stałej Avogadra. Masa 1 mola obiektów nosi nazwę masy molowej i wyraża się w kg/mol.
Przykład 1.6
Obliczyć ile atomów żelaza znajduje się w 1 mm3, jeżeli wiadomo, że gęstość tego metalu wynosi 7874 kg/m3, a masa molowa jest równa 55,845 g.
Objętość 1 M żelaza jest równa: 55,845*1000/7,874 = 7092,33 mm3,
W 1 mm3 żelaza jest 6,02*1023/7092,33 = 8,488*1019 atomów.
Podstawowe prawa chemii:
Reakcje chemiczne zaczęto systematycznie badać pod koniec XVIII wieku. Genialni chemicy tamtych czasów (Łomonosow, Lavoisier, Proust i Dalton) sformułowali trzy prawa, które uznano za podstawowe prawa chemii:
prawo zachowania masy,
prawo stałych proporcji wagowych,
prawo wielokrotnych proporcji wagowych.
Prawo zachowania masy
Mówi, że w reakcji chemicznej masa substratów jest równa masie produktów. Inaczej - masa substancji biorących udział w reakcji chemicznej nie ulega zmianie.
Prawo stałych proporcji wagowych
Każdy związek chemiczny ma stały skład ilościowy stały stosunek mas atomów poszczególnych pierwiastków w cząsteczce.
Prawo wielokrotnych proporcji wagowych
Jeżeli dwa pierwiastki tworzą kilka różnych związków chemicznych, to w związkach tych na tę samą masę jednego pierwiastka przypadają ściśle określone masy pierwiastka drugiego, pozostające do siebie w stosunku niewielkich liczb całkowitych.
Stechiometria
Obliczenia chemiczne przeprowadzane na podstawie wzorów i równań chemicznych nazywa się stechiometrią. W obliczeniach stechiometrycznych wykorzystuje się oprócz wzorów i równań chemicznych również podstawowe pojęcia i prawa chemiczne, fizyczne prawa stanu gazu oraz stężenia. Wzory chemiczne podają jakościowy i ilościowy skład związków chemicznych. Wzory określają z jakich pierwiastków jest zbudowany dany związek, określą liczbę atomów pierwiastków składowych oraz ściśle określoną jego ilość. Na podstawie wzoru chemicznego można obliczyć zawartość ilościową składników.
Przykład 1.7
1 g ołowiu przeprowadzono w PbS, otrzymując 1,1547 g tego związku. Obliczyć masę atomową ołowiu, jeżeli masa atomowa siarki jest równa 32,06 u.
x/(x+32,06)=1/1,1547, x=207,19 u
Przykład 1.8
1 g BaCO3 przeprowadzono w BaSO4 otrzymując 1,1826 g tej soli. Obliczyć masę atomową baru wiedząc, że masy węgla, tlenu i siarki są równe odpowiednio: 12,01u, 16u i 32,06u.
(x+12,01+48)/(x+32,6+64)=1/1,1826 x=137,38u.
Przykład 1.9
Uzasadnić słuszność prawa proporcji wielokrotnych jeżeli wiadomo, że z pewną ilością fosforu może połączyć się 48, 64 lub 80 g tlenu dając trzy różne tlenki fosforu. Największy wspólny dzielnik tych trzech liczb jest równy 16, a zatem 48/64/80=3/4/5.
Wartościowość:
Pojęcie wartościowości odnosi się tylko do pierwiastków w związkach chemicznych. Pierwiastki w stanie wolnym wykazują wartościowość zerową. Do zdefiniowania pojęcia wartościowości poszczególnych pierwiastków wykorzystano fakt, że większość z nich jest zdolna do reakcji z tlenem lub wodorem. Wiedziano wcześniej, że w cząsteczce wody dwa atomy wodoru łączą się z jednym atomem tlenu i to pozwoliło przypisać jedną wartościowość wodorowi i dwie wartościowości tlenowi. Formalnie wartościowość pierwiastka określa liczba atomów wodoru przypadających w cząsteczce (rzeczywistej lub hipotetycznej) na jeden atom danego pierwiastka. Wartościowość jest liczbą niemianowaną i może przyjmować wartości całkowite od 1 do 8.
Przykład 1.10
Węgiel jest pierwiastkiem czterowartościowym, tlen dwuwartościowym, wodór jednowartościowym, co wyrażają symbole:
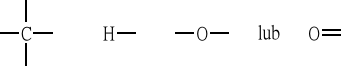
Wzory strukturalne:
podają sposób wzajemnego powiązania atomów w cząsteczkach związków chemicznych. Kreska przy symbolu pierwiastka wyraża jedną wartościowość, dwie kreski odpowiadają wartościowości równej 2, itd. Oczywiście będziemy rysować wyłącznie wzory płaskie, przedstawiające strukturę cząsteczek w sposób uproszczony.
W celu przedstawienia cząsteczki za pomocą wzoru strukturalnego należy kreski odpowiadające wartościowościom danego atomu łączyć z kreskami drugiego atomu tak, aby żadna wartościowość nie pozostała w cząsteczce wolna. W złożonych cząsteczkach kreślenie wzoru strukturalnego zaczyna się od atomu grupującego wokół siebie pozostałe atomy.
Przykład 1.11
Napisać wzory strukturalne cząsteczek: H2CO3, HNO3, POCl3, CaSO4, CaSi2O5
Zadania do samodzielnego rozwiązania:
W pięciu różnych tlenkach manganu oznaczono procentową zawartość manganu: 1) 77,4%, 2) 69,9%, 3) 63,2%, 4) 53,4%, 5) 49,5%. W jakim stosunku pozostają do siebie masy tlenu przypadające na te samą masę manganu w kolejnych tlenkach.
Odp. 1:1,5:2:2,5:3
Która z substancji zawiera więcej cząsteczek: 0,02 mola KOH, czy 0,005 kg WO3.
Odp. WO3
Obliczyć procentową zawartość wody krystalizacyjnej w gipsie (półwodny siarczan wapnia) CaSO4 ּ ½ H2O.
Odp. 6,2%
Obliczyć procentową zawartość wody konstytucyjnej w wodorotlenku wapnia Ca(OH)2.
Odp. 24,3%
Obliczyć procentową zawartość żelaza w następujących tlenkach żelaza: FeO, Fe2O3, Fe3O4.
Odp. 77,7%; 69,9%; 72,4%
Ile wynosi wartościowość fosforu w kwasach o wzorach: H3PO4 i H3PO3. Przedstawić wzory strukturalne tych cząsteczek.
Odp. V; III
Ile moli bezwodnej soli znajduje się w 1) 0,25 kg Na2SO4·10H2O, 2) 0,4 kg ZnSO4·7H2O, 3) 0,3kg BaCl2·2H2O?
Odp. 1) 0,78 mol; 2) 1,39 mol; 3) 1,39 mol
Z 0,4464 g PbO otrzymano 0,5562 g PbCl2. Obliczyć masę atomową ołowiu, jeżeli masa atomowa tlenu wynosi 16 u , a masa atomowa chloru 35,45 u.
Odp. 207 u
Obliczyć masę cząsteczkową, molową siarczanu żelaza (III) Fe2(SO4)3. Obliczyć procentową zawartość żelaza, siarki i tlenu w siarczanie żelaza.
Odp.399,87 g/mol; %Fe 27,9%; S 24,1%; %O2 48,0%
Węglik boru można otrzymać w reakcji redukcji tritlenku boru za pomocą węgla.
2 B2O3 + 4 C=B4C + 3 CO2
Obliczyć ilość moli i masę węgla, która przereaguje z 6,64 molami B2O3, zgodnie z powyższym równaniem chemicznym. Obliczyć masę otrzymanego węglika boru.
Odp. 13,3 mol C; 159,5 g C; 183,4 g B4C
Ile cząsteczek i ile moli wody znajduje się w 55 g siedmiowodnego siarczanu magnezu MgSO4 · 7 H2O.
Odp. 9,4·1023 cząsteczek H2O; 1,56 mol H2O
Męski hormon testosteron ma wzór cząsteczkowy C19H28O2. Oblicz z dokładnością do 4 liczb znaczących procentową zawartość węgla w tej substancji.
Odp. 79,12%
Żeński hormon estradiol ma wzór cząsteczkowy C18H24O2. Oblicz z dokładnością do 4 liczb znaczących procentową zawartość węgla w tej substancji. Uwzględniając wyniki zadań 4 i 5 wyjaśnij dlaczego procentowa zawartość węgla w hormonie żeńskim jest wyższa niż w hormonie męskim, pomimo tego, że hormon męski ma o 1 atom węgla więcej.
Odp. 79,37%
W doświadczeniu oznaczono stosunek mas molowych MAgJ/MAgCl = 1,6381. Obliczyć masę atomową jodu. Masy atomowe srebra i chloru wynoszą odpowiednio: 107,868 i 35,453 u.
Odp. 126,9 u
Głównym składnikiem kredy szkolnej jest węglan wapnia. Ta trudno rozpuszczalna w wodzie substancja powstaje w wyniku reakcji chlorku wapnia(II) - CaCl2 z węglanem sodu - Na2CO3. Napisać zbilansowane równanie reakcji chemicznej i obliczyć:
Ile mililitrów roztworu chlorku wapnia o stężeniu 0,250 mol/dm3 potrzeba do przereagowania z 100 ml węglanu sodu o stężeniu 0,500 mol/dm3 ?
Ile gramów węglanu wapnia wytrąci się w tej reakcji jeśli sprawność reakcji wyniesie 95%?
Odp. a) 200 ml; b) 4,75 g
1
1
Wyszukiwarka
Podobne podstrony:
CW NR2b, ĆWICZENIE Nr 2
CW NR1b, ĆWICZENIE Nr 1
CW NR2a, ĆWICZENIE NR 3
CW NR1a, ĆWICZENIE NR 5
InstrukcjeĆw.2009 2010, Cw.1.E-01. Badanie właściwości elektrycznych kondensatora płaskiego, Laborat
ćwiczenia nr 8 Rozwój umysłowej reprezentacji świata, Jagodzińska, Rozwojówka ćw
ćwiczenia nr 6, Appelt, rozw cw 6
ćwiczenia nr 10, 10. rozwojowka, Oles, cw. 10
ćwiczenia nr 10, 10. Rozwoj cw.10
ćwiczenia nr 3, cw. 3 - poznanie społeczne I - reprezentacja wiedzy społecznej - wojciszke r. 2
InstrukcjeĆw.2009 2010, Cw.3.M-01,M-02.Równia pochyła.Wahadło, Laboratorium Fizyki; ćwiczenie Nr 1
ćwiczenia nr 13, Rozwoj cw 13 - Kepinski
Lekcje, cw odp 09-12, Odpowiedzi do ćwiczeń z lekcji 1-4
ćwiczenia nr 7, Rozwoj po adolescencji; cw. 7, Olejnik M.
ćwiczenia nr 2, ćw. 2 Trempała
Ćwiczenia nr 11, Fizyka, ćw 11
ćwiczenia nr 5, cw. 5 - spostrzeganie społeczne - wojciszke r. 3
Cw 4, Ćwiczenie nr 1
więcej podobnych podstron