
1
Zachodniopomorski Uniwersytet Technologiczny w Szczecinie
Wydział Nauk o śywności i Rybactwa
Zakład Opakowalnictwa i Biopolimerów
I N S T R U K C J A
Ć
W I C Z E N I E 10
Estry
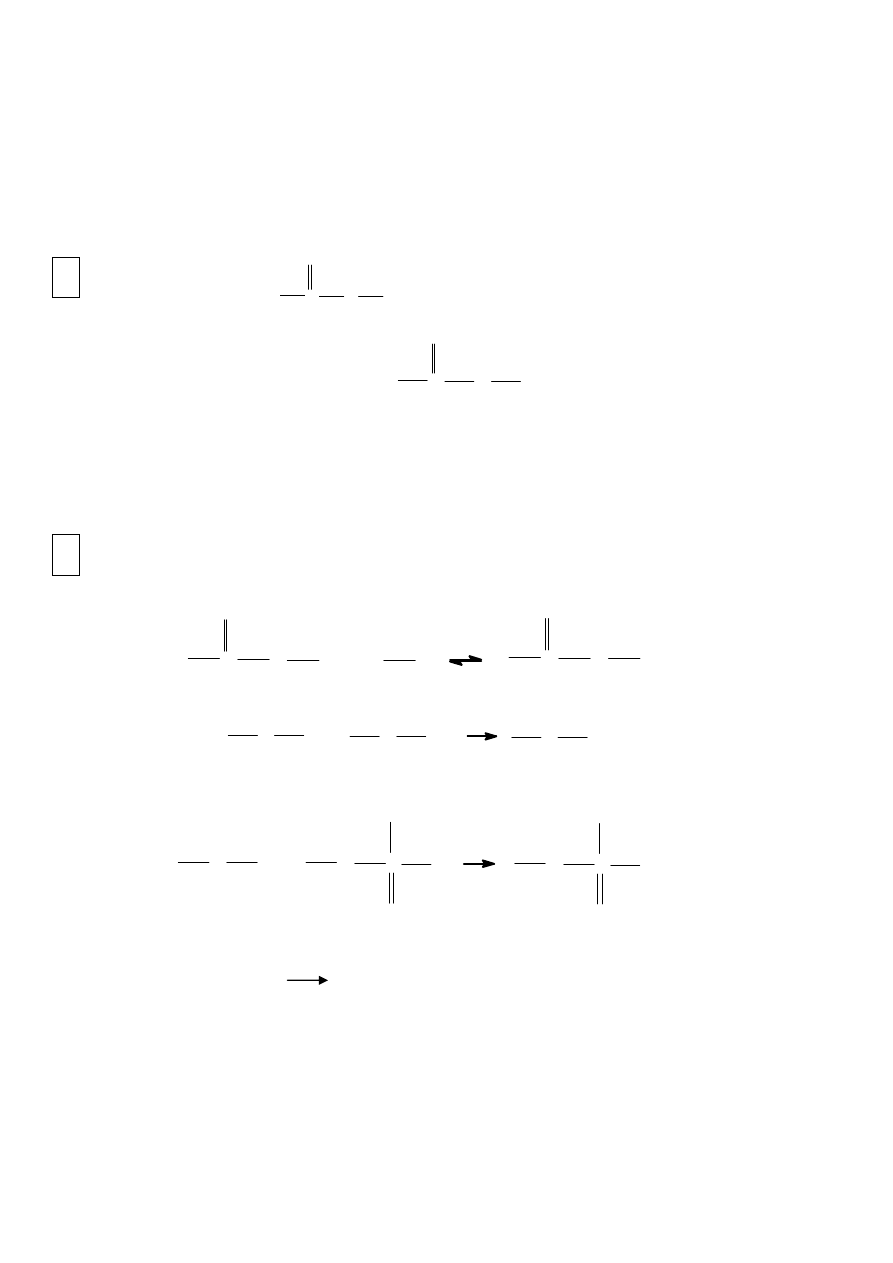
2
Estry
-
związki, które powstają w reakcji kwasów karboksylowych z alkoholami z
równoczesnym wydzieleniem wody. Jest to reakcja odwracalna. Reakcja wymaga
stosowania katalizatorów. Katalizatorami są zazwyczaj silne kwasy nieorganiczne np.
HCl, H
2
SO
4
lub kwasy sulfonowe.
-
wzór ogólny:
R1
C
O
R2
O
-
grupa funkcyjna: grupa estrowa
O
O
C
-
nazewnictwo systematyczne: nazwa kwasu R
1
-COOH z końcówką –an + nazwa grupy
alkilowej alkoholu R
2
-OH np. CH
3
COOC
2
H
5
– octan etylu lub ester etylowy kwasu
octowego.
1.
Metody otrzymywania estrów
A. reakcja kwasów z alkoholami (reakcja estryfikacji):
O
O
C
R1
H + R2
OH
H
+
R1
C
O
R2 + H2O
O
R
O
H + H
O
NO2
NO2 + H2O
O
R
R
O
H + H
O
P
+ H2O
O
OH
OH
OH
OH
O
P
O
R
B. reakcja chlorków i bezwodników kwasowych (w obecności trzeciorzędowych amin)
RCOCl + ROH + R
3
N RCOOR + R
3
NH
+
Cl
-
C. przemysłowe metody syntezy: np. estry niższych alkoholi i kwasów – reakcje kwasów z
alkoholami; octan winylu – kwas octowy + acetylen lub kwas octowy + etylen + PdCl
2
!
!

3
2. Właściwości chemiczne estrów
A. Hydroliza kwasowa (katalizowana jonami H
+
) – reakcja odwracalna:
O
O
C
R1
H + R2
OH
H
+
R1
C
O
R2 + H2O
O
R
O
H + H
O
NO2
NO2 + H2O
O
R
H
+
B. Hydroliza zasadowa (zmydlanie) – reakcja nieodwracalna:
H
2
O
OH
+ R2
R1
R1
C
O
R2 + OH
-
O
O
O-
C
R
OH + NO3
-
NO2 + OH
-
O
R
H
2
O
C. Transestryfikacja (alkoholiza estrów) – reakcja estrów z alkoholami np.otrzymywanie
estrów metylowych kwasów tłuszczowych z tłuszczów
D. redukcja estrów (za pomocą kompleksowych wodorków, sodu, oraz katalityczna redukcja
estrów) – w wyniku redukcji kwasowy fragment estru zostaje przekształcony w alkohol i
jednocześnie uwalnia się alkohol wchodzący w skład estru.
E. reakcje ze związkami metaloorganicznymi – synteza alkoholi trzeciorzędowych.
F. alkilowanie estrów .
G. reakcja kondensacji – otrzymywanie estru
β
-ketokwasu.
3. Estry w przyrodzie: w owocach występują drobne ilości estrów charakteryzujących się
specyficznym zapachem. Na zapach charakterystyczny dla danego owocu składa się
kompozycja różnych estrów i innych lotnych substancji. W przemyśle spożywczym stosuje
się często estry syntetyczne np. maślan butylu o zapachu ananasów, octan oktylu o zapachu
pomarańczy itd. Estrami są również woski (jest to mieszanina estrów długołańcuchowych
nasyconych kwasów karboksylowych i alkoholi. Do estrów należą również tłuszcze proste,
które są estrami gliceryny i kwasów tłuszczowych. Każda żywa komórka zawiera również
tzw. fosfolipidy, czyli estry kwasów fosfatydowych i silnie polarnych, hydrofilowych
alkoholi.
!

4
1. SPRZĘT
1.1 Probówki
1.2 Palnik gazowy
1.3 Papierki wskaźnikowe
1.4 Łaźnia wodna
2. ODCZYNNIKI
2.1
octan etylu
2.2
H
2
SO
4
– kwas siarkowy (VI)
2.3
2M CH
3
COOH – kwas octowy
2.4
chlorowodorek hydroksylaminy
2.5
2M alkoholowy roztwór NaOH
2.6
2M HCl – kwas solny
2.7
1% FeCl
3
– chlorek żelaza (III)
2.8
chlorek sodu NaCl
2.9
kwas octowy – CH
3
COOH
2.10
alkohol n-butylowy
2.11
alkohol izoamylowy
2.12
kwas mrówkowy – HCOOH
2.13
stężony kwas siarkowy H
2
SO
4
Ćwiczenie 1. Wykrywanie estrów
Estry (również bezwodniki i chlorki kwasowe) w reakcji z hydroksyloaminą tworzą kwasy
hydroksamowe, a te z kolei z chlorkiem żelaza (III) sole kompleksowe o charakterystycznym
fioletowym lub czerwonym zabarwieniu.
Wykonanie ćwiczenia:
Do 0,1 g (1-2 krople) octanu etylu dodać kroplami 0,5 cm
3
nasyconego alkoholowego
roztworu chlorowodorku hydroksylaminy i 2-5 cm
3
2m alkoholowego roztworu NaOH
następnie ogrzać do wrzenia. Zawartość probówki ochłodzić pod bieżącą wodą, zakwasić 2m
HCl (sprawdzić papierkiem wskaźnikowym) i dodać kilka kropli 1% roztworu FeCl
3
.

5
Równanie reakcji:
RCOOR1 + H2NOH
R1OH + RCO(NHOH)
NaOH
FeCl
3
- H
2
O
R
C
NH
O
Fe
O
1.
Opisać obserwacje z przeprowadzonego ćwiczenia.
2.
Napisać równanie reakcji
Ćwiczenie 2. Hydroliza estru w środowisku kwaśnym i zasadowym
Hydroliza estru w środowisku kwaśnym jest reakcją odwrotną do reakcji estryfikacji. Można
ją zapisać następującym równaniem:
CH3COOC2H5 + HOH
CH3COOH + C2H5OH
+H
+
W przypadku hydrolizy estru w środowisku zasadowym zamiast kwasu octowego powstaje
jego sól – octan sodu:
CH3COOC2H5 + NaOH
CH3COONa + C2H5OH
Wykonanie ćwiczenia:
1.
Przygotować dwie probówki wlać do nich po 4 cm
3
wody destylowanej
2.
Do każdej dodać 0,5 cm
3
octanu etylu – CH
3
COOC
2
H
5
3.
Do pierwszej probówki dodać 0,5 cm
3
NaOH
4.
Do drugiej probówki 0,5 cm
3
H
2
SO
4
5.
Obie probówki umieścić w łaźni wodnej i wrzucić do każdej papierek wskaźnikowy
6.
Obserwować zmianę barwy papierka w każdej z probówek
7.
Kontrolować
zapach wydzielających się substancji – z probówki z H
2
SO
4
wyczuwalny
powinien być zapach kwasu octowego, który powstaje w tej reakcji, zaś w probówce z
NaOH zanika zapach estru, ale nie powstaje kwas octowy, gdyż został on
zobojętniony przez zasadę sodową
Zadania i pytania
1.
Opisać obserwacje i spostrzeżenia z przeprowadzonego ćwiczenia.
2.
Napisać reakcję przebiegu ćwiczenia:
–
hydrolizę octanu etylu w środowisku kwaśnym;
–
hydrolizę octanu etylu w środowisku zasadowym;
6
Ćwiczenie 3. Otrzymywanie estrów
A) Otrzymywanie octanu izoamylu
Wykonanie ćwiczenia:
1.
Do dwóch probówek wlać do nich po 1 cm
3
alkoholu izoamylowego
2.
Do każdej dodać po 1 cm
3
bezwodnego kwasu octowego CH
3
COOH
3.
Do pierwszej probówki dodać szczyptę NaCl i kilka kropel stężonego H
2
SO
4
–
poprosić prowadzacego!!!!
4.
Obie probówki umieścić w łaźni wodnej na 10 minut w temp. 80°C.
5.
Następnie zawartość probówek wlać do zlewek nr1 i nr2 uprzednio napełnionych
5cm
3
wody destylowanej.
6.
Zbadać pH uzyskanych roztworów za pomocą papierka wskaźnikowego.
7.
Określić zapach uzyskanych substancji
8.
Opisać obserwacje i spostrzeżenia z przeprowadzonego ćwiczenia.
9.
Napisać reakcję przebiegu ćwiczenia.
B) Otrzymywanie mrówczanu butylu
Wykonanie ćwiczenia:
1.
Do dwóch probówek wlać do nich po 1 cm
3
alkoholu n-butylowego
2.
Do każdej dodać po 1 cm
3
bezwodnego kwasu mrówkowego HCOOH
3.
Do pierwszej probówki dodać szczyptę NaCl i kilka kropel stężonego H
2
SO
4
–
poprosić prowadzacego!!!!
4.
Obie probówki umieścić w łaźni wodnej na 10 minut w temp.80°C.
5.
Następnie zawartość probówek wlać do zlewek nr1 i nr2 uprzednio napełnionych
5cm
3
wody destylowanej.
6.
Zbadać pH uzyskanych roztworów za pomocą papierka wskaźnikowego.
7.
Określić zapach uzyskanych substancji
8.
Opisać obserwacje i spostrzeżenia z przeprowadzonego ćwiczenia.
9.
Napisać reakcję przebiegu ćwiczenia.
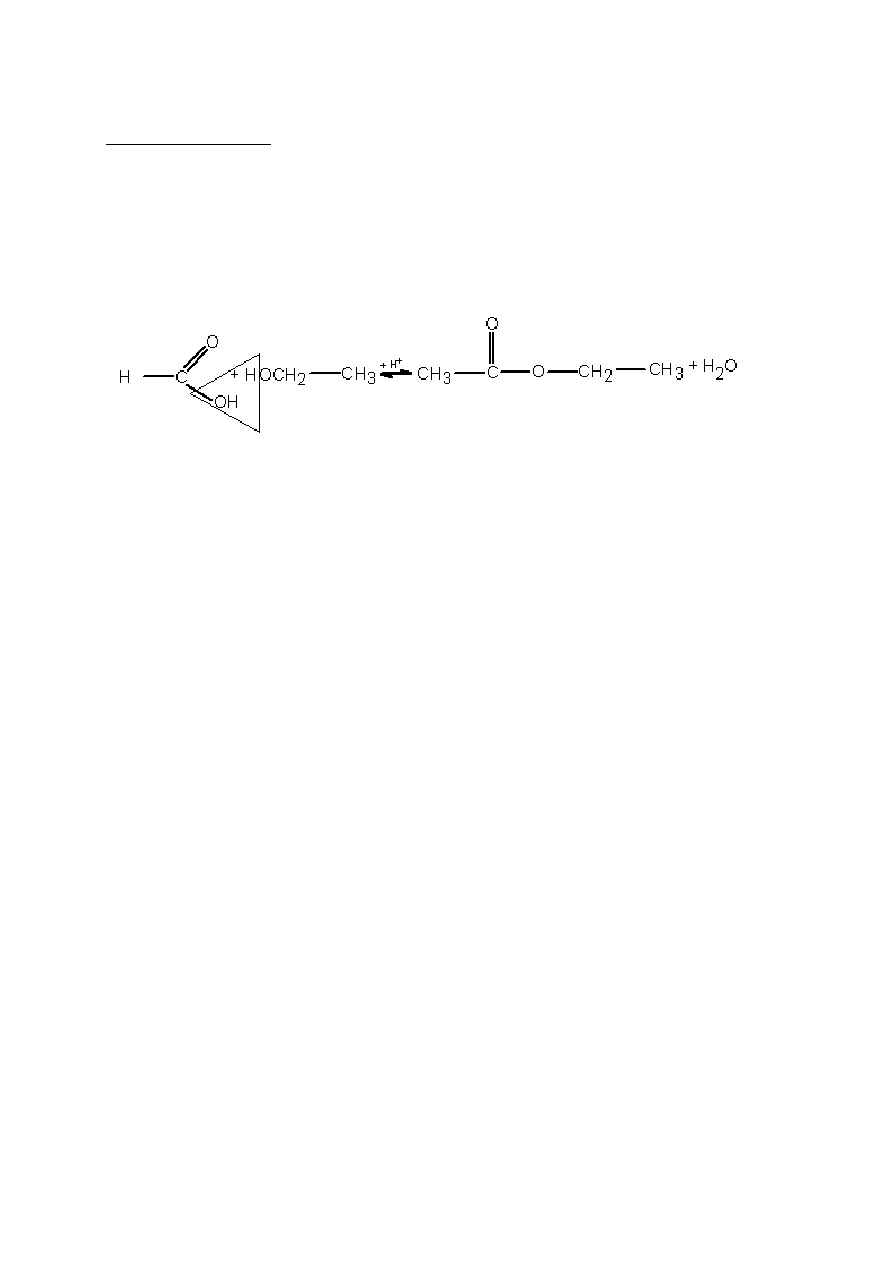
7
C) Otrzymywanie mrówczanu etylu
Wykonanie ćwiczenia:
Do probówki wlać około 1,5 cm
3
etanolu i 1 cm
3
kwasu mrówkowego. Następnie dodać
szczyptę NaCl i około 0,5 cm
3
stężonego H
2
SO
4
. całość ogrzewać kilka minut na łaźni
wodnej. Powstaje ester (mrówczan etylu) związek o zapachu rumu.
Równanie reakcji:
Zagadnienia do przygotowania:
1.
Estry
−
nazewnictwo, metody otrzymywania, właściwości fizyczne i chemiczne
−
reakcje charakterystyczne.
Literatura uzupełniająca:
1.
Kupryszewski G., 1994: Wstęp do chemii organicznej, Wydawnictwo Gdańskie,
Gdańsk
2.
Dobkowska Z., K. M. Puzdro, 1980: Szkolny poradnik chemiczny. WSiP Warszawa
3.
McMurry J., 2000: Chemia organiczna. PWN; Warszawa
4.
Marzec H., 2001: Chemia organiczna. WU ATR; Bydgoszcz
5.
Roberts J. D., M. C. Caserio, 1969: Chemia organiczna. PWN Warszawa
6.
Mastalerz P., 1984: Chemia organiczna. PWN Warszawa
7.
Tomasik P., 1998: Mechanizmy reakcji organicznych. PWN Warszawa-Łódź
Wyszukiwarka
Podobne podstrony:
ĂWICZENIE 10, ĆWICZENIE 10
Ăwiczenie 10
SPFIZC10, Sprawozdanie z ˙wiczenia C-9/10.
Æwiczenie 10
Æwiczenia 10 doc
Badanie tranzystorów unipolarnych typu, ˙wiczenie nr 10
A2 2, ˙wiczenie nr 7-10
Lab pcm30 32, LAB 10, Przebieg ˙wiczenia:
Ăwiczenie 15-16, Studia PWr W-10 MBM, Semestr II, Fizyka, Fizyka - laborki, Fizyka - laborki, Fizyka
W 10 Alkohole Estry itd
C6wiczenie 10=2E Estry=2Epdf =
10 Metody otrzymywania zwierzat transgenicznychid 10950 ppt
10 dźwigniaid 10541 ppt
wyklad 10 MNE
Kosci, kregoslup 28[1][1][1] 10 06 dla studentow
10 budowa i rozwój OUN
więcej podobnych podstron