
Bilans energii
Opracowanie: Ewa Fudalej-Kostrzewa
1
BILANS ENERGII
POJĘCIA PODSTAWOWE
UK
ŁAD TERMODYNAMICZNY
Przystępując do badania dowolnego zjawiska fizycznego należy dokładnie określić
przedmiot badań. W tym celu wyodrębnia się z otaczającej rzeczywistości obiekt – ciało
fizyczne i nazywa go układem fizycznym. Układ fizyczny wyodrębniony do rozważań cieplnych
nazwano układem termodynamicznym.
Układ termodynamiczny jest to część przestrzeni wyodrębniona za pomocą abstrakcyjnej
(pomyślanej) osłony nazywanej osłoną bilansową, ze względu na jej zastosowanie przy
sporządzaniu bilansów substancji i energii. Wielkość i kształt przestrzeni ograniczonej osłoną
bilansową może ulegać zmianie, a ponadto rozpatrywany układ może zmieniać swoje
położenie. Przestrzeń poza wyodrębnionym układem jest jego otoczeniem.
Układ termodynamiczny może być zamknięty, otwarty lub odosobniony.
Układ termodynamiczny jest zamknięty, jeśli nie dopływa do niego ani z niego nie odpływa
materia.
Układ termodynamiczny jest otwarty, jeśli przez osłonę bilansową przepływa materia.
Wówczas ilość materii zawartej wewnątrz osłony bilansowej jest w zasadzie zmienna. Ilość
materii dopływającej do układu otwartego może być jednak równa ilości materii odpływającej.
Układ termodynamiczny jest odosobniony, jeśli nie występuje przekazywanie materii
i
energii przez osłonę bilansową.
Przykłady:
A
. Układ zamknięty
a)
b)
a) W strumieniu przepływającego płynu została myślowo wydzielona jego część za pomocą
ścianki abstrakcyjnej. Jeśli ta wydzielona część będzie zawierała stale te same cząsteczki
płynu i będzie poruszać się wraz z płynem, to rozpatrywany układ będzie układem
zamkniętym.
Ścianki
abstrakcyjne
Ścianka materialna

Bilans energii
Opracowanie: Ewa Fudalej-Kostrzewa
2
b) Układ ten stanowi masa płynu, zamknięta w cylindrze z tłokiem, przy czym zarówno tłok jak
i
cylinder nie pozwalają na przepływ substancji. Układ jest ograniczony ściankami
materialnymi i stanowi układ zamknięty.
B. Układ otwarty
W strumieniu przepływającego płynu została wydzielona pewna objętość dwoma
abstrakcyjnymi, nieruchomymi powierzchniami. Przez te powierzchnie, a więc przez granice
układu, może dopływać i odpływać substancja materialna. Układ jest otwarty.
PARAMETRY STANU UKŁADU
Stan układu określają parametry stanu. Są to takie wielkości fizyczne dotyczące danego
układu, których wartość można kreślić na podstawie pomiaru.
O tym czy dana w
ielkość fizyczna jest parametrem stanu czy nie, rozstrzyga to, czy jej przyrost
przy prz
ejściu z jednego stanu układu do drugiego zależy wyłącznie od tych stanów czy od
sposobu przejścia układu od stanu pierwszego do drugiego.
Parametrem stanu jest wielkość fizyczna, której przyrost zależy wyłącznie od stanów układu
(np. ciśnienie i temperatura).
Wielkość fizyczna, której przyrost zależy od sposobu przejścia z jednego stanu do drugiego nie
jest parametrem stanu (np. praca i ciepło).
ENERGIA WEWNĘTRZNA
Tra
ktując substancję materialną jako zbiór cząsteczek i atomów, można stwierdzić, że
każda z tych cząsteczek ma swoją energię; energie te przy makroskopowym traktowaniu
układu sumują się. Przy takim sumowaniu należy także brać pod uwagę energię wzajemnego
odd
ziaływania cząstek. Ponieważ prawo zachowania energii obowiązuje w odniesieniu do
każdej cząsteczki, zatem z makroskopowego punktu widzenia układ ma pewną energię
podlegającą prawu zachowania.
Energią wewnętrzną układu nazywa się całkowitą jego energię odniesioną do układu osi
współrzędnych, mających początek w środku masy układu i umieszczonych tak, że energia
ewentualnego ruchu obrotowego układu jest równa zeru. Energia wewnętrzna jest oznaczana
literą U.
Powierzchnie
abstrakcyjne

Bilans energii
Opracowanie: Ewa Fudalej-Kostrzewa
3
Energia wewnętrzna jest oczywiście parametrem stanu, gdyż zależy jedynie od stanu
czynnika. Jest ona ponadto parametrem ekstensywnym, gdyż jej wartość zależy od masy
czynnika. Energia wewnętrzna odniesiona do jednostki masy (ilości substancji) oznaczana
będzie literą u, a więc:
i bywa nazywana energią wewnętrzną właściwą.
Na energię wewnętrzną ciała składają się, odniesione do środka masy ciała:
-
energia ruchu postępowego cząsteczek,
-
energia ruchu obrotowego cząsteczek,
-
energia ruchu drgającego atomów w cząsteczkach,
-
energia potencjalna sił międzycząsteczkowych,
-
energia stanów elektronowych w atomach,
-
energia chemiczna związana z możliwością zmian budowy jąder atomów.
Nie wlicza się do energii wewnętrznej ciała jego energii mechanicznej kinetycznej
i
potencjalnej, które są równe zeru, gdy układ współrzędnych znajduje się w środku masy
ciała i porusza się wraz z ciałem. Energia wewnętrzna ciała jest więc równa różnicy między
energią całkowitą a zewnętrzną energią mechaniczną. W termodynamice rozpatruje się
z
reguły wartości energii wewnętrznej ponad stan odniesienia przyjęty umownie za zerowy
lub przyrosty energii wewnętrznej.
Z energią wewnętrzną gazu doskonałego jest związane prawo Joule'a i Thomsona, które
brzmi następująco: „Energia wewnętrzna gazu doskonałego zależy tylko od temperatury
i
może być zmieniona przez izochoryczny wkład ciepła.”
Wyrażane jest to następująco:
-
w odniesieniu do M kg gazu
U = M c
v
(T
2
– T
1
) = Q
1,2
[J]
-
w odniesieniu do 1 kg gazu
u = c
v
(T
2
– T
1
) = q
1,2
[J/kg]
PRACA ABSOLUTNA
Wzajemne oddziaływania układu i otoczenia lub dwóch układów między sobą polegają
przede wszystkim na działaniach energetycznych, stanowiących wymianę energii między nimi.
Dla układów zamkniętych można te oddziaływania podzielić na dwa rodzaje, a mianowicie
pracę i ciepło. Praca jest to oddziaływanie energetyczne, występujące między dwoma układami
M
U
u
Bilans energii
Opracowanie: Ewa Fudalej-Kostrzewa
4
zamkniętymi (z których jednym może być otoczenie) i polegające na zmianie ich energii, takie,
że zmiana energii każdego ze współdziałających układów może być sprowadzona wyłącznie do
zmiany energii potencjalnej jak
iegoś innego układu zewnętrznego zarówno przy danym
kierunku przemiany jak i przy jej przebiegu w kierunku przeciwnym.
Definicja ta oznacza, że praca może być całkowicie zamieniona na potencjalną energię
mechaniczną jakiegoś układu i odwrotnie może być wykonana kosztem spadku tej energii.
W większości przypadków praca daje przedstawić się w postaci działania siły na pewnej
drodze, to znaczy:
Pds
L
W przypadku mającym duże znaczenie praktyczne, gdy siła jest wywołana ciśnieniem
czynnika, w
ykonanie pracy jest związane ze zmianą objętości układu. Ma to miejsce
w
układzie składającym się z cylindra i tłoka, mogącego przesuwać się bez tarcia (układ
zamknięty).
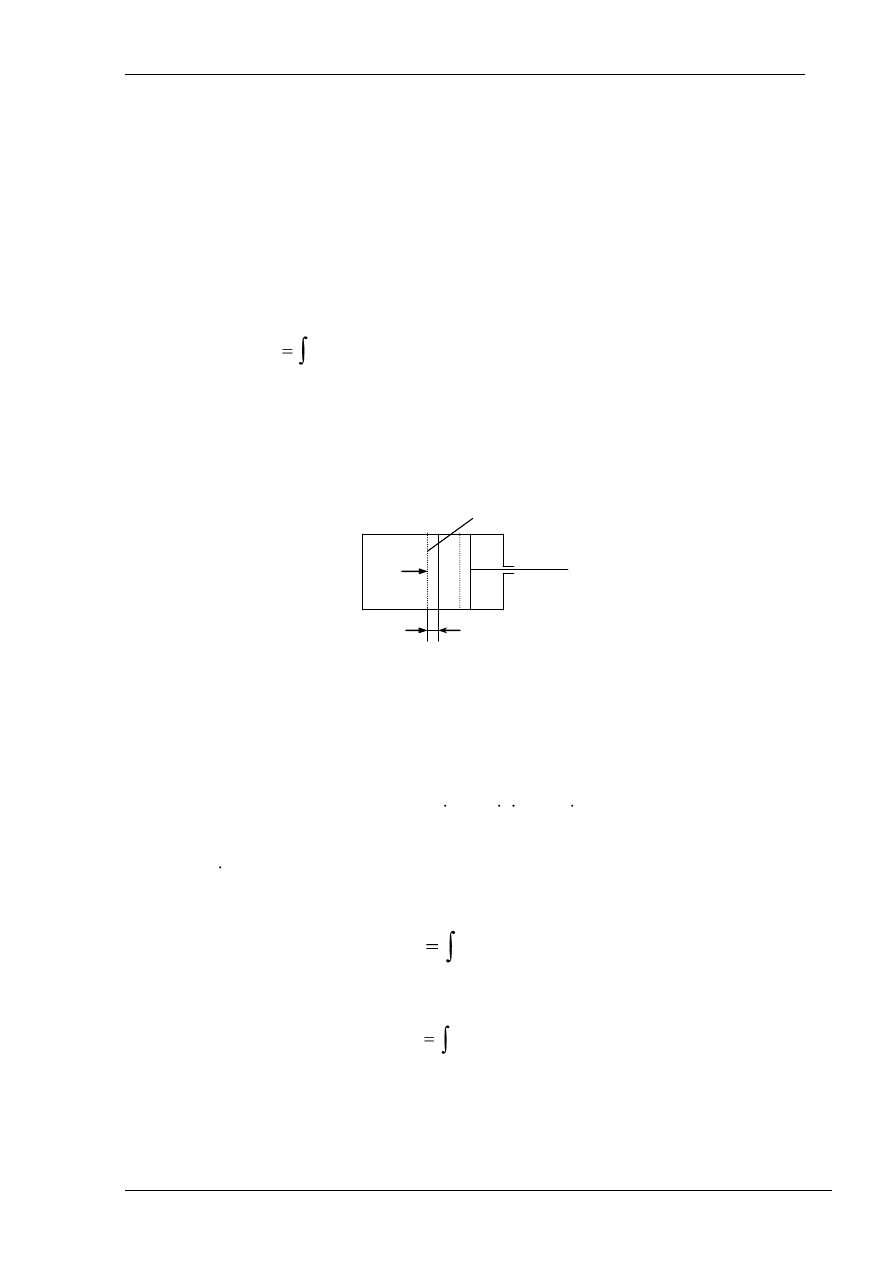
Oznaczenia na rysunku: p
– ciśnienie gazu w cylindrze, P – siła nacisku gazu na tłok, F - pole
powierzchni tłoka, ds – elementarne przesunięcie tłoka.
Jeśli tłok przesunie się o elementarną długość ds, przy czym ciśnienie można traktować
wówczas jako stałe, to praca wykonana przy takim przesunięciu wynosi:
dL = P ds = p F ds = p dV,
gdzie:
p
– ciśnienie gazu w cylindrze,
F
- pole powierzchni tłok
a,
P = p F
– siła działającą na tłok (siła nacisku gazu na tłok).
Po zakończonym przesunięciu tłoka praca wyrazi się zależnością:
w odniesieniu zaś do jednostki masy czynnika:
gdzie: v = V/M -
objętość właściwa czynnika, czyli objętość zajmowana prze jednostkę masy.
2
1
,
dV
p
L
2
1
,
dv
p
l
ds
P
p
F

Bilans energii
Opracowanie: Ewa Fudalej-Kostrzewa
5
Obliczona praca jest pracą mechaniczną, która ma bardzo duże znaczenie, szczególnie
w
zagadnieniach związanych z pracą silników cieplnych.
Praca mechaniczna
nazywa się pracą zewnętrzną lub pracą absolutną (oznaczana L
a
), przy czym stosuje się
umowę, że praca wykonana przez układ ma znak dodatni, wykonana zaś przez otoczenie nad
układem jest ujemna.
Należy zwrócić uwagę na fakt, że praca nie jest parametrem stanu, gdyż zależy nie tylko od
stanu początkowego i końcowego przemiany, lecz i od drogi tej przemiany, to znaczy od
kolejności zmian stanów między punktem początkowym i końcowym. Matematycznie oznacza
to, że wyrażenie dL nie jest różniczką zupełną funkcji L, lecz stanowi bardzo małą elementarną
pracę wykonaną przy bardzo małej zmianie objętości układu.
Na wykresie p-
v praca zewnętrzna (absolutna) wyraża się polem pod krzywą przemiany,
opartym na osi v.
Praca absolutna przemiany 1-2 przedstawionej na rysunku pow
yżej ma znak „+” gdyż układ
oddaje pracę (czynnik wykonuje pracę).
Należy zwrócić uwagę na fakt, że praca zewnętrzna stanowi pracę, jaką można otrzymać
z
układu lub, jaką należy do niego doprowadzić w przypadku, gdy układ zamknięty zmienił
swoją objętość - jest to praca jednorazowego rozprężania lub sprężania czynnika w układzie
zamkniętym.
CIEPŁO
Ciepło jest formą przekazywania energii inną niż praca i jest oznaczane literą Q lub
w odniesieniu do jednostki masy substancji
– literą q. Przekazywanie energii w postaci ciepła
z
jednego układu do drugiego może występować wówczas, gdy temperatury tych układów
różnią się między sobą.
2
1
dV
p
L
V
1
2
p
+
2
1
2
,
1
dV
p
L
a

Bilans energii
Opracowanie: Ewa Fudalej-Kostrzewa
6
Podobnie jak praca, ciepło nie jest parametrem stanu, gdyż zależy od stanu początkowego
i
końcowego oraz od drogi przemiany. W rozważaniach dotyczących silników cieplnych
przyjmuje się zwykle, że ciepło dopływające z zewnątrz do układu (pochłonięte przez układ) ma
znak dodatni, a ciepło oddane przez układ jest ujemne.
Ciepło pochłonięte przez ciało w zakresie temperatur od t
1
do t
2
można zapisać wzorem:
)
(
1
2
2
1
t
t
c
M
Q
[J]
lub w odniesieniu do 1 kg masy
ciała:
)
(
1
2
2
1
t
t
c
q
[J/kg]
gdzie: M [kg]
– masa ciała,
c [J/(kg∙K)] – pojemność cieplna właściwa (ciepło właściwe).
Ciepło właściwe zależy od rodzaju ciała i od warunków ogrzewania ciała. Np. podczas
ogrzewania przy
stałym ciśnieniu gazy doskonałe pochłaniają inną ilość ciepła niż podczas
ogrzewania
przy stałej objętości. W przypadku gazów półdoskonałych i rzeczywistych ciepło
właściwe zależy również od zakresu temperatur t
1
i t
2
.
PRACA TECHNICZNA
Duże znaczenie praktyczne w zastosowaniach technicznych mają przemiany zachodzące
w
układach otwartych, w których występuje stały i ustalony przepływ czynnika przez układ.
Zachodzą one np. w silnikach cieplnych i maszynach roboczych, takich jak sprężarki i turbiny,
przy czym przemiany te zwykle są połączone z wykonaniem pracy.
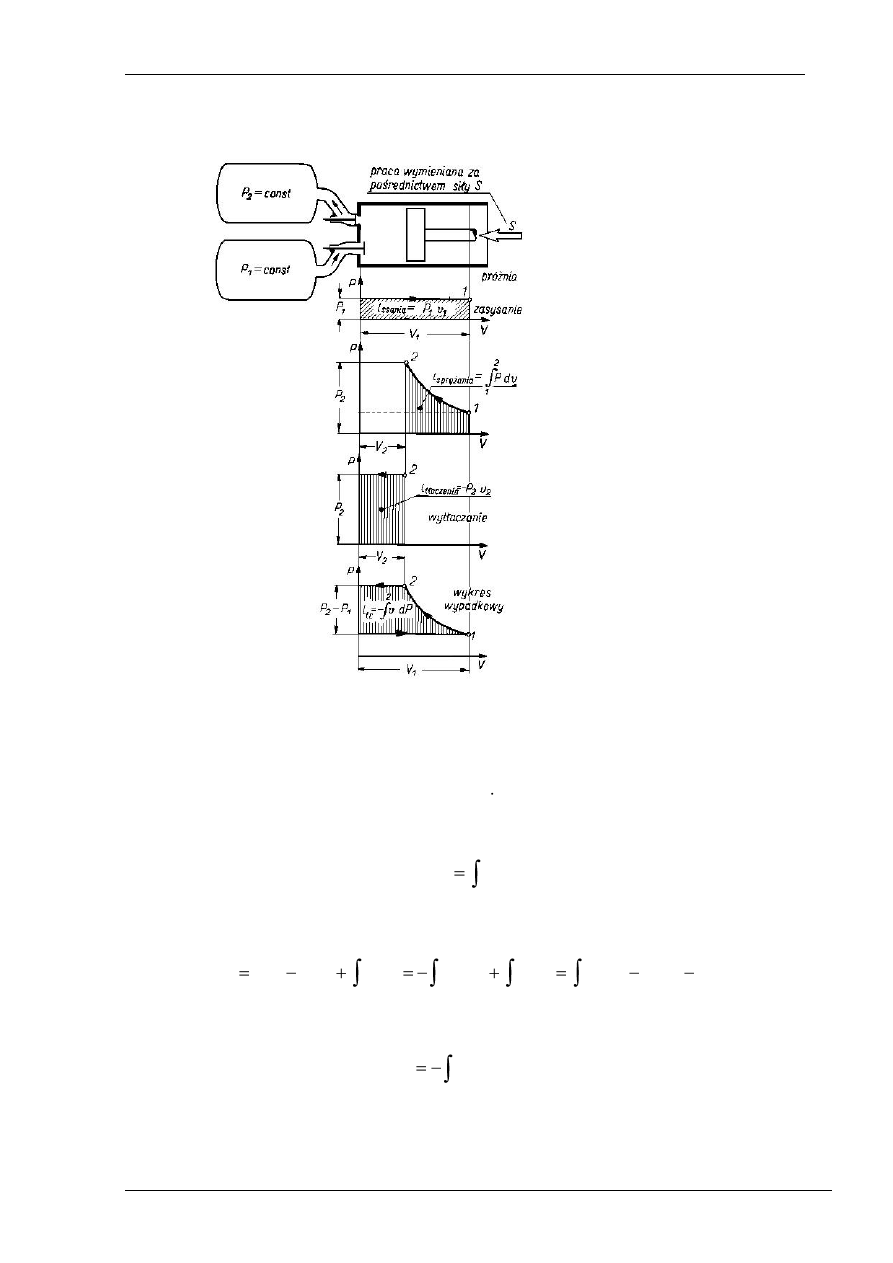
Do pojęcia pracy technicznej dochodzi się rozpatrując idealną sprężarkę tłokową, której
zadaniem jest pobranie czynnika o ciśnieniu p
1
– mniejszym, i dostarczenie tego czynnika do
przestrzeni o ciśnieniu p
2
– większym.
Sprężarka ma dwa samoczynne zawory: dolotowy i wylotowy. W chwili, gdy tłok znajduje
się w górnym martwym położeniu otwiera się zawór dolotowy i rozpoczyna się napełnianie
cylindra sprężarki. W miarę przesuwania się tłoka w prawo do cylindra dopływa czynnik roboczy
o
ciśnieniu p
1
, gdyż doskonale działający zawór dolotowy nie stawia oporu przy przepływie. Po
zakończeniu napełniania – tłok znajduje się w dolnym martwym położeniu – zawór dolotowy
zamyka się i w układzie zamkniętym (zawór wylotowy też jest zamknięty, ponieważ ciśnienie
w
cylindrze jest mniejsze od ciśnienia p
2
) odbywa się sprężanie czynnika. Ciśnienie czynnika
rośnie do wartości p
2
(wartość ciśnienia w zbiorniku), otwiera się zawór wylotowy i następuje
wytłaczanie czynnika do momentu, w którym tłok znajdzie się w górnym martwym położeniu.
Całkowita praca wykonana w układzie będzie składała się z trzech następujących pozycji:
a) praca wy
konana przez gaz wchodzący do układu (dodatnia)
p
1
V
1
,
Bilans energii
Opracowanie: Ewa Fudalej-Kostrzewa
7
b)
praca (ujemna), jaka musi być doprowadzona do gazu uchodzącego z układu, aby go
usunąć z układu, i która jest równa
- p
2
V
2
,
c)
praca zewnętrzna (absolutna) związana ze zmianą objętości (praca sprężania, ujemna)
Suma tych trzech pozycji nosi nazwę pracy technicznej i jest równa:
Ostatecznie:
lub w odniesieniu do 1 kg czynnika:
2
1
2
,
1
dp
V
L
t
2
1
.
dV
p
L
2
1
2
1
2
1
2
1
2
2
1
1
2
,
1
)
(
)
(
dp
V
dV
p
dV
p
dV
p
pV
d
dV
p
V
p
V
p
L
t
Bilans energii
Opracowanie: Ewa Fudalej-Kostrzewa
8
Na wykresie p-
v praca techniczna wyraża się polem zawartym pomiędzy krzywą przemiany,
osią p oraz liniami poziomymi, przeprowadzonymi z punktu początkowego i końcowego
przemiany.
Znak minus przed całką wynika stąd, że zgodnie z przyjętą umową praca jest dodatnia
wówczas, gdy jest wykonana przez czynnik (ciśnienie spada). Przy rozprężaniu czynnik
wykonuje pracę, lecz wówczas znak różniczki ciśnienia jest ujemny, aby więc wartość pracy
była dodatnia, musi być dodany znak minus w wyrażeniu na pracę techniczną.
„Dla układu zamkniętego praca techniczna jest wielkością matematyczną nie mającą interpretacji
fizycznej, ma natomiast interpretację fizyczną dla układu przepływowego w stanie ustalonym.” – Stefan
Wiśniewski, Termodynamika techniczna, str.32.
ENTALPIA
Energia wewnętrzna U jest wielkością wystarczająco określającą energię ciała w stosunku
do próżni. Natomiast w przypadku ciała zanurzonego w polu sił zewnętrznych o zmiennym
natężeniu, to pojęcie energii wewnętrznej jest niewystarczające.
2
1
2
,
1
.
dp
v
l
t
1
2
-
p
v
2
1
2
,
1
dp
v
l
t
F
1
próżnia
p
1
, v
1
, T
1
, u
1
V = [m
3
]
M = [kg]
p
1
A[m
2
]
x
1 kg
u
1
p
1
, T
1
, v
1
x
[m]
A [m
2
]
Rys. 1
Rys. 2

Bilans energii
Opracowanie: Ewa Fudalej-Kostrzewa
9
Weźmy 1 kg dowolnego czynnika gazowego, którego parametry stanu wynoszą p
1
, v
1
, T
1
, a tym
samym o określonej energii wewnętrznej u
1
= c
v
.
T
1
[kJ/kg]. Niech ten 1 kg gazu będzie
opakowany w rodzaj puszki (rys. 1) o przekroju poprzecznym A [m
2
] i długości x. [m].
Pominiemy grubość materiału, z którego jest zrobiona puszka. Początkowo puszka
z
czynnikiem znajduje się w próżni i gdy założymy, że energia próżni jest równa zeru, to energia
czynnika w puszce będzie energią absolutną. Spróbujmy przenieść naszą puszkę z próżni do
przestrzeni wypełnionej tym samym gazem, o tym samym ciśnieniu p
1,
objętości jednostkowej
v
1
, temperaturze T
1
i energii wewnętrznej u
1
; przestrzeń tę wyobrazimy sobie w postaci
zbiornika o nieograniczenie wielkiej pojemności (rys. 2). Niech zbiornik ma otwór doskonale
dopasowany do przekroju A puszki. Jeśli przyłożymy puszkę do otworu, to będzie ona poddana
działaniu siły ciśnienia absolutnego p
1
[Pa] w zbiorniku względem próżni na powierzchni A,
a
więc musimy ją trzymać siłą:
F
1
= p
1
A [N]
Wciskając do zbiornika puszkę na jej długości x wykonujemy wkład pracy:
F
1
x = p
1
A x = p
1
v
1
[J/kg],
bo objętość puszki A x [m
3
] odnosi się do 1 kg gazu.
Po wtłoczeniu puszki do wnętrza zbiornika i zasklepieniu otworu, możemy usunąć
z
wepchniętego gazu powłokę wyobrażalnej puszki, bo wprowadzony gaz nie będzie się niczym
różnił od reszty zawartości zbiornika.
Prz
ekonujemy się, że czynnik w polu zewnętrznego ciśnienia, prócz energii wewnętrznej
u
1
[J/kg] (absolutnej), musi posiadać jeszcze energię umieszczenia p
1
v
1
[J/kg]. Sumą tych
energii jest entalpia statyczna i
1
:
i
1
= u
1
+ p
1
v
1
[J/kg],
a ponieważ stan 1 został obrany dowolnie, więc możemy ogólnie napisać:
i = u + p v.
(1)
Mamy dane, że u = c
v
T oraz równanie stanu p v = R T, więc:
i = c
v
T + R T = (c
v
+ R) T = c
p
T
(2)
Entalpia statyczna gazu doskonałego zależy tylko od temperatury. Podsumowując:
w pr
zypadku, gdy czynnik przepływa z obszaru o ciśnieniu mniejszym do przestrzeni
o
ciśnieniu większym, nie wystarcza tylko zwiększenie energii wewnętrznej czynnika u,
ale należy czynnikowi nadać przyrost energii umieszczenia (p v):
i = u + (p v)
Entalpię gazów doskonałych można obliczyć korzystając z definicji entalpii:
i = u + p v
Ponieważ :
u = c
v
T
Bilans energii
Opracowanie: Ewa Fudalej-Kostrzewa
10
p v = R T
to w odniesieniu do 1 kg czynnika:
i = c
v
T + R T = (c
v
+ R) T = c
p
T [J/kg]
Entalpia gazu doskonałego zależy tylko od temperatury – dlatego jest parametrem stanu.
Entalpia dowolnej masy M gazu wynosi:
I = M i = M c
p
T [J]
Przyrost etalpii wynosi:
-
w odniesieniu do M kg gazu
I = M
.
c
p
.
(T
2
– T
1
) [J]
-
w odniesieniu do 1 kg gazu
i = c
p
.
(T
2
– T
1
) [J/kg]
BILANS ENERGII
– PIERWSZA ZASADA TERMODYNAMIKI
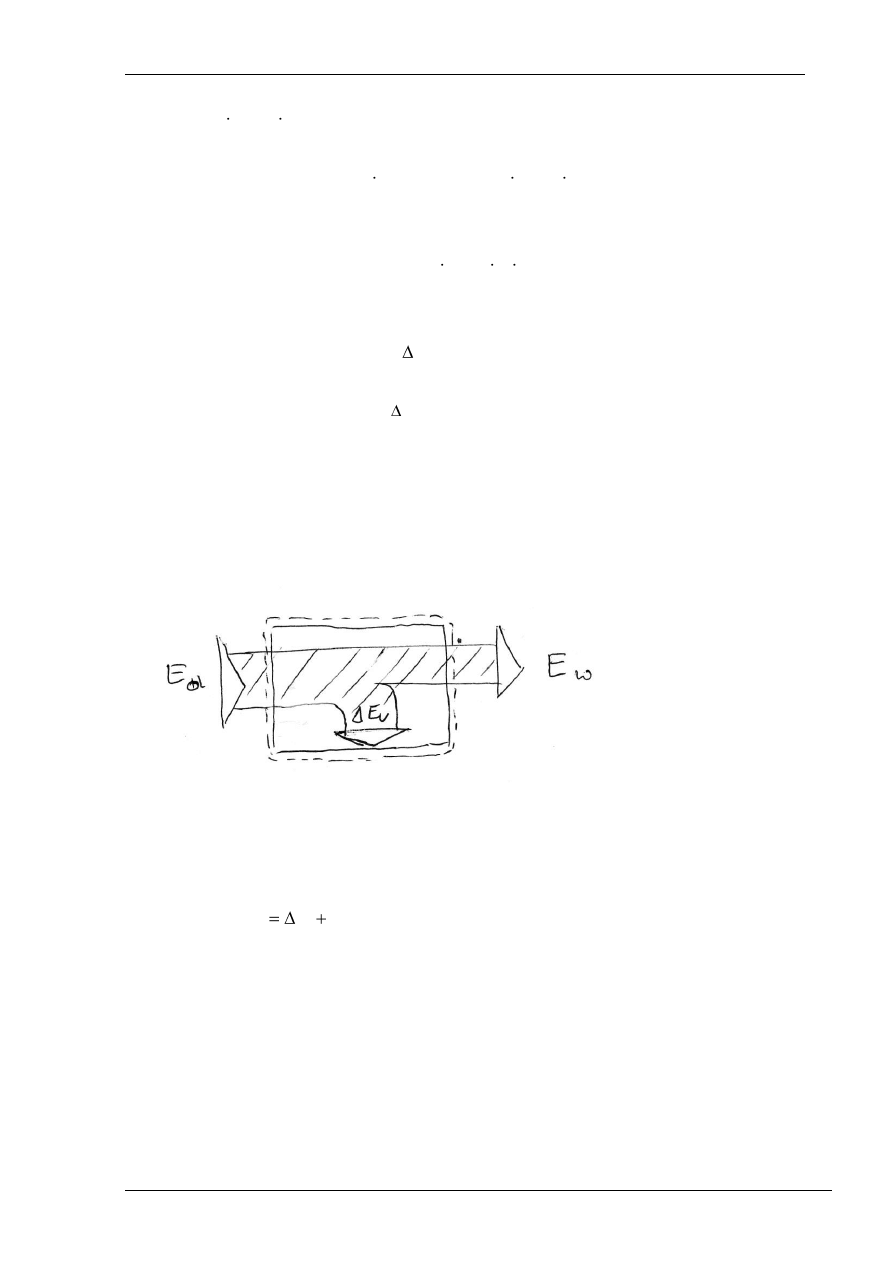
Bilans energii wynika z zasady zachowania energii i jest podstawowym narzędziem
rozwiązywania zagadnień termodynamiki technicznej. Bilans ten sporządza się dla układu
termodynamicznego wyodrębnionego osłoną bilansową.
Z energii dopro
wadzonej do układu wyodrębnionego osłoną bilansową część pozostaje
w
układzie, reszta zaś z układu wypływa.
Równanie bilansu energii można zapisać następująco:
w
u
d
E
E
E
(1)
gdzie: E
d
– energia doprowadzona do układu,
E
w
– energia wyprowadzona z układu,
ΔE
u
– przyrost energii układu.
W technice cieplnej dużą rolę odgrywają urządzenia (układy) działające w sposób ciągły
(np. kocioł, turbina) lub okresowy (np. silnik spalinowy). Jeżeli układ działa w sposób ustalony,
tzn. jeżeli jego parametry stanu nie zmieniają się w sposób okresowy i po skończonej liczbie

Bilans energii
Opracowanie: Ewa Fudalej-Kostrzewa
11
okresów wracają do wartości początkowej, to bilans energii odniesiony do jednostki czasu
wyraża równanie:
w
d
E
E
(2)
Jeżeli układ znajduje się w stanie ustalonym, to energia doprowadzona równa się energii
wyprowadzonej.
Energia układu odosobnionego jest niezmienna:
.
0
const
E
E
u
u
Zastosowanie równania bilansu energii (1) do przemian termodynamicznych prowadzi do
zależności nazywanych pierwszą zasadą termodynamiki. Z równania (2) wynika, że np. silnik, tj.
maszyna wykonująca w sposób ciągły pracę
0
w
E
, nie może działać bez zasilania energią
0
d
E
. Stąd wynika następujące sformułowanie pierwszej zasady termodynamiki:
„Jest rzeczą niemożliwą skonstruowanie perpetuum mobile pierwszego rodzaju, tj.
silnika pracującego bez zasilania energią z zewnątrz.”
Ogólnie można stwierdzić, że oddziaływania energetyczne zachodzące między układem
zamkniętym a otoczeniem, mogą zachodzić w dwojaki sposób; to znaczy energia może być
wymieniana w postaci pracy lub ciepła. W wyniku tych oddziaływań ulega zmianie energia
układu, zmniejszając się lub powiększając.
Po zastosowaniu równania bilansu energii w postaci:
w
u
d
E
E
E
do czynnika zawartego w układzie zamkniętym, dochodzi się do wniosku, że ciepło
doprowadzone do czynnika ze źródła zewnętrznego jest zużywane na wykonanie pracy
bezwzględnej i na przyrost energii wewnętrznej czynnika:
2
1
1
2
2
1
L
U
U
Q
Pow
yższe równanie jest matematycznym wyrażeniem pierwszej zasady termodynamiki
i
jest słuszne dla każdej dowolnej przemiany termodynamicznej zachodzącej w układzie
zamkniętym.
Inny zapis tego równania:
2
1
2
1
1
2
L
Q
U
U
W
układzie zamkniętym zmiana energii wewnętrznej jest równa sumie algebraicznej pracy
bezwzględnej oraz ciepła wymienionego z otoczeniem, o ile nie występuje zmiana energii
kinetycznej oraz energii położenia układu.
Dla układu otwartego pierwsza zasada termodynamiki ma postać:
I
2
– I
1
= Q
1,2
– L
t1,2

Bilans energii
Opracowanie: Ewa Fudalej-Kostrzewa
12
albo w odniesieniu do 1 kg przepływającego czynnika
i
2
– i
2
= q
1,2
– l
t1,2
.
Można więc stwierdzić, że entalpia może być zmieniona przez wkład ciepła i wkład pracy
technicznej, każdego z osobna lub równocześnie.
„Dla układów zamkniętych równanie:
I
2
– I
1
= Q
1,2
– L
t1,2
ma znaczenie tylko matematyczne.” – Jan Szargut, Termodynamika, str. 46.
ZADANIA
Zadanie 1.
W cylindrze z ruchomym tłokiem znajduje się azot. Parametry początkowe gazu wynoszą:
p
1
= 0,17 MPa, t
1
= 127
C, a objętość początkowa cylindra wynosi 2 m
3
. Gaz ogrzano
doprowadzając izobarycznie ciepło w ilości Q = 100 kJ. Obliczyć parametry końcowe gazu
w
cylindrze, przyrost energii wewnętrznej i enatalpii oraz pracę absolutna i techniczną.
Odp.: p
2
= 0,17 MPa, V
2
= 2,169 m
3
, T
2
= 434 K, U = 71,27 kJ, I = 100 kJ, L
t1,2
= 0,
L
a1,2
= 28,73 kJ
Zadanie 2.
Do 0,6 kg azotu zamkniętego w cylindrze z ruchomym tłokiem doprowadzono ciepło
q =
220kJ/kg. Jednocześnie układ wykonał pracę L
a
= 150 kJ. Obliczyć przyrost temperatury
gazu w cylindrze.
Temperatura początkowa t
1
= 100 C.
Odp.: T = -40K
Zadanie 3.
Do jakiej temperatury należy podgrzać 1 kg azotu, który w zbiorniku o stałej objętości ma
parametry początkowe p
1
= 0,1 MPa, t
1
= 17
C, aby ciśnienie wzrosło do p
2
= 0,4 MPa ?
Obliczyć zmianę energii wewnętrznej, entalpii, doprowadzone ciepło oraz pracę absolutną
i
techniczną.
Odp.: U = 646 kJ, I = 904 kJ, L
a1,2
= 0, L
t1,2
= -258,4 J
Zadanie 4.
Roztwór gazów doskonałych dla którego k = c
p
/c
v
= 1,5 podlega w układzie zamkniętym
przemianie b
ez tarcia, opisanej prostoliniową zależnością p(V). Parametry gazu wynoszą:
p
1
= 0,5 MPa, V
1
= 0,1 m
3
, p
2
= 0,2 MPa, V
2
= 0,5 m
3
. Obliczyć ilość doprowadzonego ciepła.
Odp.: Q = 240 kJ

Bilans energii
Opracowanie: Ewa Fudalej-Kostrzewa
13
Zadanie 5.
W pojemniku o objętości 11 m
3
znajduje się 28 kg azotu N
2
pod ciśnieniem 0,35 MPa. W drugim
pojemniku znajduje się 5 kg wodoru H
2
pod ciśnieniem 0,6 MPa i w temperaturze 350 K.
Obliczyć parametry stanu mieszaniny oraz energię wewnętrzną (w odniesieniu do 0 K) po
połączeniu obu pojemników.
Odp.: T = 381 K, p = 0,48 MPa, U
0K
= 27,82 MJ
Zadanie 6.
Skład kilogramowy roztworu gazów doskonałych jest następujący: azot N
2
– g
1
=0,32, tlen O
2
–
g
2
=0,18, hel He
– g
3
= 0,50. Roztwór ten jest przechowywany w zbiorniku o objętości
V = 25,6 m
3
, którym panuje ciśnienie p
1
=32,18 bar w temperaturze T
1
=295K. Do zbiornika
doprowadzono rurociągiem V
2
= 15 m
N
3
tlenu O
2
o temperaturze T
2
=283
K. Obliczyć udziału
molowe składników roztworu oraz ciśnienie w zbiorniku po doprowadzeniu tlenu.
Odp.:z
N2
=0,0787, z
O2
=0,0583, z
N2
=0,863, p=3,31 MPa.
Wyszukiwarka
Podobne podstrony:
pomiary mocy i energii id 37439 Nieznany
energiazosadow id 161683 Nieznany
Pomiar mocy i energii id 373838 Nieznany
3 praca i energia id 33987 Nieznany (2)
Bilans uproszczony id 85774 Nieznany
bilans platniczy2010 2 id 85759 Nieznany
energia 2 id 161627 Nieznany
pomiary mocy i energii id 37439 Nieznany
IMIR przyklady praca energia id Nieznany
Bilans 2 id 85682 Nieznany
Energia moc sygnalow id 161651 Nieznany
Bilans za 2011 id 85782 Nieznany (2)
Bilans 4 id 85684 Nieznany (2)
ENERGIA skrocona id 161663 Nieznany
zuzycie energii w domu id 59342 Nieznany
Energia moc sygnalow id 161652 Nieznany
3 Analiza pasywow bilansu id 33 Nieznany (2)
5 Praca energia moc id 40378 Nieznany
więcej podobnych podstron