© Prof. Antoni Kozioł, Wydział Chemiczny Politechniki Wrocławskiej, 2010/2011
1
OGÓLNOTECHNICZNE
PODSTAWY BIOTECHNOLOGII
Z GRAFIKĄ INŻYNIERSKĄ
Wykład IX
Podstawy techniki cieplnej
©
Prof. Antoni Kozioł, Wydział Chemiczny Politechniki Wrocławskiej, 2010/2011
2
Uwagi wstępne
Końcowym tematem naszych wykładów będą podstawy
tzw. techniki cieplnej.
Technika cieplna jest to nauka stosowana blisko związana
z termodynamiką i zajmująca się praktycznymi zagadnieniami
związanymi z przemianami energii cieplnej czyli ciepła i energii
mechanicznej czyli pracy.
W związku z tym, że technika cieplna bardzo blisko związana z termodynamiką,
na wstępie przedstawię Państwu podstawowe definicje i pojęcia termodynamiczne.
©
Prof. Antoni Kozioł, Wydział Chemiczny Politechniki Wrocławskiej, 2010/2011
3
Literatura
1.
E. Kalinowski: Termodynamika. Wydawnictwo
Politechniki Wrocławskiej, Wrocław 1994.
2.
J. Szargut: Termodynamika techniczna. PWN,
Warszawa 1991.
3.
S. R. Turns: Thermodynamics. Concepts and
Applications. Cambridge University Press.
Cambridge 2001.
©
Prof. Antoni Kozioł, Wydział Chemiczny Politechniki Wrocławskiej, 2010/2011
4
Uwagi wstępne
Termodynamika jest to dział fizyki zajmujący się zagadnieniami
cieplno – mechanicznymi w skali makroskopowej.
Termo – zjawiska, zagadnienia
cieplne związane z chaotycznym
ruchem cząsteczek materii
- dynamika – zjawiska, zagadnienia
mechaniczne związane z uporządkowanym
ruchem makroskopowych zbiorów materii
©
Prof. Antoni Kozioł, Wydział Chemiczny Politechniki Wrocławskiej, 2010/2011
5
Podstawowe pojęcia i definicje
termodynamiczne
Podstawowymi pojęciami termodynamicznymi są pojęcia
układu i otoczenia.
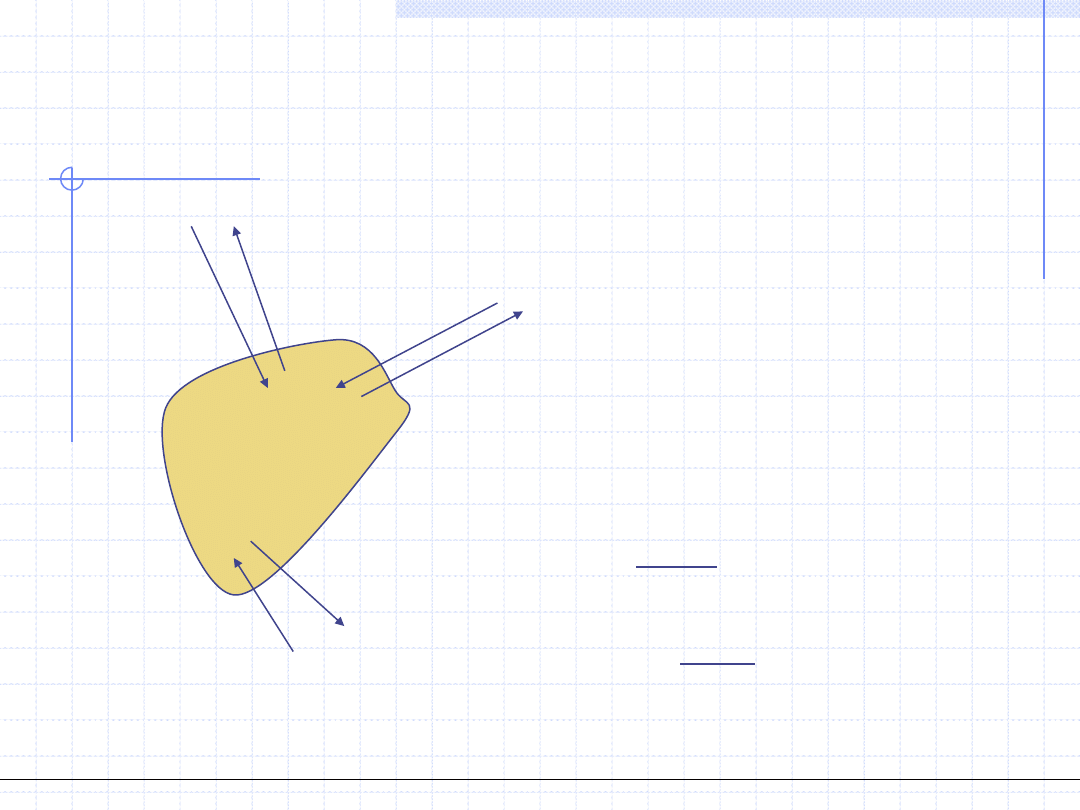
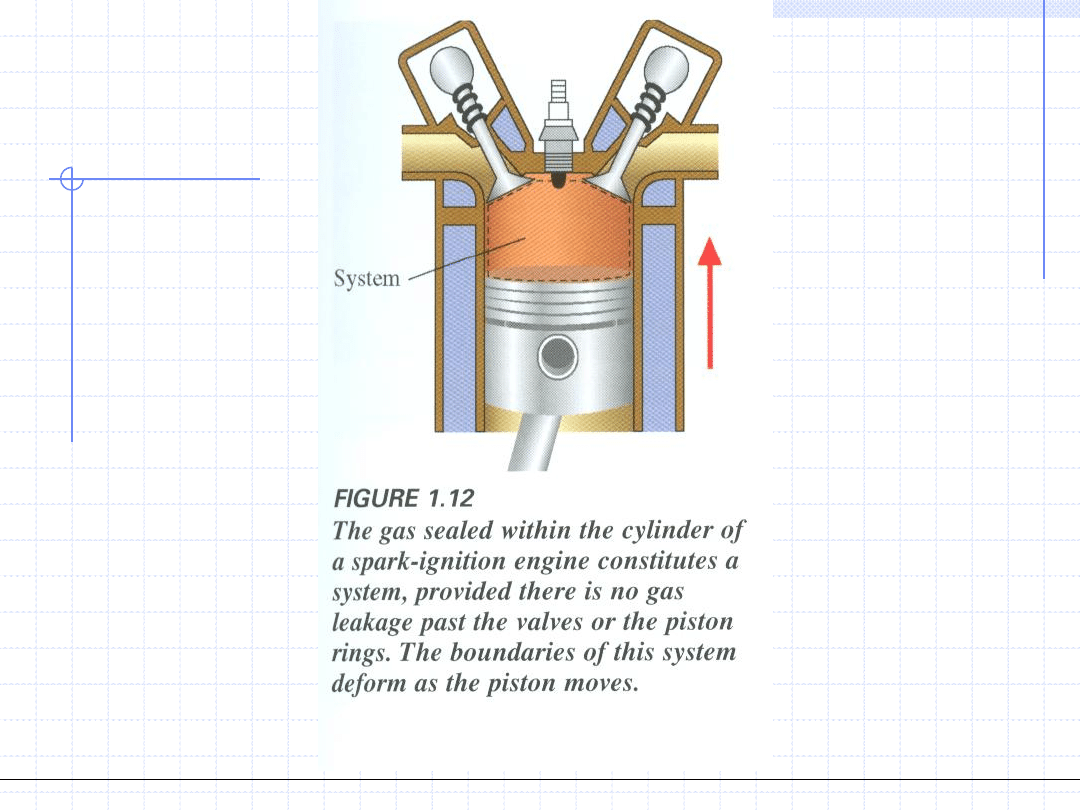
Układem nazywamy wyodrębnioną część przestrzeni wraz ze znajdującą
się tam materią będąca obiektem naszych rozważań.
Otoczeniem nazywamy część przestrzeni wraz ze znajdująca się tam
materią bezpośrednio stykająca się z układem.
Układ i otoczenie stykają się wzdłuż pewnej powierzchni będącej
brzegiem układu.
©
Prof. Antoni Kozioł, Wydział Chemiczny Politechniki Wrocławskiej, 2010/2011
Układ i otoczenie mogą wymieniać
ze sobą energię i masę.
Energia może być wymieniana na dwa
sposoby:
- jako ciepło, gdy wiąże się to
z przekazywaniem termicznym
- lub jako praca gdy energia jest
przekazywana mechanicznie w sposób
uporządkowany
6
Podstawowe pojęcia i definicje
termodynamiczne
Układ
Otoczenie
Masa
Praca (energia mechaniczna)
Ciepło (energia cieplna)
©
Prof. Antoni Kozioł, Wydział Chemiczny Politechniki Wrocławskiej, 2010/2011
7
©
Prof. Antoni Kozioł, Wydział Chemiczny Politechniki Wrocławskiej, 2010/2011
8
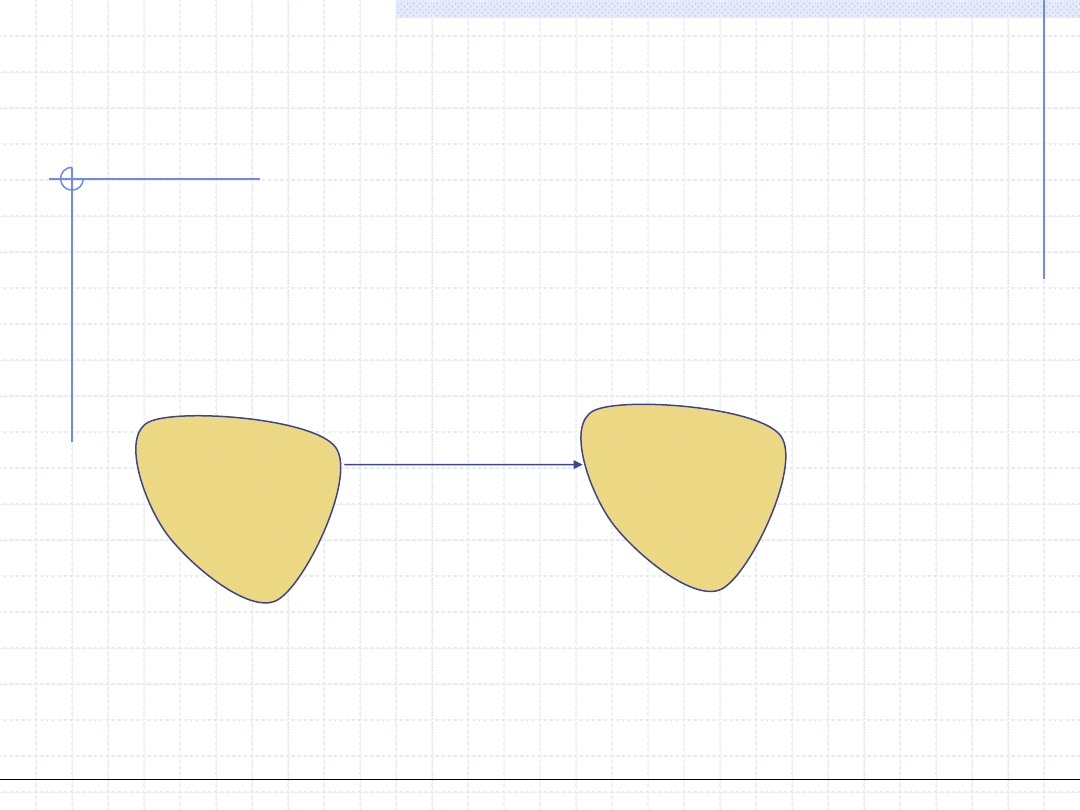
RELACJE UKŁADU Z
OTOCZENIEM
W zależności od istnienia lub braku wymiany z otoczeniem układ określa się jako:
•adiabatyczny – gdy nie ma wymiany ciepła
•w kontakcie termicznym – gdy wymiana ciepła jest obecna
•izolowany mechanicznie – gdy praca nie jest wykonywana
•w kontakcie mechanicznym – gdy praca jest wykonywana
•zamknięty – gdy nie ma wymiany masy
•otwarty – gdy wymiana masy się odbywa
©
Prof. Antoni Kozioł, Wydział Chemiczny Politechniki Wrocławskiej, 2010/2011
9
RÓWNOWAGA
TERMODYNAMICZNA
Mówimy, że układ znajduje się w stanie równowagi termodynamicznej,
gdy jest on pozostawiony sobie przez odpowiednio długi czas.
Układ który jest w stanie równowagi cechuje się stałością w czasie parametrów
opisujących jego stan. Oznacza to że nie zachodzą w nim żadne makroskopowe
zmiany. Stan równowagi nie oznacza że w układzie nic się nie dzieje.
Oznacza tylko tyle że procesy zachodzące w układzie nie dają efektów
makroskopowych. W stanie równowagi mogą np. zachodzić tzw. odwracalne
reakcje chemiczne zachodzące w obydwie strony z jednakową szybkością.
©
Prof. Antoni Kozioł, Wydział Chemiczny Politechniki Wrocławskiej, 2010/2011
10
STAN UKŁADU I PRZEMIANA
TERMODYNAMICZNA
Stan układu termodynamicznego opisuje szereg wielkości fizycznych
nazywanych parametrami lub funkcjami stanu.
Jeżeli układ zmienia swój stan, to mówimy że odbywa się przemiana
termodynamiczna
Stan 1
Stan 2
Przemiana
Przemianę termodynamiczną charakteryzują:
a) przyrosty parametrów stanu
b) wielkości opisujące wymianę między układem a otoczeniem
(parametry przemiany)
©
Prof. Antoni Kozioł, Wydział Chemiczny Politechniki Wrocławskiej, 2010/2011
11
ODWRACALNOŚĆ I QUASI-STATYCZNOŚĆ
PRZEMIAN TERMODYNAMICZNYCH
Bardzo ważnym pojęciem jest tzw. odwracalność przemian
termodynamicznych. Jest to pojęcie idealne tzn. że rzeczywiste
przemiany nigdy nie są odwracalne.
Daną przemianę będziemy nazywać odwracalną gdy możliwy jest
powrót zarówno układu jak i otoczenia do punktu wyjściowego.
Przemianę będziemy nazywać quasi-statyczną jeżeli jest ona ciągiem
następujących po sobie stanów równowagi układu.
Każda przemiana odwracalna jest przemianą quasi-statyczną.
Przemianę, która nie jest odwracalna nazywamy przemianą
nieodwracalną.
©
Prof. Antoni Kozioł, Wydział Chemiczny Politechniki Wrocławskiej, 2010/2011
12
WIELKOŚCI EKSTENSYWNE I
INTENSYWNE
)
(
)
(
)
(
2
1
X
X
X
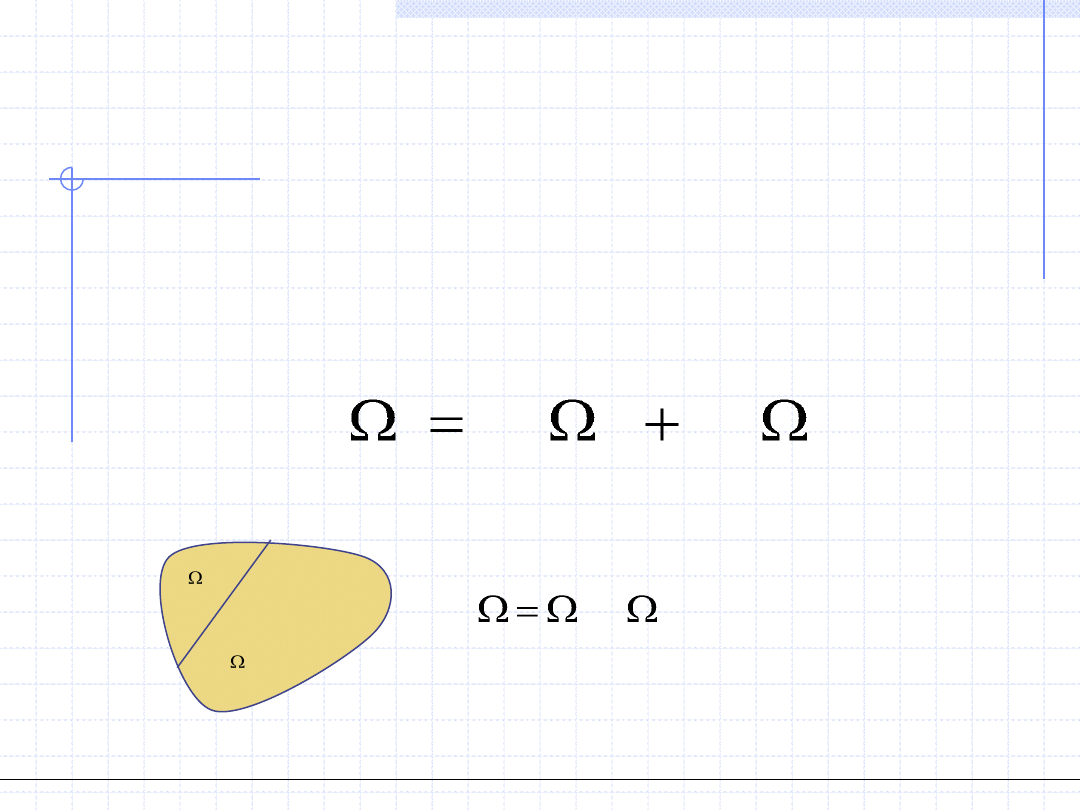
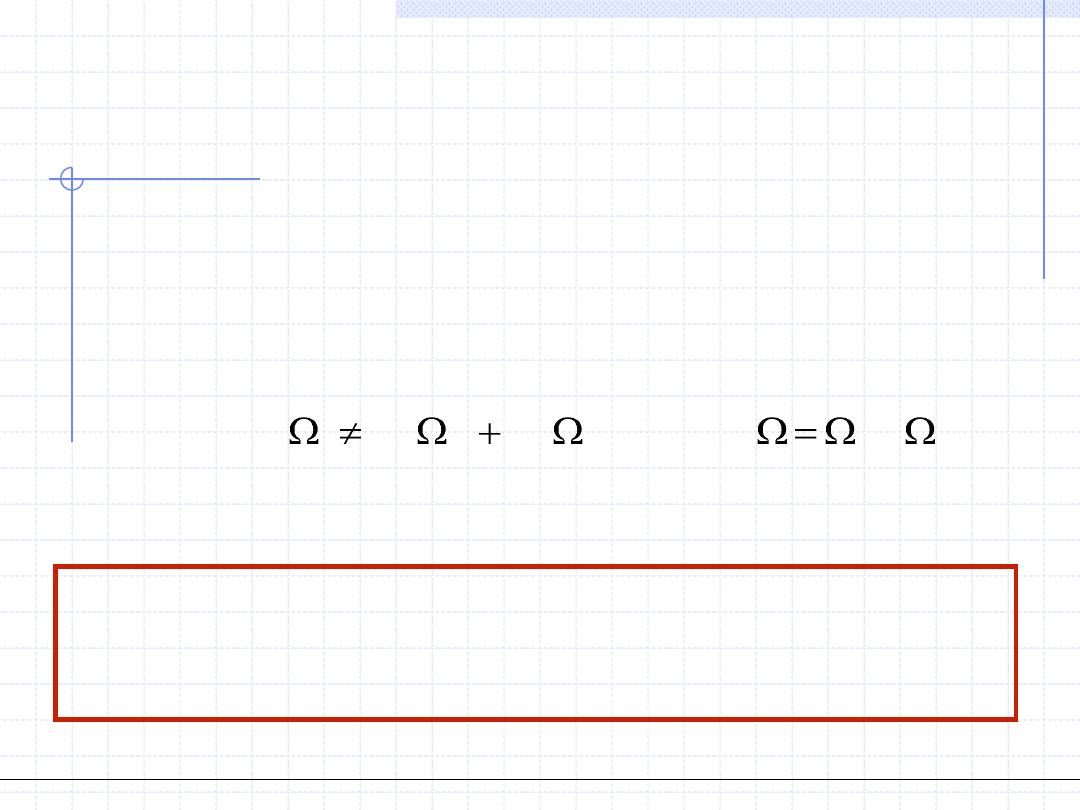
Wielkości termodynamiczne (zarówno parametry stanu jak i wielkości
opisujące przemiany) dzielą się na dwie ważne grupy:
• Wielkości ekstensywne – wielkości X spełniające następujące własności:
1 - są określone na zbiorach przestrzennych
2 - są addytywne (bilansowalne) tzn. spełniają relację
2
1
1
2
©
Prof. Antoni Kozioł, Wydział Chemiczny Politechniki Wrocławskiej, 2010/2011
13
WIELKOŚCI EKSTENSYWNE I
INTENSYWNE
)
(
)
(
)
(
2
1
X
X
X
Wielkości intensywne – wielkości x spełniające następujące własności:
1 - są określone dla punktów przestrzennych (w przypadku zbiorów
przestrzennych oznaczają wartości średnie)
2 - nie są addytywne (bilansowalne) tzn.:
2
1
Iloraz dwu wielkości ekstensywnych zawsze jest
wielkością intensywną !
©
Prof. Antoni Kozioł, Wydział Chemiczny Politechniki Wrocławskiej, 2010/2011
14
WIELKOŚCI MIERZALNE I
KONCEPTUALNE
Inny podział wielkości termodynamiczny wiąże się z możliwością
ich eksperymentalnego pomiaru. Zgodnie z tym podziałem mamy
wielkości mierzalne i konceptualne.
Wielkości mierzalne to takie, które możemy bezpośrednio z odpo-
wiednią dokładnością zmierzyć za pomącą odpowiednich przyrządów
pomiarowych. Mierzalne są np. temperatura, ciśnienie i objętość.
Wielkości konceptualne to takie dla których określenia konieczna
jest pewna procedura zawierająca różne założenia i konwencje.
Konceptualne są takie wielkości jak energia wewnętrzna, entalpia
czy entropia.
©
Prof. Antoni Kozioł, Wydział Chemiczny Politechniki Wrocławskiej, 2010/2011
15
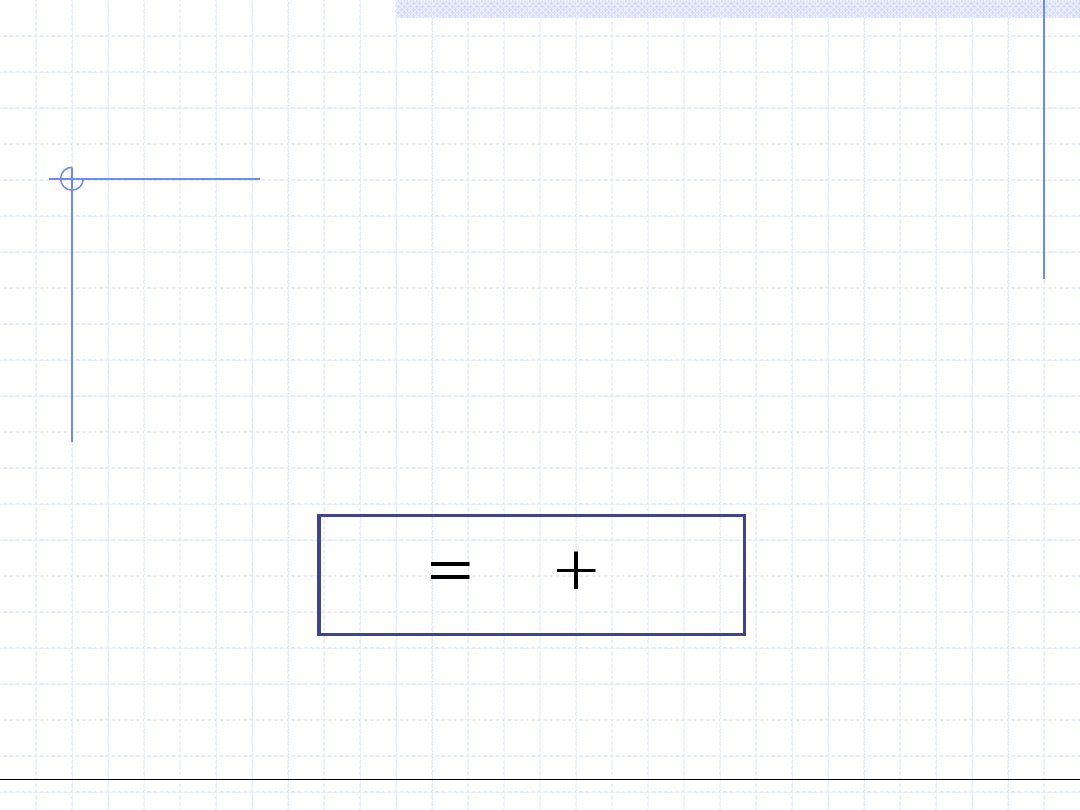
PARAMETRY STANU
1. Temperatura – T, [K] – parametr intensywny
Temperatura jest to podstawowy parametr stanu określający zdolność układu
do przekazywania ciepła czyli energii chaotycznego ruchu cząsteczek.
2. Ciśnienie – p, [Pa] – parametr intensywny
Ciśnienie jest to drugi podstawowy parametr stanu określający zdolność układu
do wykonywania pracy tzn. do przekazywania energii na sposób mechaniczny.
3. Objętość – V, [m
3
] – parametr ekstensywny
Objętość układu jest określona przez objętość przestrzeni zajmowanej przez układ.
©
Prof. Antoni Kozioł, Wydział Chemiczny Politechniki Wrocławskiej, 2010/2011
16
PARAMETRY STANU
4. Energia wewnętrzna – U, [J] – parametr ekstensywny
Energia wewnętrzna jest to całkowita energia zawarta w układzie pomniejszona
o jego energię kinetyczną związaną z ruchem i potencjalną związaną z położeniem.
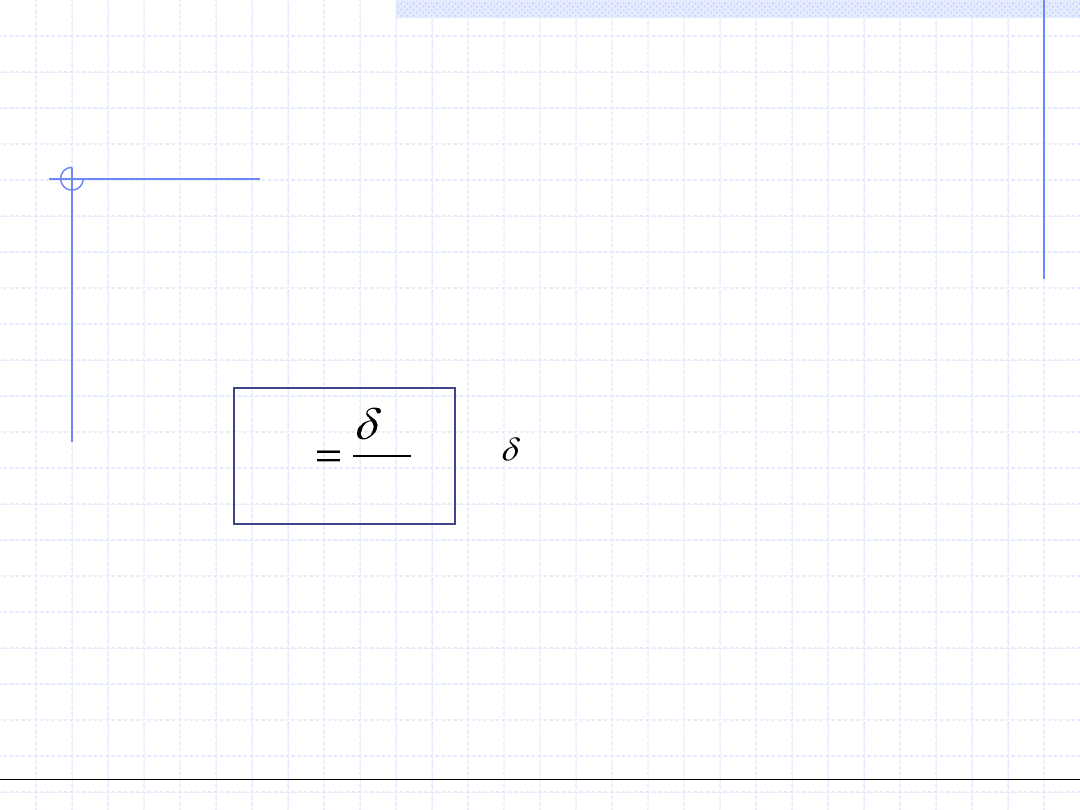
5. Entalpia – H, [J] – parametr ekstensywny
Entalpia jest pomocniczą wielkością energetyczną układu zaproponowaną przez
Gibbsa, której definicja jest następująca:
pV
U
H
©
Prof. Antoni Kozioł, Wydział Chemiczny Politechniki Wrocławskiej, 2010/2011
17
PARAMETRY STANU cd.
T
Q
dS
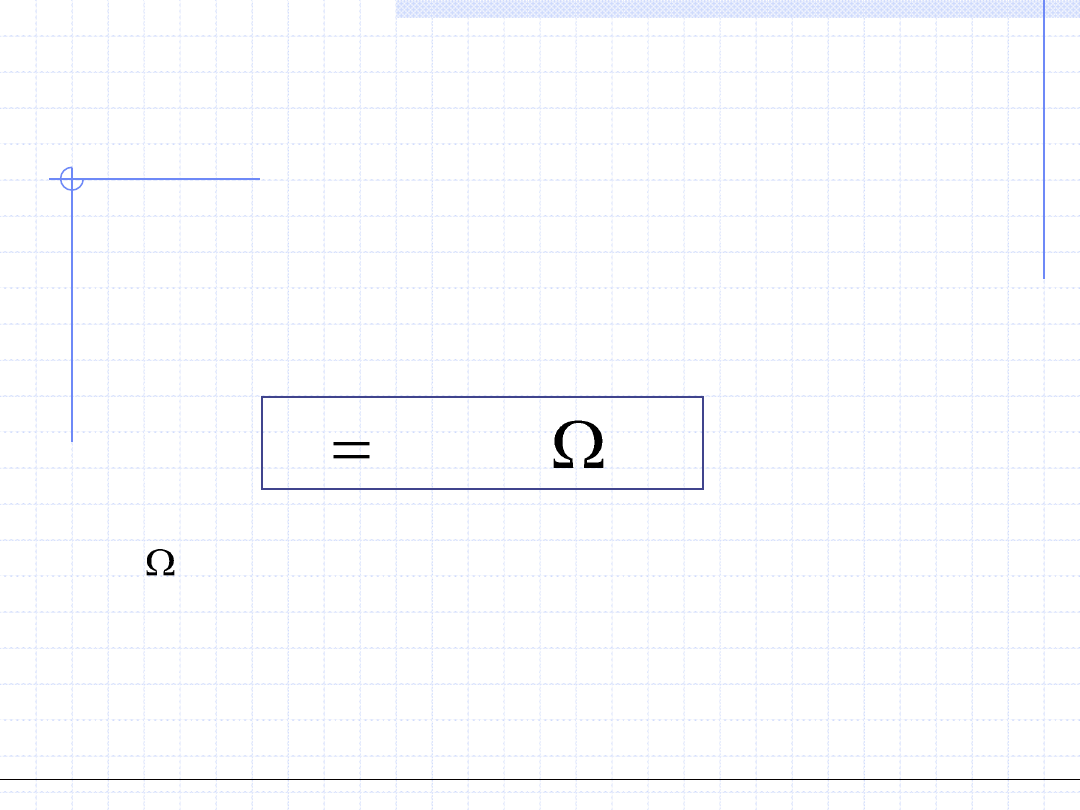
6. Entropia – S, [J/K] – parametr ekstensywny
Entropia jest to fundamentalny parametr termodynamiczny wprowadzony
przez Clausiusa. Entropia ma dwie interpretacje.
Klasyczna definicja Clausiusa określa zmianę entropii w różniczkowej
przemianie odwracalnej:
Q
- elementarne ciepło wymienione podczas
przemiany różniczkowej
©
Prof. Antoni Kozioł, Wydział Chemiczny Politechniki Wrocławskiej, 2010/2011
18
PARAMETRY STANU cd.
Druga definicja entropii zaproponowana przez Boltzmana wiąże się ze
statystycznym rozkładem poziomów energetycznych cząstek zawartych
w układzie. Popularnie, aczkolwiek nie całkiem ściśle, entropia jest określana
jako miara nieuporządkowania (chaosu) w układzie
.
)
ln(
E
nR
S
- liczba dostępnych mikrostanów na które może się rozkładać
energia wewnętrzna układu
E
©
Prof. Antoni Kozioł, Wydział Chemiczny Politechniki Wrocławskiej, 2010/2011
19
PARAMETRY STANU cd.
TS
U
A
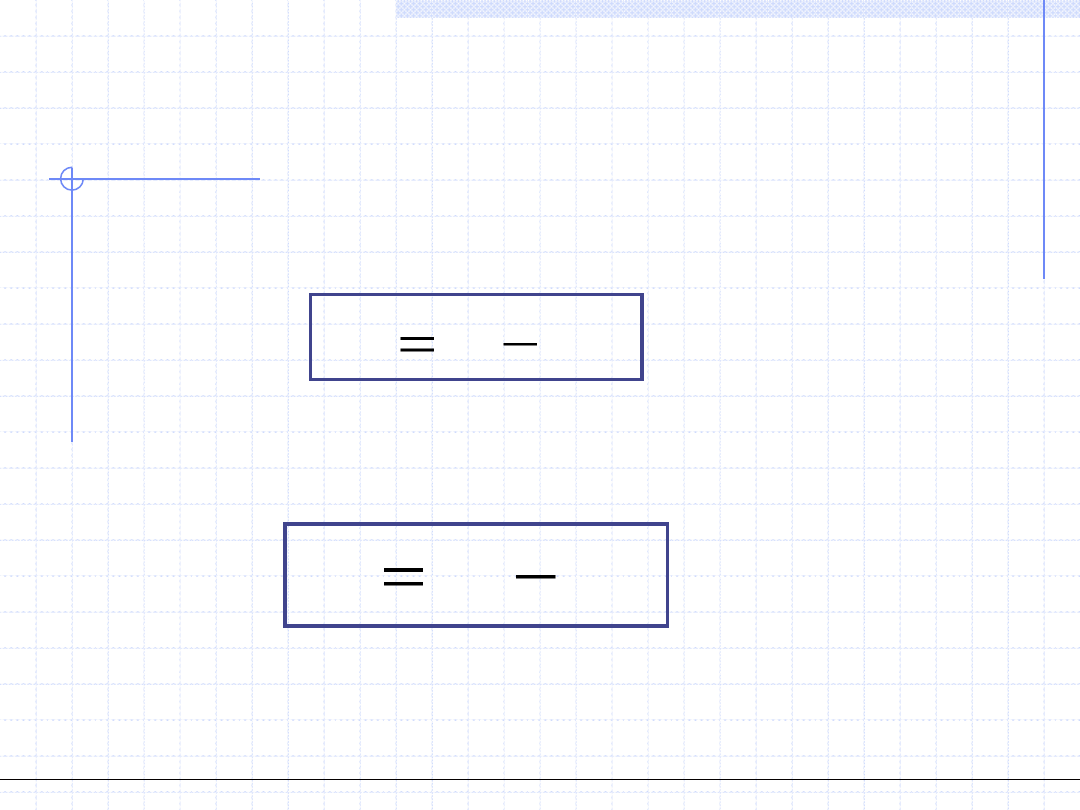
7. Energia swobodna – A, [J] – parametr ekstensywny
Energia swobodna, nazywana też energią Helmholza jest to pochodna wielkość
energetyczna określona wzorem:
8. Entalpia swobodna – G, [J] – parametr ekstensywny
Entalpia swobodna, nazywana też energią Gibbsa jest to pochodna wielkość
energetyczna określona wzorem:
TS
H
G
©
Prof. Antoni Kozioł, Wydział Chemiczny Politechniki Wrocławskiej, 2010/2011
20
PARAMETRY PRZEMIANY
Przemianę termodynamiczną opisują:
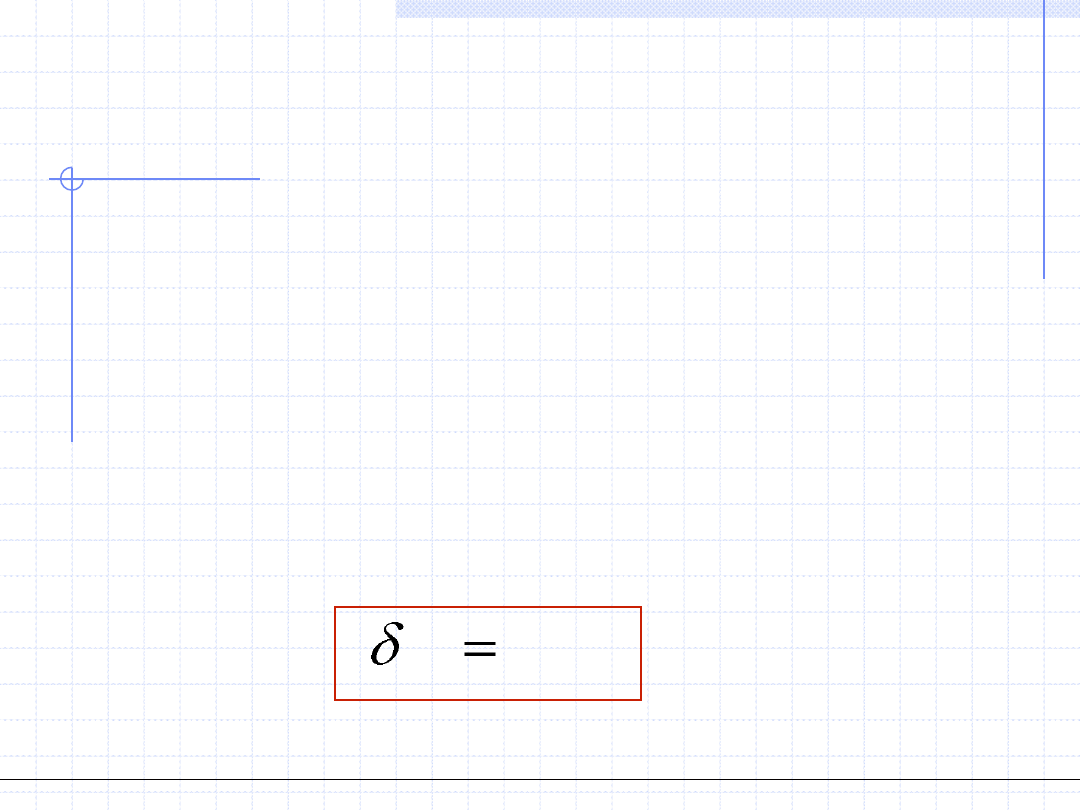
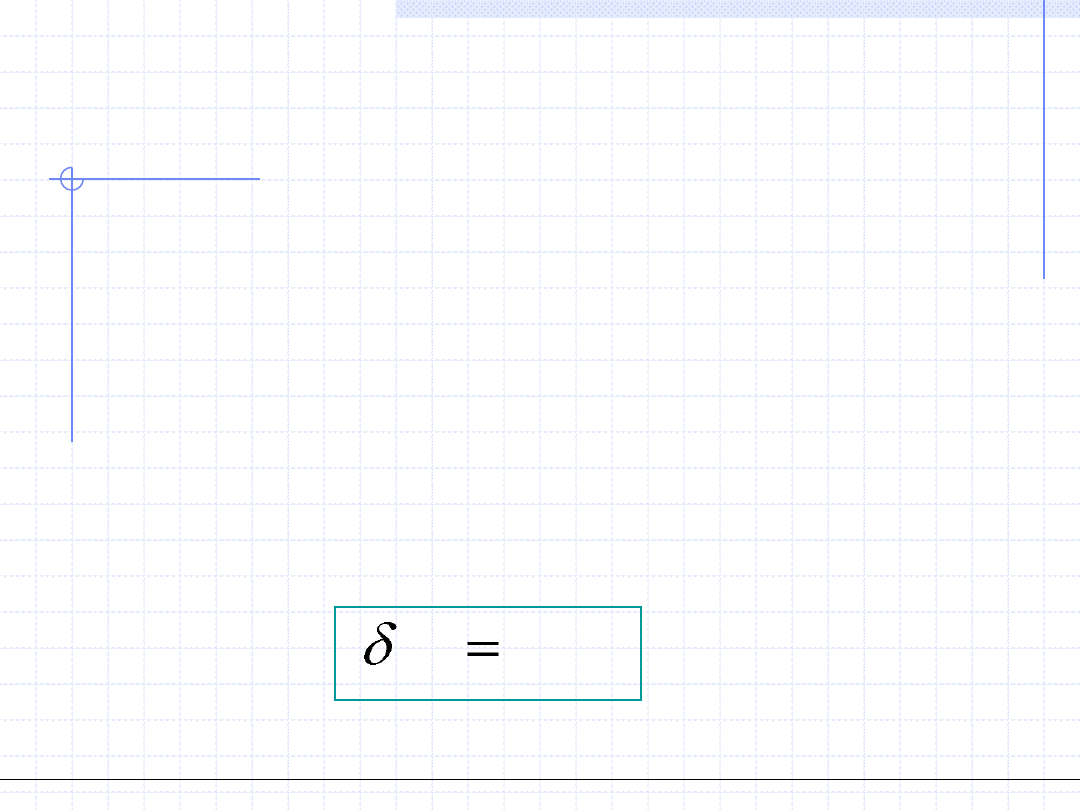
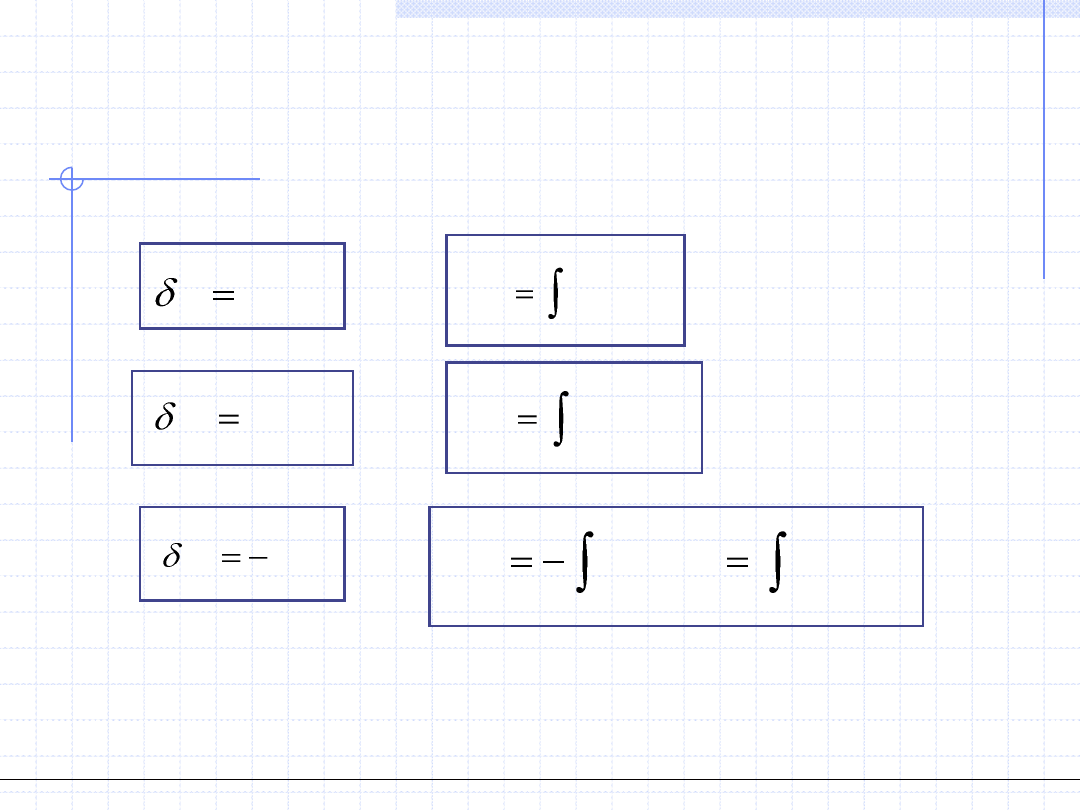
1. Ciepło przemiany – Q, [J] – wielkość ekstensywna.
Ciepło przemiany jest to wymieniona między układem a otoczeniem ilość
energii chaotycznego (termicznego) ruchu cząstek. Dla przemiany różniczkowej
ilość tę oznaczamy przez δQ. Powszechnie przyjęta konwencja określa ciepło
dostarczone do układu jako dodatnie.
Ilościowo ciepło przemiany można określić jeżeli znana jest tzw. pojemność
cieplna układu oznaczana jako C. Dla przemiany różniczkowej mamy:
Q
CdT
©
Prof. Antoni Kozioł, Wydział Chemiczny Politechniki Wrocławskiej, 2010/2011
21
PARAMETRY PRZEMIANY
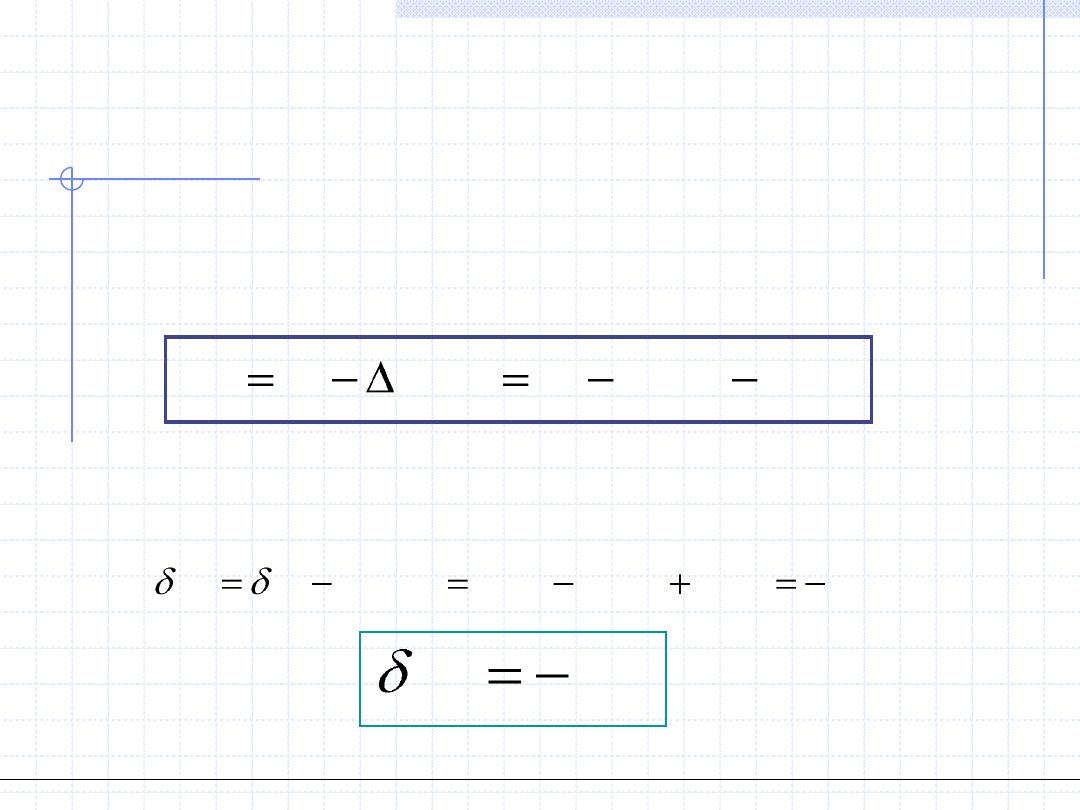
2. Praca przemiany – W, [J] – wielkość ekstensywna.
Praca przemiany jest to wymieniona między układem a otoczeniem ilość energii
mechanicznej związanej z uporządkowanym ruchem pewnej części układu. Dla
przemiany różniczkowej ilość tę oznaczamy przez δW. Istnieją dwie konwencje
określające znak pracy. W termodynamice technicznej za dodatnią uważa się
pracę wykonaną przez układ na otoczeniu. Przy pracy dodatniej w takiej umowie
energię traci układ a zyskuje otoczenie. W termodynamice chemicznej oraz
w chemii fizycznej konwencja jest odwrotna. Za dodatnią uważa się tam pracę
wykonaną przez otoczenie
na
układzie. Ja w dalszym układzie będę stosował
konwencję pierwszą.
Praca przemiany jest ściśle związana z objętością układu V i temperaturą T.
Dla przemiany różniczkowej obowiązuje prosty wzór:
W
pdV
©
Prof. Antoni Kozioł, Wydział Chemiczny Politechniki Wrocławskiej, 2010/2011
22
PARAMETRY PRZEMIANY cd.
)
(
)
(
1
1
2
2
V
p
V
p
W
pV
W
W
t
(
)
(
)
t
W
W
d pV
pdV
pdV
Vdp
Vdp
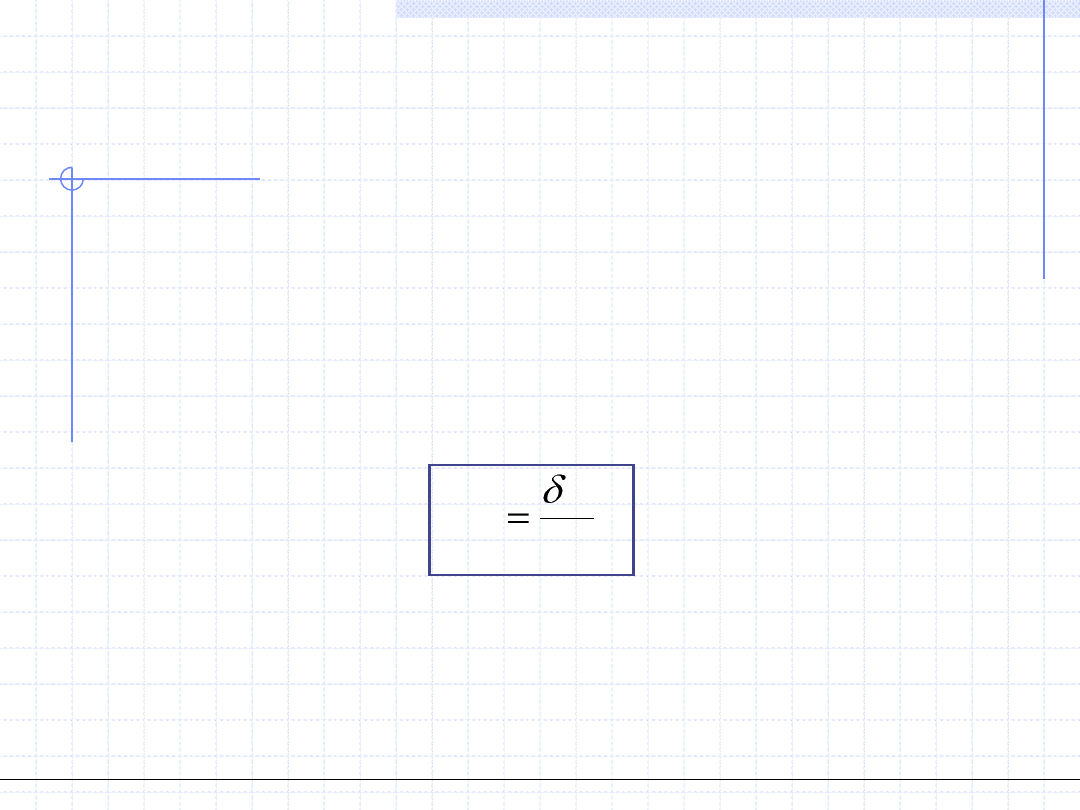
3. Praca techniczna – W
t
, [J] – wielkość ekstensywna.
Praca techniczna jest pomocniczą wielkością opisującą przemianę termodynamiczną
określoną za pomocą wzoru
Dla przemiany różniczkowej powyższy wzór przybiera postać:
t
W
Vdp
©
Prof. Antoni Kozioł, Wydział Chemiczny Politechniki Wrocławskiej, 2010/2011
23
PARAMETRY PRZEMIANY cd.
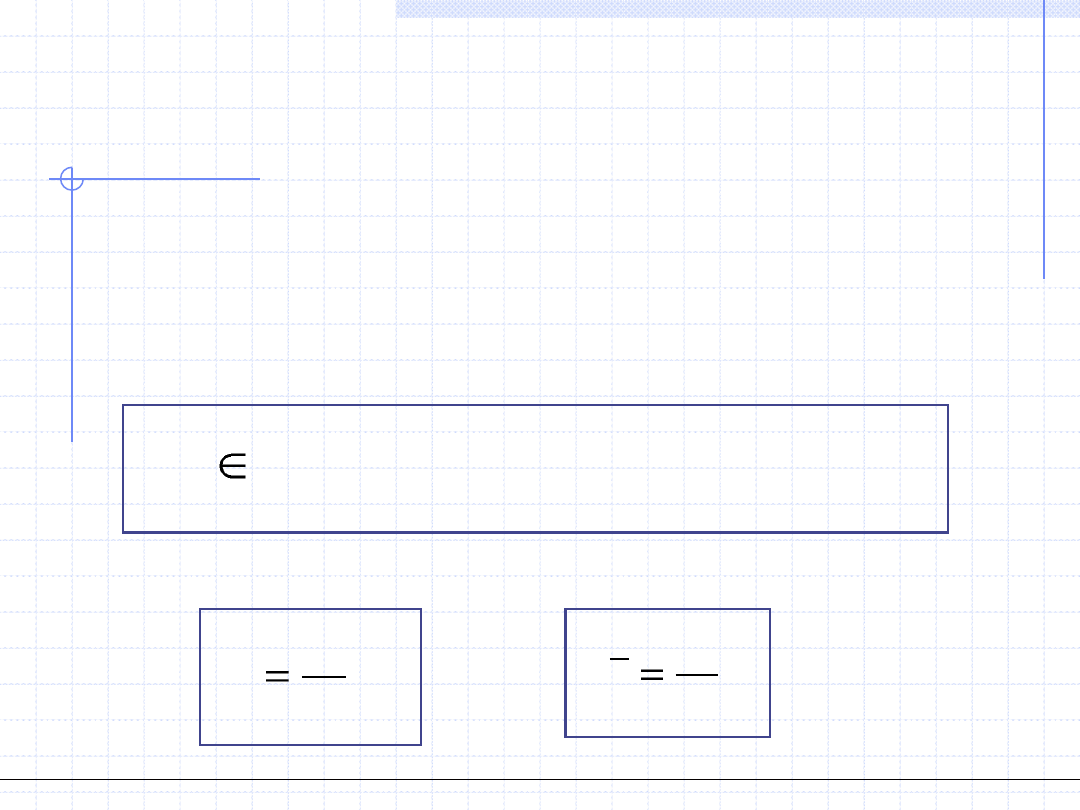
4. Pojemność cieplna układu podczas przemiany – C, [J/K]
Pojemność cieplna układu podczas przemiany jest ściśle zdefiniowana tylko dla
przemian różniczkowych. Zakładając, że w danej przemianie wymienione ciepło
wynosi δQ a przyrost temperatury dT, pojemność cieplną określa się jako:
dT
Q
C
©
Prof. Antoni Kozioł, Wydział Chemiczny Politechniki Wrocławskiej, 2010/2011
24
WŁAŚCIWE PARAMETRY STANU I
PRZEMIANY
}
,
,
,
,
,
,
,
,
,
{
C
W
W
Q
G
A
S
H
U
V
X
t
n
X
x
Dla układów zamkniętych często zamiast ekstensywnych parametrów
stanu i parametrów przemiany stosuje się intensywne tzw. wielkości
właściwe.
Istnieją dwa rodzaje wielkości właściwych – masowe i molowe.
Niech duża litera X oznacza jeden z ekstensywnych parametrów stanu
lub parametrów przemiany:
Odpowiednie intensywne wielkości właściwe są określone wzorami:
m
X
x
©
Prof. Antoni Kozioł, Wydział Chemiczny Politechniki Wrocławskiej, 2010/2011
25
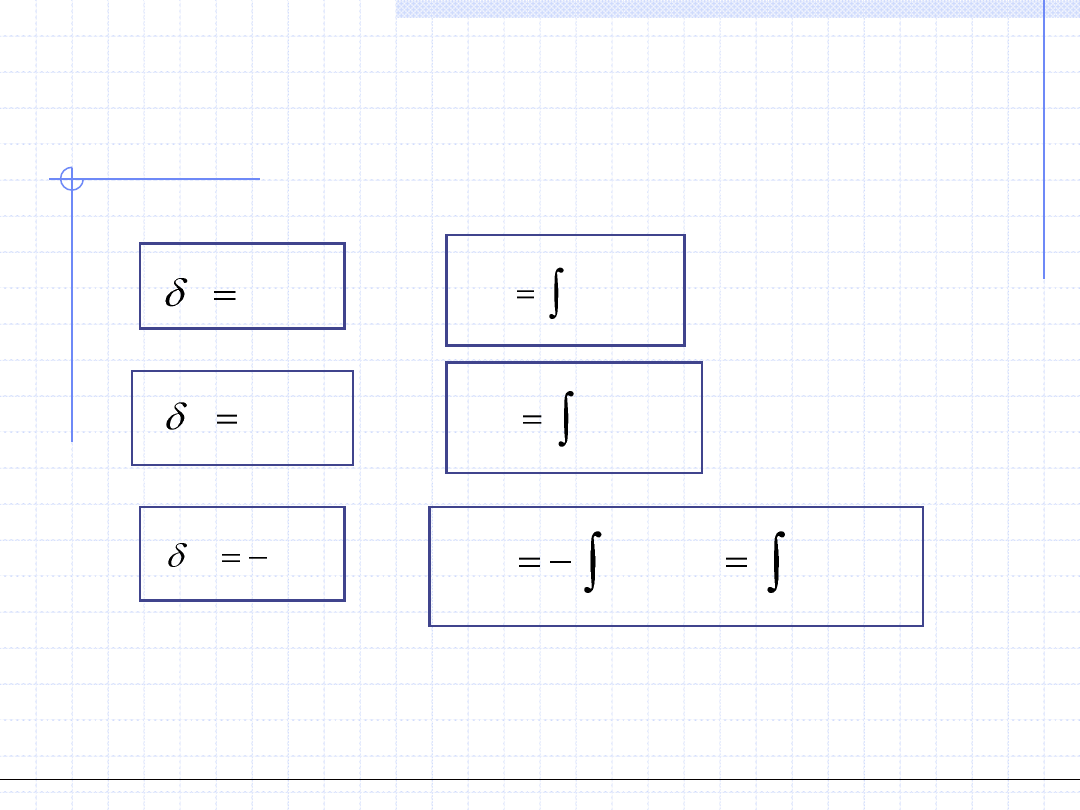
PODSTAWOWE WZORY OKREŚLAJĄCE CIEPŁO,
PRACĘ I PRACĘ TECHNICZNĄ W PRZEMIANACH
RÓŻNICZKOWYCH I CAŁKOWYCH
CdT
Q
2
1
)
(
T
T
dT
T
C
Q
pdV
W
Powyższe definicje oraz proste rozważania prowadzą do następujących wzorów:
2
1
)
(
V
V
dV
V
p
W
Vdp
W
t
1
2
2
1
)
(
)
(
p
p
p
p
t
dp
p
V
dp
p
V
W
Analogiczne wzory obowiązują dla odpowiednich parametrów właściwych:
©
Prof. Antoni Kozioł, Wydział Chemiczny Politechniki Wrocławskiej, 2010/2011
26
PODSTAWOWE WZORY OKREŚLAJĄCE CIEPŁO,
PRACĘ I PRACĘ TECHNICZNĄ W PRZEMIANACH
RÓŻNICZKOWYCH I CAŁKOWYCH
cdT
q
2
1
)
(
T
T
dT
T
c
q
pdv
w
2
1
)
(
v
v
dv
v
p
w
vdp
w
t
1
2
2
1
)
(
)
(
p
p
p
p
t
dp
p
v
dp
p
v
w
W celu zastosowania wzorów całkowych konieczna jest znajomość odpowiednich funkcji.
©
Prof. Antoni Kozioł, Wydział Chemiczny Politechniki Wrocławskiej, 2010/2011
27
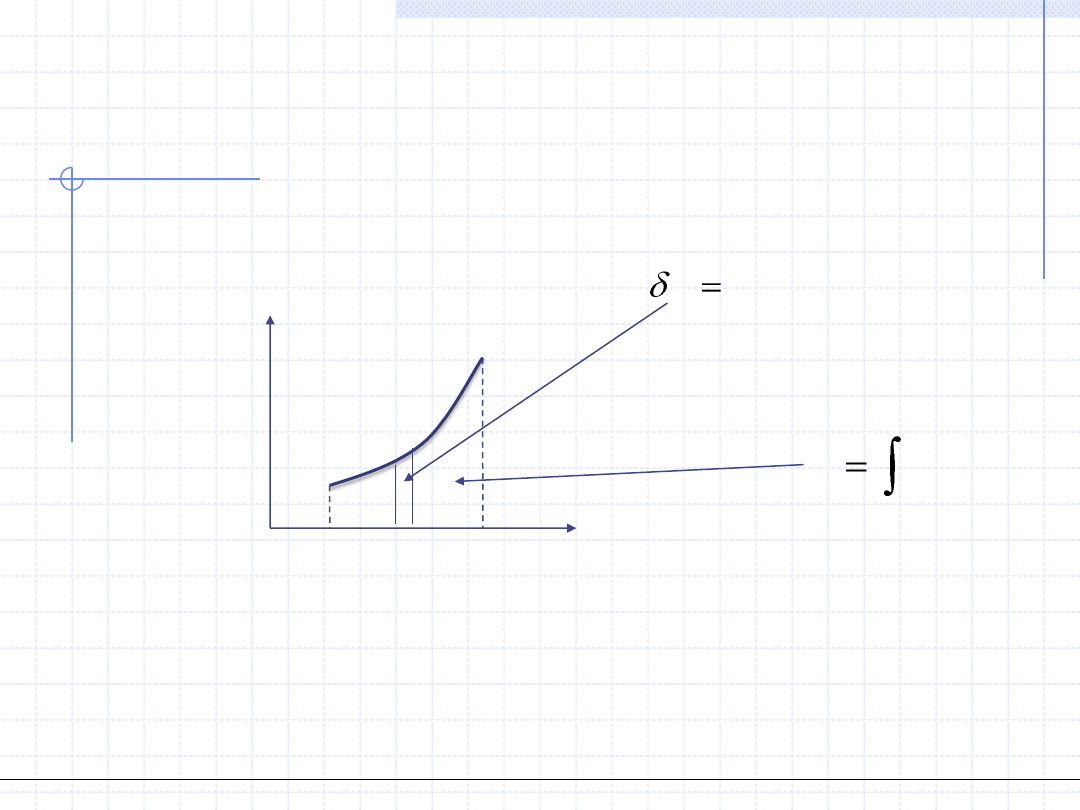
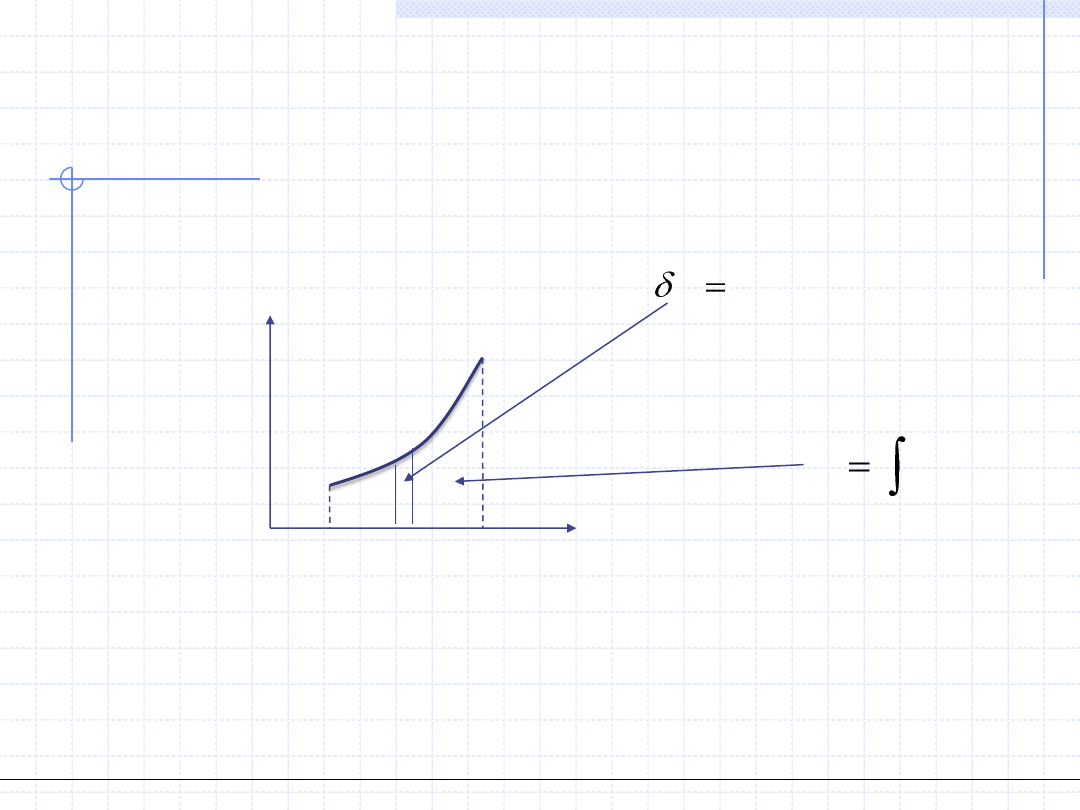
WYKREŚLNA ILUSTRACJA CIEPŁA
2
1
)
(
T
T
dT
T
C
Q
Wzory całkowe mają prostą interpretację graficzną:
T
T
1
C
T
2
dT
CdT
Q
Ciepło przemiany jest równoważne polu pod krzywą zależności pojemności
cieplnej od temperatury.
©
Prof. Antoni Kozioł, Wydział Chemiczny Politechniki Wrocławskiej, 2010/2011
28
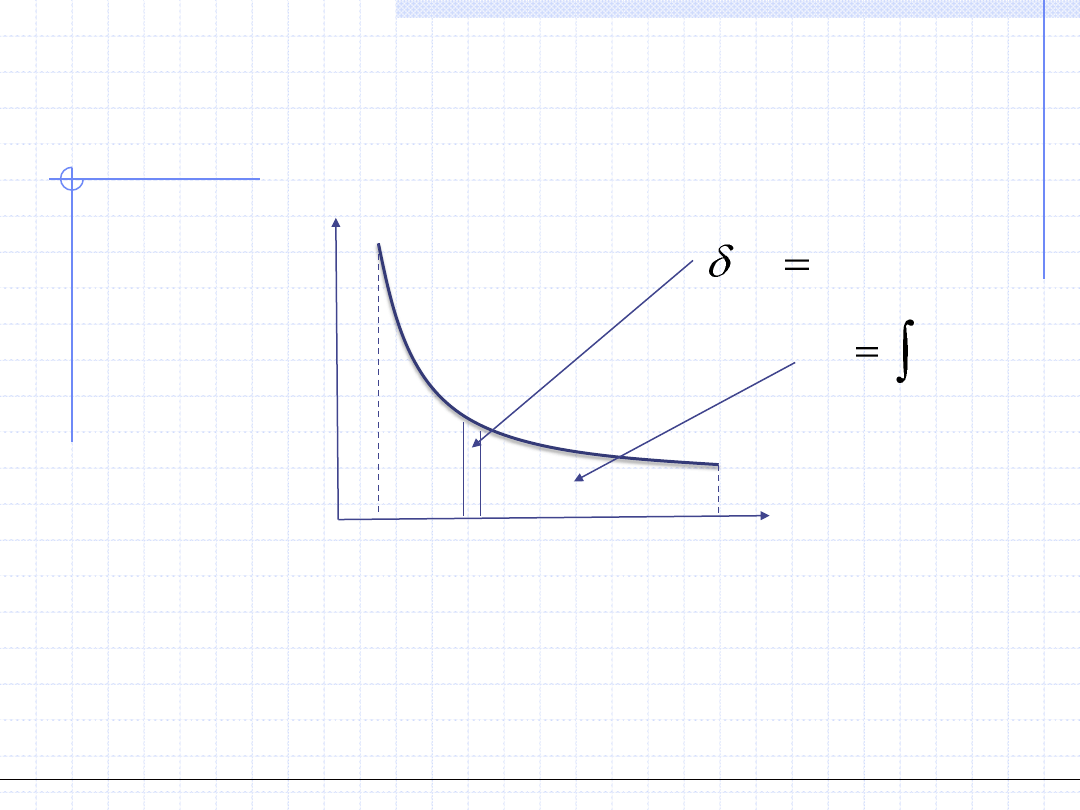
WYKREŚLNA ILUSTRACJA CIEPŁA
2
1
)
(
S
S
dS
S
T
Q
Druga interpretacja graficzna ciepła przemiany wynika z
klasycznej definicji entropii:
S
S
1
T
S
2
dS
TdS
Q
Ciepło przemiany jest równoważne polu pod krzywą zależności temperatury
od entropii.
©
Prof. Antoni Kozioł, Wydział Chemiczny Politechniki Wrocławskiej, 2010/2011
29
WYKREŚLNA ILUSTRACJA PRACY
2
1
)
(
v
v
dV
V
p
W
p
V
V
1
V
2
dV
pdV
W
Praca przemiany jest równoważna polu pod krzywą zależności ciśnienia
od objętości.
©
Prof. Antoni Kozioł, Wydział Chemiczny Politechniki Wrocławskiej, 2010/2011
30
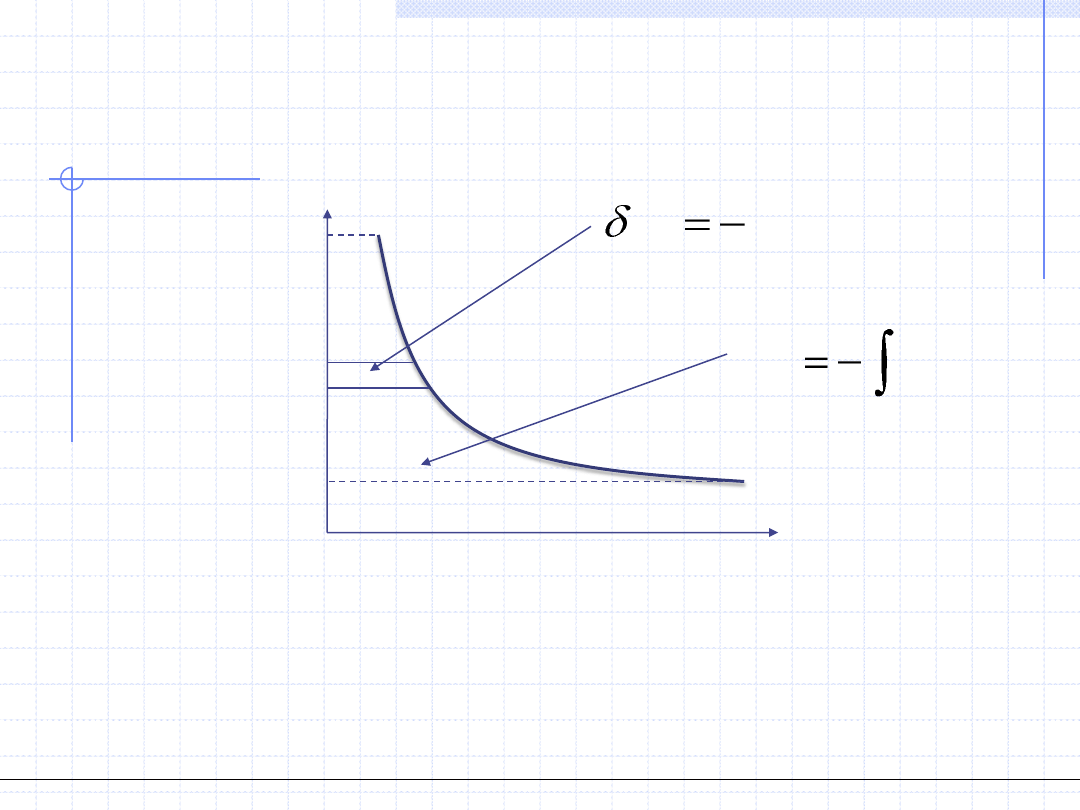
WYKREŚLNA ILUSTRACJA PRACY
TECHNICZNEJ
p
V
p
1
p
2
2
1
)
(
p
p
t
dp
p
V
W
-dp
Vdp
W
t
Praca techniczna przemiany jest równoważna polu między krzywą zależności
ciśnienia od objętości a osią ciśnienia.
©
Prof. Antoni Kozioł, Wydział Chemiczny Politechniki Wrocławskiej, 2010/2011
31
To na dzisiaj tyle.
Dziękuję bardzo Państwu za uwagę.
Wyszukiwarka
Podobne podstrony:
Ogolnotech dla Bio I WYKLAD IV
Ogolnotech dla Bio WYKLAD VI
Ogolnotech(dla Bio I) WYKLAD I
Ogolnotech(dla Bio I) WYKLAD V
Ogolnotech dla Bio I WYKLAD III
Ogolnotech dla Bio I WYKLAD IV
Ogolnotech dla Bio Ir WYKLAD IX
Ogolnotech(dla Bio Ir) WYKLAD X
Ogolnotech(dla Bio Ir) WYKLAD XI
Ogolnotech dla Bio IV WYKLAD VII
Ogolnotech(dla Bio I) W VI
Ogolnotech(dla Bio I) W X
Wykład IX dla stud, Wykład IX
więcej podobnych podstron