
PODSTAWY CHEMII
kierunek: BIOLOGIA
rok: I
rodzaj zajęć: laboratorium
Zajęcia laboratoryjne odbywają się zgodnie z planem i obejmują 10 spotkań trwających 2h 15min (3 godziny dydaktyczne)
Realizowane bloki tematyczne
Analiza jakościowa
1. Analiza kationów - reakcje charakterystyczne dla wybranych kationów i ich wykrywanie w
mieszaninie.
2. Analiza anionów - reakcje charakterystyczne dla wybranych anionów i ich wykrywanie w
mieszaninie.
Analiza ilościowa
3. Alkacymetria – oznaczanie węglanu sodu
4. Alkacymetria – oznaczanie kwasu octowego
5. Manganometria - oznaczanie żelaza (Fe
2+
)
6. Jodometria – oznaczanie miedzi (Cu
2+
)
7. Bufory
8. Kolorymetria – oznaczanie żelaza (Fe
2+
)
Ćwiczenia są szczegółowo opisane w skrypcie:
Zofia Szponar, Tomasz Pluciński, „Obliczenia z chemii ogólnej i analitycznej dla biologów”, Wydawnictwo UG,
Gdańsk 1999 (starsze wydania nie zawierają opisu wszystkich ćwiczeń)
ANALIZA KATIONÓW
Analiza kationów ograniczona jest do wybranych kationów z grupy analitycznej (wg podziału
Freseniusa) IV i V: Ba
2+
, Ca
2+
(IV grupa) i Mg
2+
, K
+
, NH
4
+
(V grupa).
Przed przystąpieniem do właściwej analizy jakościowej (wykrywania w mieszaninie) tych
kationów, należy zapoznać się z ich reakcjami charakterystycznymi.
I. Wykonanie reakcji charakterystycznych dla wybranych kationów
Przeprowadź reakcje charakterystyczne dla poszczególnych kationów stosując odczynniki
przedstawione w tabeli. Obserwuj zachodzące zmiany. Zapisz dokonane obserwacje i przedstaw
równania zachodzących reakcji chemicznych.
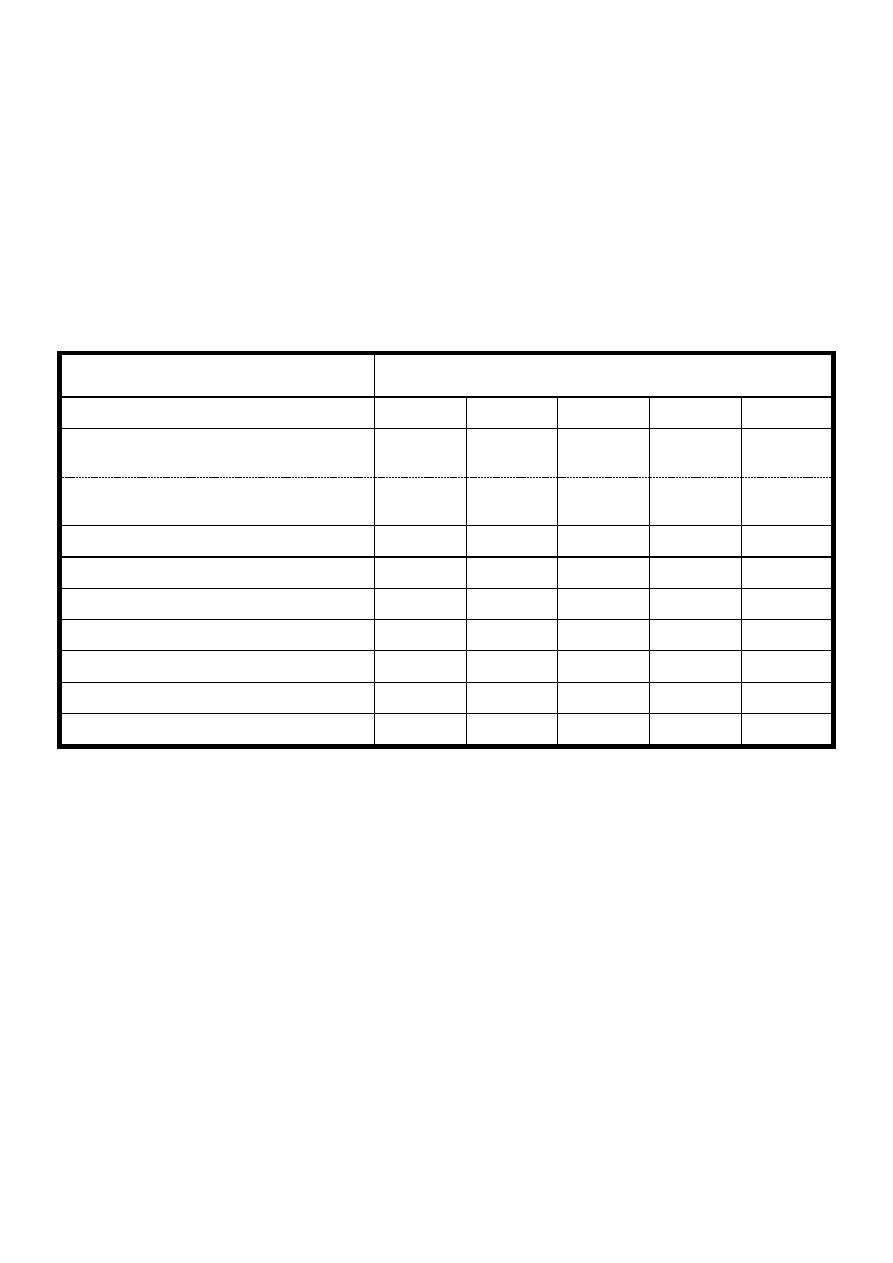
Kationy
odczynnik
Ba
2+
Ca
2+
Mg
2+
K
+
NH
4
+
(NH
4
)
2
CO
3
+ NH
4
Cl + NH
3
(odczynnik grupowy IV grupy analitycznej)
X
X
X
X
X
powstałe osady + 2M CH
3
COOH
X
X
K
2
CrO
4
X
X
NaOH
X
X
X
X
Na
2
HPO
4
X
X
X
Na
3
Co(NO
2
)
6
X
X
barwienie płomienia
X
X
X
NaClO
4
X
X
magnezon
X
Ogólne zasady przeprowadzania reakcji charakterystycznej:
Do probówki zawierającej 1 cm
3
roztworu soli zawierającej badany kation dodajemy kroplami
roztworu wskazanego odczynnika. Obserwujemy zachodzące zmiany.
Sporządzanie odczynnika grupowego IV grupy:
Zmieszaj 5 objętości roztworu węglanu amonu z 1 objętością chlorku amonu. Dodaj kilka kropel
amoniaku. Sprawdź, czy sporządzony przez Ciebie roztwór jest właściwy. W tym celu odlej 1 cm
3
odczynnika i dodaj do niego kilka kropel roztworu chlorku magnezu. Jeśli NIE POJAWI się
zmętnienie bądź osad odczynnik jest wykonany PRAWIDŁOWO.
Wykonanie próby barwienia płomienia:
Zanurz platynowy drucik umieszczony w oprawce w roztworze stężonego kwasu solnego, a
następnie wyprażaj w płomieniu przez kilka chwil. Czynność powtarzaj tak długo, aż płomień
będzie bezbarwny. Następnie zanurz drucik w badanej próbce i umieść go płomieniu. Obserwuj
barwę płomienia.
Wykrywanie magnezu za pomocą magnezonu:
Do 1 cm
3
roztworu zawierającego jony magnezu dodać kilka (2 – 5) kropli roztworu magnezonu
(unikać nadmiaru). Następnie roztwór należy zalkalizować (dodać roztworu wodorotlenku sodu). W
obecności dużej ilości jonów magnezu powstaje niebieski osad.
II. Wykrywanie kationów w próbce
Na podstawie znajomości efektów przeprowadzonych w części I reakcji należy zidentyfikować
zawarte w mieszaninie kationy.
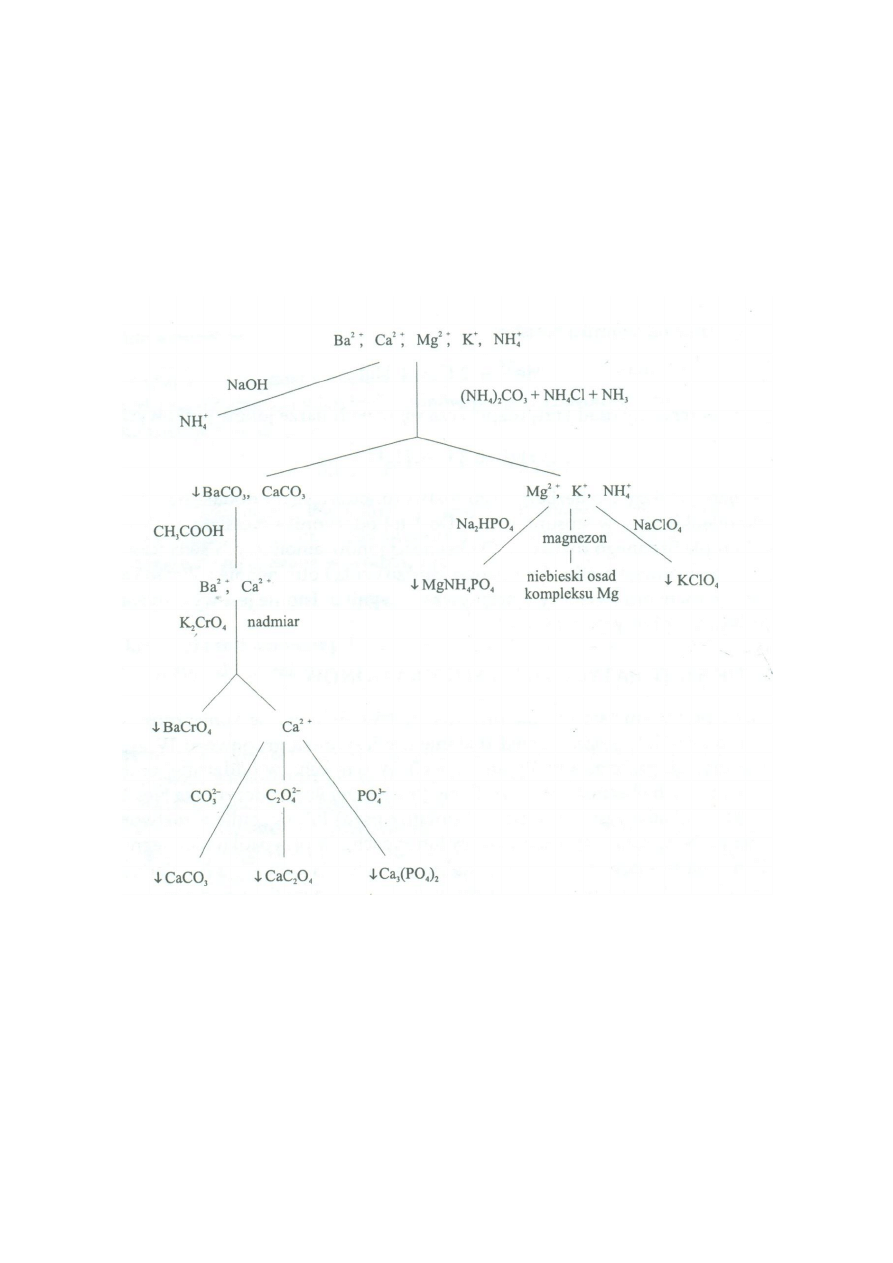
Schemat przedstawiający tok analizy kationów:
Tok analizy składa się z następujących etapów (przedstawionych graficznie na schemacie):
1. Identyfikacja jonu amonowego
Próbę wykonujemy w oddzielnej probówce. Po dodaniu roztworu mocnego wodorotlenku (np.
NaOH) i ogrzaniu roztworu do wrzenia wydziela się amoniak o charakterystycznym zapachu.
Zawartość probówki wąchamy kierując powietrze ręką w kierunku nozdrzy (nie wąchamy
bezpośrednio!).
2. Reakcja z odczynnikiem grupowym IV grupy analitycznej.

Do kilku cm
3
badanej próbki dodajemy taką samą objętość odczynnika. Dokładnie mieszamy.
Jeśli pojawia się osad probówkę można wstawić do łaźni wodnej (zlewka z gotującą się wodą)
na kilka minut, aby ułatwić tworzenie się gruboziarnistego osadu.
Otrzymaną zawiesinę rozdzielamy poprzez wirowanie.
Po odwirowaniu należy sprawdzić, czy wszystkie jony wapnia i/lub baru zostały wytrącone. W
tym celu do klarownego roztworu znajdującego się nad osadem dodajemy kilka kropel
odczynnika grupowego. W razie pojawienia się zmętnienia należy dodać jeszcze kilka kropel
odczynnika, wymieszać i odwirować. Czynności związane ze sprawdzaniem całkowitości
wytrącania powtarzamy tak długo, aż osad przestanie się wytrącać.
3. Oddzielenie powstałego osadu od przesączu.
Dekantujemy ciecz z nad osadu. Dokonujemy analiz rozdzielonych części (przesączu i osadu).
4. Rozpuszczenie osadu
Do osadu dodajemy kwasu octowego (rozpuszczamy osad). Podczas tej czynności dokładnie
mieszamy zawartość probówki, aby uniknąć dodania nadmiaru tego kwasu, który utrudnia dalszą
analizę. Po otrzymaniu klarownego roztworu przeprowadzamy reakcje charakterystyczne dla
jonów: baru i wapnia (np. prowadzimy reakcję z chromianem(VI) potasu, powstający osad
odwirowujemy, sprawdzamy całkowitość wytrącenia, oddzielamy od przesączu. W przesączu
sprawdzamy obecność jonów wapnia).
5. Badanie przesączu (pozostałego po oddzieleniu jonów wapnia i baru) na obecność pozostałych
jonów: magnezu i potasu.
Jeśli w badanej mieszaninie nie występuje jon amonowy można wykorzystać do wykrywania jonu
potasowego reakcję z Na
3
Co(NO
2
)
6
(heksaazotynokobaltanem sodu).
Podczas wykrywania jonów magnezu za pomocą wodorofosforanu(V) sodu należy pamiętać, że
podobną reakcję dają jony wapnia oraz baru. Jeśli nie zostały one starannie oddzielone za pomocą
odczynnika grupowego próba będzie dawała fałszywe wyniki.
Mocne wodorotlenki z roztworu zawierającego sól magnezu wytrącają biały osad wodorotlenku
magnezu. Osad ten jednak nie powstanie gdy w roztworze znajdują się jony amonowe i amoniak
(pochodzące od odczynnika grupowego).
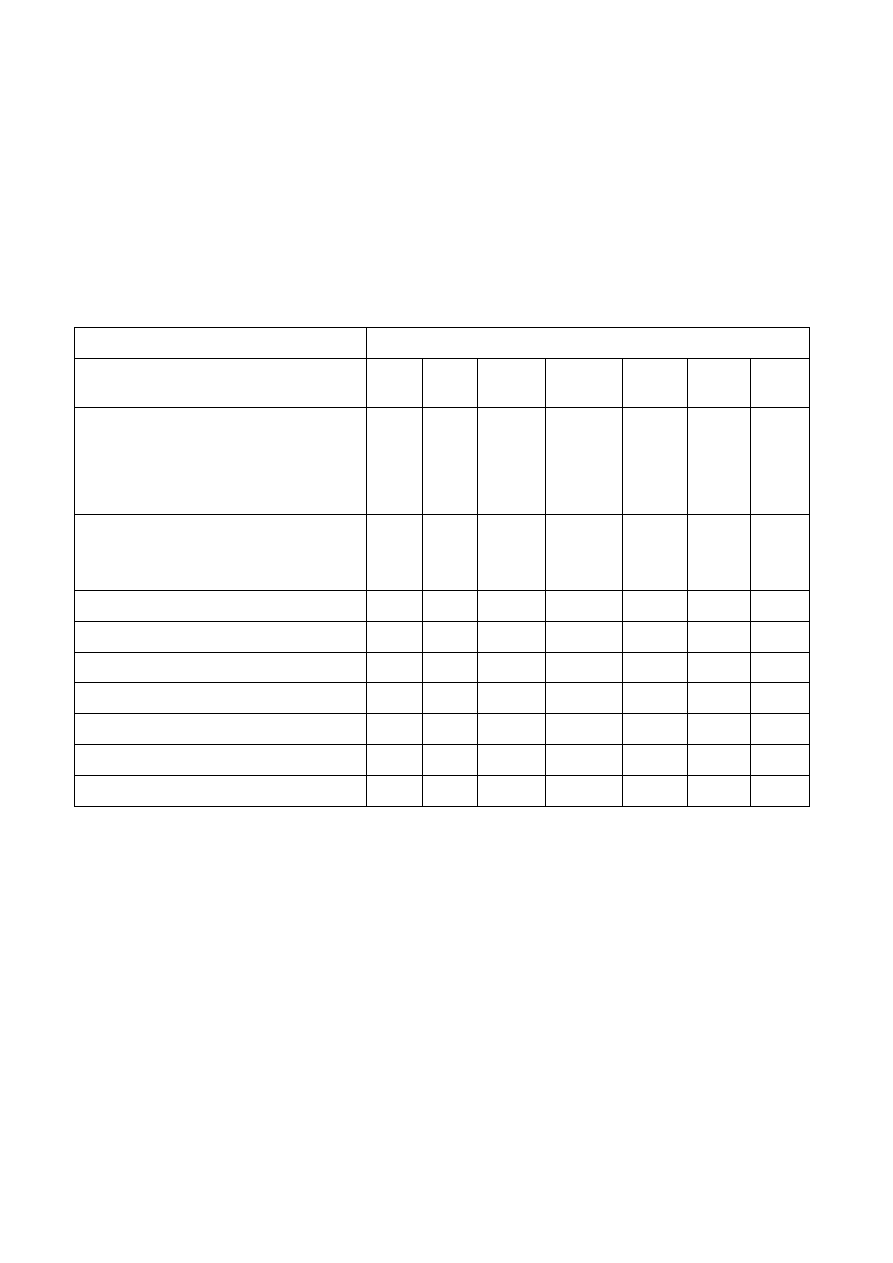
ANALIZA ANIONÓW
Analiza dotyczy następujących anionów: Cl
-
, I
-
, CO
3
2-
, C
2
O
4
2-
, PO
4
3-
, SO
4
2-
, NO
3
-
.
I. Wykonanie reakcji charakterystycznych dla wybranych anionów
Przeprowadź reakcje charakterystyczne dla poszczególnych anionów wykorzystując odczynniki
przedstawione w tabeli. Obserwuj zachodzące zmiany. Zapisz dokonane obserwacje i przedstaw
równania zachodzących reakcji chemicznych.
odczynnik
aniony
Cl
-
I
-
CO
3
2-
C
2
O
4
2-
PO
4
3-
SO
4
2-
NO
3
-
AgNO
3
osady podzielić na 2 części, do każdej dodać:
a) NH
3
b) 2M HNO
3
X
X
X
X
X
X
X
X
X
X
X
X
Ba(NO
3
)
2
osady powstałych soli zadać
2M HNO
3
X
X
X
X
X
X
X
X
X
X
2M HCl
X
2M HCl + H
2
O
2
w obecności skrobi
X
2M HCl + H
2
O
2
+ CHCl
3
X
1M H
2
SO
4
+ KMnO
4
X
X
X
mieszanina magnezowa
X
X
X
(NH
4
)
2
MoO
4
+ HNO
3
X
2M HCl + KI + skrobia + magnez
X
Ogólne zasady przeprowadzania reakcji charakterystycznej:
Do probówki zawierającej 1 cm
3
roztworu soli zawierającej badany anion dodajemy kroplami
roztworu wskazanego odczynnika. Obserwujemy zachodzące zmiany.
Reakcje anionów z jonami srebra
Do poszczególnych roztworów zawierających badany anion (1 cm
3
) dodajemy kroplami roztworu
azotanu(V) srebra. Obserwujemy barwy ewentualnych osadów i badamy ich rozpuszczalność w
amoniaku oraz w kwasie azotowym(V) – po uprzednim rozdzieleniu osadu na dwie części.

Reakcje anionów z jonami baru
Do poszczególnych roztworów zawierających badany anion (1 cm
3
) dodajemy kroplami roztworu
azotanu(V) baru. Obserwujemy wytrącanie ewentualnych osadów, a następnie badamy ich
rozpuszczalność w kwasie azotowym(V). Zapisujemy otrzymane wyniki.
Badanie odczynu roztworów soli
Zanurzamy papierek wskaźnikowy kwasowo – zasadowy w roztworze soli (zawierającej badany
anion i kation pochodzący od mocnego wodorotlenku).
Aniony, pochodzące od słabych kwasów, w roztworze wodnym ulegają hydrolizie z wytworzeniem
jonów wodorotlenkowych.
Reakcja z manganianem(VII) potasu
Do roztworów zawierających badany jon (o objętości maksymalnie 1 cm
3
) dodajemy kilka kropel
rozcieńczonego kwasu siarkowego(VI), a następnie 1 – 2 krople (unikać nadmiaru) roztworu
manganianu(VII) potasu.
Jeśli trzeba ogrzewamy do pożądanej temperatury. Zanik fioletowej barwy jest wynikiem
pozytywnym.
Jony jodkowe reagują na zimno (roztwór barwi się na kolor brunatny od powstającego jodu).
Jony szczawianowe reagują po ogrzaniu do 50°C.
Jony chlorkowe reagują dopiero po kilkuminutowym ogrzewaniu w temperaturze 100°C.
Powstający chlor można poznać po charakterystycznym zapachu.
Wykrywanie jonu azotanowego(V)
Roztwór zawierający jony azotanowe(V) zakwaszamy kwasem solnym, dodajemy roztworu jodku
potasu oraz skrobi. Do bezbarwnej mieszaniny wrzucamy kawałek magnezu. Pojawia się
niebieskie/granatowe zabarwienie.

II. Wykrywanie anionów w próbce
Na podstawie znajomości efektów przeprowadzonych w części I reakcji należy zidentyfikować
zawarte w mieszaninie aniony.
Wytrącanie osadów – ogólny tok postępowania
Do badanej próbki dodajemy odczynnika strącającego. Jeśli nastąpiło zmętnienie lub wytrącił się
osad zawartość probówki odwirowujemy.
Następnie sprawdzamy całkowitość wytrącenia przez kolejne dodanie odczynnika strącającego. W
razie pojawienia się osadu ponownie odwirowujemy zawartość probówki. Powtarzamy powyższe
czynności do momentu, aż przestanie pojawiać się zmętnienie po dodaniu kolejnej porcji
odczynnika strącającego.
Rozpuszczanie osadów – ogólne uwagi
Podczas badania, czy dany osad rozpuszcza się w jakimś odczynniku zawsze należy mieszać
zawartość probówki w trakcie dodawania tego odczynnika.
Reakcja mieszaniny anionów z roztworem manganianu(VII) potasu
Obecność jonów jodkowych uniemożliwia wykrycie jonów szczawianowych. Dlatego w pierwszej
kolejności należy je usunąć z badanej mieszaniny. W tym celu do badanego roztworu dodajemy
roztworu azotanu(V) baru. Powstałe w tej reakcji osady nierozpuszczalnych soli baru (w tym
szczawianu baru) należy strącić całkowicie, następnie po ostatnim wirowaniu zdekantować i
kilkakrotnie przemyć destylowaną wodą, aby dokładnie oddzielić jony jodkowe (i przy okazji
chlorkowe), które nie tworzą osadów z jonami baru.
Przemywanie osadów
Po odwirowaniu zawartość probówki dekantujemy (zlewamy) roztwór z nad osadu. Dolewamy
wody destylowanej, mieszamy, odwirowujemy i powtarzamy te czynności kilka razy.
Po ostatnim płukaniu i wirowaniu dekantujemy mieszaninę, osad rozpuszczamy i prowadzimy
reakcję z manganianem(VII) potasu.

ALKACYMETRIA
Jeśli dwie substancje A i B reagują ze sobą w stosunkach stechiometrycznych (ściśle ustalonych), to na podstawie
znajomości ilości substancji B zużytej do reakcji z A można obliczyć, ile substancji A wzięło udział w reakcji. To
zjawisko wykorzystuje się w analizie miareczkowej do badania zawartości (oznaczania) substancji w próbkach. Analiza
ta polega na tym, że do roztworu zawierającego oznaczaną substancję (A) wprowadza się niewielkimi porcjami
(miareczkami) równoważną chemicznie ilość drugiej substancji (B) (w postaci roztworu o znanym stężeniu tzw.
roztworu mianowanego lub titranta). Po skończonym badaniu mierzy się dokładną objętość zużytego w reakcji roztworu
mianowanego i oblicza ilość zużytej substancji (B). Następnie na podstawie stechiometrii reakcji oblicza się ilość
oznaczanej substancji (A).Moment, w którym do oznaczanego roztworu została wprowadzona równoważna chemicznie
ilość drugiej substancji nazywa się punktem równoważnikowym (PR). Aby ten moment uwidocznić dla badającego
stosuje się np. wskaźniki (najczęściej są to substancje, które zmieniają barwę w chwili zakończenia reakcji pomiędzy
roztworem miareczkowanym a mianowanym). Alkacymetria jest jedną z metod (analiz) miareczkowych. Opiera się ona
na rekcji kwas – zasada. Obejmuje oznaczanie wodorotlenków za pomocą mianowanych roztworów kwasów lub
oznaczanie kwasów przy użyciu roztworów wodorotlenków o znanym stężeniu.
Ogólne zasady miareczkowania
1. Przygotowanie biurety
Przyrządem do odmierzania objętości titranta jest biureta – wąska rura szklana zaopatrzona w
podziałkę i kranik u dołu, przez który małymi porcjami jest wypuszczany roztwór mianowany.
Objętość cieczy wylanej z biurety oblicza się na podstawie różnicy początkowego i końcowego
poziomu cieczy (w przypadku bezbarwnych cieczy odczytuje się położenie menisku dolnego –
oko odczytującego musi znaleźć się na poziomie menisku).
1.1.
Umycie biurety
1.2.Przepłukanie biurety 2 – 3 razy małymi porcjami (kilka cm
3
) roztworu mianowanego (za
każdym razem należy wypuścić roztwór możliwie całkowicie)
1.3.Ustawienie biurety w statywie dokładnie w położeniu pionowym
1.4.Napełnienie biurety titrantem powyżej poziomu zerowego (można użyć lejka)
1.5.Wypuszczenie przez kranik ewentualnych pęcherzyków powietrza
1.6.
Dopełnienie biurety titrantem do poziomu zerowego
2. Miareczkowanie
Podczas badania należy wypuszczać kroplami roztwór mianowany z biurety do oznaczanego
roztworu (stale go mieszając) aż zostanie osiągnięty punkt równoważnikowy. Należy wykonać co
najmniej trzy miareczkowania. Wszystkie miareczkowania wykonuje się przy jednorazowym
napełnieniu biurety. Po zakończeniu każdego miareczkowania odczytujemy objętość zużytego
titranta.
3. Obliczenia
Na podstawie znajomości objętości zużytego roztworu mianowanego oraz jego stężenia obliczamy
ilość zużytego titranta. Korzystając z równania reakcji chemicznej obliczamy ilość badanej
substancji (stosownie do wymagań może to być jej stężenie lub ilość wyrażona w gramach).
Współmierność kolby i pipety
Kolba miarowa i pipeta są używane razem (próbka jest rozcieńczana w kolbie do określonej
objętości, a następnie określona część gotowego roztworu jest pobierana za pomocą pipety do
analizy) i z tego względu należy wyznaczyć stosunek pojemności obu tych naczyń miarowych.
W tym celu należy wlać do kolby miarowej o pojemności 250 cm
3
10 razy zawartość pipety o
objętości 25 cm
3
i zaznaczyć na kolbie wysokość wody (menisk wklęsły).
Napełnianie kolby za pomocą pipety należy powtarzać tak długo, aż słup wody w szyjce kolby
będzie znajdować się na tej samej wysokości.

ANALIZY
Oznaczanie węglanu sodu
Celem tego ćwiczenia jest określenie zawartości węglanu sodu w stałych zanieczyszczonych
próbkach.
1. Odważamy określoną masę zanieczyszczonej próbki.
2. Rozpuszczamy próbkę w wodzie w kolbie miarowej i otrzymujemy roztwór o objętości 250 cm
3
.
3. Pobieramy 25 cm
3
tego roztworu do kolby stożkowej.
4. Dodajemy kilka kropli oranżu metylowego.
5. Prowadzimy miareczkowanie za pomocą mianowanego roztworu kwasu solnego do momentu, aż
wskaźnik w roztworze osiągnie barwę cebulkową (miareczkowanie powtarzamy 2 – 3 razy – do
powtarzalności otrzymanych wyników).
6. Dokonujemy obliczeń procentowej zawartości węglanu sodu w próbce wiedząc, że reagenty
reagują ze sobą w myśl równania: Na
2
CO
3
+ 2HCl 2NaCl + H
2
O.
Oznaczanie kwasu octowego
Celem tego ćwiczenia jest oznaczenie liczby moli kwasu octowego w próbce.
1. Otrzymaną do badania próbkę roztworu kwasu octowego rozpuszczamy w kolbie miarowej na
250 cm
3
.
2. Pobieramy 25 cm
3
roztworu i przelewamy do kolby stożkowej.
3. Dodajemy kilka kropel fenoloftaleiny.
4. Roztwór miareczkujemy mianowanym roztworem wodorotlenku sodu do pojawienia się
pierwszej malinowej barwy.
5. Dokonujemy odpowiednich obliczeń.

Manganianometria
Oznaczanie jonów żelaza (Fe
2+
)
Oznaczanie jonów żelaza(II) będzie polegało na miareczkowaniu próbki zawierającej te jony za
pomocą mianowanego roztworu manganianu(VII) potasu w środowisku kwaśnym.
1. Otrzymaną do analizy próbkę rozcieńczamy w kolbie miarowej do objętości 250 cm
3
.
2. Pobieramy 25 cm
3
roztworu i przelewamy do kolby stożkowej.
3. Do kolby stożkowej dodajemy 40 cm
3
2M kwasu siarkowego(VI).
4. Miareczkujemy do momentu aż ostatnia kropla dodanego titranta wywoła trwałe różowe
zabarwienie roztworu.
5. Na podstawie znajomości równania reakcji chemicznej obliczamy liczbę moli jonów żelaza(II) w
otrzymanej próbce.

Jodometria
Oznaczanie jonów miedzi (Cu
2+
)
Jodometryczne oznaczanie jonów miedzi(II) nie jest analizą bezpośrednią. Na początku
przeprowadza się jony miedzi(II) w trudno rozpuszczalny jodek miedzi(I) stosując w celu
całkowitego wytrącenia osadu duży nadmiar jodku potasu:
2Cu
2+
+ 4I
-
2CuI + I
2
Powyższa reakcja zachodzi szybciej w środowisku kwaśnym.
Po całkowitym wytrąceniu jodku miedzi(I) odmiareczkowuje się powstały jod mianowanym
roztworem tiosiarczanu sodu:
I
2
+ 2Na
2
S
2
O
3
Na
2
S
4
O
6
+ 2NaI
Miareczkowanie jodu wykonać należy niezwłocznie z uwagi na możliwość utleniania się jonów
jodkowych znajdujących się w mieszaninie, co skutkować będzie otrzymaniem fałszywych
wyników analizy.
Wykonanie
1. Otrzymaną próbkę do badań rozcieńczamy w kolbie miarowej do objętości 250 cm
3
.
2. Za pomocą pipety miarowej pobieramy 25 cm
3
roztworu i przelewamy do kolby stożkowej.
3. Dodajemy 3 – 8 cm
3
kwasu octowego.
4. Wsypujemy łyżeczkę stałego jodku potasu i dokładnie mieszamy zawartość kolby.
5. Mieszaninę miareczkujemy mianowanym roztworem tiosiarczanu sodu. Gdy mieszanina nieco
ulegnie rozjaśnieniu dodajemy kilka kropel roztworu skrobi (roztwór zabarwi się na granatowo od
obecnego w nim jodu).
6. Kontynuujemy miareczkowanie do zaniku granatowej barwy (roztwór pozostaje białoróżowy).
Bufory
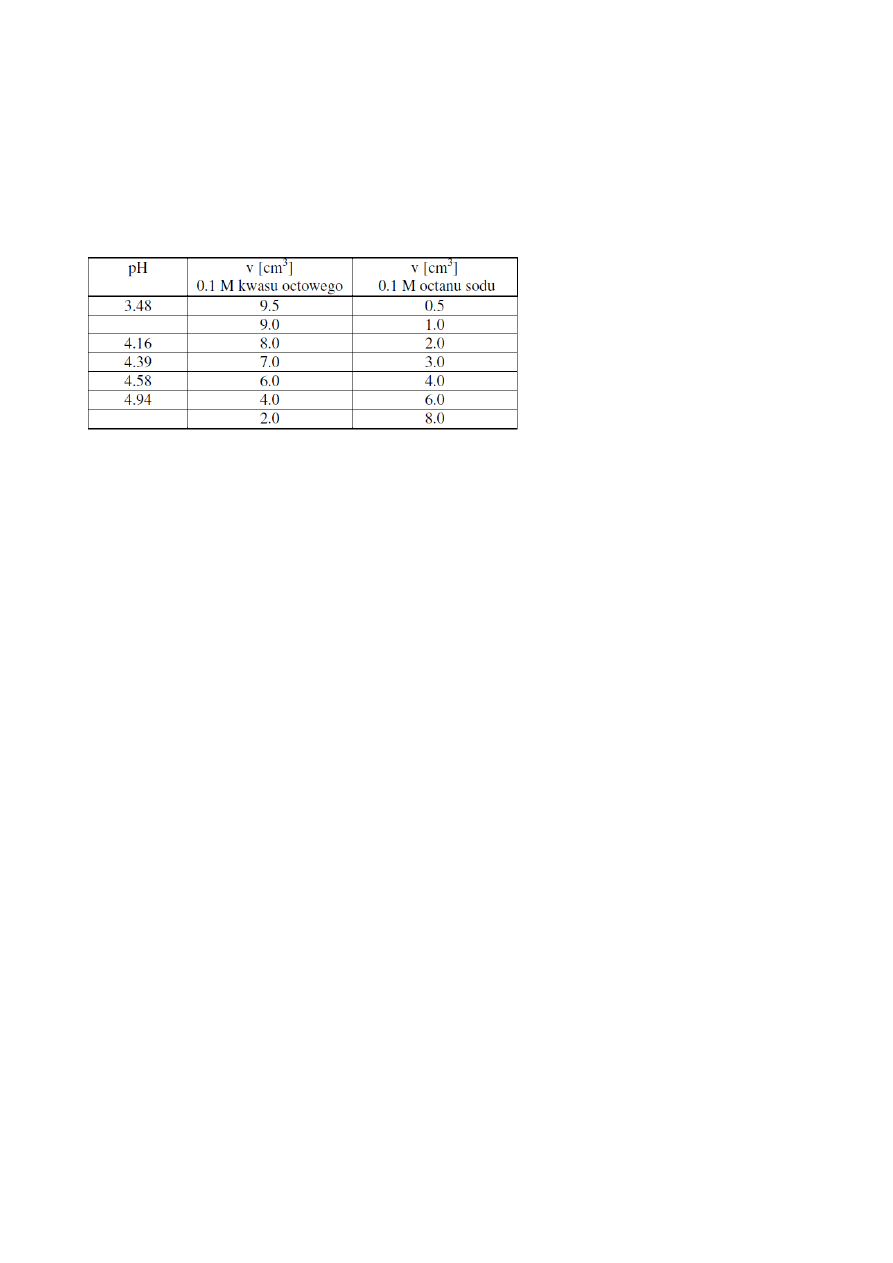
W celu przypomnienia zagadnień związanych z buforami oblicz brakujące pH roztworów
buforowych i uzupełnij tabelę.
1. Sporządzanie roztworów buforowych o różnym pH.
Przygotowujemy bufory mieszając ze sobą roztwory kwasu octowego i octanu sodu o
odpowiednich stężeniach w ilościach podanych w tabeli.
2. Badanie wpływu rozcieńczenia, dodatek kwasu i wodorotlenku na pH roztworów
buforowych
Dzielimy każdy z otrzymanych roztworów na 3 równe części i do każdego z nich dodajemy badane
czynniki (1 – wody (rozcieńczenia), 2 – kwasu, 3 – wodorotlenku). Tworzymy również tzw. próbę
kontrolną, czyli napełniamy trzy naczynia wodą o podobnej objętości i prowadzimy takie same
badania jak w przypadku buforów. Odczynniki dodajemy małymi porcjami, po każdej porcji
sprawdzając pH mieszaniny.

Kolorymetria
Oznaczanie żelaza (Fe
2+
) metodą rodankową
Kolorymetria jest jedną z metod analizy ilościowej wykorzystującą absorpcję światła białego przez roztwór badanej
substancji. Absorpcja światła jest proporcjonalna do stężenia barwnej substancji w roztworze.
W kolorymetrycznym oznaczaniu jonów żelaza(III) przekształca się je w barwny związek za pomocą jonów
rodankowych, z którymi tworzą kompleks o krwistoczerwonym zabarwieniu.
Wykonanie
1. Do 6 kolbek miarowych o pojemności 50 cm
3
dodajemy po 2 cm
3
kwasu azotowego(V)
rozcieńczonego wodą w stosunku 1 : 1, następnie 10 cm
3
10% rodanku potasowego. Do tak
przygotowanych roztworów wlewamy różną objętość soli żelaza(III) o stężeniu 0,1 mg/cm
3
:
1 – 1 cm
3
2 – 2 cm
3
3 – 4 cm
3
4 – 6 cm
3
5 – 8 cm
3
6 – 10 cm
3
Po czym dopełniamy kolbki wodą destylowaną do 25 objętości cm
3
.
2. Wykonujemy pomiary ekstynkcji (absorpcji) światła dla poszczególnych roztworów i
wykreślamy na papierze milimetrowym wykres przedstawiający zależność absorpcji od ilości
jonów żelaza(III) w próbce.
3. Badamy próbkę o nieznanym stężeniu jonów żelaza(III).
Do otrzymanego do oznaczenia roztworu znajdującego się w kolbce miarowej o objętości 25 cm
3
dodajemy kwasu azotowego(V), rodanku i wody zgodnie z przepisem w punkcie 1. Następnie
dokonujemy pomiaru absorpcji. Wynik nanosimy na wykres i odczytujemy stężenie jonów
żelaza(III).
Wyszukiwarka
Podobne podstrony:
LAB instrukcje, Ćwiczenie 13, Przebieg _wiczenia:
Lab ME II zad rach 2012 13
ver.2 rozklad 2012-13 lab syste
Lab ME MI1 instrukcja 2012 E
Lab ME MPS instrukcja 2012 E
Lab ME MS instrukcja 2012 E id Nieznany
Lab ME TR instrukcja 2012 E id Nieznany
Lab ME MI2 instrukcja 2012 E id Nieznany
BMZ wykłady- fiszki z wykładów 2012-13, Psychologia, Psychologia I rok, semestr zimowy, Biologiczne
Lab ME MS instrukcja 2012 E
Lab ME MPS instrukcja 2012 E
Lab ME MI2 instrukcja 2012 E
Biotechnologia zamkniete użycie (2012 13)
Algebra liniowa i geometria kolokwia AGH 2012 13
kol zal dod pop algebra ETI 2012 13
zestawienie fakultetow 2012 13 Nieznany
cw2 tip 2012 13
więcej podobnych podstron