
Akademia Górniczo-Hutnicza w Krakowie, Wydział Inżynierii Materiałowej i Ceramiki
Katedra Ceramiki i Materiałów Ogniotrwałych
1
BADANIE WŁAŚCIWOŚCI CEMENTU GLINOWEGO
INSTRUKCJA DO ĆW. NR 1 i 2
I.
CEL ĆWICZENIA
Celem ćwiczenia jest zapoznanie się z procesem hydratacji cementu glinowego,
oznaczaniem pH zawiesiny cementu glinowego, zawartości wody związanej przez składniki
cementu glinowego i określenie wpływu nano- i mikrododatków na wymienione parametry
i procesy.
II.
PODSTAWY TEORETYCZNE
Cement glinowy zalicza się do specjalnego typu cementów, które znajdują
zastosowanie, poza budownictwem, przede wszystkim do produkcji nieformowanych
materiałów ogniotrwałych. Znacznie różni się on pod względem chemicznym od powszechnie
stosowanego w budownictwie cementu portlandzkiego. Konsekwencją tego są różne
właściwości tych dwóch spoiw hydraulicznych. Cement portlandzki składa się głównie
z CaO i SiO
2
, które występują w formie krzemianów wapnia:
alit – krzemian trójwapniowy - C
3
S - 3CaO·SiO
2
,
belit – krzemian dwuwapniowy - C
2
S - 2CaO·SiO
2
.
W reakcji z wodą fazy te tworzą hydraty krzemianowo-wapniowe
(faza C-S-H) i krystaliczny wodorotlenek wapnia. Innymi składnikami cementu są:
brownmilleryt – C
4
AF - 4CaO·Al
2
O
3
·Fe
2
O
3
glinian trójwapniowy –C
3
A - 3CaO·Al
2
O
3
Z kolei głównymi składnikami tlenkowymi cementów glinowych jest Al
2
O
3
i CaO,
które tworzą gliniany wapnia – Tabela 1 i rys. 1. Głównym składnikiem fazowym cementu
glinowego jest monoglinian wapniowy CA, lecz należy zaznaczyć, że gatunki cementu
glinowego, w którego skład wchodzi około 36-42% Al
2
O
3
zawierają ponadto znaczne ilości
gelenitu (C
2
AS). Z kolei cementy o najwyższej zawartości Al
2
O
3
zawierają dodatkowo takie
składniki fazowe jak CA
2
, CA
6
, C
12
A
7
i α-Al
2
O
3
.
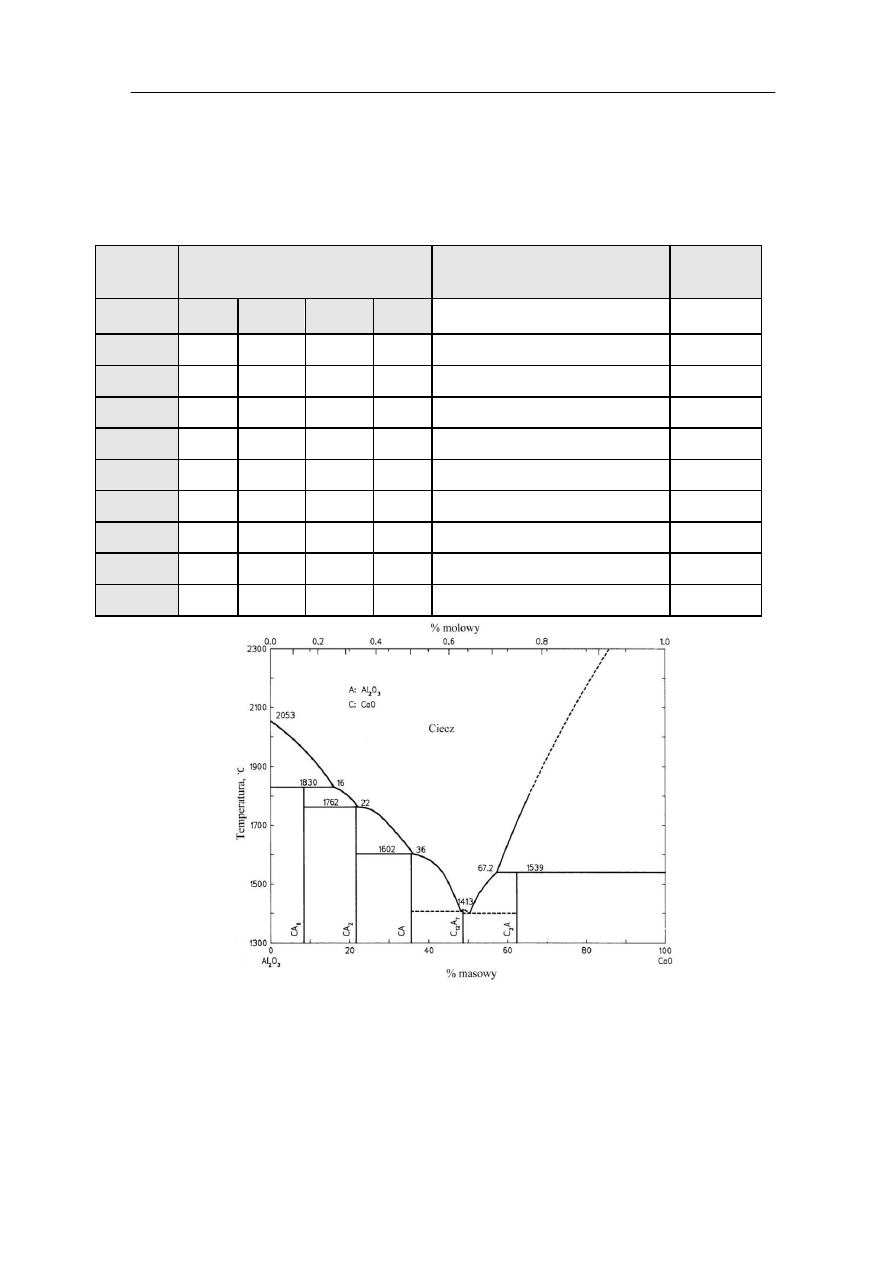
Tabela 1 przedstawia podstawowe własności faz wchodzących w skład cementu
glinowego. W największej ilości występuje w nim glinian jednowapniowy, CA,
który charakteryzuje się wysoką temperaturą topnienia (1602˚C) oraz wykazuje
największą wytrzymałość mechaniczną spośród wymienionych faz, osiąganą
w relatywnie krótkim czasie potrzebnym na związanie betonu.
Kolejną fazą występującą w znacznych ilościach w cementach glinowych
jest dwuglinian wapniowy, CA
2
, który jest bardziej ogniotrwały niż CA. Charakteryzuje się
on powolną hydratacją, przyspieszoną w podwyższonych temperaturach. Hydratacja CA
przebiega szybciej w obecności CA
2
. Reakcja odwrotna ma inny charakter, a mianowicie
hydratacja CA
2
może zostać spowolniona przez obecność CA. Wytrzymałość CA
2
po trzech
dniach hydratacji porównywalna jest do wytrzymałości czystego uwodnionego CA.
Oprócz CA i CA
2
podstawowym składnikiem cementów glinowych
jest siedmioglinian dwunastowapniowy, C
12
A
7
, który szybko hydratyzuje i posiada relatywnie
niską temperaturę topnienia.
Warto wspomnieć również o takich fazach jak C
2
S oraz C
4
AF występujących często
w cemencie portlandzkim oraz w cementach wysoko glinowych niższej jakości bogatych
w tlenki żelaza. C
4
AF tworzy mieszaniny hydratów glinianu wapnia i żelazianu wapniowego.
Innym niepożądanym składnikiem jest C
2
AS, który wykazuje niewielką tendencję do
hydratacji, obniża ogniotrwałość i własności wysokotemperaturowe.
Akademia Górniczo Hutnicza w Krakowie, Wydział Inżynierii Materiałowej i Ceramiki,
Katedra Ceramiki i Materiałów Ogniotrwałych
2
CA
6
jest jedynym glinianem wapnia niemalże nie hydratującym, występującym często
w czystych cementach. Uważa się, iż CA
6
tworzy się z CA
2
.
UWAGA: C=CaO, S=SiO
2
, A=Al
2
O
3
, H=H
2
O, F=Fe
2
O
3
Tabela 1. Charakterystyka faz cementu glinowego.
Rys. 1. Układ dwuskładnikowy CaO-Al
2
O
3
.
W zależności od dopuszczalnej ilości zanieczyszczeń w produkcie, cementy glinowe
o wysokiej zawartości Al
2
O
3
wytwarza się na drodze spiekania, pozostałe otrzymuje się przez
topienie mieszaniny wapienia z boksytem lub tlenkiem glinu. W zależności od zawartości
Fe
2
O
3
i Al
2
O
3
wyróżnić można cztery rodzaje cementu glinowego (Tabela 2). Cement
Faza
Zawartość składnika
[% masowy]
Temperatura topnienia [
o
C]
Gęstość
[g/cm
3
]
CaO
Al
2
O
3
Fe
2
O
3
SiO
2
CaO
99,8
2570-2625
3,25/3,38
C
12
A
7
48,6
51,4
1392-1413
2,69
CA
35,4
64,6
1602 (inkongruentnie)
2,98
CA
2
21,7
78,3
1750-1765 (inkongruentnie)
2,91
C
2
S
65,1
34,9
2130
3,27
C
4
AF
46,2
20,9
32,9
1415
3,77
C
2
AS
40,9
37,2
21,9
1593
3,04
CA
6
8,4
91,6
1830 (inkongruentnie)
3,38
α-Al
2
O
3
99,8
2020-2051
3,98
Akademia Górniczo Hutnicza w Krakowie, Wydział Inżynierii Materiałowej i Ceramiki,
Katedra Ceramiki i Materiałów Ogniotrwałych
3
glinowy może zawierać naturalne zanieczyszczenia pochodzące z wyjściowych surowców,
oprócz Fe
2
O
3
i SiO
2
,
także TiO
2
, MgO i tlenki alkaliów (Na
2
O, K
2
O).
Tabela 2. Skład chemiczny cementów glinowych.
rodzaj
kolor
Al
2
O
3
CaO
SiO
2
Fe
2
O
3
+FeO
TiO
2
MgO
Na
2
O
K
2
O
1
szary/
czarny
36-42
36-42
3-8
12-20
<2
~1
~0,1
~0,15
2
szary/
biały
48-60
36-42
3-8
1-3
<2
~0,1
~0,1
~0,05
3
biały
65-75
25-35
<0,5
<0,5
<0,05
~0,1
<0,3
~0,05
4
biały
≥80
<20
<0,2
<0,2
<0,05
<0,1
<0,2
~0,05
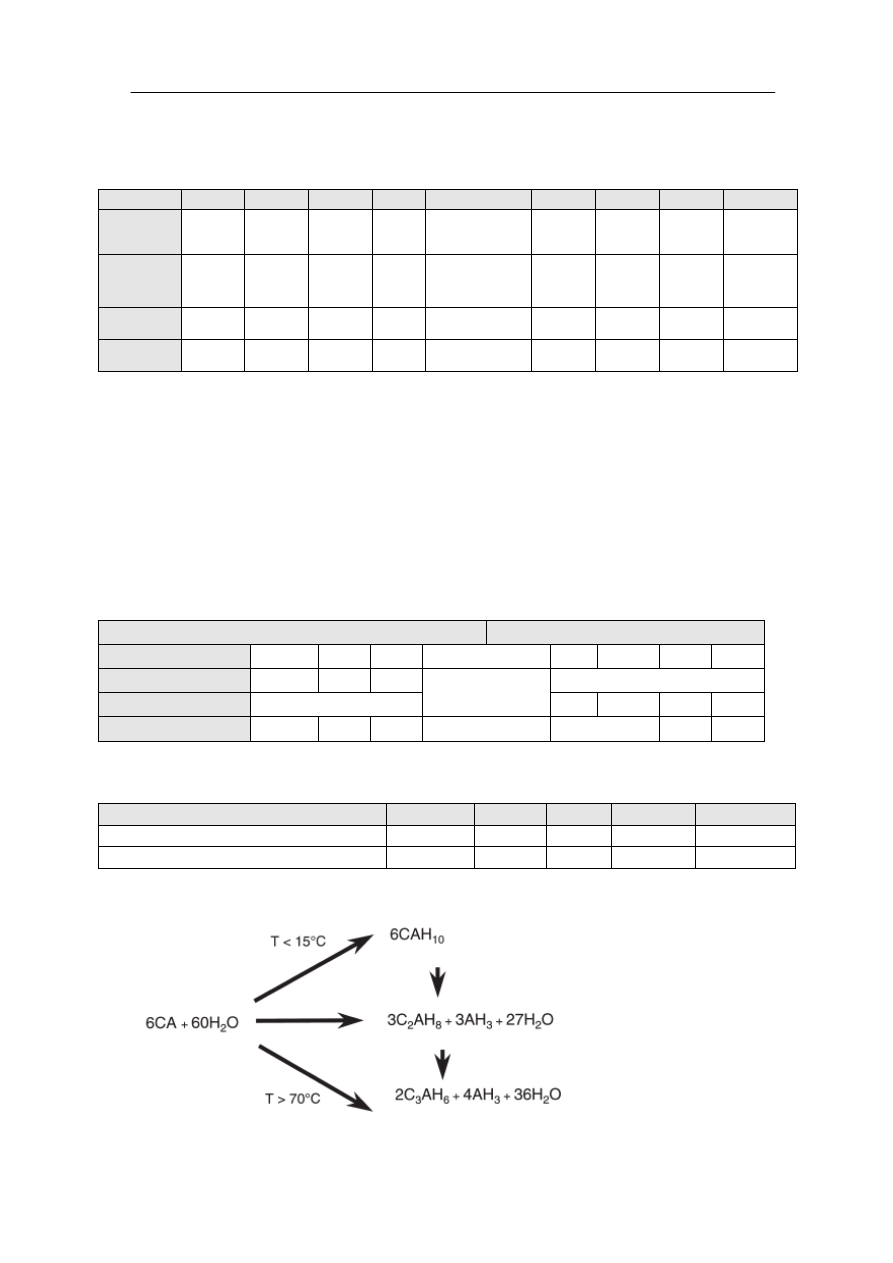
Główne składniki cementu glinowego z różną szybkością reagują z wodą (Tabela
3 i 4). Widoczne jest, że w miarę wzrostu zawartości wapna (wzrost stosunku C/A) wzrasta
także reaktywność z wodą poszczególnych glinianów. Rodzaj powstałych hydratów zależy
od czasu, wilgotności i temperatury, w której przebiega reakcja. Na przykładzie
monoglinianu wapnia (CA), rys. 2 można prześledzić rodzaj powstałych produktów w funkcji
czasu. W temperaturze poniżej 15˚C pierwszą powstałą fazą jest CAH
10
, powyżej 70˚C
tworzy się C
3
AH
6
i AH
3
a w temperaturze pośredniej C
2
AH
8
i AH
3
. Poszczególne fazy
powstałych hydratów przekształcają się w inne, zgodnie z rys. 2.
Tabela 3. Porównanie aktywności hydraulicznej składników cementów glinowych
i cementów portlandzkich.
Cement portlandzki
Cement glinowy
Faza
CS
C
2
S
C
3
S
C
C
3
A
C
12
A
7
CA
CA
2
Stosunek C/S
1
2
3
Stosunek C/A
3
1,7
1
0,5
Reaktywność
Inertny
Mała
Duża
Natychmiastowa
Bardzo duża
Duża
Mała
Tabela 4. Reaktywność glinianów wapnia z wodą.
Faza
C
3
A
C
12
A
7
CA
CA
2
CA
6
Stosunek mol. CaO/Al
2
O
3
3
1,7
1
0,5
0,2
Reaktywność z wodą w temp. 20°C. b. szybko szybko wolno b. wolno nie reaguje
Rys. 2. Przebieg hydratacji monoglinianu wapnia (CA) w funkcji temperatury.
Akademia Górniczo Hutnicza w Krakowie, Wydział Inżynierii Materiałowej i Ceramiki,
Katedra Ceramiki i Materiałów Ogniotrwałych
4
MECHANIZM HYDRATACJI GLINIANÓW WAPNIA
Na mechanizm hydratacji glinianów wapnia składa się proces rozpuszczania, gdzie
bezwodne fazy cementu glinowego rozpuszczają się a następnie w postaci hydratów
wytrącają z roztworu. Wyróżnić można więc trzy zasadnicze fazy procesu hydratacji:
I.
rozpuszczanie,
II.
nukleacja,
III.
wytrącanie.
Proces uwadniania się jest inicjowany przez hydroksylację powierzchni cementu.
W kolejnym etapie ma miejsce rozpuszczanie się cementu w wodzie i uwalnianie jonów
wapnia i glinu do roztworu. W momencie gdy koncentracja jonów przekroczy poziom
rozpuszczalności hydratów C
2
AH
8
i AH
3
tworzy się niewielka ilość żelu hydratów.
Rozpuszczanie jest kontynuowane przy równoczesnym wzroście stężenia jonów wapnia
oraz glinu w wodzie aż do momentu, gdy osiągnięty zostaje poziom nasycenia. Powstają
wówczas w dużej ilości zarodki kryształów – faza nukleacji. Masowo zaczynają wytrącać się
hydraty, co prowadzi do spadku koncentracji jonów. Jest to proces dynamiczny,
który prowadzi do rozpuszczenia reszty bezwodnego cementu. W sensie fizycznym mamy do
czynienia ze wzrostem uwodnionych kryształów, które zazębiają się i wiążą
ze sobą, co prowadzi w efekcie do powstania monolitu w skali makro. Siłą napędową
jest niższa rozpuszczalność hydratów w wodzie niż bezwodnego glinianu wapniowego.
Temperatura otoczenia znacznie wpływa na hydraty, gdyż ich rozpuszczalność bardzo
zmienia się wraz ze zmianą temperatury.
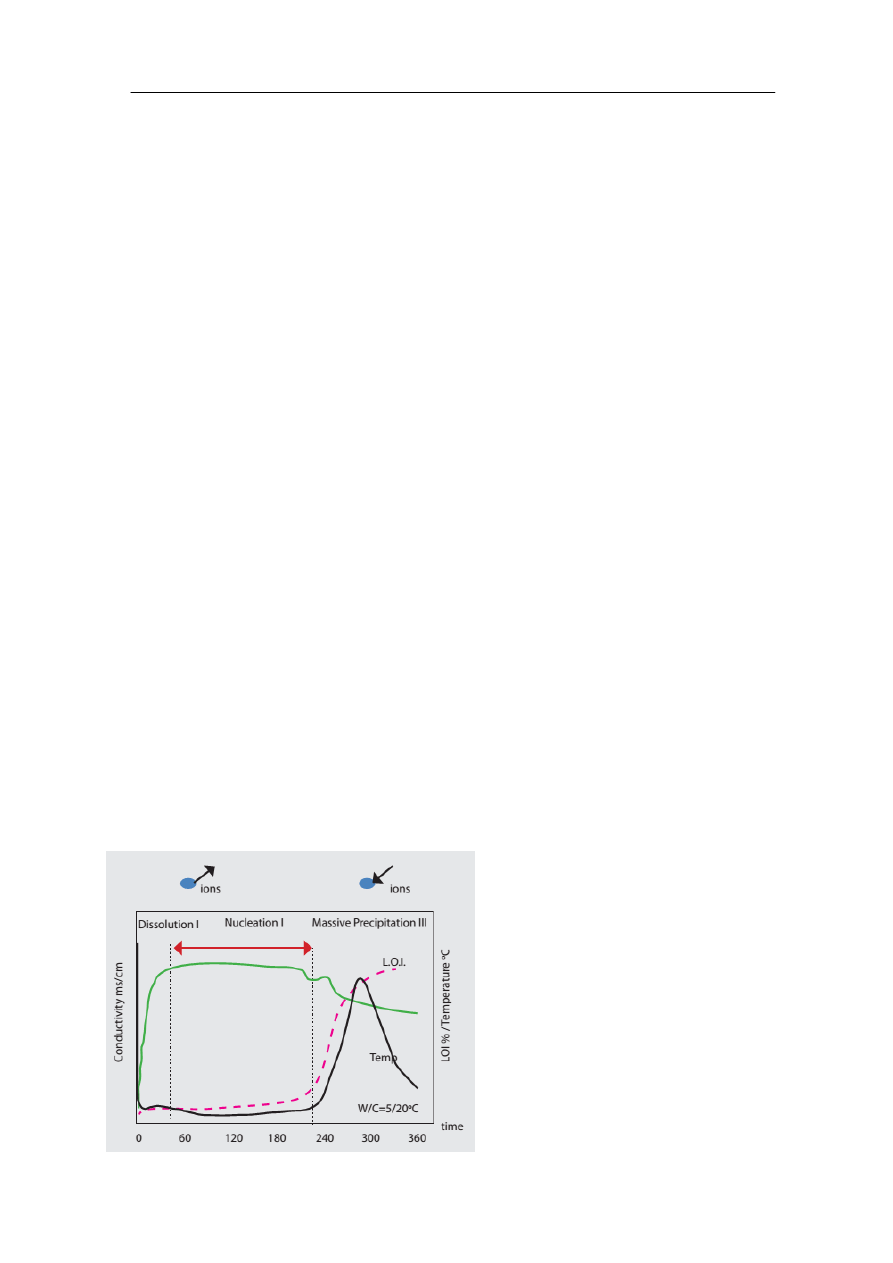
Hydratacja jest procesem związanym z przejściem jonów do roztworu. Można to
potwierdzić stosując pomiary konduktometryczne. W tym celu próbkę cementu umieszcza się
w wodzie i poddaje badaniom na przewodność jonową. Jej wartość wzrasta w miarę
zwiększania się ilości jonów w jednostce objętości.
W badaniu przewodności jonowej mogą wystąpić trzy stadia:
1. Szybki wzrost przewodności, związany z gwałtownym wzrostem ilości jonów
Ca
2+
oraz Al(OH)
-
4
. Ta faza jest egzotermiczna i towarzyszy jej generowanie ciepła.
Widoczne jest w jej trakcie powolne osadzanie się pierwotnych hydratów w formie
żelu.
2. Stan nasycenia - płaska krzywa, gdzie tworzą się zarodki kryształów.
3. Gwałtowny spadek przewodności. Związane jest to z formowaniem się hydratów, ich
masowe wydzielanie się powoduje obniżenie przewodności. Ten stan jest silnie
egzotermiczny.
Rys. 3. Stadia procesu hydratacji.
źródło: www.pieceprzemysłowe.com.pl

Akademia Górniczo Hutnicza w Krakowie, Wydział Inżynierii Materiałowej i Ceramiki,
Katedra Ceramiki i Materiałów Ogniotrwałych
5
III. WYKONANIE ĆWICZENIA
Surowce: cement glinowy, woda, woda destylowana, nano- i mikrododatki:, nanotlenek SiO
2
,
mikrokrzemionka.
Sprzęt: waga laboratoryjna, suszarka, szklane naczynia laboratoryjne, szpatułki, folia
aluminiowa, pH-metr.
ĆWICZENIE 1 - Badanie pH zawiesin cementu glinowego
I. Przygotowanie pH-metru do badań:
1. Umieścić elektrodę oraz czujnik temperatury na stojaku a następnie podłączyć je do
pH-metru
2. Włączyć pH-metr a następnie elektrodę i czujnik temperatury umieścić w zlewce
z wodą destylowaną
3. Odczytać wynik pH dla wody destylowanej
II. PRZYGOTOWANIE TRZECH ZAWIESIN:
1 – ODNIESIENIA – 35g CEMENTU + 150g WODY
2 – Z MIKROKRZEMIONKĄ – 30g CEMENTU + 5g MIKROKRZEMIONKI +
150g WODY
3 – Z NANO TLENKIEM SiO
2
- 30g CEMENTU + 5g NANO-SiO
2
+ 150g WODY
1. Do sporządzenia próbki odniesienia odważyć 35g cementu glinowego oraz 150g
wody. W celu przygotowania dwóch pozostałych prób odważyć po 30g cementu
glinowego, 5g mikrokrzemionki i nano-SiO
2
oraz 150g wody.
2. Dokładnie wymieszać składniki suche a następnie dodać wodę i ponownie wymieszać.
3. Sporządzone zawiesiny niezwłocznie poddać badaniu pH.
III. Pomiar pH zawiesin:
1. Przed pomiarem pH zawiesinę mocno wymieszać, a następnie umieścić w niej czujnik
temperatury oraz elektrodę
2. Odczekać chwilę a następnie odczytać wynik pH
3. Po każdym pomiarze należy opłukać elektrodę oraz czujnik temperatury wodą
destylowaną z tryskawki a następnie umieścić je w zlewce z wodą destylowaną
Odczyt pH dla wszystkich zawiesin wykonywać po upływie takich samych okresów
czasu
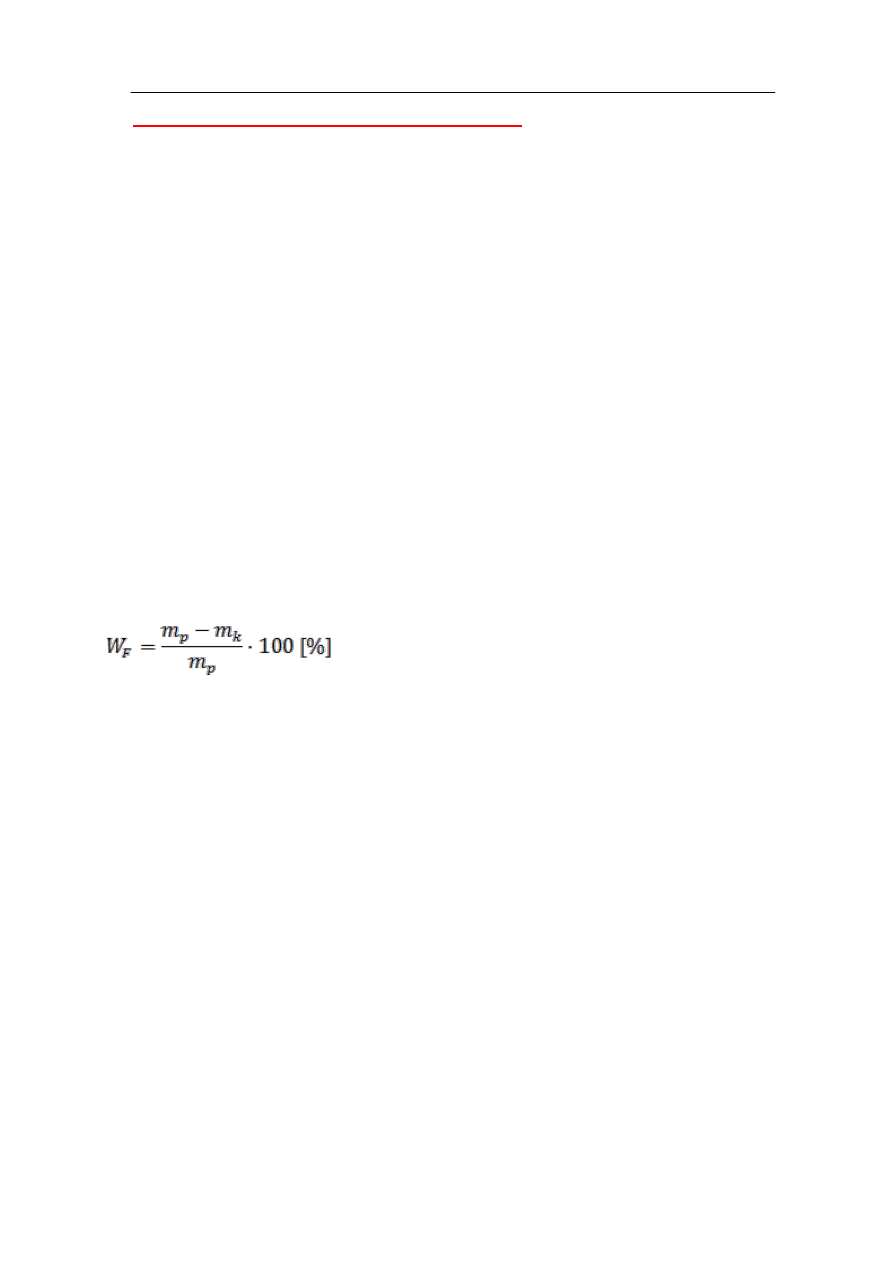
Akademia Górniczo Hutnicza w Krakowie, Wydział Inżynierii Materiałowej i Ceramiki,
Katedra Ceramiki i Materiałów Ogniotrwałych
6
ĆWICZENIE 2 - Oznaczanie ilość wody związanej
I. PRZYGOTOWANIE TRZECH PAST:
1 – ODNIESIENIA – 5g CEMENTU + 2g WODY
2 – Z MIKROKRZEMIONKĄ – 4,5g CEMENTU + 0,5g MIKROKRZEMIONKI +
2g WODY
3 – Z NANO TLENKIEM SiO
2
- 4,5g CEMENTU + 0,5g NANO-SiO
2
+ 2g WODY
1. Do sporządzenia próbki odniesienia odważyć 5 g cementu glinowego oraz w celu
przygotowania dwóch pozostałych prób po 4,5g cementu glinowego i po 0,5g
mikrokrzemionki i nano-SiO
2
.
2. Dokładnie wymieszać mieszanki.
3. Do zhomogenizowanych mieszanek dodać wodę z zachowaniem stosunku W/C
(woda/spoiwo) = 0,4 (2,0g) i dokładnie wymieszać.
4. Sporządzone pasty pozostawić na około 0,5 h.
II. WYKONANIE OZNACZENIA
Sporządzone pasty po upływie 0,5h przenieść do czystego naczyńka wagowego
wyłożonego folią aluminiową, a następnie umieścić je w suszarce laboratoryjnej. Proces
suszenia prowadzić w temperaturze 105 ± 5°C. Należy kontrolować ubytek masy co 15 min,
aż do uzyskania stałej masy próbki.
Zawartość wolnej wody w paście na każdym etapie badania, a także po uzyskaniu stałej
masy próbki oblicza się następująco:
gdzie:
W
F
– zawartość wilgoci w paście (wolna woda) po x min. suszenia, %
m
p
– masa próbki wyjściowej, g
m
k
– masa próbki po x min. suszenia, g
Po uzyskaniu stałej masy próbki należy podać ilość wody związanej przez składniki pasty.
Wyszukiwarka
Podobne podstrony:
Ćw.1.Badanie właściwości dynamicznych czujnika temperatury
Cw 2) BADANIE ODBIORNIKA RADIO Nieznany
Badanie wlasciwosci dynamicznyc Nieznany (2)
Mat termoizol gr 10 ponoc zzzz wnioskami, Poniedziałek - Materiały wiążące i betony, 07. (17.11.201
Ćw. 2 - Badanie właściwości impulsowych tranzystora, Politechnika Lubelska
Cw 6 Badanie wlasciwosci mtrologicznych czujnikow temperatury
Instrukcja B, Poniedziałek - Materiały wiążące i betony, 04. (27.10.2011) Ćw B - Badanie właściwości
Obl, Poniedziałek - Materiały wiążące i betony, 02. (17.10.2011) Ćw D - Badanie właściwości zapraw b
6 badanie wlasciwosci mechanicz Nieznany (2)
07 Badanie wlasciwosci fizyczny Nieznany (2)
Instrukcja F, Poniedziałek - Materiały wiążące i betony, 10. (08.12.2011) Ćw F - Badanie właściwości
Sprawozdanie Gr, Poniedziałek - Materiały wiążące i betony, 07. (17.11.2011) Ćw I - Badanie właściwo
Instrukcja I, Poniedziałek - Materiały wiążące i betony, 07. (17.11.2011) Ćw I - Badanie właściwości
Ćw. 2 - Badanie właściwości impulsowych tranzystora, POLITECHNIKA LUBELSKA
Ćw. 2 -Badanie właściwości impulsowych tranzystora, Politechnika Lubelska
Ćw 1 Badanie właściwości dynamicznych czujnika temperatury
więcej podobnych podstron