Funkcje biologiczne wybranych pierwiastków i ich związków. I. Tlen – pierwiastek życia i śmierci
245
Biological function of some elements and their compounds.
I. Oxygen – the element of life and dead
Puzanowska-Tarasiewicz H., Kuźmicka L., Tarasiewicz M.
Higher School of Cosmetology and Protection of Health in Bialystok,
Poland, Department of Chemistry Sciences
Oxygen in cells occurs with carbon and hydrogen in most organic
compounds that have either structural or metabolic functions. Ato-
mic and molecular oxygen in singlet form or as free radicals (i.e.
superoxide anionic radical, hydroxide radical) and as hydrogen pe-
roxide, peroxidenitrate (III), nitrogen oxide are harmful to cellular
structure and its metabolism and induce harmful genic mutations.
Oxygen reactive species are secondary signaling molecules for trans-
cription factors and cytokines. Therefore, it is crucial to maintain
homeostasis at the level of reaction of oxidation and reduction. It is
important for such significant biological processes as DNA synthe-
sis, enzymes activation, cellular cycle regulation, gene transcription
activation, and apoptosis. The review is also devoted for oxygen
carriers in living organisms, e.g. hemoglobin, mioglobin and the toxi-
city of oxygen and ozone.
Key words: oxygen, reactive oxygen species, carriers of oxygen
Pol. Merk. Lek., 2009, XXVII, 159, 245
Funkcje biologiczne wybranych pierwiastków i ich
związków. I. Tlen – pierwiastek życia i śmierci
HELENA PUZANOWSKA-TARASIEWICZ, LUDMIŁA KUŹMICKA, MIROSŁAW TARASIEWICZ
Wyższa Szkoła Kosmetologii i Ochrony Zdrowia w Białymstoku, Zakład Nauk Chemicznych, kierownik: prof. dr hab. H. Puzanowska-Tarasiewicz
Funkcje biologiczne wybranych pierwiastków i ich związków.
I. Tlen – pierwiastek życia i śmierci
Puzanowska-Tarasiewicz H., Kuźmicka L., Tarasiewicz M.
Wyższa Szkoła Kosmetologii i Ochrony Zdrowia w Białymstoku,
Zakład Nauk Chemicznych
W większości związków organicznych spełniających funkcję budul-
cową bądź metaboliczną tlen w komórkach występuje głównie obok
węgla i wodoru. Tlen atomowy oraz cząsteczkowy w formie single-
towej lub w postaci wolnych rodników (np. anionorodnik ponadtlen-
kowy, rodnik hydroksylowy) oraz jako nadtlenek wodoru, nadtleno-
azotan (III), tlenek azotu działa bardzo szkodliwie na struktury ko-
mórkowe i ich metabolizm, a także wywołuje niekorzystne mutacje
genowe. Reaktywne formy tlenu są wtórnymi cząsteczkami sygnali-
zacyjnymi dla czynników transkrypcyjnych i cytokin. Dlatego też tak
bardzo istotne jest zachowanie homeostazy na poziomie reakcji utle-
niania i redukcji. Ma to znaczenie dla tak istotnych procesów biolo-
gicznych, jak: synteza DNA, aktywacja enzymów, regulacja cyklu
komórkowego, aktywacja transkrypcji genów i apoptoza. W pracy
omówiono także przenośniki tlenu w organizmach żywych, np. he-
moglobinę, mioglobinę oraz toksyczność tlenu i ozonu.
Słowa kluczowe: tlen, reaktywne formy tlenu, przenośniki tlenu
Pol. Merk. Lek., 2009, XXVII, 159, 245
Tlen jest pierwiastkiem niezbędnym do prawidłowego prze-
biegu wszystkich procesów życiowych. Organizmy czerpią
potrzebną do życia energię z reakcji biologicznego utlenia-
nia. W organizmie człowieka tlen jest pobierany przez płu-
ca, gdzie zużywany jest w procesie oddychania, co wiąże
się z hemoglobiną krwinek czerwonych. Następnie zostaje
oddawany do tkanek, gdzie bierze udział w przemianie
materii. Szybkość metabolizmu komórkowego i generowa-
nia energii uwarunkowana jest ilością dostarczonego tlenu.
Wysoki potencjał energetyczny ustroju jest istotnym warun-
kiem zachowania zdrowia, witalności, sprawności i dobre-
go samopoczucia.
Pod kontrolą mechanizmów enzymatycznych „przerabia-
nych” jest 98-99% tlenu. Jednak 1-2% tej ilości nie jest prze-
twarzana do końca, tzn. do momentu powstania cząsteczek
wody, a zatrzymuje się na etapie związków pośrednich. Pew-
na bowiem liczba elektronów „wycieka” z łańcucha oddecho-
wego przez wewnętrzną błonę mitochondrialną i redukuje tlen,
wskutek czego wytworzone zostają reaktywne formy tlenu –
ROS (ang. reactive oxygen species). Określenie reaktywne
formy tlenu jest używane w stosunku do tych cząsteczek tle-
nu lub jego związków, które są produktami jedno-, dwu-, trój-
elektronowej redukcji tlenu:
O
2
® O
2
·–
® H
2
O
2
®
·
OH
® H
2
O
gdyż tlen nie zawsze ulega pełnej czteroelektronowej reduk-
cji, czyli reakcji: O
2
+ 4 e + 4 H
+
® 2 H
2
O.
Do reaktywnych form tlenu zaliczamy: anionorodnik po-
nadtlenkowy O
2
·–
, nadtlenek wodoru H
2
O
2
, rodnik hydroksylo-
wy
·
OH, rodnik wodoronadtlenkowy HO
2
·–
, tlenek azotu NO
·
,
kwas nadtlenoazotowy(III) ONOOH, anion kwasu nadtleno-
azotowego(III) ONOO
–
, dwutlenek azotu NO
2
·
. Cząsteczki i
związki azotu określa się często jako reaktywne formy azotu
– RNS (ang. reactive nitrogen species) [15].
Reaktywne formy tlenu mogą powstawać w organizmie
podczas utleniania, np. katecholamin, adrenaliny, DOPA,
utleniania ksenobiotyków i związków fenolowych znajdują-
cych się w pożywieniu. Źródłem ROS są także występujące
wewnątrz komórek oksydazy, zawierające w swoim aktyw-
nym centrum nukleotyd flawianoadeninowy [6]. Głównym
komórkowym źródłem H
2
O
2
są peroksysomy, w których za-
chodzi
b-oksydacja kwasów tłuszczowych, natomiast we-
wnątrzkomórkowym źródłem anionorodników ponadtlenko-
wych są, m.in. mitochondria, gdzie zlokalizowany jest układ
oddechowy.
Reaktywne formy tlenu jako wolne rodniki bądź formy nie-
rodnikowe, np. nadtlenek wodoru H
2
O
2
, ozon, tlen singleto-
wy, reagują ze składnikami organizmów żywych i prowadzą
do powstania wolnych rodników substancji organicznych.
Reakcje te mogą mieć niepożądane, a nawet groźne dla or-
ganizmu skutki. Liczba wolnych rodników rośnie lawinowo
przy niedoborze witamin i związków o właściwościach prze-
ciwutleniających. Duża akumulacja ROS w organizmie, w
wyniku zaburzonego metabolizmu komórkowego oraz dzia-
łania czynników zewnętrznych (promieni UV, toksyn ze śro-
dowiska), może prowadzić do zachwiania równowagi pomię-
dzy związkami wolnorodnikowymi i przeciwutleniającymi, tzw.
antyoksydantami. Reaktywne formy tlenu atakują wówczas
wrażliwe błony komórkowe, uszkadzają struktury komórko-
we, wywołują reakcje łańcuchowe i osłabiają mechanizmy

H. Puzanowska-Tarasiewicz, L. Kuźmicka, M. Tarasiewicz
246
obronne organizmu. Zjawisko to nazywa się stresem oksy-
dacyjnym lub szokiem tlenowym [7].
Rodniki tlenowe i azotowe nie tylko powodują uszkodze-
nia DNA, prowadzące do mutacji, ale reagując z aminokwa-
sami inicjują powstawanie adduktów DNA z białkami, utle-
niają też lipidy w błonach komórkowych. Reakcje rodników z
DNA, białkami i lipidami, a zwłaszcza nagromadzenie się ich
produktów, to początek procesów degeneracyjnych, a następ-
nie rozwoju wielu chorób i starzenia się organizmu. Mało kto
zdaje sobie jednak sprawę, że nadmiar tlenu szkodzi. Zwłasz-
cza nadmiar ROS może mieć groźne dla organizmu skutki i
prowadzić do apoptozy komórek [8].
SYGNALIZACJA KOMÓRKOWA
Hipoteza, że ROS mogą być mediatorami, metabolicznymi
przekaźnikami sygnałów wysuwana była wielokrotnie. Przy-
kładowo anionorodnik ponadtlenkowy O
2
·–
i nadtlenek wodo-
ru H
2
O
2
są dobrymi przekaźnikami, gdyż są stosunkowo mało
reaktywne. Te reaktywne formy tlenu są stale obecne w komór-
kach w bardzo małych stężeniach, które mogą jednak ulec zwięk-
szeniu, jeśli uaktywnione zostaną ich komórkowe źródła [7].
Reaktywne formy tlenu oraz reaktywne formy azotu znane
są ze swego dwojakiego działania w żywych organizmach. Ich
rola nie ogranicza się tylko do destrukcyjnego działania. W ko-
mórce istnieją bowiem obok siebie dwa niezależnie działające
systemy, które angażują rodniki ponadtlenkowe i tlenek azotu
do wykonywania swych funkcji; jednym z nich jest komplek-
sowy system obrony immunologicznej, drugi natomiast
pełni bardzo pozytywną rolę w procesie komunikacji ko-
mórek [6]. Dlatego utrzymanie określonego stężenia rodników
w komórkach jest niezbędne dla zapewnienia przepływu infor-
macji pomiędzy komórkami, a także wewnątrz komórek.
Procesy związane z sygnalizacją komórkową kontrolują
ekspresję enzymów przeciwutleniających oraz wytwarzanie
białek sygnalizacji międzykomórkowej, dlatego sprawują kon-
trolę nad podziałem, różnicowaniem, apoptozą oraz przeży-
walnością komórek [6]. Przykładowo komórki fagocytarne
organizmu, takie jak: granulocyty, monocyty, makrofagi, w
odpowiedzi na inwazję bakterii, reagują wytwarzaniem i wy-
dzielaniem na zewnątrz dużej ilości anionorodnika ponad-
tlenkowego O
2
·–
i tlenku azotu NO
·
. Tworzy się produkt reak-
cji NO
·
z O
2
·–
– anion kwasu nadtlenoazotowego(III) – ONOO
–
, który ma istotne znaczenie bakteriobójcze. Tlenek azotu
należy do neurotransmiterów, małych cząsteczek przekazu-
jących sygnał między neuronami. Ponadto NO
·
jest czynni-
kiem relaksującym, czyli rozszerzającym naczynia. Oprócz
regulacji ciśnienia krwi, tlenek azotu pełni wiele funkcji w or-
ganizmie, m.in. hamuje adhezję leukocytów i agregację pły-
tek krwi, pobudza wytwarzanie endoteliny [12] oraz prolifera-
cję mięśni gładkich [10].
Sygnalizację komórkową (sygnalizację związaną z po-
ziomem redoks w komórce) regulują reakcje utleniania i
redukcji. Mianem poziomu redoks komórki określamy po-
ziom utleniania lub redukcji cząsteczek wrażliwych na pro-
cesy utleniania i redukcji, obecnych w specyficznym miej-
scu i czasie. Reaktywne formy tlenu wzmacniają sygnali-
zację komórkową poprzez oddziaływanie na specyficzne
cząsteczki komórkowe, będące czujnikami stężenia rodni-
ków. Przykładowo białka wrażliwe na stres tlenowy mają
domeny funkcyjne, których zadaniem jest m.in. odbiór
zmian utleniania i redukcji w komórce [6]. Przykładem sys-
temu, który zapewnia homeostazę pomiędzy reakcjami
utleniania i redukcji w komórce jest stosunek zredukowa-
nego glutationu do utlenionego (GSH/GSSG). Za odtwa-
rzanie zredukowanej formy glutationu odpowiedzialna jest
reduktaza glutationowa [2].
Do innych, wewnątrzkomórkowych, aktywnych w reak-
cjach utleniania i redukcji cząsteczek należą białka mające
tiolowe grupy cystein albo grupy sulfhydrylowe lub też nukle-
otydy pirydynowe oraz enzymy zawierające metale, np.: że-
lazo, cynk, miedź. Grupy tiolowe bowiem reagujące na reak-
cje utleniania i redukcji zawierają reszty cysteinowe wystę-
pujące, m.in. w domenie wiążącej się z DNA. Grupy te od-
grywają istotną rolę w ścieżkach sygnalizacji komórkowej,
ponieważ mogą aktywować czynniki transkrypcyjne lub re-
gulować ich aktywność i zdolność do wiązania się z DNA.
Promieniowanie UV o długości fali 320-380 nm wykazuje sil-
nie uszkadzające działanie w stosunku do DNA i prowadzi
do wytworzenia ROS. Tioredoksyna, jako białko wrażliwe na
ROS zlokalizowane wewnątrz komórki, odgrywa ważną rolę
w reakcjach, jakie zachodzą pomiędzy białkiem, a kwasem
nukleinowym na drodze utleniania i redukcji reszt cysteino-
wych. Tioredoksyna, m.in. moduluje wiązanie się czynników
transkrypcyjnych z DNA, regulując w ten sposób proliferację
komórek i naprawę DNA [10].
Do cząsteczek niezbędnych w sygnalizacji komórkowej,
poza omówionymi rodnikami – O
2
·–
i NO
·
należy nadtlenek
wodoru H
2
O
2
. Jako stosunkowo mało reaktywny, a obojętny
elektrycznie związek, może łatwo przenikać przez błony ko-
mórkowe i pojawiać się w przedziałach komórki zupełnie róż-
nych od tych, w których powstaje [7]. Dokładne omówienie
reaktywnych form tlenu jako cząsteczek sygnałowych moż-
na znaleźć w pracy Grzenkowicz i wsp. [6].
PRZENOŚNIKI TLENU W ORGANIZMACH
ŻYWYCH
Przenośnikami tlenu w układach biologicznych są jony me-
tali przejściowych (Fe, Cu i prawdopodobnie V) związane z
białkiem, koordynujące cząsteczkę tlenu (O
2
) w sposób od-
wracalny. Na przykład rozpuszczalność tlenu w wodzie jest
bardzo mała. Pod ciśnieniem 0,1 MPa (1 atm.) i w tempera-
turze 293 K w 1 dm
3
wody rozpuszcza się 6,59 cm
3
tlenu,
dając roztwór o stężeniu 3 × 10
–4
mol/dm
3
. Szybkość, z jaką
układ krążenia może dostarczać tlen, jest zatem ograniczona.
Układy biologiczne rozwinęły więc przenośniki tlenu. Dzięki
nim w stanie równowagi z powietrzem, w temperaturze 293 K,
w 1 dm
3
ludzkiej krwi rozpuszcza się 200 cm
3
O
2
, co daje
roztwór o stężeniu 9 × 10
–3
mol/dm
3
. Krew przenosi zatem 30
razy więcej tlenu niż czysta woda.
Zadanie przenośnika tlenu we krwi spełniają krwinki czer-
wone (erytrocyty), które są najliczniejszymi komórkami krwi i
stanowią około 45% jej objętości. Erytrocyt jest zbudowany z
błony komórkowej i jest wypełniony wysoko wyspecjalizowa-
nym białkiem – hemoglobiną. Hemoglobina transportuje po-
nad 99% tlenu zawartego we krwi i odprowadza do płuc oko-
ło 55% dwutlenku węgla uwolnionego w tkankach.
Hemoglobina – przenośnik tlenu w organizmach żywych,
podobnie jak chlorofil – (zielony barwnik roślin) jest przykła-
dem naturalnych biokompleksów makrocyklicznych. W skład
tych związków wchodzi porfiryna – ligand makrocykliczny
zawierający cztery pierścienie pirolowe, zdolne do koordy-
nowania jonów żelaza(II) lub magnezu. Żelazo(II), podobnie
jak większość metali przejściowych, tworzy z porfirynami
kompleksy o liczbie koordynacyjnej LK=4 i strukturze płaskie-
go kwadratu. Atom żelaza jest umieszczony w centrum pier-
ścienia protoporfiryny, gdzie wiąże się wiązaniem koordyna-
cyjnym z czterema atomami azotu pierścieni pirolowych two-
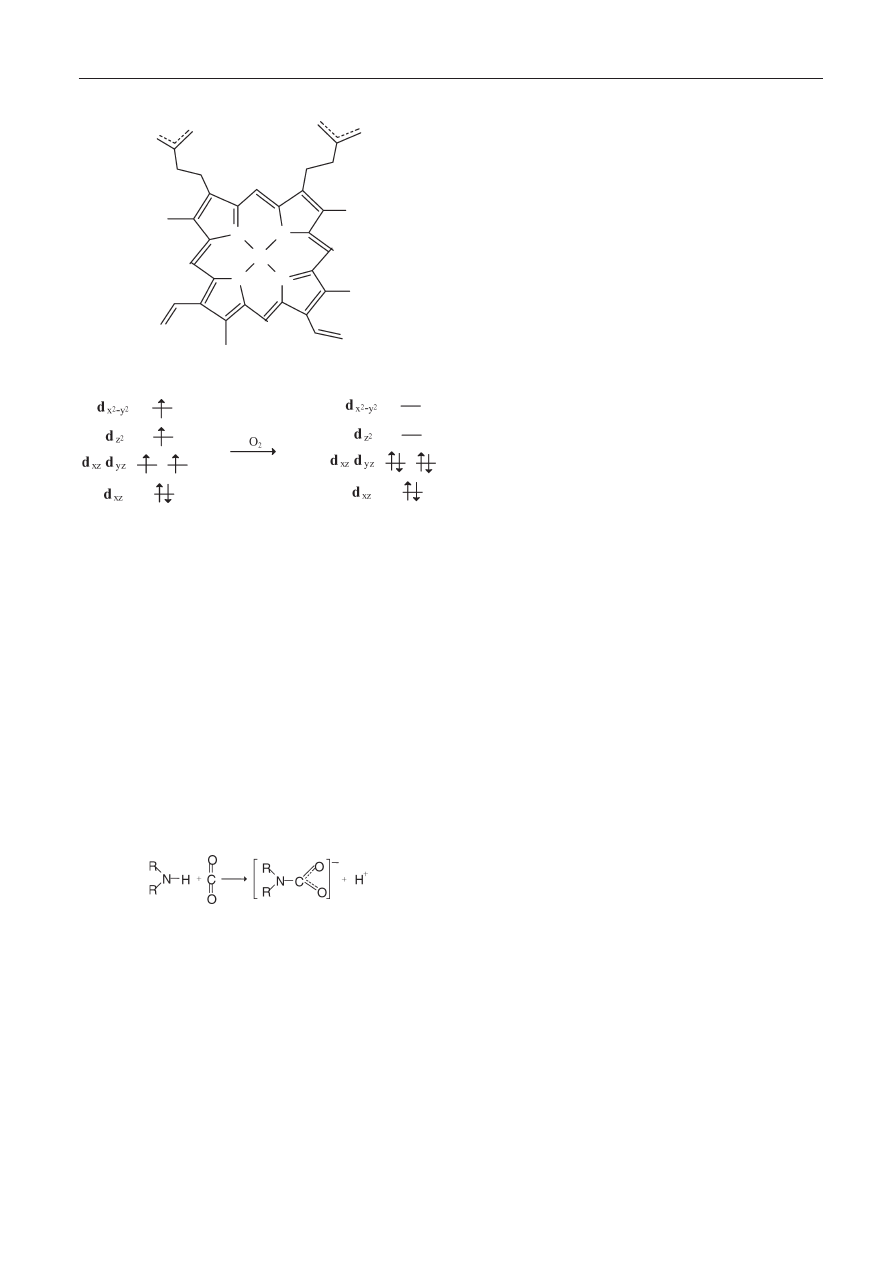
rząc hem (ryc. 1).
Jon żelaza(II) może tworzyć dwa dodatkowe wiązania,
każde po jednej stronie płaszczyzny hemu. Te miejsca wią-
zania nazywane są piątą i szóstą pozycją koordynacyjną. W
hemoglobinie piąta pozycja koordynacyjna jest zajęta przez
pierścień imidazolowy reszty histydyny pochodzącej z białka
[3], zaś szósta – przez tlen.
Związanie cząsteczki tlenu z szóstą pozycją koordyna-
cyjną zmienia układ elektronów w otoczeniu żelaza. Cząstecz-
ka tlenu, zajmując położenie trans- w stosunku do histydy-
nowego atomu azotu, zmienia natężenie pola ligandów i atom
żelaza przechodzi ze stanu wysokospinowego w stan nisko-
spinowy (ryc. 2).
Funkcje biologiczne wybranych pierwiastków i ich związków. I. Tlen – pierwiastek życia i śmierci
247
Mioglobina składa się z ośmiu helikalnych segmentów po-
łączonych zgiętymi fragmentami łańcucha, co tworzy zwartą,
niemal kulistą strukturę trzeciorzędową. Szczególnie ważne
w tej strukturze jest oddziaływanie hydrofilowe polarnych łań-
cuchów bocznych naładowanych elektrycznie, mających skłon-
ność do lokowania się na zewnętrznej powierzchni białka, gdzie
mogą być solwatowane przez cząsteczki wody. Niemniej waż-
ne dla stabilizacji struktury trzeciorzędowej białka jest tworze-
nie mostków dwusulfidowych między resztami cysteinowymi,
tworzenie wiązań wodorowych między pobliskimi aminokwa-
sami i powstanie przyciągania elektrostatycznego, zwanego
mostkiem solnym, między dodatnio i ujemnie naładowanymi
częściami różnych aminokwasów w białkach [9].
Hemocyjaniny zawierają miedź i wiążą jedną cząstecz-
kę O
2
na każdą parę jonów miedzi(I). Rozpuszczone we krwi
stanowią około 90-98% wszystkich obecnych białek. Postać
utlenowana hemocyjanin jest niebieska, nieutlenowana – pra-
wie bezbarwna. Występują tylko w mięczakach i stawono-
gach (skorupiakach i pajęczakach) [9].
Hemerytryny, zawierające w centrum koordynacji dwa
jony żelaza(II) skompleksowane przez białko (brak porfiry-
ny), wiążą jedną cząsteczkę tlenu. Postać utlenowana jest
zabarwiona na fioletoworóżowo, a postać nieutlenowana jest
bezbarwna [9]. Inne informacje dotyczące przenośników tle-
nu w organizmach żywych można znaleźć w wydawnictwach
książkowych [3, 9, 13].
TOKSYCZNOŚĆ TLENU I OZONU
Organizmy aerobowe – w tym człowiek – przystosowały się
w toku milionów lat ewolucji do życia w atmosferze zawiera-
jącej co najwyżej 1/5 tlenu. Nie czują się lepiej, gdy narażo-
ne są na działanie tlenu o wyższych stężeniach, wręcz prze-
ciwnie. Narządami najbardziej narażonymi na działanie tle-
nu są płuca i oczy. Oddychanie czystym tlenem znajdującym
się pod ciśnieniem 1 atmosfery przez 6 godzin prowadzi do
odczuwalnych zaburzeń dróg oddechowych. Podawanie tle-
nu przez kilkadziesiąt godzin uszkadza pęcherzyki płucne i
powoduje ich obrzęk. Jeszcze dłuższa ekspozycja powoduje
obumieranie nabłonka wyściełającego pęcherzyki płucne i za-
stąpienie ich komórek komórkami większymi. Wzmaga to wy-
twarzanie kolagenu i prowadzi do włóknienia płuc [7].
Nadmierne podawanie tlenu może być niebezpieczne dla
wcześniaków w inkubatorach. Dziesięciodobowy kontakt wcze-
śniaka z atmosferą zawierającą 35-40% tlenu powoduje zwę-
żenie naczyń krwionośnych oka, obumarcie naczyń doprowa-
dzających krew do siatkówki i wystąpienia groźnej choroby, czyli
zwłóknienia pozasoczewkowego. Na wskutek skurczu naczyń
siatkówki może dojść do utraty wzroku u niemowląt [8].
Niebezpieczne jest podawanie tlenu pod zwiększonym
ciśnieniem. Stwierdzono, że tlen podawany pod ciśnieniem
2-3 atmosfer wywołuje konwulsje, a dłuższa ekspozycja może
prowadzić do trwałych uszkodzeń mózgu i rdzenia kręgowe-
go [16]. Opisano także przypadki krwotoków ucha wewnętrz-
nego i głuchoty [2]. Zwierzęta i rośliny są jeszcze bardziej
wrażliwe na działanie tlenu pod podwyższonym ciśnieniem.
Przykładowo 15-godzinne działanie czystego tlenu pod ci-
śnieniem 6 atm. jest zabójcze dla wielu roślin, których ob-
umieranie poprzedzają takie objawy, jak odwodnienie i od-
barwienie liści [2].
Toksyczność tlenu jest związana z kumulacją w komór-
kach reaktywnych form tlenu, powstających w metabolizmie
tlenowym, powodują one bowiem uszkodzenia we wszyst-
kich klasach makrocząsteczek i wywołują stany patologicz-
ne, m.in. cukrzycę, miażdżycę, marskość wątroby, udar na-
czyniowy, nowotwory mózgu, chorobę Parkinsona, Alzheime-
ra, zespół Downa, rozedmę płuc, ostrą niewydolność nerek
[6]. Do fizjologicznych następstw działania stresu oksydacyj-
nego należą: obniżenie stężenia ATP oraz stosunku zredu-
kowanego glutationu do utlenionego (GSH/GSSG), a jedno-
cześnie zwiększenie stężenia jonów wapnia w cytoplazmie
Ryc. 1. Hem (Fe-protoporfiryna IX)
Fig. 1. Hem (Fe-protoporfirine IX)
O
O
O
O
N
N
N
N
Fe
–
–
Ryc. 2. Zmiany spinowe żelaza podczas wiązania O
2
w hemoglobinie
Fig. 2. Spin changes of iron during the bonding of O
2
in hemoglobine
Przyłączenie O
2
i utworzenie aduktu Fe
III
-O
2
–
zmniejsza
promień kowalencyjny żelaza [3], które następnie przemiesz-
cza się w środek płaskiego pierścienia porfirynowego i po-
wstaje kompleks oktaedryczny.
Przyroda skonstruowała elastyczny układ wiązania i uwal-
niania O
2
w zmieniających się w szerokim zakresie warun-
kach biologicznych. Niska wartość pH sprzyja uwalnianiu tlenu
z hemoglobiny, co ułatwia jego przenoszenie z krwi do in-
nych tkanek [13]. Powinowactwo bowiem hemoglobiny do tle-
nu zmniejsza się wraz ze zmniejszeniem pH z wartości 7,4
występującej w płucach, do wartości 7,2 w aktywnym mię-
śniu [3]. Tkanki o szybkim metabolizmie, takie jak kurczący
się mięsień, wykazują duże zapotrzebowanie na tlen i rów-
nocześnie wytwarzają duże ilości protonów i dwutlenku wę-
gla. Dwutlenek węgla stabilizuje deoksyhemoglobinę dzięki
oddziaływaniu z końcowymi grupami aminowymi, co prowa-
dzi do powstania grup karbaminianowych obdarzonych ła-
dunkiem ujemnym:
Stabilizacja struktury deoksyhemoglobiny sprzyja uwalnianiu
tlenu [3].
Hemoglobina ze związanymi protonami i CO
2
jest kiero-
wana z krwią z powrotem do płuc, gdzie uwalnia protony
oraz dwutlenek węgla i ponownie wiąże tlen, zatem hemo-
globina, obok transportowania tlenu, wspomaga także trans-
port protonów i dwutlenku węgla (około 14%) [3]. Do prze-
nośników tlenu należy także mioglobina, hemocyjanina i
hemerytryna [9].
Mioglobina jest pojedynczym białkiem peptydowym (glo-
bularnym), złożonym z 153 aminokwasów. Podobnie jak he-
moglobina zbudowana jest z hemu i niebiałkowej grupy pro-
stetycznej (pomocniczej), złożonej z protoporfiryny IX i cen-
tralnie usytuowanego żelaza(II) [8]. W hemoglobinie hem słu-
ży do przenoszenia CO
2
i H
+
, w mioglobinie jedynie do ma-
gazynowania tlenu, a w cytochromie C pełni funkcję przeno-
śnika elektronów.

H. Puzanowska-Tarasiewicz, L. Kuźmicka, M. Tarasiewicz
248
[14]. Efekty te są głównie następstwem uszkodzeń aktyw-
nych metabolicznie białek zawierających grupy SH, co po-
woduje zmiany w ich konformacji i aktywności [4].
Coraz więcej dowodów świadczy o tym, że szkodliwe czyn-
niki środowiskowe (promieniowanie jonizujące) oraz wiele
różnych ksenobiotyków (wielopierścieniowe węglowodory
aromatyczne) wzbudzają wytwarzanie ROS [2], które mogą
działać jako inicjatory i promotory karcynogenezy [5]. Jed-
nak do pewnych granic procesy uszkadzającego działania
ROS są pod kontrolą wewnątrz- i zewnątrzkomórkowych
czynników przeciwutleniających [1, 15].
Ozon, O
3
, alotropowa odmiana tlenu, powstaje w stratos-
ferze (15-50 km nad powierzchnią Ziemi) w wyniku działania
promieniowania słonecznego na cząsteczkę O
2
. Z kolei w tro-
posferze (warstwie atmosfery do wysokości 15 km) stężenie
ozonu rośnie zależnie od miejsca położenia [11]. Przyczyną
tego zjawiska jest przede wszystkim fotochemiczne utlenia-
nie spalin samochodowych (CO, C
m
H
n
), katalizowane przez
tlenki azotu. Jeszcze niedawno uważano ozon za gaz orzeź-
wiający, korzystny dla człowieka. Ponieważ powstaje on pod
wpływem wyładowań atmosferycznych, twierdzono, że orzeź-
wiające powietrze po burzy jest wynikiem podwyższonego
stężenia tego gazu.
Miejscowe działanie ozonu na organizm człowieka powo-
duje podrażnienia spojówek i błon śluzowych. Przy wyższych
stężeniach odczuwa się suchość górnych dróg oddechowych,
podrażnienie śluzówki nosa, gardła, kaszel, osłabienie, pod-
rażnienie oskrzeli. Czasem w kilka godzin po przerwaniu
narażenia może wystąpić obrzęk płuc, który może zakończyć
się śmiercią. Przewlekłe narażenie na ozon wywołuje bóle
głowy, osłabienie, duszność, senność, ograniczenie koncen-
tracji, zwolnienie akcji serca, zaburzenia widzenia.
Wysokie stężenia ozonu w atmosferze mają niekorzystny
wpływ na rośliny, zwierzęta i człowieka. Powodują m.in. za-
burzenie procesu fotosyntezy, uszkodzenia liści, punktowe
przebarwienia oraz przedwczesne starzenie się roślin. Ba-
dania przeprowadzone na zwierzętach wskazują na szybsze
starzenie się i przyspieszenie powstawania guzów płuc [17].
Ozon jest silniejszym utleniaczem niż tlen, używany jest
więc jako środek bakteriobójczy do odkażania wody wodo-
ciągowej, wody w basenach kąpielowych. Stosowany jest
również jako środek dezynfekujący żywność w chłodniach, a
także do bielenia tkanin, wosków, olejów mineralnych i ich
pochodnych, masy papierowej, cukru. Ponadto ozon znalazł
zastosowanie przy wytwarzaniu niektórych perfum, waniliny
i kamfory, w niszczeniu odpadów przemysłowych, przy su-
szeniu lakierów, farb drukarskich.
PODSUMOWANIE
Wszystkie substancje występujące w organizmach żywych
są związkami tlenu, zaś wolny tlen, podobnie jak jego związ-
ki, jest niezbędny do życia wszystkich istot żywych (z wyjąt-
kiem bakterii anaerobowych).
Wdychany przez człowieka tlen przez pęcherzyki płucne
dostaje się do krwi, gdzie wiązany jest przez hemoglobinę
(barwnik krwi) w czerwonych krwinkach i przez utlenowaną
hemoglobinę przenoszony do komórek. Przy udziale odpo-
wiednich enzymów utlenia się w nich do CO
2
i H
2
O. Uwalnia-
na w tych procesach energia zużywana jest do podtrzymy-
wania procesów życiowych, takich, jak: praca mięśni, ciepło
ciała itd.
W 1968 roku odkryto perfluorokarbony – związki naśla-
dujące funkcje hemoglobiny – mające zdolność transporto-
wania O
2
i CO
2
, a więc biorące udział w wymianie gazowej.
Dzięki dużej liczbie wiązań podwójnych, związek ten ma
zdolność wiązania tlenu. Spośród licznych perfluorokarbo-
nów, perfluorodekalina charakteryzuje się najkorzystniejszy-
mi parametrami biochemicznymi. Ten bioaktywny składnik
jest wykorzystywany w kosmetyce do odświeżania i odży-
wiania skóry.
W komórkach organizmów żywych, w wyniku przebiegu
reakcji biochemicznych, powstają reaktywne formy tlenu.
Niewielkie nawet wahania w stężeniu podstawowym ROS w
znaczący sposób wpływają na zmianę metabolizmu komór-
ki, ekspresję genów, modyfikacje protranslacyjne białek. Kiedy
stężenie wolnych rodników tlenowych przekroczy możliwo-
ści przeciwutleniające komórek, dochodzi do powstania stresu
oksydacyjnego (tlenowego), który jest przyczyną wielu cho-
rób oraz przyśpieszonego starzenia się organizmu [1]. Ko-
mórki wykształciły jednak skomplikowany mechanizm ochron-
ny przeciwko stresowi tlenowemu, niwelujący nadmiar ROS
poprzez neutralizację wolnych rodników i blokowanie wytwa-
rzania ROS.
PIŚMIENNICTWO
1. Ball S.: Antyoksydanty w medycynie i zdrowiu człowieka. Medyk. War-
szawa 2001.
2. Bartosz G.: Druga twarz tlenu. Wolne rodniki w przyrodzie. Wyd. Nauk.
PWN. Warszawa, 2003.
3. Berg J.M., Tymoczko J.L., Stryer L.: Biochemia. Wyd. Nauk. PWN. War-
szawa, 2005.
4. Dębski B. Milner J.A.: Molekularne mechanizmy przeciwnowotworowego
działania czosnku; rola reaktywnych form tlenu. Bromat. Chem. Toksy-
kol., 2007, 40, 223-228.
5. Gius D., Spitz D.R.: Redox signalling in cancer biology. Antioxid. Redox.
Signal., 2006, 8, 1249-1252.
6. Grzenkowicz J., Wojtkowiak D., Podhajska A.J.: Reaktywne formy tlenu
jako cząsteczki sygnałowe. Pol. J. Cosmetol., 2002, 2, 90-106.
7. Halliwel B., Gutteridge J.M.: Free radicals in biology and medicine. Oxford
University Press. Oxford, New York, 1999.
8. Halliwell B., Gutteridge J.M.: Oxygen toxicity, oxygen radicals, transition
metals and disease. Biochem. J., 1984, 219, 1-14.
9. Hay R.W.: Chemia bionieorganiczna. Wyd. Nauk. PWN. Warszawa. 1990.
10. Jeremy J.Y., Rowe D., Emsley A.M., Newby A.C.: Nitric oxide and the
proliferation of vascular smooth muscle cells. Cardiovasc. Res., 1999,
43, 580-594.
11. Lautenschläger K.-H., Schröter W., Wanninger A.: Nowoczesne compen-
dium chemii. Wyd. Nauk. PWN. Warszawa, 2007.
12. Lavallee M., Takamura M., Parent R., Thorin E.: Crosstalk between en-
dothelin and nitric oxide in the control of vascular tone. Heart Fail. Rev.,
2001, 6, 265-276.
13. Lippard S.J., Berg J.M.: Podstawy chemii bionieorganicznej. Wyd. Nauk.
PWN. Warszawa, 1998.
14. Marks D.B., Marks A.D., Smith C.M.: Basic Medical Biochemistry: A Cli-
nical Approach. Williams & Wilkins, 1996, 331.
15. Puzanowska-Tarasiewicz H., Starczewska B., Kuźmicka L.: Reaktywne
formy tlenu. Bromat. Chem. Toksykol., 2008, 41, 1007-1015.
16. Seńczuk W.: Toksykologia. PWN. Warszawa, 1990.
17. Zdrowie a skażenie środowiskowe i jego minimalizacja. Fundacja „Życie
w zdrowiu”. Białystok, 1999.
Adres: Helena Puzanowska-Tarasiewicz, Wyższa Szkoła Kosmetologii i Ochro-
ny Zdrowia w Białymstoku, 15-875 Białystok, ul. Krakowska 9; tel. 085-749-
94-30, e-mail: kuzmicka@uwb.edu.pl
Wyszukiwarka
Podobne podstrony:
Biologiczne działanie wybranych pierwiastków, szkola
36 Struktury morfologiczne plemnika i ich funkcja biologiczna
Tkanki nabłonkowe typy nabłonków i ich funkcje, BIOLOGIA MOJE PRYWATNE
Funkcje biologiczne pierwiastków
Funkcje biolog pierwiastków
PIERWIASTKI I ICH ZWIĄZKI
Hormony steroidowe (płciowe) – budowa, przykłady i funkcje biologiczne
biologia, gatunki kwiatow i ich opis, Akant kłujący Acanthus Spinosus Rodz: Acanthaceae - przez wysi
FUNKCJA RUCHU I MOWY ORAZ ICH W Nieznany
6 Przedstaw istotne?chy rysunku rastrowego i wektorowego oraz wybraną formę ich zapisu
13 geochemia wybranych pierwiastków
funkcje duchów w wybranych utworach literackich prezentacja maturalna
PORÓWNANIE BUDOWY ATOMÓW wybranych pierwiastków
pnom, Mechatronika, Semestr I, PNoM, Laborki, 11. Porównanie struktur i wlasnosci wybranych metali i
JAKOŚCIOWE OZNACZANIE WYBRANYCH PIERWIASTKÓW W ZWIĄZKACH ORGANICZNYCH
MODELE ATOMÓW WYBRANYCH PIERWIASTKÓW
biologia wybranych szkodnikAXlw Nieznany (2)
więcej podobnych podstron