
Politechnika Poznańska
Wydział Fizyki Technicznej
Kierunek: Fizyka Techniczna
Praca przejściowa
Temat pracy:
Cytometr przepływowy w technologii Lab on Chip dla obiektów
znakowanych radioizotopami.
Autor:
Emilia Władziewicz
rok III 2012/2013
semestr letni
Promotor pracy:
dr inż. Zbigniew Górski

Emilia Władziewicz
FT, Politechnika Poznańska
2
Spis treści
1.
Cel pracy ...................................................................................................... 3
2.
Cytometria przepływowa ............................................................................. 3
2.1.
Budowa i zasada działania cytometru ............................................ 3
2.2.
Sposób pomiaru parametrów badanych obiektów................................. 5
2.2.1.
Znakowanie obiektów ..................................................................................................5
2.2.2.
Detektory światła rozproszonego .................................................................................7
2.3.
Zastosowanie cytometrii przepływowej ................................................. 8
3.
Technologia Lab-on-a-Chip ........................................................................... 9
3.1.
Budowa lab on chipu ............................................................................ 10
3.2.
Technologie wytwarzanie układów lab-on-chip ................................... 11
3.2.1.
Kształtowanie termiczne ............................................................................................ 11
3.2.2.
Ablacja ....................................................................................................................... 11
3.2.3.
Druk 3D ..................................................................................................................... 12
3.2.4.
Nadbudowa Elektrochemiczna ................................................................................... 12
3.2.5.
Miękka litografia ........................................................................................................ 12
3.3.
Zastosowanie ....................................................................................... 13
3.4.
Dlaczego cytometry w lab on chip ........................................................ 13
3.5.
Zalety układów lab on chip................................................................... 14
4.
Plany na przyszłość ..................................................................................... 15
5.
Bibliografia ................................................................................................. 15

Emilia Władziewicz
FT, Politechnika Poznańska
3
1. Cel pracy
Celem pracy jest zapoznanie się z ideą cytometrii przepływowej oraz technologią
projektowania i wytwarzania układów Lab on Chip a następnie zaprojektowanie i wykonanie
struktury cytometru przepływowego dostosowanej do pomiaru radioaktywności drobin ciała
stałego lub komórek znakowanych izotopem beta minus promieniotwórczym.
2. Cytometria przepływowa
Słowo cytometria stanowi połączenie dwóch słów pochodzenia greckiego: cyto-,
oznaczającego komórkę, oraz -metria, czyli mierzyć [1]. Słowo „przepływowa” sugeruje, że
pomiaru komórek dokonuje się podczas ich przepływu.
Istotnie, cytometria przepływowa to metoda pomiaru parametrów morfologicznych
pojedynczych komórek, kryształów lub makrocząsteczek przepływających przez aparat w
strumieniu cieczy. Ważne jest takie wymuszenie ruchu zawiesiny, aby cząsteczki poruszały
się „gęsiego” [2, 3]. Wówczas możliwy jest pomiar parametrów każdej z nich poprzez
skierowanie wiązki światła, a następnie detekcji promieniowania:
przechodzącego i rozproszonego przez cząstkę
powstałego w wyniku jej wzbudzenia (fluorescencja)
emitowanego przez znacznik radioizotopowy.
2.1.
Budowa i zasada działania cytometru
Na układ cytometru przepływowego składają się:
kapilara, przez którą przepływają komórki; zapewnia laminarny przepływ zawiesiny;
układ hydrauliczny, wytwarzający strumień cieczy otaczającej badaną zawiesinę;
poprzez regulowanie prędkości wypływu i gęstości płynu buforowego, można
modulować prędkość, z jaką komórki przechodzą przez punkt pomiarowy;
komora, do której docierają cząsteczki po uformowaniu w liniową strugę; w niej
następuje pomiar;
źródło światła (najczęściej laser), które oświetla przepływające cząsteczki; światło
następnie ulega rozproszeniu oraz/lub wzbudza fluorescencję;
Emilia Władziewicz
FT, Politechnika Poznańska
4
układ optyczny, którego zadaniem jest skupienie wiązki światła na kolejnych
elementach przepływającej zawiesiny a następnie skierowanie na detektory światła
rozproszonego na obiektach pomiarowych oraz powstałego w wyniku fluorescencji;
układ elektroniczny, przetwarzający promieniowanie elektromagnetyczne na sygnał
elektryczny;
układ analizy, czyli oprogramowanie komputerowe umożliwiające interpretację i
obróbkę danych [4-7].
Najważniejszą częścią cytometru przepływowego jest komora, w której zachodzi pomiar.
Kiedy zawiesina do niej dociera, cząsteczki są już ustawione jedna za drugą. Laminarny
przepływ jest niezbędny do prawidłowego wykonania pomiaru – tylko w ten sposób światło
laserowe oświetli każdy z elementów. Ustawienie cząsteczek w ten sposób wymaga układu
hydraulicznego.
Efekt ułożenia cząsteczek „gęsiego” w odpowiedniej odległości od siebie uzyskuje się
poprzez jednoczesne wprowadzenie do kapilary cieczy buforowej, otaczającej badaną
zawiesinę.
Pojawiający się prąd laminarny powoduje skupienie się badanych cząsteczek w środku
strumienia. Poprzez modulację prędkości i ciśnienia cieczy buforowej można wytworzyć
pożądane odstępy między komórkami.
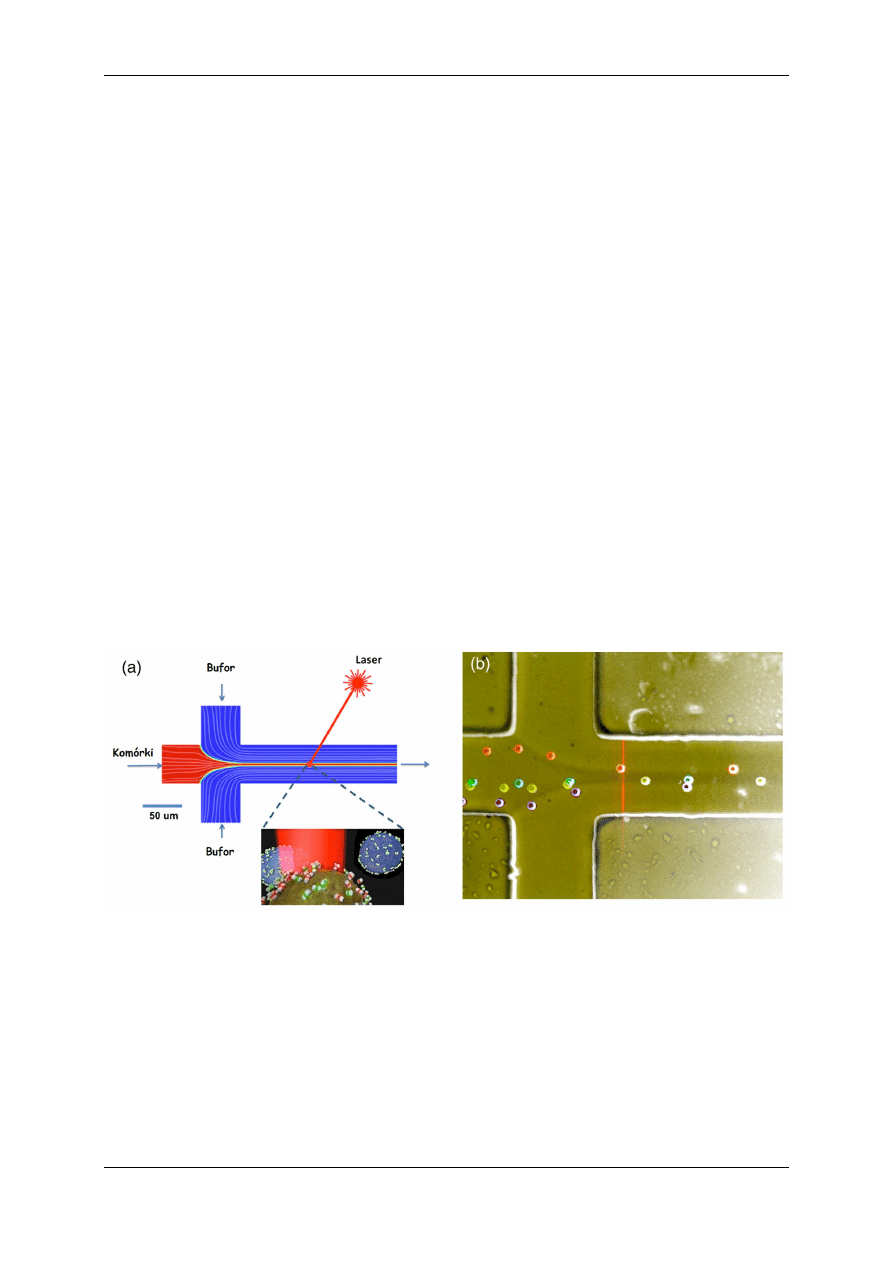
Rysunek 1. Wprowadzenie zawiesiny do kapilary [8]
Emilia Władziewicz
FT, Politechnika Poznańska
5
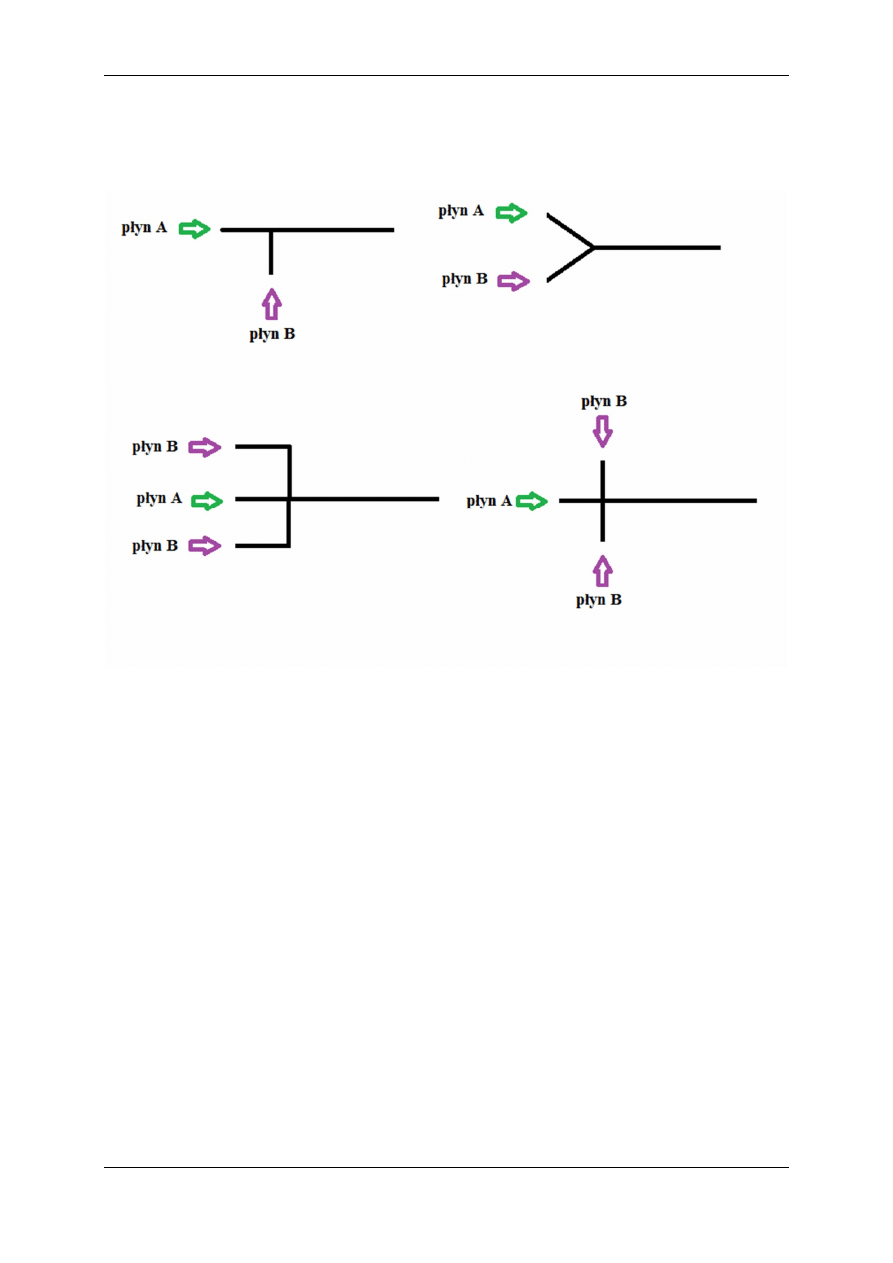
Kanał wejściowy może mieć różne kształty, najpopularniejsze są w kształcie litery T lub Y.
2.2.
Sposób pomiaru parametrów badanych obiektów
2.2.1. Znakowanie obiektów
2.2.1.1.
Fluorochromy
Jedną z metod detekcji cząsteczek przemieszczających się przed punktem pomiarowym jest
dołączenie do nich tzw. fluorochromów. Są to związki chemiczne, w których po
zaabsorbowaniu promieniowania następuje proces fluorescencji. W zależności od badanej
substancji stosuje się różne rodzaje fluorochromów, o odmiennych właściwościach. Jeżeli np.
jest potrzeba wykrycia struktur białkowych, do zawiesiny dołącza się fluorochrom, który
emituje światło jedynie przy połączeniu ze strukturą białka. Wówczas nawet, gdy dojdzie do
połączenia fluorochromu z każdym z elementów zawiesiny, detektor zarejestruje jedynie
Rysunek 2. Kształty kanałów wejściowych

Emilia Władziewicz
FT, Politechnika Poznańska
6
przepływające białka. Większość znaczników to produkty syntezy organicznej. Spośród
naturalnych stosuje się antybiotyki (np. nystatyna) i hormony (np. adrenalina). Każdy
znacznik fluorescencyjny ma inne właściwości. Różnią się one między sobą między innymi
długością fali, dla której następuje maksymalna absorpcja (wzbudzenie) oraz długością fali
maksymalnej fluorescencji (emisji). Parametry te zależą w dużym stopni od rodzaju
używanego rozpuszczalnika [9].
2.2.1.2.
Kropki kwantowe
Znakowania cząsteczek można dokonać także przy użyciu kropek kwantowych. Pochłaniają
one padające fotony tak jak tradycyjne barwniki, jednak proces absorpcji różni się jej
zakresem. Kropki kwantowe pochłaniają światło w zakresie znacznie szerszym niż
fluorochromy. Wartość energii emitowanego fotonu, a zarazem jego częstotliwość zależy od
wielkości kropki. Jest to spowodowane specyficzną budową kropek kwantowych, w których
elektron przeniesiony do pasma przewodnictwa może być wyobrażony jako swobodna
cząstka w studni potencjału. Wzrost objętości studni powoduje wzrost energii elektronu, a
zatem krótszą długość emitowanej fali. Ponieważ kropka kwantowa to nanokryształ o
wielkości określonej przez sposób otrzymywania, zatem dwa kryształy jednego związku
różniące się rozmiarami to dwie różne kropki kwantowe, chociaż chemiczne to wciąż ten sam
związek. Z tego względu wszystkie kropki kwantowe zastosowane w zawiesinie można
wzbudzać jedną długością fali, otrzymując dla różnych kropek różne położenia maksimum
emisji [10-12].
2.2.1.3.
Radioznaczniki
Inną metodą oznaczenia przepływających obiektów jest zastosowanie radioznaczników.
Wówczas do obiektów zawartych w zawiesinie wbudowuje się atomy pierwiastka
promieniotwórczego. Niestabilne izotopy pierwiastków ulegają rozpadowi emitując
promieniowanie jonizujące w postaci jąder helu (promieniowanie
), elektronów lub
pozytonów (promieniowanie
,
) oraz promieniowania
. Detekcja promieniowania
następuje przy użyciu detektora promieniowania jonizującego, np. scyntylatora. Nie istnieją
różnice pomiędzy własnościami chemicznymi izotopów tego pierwiastka, zatem zamiana
kilku atomów jednego izotopu na inny nie powoduje zakłóceń w kontrolowanych chemicznie
procesach biologicznych. Jest to duża zaleta znakowania radioizotopami, ponieważ każda
inna metoda prowadzi do zdecydowanie większej ingerencji w strukturę związku biologicznie
czynnego. Dołączane radioizotopy jedynie nieznacznie zmieniają szybkość procesów. W
przypadku markerów fluorescencyjnych lub kropek kwantowych może nastąpić zmiana
właściwości biochemicznych przez pogorszenie dopasowania centrów aktywnych do
substratu [13].
Wszystkie wymienione metody znakowania powodują występowanie
kinetycznych efektów markerowych – zmiana szybkości procesów kontrolowanych
procesami fizycznymi np. dyfuzją.
Emilia Władziewicz
FT, Politechnika Poznańska
7
2.2.1.4.
Markery ferromagnetyczne
Markery
ferromagnetyczne
to
znaczniki
składające
się
z
nanocząsteczkowego
ferromagnetyku i substancji sprzęgającej go z znakowanym obiektem. Wprowadzenie takiego
znacznika powoduje zmianę (nadanie własności) magnetycznych obiektom, co można
wykorzystać do śledzenia i programowania ruchu znakowanych obiektów.
2.2.2. Detektory światła rozproszonego
Znajdujące się w zawiesinie drobiny oddziałują ze światłem poprzez rozproszenie, odbicie,
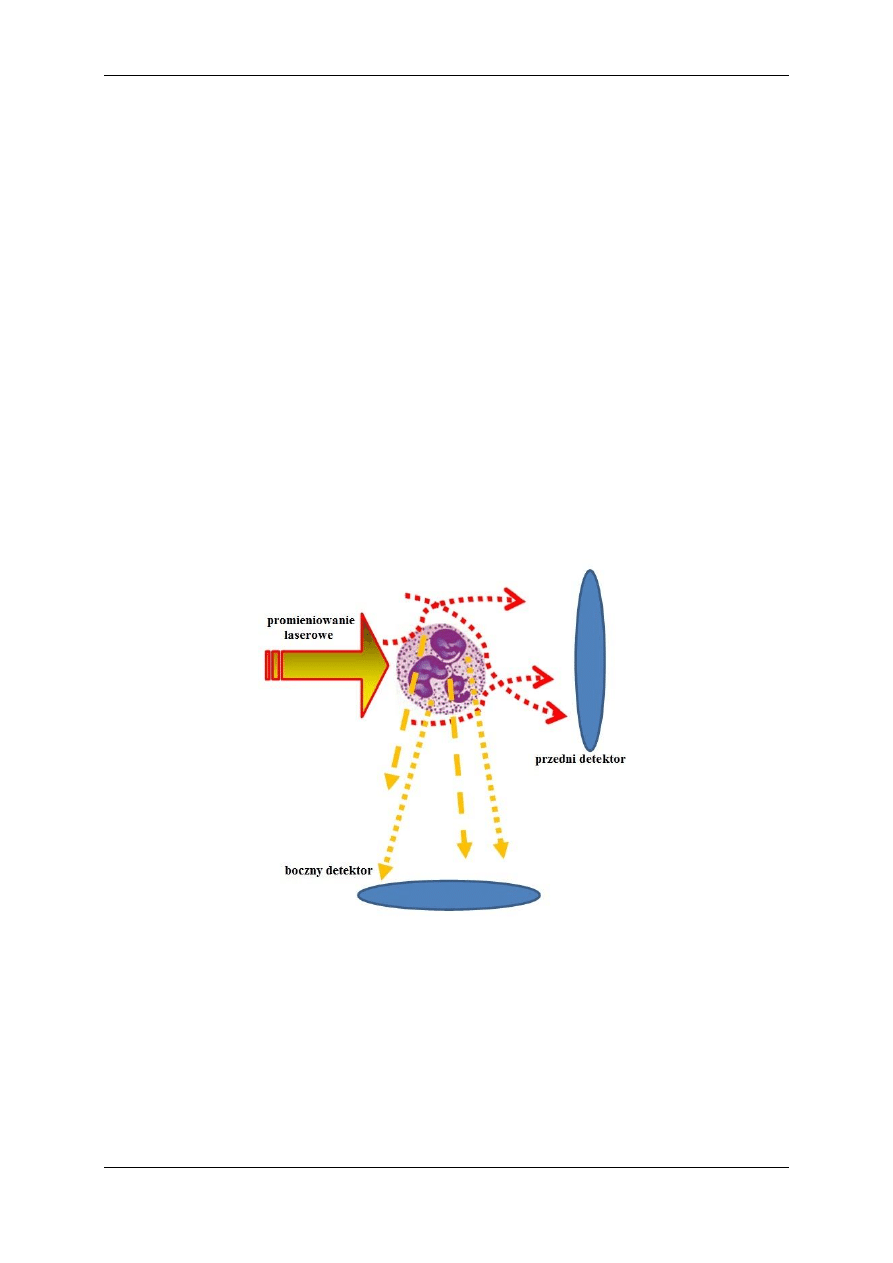
załamanie i absorpcję. Światło rozproszone jest rejestrowane przez dwa detektory – przedni i
boczny. Do przedniego dociera promieniowanie rozproszone pod małymi kątami, światło
rozproszone pod kątem 90
o
trafia do detektora bocznego [14].
Na rysunku 3 schematycznie przedstawiono ustawienie detektorów. Przedni to zwykle
detektor czterosegmentowy ustawiony tak, aby wiązka lasera nie powodowała jego aktywacji
lub główna wiązka lasera jest przesłaniana przez wnękę przechwytującą światło
przechodzące.
Analizując różnice w intensywności sygnału na każdym z detektorów możliwe jest uzyskanie
informacji o fizycznej strukturze przepływających elementów. Przedni detektor zbierając
Rysunek 3. Schemat ustawienia detektorów światła rozproszonego [4]

Emilia Władziewicz
FT, Politechnika Poznańska
8
światło ugięte na brzegach komórki (Rys. 3) rozróżnia komórki ze względu na ich rozmiary,
ponieważ im są one większe, tym mocniej rozpraszają światło, natomiast boczny ze względu
na ich gęstość (ziarnistość) – światło rozpraszane jest na wewnętrznych elementach
cząsteczki. Im bardziej skomplikowana wewnętrzna struktura komórki, tym więcej światła się
załamuje i trafia do bocznego detektora [2, 7].
2.3.
Zastosowanie cytometrii przepływowej
Cytometria przepływowa znalazła zastosowanie głównie w diagnostyce medycznej oraz
badaniach biotechnologicznych. Jednym z głównych nurtów pomiarów realizowanych w
układzie cytometru jest analiza immunofenotypu komórek, czyli ich indywidualnych cech
rozpoznawanych przez układ odpornościowy. W ten sposób możliwa jest diagnoza
nowotworu oraz ocena jego złośliwości, nawet w przypadku niewielkich ilości komórek
nowotworowych (początkowe stadium choroby lub zapowiedź jej nawrotu). Badania
cytometryczne stosowane są głównie w przypadku białaczek, nowotworów oraz chorób
układu immunologicznego, np. AIDS [6, 15].
Cytometrię przepływową stosuje się do analizy krwi, np. w transplantologii do wykonania
tzw. próby krzyżowej, tj. zbadania, czy w krwi biorcy nie znajdują się przeciwciała toksyczne
dla komórek dawcy. Analiza krwinek czerwonych jest niezbędna również w badaniach
antydopingowych w celu wykrycia nielegalnego transferu krwi oraz w ocenie populacji
krwinek czerwonych płodu w krążeniu matki. W alergologii cytometria przepływowa
umożliwia ocenę efektywności terapii odczulającej [16, 17].
Cytometria przepływowa jest wykorzystywana również przez botaników i producentów
nasion do badania komórek roślinnych oraz przez inspektorów środowiska do badania jakości
wody poprzez analizę skupisk fitoplanktonu [18].
Informacje uzyskiwane z pomiarów zbliżonych do cytometrycznych wykorzystuje się w
analizie wielkości mikro- i nanokryształów, sedymentacji zawiesin w płynach (analiza mgieł i
pyłów) oraz w sterowaniu procesami frakcjonowania zawiesin (procesy fluidyzacji i
hydrofluidyzacji).

Emilia Władziewicz
FT, Politechnika Poznańska
9
3. Technologia Lab-on-a-Chip
Cechą charakterystyczną nowoczesnych technologii jest postępująca wciąż miniaturyzacja.
Jeszcze do niedawna głównym skojarzeniem ze sformułowaniem „medyczne laboratorium
analityczne” było wyobrażenie pomalowanego na biało pomieszczenia wypełnionego
zaawansowaną aparaturą pomiarową, z mnóstwem próbówek i naczyń oraz skupionym na
pracy personelem posiadającym odpowiednie kwalifikacje, aby obsłużyć sprzęt i wykonać
analizę uzyskanych wyników. Trwające obecnie badania mają na celu zmniejszenie całej tej
infrastruktury w „pudełku” o powierzchni kilku centymetrów kwadratowych. Te pudełka
nazywamy układami lab-on-a-chip.
Układy lab-on-a-chip można zdefiniować jako miniaturowe zintegrowane elektromechaniczne
systemy, które mogą przeprowadzać procesy i reakcje chemiczne. Na pojedynczym układzie
(czipie) o rozmiarach rzędu centymetrów kwadratowych łączą one wiele funkcji laboratorium,
pracując w objętości płynów poniżej jednego pikolitra. Są często używane do wykonywania
żmudnych, powtarzających się czynności laboratoryjnych [19].
Rysunek 4. Wizualizacja technologii LOC [20]
Emilia Władziewicz
FT, Politechnika Poznańska
10
3.1.
Budowa lab on chipu
Można powiedzieć, że ile zastosowań, tyle różnych konfiguracji układów lab-on-a-chip. Ich
budowa oraz sposób działania zależą od przeprowadzanej analizy. Ten brak standaryzacji był
z początku przeszkodą dla masowej produkcji a co za tym idzie – zastosowania LOC-ów w
komercyjnych rozwiązaniach. Niezależnie od przeznaczenia, każda płytka musi łączyć w
sobie wszystkie funkcje laboratorium - powinno być miejsce na próbkę, obszar łączenia lub
rozdzielenia składników i przeprowadzenia reakcji oraz punkt pomiarowy.
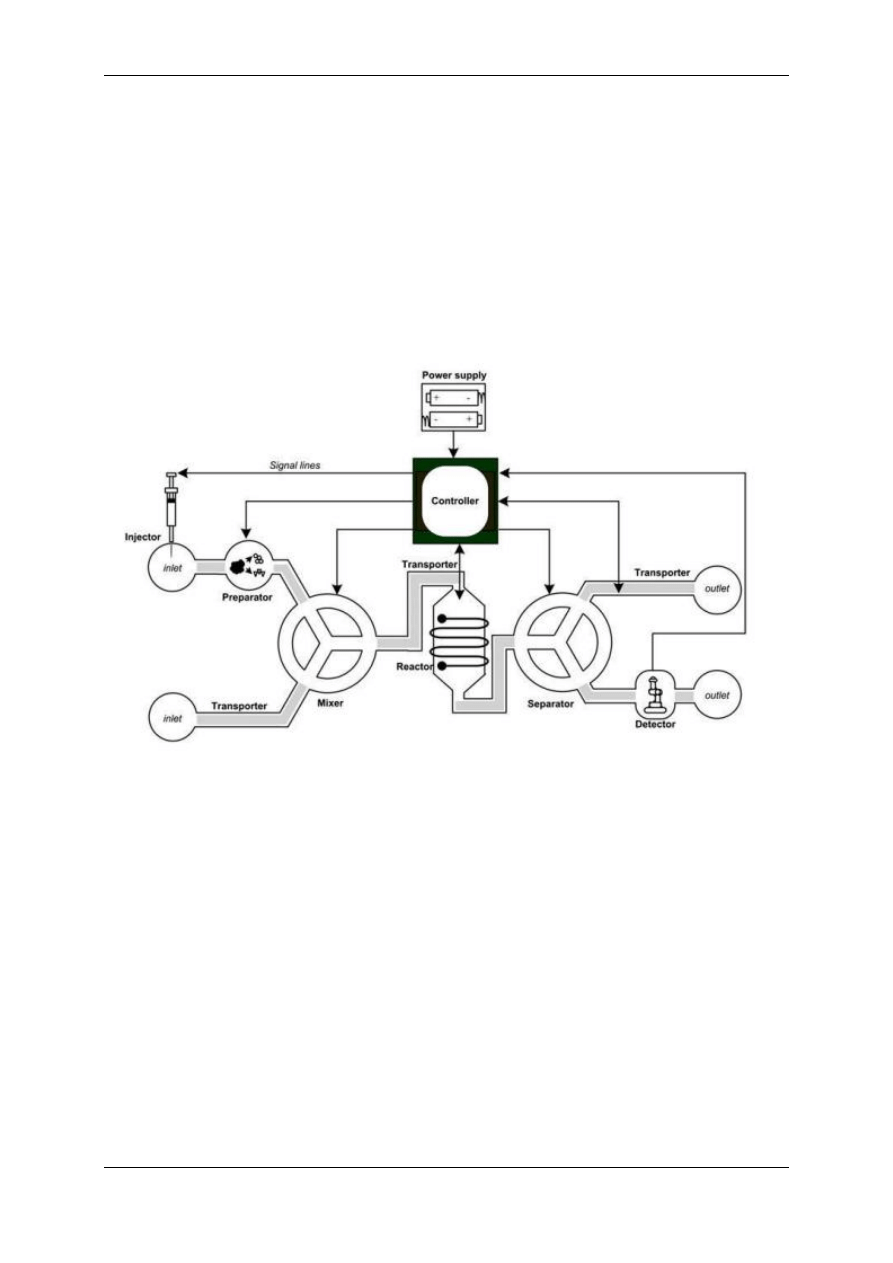
Rysunek 5 przedstawia jeden z przykładowych modeli układu lab-on-chip.
W ogólności możemy wyróżnić następujące elementy lab-on-chipu: dozownik, transporter,
koncentrator, mikser, reaktor, separator, detektor, sterownik oraz zasilacz.
Poprzez dozownik, którym może być np. w pełni zautomatyzowana elektroniczna pipeta,
wprowadzamy precyzyjnie odmierzoną ilość próbki na chip. Transporter odpowiedzialny jest
za kontrolę przepływu zawiesiny za pomocą odpowiednich mikropomp. W koncentratorze
następuje wydzielenie oznaczonych składników mieszaniny a w mikserze wymieszanie
niezbędnych reagentów. Z miksera próbka trafia do reaktora, będącego najważniejszym
miejscem chipu. W nim zachodzi pożądana reakcja. Po jej zakończeniu w separatorze
zachodzi rozdzielenie produktów. Po zarejestrowaniu sygnału przez detektor następuje
Rysunek 5. Modelowy schemat układu LOC [19]

Emilia Władziewicz
FT, Politechnika Poznańska
11
odprowadzenie produktów reakcji. Bardzo ważnym elementem układu lab-on chip jest
sterownik, który gromadzi uzyskane dane oraz kontroluje każdy z pozostałych elementów
nadzorując pracę całego chipu [19, 21].
Przedstawiony na rysunku chip oraz jego opis jest przykładem modelowym. W zależności od
przeznaczenia i charakteru pracy chipy różnią się między sobą budową i wyglądem.
3.2.
Technologie wytwarzanie układów lab-on-chip
Rozwijane są różne metody wytwarzania układów LOC, ponieważ różne są ich końcowe
przeznaczenia. Każda dziedzina wymaga innych konstrukcji, ważne jest też czy układ będzie
stosowany w przemyśle czy badaniach naukowych. Materiałami powszechni używanymi są
szkło oraz krzem. Alternatywą dla nich są polimery, zwłaszcza poli(metakrylan metylu)
(PMMA), gumy silikonowe, folie PCV czy papier, ponieważ są tańsze i potrzebują krótszego
czasu produkcji, nie tracąc przy tym na jakości.
Proces produkcji odbywa się techniką kształtowania termicznego, ablacji (frezowanie CNC,
wycinanie laserowe), druku 3D, nadbudowy elektrochemicznej lub miękkiej litografii [22].
3.2.1. Kształtowanie termiczne
Wyróżnia się dwa rodzaje tej techniki. Pierwszą z nich jest formowanie wtryskowe –
wtryskiwanie stopionego materiału do podgrzanej formy. Metoda ta jest wydajna, jednak
rzadko stosowana m.in. ze względu na wysokie koszty. Drugą metodą kształtowania
termicznego jest wytłaczanie na gorąco. Polega na dociskaniu podgrzanego krzemu lub
metalu do termoplastycznego arkusza np. PMMA aby odcisnąć pożądany kształt. Wytłaczanie
jest szybsze i tańsze niż wtryskiwanie jednak pojawia się problem spajania wytłocki z
segmentem zamykającym kanały układu [22].
3.2.2. Ablacja
Jest to proces usunięcia materiału z powierzchni ciała stałego metodą mechaniczną, ścierną
lub za pomocą lasera. Przy produkcji układów LOC stosuje się wieloosiowe maszyny CNC
wyposażone w narzędzia skrawające lub laser impulsowy do usuwania materiału z
powierzchni termoplastycznej, np. PMMA. Metoda ablacji jest tania, jednak posiada wiele
wad. Powierzchnia mikrokanalików jest chropowata, co wpływa na ich wydajność optyczną.

Emilia Władziewicz
FT, Politechnika Poznańska
12
Pozostają w nich drobiny zanieczyszczeń, które należy starannie usunąć. Szerokość
kanalików jest zwykle nie większa od
50
[22].
3.2.3. Druk 3D
Jest to jedna z metod polegających na wytworzeniu obiektu na podstawie trójwymiarowego
projektu stworzonego w programie typu CAD (z j. ang. Computer Aided Design). Polega na
nakładaniu warstwa po warstwie płynnego spoiwa na materiał w postaci proszku, tworząc w
ten sposób kolejne przekroje modelu. Metoda druku 3D jest szybka i stosunkowo tania.
Dokładność a zarazem dolna granica wymiarów tworzonych struktur zależy od dokładności
głowicy drukującej [23].
3.2.4. Nadbudowa Elektrochemiczna
Technika ta jest wykorzystywana do produkcji metalowych form, które są następnie używane
w procesach odciskania czy odlewania. Jednym ze sposobów tworzenia struktur do osadzania
metali jest komputerowe projektowanie ścieżek. Są to tzw. obwody drukowane PCB (z j. ang.
Printed Circuit Board). Wzór ścieżek przy użyciu druku termotransferowego lub fotografii
nanosi się na laminat pokryty miedzią, jedno- lub dwustronnie. Dzięki temu możliwe jest
umieszczenie z jednej strony struktury mechanicznej, a z drugiej elektronicznej części
sterującej [23].
3.2.5. Miękka litografia
Wymaga wykonania tzw. pieczątki z polidimetylosiloksanu (PDMS). Jest to rodzaj
przezroczystego, hydrofobowego polimeru. Na powierzchnię płytki z wytworzonym
kształtem (pozytyw kanału) wylewa się PDMS W ten sposób powstaje negatywowa forma
odlewnicza. Następnie na podkład tej formy wylewa się cienką warstwę PMMA lub żywicę
chemo-
lub termoutwardzalną, a
nawet
niskotopliwe stopy
metali które po
zestaleniu/usieciowaniu tworzą układ kanałów. Jest to bardzo precyzyjna metoda,
niewymagająca zarazem drogiego sprzętu, możliwa do wykonania w każdym laboratorium
[24].

Emilia Władziewicz
FT, Politechnika Poznańska
13
3.3.
Zastosowanie
Pierwszy układ do chromatografii gazu będący prototypem dzisiejszych układów lab-on-chip
został skonstruowany i opisany w 1979r. Autorzy pracy przewidywali wówczas, że użyta
przez nich technologia znajdzie szerokie zastosowanie w badaniu zanieczyszczeniu powietrza
i naukach biologicznych. Nie mylili się i być może nawet nie podejrzewali, że sztuka
budowania laboratorium na czipie znajdzie zastosowanie w aż tylu dziedzinach na tak szeroką
skalę [25].
Głównym miejscem, w którym wykorzystuje się systemy lab-on-a-chip są laboratoria
chemiczne i biotechnologiczne. Ze względu na szereg zalet LOC-ów, które szerzej omówione
zostaną w punkcie 3.5, naukowcy często wybierają pracę na mikrosystemach zamiast
tradycyjnych kolb i probówek. Te niewielkie czipy pozwalają chemikom na syntezę
cząsteczek i badania nowych materiałów a biologom umożliwiają badanie procesów
komórkowych. Wykorzystywane były przez badaczy między innymi do hodowli komórek
[26], rozdzielania składników krwi [27], izolacji materiału genetycznego z pojedynczych
komórek [28].
Praktyczne zastosowanie układy lab-on-chip znajdują w medycynie sądowej przy ustalaniu
ojcostwa czy poszukiwania przestępcy [29] czy badaniach środowiska [21]. Posiadają one
możliwości analityczne, dzięki którym mogą spowodować przełom w medycynie i szeroko
pojętej diagnostyce. Zwłaszcza na obszarach gdzie dostęp do placówek medycznych jest
utrudniony, przenośne miniaturowe urządzenia diagnostyczne będą bardzo przydatne [30].
Także w krajach rozwiniętych możliwość użycia jednorazowego minilaboratorium szybko
wykrywającego oznaki choroby, obecność wirusów czy bakterii oraz toksycznych substancji
znacznie usprawniłaby działanie służby zdrowia. Obecnie coraz więcej ludzi wyjeżdża na
wycieczki do krajów egzotycznych, co sprzyja rozprzestrzenianiu się zakażeń wirusowych.
Zastosowanie układów LOC jest tańsze niż tradycyjne badania, co pozwala odpowiednim
służbom działać w celu zapobieżenia epidemii [31].
3.4.
Dlaczego cytometry w lab on chip
Powodem budowy cytometrów przepływowych w technologii lab-on-a-chip jest przede
wszystkim rozmiar czipów. Kanaliki na ich powierzchni są kapilarami o średnicy od
10 do
100
, co gwarantuje laminarny przepływ zawiesiny. Jest to bardzo ważne w cytometrii, bo
dzięki temu możliwy jest precyzyjny pomiar każdego z przepływających elementów.
Ważnym powodem są wszystkie zalety wymienione w punkcie 3.5. Możliwa jest
minimalizacja próbki, co pozwala zmniejszyć koszty oraz skrócić czas przeprowadzanego
pomiaru. Wiele badań mogłoby zostać wykonanych „od ręki”, bez konieczności
kilkudniowego oczekiwania na wyniki lub w domu, bez angażowania wykwalifikowanego
personelu.

Emilia Władziewicz
FT, Politechnika Poznańska
14
Cytometry przepływowe wykorzystuje się nie tylko w szpitalach i laboratoriach
analitycznych, są wykorzystywane również „w terenie”. Inspektorzy środowiska wyposażeni
w cytometry na czipie mogliby badać jakość wody bez konieczności pobierania próbek,
konserwowania ich, opisywania i wysyłania ich do odległych laboratoriów.
Ponieważ cytometry wykorzystywane są do monitorowania przebiegu choroby lub oceny
postępu leczenia, zdecydowanym usprawnieniem służby zdrowia byłoby wyposażenie
pacjenta w urządzenie, które będzie mógł mieć przy sobie bez konieczności przebywania w
szpitalu czy ciągłych kontroli lekarskich. Możliwe jest także zrealizowanie czipu dozującego
leki na podstawie obrazu morfologicznego płynów ustrojowych. Pacjent prowadziłby
normalne życie, bez konieczności ciągłej obserwacji lekarskiej.
3.5.
Zalety układów lab on chip
Zgodnie z prognozami, „laboratoria na czipie” stopniowo będą wypierały tradycyjne
laboratoria chemiczne i analityczne z mnóstwem kolb, probówek i sprzętu. Co powoduje, że
wiązane są z nimi tak wielkie nadzieje? Główną zaletą układów lab-on-a-chip jest ich
wielkość. Małe rozmiary to przede wszystkim krótszy czas trwania badania. Co prawda czas
syntezy i analizy składników nie ulega zmianie, jednakże likwiduje się przerwy
międzyoperacyjne, uciągla się proces i eliminuje wpływ człowieka na przebieg procesu i
uzyskane wyniki. Profesor Graham Sandford przedstawia to obrazowo twierdząc, że dłużej
trwa dotarcie do chipu w laboratorium niż przeprowadzana analiza [32]. Dodatkowo dzięki
małym rozmiarom czipu do przeprowadzenia analizy potrzebne jest zdecydowanie mniejsza
objętość próbki, powstaje mniej odpadów chemicznych, co powoduje obniżenie kosztów.
Małe objętości płynów to także możliwość łatwiejszej kontroli ciśnienia i temperatury
przeprowadzanych procesów, a podgrzewanie lub chłodzenie próbek wymaga znacznie
krótszego czasu. Mikroczipy otwierają drzwi dla reakcji niebezpiecznych, mogących
zakończyć się eksplozją. Niektóre z takich reakcji w makroskopowych warunkach muszą być
przeprowadzane w temperaturze ciekłego azotu, aby zapobiec przegrzaniu reaktantów. Przy
użyciu małych objętości, reakcje te mogą przebiegać bezpiecznie w temperaturze pokojowej.
Jest to ważne ze względów ekonomicznych [33].
Niewielkie rozmiary układów LOC czynią z nich urządzenia przenośne. Próbki możemy
analizować natychmiast, w miejscu, gdzie jest to potrzebne, bez ich konserwacji konieczności
transportowania do odległego laboratorium. Umożliwia to również dokonanie analizy w
warunkach ciężkich bądź niedostępnych dla tradycyjnych metod diagnostycznych [34].
Emilia Władziewicz
FT, Politechnika Poznańska
15
4. Plany na przyszłość
W ramach pracy inżynierskiej wykonany zostanie układ lab on a chip dostosowany do
pomiarów cytometrycznych. Po przygotowaniu próbek znakowanych radioizotopem nastąpi
sprawdzenie poprawności wykonanego układu poprzez rejestrację rozkładu radioaktywności
drobin zawartych w przepływającej przez chip zawiesinie.
5. Bibliografia
[1] Internetowy słownik języka angielskiego Dictionary.com.
[2] Flow cytometry guide [online], [dostęp: 20 czerwca 2013r.], dostępne w Internecie:
<http://docs.abcam.com/pdf/protocols/Introduction_to_flow_cytometry_May_10.pdf>
[3] Baran J., Nowa epoka cytometrii przepływowej – przewodnik po współczesnych cytometrach i ich
zastosowanie, Postępy biologii komórki, Tom 35, 2008, Suplement nr 24, s. 3-15.
[4] Wojtaszewska Martyna, Cytometria przepływowa w pigułce [online], [dostęp: 20 czerwca 2013r.],
dostępne w Internecie:
<http://dolinabiotechnologiczna.pl/polecamy/cytometria-przeplywowa-w-pigulce/>
[5] Flow cytometry [online], [dostęp: 23 czerwca 2013r.], dostępne w Internecie:
<http://www.appliedcytometry.com/flow_cytometry.php>
[6] Muszyńska Marta, Cytometria przepływowa [online], [dostęp: 20 czerwca 2013r.], dostępne w
Internecie:
<http://www.e-biotechnologia.pl/Artykuly/Cytometria-przeplywowa/>
[7] Noatyńska Anna, Feret Dorota, Cytometria przepływowa jako metoda fenotypowania komórek
krwi.
[8] Pallaoro A., Hoonejani M, Braun G, Meinhart C, Moskovits M., Combined surface-enhanced
Raman spectroscopy biotags and microfluidic platform for quantitative ratiometric discrimination
between noncancerous and cancerous cells in flow, J. Nanophoton. 7(1), 073092 (May 09, 2013).
[9] Jóźwiak Zofia, Bartosz Grzegorz, Biofizyka. Wybrane zagadnienia wraz z ćwiczeniami. PWN.
Warszawa 2005r.
[10] Prokopowicz Zosia, Kropki kwantowe [online], [dostęp: 28 czerwca 2013r.], dostępne w
Internecie:
<http://bioinfo.mol.uj.edu.pl/articles/Prokopowicz03>
[11] Frąckowiak D., Staśkowiak E., Łukasiewicz J., Kropki kwantowe w biotechnologii i medycynie,
Postępy fizyki 2005, Tom 56, Zeszyt 1, s. 12-19.

Emilia Władziewicz
FT, Politechnika Poznańska
16
[12] Ugarte I., Castelló I., Palomares E., Pacios R., Quantum Dots as a Light Indicator for Emitting
Diodes and Biological Coding, Quantum Dots - A Variety of New Applications, Dr. Ameenah Al-Ahmadi
(Ed.), ISBN: 978-953-51-0483-4.
[13] Radiolabeling and Isotopic Markers – Introduction [online], [dostęp: 28 czerwca 2013r.],
dostępne w Internecie:
<http://www.radiolabeling.org/theory/>
[14] Burchardt D. et al., Cytometria przepływowa – możliwości zastosowania w diagnostyce klinicznej
zmian w obrębie jamy ustnej, Nowiny Lekarskie 2008, 77, 4, 324-329.
[15] Kaczmarek A., Mackiewicz A., Leporowska E., Osawa T., Rola i miejsce cytometrii przepływowej w
diagnostyce klinicznej, Współcz Onkol (2002), vol. 6, 6, 366-373.
[16] Stachurska A., Fabijańska-Mitek J., Zastosowanie cytometrii przepływowej w
immunohematologicznej ocenie krwinek czerwonych, Postępy Nauk Medycznych 7/2012, 583-588.
[17] Maślanka Tomasz, Wprowadzenie do cytometrii przepływowej, [online], [dostęp: 28 czerwca
2013r.], dostępne w Internecie:
<http://wet.uwm.edu.pl/wiedza-ogolna/artykul/wprowadzenie-do-cytometrii-przeplywowej-tomasz-
maslanka/>
[18] Marie D., Simon N., Vaulot D., Algal Culturing Techniques, Elsevier Inc. 2005.
[19] Lim Y., Kouzani A., Duan W., Lab-on-a-chip: a component view, Microsystem Technologies,
December 2010, Volume 16, Issue 12, pp 1995-2015
[20] Lab-on-chip [online], [dostęp: 23 czerwca 2013r.], dostępne w Internecie:
<http://www.gene-quantification.de/lab-on-chip.html>
[21] Kuteń Olga, Wykorzystanie mikroukładów ‘lab-on-a-chip’ w aparatach diagnostyki medycznej -
Tas, praca inżynierska, Wydział Chemiczny, PWr.
[22] Sollier E., Murray C., Maoddi P., Di Carlo D., Rapid prototyping polymers for microfluidic devices
and high pressure Injections, Lab Chip, 2011,11, 3752-3765.
[23] Pawłowski Ariel, Przepływowy mikrodetektor fluorescencyjny do oznaczania tlenku azotu, praca
inżynierska, Wydział Technologii Chemicznej, PP.
[24] Bartoszek-Bober Dobrosława, Jak odbić zimne atomy od płyty DVD, [online], [dostęp: 29 czerwca
2013r.], dostępne w Internecie:
<http://www.coldatoms.com/pliki/prezentacje/semdb6_plazmony.pdf>
[25] Terry S. et al., A gas chromatographic air analyzer fabricated on a silicon wafer, IEEE
Transactions on electron devices, vol d-26, no. 12, 1979.
[26] Jędrych E., Ziółkowska K., Chudy M., Brzózka Z., Miniaturowy system analityczny do hodowli
komórkowych, Przegląd elektrotechniczny, r. 86, nr. 10/2010.
[27] Hou et al., Microfluidic devices for blood fractionation, Micromachines 2011, 2, 319-343.

Emilia Władziewicz
FT, Politechnika Poznańska
17
[28] Streets A., Huang Y., Chip in a lab: Microfluidics for next generation life science research,
Biomicrofluidics 7, 011302 (2013).
[29] Liu P. et al., Integrated DNA purification, PCR, sample cleanup, and capillary electrophoresis
microchip for forensic human identification, Lab Chip, 2011, 11, 1041.
[30] Lisowski P., Zakrzycki P., Badania nad mikroprzepływowymi urządzeniami analitycznymi na bazie
papieru (µPADs) – przegląd literatury, Camera Separatoria, 2012, Vol 4, No 2, 135-149.
[31] Yager P. et al., Microfluidic diagnostic technologies for global public health, Nature, 2006, vol
442, 412-418.
[32] Hogan J., A little goes a long way, Nature, 2006, vol 442, 351-352.
[33] Guijt R. et al., Chemical and physical processes for integrated temperature control in microfluidic
devices, Lab Chip, 2003, 3, 1-4.
[34] Lab on a chip, Nature, vol 442, issue 7101.
Wyszukiwarka
Podobne podstrony:
PRACA PRZEJŚCIOWA OPTYMALIZACJA PROCESÓW ENERGETYCZNYCH POPRZEZ ZASOTOWANIE NOWOCZESNYCH ALGORYTMÓW
karta inf praca przejściowa projekt
Praca Przejściowa-1, Pomoce Naukowe 2, SEMESTR 6, technologia referat, technologia -projekt
Praca przejściowa
PRACA PRZEJŚCIOWA Robotyzacja w przemyśle
Praca przejściowa
PRACA PRZEJŚCIOWA Moja
Systemy informatyczne w biznesie, Praca przejściowa
PRACA PRZEJŚCIOWA PORADNIK, 6 OPRACOWYWANIE TREŚCI PRACY PRZEJŚCIOWEJ, OPRACOWYWANIE TREŚCI PRACY PR
Spis treści, Politechnika Lubelska, Studia, Studia, wszystkie, Praca przejsciowa
Praca+przejsciowa+wzor+v1 1, IMIR, I stopień, 6 semestr, Praca
PRACA PRZEJŚCIOWA PORADNIK, 1TEMAT PRACY PRZEJŚCIOWEJ, TEMAT PRACY PRZEJŚCIOWEJ
Praca przejściowa
Praca przejsciowa
Praca przejściowa ~$rta tematyczna
PRACA PRZEJŚCIOWA PORADNIK, załącznik 2 RYSUNEK WBS
PRACA PRZEJŚCIOWA PORADNIK, 5 POZYSKIWANIE WIEDZY NIEZBĘDNEJ DO NAPISANIA PRACY PRZEJŚCIOWEJ, POZYSK
Praca Przejściowa kopia
korekcja zębów, Polibuda (MiBM), Semestr VI, SKOWRON, Nowy folder, VI semestr, przejściówka, bilu, P
więcej podobnych podstron