
1.ANOMALNE WŁAŚCIWOŚCI LITU:
2.anomalne właściwości berylu
3. Termit Goldschmita (aluminotermia)
4. Roztwarzanie minii
5. otrzymywanie sody
6. azydek wodoru
7. Czy H2O2 jest utleniaczem?
8. Czy H2SO4 jest utleniaczem?
9. Otrzymywanie H2SO4 met. komorową.
10. Co to jest oleum?
11. Masło Cynowe
12. Co jest katalizatorem w reakcji otrzymywania NH3?
13.Dlaczego nie można gasić magnezu wodą?
14. metody oczyszczania boksytów.
15. Otrzymywanie Siarki
16. HNO3 jako akceptor i donor
17. H3BO3 w roztworach wodnych
18. Otrzymywanie potażu-K2CO3
19. Woda królewska
20. Struktura hydratów helowców (metoda z hydrohinonem)
21. Metoda weldona
22. Co to jest zielone złoto?
23. Jak pozbyć się nadmiaru chloru przy produkcji wapna palonego?
24. F3Cl-hybrydyzacja.
25. Złoto mozaikowe
25. Złoto mozaikowe
26. Odmiany metaliczne selenu, metody otrzymywania i właściwości.
27. Silany, silikony, siloksany.
28. Biel litoponowa
29. Diboran-B2H6
30. Budowa N2O5-otrzymywanie i właściwości
31. Wykazać właściwości utleniające i redukujące kw. arsenowego(III)
32. Hydroksylamina NH2OH -otrzymywanie i zastosowanie
33. Wapno chlorowane-otrzymywanie, wzór rzeczywisty.
34. Jakim związkiem wykrywamy CO w chemii analitycznej?
35. Karbonylki
36. ZW. NITRYLOWE
37. ZW. NITROZYLOWE
38.H2O2
39.Otrzymywanie Al
40.Fulereny
41.Kwas tiosiarkowy
42.Woda chlorowa i bromowa
43.Związki litowców na –1 stopniu utl.
44.Otrzymywanie siarki cząsteczkowej.

45.Struktura hydroboranu berylu - wł.
46.Pochodne karbonylków - otrzym.
47.Reakcja kwasu ortokrzemowego z H2O :
48.Boraks- wzór ,struktura.
49.Otrzymywanie Mg
50.Otrzymywanie Si
51.Otrzymywanie P.
52.Termiczny rozkład azotanów
53.Rozkład difosforanu P2H4
54.(CN)2-metody otrzym
55.Tetraazotek terrasiarki N4S4
56.TeCl4-struktura, hybrydyzacja
57.Cyjanamid wapnia
58.Który kwas z grupy 15-ej ma LK=6 ?
59.Chlorek tionylu i sulfurylu- otrzymywanie i hybrydyzacja:
60.Usuwanie chloru w przem. włókienniczym:
61.Hydrazyna. N2H4
62.Purpura Kasjusza:
63.Biały grafit BN
64.Antymon wybuchowy – otrzym.:
65.Ponadtlenek węgla
66.Diboran
67.Bizmutany
68. BH3
69. Rozkład termiczny KClO3 bez i z katalizatorem
70. Superfosfat podwójny – metody otrzymywania.
71. Kwas diazotowy – struktura i właściwości
72.PODTLENEK WĘGLA: C3O2
73. OKSOBORANY
74.KRZEMIANY PODZIAŁ
75. WĘGLIKI – PODZIAŁ I WŁAŚCIWOŚCI
76. odmiany alotropowe siarki z parzystą liczbą atomów siarki . otrzymywanie.
77. Borazyna –wzór strukturalny, reakcje z CH3OH.
78. KLASYFIKACJA Boranów.
79. LICZBA KOORDYNACYJNA 6 W xv GRUPIE.
80. PERBORAKS- BUD. OTRZYM. ZAST. WŁAŚC. FIZ. I CHEM.
81. SPINELE –BUDOWA, OTRZYMYWANIE, ZASTOSOWANIE.

82. DLACZEGO SELEN I TELLUR SĄ TRWALSZE W WYSOKICH TEMP.
83. STRUKTURA SO3 W STANIE GAZOWYM I STAŁYM.
84. ODMIANY ALOTROPOWE ARSENU – MET. OTRZYM. WŁAŚC. FIZYKOCHEM.
85. Perboraks.:
86. Kwas Pruski.
87.Wodorek magnezu.
88. REAKCJE
1.ANOMALNE WŁAŚCIWOŚCI LITU:
temp. top. i wrzeń. Li jest względnie wysoka w porównaniu z temp. wrzen. i top. Pozostałych litowców.
Lit jest dużo twardszy niż pozostałe litowce.
Lit reaguje z tlenem najmniej chętnie i tworzy się tlenek a nie nadtlenek jak w przypadku pozostałych litowców.
Lit jest pierwiastkiem najmniej elektrododatnim, dlatego wiele jego związków jest stosunkowo mało trwałych.
Li z N tworzy Li3N (azotek litu), co jest cechą charakterystyczną dla pierwiastków grupy II, niż pozostałych litowców.
Następujące sole litu: Li2CO3, LiF, Li3PO4 są w H2O stosunkowo trudno rozpuszczalne- analogicznie jak tego samego typu sole Mg, w
odróżnieniu od reszty litowców
LiOH jest w wodzie ok. 4 do 5 razy trudniej rozpuszczalny od wodorotlenków pozostałych litowców.
Jony Li są najsilniej hydratowane spośród pozostałych litowców (jony Mg są najsilniej hydratowane spośród berylowców).
LiHCO3 jest w H2O łatwiej rozpuszczalny od Li2CO3 co jest charakterystyczne dla berylowców w odróżnieniu od pozostałych litowców.
LiHS jest najmniej trwały od wodorosiarczków pozostałych litowców.
LiH jest bardziej trwały od wodorków pozostałych litowców i o wiele lepiej się rozpuszcza się w bezwodnych rozpuszczalnikach organicznych.
Lit tworzy imidek gdy pozostałe litowce nie tworzą imidków.
Lit w odróżnieniu od siarczków pozostałych litowców nie tworzy ałunów.
Związki litoorganiczne są kowalencyjne co jest raczej rzadkością u pozostałych związków organicznych litowców (duża lotność \,
rozpuszczalność w węglowodorach, lub w spolimeryzowanych ciałach stałych , czasem niektóre z nich zapalają się w kontakcie z powietrzem).
Lit rozpuszcza się w polarnych rozpuszczalnikach organicznych, pozostałe chlorki litowców w mniejszym stopniu.
lit nie tworzy związków na –1 st. utl.
2.anomalne właściwości berylu
małe rozmiary duży ładunek, tworzy związki o zdecydowanym udziale wiązania kowalencyjnego.
związki berylu rozpuszczają się w rozpuszczalnikach organicznych, natomiast w H2O ulegają hydrolizie. sole berylu charakteryzują się wysoką
temp. Top. w odróżnieniu od innych berylowców.
przejawia tendencje do tworzenia licznych związków kompleksowych w odróżnieniu od innych berylowców
beryl analogicznie jak glin roztwarza się w wodorotlenkach litowców lub w stopionych wodorotlenkach litowców w odróżnieniu od innych
berylowców: Be+2NaOH+H2O®Na2[Be(OH)4]+H2
Be+2NaOH
®T®Na2BeO2+H2
wodorotlenek berylu jest amfoteryczny w odróżnieniu od innych berylowców
beryl pod wpływem stężonego HNO3 ulega pasywacji pokrywa się warstewką pasywną BeO w odróżnieniu od innych berylowców
wodorek berylu jest wodorkiem kowalencyjnym w odróżnieniu od wodorków Ca, Sr, Ba
tlenek berylu ma sieć przestrzenną typu wurcytu sieć typowa dla związków o wiązaniach kowalencyjnych.
pozostałe tlenki mają wiązanie jonowe i typ sieci NaCl
beryl nie tworzy nadtlenków w odróżnieniu od innych berylowców
sproszkowany beryl i jego sole są silnie toksyczne.
3. Termit Goldschmita (aluminotermia)
Reagująca mieszanina drobnych ziaren aluminiowych z tlenkiem żelaza: 3Fe3O4+8Al®4Al2O3+9Fe do zapoczątkowania reakcji potrzebne jest
lokalne podgrzanie mieszaniny. Reakcja przebiega z wydzieleniem dużych ilości ciepła takich że wydzielone wolne żelazo ulega stopieniu.
ΔH=-3396kJ/mol. Termit G. Jest stosowny również do otrzymywania niektórych metali z ich tlenków.
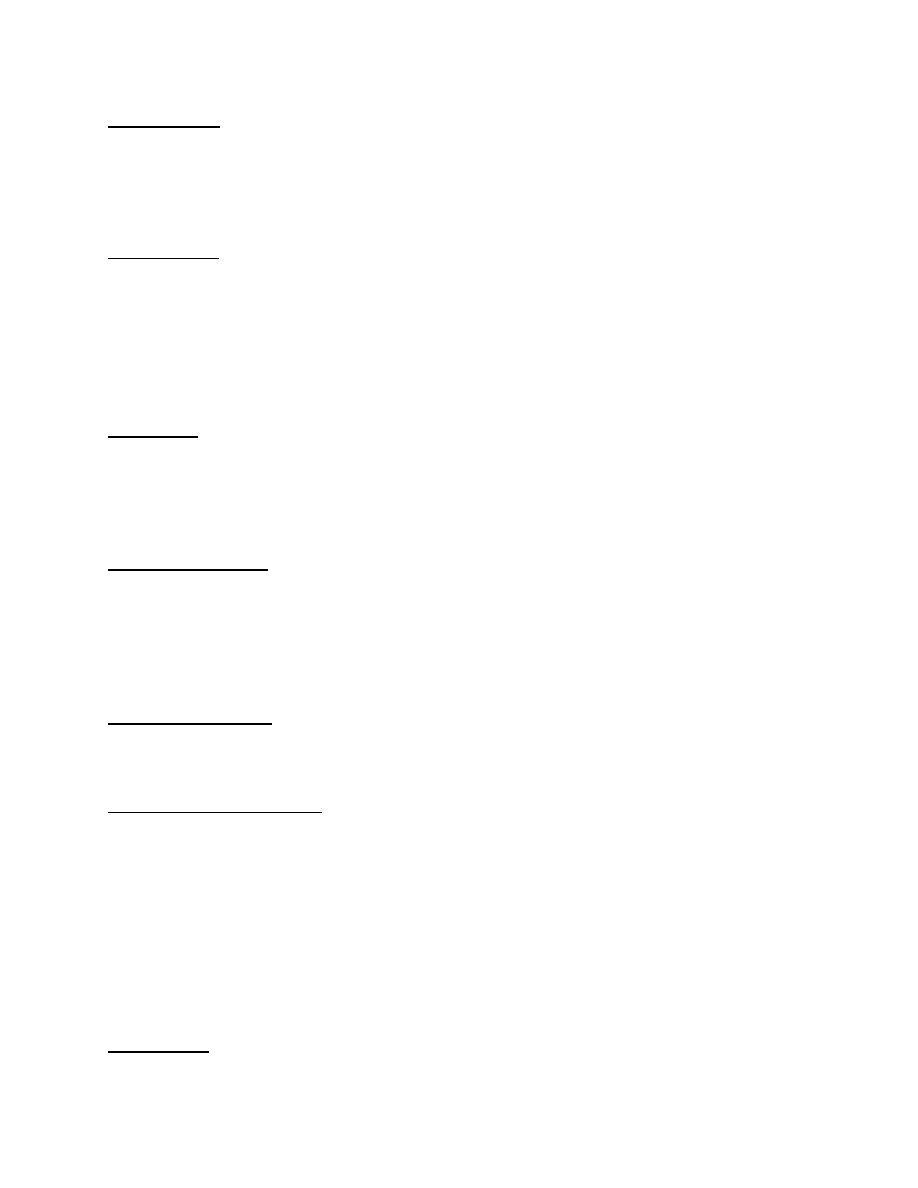
4. Roztwarzanie minii
Pb3O4 otrzymujemy przez utlenianie PbO tlenem atmosferycznym w temp. 770K. Minie można uważać za ortoołowian ołowiu (II) Pb2PbO4
gdyż zawiera ona 2 at. Ołowiu na drugim st. utl. i. jeden atom na IV st. utl. Podziałaniem HNO3 rozpuszcza się tylko częściowo a częściowo
przechodzi w PbO2. Pb3O4+4HNO3®2Pb(NO3)2+PbO2+2H2O. minia ma barwę czerwoną i służy do ochrony żelaza przed korozją.
Pb3O4+8CH3COOH®2Pb(CH3COO)2+ Pb(CH3COO)4+4H2O. Rozpuszczalność Pb(CH3COO)4 jest 4 razy mniejsza niż rozpuszczalność
Pb(CH3COO)2..
Pb(CH3COO)4jest utleniaczem.
5. otrzymywanie sody
met Leblanca: 2NaCl+H2SO4®Na2SO4+2HCl
Na2SO4+2C®Na2S+2CO2
Na2S+CaCO3®Na2CO3+CaS Na2CO3×10H2O (69%H2O)
met. Solwaya – polega na nasyceniu NaCl amoniakiem i CO2:
NH3+H2O+CO2®NH4HCO3
NH4HCO3+NaCl®NaHCO3+NH4Cl
2NaHCO3®(T)®Na2CO3+H2O+CO2
6. azydek wodoru
HN3 jest to kwas o mocy podobnej do CH3COOH jest to ciecz bezbarwna silnie trująca o niemiłym zapachu. HN3 ma budowę liniową H-N-N-N
co świadczy o hybrydyzacji sp środkowego at. (orbitalu) jon N3
¾
podobnie jak CN
¾
,SCN
¾
zaliczamy do pseudohalogenków jest on
izoelektryczny z CO2. azydki litowców i berylowców mają budowę jonową, w czasie ogrzewania ulegają rozkładowi na metal i azot (dys.
termiczna) bez wybuchu.
otrzymywanie HN3 : NH2+N2®T®NaN3+H2O
2NaN3+H2SO4(rozc)®Na2SO4+2HN3
reakcje
charakterystyczne 2HN3+I2®3N2+HI 3HN3®Pt®4N2+NH3
7HN3+6Me®N2H4+NH3+6MeN3.
7. Czy H2O2 jest utleniaczem?
nadtlenek wodoru w którym tlenowi przypisuje się stopień utl. –1 jest silnym środkiem utl. o czym świadczą potencjały standardowe elektrod na
których zachodzą procesy: H2O2+2H
+
+2e
®2H2O2
E=+1,77V
HO2
¾
+H20+2e®3OH
¾
E=+0,87V. Pod jego działaniem wydziela się
jod z zakwaszonych roztworów KI. Utlenia także liczne barwniki organiczne I
¾
+H2O2+H
+
®I2+H2O+1/2O2
(TiO)SO4-Siarczan tytanylu
bezbarwny pod wpływem H2O2 zmienia barwę na żółtą. W niektórych przypadkach nadtlenek wodoru wykazuje własciwości redukujące
obawiają się one w obecności niektórych substancji silnie utleniających np. nadmanganian potasu w rozt. kwaśnym, dwutlenek ołowiu lub tlenek
rtęci w środ. zas. 2MnO4
¾
+6H
+
+5H2O2®2Mn
2+
+8H2O+5O2 HgO+H2O2®Hg+H2O+O2
PbO2+2H
+
+H2O2®Pb
2+
+2H2O+O2
8. Czy H2SO4 jest utleniaczem?
Stężony kwas siarkowy w podwyższonej temp. wykazuje wyraźne zdolności utlen. Roztwarza wówczas niektóre metale szlachetne np. Cu lub
Hgredukując się równocześnie do SO2
Hg+2H2SO4®HgSO4+SO2+2H2O Gorący kw. siarkowy utlenia również niemetale np. C i S.
2H2SO4+C®CO2+2SO2+2H2O 2H2SO4+S®3SO2+2H2O W rozcieńczonych roztw. wodnych kw. siarkowy nie działa utlen.
9. Otrzymywanie H2SO4 met. komorową.
Produkcja kw. siarkowego w skali technicznej polega na otrzymaniu dwutlenku siarki, utlenianiu go do SO3 i związaniu z wodą w H2SO4.
SO2+1/2O2®SO3 Reakcja ta jest procesem egzoterm. w związku z czym równowaga w miarę podwyższania temp. przesuwa się w kierunku
rozkładu trójtlenku siarki. Im wyższa temp. tym mniej SO2 może się połączyć z tlenem. Utlenianie SO2 do SO3 może się więc odbywać z dobrą
wydajnością tylko w temp. niezbyt wysokich. W zakresie temp. 650-850K szybkość tego procesu jest jednak mała i staje się konieczne użycie
katalizatorów. W stosowanej dawnej metodzie komorowej rolę katalizatora odgrywały tlenki azotu wprowadzone do mieszaniny gazów. Zasada
działania: (komory ołowiane obecnie zastępowane wieżami), 1. Piece pirytowe-otrzymywanie SO2 ze spalania siarczków metali, 2. odpylacze-
oczyszczanie SO2 z pyłów, 3. w wieży Glovera wypełnionym materiałem kwasoodpornym zraszanej nitrozy czyli mieszaniny stężonego HNO3 i
stężonego H2SO4 kwas nitrozylosiarkowy tlenki azotu oczyszczone i gorące produkty z pieców pirytowych łączą się z tlenkami azotów i
powstaje część H2SO4 4. w komorach ołowianych powstaje główny H2SO4 (najmniej 3) 5. wieże Guy-Zussacca zawracanie tlenków azotu do
obiegu.
10. Co to jest oleum?Oleum czyli kwas dymiący jest to roztwór ok. 20% SO3 (w postaci H2S2O7) w H2SO4(98%) H2SO4+SO3®H2S2O7
w wyniku jego hydrolizy otrzymujemy H2S2O7+H2O powstaje 2H2SO4.
11. Masło Cynowe
Niektóre czterohalogenki wydzielają się z roztworów tworząc krystalohydraty np. hydrat czterochlorku cyny wydziela się jako SNCl4×5H2O w
postaci miękkiej masy zwanej masłem cynowym.
12. Co jest katalizatorem w reakcji otrzymywania NH3?
synteza amoniaku prowadzi się na katalizatorze żelaznym. Otrzymywanie katalizatora żelaznego polega na przetopieniu syntetycznego
magnetytu Fe3O4 z dodatkami Al2O3 oraz CaO i K2O jako promotorów. w reaktorze tlenek żelaza ulega redukcji do żelaza metalicznego i w tej
dopiero postaci jest katalitycznie czynny 2NH4Cl+Ca(OH)2®Fe(metaliczne)®CaCl2+2NH3+2H2O
13.Dlaczego nie można gasić magnezu wodą?
ponieważ magnez pali się nadal po umieszczeniu go w atmosferze pary wodnej. Magnez rozkłada wodę z wydzieleniem H2.
Mg+2H2O®Mg(OH)2+H2 podczas tej reakcji wydziela się duża ilość ciepła dlatego tworzy się MgO i pewne ilości Mg3N2.
14. metody oczyszczania boksytów.
znane są dwie metody: 1. alkaliczna a) metoda mokra polega na tym że zmielone boksyty poddaje się działaniu NaOH (trawienie) przy trawieniu
za pomocą NaOH glin przechodzi do roztworu w postaci glinianów NaAlO2 a żelazo pozostaje w fazie stałej {FeO(OH)}. wydzielenie Al(OH)3
z roztworu glinianu następuje pod działaniem CO2 2 NaAlO2+CO2+3H2O®2Al(OH)3+Na2CO3 Al(OH)3®T®Al2O3
b)metoda sucha
polega na tym że zmielone boksyty stapia się sodą i wapniem. Wodorotlenek glinu przechodzi w glinian
2AlO(OH)+Na2CO3®2NaAlO2+CO2+H2O z otrzymanego spieku ługuje się glinian sodu wodą.
2.metoda kwaśna – polega na
ługowaniu boksytów za pomocą H2SO4 i powstaje Al2(SO4)3.
15. Otrzymywanie Siarki
Siarkę elementarną otrzymuje się za pomocą siarki rodzimej.
metoda Frasha polega na wytapianiu siarki pod ziemią przy użyciu przegrzanej pary wodnej i wypychaniu cieczy na powierzchnię za pomocą
sprężonego powietrza. Zarówno przegrzaną parę wodną jak i powietrze wprowadza się przez specjalny układ rur umieszczonych w otworach
wiertniczych. Siarka wydobyta w ten sposób zawiera tylko drobne ilości zanieczyszczeń i nie jest poddawana dalszej rafinacji.
znaczne ilości siarki elementarnej uzyskuje się przy okazji oczyszczania gazu ziemnego od siarkowodoru. wydzielenie siarki z siarkowodoru
polega na jego katalitycznym utlenieniu – metoda Clausa. H2S+1/2O2®H2O+S.
zastosowanie siarki elementarnej: do wytwarzania SO2 jako produktu wyjściowego do otrzymywania kwasu siarkowego, jako środek
dezynfekujący (przemysł fermentacyjny) i bielący, znaczna ilość siarki stosuje się do wulkanizowania kauczuku, do otrzymywania dwusiarczku
węgla, ultramaryny i niektórych barwników organicznych. Preparaty siarkowe znajdują także zastosowanie w medycynie przy leczeniu chorób
skórnych a w rolnictwie do zwalczania pasożytów roślin.
16. HNO3 jako akceptor i donor
Cząsteczki HNO3 w zależności od warunków mogą spełniać role akceptora i donora protonów. Właściwości akceptorowe przejawia tylko
bezwodny kwas HNO3 oraz jego stężone roztwory. Bezwodne HNO3 ul erga autodysocjacji a następnie dehedratacji:
2HNO3®H2NO3
+
+NO3
¾
H2NO3
+
®NO2
+
+H2O
2HNO3®NO2
+
+NO3
¾
+H2O
(w temperaturze 230K dysocjacji takiej ulega 3/5 kwasu). HNO3 działa jako akceptor protonów również w
tedy gdy wprowadza się go do bezwodnych lub stężonych silniejszych od niego kwasów np. HclO4 lub H2SO4
HNO3+2HclO4®NO2
+
+2ClO4
¾
+H3O
+
HNO3+2H2SO4®NO2
+
+2HSO4
¾
+H3O
+
w rozcięczonych roztworach wodnych oraz w obecności słabszych od siebie kwasów HNO3 jest donorem protonów. i wykazuje silne
właściwości kwasowe: HNO3+H2O®H3O
+
+NO3
¾
HNO3 jest silnym utleniaczem:
3Cu+8HNO3®3Cu(NO3)2+2NO+4H2O
woda królewska HNO3+3HCl®Cl2+2H2O+NOCl
17. H3BO3 w roztworach wodnych

H3BO3-cząsteczki płaskie. W stanie stałym łączą się ze sobą za pośrednictwem wiązań wodorowych tworząc warstwy powiązane między sobą
tylko w skutek działania sił międzycząsteczkowych. W temp. powyżej 400K kw. ortoborowy traci część wody i przechodzi w kw. metaborowy:
H3BO3®HBO2+H2O-dehydratacja
Kw. ortoborowy jest bardzo słabym jednoprotonowym kwasem który w roztworach działa nie jako donor protonów lecz jako akceptor jonów
wodorotlenowych. Wykazuje więc właściwości kw. Lewisa. H3BO3+2H2O®H3O
+
+[B(OH)4]
¾
18. Otrzymywanie potażu-K2CO3
K2CO3-biały proszek, b. dobrze rozp. w wodzie, z roztworów krystalizuje w postaci hydratów (K2CO3×2H2O). Z kwasami rozkłada się dając
CO2. Jest to sól silnie higroskopijni, służy do wyrobu miękkich mydeł i szkła potasowego, ma również zastosowanie do osuszania
rozpuszczalników nieorganicznych (bezwodny potaż) oraz do otrzymywania innych soli potasu.
Dawniej potaż otrzymywany był na dużą skalę z popiołu drzewnego. Obecnie najczęściej w reakcjach:
1.2KCl+3(MgCO3×3H2O)+CO2®2(KHCO3×MgCO3×4H2O)+MgCl2
2(KHCO3×MgCO3×4H2O)®333K®K2CO3+2(MgCO3×3H2O)+3H2O+CO2 Strącającą się sól podwójną rozkłada się za pomocą CO2 na
MgCO3-nierozpuszczalne. K2CO3rozpuszczalne.
2.2KOH+CO2®K2CO3+H2O
3.K2SO4+Ca(OH)2+2CO®p=30atm®CaSO4+2HCOOK
2HCOOK+O2®K2CO3+CO2+H2O
4.Metoda Lablanca
2KCl+H2SO4®K2SO4+2HCl
K2SO4+2C®K2S+2CO2
K2S+CaCO3®K2CO3+CaS
K2CO3 nie jest otrzymywane met. Solvaya ponieważ jest zbyt mała różnica rozpuszczalności pomiędzy K2CO3 a KHCO3
19. Woda królewska
Woda królewska- mieszanina stężonego kw. solnego i azotowego w stosunku 3:1, która swe bardzo silne właściwości utleniające zawdzięcza
wydzielającemu się chlorowi i chlorkowi nitrozylu. 3HCl+HNO3®CL2+2H2O+NOCl Woda królewska działa na metale w następujący sposób:
Hg+4Cl
¾
+NO3
¾
+4H
+
®HgCl4
2×¾
+NO+2H2O. Wodę królewską możemy zastąpić mieszaniną H2SeO4 i HCl. H2SeO4 jest kwasem
mocniejszym od H2SO4 różni się od niego silnymi właściwościami utleniającymi. H2SO4 ma zdolności do wydzielania chloru z HCl, co
powoduje, że ma podobne właściwości do wody królewskiej.
20. Struktura hydratów helowców (metoda z hydrohinonem)
Klatraty stanowią specyficzny typ połączeń, w którym substancje macierzyste: hydrohinon, fenol, anilina, itd. krzepnąc okludują we wnękach
obecnych w sieci przestrzennej, cząsteczki obce np. SO2,H2S, HCl itd. Wnęki te mają zazwyczaj rozmiar średnicy kilkuset pm. Cząsteczki obce
zostają w nich uwięzione czysto mechanicznie be wytworzenia jakichkolwiek wiązań chemicznych. Najbardziej znanymi przykładami klatratów
tworzących się z udziałem helowców są Klatraty, których sieć macierzysta tworzy hydrohinon C6H4(OH)2. powstają one podczas krystalizacji
hydrochinonu z roztworów benzenowego lub wodnego, nasyconych argonem, kryptonem, lub ksenonem pod zwiększonym ciśnieniem. Zawierają
one nieco mniej niż jeden atom helowca na trzy cząsteczki hydrohinon.
Klatraty argonu uzyskany pod ciśnieniem 4MPa ma skład odpowiadający wzorowi: [C6H4(OH2]3∙0,8Ar
Klatraty ksenonu uzyskujemy pod ciśnieniem 1,4 MPa :[(C6H4(OH)2]3∙0,88Xe Gazy te można łatwo odzyskać rozpuszczając Klatraty np. w
alkoholu metylowym lub ogrzewając go do temp. 390K Klatraty tworzone są przez wszystkie gazy szlachetne z wyjątkiem helu.
Związkami typu klatratów są również hydraty helowców. W hydratach o wzorze Y∙5,75H2O (Y-at. helowca) cząsteczki wody krzepnącej w
obecności helowca układają się w taką strukturę krystaliczną że komórka elementarna zawiera 46 cząsteczek wody na 8 atomów helowca.
Pomiędzy uwięzionymi atomami helowca a cząsteczkami wody tworzącymi sieć przestrzenną kryształu, nie tworzą się wiązania a są tylko słabe
siły międzycząsteczkowe.
21. Metoda weldona
MnO2+4HCl→MnCl2+Cl2+2H2O do technicznego otrzymywania chloru
MnCl2+Ca(OH)2→Mn(OH)2+CaCl2

Mn(OH)2+1/2O2→MnO(OH)2
22. Co to jest zielone złoto?
Zielone złoto to stop 75%Au, 20%Ag, 5%In -stosowany w jubilerstwie.
23. Jak pozbyć się nadmiaru chloru przy produkcji wapna palonego?
CaCO3→T→CaO+CO2 dodajemy H2S Cl
¯
+H2S→Cl2+
Wapno palone otrzymujemy przez spalanie CaCO3:
CaCO3→T→CaO+CO2
Na tlenek działa się NH4Cl i wodą otrzymując CaCl2, po czym poddaje się skroplony chlorek elektrolizie.
24. F3Cl-hybrydyzacja.
W związkach międzyhalogennych AX3, AX5, AX7- fluor nigdy nie obejmuje roli atomu A, a wynika to stąd ze powłoka walencyjna fluoru
(powłoka L) nie zawiera orbitali d, które są nieodzowne do tworzenia tych związków.
ClF3- cząsteczka ta ma kształt litery T, atom chloru wykazuje w stanie podstawowym konfigurację elektronową 3s
2
p
5
ulega hybrydyzacji sp
3
d,
w którym bierze udział jeden z pustych orbitali 3d. łaczna liczba elektronów walencyjnych walencyjnych walencyjnych cząsteczce ClF3 wynosi
28. (rysunek)
25. Złoto mozaikowe
Otrzymuje się na drodze suchej SnS2
Sn+S2→T→SnS2 (złote płatki)
SnCl4+2H2S→SnS2+4HCl
Złoto mozaikowe w postaci złotych łusek znajduje zastosowanie jako złota farba malarska-używana do dekoracji.
26. Odmiany metaliczne selenu, metody otrzymywania i właściwości.
Selen tworzy dwie odmiany bezpostaciowe i cztery krystaliczne, podobnie jak siarka może tworzyć ośmioatomowe cząstki pierścieniowe,Se8,
oraz cząsteczki łańcuchowe o bardzo znacznej długości.
Cząsteczki pierścieniowe Se8wystepują w trzech nietrwałych krystalicznych odmianach: selen α, β i γ.Odmiany te mają barwę czerwoną, Są one
produktami przemian czerwonego selenu bezpostaciowego otrzymywanego przez kondensację par selenu.
Cząsteczki łańcuchowe – o znacznej długości, stanowiące odpowiednik siarki, występują w stopionym selenie wykazującym na skutek tego
znaczną lepkość. Przez nagłe ostudzenie takiego stopu uzyskuje się szary selen bezpostaciowy.
Selen szklisty – zawierający „zamrożone” cząsteczki łańcuchowe i stanowiący odpowiednik siarki plastycznej.
Selen szary (niekiedy zwany metalicznym ze względu na swój wygląd)– występują tu także cząsteczki łańcuchowe, najtrwalsza odmiana selenu,
Odmianę tą otrzymuje się jako ostateczny produkt ogrzewania innych odmian w temp. 470K. Selen szary wykazuje w ciemności bardzo słabe
przewodnictwo elektryczne. Wzrasta ono jednak o kilka rzędów pod wpływem naświetlania (fotoprzewodnictwo). Zjawisko to stanowi podstawę
działania fotokomórek selenowych. Selen w stanie gazowym występuje w postaci cząsteczek dwuatomowych.
27. Silany, silikony, siloksany.
Krzem tworzy z wodorem połączenia zwane salinami (dawniej krzemowodory) Ich struktura jest analogiczna do węglowodorów nasyconych i
wyrażają się wzorem: SinH2n+2. salinami o największej masie cząsteczkowej jest dekasilan Si10H22 oraz pentadekasilan Si15H32. Najprostszy
spośród krzemowodorów, to monosilan SiH4.
SiCl4 + LiAIH4 = SiH4 + LICI + AlCl3
W analogiczny sposób z sześciochlorku dwukrzemu, Si2Cl6, wytwarza się disilan, Si2H6:
2Si2Cl6 + 3LiAlH4 = 2Si2H6 + 3LiCl + 3AICl3
Metoda otrzymywania SiH4 polega na bezpośrednim uwodornianiu SiO2 pod p=49MPa w temp 450K lub krzemianów w eutektycznej
mieszaninie stopionych soli NaCl+AlCl3 zawierających rozdrobniony Al. Przypuszcza się, że jako produkt pośredni tworzy się b. nietrwały
związek AlHxCl3-x , a proces uwodornienia przebiega zgodnie ze schematem:
Al.+AlCl3→H2→AlHxCl3-x→SiO2→SiH4
Silany wykazują mniejszą odporność od alkanów:
Si5H12→T→Si2H6+SiH4+2/x∙(SiH)x
Ca2S4+bezwodny CH3COOH→(SiH2)n – produkt stały zwany posilanem.

(rysunek)
wszystkie silany – reagują gwałtownie z tlenem, a ich pary zapalają się w zetknięci z powietrzem (samorzutnie i wybuchowo rozkładają się na
powietrzu na SiO2 i H2O) z wodą czystą lub zakwaszoną nie reagują. W obecności śladów alkalidów ulegają szybkiej hydrolizie, dając
uwodornioną krzemionkę i wodór: SiH4+(n+2)H2O=SiO2 ∙nH2O+4H2
Silany są silnymi reduktorami: MnO4
¯
→MnO2
Hg
(II)
→Hg
(0)
Silany w temp. pokojowej reagują wybuchowo z fluorowcami (pochodne silanów-halogenosilany).
SiH4+HCl→Al2Cl6→SiH3Cl+H2 (SiH2Cl2,SiHCl3)
Jodek sililu SiH3I daje z sodem reakcję typu Wurtza
2SiH3I+2Na→Si2H6+2NaI,
2SiH3X→SiH2X2+SiH4 - r. dysproporcjonowania
Halogenosilany w obecności wody ulegają kondensacji z odszczepieniem odpowiedniego fluorowcowodoru HX.
H3-Si-Cl+H-O-H+Cl-Si-H3+H3Si-O-SiH3+2HCl
Produkty kondensacji zwane siloksanami-zawierające łańcuch złożony z atomów tlenu i krzemu, są bardziej odporne chemicznie niż silany.
Odporność chemiczną siloksanów można znacznie zwiększyć zastępując atomu wodoru organicznymi rodnikami alkilowymi-CH3 lub arylowymi
C6H5 W ten sposób uzyskuje się silikony-odznaczające się małą aktywnością chemiczną dużym zastosowaniem. Materiałem wyjściowym z
którego otrzymuje się silikony są alkilochlorosilany. Substancje te otrzymuje się zw. Grignarda na SiCl4 :
RMgCl+SiCl4→RSiCl3+MgCl2
Silikony zależnie od warunków ich otrzymywania produkuje się w postaci oleju i żywic.Duza odporność chemiczna i termiczna powoduje że
stosuje się je jako np. smary do sprzętu laboratoryjnego pracującego pod zwiększonym ciśnieniem. Trimetylochlorosilan (CH3)3-żywice
silikonowe-są skomplikowanymi produktami kondensacji i dobrym materiałem do wyrobu izolacji elektrycznej.
28. Biel litoponowa
BaS+ZnSO4→BaSO4+ZnS
Zastosowanie:
Jako biała farba malarska (Do bielenia ścian), materiał kontrastowy do wypełniania żołądka i jelit w badaniach rentgenologicznych i jako
materiał do wypełniania masy papierowej.
29. Diboran-B2H6
Synteza: 4BCl3+3Li[AlH4]→2B2H6+3LiAlCl4
B2O3+Al.+AlCl3+H2→480K,75MPa→B2H6+Al2O3+AlCl3
6LiH+8(C2H5)2O∙BF3→6LiBF4+8(C2H5)2O+B2H6
diboran-(dwuborowodór)-należy do najprostszych boranów, przypisuje mu się strukturę, w której dwa atomy wodoru tworzą mostek pomiędzy
obu atomami boruLrysunek)
Reakcje:B2H6+6H2O→2H3BO3+6H2
B2H6+2NaH→2NaBH4
30. Budowa N2O5-otrzymywanie i właściwości
Pięciotlenek dwuazotu otrzymuje się za pomocą odwodnienia kw. azotowego pięciotlenkiem fosforu:, 2HNO3+P2O5→N2O5+2HPO3 jest to
ciało stałe, bezbarwne o temp topnienia 314K, łatwo ulega rozkładowi na N2O4 i tlen. N2O5→N2O4+1/2O2. Z wodą łączy się energicznie dając
kw. azotowy, jest, więc bezwodnikiem tego kwasu.
N2O5-rozpuszcza się w stężonym kw. siarkowym, w którym ulega dysocjacji: N2O5+3H2SO4→2NO2
+
+3HSO4
¯
+H3O
+
. Cząsteczce w stanie
gazowym przypisuje się budowę O2N-O-NO2, w stanie stałym pięciotlenek dwuazotu ma strukturę jonową [NO2]
+
[NO3]
¯
i można go nazwać
azotanem nitroilu.
31. Wykazać właściwości utleniające i redukujące kw. arsenowego(III)
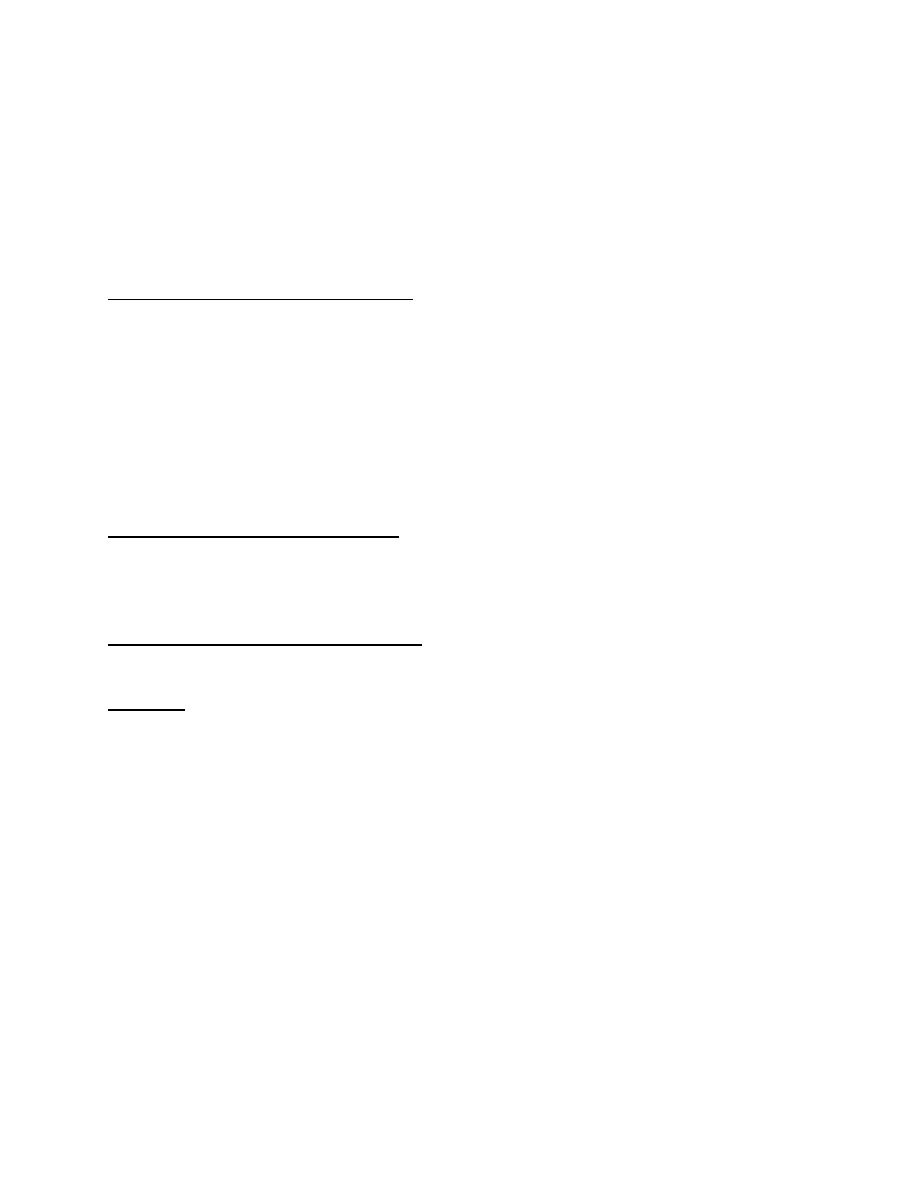
H3AsO3-zależnie od warunków może zachowywać się jak utleniacz lub reduktor. Właściwości utleniające - w roztworze kwaśnym utlenianiu
kw. arsenowym ulegać będą wszystkie układy redoks o potencjale standardowym niższym niż potencjał standardowy układu:
H3AsO3+3H
+
+3e→As+3H2O E
¯
=+0,2476V
Tak, więc kw arsenowy będzie ulatniać cynk metaliczny do Zn
2+
, wodór do H
+
, oraz jony Sn
2+
do Sn
4+
. równocześnie nastąpi redukcja
H3AsO3do wolnego arsenu: Zn
2+
+2e→Zn, 2H
+
+2e→H2, Sn
4+
+2e→Sn
2+
Właściwości redukujące kw arsenowego ukazuje reakcja: H3AsO3+H2O→H3AsO4+2H
+
+2e
Kwas arsenawy ulega utlenianiu pod wpływem HNO3, O2, H2O2, w roztworze obojętnym lub zasadowym kw arsenawy ulega także utlenianiu
pod działaniem roztworu jodu w jodku potasu. Reakcja ta znajduje zastosowanie w chemii analitycznej.
32. Hydroksylamina NH2OH -otrzymywanie i zastosowanie
Otrzymuje się zazwyczaj w postaci soli, które są bardziej trwałe od wolnej hydroksylaminy ulegającej łatwo rozkładowi. Siarczan
hydroksylaminy (NH3OH)2SO4, powstaje w czasie katodowej redukcji mieszaniny 50%-owego kw azotowego z 50%-owym kw siarkowym.
Produktem redukcji zachodzącej na katodzie ołowianej jest hydroksylamina: HNO3+6H2→NH2OH+2H2O która następnie z kw siarkowym
tworzy siarczan hydroksylaminowy: 2 NH2OH+H2 SO4→(NH3OH)
+
+SO4
2-
→(NH3OH)2SO4
NH2OH-wydzielina z soli substancja krystaliczna o temp top 306K , jest ona nietrwała-trwalsze są jej sole. Hydroksylamina w roztworach
wodnych a zwłaszcza w obecności kwasów wykazuje właściwości zasadowe jest jednak słabsza zasadą od NH3:
NH2OH+H2O→NH3
+
+OH
¯
Hydroksylamina zawiera azot na -1 st utl zależnie od warunków może przyjmować właściwości redukujące a niekiedy także utleniające.
Redukuje się sole rtęci(II) do rtęci(I), a następnie rtęci(I) do rtęci(0). Wydziela Cu2O z płynu Fehlinga, w roztworach kwaśnych utlenia ona
jodowodór do jodu, jony cyny(II) do cyny(IV).
33. Wapno chlorowane-otrzymywanie, wzór rzeczywisty.
Wapno chlorowane jest to produkt działania chloru no wodorotlenek wapnia, tani środek dezynfekcyjny, był uważany za sól mieszaninę kwasu
solnego i podchlorawego.
Cl2+Ca(OH)2→CaCl(ClO)+H2O W rzeczywistości stanowi on mieszaninę podchlorynu wapnia Ca(ClO)2∙4H2O z zasadowym chlorkiem
wapnia o składzie zbliżonym do CaCl2∙Ca(OH)2H2O
34. Jakim związkiem wykrywamy CO w chemii analitycznej?
I2O5+5CO→5CO2+I2 , I2O5-służy do wykrywania i oznaczania CO ponieważ utlenia CO do CO2, przy czym powstaje jod elementarny.
PdCl2+H2O+CO→Pd+2HCl+CO2 , PdCl2∙2H2O-również znajduje zastosowanie w chemii analitycznej do wykrywania CO.
35. Karbonylki
Karbonylki-zw.met. gr. przejści. z tlenkiem węgla. Zw. Kompleksowe, w których met. jest na 0 st.utl. Mogą być 1. jednordzeniowe M(CO)y,
2.dwurdzeniowe M2(CO)y,
3. wielordzeniowe Mx(CO)y.
Karbon. proste są tworzone przez metale o parzystej liczbie elekt. walencyj., wyj. karb. wanadu V(CO)6. karbonylki jako typowe zw.
kowalencyjne rozpuszczają się dobrze w rop. Organicznych.
SYNTEZA:
1. bezpośrednia synt. Met. i CO: najłatwiej otrzymać czterokarbonylek niklu
Ni + 4CO = Ni(CO)4: reakcja zachodzi w temp pokoj. i pod ciś. atmosf. jeżeli użyjemy metalu rozdrobnionego świeżo otrzymanego przez
redukcje. 2. synteza Co2(CO)8: 2CoCO3 + 2H2 + 8CO = Co2(CO)8 + 2CO2 + 2H2O
3. działanie CO pod ciś 20-30 MPa na zawiesinę halogenków odpowiednich metali w rozpuszczalnikach organicznych w obecności reduktorów
np.: synteza heksakarbonylku chromu Cr(CO)6 przeprowadzona z CrO3 i CO w obecności Al2O3 i sproszkowanego Al w zawiesinie benzenu.
4. Redukcja tlenków metali przejściowych przeprowadzona za pomocą CO pod wysokim ciśnieniem. Re2O7 + 17CO = Re2(CO)10 + 7CO2 5.
Karbonylki wielordzen. otrzym. przez ogrzewanie lub naświetlanie np. światłem nadfioletowym karbonylków prostych.
STRUKTURA: w karbonylkach jednordzeń. wiązanie H-C-O jest liniowe, heksakarbonylki wykazują strukture oktaedryczną. Przyjmuje się że
orbital ‘sigma’ powstaje na skutek pokrywania się orbitalu hybrydyzowanego atomu węgla zajętego przez parę elektronową w cząsteczce CO z
pustym orbitalem dx
2
y
2
atomu centralnego. Równoczesne pokrywanie się obsadzonych elektronami orbitali np. dxy z pustymi antywiążącymi,
orbitalami ‘pi*’ cząsteczki CO prowadzi do powstania orbitali ‘sigma’.

W karbonylkach wielordzeniowych obok liniowo związanych cząsteczek CO występują również cząsteczki CO tworzące mostek pomiędzy
dwoma atomami metalu.
W tym przypadku przyjmuje się zmianę hybrydyzacji atomu węgla z sp3 na sp2. Jeden z orbitali zhybrydyzowanych tworzy teraz wiązanie w
kombinacji liniowej z odpowiednim orbitalem atomu tlenu. Dwa pozostałe zostają wykorzystane do utworzenia wiązań z atomami metalu. W
ligandzie CO mogą utworzyć się zamiast dwóch tylko jedno wiązanie ‘pi’ , a mianowicie przy użyciu niezhybrydyzowanego orbitalu atomu
węgla. Wiązanie węgiel-tlen staje się teraz wyraźnie słabsze niż w wolnej cząsteczce CO.
36. ZW. NITRYLOWE
zw. zawierające grupę NO2 związaną kowalencyjnie, np z chlorkiem i fluorkiem tworzy się chlorek nitrylu: Cl2 + 2NO2 = 2NO2Cl. Jon
nitrylowy pojawia się w stanie stałym w solach nitrylowych np.: nadchloran nitrylu [NO2]+[ClO4]-, fluorofosforan nitrylu [NO2]+[PF6]-. N2O5
w stanie stałym występuje jako azotan nitrylu[NO2]+[NO3]-. Podczas autodysocjacji HNO3 powstaje jon nitrylowy 2HNO3 = NO2+ + NO3- +
H2O
37. ZW. NITROZYLOWE
zw. zawierające grupę NO. Może być ona związana kowalencyjnie np. halogenek nitrozylu NOCl, NOF, powstają w wyniku bezpośredniej
syntezy. Może występować w postaci jonu jednoujemnego np. nitrozyl sodu NaNO -powstaje w wyniku działania NO na roztwór sodu
metalicznego w ciekłym azocie. Może też w postaci kationu nitrozylowego NO+ np. w nadchloranie nitrozylu (NO)ClO4 kw nitrozylosiarkowy
NOHSO4. w stanie ciekłym i stałym NO ulega polimeryzacji. Cząsteczki pojedyncze (monomery) łączą się w cząsteczki podwójne (dimery).
38.H2O2
Metoda antrachinonowa- 2-etyloantrachinon rozpuszczony w mieszaninie odpowiednich rozpuszczalników organicznych redukuje wodę w
obecności katalizatora Ni do 2-etylo-9,10-antracenodiolu. Przez roztwór przepuszczamy powietrze co powoduje regenerację 2-etyloantrachinonu
i wydzielenie H2O2 (rysunek)
Elektroliza 2(NH4)HSO4→(NH4)2S2O8+H2
(NH4)2S2O8+H2O→T→2(NH4)HSO4+H2O2
kwas + nadtlenek BaO2+H2SO4→BaSO4+H2O2
Na2O2+H2SO4→Na2SO4+H2O2
H2O2-perhydrol-30% roztwór wody utl. Otrzymywany przez destylację frakcyjną pod zmniejszonym ciśnieniem.
H2O2 ma słabe właściwości kwasowe: H2O2+H2O→H3O
+
+OH¯, szybko się rozkłada 2H2O2→2H2O+O2
Silny środek utleniający świadczy o tym duży potencjał standardowy elektrod na których zachodzą procesy: H2O2+2H
+
+2e→2H2O E¯=+1,77V
H2O¯+ H2O+2e→3OH¯ E¯=+0,87
Pod jego działaniem wydziela się jod z zakwaszonych roztworów KI. Utlenia także liczne barwniki organiczne I
¾
+H2O2+H
+
®I2+H2O+1/
2O2
(TiO)SO4-Siarczan tytanylu bezbarwny pod wpływem H2O2 zmienia barwę na żółtą.
W niektórych przypadkach nadtlenek wodoru wykazuje własciwości redukujące obawiają się one w obecności niektórych substancji silnie
utleniających np. nadmanganian potasu w rozt. kwaśnym, dwutlenek ołowiu lub tlenek rtęci w środ. zas.
2MnO4
¾
+6H
+
+5H2O2®2Mn
2+
+8H2O+5O2 HgO+H2O2®Hg+H2O+O2
PbO2+2H
+
+H2O2®Pb
2+
+2H2O+O2
39.Otrzymywanie Al
AlCl3+3K→T→Al.+3KCl
Elektroliza stopionego Na[AlCl4]
Elektroliza stopionej mieszaniny boksytu, knolitu Na3AlF3 i fluorytu CaF2 w temp 1220K (rysunek)
40.Fulereny-to nowa odmiana cząsteczkowego węgla, posiadająca strukturę cząsteczkową. Są one pierwszą i jedyną trwałą odmianą czystego
węgla, bo fulereny nie potrzebują nie potrzebują żadnych dodatkowych atomów wysycających wiązania ni ich powierzchni w doróżnieniu od
diamentu i grafitu, które po przełupaniu natychmiast pokrywają się wodorkiem wysycającym ich zerwane wysycenia. Fuleren łatwo krystalizuje
dając pólprzezroczyste brązowe sześciokątne płytki gwiazdki o metalicznym połysku. Nie rozpuszczają się w wodzie ani w eterze rozpuszczając
się natomiast w węglowodorach i CCl4. Cząsteczki C60 (klastery o budowie piłki futbolowej) o unikalnym stabilnym kształcie można uzyskać
dzięki odparowaniu grafitu w silnym strumieniu helu. Cząsteczki te mają wyjątkowa trwałość co zawdzięczają doskonale symetrycznemu
kształtowi piłki futbolowej. Cząsteczka C60 zawiera 20 sześciokątów natomiast C70 ma 25 i przypomina piłkę do rugby każda z nich ponadto

musi zawierać 12 pierścieni pięcioczłonowych. W środku cząsteczki fulerenu (wewnątrz pustej) można umieścić atom metalu np. K, Cs, Za, V,
itd. Fuleren C60 zdołano uwodnić w dwóch etapach: C60+9H2→C60H18 , C60H18+9H2→C60H36.
Najbardziej interesujące możliwości zastosowania fulerenów pojawiają się w elektrotechnice. Wielka różnorodność tych materiałów umożliwia
ułożenie ich w postaci izolatorów, przewodników, półprzewodników i nadprzewodników (odpowiednie domieszkowanie). Łączac C60 z potasem
można otrzymać nową fazę metaliczną. C60F60 są to tzw. Piłki teflonowe, mogą być najlepszymi na świecie smarami. Fulereny łatwo wchodzą
w reakcje z fluorem dając związki charakteryzujące cię parzystą liczbą atomów fluoru w cząsteczce np. C60F36, C60F60. Fulereny tworzą
związki addytywne. Działając na zredukowane fulereny jodkiem metlu otrzymujemy jasnobrunatne ciało stałe składające się z mieszaniny
polietylowych fulerenów zawierających od 1 do 24 grup metylowych. Etylowanie C60 i C70 stwarza możliwość wprowadzenia do cząsteczki
fulerenów także innych grup funkcyjnych co umożliwia wykorzystanie pochodnych fulerenów jako odczynników w syntezach chemicznych.
41.Kwas tiosiarkowy
Kwas tiosiarkowy w stanie bezwodnym został otrzymany działaniem chlorowodoru na tiosiarczan sodu w roztworze eteru dietylowego w temp.
195 K (-78°C)
Na2S203 + 2HCl = H2S203 + 2NaCl
Jest to substancja bardzo nietrwała, która w czasie ogrzewania już poniżej 273,15 K ulega rozkładowi:H2S203→H2S+S03
Trwałe są natomiast sole tego kwasu - tiosiarczany. Otrzymuje się je najdogodniej przez ogrzewanie roztworu odpowiedniego siarczynu z siarką,
np.: Na2S03 + 1/8S8 = Na2S203
lub też przez utlenianie wielosiarczków tlenem z powietrza: Na2S2+ 302 = Na2S203
Pod wplywem kwasów tiosiarczany ulegają rozkładowi, który zwykle jest przedstawiany za pomocą reakcji: Na2S203 + 2HCI = 2NaCl + 1/xSx +
SO2+ H20
W rzeczywistości proces ten jest bardziej skomplikowany, gdyż zależnie od warunków tworzy się także siarkowodór, polisiarczki wodoru, kwas
siarkowy, politioniany. Na uwagę zasługuje fakt, że siarka wydziela się częściowo w formie cyklo-oktasiarki, S8a częściowo w formie cyklo-
heksasiarki, S6. Spośród soli kwasu tiosiarkowego największe znaczenie ma tiosiarczan sodu, Na2S203 ∙5H2O, bezbarwna substancja krystaliczna
używana w fotografii jako utrwalacz. Znajduje on także zastosowanie w przemyśle włókienniczym jako substancja służąca do usuwania resztek
chloru użytego do bielenia tkanin:
S2O3
2-
+ 4CI2 + 5H20 = 2S04
2-
+ 8CI¯ + 1OH
+
Słabiej od chloru utleniający jod utlenia tiosiarczan do czterotionianu:
I2 + 2Na2S203 = 2NaI + Na2S206
Reakcja ta stanowi podstawę działu analizy miareczkowej zwanego jodometrią. Jon tiosiarczanowy ma strukturę analogiczną do struktury jonu
siarczanowego z tą tylko różnicą, że zamiast jednego atomu tlenu zawiera atom siarki (rys)
W związku z tym centralnemu atomowi siarki przypisujemy stopień utlenienia VI, a skrajnemu atomowi -II.
42.Woda chlorowa i bromowa
Chlor i brom rozpuszczają się w wodzie dosyć dobrze w temp 298K w 1 objętości wody rozpuszcza się 2,26 objętości chloru, a w 100 cz. mas.
Wody rozpuszcza się 3,55 cz. mas. bromu dając wodę bezbarwną chlorową i brunatną wodą bromową używaną w laboratorium jako utleniacz. W
czasie krzepnięcia tych roztworów wydzielają się kryształy hydratów Cl2∙8H2O, i Br2∙10H2O.
43.Związki litowców na –1 stopniu utl.
Związki te tworzą Rb,Cs,K i Na; Li nie tworzy. Do tego rodzaju związków należą kryptaty. Kryptaty tworzą trwałe kompleksy z kationami
litowców. Jeżeli doda się 2 mole litowca więcej w stosunku do kryptatu, to połowa tego litowca przechodzi w formę kationową, a druga na
skutek solwatacji przechodzi w jednoujemny anion. Np.:
Sodek kryptatu(I) - [Na(kryptat)]
+
[Na
-
]
Rys.
44.Otrzymywanie siarki cząsteczkowej.
Siarke taką otrzymujemy w reakcji wodorków polisiarki H2Sn z chlorkami polisiarki Cl2Sn. Np.: H2S8 +S4Cl2 = 2HCl+S12
45.Struktura hydroboranu berylu - wł.
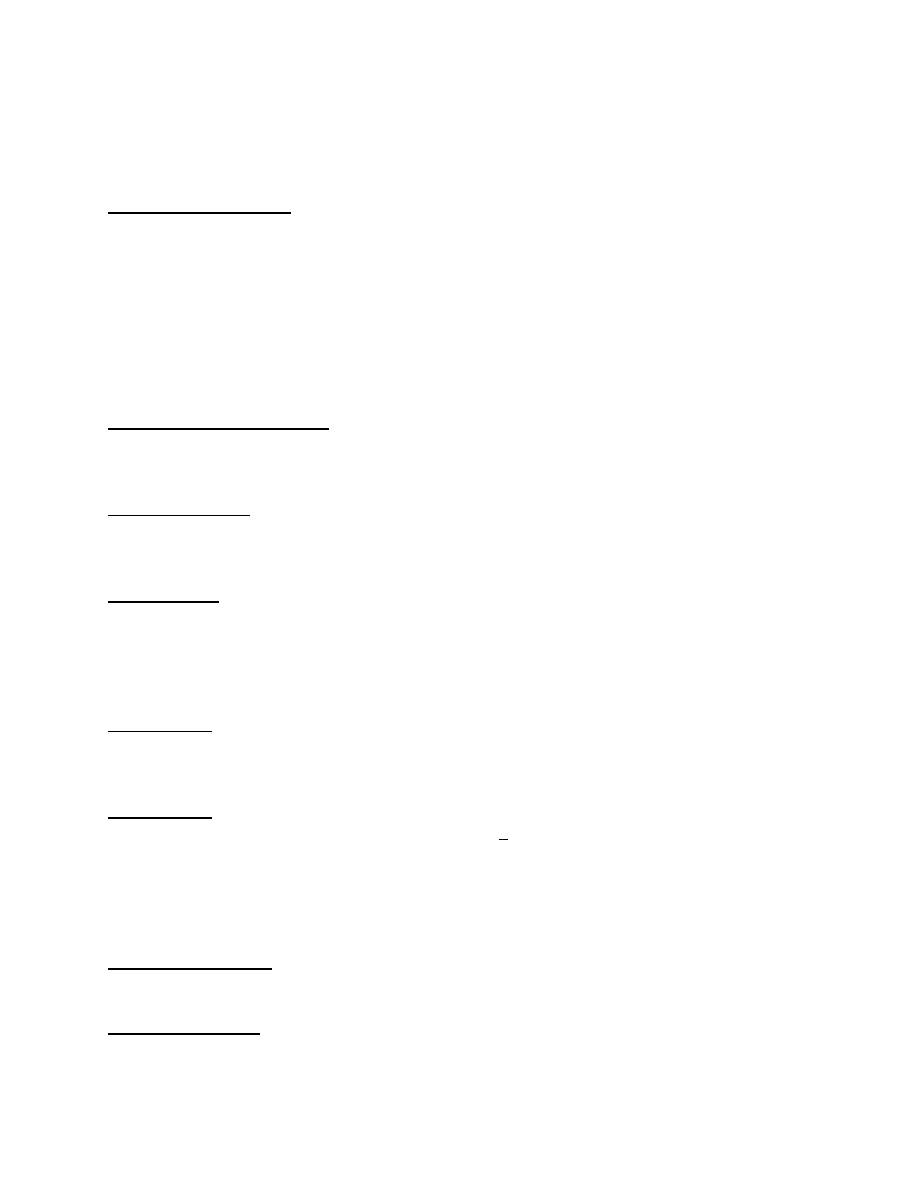
Be(BH4)2 . Hyd.ber., glinu i niektórych pierwiastków przejściowych są lotne, przy czym lotność wzrasta w szeregu Na, Be, Al. Hydroboran
berylu wykazuje budowę kowalencyjną (wiązania pomiędzy metalem a gr.BH4). W związku tym występują mostki wodorowe utworzone przez
wiązania analogiczne do wiązań trójcentrowych B-H-B. Bor wykazuje hybryd. sp
3
BeH2+B2H6 = Be(BH4)2 rys.
46.Pochodne karbonylków - otrzym.
Przeniesienie elektronów dostarczanych przez litowce umożliwia uzyskanie w bezwodnym środowisku anionów karbonylowych , którym
odpowiadają sole kompleksowe np.
Fe(CO)5+2Na=[Fe(CO)4]
-2
+2Na
+
+CO
-
Tetrakarbonylożelazian(II) sodowy Na2[Fe(CO)4]
Można je tez otrzymać w reakcjach redoks działając stężoną zasad Fe(CO)5+4OH
-
=[Fe(CO)4]
2-
+CO3
2-
+2H2O
Aniony karbonylkowe:[V(CO)6]
-
,[Cr(CO)5]
2-
,[Mn(CO)5],[Ni3(CO)9]
2-
Sole kompleksowe karbonylków traktowane mocnym kwasem bez dostępu powietrza przechodzą w hydroksykarbonylki metali
Na2[Fe(CO)4]+2HCl=H2[Fe(CO)4]+2NaCl są to lotne nietrwałe silnie redukujące ciecze stosowane jako przenośniki wodoru i tlenku węgla
Halogenokarbonylki otrzymuje się najczęściej przez działanie X2 na odpowiedni karbonylek Fe(CO)5+X2 gdzie:
X-fluorowiec
47.Reakcja kwasu ortokrzemowego z H2O :
nie ma takiej reakcji(nie hydrolizuje)
Hydrolizie ulegają sole kw. ortokrzemowego Na4SiO4+4H2O=H4SiO4+4NaOH
Kwas ten wykazuje tędęcję do odszczepiania H2O i kondensowania się w układy wielokrzemowe (powstaje kwas ortodikrzemowy)
48.Boraks- wzór ,struktura.
Na2B4O7*10 H2O-dobry środek antyseptyczny jest to str. skomplikowana [B4O5(OH)4]
2-
, dwa atomy B są o liczbie koordynacyjnej LK=4, a
dwa o o LK=3. Wzór boraksu [Na(H2O)4]2 [B4O5(OH)4] Zastosowanie: zmiękczanie wody, klarowanie szkła, oczyszczanie powietrza, substrat
dla innych zw.
49.Otrzymywanie Mg
1.MgO+Cl2+C=MgCl2+CO elektroliza MgCl2 w T ok.1000K, anoda-Fe a katoda –grafit. Reakcję przeprowadza się w atmosferze gazu
inertnego w tej T stopiony Mg wypływa na pow. elektrolitu I możemy go zbierać czerpakiem (czystość 99,8%)
2.MgO+ C=
Mg+CO
(T=2300K) karboredukcja kosztowna
3.2(MgO*CaO) + Si=2CaO*SiO2+2Mg
4.MgO+ CaC2=Mg+CaO+2C
50.Otrzymywanie Si
SiO2+2Mg=MgO+Si wydzielony krzem zawiera domieszki B i P pozbywamy się ich dodając HCl przeprowadzając Si w trichlorosilan
Si+3HCl=SiHCl3+H2 następnie oczyszczamy poprzez destylację frakcjonowaną .Trichlorosilan rozkłada się w T = 1500K drobnokrystaliczny
Si poddajemy dalej stopnieniu strefowemu w wysokiej próżni
51.Otrzymywanie P.
1. Ogrzewanie Ca3(PO4)2 z piaskiem i koksem w piecach elektr. (T=ok.1600K) Ca3(PO4)2 +3SiO2+5C=CaSiO3+5CO+0,5P4 proces
odbywa się bez dostępu powietrza fosfor wydziela się w postaci pary, ulega kondensacji podczas przepuszczania gazów płynących z pieca przez
warstwę wody. Zestalony fosfor oczyszczamy przez destylację. Otrzymany produkt stanowi odmianę fosforu-fosfor biały-
przez ogrzewanie go bez dostępu powietrza przemienia się w fosfor czerwony (używany do wyrobu zapałek). 2.
6NaPO3+3SiO2+10Al=3NaSiO3+Al2O3+1,5P4
3. 6P2H4=8PH3+P4
52.Termiczny rozkład azotanów
1)2AgNO3=2Ag+2NO2+O2 2)Ba(NO3)2=BaO+NO+NO2+O2 3)Ca(NO3)2=CaO+NO+NO2+O2 4)2KNO3=2KNO2+O2
5)2Pb(NO3)2=2PbO+4NO2+02. W reakcji 4) azotany litowców rozkładają się na azotyny tracąc tlen.
53.Rozkład difosforanu P2H4
:difosforan powstaje jako produkt uboczny podczas otrzymywania fosfanu (PH3). Jest cieczą o silnych właściwościach redukujących , zapala
się w zetknięciu z powietrzem. W odróżnieniu od hydrazyny nie wykazuje właściwości zasadowych. Rozpada się pod wpływem światła:
6P2H4=8PH3+P4
54.(CN)2-metody otrzym
., struktura, reakcja z KOH Dwucyjan ma budowę liniową
:N ≡ C-C ≡ N: otrztm.:1) Hg(CN)2=Hg+(CN)2 2) Cu
2+
+2CN
-
=Cu(CN)2=CuCN+0,5(CN)2. 3) Hg(CN)2+HgCl2=Hg2Cl2+(CN)2.
Dwucyjan jest bezbarwnym gazem o zapachu gorzkich migdałów, silnie toksyczny. (CN)2+2KOH=KCN+KCNO+H2O.
55.Tetraazotek terrasiarki N4S4
Wydziela się w postaci żółto –pomarańczowych kryształów wtedy gdy do r-ru S2Cl2 w bezwodnym eterze wprowadzimy suchy amoniak.
6S2Cl2+16NH3=S4N4+12NH4Cl+8S. 10S + 16NH3=S4N4+6(NH4)2S. Związek silnie endotermiczny S4N4=2N2+4S+128 kcal, w cząsteczce
S4N4 atomy siarki tworzą 8-oczłonowy wygięty pierścień (ma kształt dwufenoidu, w którym tylko atom N leż w jednej płaszczyźnie) tworzy
złoto żółte kryształy o Ttop.=178
o
C
56.TeCl4-struktura, hybrydyzacja
TeO2+2SCl4+2SOCl2. Tetrachlorektelluru wykazuje strukturę zdeformowanego sześcianu, atomy Te hybrydyzują w sp
3
d, osie orbitali
zhybrydyzowanych są skierowane ku narożom bi-piramidy trygonalnej. Tetrachlorek teluru reaguje z HCl tworząc jon kompleksowy [TeCl6]
2-
.
TeCl4+2HCl=H2[TeCl6] . TeCl4+2H2O=TeO2+4HCl.
57.Cyjanamid wapnia
–zast., mech.działania
CaCN2 : CaC2+N2=CaCN2+C (T=1500K). Pod wpływem wody wydziela amoniak
:CaCN2+3H2O=CaCO3+2NH3.(Dawniej metoda otrzymywania amoniaku). Zast.: jako nawóz sztuczny (azotniak)wprowadzający do gleby N i
Ca (obecnie zużycie maleje ze względu na koszty.
58.Który kwas z grupy 15-ej ma LK=6 ?
H[Sb(OH)6] –kw. sześciohydroksoantymonowy w odróżnieniu od kwasów fosforowych i arsenowych w których P i As mają LK=4
59.Chlorek tionylu i sulfurylu- otrzymywanie i hybrydyzacja:
SOCl2 stosowany w chemii organicznej do wprowadzania grup tionylowych.PCl5+SO2=POCl3+SOCl2. Struktura –kształt bipiramidalny,
hybrydyzacja sp
3
. Jest bezbarwna cieczy o przenikliwej woni. Chlorek sulfurylu SO2+Cl2 =SO2Cl2 kształt tetraedryczny hybryd sp
3
,
bezbarwna ciecz o ostrej woni.
60.Usuwanie chloru w przem. włókienniczym:
Cl2+S2O6
-
+H2O=2Cl
-
+4H
+
+2SO4
2-
61.Hydrazyna. N2H4
- pozostaje w takim samym stosunku do NH3 jak H2O2 do H2O.
Grupy aminowe w hydrazynie nie mają swobody obrotu. Oba at. N mają hybryd. sp
2
hydrazyna charakteryzuje się znacznym momentem
dipolowym,jest silnie toksyczna. W roztworach wodnych w obecności kwasów zachowuje jak słaba zasasda. Z wodą tworzy hydrat
N2H4*2H2O, z kwasami –sole. Hydrazyna jak i jej sole są silnymi reduktorami ,redukują sole Fe
3+
do Fe
2+
,wydzielają metale szlachetne z
roztworów ich soli. W roztworach kwaśnych hydrazyna wykazuje właśc. utl: N2H5
+
+3H
+
+2e=2NH4
+
N2H4+H2O=[N2H5]
+
OH
-
- jon hydrazoniowy. N2H4*H2SO4- siarczan hydrazyny N2H4*HCl- chlorek hydrazyny. Hydr. Stosowana jest jako
paliwo rakietowe N2H4+O2=N2+H2O.
OTRZYM: 1). Metoda Rashinga (
temp.=450K,p=5Mpa) NH3+NaClO=NaOH+NH2Cl
NH2Cl+NH3=N2H4+HCl, chloramina może reagować z hydrazyną pogarszając w ten sposób wydajność procesu : 2NH2Cl+N2H4=2NH4Cl+N2
2).CO(NH2)2+NaClO+2NaOH=N2H4+Na2CO3+H2O+NaCl (mocznik + chloran sodu)
3).metoda radiacyjna: NH3=H2+NH2 , 2NH2=N2H4
62.Purpura Kasjusza:
SnO2 – absorbuje na swojej pow. cząsteczki złota dając żel o czerwonej barwie – Purpur Kasjusza. Stosuje się ją jako farbę do barwienia szkła i
porcelany. 2Au
3+
+3Sn
2+
+6H2O=12H
+
+3SnO2+2Au.

63.Biały grafit BN
– otrzym. m.in. na drodze bezpośredniej syntezy z pierw. W wysokich temp. Jest jedną (najważniejszą) odmianą polimorficzną azotku boru
posiada budowę warstwową - tak jak grafit, strukturę heksagonalną, różni się od grafitu tym że nie przewodzi prądu elekt., duża odporność
chem., stosowany jako wysoko temperaturowy smar. W temp czerwonego żaru reaguje z parą wodną dając kw. ortoborowy:
BN+3H2O=H3BO3+NH3
64.Antymon wybuchowy – otrzym.:
jest to czarny osad wydzielający się na katodzie w czasie elektrolizy zakwaszonego roztworu SbCl3 prądem o dużej gęstości. Wystarczy lekkie
zadrapanie lub podgrzanie by spowodować przemianę bezpostaciowej masy w metaliczny antymon. Przemianie tej towarzysz wydzielenie
dużych ilości ciepła. Sb wybuchowy zapala się po ogrzaniu do temp. 470K.
65.Ponadtlenek węgla
C3O2 – jest to bezbarwna subst. gazowa (tempw=280K) powstająca w czasie odwadniania kw. malonowego za pomocą P4O10 w próżni
H2C(COOH)2----
P
4
O
10--à O=C=C=C=O+H2O (dlatego uważany jest za bezwodnik kw. malonowego ).Pod normalnym ciś. ulega
polimeryzacji, ulega hydrolizie. Cząsteczka- kształt liniowy , hybryd. sp. Spala się niebieskim płomieniem dając CO2.
66.Diboran
B2H6-otrzym.:4BCl3+Li[AlH4]=2B2H6+3LiAlCl4,
B2O3+Al.+AlCl3+H2-75MPa
450K
=B2H6+Al2O3+AlCl3.
6LiH+8(C2H5)2O*BF3=6LiBF4+8(C2H5)2+B2H6.
Diboran należy do najprostszych boranów przypisuje mu się strukturę w której dwa atomy wodoru tworzą mostki pomiędzy oboma atomami boru
(hybryd.sp
3
) rys.
Schemat nakładania się zhybrydyzowanych orbitali sp
3
boru na orbital s atomu H, kształt zdelokalizowanego orbitalu trójcentrowego w
cząsteczce diboranu (orbital bananowy) B-H-B. B2H6+6H2O= 2H3BO3+6H2(kw. ortoborowy), B2H6+2NaH=2NaBH4.
67.Bizmutany
BiH3 (bizmutan) do nielicznych zw. bizmutu (V) należą bizmutany litowców: bizmutany sodu(NaBiO3-żółty,Na3BiO4-brunatny). Powstają w
czasie utleniania zawiesiny Bi(OH)3 w roztworze NaOH za pomocą Cl2 lub KMnO4 , a także przez stapianie
Bi2O3+2Na2O2=NaBiO3+Na3BiO4. Kwas azotowy wydziela z nich czerwono- brunatny Bi2O5. Bizmutany i Bi2O5 działają silnie utl.
wydzielają Cl2 z HCl , utleniaja sole Mn
2+
do MnO4.
68. BH3
BH3 nie występuje osobno tylko w postabi adduktów w których odgrywa rolę kwasu Lewisa, Jako przykład mogą posłużyć addukty BH4¯ i
(CH3)3N∙BH3 z jonem wodorowym oraz trimetyloaminą stanowiącymi zasady Lewisa. Badania termochemiczne wykazują że entalpia
dimeryzacji BH3 na B2H6 wynosi ΔH=-150 kJ/mol, co wyjaśnia termodynamiczne przyczyny znacznie większej trwałości B2H6 niż BH3.
69. Rozkład termiczny KClO3 bez i z katalizatorem
2KClO3®MnO2®2KCl+3O2
4KClO3®3KClO4+KCl –r. dysproporcjonowania
70. Superfosfat podwójny – metody otrzymywania.
W wyniku działania kw. siarkowego na fosforyt uzyskuje się produkt zwany superfosfatem, zawierający siarczan wapnia stanowiący
niepotrzebny balast. Ca(PO4)2+2H2SO4®Ca(H2P)4)2+2CaSO4 korzystniejszy z tego względu jest superfosfat podwójny – nie zawierający
gipsu otrzymany w reakcji kw. fosforowego z fosforytem Ca3(PO4)2+4H3PO4®3Ca(H2PO4)2
71. Kwas diazotowy – struktura i właściwości
H2N2O2 – kw diazotowy (podazotowy)

H-O-N=N-O-H. Jest to ciało krystaliczne, w stanie bezwodnym łatwo wybucha, w roztworze wodnym ulega rozkładowi na N2O.
H2N2O2®N2O+H2O
reakcja ta jest nieodwracalna. Otrzymywanie: H2N2O2 otrzymuje się przez redukcję azotanów (III) amalgatem sodu:
2NaNO2+4Na+2H2O®Na2N2O2+4NaOH Na2N2O2+2Ag
+
®Ag2N2O2+2Na
+
Ag2N2O2+2HCl® H2N2O2+2AgCl
72.PODTLENEK WĘGLA: C3O2
Jest to bezbarwna substancja gazowa (temp. Wrzenia 280K) tworząca się w czasie odwadniania kwasu malonowego za pomocą P4O10 w próżni:
H2C(COOH)2®P4O10®O=C=C=C=O
dlatego uważany jest za bezwodnik kw malonowego H4C3O4. pod normalnym ciśnieniem ulega on polimeryzacji na bezwonny produkt. W
czasie hydrolizy tworzy ponownie kw malonowy. Cząsteczka C3O2 ma krztałt liniowy, hybrydyzacja sp. C3O2 bezbarwny gaz o nieprzyjemnym
zapachu, spala się niebieskim płomieniem dając CO2.
73. OKSOBORANY
Oksoborany – czyli sole kwasów borowych. Większość Oksoboranów wywodzi się od skondensowanych kwasów borowych nieznanych w stanie
wolnym . struktura oksoboranów wykazuje pewne anologie do struktury krzemianów i fosforanów. Aniony oksoboranów składają się z prostych
trójkątnych grup [BO3] połączonych ze sobą za pośrednictwem atomów tlenu, podobnie jak łączą się tetraedryczne grupy [SiO4] w krzemianach
i [PO4] w skondensowanych fosforanach. Struktura anionów oksoboranowych jest jednak o tyle bardziej skomplikowana, że obok grup [BO3]
pojawiają się w nie także tetraedryczne grupy [BO4].
a)w ortooksoboranach – tworzone tylko przez metale trójwartościowe (ScBO30, InBO3, występują płaskie aniony BO3
3¾
.
Rys.
b) w pirooksoboranach (pentaoksodiboranach) np. w Ca2B2O5, anion tworzony jest przez dwie grupy [BO3] łączy się za pośrednictwem jednego
wspólnego atomu tlenu.
Rys
c)w metaoksoboranach – anion o składzie (BO2)n
3¾
występuje w postaci sześcioczłonowych pierścieni (np. w metaoksoboranie sodu) lub w
postaci długich łańcuchów (np. w metaoksoboranie wapnia).
Rys
74.KRZEMIANY PODZIAŁ
-ortokrzemiany tj.krzeminy zawierające oddzielny jon [SiO4]
4¾
-krzemiany wyspowe zaweierające oddzielny zespół gróp krzemotlenowych {Si2O7]
6¾
, [SiO3]
9¾
, [Si6O18]
12¾
-krzemiany o anionach łańcuchowych i wstęgowych
-krzemiany o anionach warstwowych
-krzemiany o trójwymiarowej (szkieketowej) strukturze anionu
ortokrzemiany - wywodzą się od kw ortokrzemowego H4SiO4 i zawierają jony SiO4
4¾
w postaci czterościanów, które nie mają żadnych naroży
wspólnych z innymi czterościanami w sieci przestrzennej. Typowymi przykładami są fenakity Be2SiO4, willemity Zn2SiO4 oraz olwin
Mg(Fe)2SiO4 .
krzemiany wyspowe zawierają bardziej skomplikowane aniony stanowiące oddzielne zespoły tetraedów krzemotlenowych: [Si2O7]
6¾
,
[Si3O9]
6¾
, [Si6O18]
12¾
rys.
krzemiany o anionach łańcuchowych i wstęgowych
struktury łańcuchowe – pirokseny (polimetakrzemiany). Równoległe łańcuchy są ze sobą połączone przez takie aniony jak Ca
2+
, Mg
2+
, Fe
2+
, a
czasem Na
+
lub Al
3+
. Przykłady: enstatyt (Mg,Fe)2Si2O6, diopsyd (Ca,Mg)Si2O6
rys.
struktury wstęgowe – amfibole (politetrakrzemiany). Każda wstęga związana jest jonami dodatnimi z sąsiednimi. Ponadto między wstęgi
wbuduwuje się jony OH
¾
lub F
¾
np. tremolit, CoMgSi2O6

rys.
Krzemiany o anionach warstwowych – krzemiany w których występują warstwy utworzone przez czworościany krzemotlenowe [SiO4] w taki
sposób, że każdy z nich ma trzy naroża wspólne z trzema innymi czworościanami a wolne wierzchołki znajdują się po jednej stronie płaszczyzny.
krzemiany o trójwymiarowej strukturze anionu – czasami czworościany krzemotlenowe [SiO4] łączą się ze sobą w ten sposób, że każdy z nich
ma cztery naroża wspólne z innymi czworościanami. W rezultacie powstaje ciągła struktura trójwymiarowa tzw. szkieletowa (kwarc, krystobalit).
Na każdy atom krzemu przypadają w niej . struktury tego typu wykazują wszystkie odmiany polimorficzne SiO2.
75. WĘGLIKI – PODZIAŁ I WŁAŚCIWOŚCI
węgliki dzielimy na :
-jonowe typu soli
zawierające aniony C
4¾
, C2
2¾
, lub C3
4¾,
otrzymuje się je przez ogrzanie odpowiedniego metalu lub jego tlenku z węglem lub
węglowodorem. Węgliki jonowe tworzą węgiel z pierwiastkami grup IA, IIA, IIIB. Węgliki jonowe dzieli się na 3 typy:
acetylenki CaC2+2H2O®C2H4+Ca(OH)2
metanki Al4C3+12H2O®3CH4+4Al(OH)3
allilki Mg2C3+4H2O®CH3CºCH+2Mg(OH)2
CaC2 – karbid ma zastosowanie do produkcji acetylenu oraz cyjanoamidu wapnia CaCN2:
CaC2+N2®T®CaCN2+C
CaCN2+3H2O®CaCO3+2NH3
-międzywęzłowe (metaliczne) powstają w wyniku bezpośredniego działania węgla na metale IVB, VB, VIB. Są to substancje trudnotopliwe,
twarde a jednocześnie kruche i bierne chemicznie – ulegają tylko działaniu silnych środków utleniających. Wykazują one pewne cechy
metaliczne: połysk metaliczny i dobre przewodnictwo elektryczne. Atomy metali tworzące ten typ węglików mają z reguły znacznie większe
promienie atomowe r>130pm niż węgiel r=77pm. Sieci przestrzenne tych węglików zbudowane są z atomów metali oraz atomów węgla
znajdujących się w przestrzeniach międzywęzłowych: MoC, WC, TiC. Ze względu na dużą twardość i ogniotrwałość węglików tytanu, i
wolframu znajdują one zastosowanie do wyrobu materiałów, którymi pokrywa się ostrza do szybkościowego ścierania metali do wyrobu matryc.
- kowalencyjne węglikami tego typu są związki węgla z pierwiastkami o zbliżonej elektroujemności np. SiC, B4C, SiC
SiO2+3C®2200K®SiC+2CO Twardość jego jest zbliżona do twardości diamentu. Znajduje zastosowanie jako materiał szlifierski, do wyrobu
tygli i ogniotrwałych elementów grzewczych do pieców elektrycznych. SiC stosuje się do wyrobu pojemników paliwowych wysoko
temperaturowychchłodzonych gazem reaktorów jądrowych.
węgliki typu węgliki żelazowe – metale o promieniach atomowych mniejszych od 130pm, Fe, Cr, Co, Ni, tworzą węgliki o właściwościach
pomiędzy węglikami jonowymi i międzywęzłowymi. Od węglików międzywęzłowych różnią się strukturą sieci przestrzennej oraz większą
reaktywnością chemiczną. Węgliki te reagują z H2O, rozcieńczonymi kwasami np. Fe3N, Ni3C są zbudowane w ten sposób, że at węgla znajdują
się wewnątrz słupów trygonalnych utworzonych przez at metali, natomiast w Cr3C2 atomy C tworzą łańcuchy. Fe3C – cement, występujący w
postaci oddzielnej fazy krystalicznej w żelazie surowym.
76. odmiany alotropowe siarki z parzystą liczbą atomów siarki . otrzymywanie.
Siarka elementarna zależnie od warunków może tworzyć cząsteczki o pierścieniowym lub łańcuchowym układzie at powoduje to, że siarka
wykazuje wyjątkowe bogactwo odmian w stanie stałym i ciekłym.
1)siarka rombowa – to odmiana trwała w temp pokojowej, o barwie jasnożółtej. Siarka rombowa złożona jest z cząsteczek ośmioatomowych S8
(cyklo siarka), w których atomy ułożone są w formie zygzatowanego pierścienia. Siarka rombowa jest trudno rozpuszczalna w alkoholu i
benzynie, dobrze natomiast w dwusiarczanie węgla CS2. po ogrzaniu do temp 368,8K siarka rombowa ulega przemianie w siarkę jednoskośną.
2)Siarka jednoskośna – zwana siarką β topiąca się w temp 392K. Ciekła siarka już powyżej temp topnienia jest ruchliwą cieczą barwy
jasnożółtej złożoną z cząsteczek cyklo-oktasiarki, która pozostaje w równowadze z siarką łańcuchową również ośmioatomową. Obydwie
odmiany odmiany rombowa i jednoskośna zawierają powyginane pierścienie S8 i różnią się tylko ułożeniem pierścienia w krysztale.
3)trzecia odmiana znana jest jako siarka Engela jest nietrwała i zawiera pierścień S6 o konformacji krzesłowej. Otrzymuje je się poprzez wlanie
roztworu Na2S2O3 do stężonego HCl, a następnie ekstrakcję siarki toluenem.
4)Siarka plastyczna, czyli bezpostaciowa, powstaje w wyniku wlania ciekłej siarki do wody i zawiera łańcuchy atomów siarki . Otrzymano
siarkę o dużych pierścieniach (S10 i S12) : H2S8+S4Cl2®2HCl+S12 Wszystkie odmiany siarki mają charakter niemetaliczny.
77. Borazyna –wzór strukturalny, reakcje z CH3OH.

Borazyna B3N3H6 – tzw. nieorganiczny benzen . 3B2H6+NH3®-3H2,T®3[H2B(NH3)2]
+
+[BH4]
-
®-9H2®2B3N3H6 związek ten jest
izostrukturalny i izoelektronowy z benzenem w wykazuje podobne właściwości fizykochemiczne. Jest bardziej aktywny od benzenu ze względu
na większą elektroujemność.
Rys.
78. KLASYFIKACJA Boranów.
Znanych jest 5 klas boranów typu: BNHM i BnHm
x¾
.
1)Claso-borany (klatka) – kturych struktury maja postać zamkniętych klasterów poliedrycznych zawierających n at boru np. BnHn
2¾
.
2)Nido-borany (gniazda) – o częściowo otwartych strukturach w których klaster Bn zajmuje n naroży wielościanu mającego n+1 naroży np.
BnHn+4, BmHn+3
¾
3)Arachno-borany (sieć pajęcza) – o bardziej niż nido-borany otwartych klasterach, w których at. B zajmują n naroży wielościanu mającego n+2
naroży.
4)Hypho-borany (sieć) – o najbardziej otwartych klasterach w których at zajmują n naroży np. B8H16.
5)Concjuncto – borany (łącze) o strukturach utworzonych poprzez połączeni dwóch lub więcej klastrów przestrzennych poprzenich klas. np.
BnHn
79. LICZBA KOORDYNACYJNA 6 W xv GRUPIE.
Azotowce tworzą na ogół związki o wiązaniach kowalencyjnych. Trzy niesparowany elektrony tworzą wiązanie z innymi atomami, a powstająca
cząsteczka jest tetraedryczna, przy czym jedno połozenie zajmuje wolna para elektronowa. Liczba koordynacyjna 4 zostaje osiągnięta poprzez
oddanie tej wolnej pary elektronowej innemu atomowi lub jonowi np. w jonie amonowym. Azot niemający orbitali d nie wytwarza nigdy więcej
niż 4 wiązania kowalencyjne. Inne azotowce mogą mieć liczby koordynacyjne 5 np. PCl5 lub 6 np. [PCl6]
¾
; można to wytłumaczyć udziałem
jednego lub dwóch orbitali d w tworzeniu wiązania i hybrydyzacji sp
3
d lub sp
3
d
2
.
80. PERBORAKS- BUD. OTRZYM. ZAST. WŁAŚC. FIZ. I CHEM.
Perboraks – Na2B4O7×H2O2×9H2O – należy do peroksoboranów, które są uwodnionymi boranami, w których część cząsteczek wody została
zastąpiona cząsteczkami H2O2. powstaje w reakcji: 4H3BO3+Na2O2+4H2O®Na2B4O7× H2O2×9H2O. Występuje w postaci trimerów. Ma
właściwości utleniające i stosuje się go jako środek bielący, dodawany do proszków do prania, środek rozjaśniający włosy w kosmetyce, a także
jako środek dezynfekcyjny.
81. SPINELE –BUDOWA, OTRZYMYWANIE, ZASTOSOWANIE.
Spinele AB2O4 – są to podwójne tlenki. A i B oznaczają atomy metali o wartościowościach najczęściej AII, i BIII oraz AIV i BII lub AVI i BI.
Otrzymywanie: MgO+Al2O3®MgAl2O4. w spinelach jony tlenkowe tworzą sieć regularną płasko centrowaną pomiędzy anionami O
2¾
w sieci
występują dwa rodzaje luk:
a)luki tetraedryczne otoczone 4 jonami O
2¾
.
b)luki oktaedryczne otoczone 6 jonami O
2¾
.
Komórka elementarna spinolu obejmuje32 at O, w normalnym spinelu spośród zawartych w komórce 32 luk oktaedrycznych, 16 zajmują jony
metali trójwatrościowego np. Al
3+
a spośród 64 luktetraedrycznych 8 zajętych jest przez jony metalu dwu wartościowego. Spinele tworzą się w
wysokich temp.
82. DLACZEGO SELEN I TELLUR SĄ TRWALSZE W WYSOKICH TEMP.
Tellenowodór i selenowodór są związkami powstającymi w reakcjach endotermicznych z równoczesnym pochłonięciem ciepła. H2(g)+1/
2Se2(s)®H2Se(g) ΔH=+85kJ/mol H2(g)+1/2Te2(s)®H2Te(g) ΔH=+154,4kJ/mol W związku z tym w miarę podwyższania temp równowaga
reakcji jest przesunięta w kierunku tworzenia produktów – dlatego są trwalsze w wysokich temp.
83. STRUKTURA SO3 W STANIE GAZOWYM I STAŁYM.
W stanie gazowym SO3 występuje w postaci pojedynczych cząsteczek. Mają one kształty płaskie, a kąt pomiędzy wiązaniami O-S-O wynosi
120
° świadczy to o hybrydyzacji sp
2
. Po skropleniu gazowego SO3 ciekły So3krzepnie z utworzeniem ciała stałego przypominającego lód. Jest
to odmiana stała złożona z pierścieniowych cząsteczek (SO3)3
Rys

Hybrydyzacja sp
3
. po dłuższym przechowywaniu γ-SO3 przechodzi w α-SO3 i β-SO3. cząsteczki tych odmian polimorficznych łączą się w
długie łańcuchy.
Rys
84. ODMIANY ALOTROPOWE ARSENU – MET. OTRZYM. WŁAŚC. FIZYKOCHEM.
Istnieją dwie odmiany alotropowe - szara i żółta. Arsen szary uzyskuje się przez termiczny rozkład arsenopirytu. Jest to odmiana trwała,
przewodzi prąd elektryczny, krystalizuje w układzie heksagonalnym, ma strukturę warstwową, kruchy. Znane są odmiany arsenu szarego, które
różnią się tylko stopniem rozdrobnienia. As - czarny i As – brązowy. As – czarny można otrzymać poprzez termiczny rozkład AsH3. As –
brunatny powstaje w wyniku reakcji jego związków za pomocą SnCl4. W wyniku szybkiego oziębiania powstałego arsenu otrzymuje się As
żółty. Jest to odmiana nietrwała. Jest to przezroczyste ciało stałe krystalizujące w układzie regularnym. As rozpuszcza się w CS2, nie przewodzi
prądu, reaguje z O2 dając As2O3. nie rozpuszcza się w H2SO4, HCl, tworzy arsenki: FeAsS®T®FeS+1/4As4 As4O6+6C®As4+6CO
85. Perboraks.:
Na2B4O7*H2O2*9H2O- należy do perboraksów które są uwodnionymi boranami, w których część cząsteczek wody zastąpiona została
cząsteczkami H2O2. Otrzym:
4H3PO3+Na2O2+4H2O=Na2B4O7*H2O2*9H2O. Perboraks ma właś. utleniające i stosuje się go jako środek bielący, dodawany do proszków
do prania, środek rozjaśniający włosy w kosmetyce, a także jako środek dezynfekcyjny. Wytstępuje w postaci trimerów : (Na-O-O-B-O)3.
86. Kwas Pruski.
Cyjanowodór. HCN. Otrzymuje się przez destylację mieszaniny cyjanku potasu lub heksacyjanożelazian(II) potasu z kwasem siarkowym
średniostężonym:
2KCN+H2SO4= K2SO4 + 2HCN. Inny sposób polega na przepuszczeniu H2S z cyjankiem rtęci (II): H2S+Hg(CN)2 = 2HCN + HgS.
Cyjanowodór jest cieczą bezbarwną o zapachu gorzkich migdałów, należy do szybkodziałających trucizn, dawka śmiertelna wynosi ok. 50mg.
Cząsteczka cyjanowodoru wykazuje duży moment dipolowy i w związku z tym ciekły HCN odznacza się dużą przenikalnością elektr. Z wodą,
alkoholem, eterem, cyjanowodór miesza się w każdym stosunku. Ulega dysocjacji: HCN + H2O = H3O
+
+ CN
-
. Występuje w postaci 2
izomerów będących z sobą w równowadze: H-C≡N:=:C≡N-H. Znane są jego liczne sole – cyjanki. Cyjanki litowców, berylowców są dobrze
rozpuszczalne w wodzie. Cyjanki metali ciężkich trudno rozpuszczalne (wyjątek stanowi Hg(CN)2. Roztwory cyjanków litowców ulęgają silnej
hydrolizie, wykazują przy tym zasadowy odczyn, a wydzielające się z nich pary HCN mają zapach gorzkich migdałów. Jony cyjankowe mają
zdolność do tworzenia kompleksów z metalami ([Fe(CN)6]
4-
, [Fe(CN)6]
3-
). Spośród cyjanków na skalę techniczną produkowany jest cyjanek
sodu: NH3 + Na = NaNH2 + 0,5 H2.
87.Wodorek magnezu. MgH2- ma wł. wodorków jonowych i kowalencyjnych .Można go otrzymać na drodze bezpośredniej syntezy z
pierwiastków przy zwiększonym ciś. wodoru.
Oraz : 1)Mg(C2H5)2 -
temp
-= MgH2+2C2H4. 2)C2H5MgI=MgH2+C2H3I. 3)2Mg(CH3)2+Li[AlH4]-
eter-
= 2MgH2+Li[Al(CH3)4]. W czasie
ogrzewania ulega łatwo rozpadowi na pierwiastki, dzięki temu znalazł zastosowanie w prototypach samochodów napędzanych wodorem.

Document Outline
Wyszukiwarka
Podobne podstrony:
Chemia - zagadnienia na egzamin, Science ^^, Farmacja, 1 rok, Chemia, Ogólna i nieorgan, egzamin
zagadnienia na egzamin wazne
Opracowanie Zagadnień na egzamin Mikroprocki
koncepcja kształcenia multimedialnego, STUDIA PWSZ WAŁBRZYCH PEDAGOGIKA, zagadnienia na egzamin dypl
Zagadnienia na egzamin(nauka adm), WSAP, WSAP, Nuka o administracji, Nuka o administracji
Zagadnienia na egzamin prawo cywilne ogólne i zobowiązania - P41 i P31, STUDIA-Administracja
Dodatkowe zagadnienia na egzamin teoretyczny z Farmakologii, med, Med2, Med2, Farmakologia (pajro)
Zagadnienia na Egzamin z Demografii, Wyższa Szkoła Biznesu w Dąbrowie Górniczej, Demografia spoleczn
Wykłady PAU zagadniuenia na egzamin 12
ZAGADNIENIA NA EGZAMIN Polityka Zagraniczna USA
Zagadnienia na egzamin z ZPiU
ZAGADNIENIA NA EGZAMIN Z DIAGNOSTYKI
Opracowanie zagadnień na egzamin z MO
metodologia - zagadneinia na egzamin, UKSW - Pedagogika, II rok - I semestr, Metodologia Badań Pedag
7 wersologia 2, Filologia polska UWM, Teoria literatury, zagadnienia na egzamin
Zagadnienia na egzamin z EGiB. 2011, EGiB
więcej podobnych podstron