
Ć
WICZENIE 6
OZNACZANIE TEMPERATURY ZAPALENIA TWORZYW
SZTUCZNYCH
wg PN/C-89022. Tworzywa sztuczne. Oznaczanie temperatury
zapalenia
I. CZ
ĘŚĆ
TEORETYCZNA
1. Podstawowe poj
ę
cia z dziedziny tworzyw sztucznych
Tworzywa sztuczne należą do najbardziej rozpowszechnionych materiałów
syntetycznych wytwarzanych przez człowieka i znajdują wszechstronne zastosowanie w
wielu gałęziach przemysłu, a także w życiu codziennym. Zastępują wiele materiałów
tradycyjnych pochodzenia naturalnego. Z uwagi na rozwój cywilizacyjny zapotrzebowanie na
tworzywa sztuczne rośnie. Wiodącym odbiorcą jest budownictwo (elementy wyposażenia
wnętrz, instalacje elektryczne i elektroenergetyczne). Niejednokrotnie wadą ograniczającą
stosowanie tworzyw sztucznych jest ich palność. Jest ona wypadkową kilku cech związanych
z właściwościami termokinetycznymi, dymotwórczymi oraz toksycznymi do których można
zaliczyć [1]:
•
zapalność,
•
palność lotnych produktów rozkładu termicznego,
•
całkowitą ilość ciepła wydzielonego podczas spalania,
•
szybkość wydzielania ciepła,
•
rozprzestrzenianie się płomienia,
•
zdolność do tworzenia dymu oraz toksyczność.
1.1. Tworzywa sztuczne
Tworzywa sztuczne to wielkocząsteczkowe substancje organiczne - polimery stanowiące
podstawowy
składnik
danego
tworzywa.
Obok
polimerów
w tworzywie sztucznym mogą znajdować się wypełniacze, plastyfikatory, barwniki,
stabilizatory,
antypireny
i
inne
dodatki
wprowadzone,
na
przykład
w celu zwiększenia wytrzymałości mechanicznej, termicznej, względnie odporności a procesy
starzenia lub procesy opóźniające zapoczątkowanie spalania.
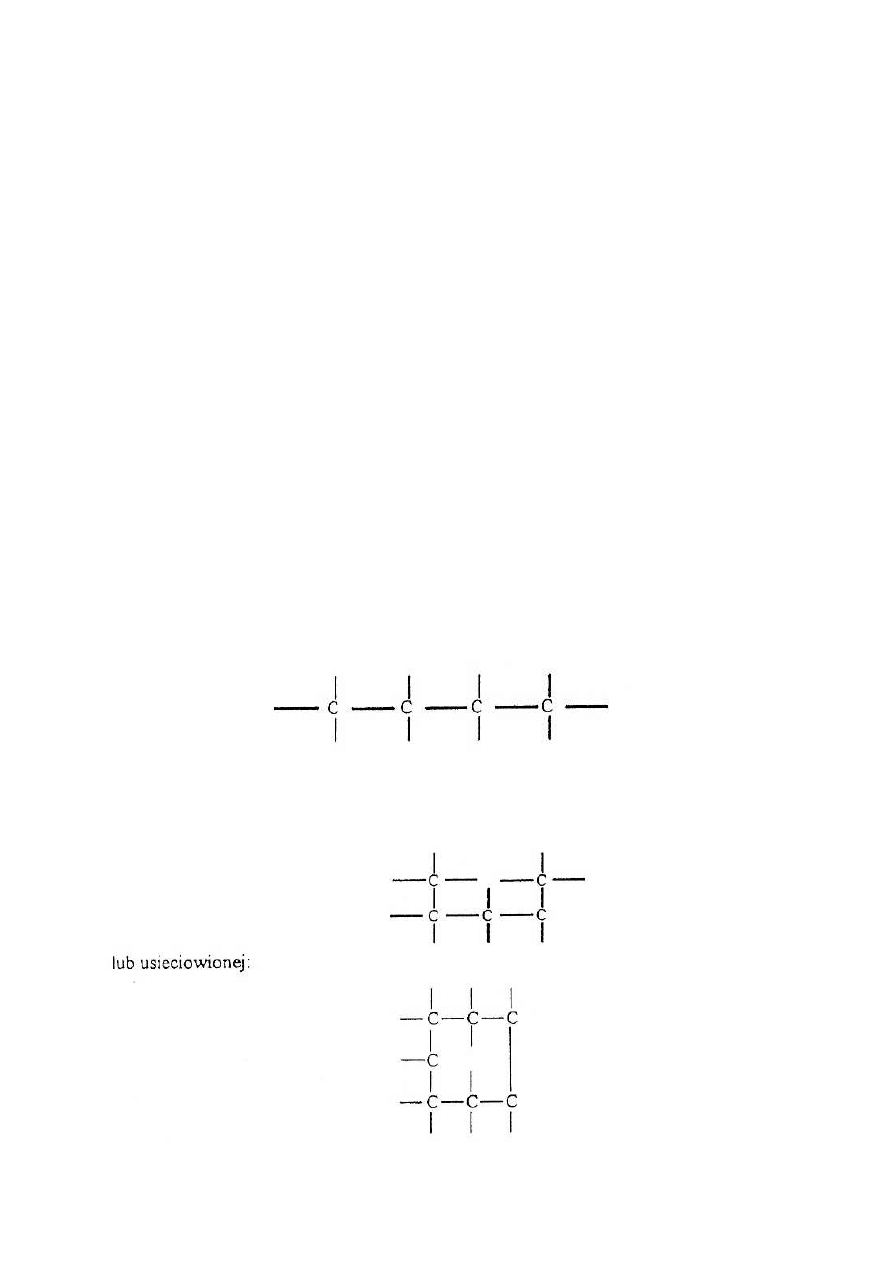
1.2. Polimery
Polimery to inaczej związki wielkocząsteczkowe, których cząsteczki zbudowane są z
dużej liczby powtarzających się grup zwanych merami. Substancjami wyjściowymi do
otrzymywania polimerów są związki o małym ciężarze cząsteczkowym zwane monomerami
O powstaniu makrocząsteczki polimeru decyduje też funkcyjność monomeru. Przez
funkcyjność danego związku rozumie się liczbę posiadanych przez niego grup zdolnych do
reakcji chemicznej, np. grupy -OH, - COOH, -NH
2
–SOH
3
itd.
Jeśli związek zawiera w cząsteczce tylko jedną z tych grup, nazywany jest związkiem
jednofunkcyjnym, a gdy jest ich więcej - związkiem wielofunkcyjnym. Przykładem związku
dwufunkcyjnego jest kwas adypinowy HOC-(CH
2
)
4
- COOH,
związku trójfunkcyjnego - gliceryna HOCH
2
-CH(OH)-CH
2
H.
Funkcyjność związków określa się również na podstawie obecności w nich podwójnych
lub potrójnych wiązań.
Związki o jednym podwójnym wiązaniu, np. etylen CH
2
= H
2
są dwufunkcyjne, zaś związki o
dwóch reaktywnych wiązaniach w cząsteczce jak butadien H
2
C=CH-CH=CH
2
oraz mający
potrójne wiązanie acetylen CH≡CH są czterofunkcyjne.
Z monomerów dwufunkcyjnych otrzymuje się polimery o budowie liniowej (brak
rozgałęzień innego rodzaju jak grupy boczne monomerów, np. grupa fenolowa styrenu):
W
przypadku
użycia
przynajmniej
jednego
monomeru
trójfunkcyjnego
i wielofunkcyjnego powstaje polimer o budowie rozgałęzionej:

Ze względu na stopień uporządkowania struktury wewnętrznej polimery można podzielić
na krystaliczne i bezpostaciowe (amorficzne). Jeśli polimer wykazuje wysoki stopień
uporządkowania
(tzn.
regularne
ułożenie
atomów
i cząsteczek), to struktura jego jest zbliżona do kryształu. Są to polimery krystaliczne, których
cechą
charakterystyczną
jest
duża
regularność
i
symetria
w budowie łańcucha, np. polietylen [
CH
2
– CH
2
]
n
CH3
I
polipropylen [-CH-CH
2
- ]
n
Związki o budowie krystalicznej mają ściśle określoną temperaturę topnienia, w której
lepkość i gęstość zmieniają się gwałtownie.
Polimery o strukturze bezpostaciowej odznaczają się całkowitym brakiem porządku w roz-
mieszczeniu cząsteczek. Makrocząsteczki są bezładnie splątane między sobą. Ich przemiany
pod wpływem ogrzewania przebiegają w sposób stopniowy. Polimery miękną stopniowo i
przechodzą w ciecz w określonym zakresie temperatur.
Stan krystaliczny polimerów występuje znacznie rzadziej niż amorficzny. Polimery nie są
całkowicie krystaliczne. Tworzą układ, w którym obok obszarów krystalicznych o regularnej
budowie występują równocześnie obszary bezpostaciowe. Strukturę polimerów tworzących
taki układ można więc określić jako częściowo krystaliczną Ze wzrostem krystaliczności
rośnie ich temperatura topnienia i wytrzymałość mechaniczna, a przejście ze stanu stałego w
postać cieczy staje się bardziej ostre (zakres temperatur, w których to następuje, zawęża się).
1.3. Rodzaje polimerów
Polimery ze względu na budowę
i
zachowanie pod wpływem temperatury dzieli się na
termoplastyczne i termoutwardzalne.
1.3.1. Polimery termoplastyczne
Są to polimery o strukturze liniowej lub rozgałęzionej. Ze względu na brak grup
funkcyjnych zdolnych do sieciowania nie utwardzają się podczas ogrzewania, zachowując
budowę liniową lub rozgałęzioną.
Polimery termoplastyczne mogą być kształtowane wielokrotnie, a ich przerób
w wysokich temperaturach (poniżej temperatury rozkładu polimeru) nie prowadzi w sposób

wyraźny do zaniku plastyczności, ani możliwości do formowania się. Polimery te są
rozpuszczalne w rozpuszczalnikach, topią się i płyną.
1.3.2. Polimery termoutwardzalne
To tworzywa, w których pod wpływem podwyższonej temperatury następuje
nieodwracalny proces powstawania struktury przestrzennie usieciowanej. Struktura ta może
być kształtowana tylko jednokrotnie Polimery te są nierozpuszczalne i nietopliwe po
utwardzeniu oraz znacznie mniej elastyczne, bardziej wytrzymałe mechanicznie i
odporniejsze
na
działanie
czynników
agresywnych
chemicznie
od
polimerów
termoplastycznych.
1.3.3. Polimery chemoutwardzalne
W przypadku niektórych polimerów nieodwracalne, sieciowanie może przebiegać w wyniku
reakcji chemicznej ze specjalnymi utwardzaczami.
1.4. Otrzymywanie polimerów
Polimery otrzymuje się z monomerów na drodze polimeryzacji addycyjnej lub stopniowej
oraz polimeryzacji polikondensacyjnej (polikondensacji).
1.4.1. Polimeryzacja addycyjna
Polimeryzacja ta to proces łączenia się wielu cząsteczek monomeru bez wydzielania mało
cząsteczkowych produktów ubocznych
nA → [A]
n
A - cząsteczka monomeru,
n - liczba cząsteczek monomeru,
[A]
n
- makrocząsteczka polimeru.
Reakcja polimeryzacji addycyjnej przebiega bez zmiany składu substancji reagujących,
np.: etylen nCH
2
=CH
2
→
[
CH
2
- CH
2
]
n
1.4.2. Polimeryzacja stopniowa
Polimeryzacja
ta
przebiega
bez
wydzielania
produktów
ubocznych,
ale z przeniesieniem (migracją) niektórych atomów poszczególnych monomerów, przez co
różni
się
od
polimeryzacji
addycyjnej
mechanizmem
i kinetyką.

i tak:
A,B - monomery zawierające grupy funkcyjne x, y,
x, y - grupy funkcyjne,
x - A - B - y - polimer, który powstał w wyniku przegrupowania atomu lub grupy atomów
(grup funkcyjnych).
1.4.3. Polikondensacja
Jest
to
proces
łączenia
się
wielu
cząsteczek
substancji
wyjściowych
w związek wielkocząsteczkowy z jednoczesnym wydzielaniem prostego związku
małocząsteczkowego jako produktu ubocznego reakcji, np. wody H
2
O, chlorowodoru HCl,
amoniaku NH
3
).
n x - A – y →
[
A]
n
+ n xy
lub
n x - A - x +
n y - B - x
↔
x-(A-B)
n
- y +
(n-l)xx
A,B - monomery zawierające grupy funkcyjne x, y, x,y -
grupy funkcyjne.
[
A]
n
; x-(A-B)
n
- y - polimery
xy - mało cząsteczkowy produkt uboczny.
1.5. Starzenie się związków wielkocząsteczkowych (polimerów) - reakcje
destrukcyjne
Trwałość polimerów określają następujące czynniki: - budowa
makrocząsteczek,
- stan fizyczny polimeru,
- aktywność środowiska,
- rodzaj i natężenie działania energetycznego,
- obecność zanieczyszczeń zdolnych przyspieszyć lub zahamować rozkład.
W związkach wielkocząsteczkowych pod wpływem takich czynników jak energia, zwłaszcza
cieplna, oraz utlenianie chemiczne lub działanie czynników agresywnych mogą zachodzić
zmiany chemiczne, które spowodują pogorszenie się właściwości fizykochemicznych
tworzyw. Starzeniu polimerów towarzyszą reakcje rozkładu: destrukcja, degradacja i
depolimeryzacja.
1.5.1. Destrukcja
W procesie destrukcji następuje nieregularny rozpad polimeru, między innymi do
produktów małocząsteczkowych, np.:
1.5.2. Degradacja
W procesie degradacji zachodzi przypadkowe zmniejszenie masy cząsteczkowej przez
rozkład polimeru nie na produkty małocząsteczkowe lecz na fragmenty o dużych, chociaż
mniejszych od wyjściowego polimeru ciężarach cząsteczkowych. Metodą degradowania jest
np. oddziaływanie mechaniczne - walcowanie.
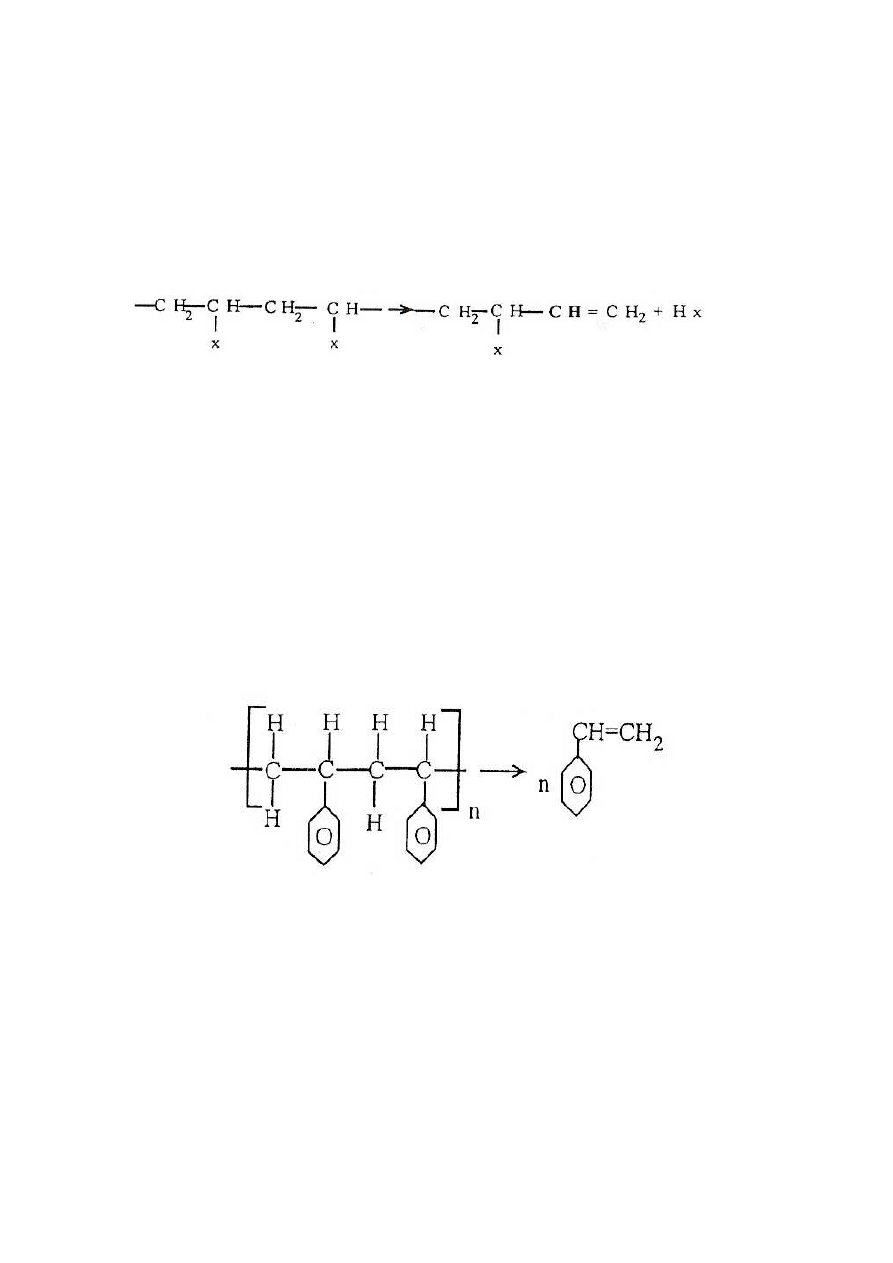
1.5.3. Depolimeryzacja
Depolimeryzacja jest to reakcja rozkładu, podczas której wydziela się czysty monomer Jako
produkt rozkładu termicznego związku wielkocząsteczkowego, np. polistyren do styrenu:
Procesy destrukcyjne działają w kierunku zmniejszenia długości łańcuchów makro
cząsteczek,
a
więc
zmniejszenia
ciężaru
cząsteczkowego
i
związanych
z tym zmian takich właściwości, jak: lepkość roztworów, wytrzymałość mechaniczna,
elastyczność, stan skupienia, temperatura topnienia, rozpuszczalność itp. Większą lub
mniejszą skłonność polimerów do rozkładu określa ich trwałość chemiczna i termiczna.

1.6. Odporność termiczna polimerów
O podstawowych właściwościach każdego polimeru decyduje przede wszystkim jego
masa cząsteczkowa i struktura chemiczna. Przez strukturę polimeru należy rozumieć budowę
chemiczną makrocząsteczek, ich przestrzenną konfigurację i wzajemne położenie oraz
stopień krystaliczności. W stanie stałym większość związków wielkocząsteczkowych to
polimery bezpostaciowe. Atomy wchodzące w skład makrocząsteczki tworzą łańcuch główny
utworzony najczęściej z atomów węgla i przyłączonych do niego podstawników. Makro
cząsteczki mają w rzeczywistości postać trójwymiarową i są w przestrzeni chaotycznie
skłębione.
Związki wielkocząsteczkowe wykazują różną wytrzymałość łańcucha na rozerwanie
i
niejednakowo ulegają wpływom temperatury.
Jednym z zasadniczych czynników, które wpływają na wielkość rozkładu termicznego
jest moc (energia) wiązań między atomami.
W tabeli l. przedstawiono średnie wartości energii wiązania w zależności od grupy, czy
związku, w jakim to wiązanie występuje.
Ś
rednia energia wiązania E
0
(termochemiczna energia wiązania) jest wielkością przypisywaną
każdemu wiązaniu w taki sposób, że suma energii wszystkich wiązań jest równa entalpii
reakcji rozkładu l mola gazowych cząsteczek na atomy w temperaturze 0°C w stanie
podstawowym.
Tabela 1.
Energia wiązań
Na podstawie wartości energii podanych w tabeli l. należy przypuszczać, że polimery
zbudowane na bazie wiązań wielokrotnych będą bardziej odporne na działanie temperatury
niż te z wiązaniami pojedynczymi.
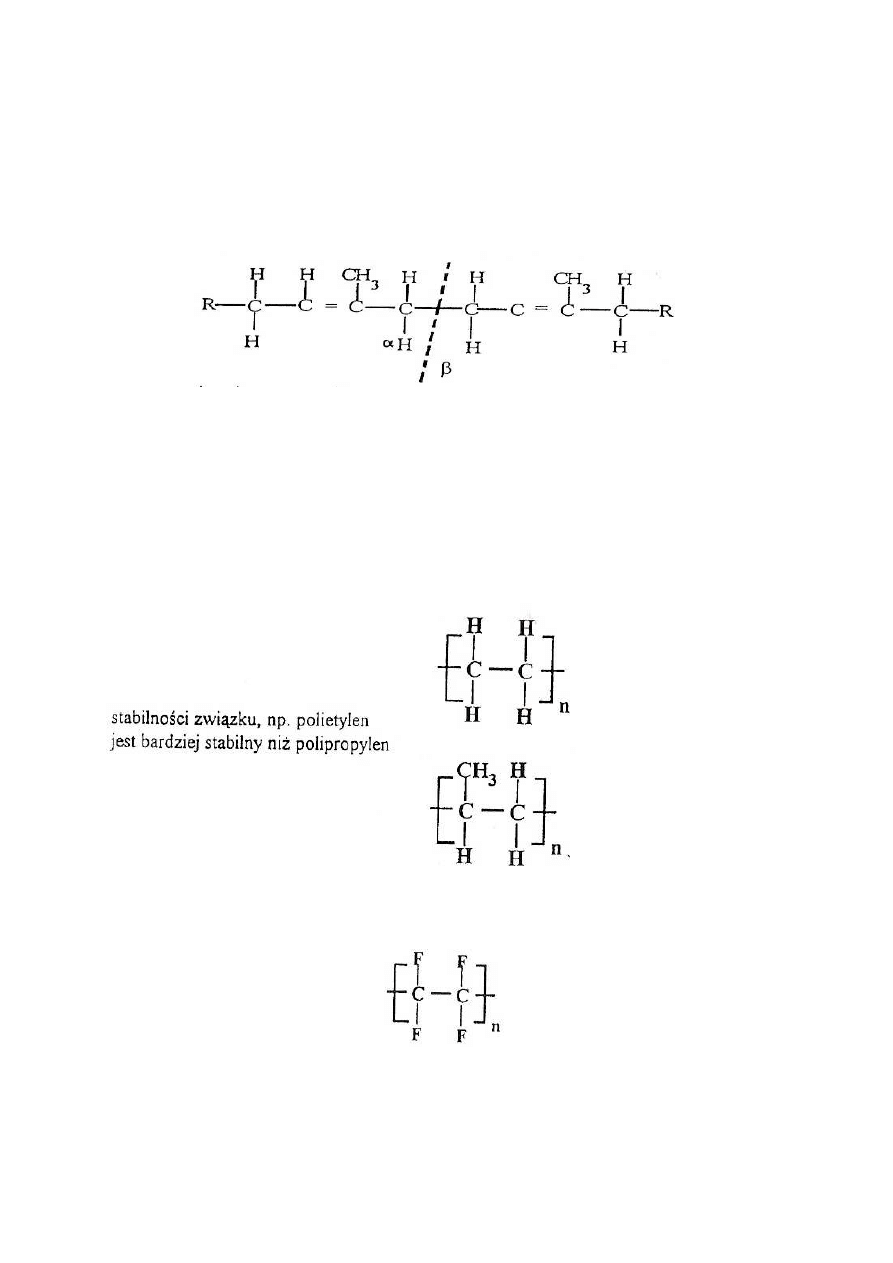
Jednocześnie trzeba pamiętać, że występujące w związku wiązanie podwójne powoduje
osłabienie
wiązania
pojedynczego
C-C
(wiązania
ß),
np. w polizoprenie, czy w polibutadienie. Polizopren:
wiązanie α jest wzmocnione przez sąsiedztwo z wiązaniem podwójnym).
Z
danych
literaturowych
wynika,
ż
e
nie
tylko
wiązania
wielokrotne
w łańcuchach mogą wpływać na odporność termiczną polimerów, ale również ich struktura.
Stwierdzono, że:
a) liniowość łańcucha, brak rozgałęzień w łańcuchu polimerów typu parafinowego sprzyja
Stabilność polimeru nie wzrasta znacząco, gdy 3 atomy wodoru zastąpione zostaną atomami
fluoru (F), ale wzrasta znacznie w przypadku podstawienia nim 4 atomów wodoru
(policzterof1uoretylen)
Natomiast podstawienie w miejsce atomu wodoru grupy - Cl, np. polichlorek winylu

zmniejsza Odporność termiczną polimeru, ze względu na łatwość odszczepienia
chlorowodoru HCl (początek w » 200°C).
Odporne są związki całkowicie chlorowcowane.
b) podstawienie grupy CH) w miejsce wodoru obniża stabilność termiczną, np. w poli-
propylenie,
c) obniżenie stabilności polimeru występuje też na skutek wprowadzenia do łańcucha
dużych grup bocznych np. benzylowych, w polistyrenie,
d)
pierścień benzenowy w łańcuchu głównym polimeru powoduje wzrost stabilności
termicznej np. w polibenzylu. Wzrost termostabilności zachodzi dzięki rezonansowi
pierścieni grup wprowadzonych do łańcucha,
e)
sieciowanie podnosi termostabilność polimeru, np. poliwinylobenzenu,
f)
obecność tlenu w łańcuchu wpływa na obniżenie temperatury rozkładu polimeru, np.
politlenku etylenu,
g)
wysoki ciężar cząsteczkowy wzmacnia stabilność termiczną polimerów, ale np. dla
niektórych poliamidów (nylonu) - wzrost ciężaru powoduje spadek stabilności,
h)
obecność zanieczyszczeń w polimerze obniża jego odporność termiczną.
2. Spalanie tworzyw sztucznych
Spalanie tworzyw sztucznych to proces, który obejmuje wiele przemian fizycznych i
chemicznych.
Wyróżnia się trzy podstawowe etapy spalania. Pod wpływem ciepła następuje:
a.
ogrzewanie materiału,
b.
rozkład termiczny - piroliza,
c.
zapalenie
ad. 2a) Ogrzewanie materiału
Pod wpływem działającego ciepła tworzywa sztuczne ulegają różnym przemianom:
mięknięciu, topnieniu lub rozkładowi z wytworzeniem warstwy węgla. Kolejność tych
procesów, poprzedzających wytwarzanie fazy lotnej, zależy od właściwości tworzyw (rys. l.)
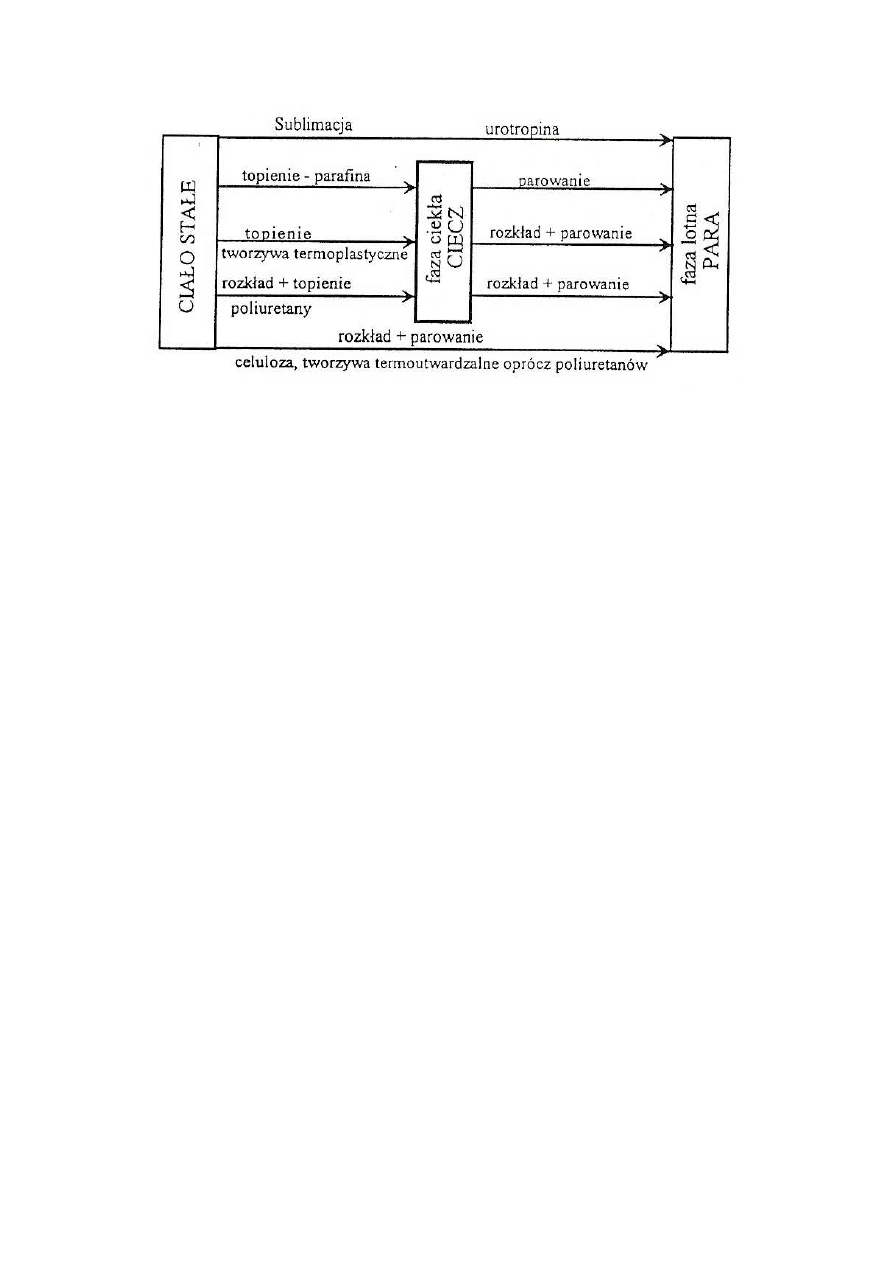
Rys. 1. Różne sposoby wydzielania fazy lotnej jako paliwa z ciała stałego
Przykłady:
- urotropina, naftalen przechodzą z fazy stałej do gazowej z pominięciem fazy ciekłej;
- parafina topi się. a następnie przechodzi do fazy gazowej bez chemicznej przemiany;
- tworzywa termoplastyczne topią się, a następnie rozkładają z wytworzeniem lotnych
produktów o niskim ciężarze cząsteczkowym. Ciepło z zewnętrznego źródła przekazywane do
tworzywa stopniowo podnosi jego temperaturę. Szybkość wzrostu temperatury danego
polimeru jest funkcją szybkości przepływu strumienia ciepła od źródła do materiału, różnicy
temperatur pomiędzy powierzchnią ogrzewaną, a jego wnętrzem, jak i następujących
parametrów, które są cechą charakterystyczną dla danego polimeru (tabela 2.)
- ciepła właściwego ( temperatura materiałów o wysokim cieple właściwym wzrasta wolniej
niż materiałów o niskim cieple właściwym);
- przewodnictwa cieplnego (wysoka wartość przewodnictwa cieplnego powoduje, że ciepło
jest przekazywane o wiele szybciej niż byłoby przekazywane przy niskim przewodnictwie
cieplnym);
- entalpii zachodzących reakcji topienia; parowania lub innych zmian, które występują
podczas ogrzewania.
W większości rodzajów tworzywa odznaczają się małym ciepłem właściwym
i złym przewodnictwem ciepła, co powoduje nagrzewanie się ich powierzchni
i zachodzenie powolnych przemian w warstwach położonych głębiej.
Tabela 2.
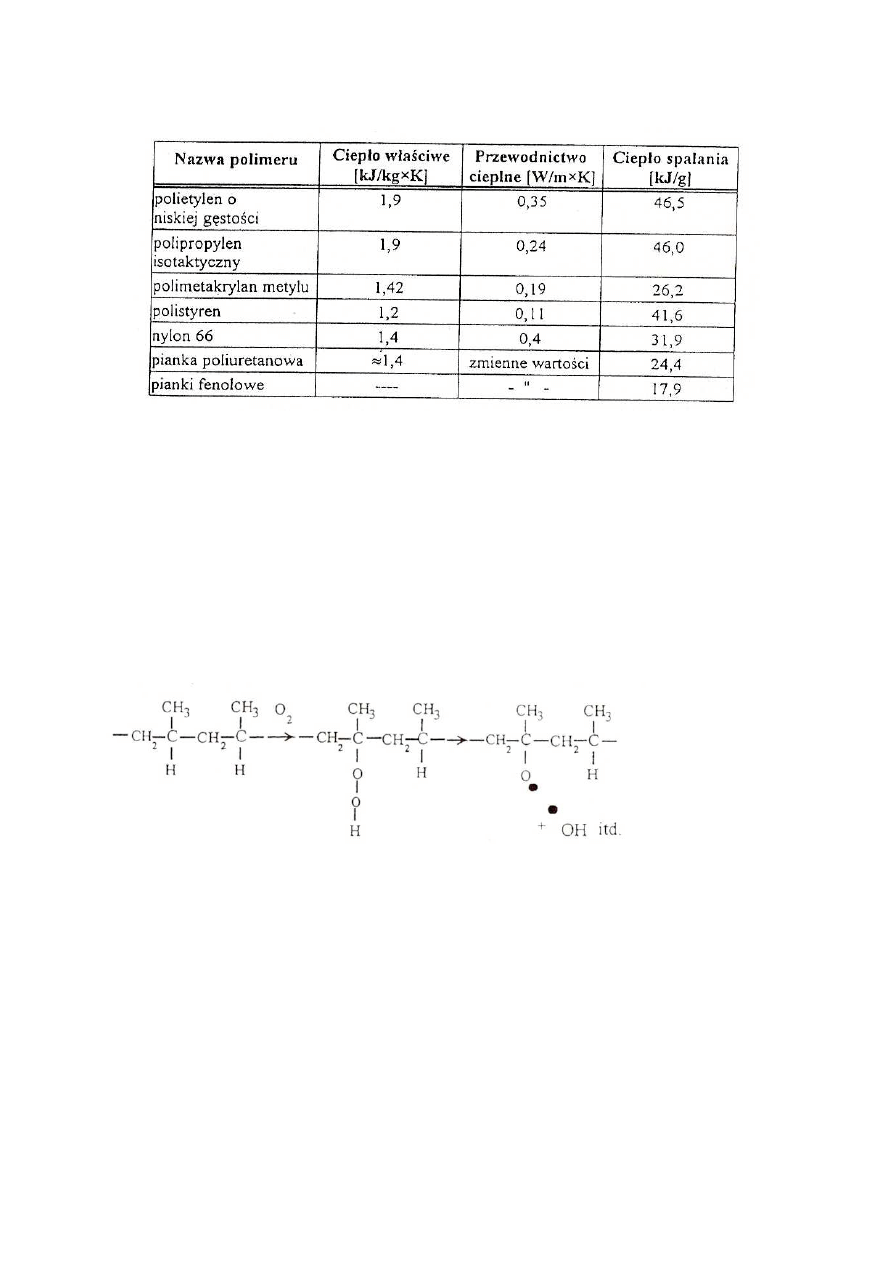
Ciepło właściwe, przewodnictwo cieplne, ciepło spalania niektórych polimerów
ad.2b) Rozkład termiczny
Związki
wielkocząsteczkowe
pod
wpływem
energii
cieplnej
i promieniowania ultrafioletowego reagują z tlenem, a także z innymi związkami
chemicznymi. Wynikiem tego może być zmiana składu chemicznego, degradacja lub
destrukcja. Powstają produkty zdolne do dalszych reakcji inicjujące reakcje
depolimeryzacji,
np.:
w
reakcji
z
tlenem
w łańcuchu polimeru powstaje grupa wodoronadtlenowa, która może następnie ulec
rozpadowi na rodniki zdolne do dalszej reakcji.
W środowisku gazu obojętnego lub w próżni pod wpływem wysokiej temperatury może
przebiegać również proces rozkładu polimeru zwany pirolizą, połączony z wydzielaniem
lotnych gazów i fragmentów polimeru. Temperatura i szybkość pirolizy polimeru zależy od
jego termicznej stabilności i reakcji chemicznych rozkładu (tj. depolimeryzacji, destrukcji i
degradacji) występujących w istniejących warunkach.
Aby tworzywo mogło ulec rozkładowi, musi być dostarczona odpowiednia energia, która
wystarczy do rozerwania wiązań pomiędzy poszczególnymi atomami, z których związki te są
zbudowane.
O możliwości zaistnienia reakcji rozkładu decyduje wielkość energii aktywacji polimeru
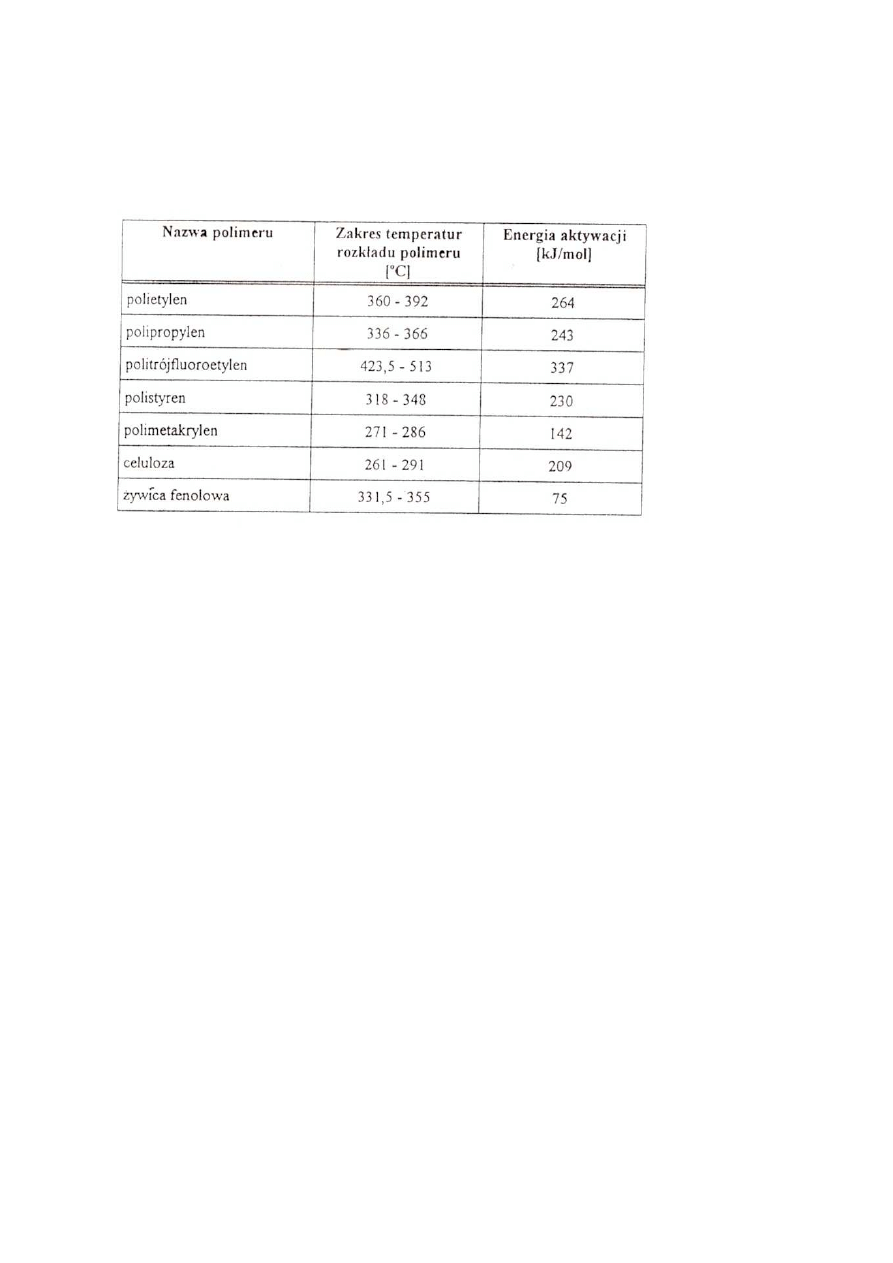
Tabela 3
Energie aktywacji rozkładu termicznego niektórych polimerów
organicznych w próżni
Rozkład
termiczny
tworzyw
jest
procesem
endotermicznym
i
nieodwracalnym,
przebiegającym
początkowo
pod
wpływem
dostarczonego
z zewnątrz ciepła, a następnie ciepła wytwarzanego w czasie spalania. Ze względu na to, że
powierzchnia tworzyw nagrzewa się szybciej niż warstwy położone głębiej, wytwarza się
gradient temperatur i szybkość pirolizy na powierzchni jest największa.
Gdy materiał ma dużą powierzchnię właściwą, to o szybkości pirolizy decyduje tylko
nagrzanie powierzchniowe. W związku z tym, materiały spienione, gąbczaste, w postaci folii
itp. o dużej powierzchni właściwej są w obecności powietrza najbardziej niebezpieczne pod
względem pożarowym.
W trakcie rozkładu termicznego, w zależności od rodzaju tworzywa, mogą wydzielać się
następujące produkty:
a)
gazy palne lub pary, które spalają się w obecności powietrza (metan, etan, etylen,
formaldehyd, aceton, tlenek węgla),
b)
gazy niepalne lub gazy, które nie palą się w obecności powietrza - dwutlenek węgla,
chlorowodór, bromowodór, para wodna,
c)
ciecze,
zwykle
częściowo
rozłożony
polimer
i
związki
organiczne
o wysokim ciężarze cząsteczkowym,
d)
produkty stałe - zwykle zwęglone pozostałości, węgiel lub popiół,
e)
porwane cząsteczki stałe lub fragmenty polimeru jako dym.

Przykład
Wiele polimerów takich jak polimetastyren, polimetakrylan metylu rozkładają się głównie do
monomeru, który jest zwykle palny w wystarczająco wysokiej temperaturze, spalanie jest
prawie całkowite.
Materiały takie jak żywice fenolowe lub poliestry termoutwardzalne podlegają bardziej
skomplikowanemu rozkładowi, w wyniku którego powstają różnorodne gazowe produkty
zdolne do dalszego rozpadu i pozostałość zwęglona zawierająca trudno zapalający się węgiel
pirolityczny.
Polimery takie jak polichlorek winylu PCV degradują się najpierw poprzez eliminację
chlorowodoru HCI. Taki rozkład powoduje wzrost ilości wiązań nienasyconych w łańcuchu
polimerowym, które komplikują procesy utlenienia. Doprowadza to do wytworzenia struktur
aromatycznych i powstania zwęglonej masy.
Na stopień rozkładu polimeru wpływa tzw. charakterystyka materiałowa, tj.:
1)
struktura materiału i jego właściwości fizyczne,
2)
temperatura początkowego rozkładu lub najniższa temperatura rozkładu,
3)
szybkość wzrostu temperatury w materiale,
4)
zawartość tlenu w otoczeniu (obecność tlenu zwiększa przebieg destrukcji,
jak i ilość produktów rozkładu),
5)
szybkość przepływu powietrza w układzie,
6)
temperatura otoczenia.
Skład i objętość tworzącej się fazy lotnej zależy również od wymiaru i kształtu próbki.
ad.2c) Zapalenie
Zapalenie
tworzyw
sztucznych
występuje
wówczas,
gdy
powstałe
z rozkładu termicznego gazy osiągną stężenie w zakresie granic zapalności
i temperaturę równą temperaturze zapalenia chociaż jednego składnika. Podtrzymanie
procesu
palenia
jest
zależne
od
ilości
ciepła
przekazanego
z
płomienia
do
polimeru,
od
ilości
gazów
palnych,
i
od
ilości
tlenu
w otoczeniu. Wynika z tego, że proces spalania nie będzie utrzymany, jeśli rozkład wymaga
więcej ciepła niż dostarczone przez płomień lub jeżeli stała, niepalna pozostałość pokryje
powierzchnię i odizoluje pozostałość palnego polimeru od źródła ciepła.

Spalanie gazów powstałych z rozkładu termicznego jest reakcją egzotermiczną. Wszystkie
polimery palą się powierzchniowo płomieniem dyfuzyjnym. Czynnikiem wspomagającym,
który determinuje szybkość spalania płomieniowego jest ciepło spalania. Na zapalność
tworzywa ma wpływ zawartość atomów wodoru w cząsteczce polimeru. Im liczba atomów
wodoru jest mniejsza, tym mniej palnych gazów wytwarza się w czasie pirolizy, zaś pozo:
stałość stała jest większa.
Mechanizm spalania tworzyw sztucznych zależy od budowy tych tworzyw. Inaczej ulegają
spalaniu tworzywa termoplastyczne, inaczej termoutwardzalne.
2.1. Spalanie tworzyw termoplastycznych
W czasie rozkładu w wyniku przemian fizycznych (parowanie) oraz chemicznych
(destrukcja) tworzywa termoplastyczne wytwarzają mieszaninę gazową. Powstała faza lotna
może ulec zapaleniu lub zapłonowi i w rezultacie spalać się płomieniowo. Mechanizm
spalania tego rodzaju tworzyw można porównać ze spalaniem cieczy. W taki sposób pali się
polimetastyren.
2.2. Spalanie tworzyw termoutwardzalnych
Tworzywo
termoutwardzalne
rozkłada
się
pod
wpływem
ciepła
z wytworzeniem związków nisko cząsteczkowych o różnych stanach skupienia. W chwili
zapalenia
lub
zapłonu
palna
faza
lotna
zapala
się
płomieniem,
a pozostałość popirolityczna (koksowa) zaczyna spalać się bezpłomieniowo, (czyli tlić) na
granicy rozdziału fazy stałej i lotnej (powietrze). W taki sposób spalają się np. poliestry
termoutwardzalne.
Tabela 5.
Temperatura zapalenia wybranych polimerów
2.3. Sposoby zmniejszenia palności tworzyw sztucznych
W celu ograniczenia palności tworzyw sztucznych istnieje konieczność ich
modyfikacji, której celem poprawa właściwości pożarowych. Konwencjonalne metody
obniżania palności polegają na dodaniu do polimerów związków chemicznych
(komponentów), nazywanych środkami ogniochronnymi, antypirenami. Do najbardziej
powszechnych zalicza się: tritlenek antymonu i molibdenu, fosforany i polifosforany
amonowe, boran cynku, wodorotlenek glinu i magnezu i inne. Ich mechanizm działania
ogólnie polega na:
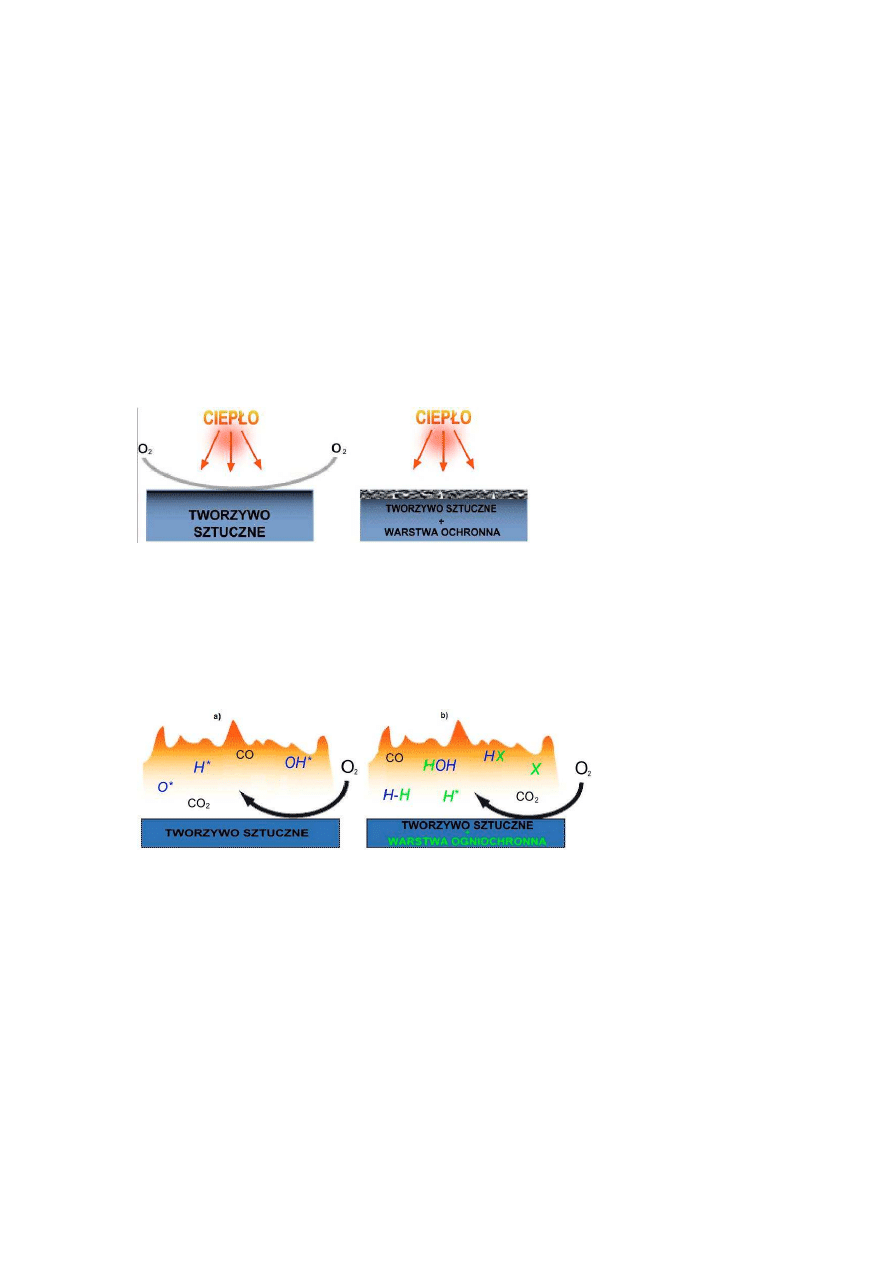
•
fizycznym działaniu w fazie stałej (rys.2),
ź
ródło: Jaskółowski W., Mojski K, Ogrodniczuk K., Środki ogniochronne do tworzyw
sztucznych: teraźniejszość i przyszłość, Przegląd Pożarniczy, 4/2008.
Rys. 2. Mechanizm działania fizycznego w fazie stałej.
•
chemicznym działaniu w fazie lotnej (rys.3),
ź
ródło: Jaskółowski W., Mojski K, Ogrodniczuk K., Środki ogniochronne do tworzyw
sztucznych: teraźniejszość i przyszłość, Przegląd Pożarniczy, 4/2008.
Rys. 3. Mechanizm działania chemicznego w fazie lotnej.
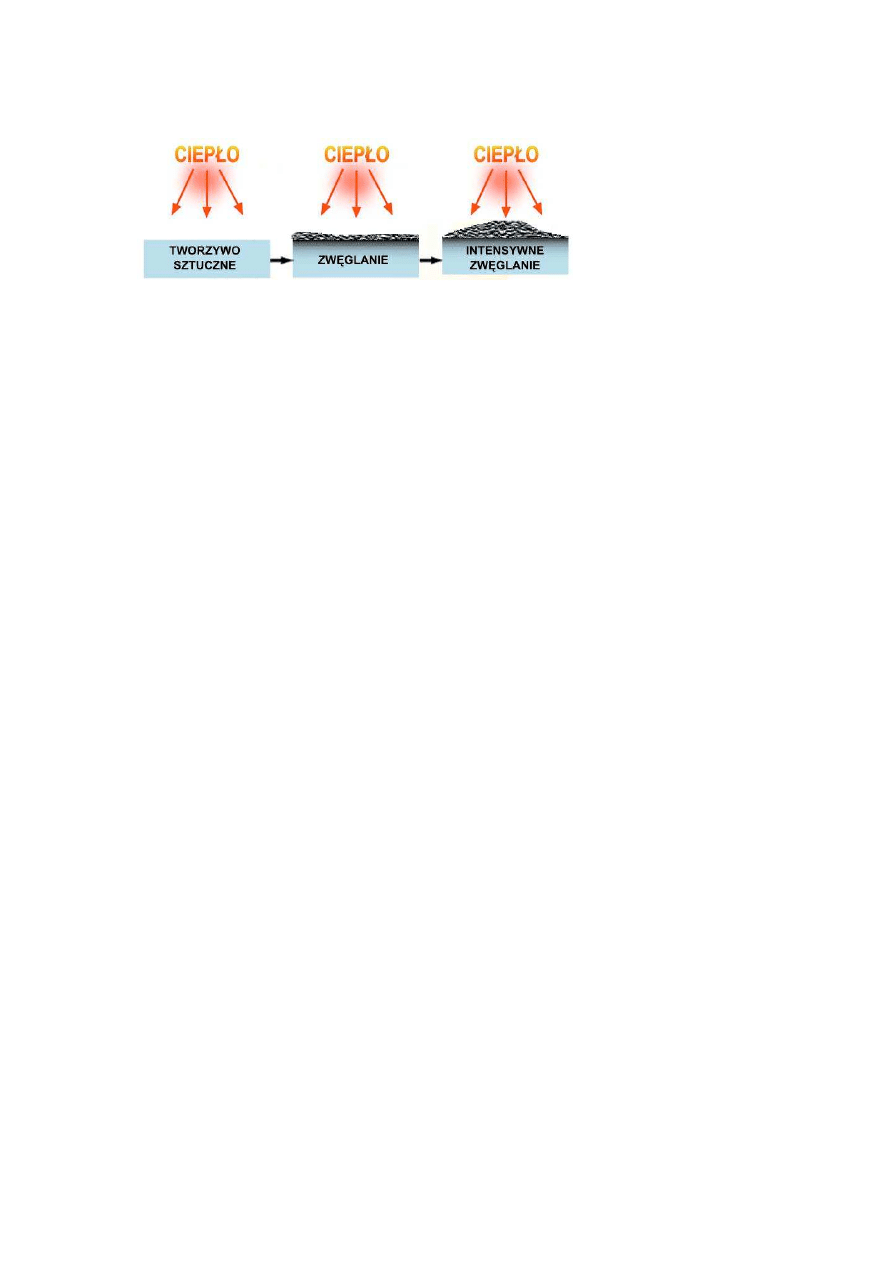
•
fizycznym i chemicznym działaniu w fazie stałej (rys.4).
ź
ródło: Jaskółowski W., Mojski K, Ogrodniczuk K., Środki ogniochronne do tworzyw
sztucznych: teraźniejszość i przyszłość, Przegląd Pożarniczy, 4/2008.
Rys. 4. Mechanizm działania fizycznego i chemicznego w fazie stałej.
Głównie zaletą stosowania antypirenów jest spowolnienie procesu rozkładu termicznego
materiału będącego pod wpływem oddziaływania promieniowania cieplnego i tym samym
zmniejszenie szybkości spalania. W rezultacie temperatura pożaru z udziałem wyrobów
(materiałów) wzrasta wolniej.
Efekt ten zawdzięcza się dzięki:
1.
Wytworzeniu powierzchniowej warstwy izolacyjnej w czasie spalania (dodatek boranów i
fosforanów wapnia, glinu oraz związku chlorowców) (rys.4). W rezultacie zmniejsza się
szybkość ubytku masy i związana z tym szybkość wydzielanego ciepła.
2.
Dezaktywacji aktywnych atomów i rodników tworzących się w płomieniu (rys.3).
3.
Zmniejszeniu powierzchni rozprzestrzeniania się płomieni.
4.
Wydzielaniu niepalnych produktów rozkładu termicznego, które mieszając się z tlenem
zawartym w powietrzu, obniżają stężenie tlenu, mają działanie chłodzące i tym samym
spowalniają proces spalania.
Ze stosowaniem chemicznych środków ogniochronnych związane są również wady.
Ujemnym skutkiem ich stosowania jest często toksyczność produktów rozkładu termicznego
i spalania, powstających w sytuacji, gdy wyroby z tworzyw sztucznych znajdą się w
ś
rodowisku pożarowym. W czasie spalania powstają produkty toksyczne, zarówno gazowe,
ciekłe, jak stałe. Należą do niech m.in.[2-3]:
•
halogenowodory, które oprócz działania toksycznego są niejednokrotnie przyczyną
korozji urządzeń, maszyn, które znalazły się w strefie pożaru,
•
polibromowane dibenzo-p-dioksyny (PBDDs) oraz dibenzofurany (PBDFs),
•
polichlorowane dibenzo-p-dioksyny (PCDDs) oraz dibenzofurany (PCDFs),
•
SO
2
i NO
x
,
•
cyjanowodór; najwięcej cyjanowodoru uwalniają żywice typu poliakrylonitrylowego,
nieco mniej żywice poliamidowe, a także wełna, zaś najmniej żywice nie zawierające
azotu, powstałe na bazie celulozy i polietylenu.
•
amoniak.
Istnieje zatem konieczność prowadzenia prac badawczych nad chemicznymi środkami
ogniochronnymi, które zachowałyby swoje funkcje przy jednoczesnym obniżeniu stopnia
toksyczności i dymotwórczości produktów rozkładu termicznego i spalania z ich udziałem.
Nowe nadzieje w tym zakresie związane są ze stosunkową nową dziedziny wiedzy jaką jest
nanonauka i związana z tym bezpośrednio nanotechnologia. Nanonauka [4] to badanie
zjawisk i manipulacja elementami materii na poziomie atomowym, molekularnym
i makromolekularnym (zakres od 1-100 nm), gdzie właściwości materii różnią się w istotny
sposób od właściwości w większych skalach wymiarowych.
ź
ródło: Jaskółowski W., Mojski K, Ogrodniczuk K., Środki ogniochronne do tworzyw
sztucznych: teraźniejszość i przyszłość, Przegląd Pożarniczy, 4/2008.
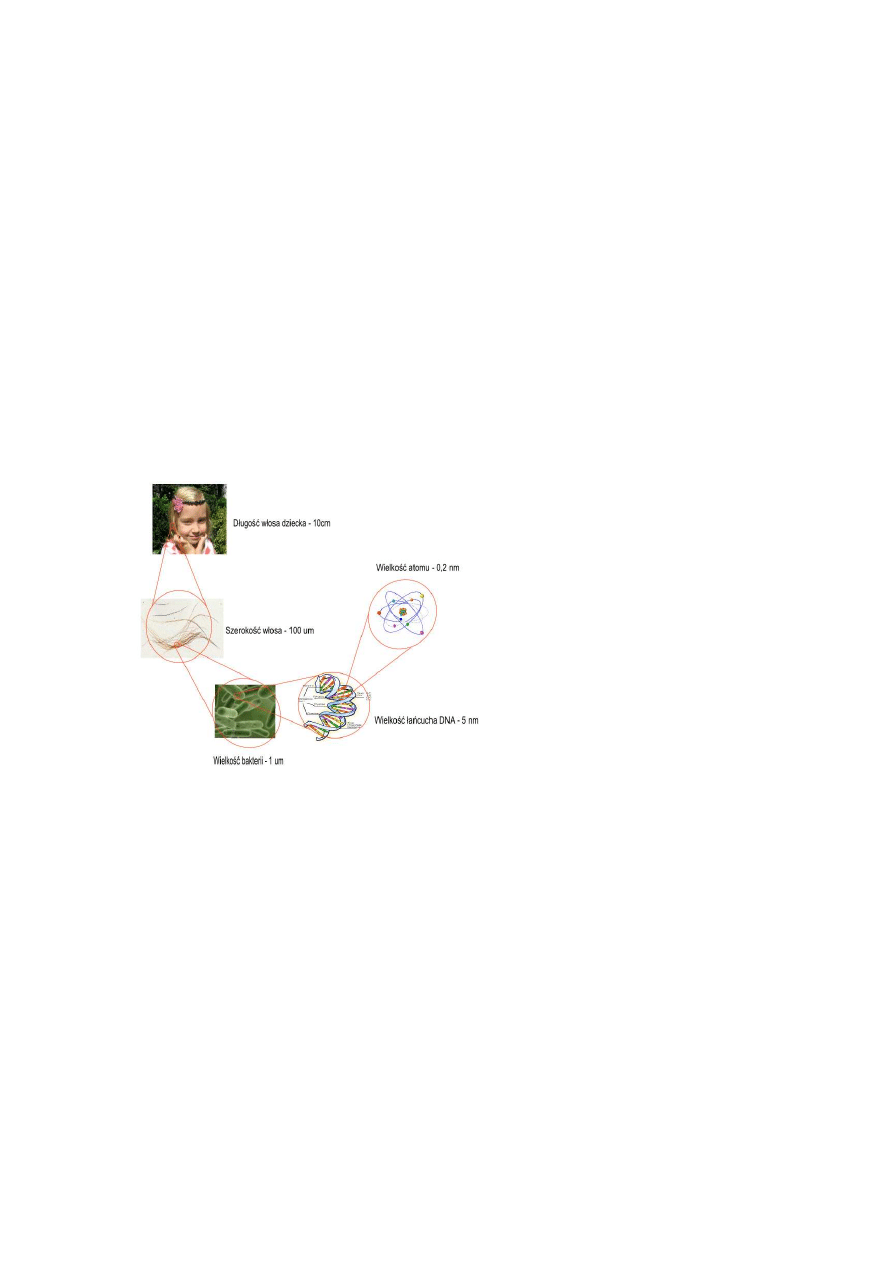
Rys.5. Porównanie rozmiarów wybranych struktur (elementów).
W inżynierii materiałowej wykorzystywane są następujące nanonapełniacze [3, 5-9]:
•
montmorylonit - Al
2
[(OH)
2
Si
4
O
10
]·nH
2
O; uwodniony hydrokrzemian glinu (zawierać
może także żelazo lub magnez). Minerał należący do grupy minerałów ilastych..
Barwa biała, żółta, zielona lub szara. Posiada bardzo dobre właściwości adsorbcji
wody. Powstaje wskutek procesów wietrzenia chemicznego (wietrzenie) różnego
rodzaju skał. W Polsce w większych ilościach spotykany na obszarze Karpat oraz w
okolicach Buska - Zdroju,
•
metale i ich związki – np.: TiO
2
, Fe
2
O
3
Ag,

ź
ródło: http://images.google.pl/
Rys. 6. Nanocząsteczki TiO
2
•
krzemionki; nazwa zwyczajowa tlenku krzemu, SiO
2
, bezwodnika kwasów
krzemowych (krzemiany). Bezbarwne ciało stałe o temperaturze topnienia 1710°C;
dodawanie krzemionki poprawia właściwości mechaniczne i termiczne materiałów
•
nanorurki węglowe; w 1991 r. japończyk Sumoi Iijima oglądając za pomocą
mikroskopu elektronowego w Laboratorium Badań Podstawowych Firmy NEC w
Tsukubie w Japonii próbkę rozmazanej sadzy dostrzegł w niej dziwne nici o
rozmiarach rzędu nanometrów nazwane później nanorurkami.
ź
ródło: www.nanonet.pl
Rys.7. Nanorurki węglowe
•
fullereny; odmiany alotropowe węgla, które zostały odkryte dość niedawno bo w
1996 r. Odkrywcy (H. Koto, R.Smalley oraz B.Curl) [10] otrzymali nagrodę Nobla w
dziedzinie fizyki. Stosowanie fullerenów oraz nanorurek wpływa głównie na wzrost
właściwości mechanicznych i elektrycznych modyfikowanych materiałów. Nazwa
„fullereny” pochodzi od nazwiska amerykańskiego konstruktora, budowniczego i
matematyka R. Buckminstera Fullera, który kontruował kopuły przypominające
fragment cząsteczki C
60

ż
ródło: www.nanonet.pl/
Rys.7. Fullereny
Nanokompozyty polimerowe otrzymuje się wykorzystując głównie [8]:
1.
Metodę polimeryzacji in situ.
2.
Metodę rozpuszczalnikową.
3.
Metodę polegającą na mieszaniu nanonapełniacza z uplastycznionym
polimerem.
Spośród ww. nanonapełniaczy podstawowymi produktami stosowanymi do
ograniczenia palności tworzyw sztucznych są krzemiany wielowarstwowe. Decydują o tym
przede wszystkim względy ekonomiczne. Nanokompozyty polimerowe w przeciwieństwie
do tradycyjnych środków ogniochronnych wymagają relatywnie niskiego napełnienia, przy
zachowaniu dobrych właściwości użytkowych i przetwórczych. Mechanizm oddziaływania
nanonapełniaczy nieorganicznych związany jest przede wszystkim z wytworzeniem trwałej i
stabilnej struktury węgla porowatego, która w początkowej fazie spalania chroni materiał
przed intensywnym rozkładem termicznym. Ponadto powstała struktura stanowi fizyczną
barierę ograniczającą przepuszczalność z jednej strony tlenu zawartego w powietrzu oraz
strumienia ciepła do termicznie nierozłożonego materiału. Z drugiej strony utrudnia
gazyfikację produktów rozkładu termicznego. W rezultacie szybkość wydzielania ciepła dla
badanych tworzyw sztucznych, np.: PMMA z dodatkiem krzemionki (SiO
2
) ulega redukcji o
ok. 50 % [6].
Oprócz zalet z zakresu bezpieczeństwa pożarowego dowiedziono, że nanokompozyty
polimerowe w porównaniu z niemodyfikowanymi charakteryzują się [ 1]:
•
lepszymi właściwościami mechanicznymi,
•
lepszymi właściwościami optycznymi,
•
lepszą przewodnością jonową

II.
CZĘŚĆ DOŚWIADCZALNA
Oznaczanie temperatury zapalenia tworzyw sztucznych wg
PN-69/C-89022 Tworzywa sztuczne. Oznaczanie temperatury zapalenia
2.1. Definicje podstawowe
Temperatura zapalenia tworzyw sztucznych
Temperatura zapalenia tworzyw sztucznych jest to najniższa temperatura powierzchni
grzejnej, przy której gazowe produkty rozkładu termicznego ciała stałego zapalają się
płomieniem od punktowego bodźca termicznego, np. płomienia.
Temperatura zapalenia jest wielkością stałą dla danego tworzywa i w danych określonych
warunkach badania.
Jej wartość zależy od:
- sposobu i szybkości ogrzewania,
- stopnia rozdrobnienia tworzywa,
- źródła zapłonu,
- czasu oddziaływania.
2.2. Metoda oznaczania temperatury zapalenia tworzyw sztucznych
wg PN-69/C-89022
Istota metody
Istota metody polega na ogrzaniu próbki badanego tworzywa (do temperatury 10° C
niższej od spodziewanej temperatury rozkładu) i na próbie zapalenia wydzielających się
gazów.
Za temperaturę zapalenia przyjmuje się najniższą temperaturę, w której nad wylotem
gilzy z tworzywem można zaobserwować płomień nie znikający przez co najmniej 5 s.
Aby zminimalizować wpływ czynników takich jak sposób i szybkość ogrzewania,
stopień
rozdrobnienia
itd.
na
wartość
temperatury
zapalenia,
w normie PN-69/C-89022 określono wymiary kawałków, na jakie trzeba rozdrobnić badane
tworzywo, wymiary probówki (gilzy), w której poddaje się rozkładowi termicznemu
tworzywo sztuczne.
2.3. Wykonanie oznaczenia temperatury zapalenia tworzyw sztucznych
2.3.1. Opis aparatury
Przyrząd do oznaczania temperatury zapalenia tworzyw sztucznych (rys. 8.) składa się z
następującego zestawu:
a)
bloku w postaci okrągłego, aluminiowego walca z 4 otworami na probówki
(gilzy) z ba danym tworzywem. Blok jest ogrzewany elektrycznie tak, aby
można było osiągnąć temperaturę w zakresie od 0 do 700°C,

Rys. 8. Zestaw aparatury do oznaczania temperatury zapalenia tworzyw sztucznych
b) czterech probówek ze stali kwasoodpornej o znormalizowanych wymiarach,
wyposażonych w metalowe przykrywki z otworami, przez które może uchodzić gaz
pochodzący z rozkładu ogrzewanego tworzywa sztucznego,
c) termometru (termopary),
d) palnika,
f)
zasilacza
2.3.2. Przygotowanie próbek tworzywa sztucznego
Badane tworzywo należy rozdrobnić na kawałki o wymiarach od 0,5 mm do
1,0 mm. Do każdego oznaczenia należy użyć próbki o masie 1±0,1g.
Do oznaczania temperatury zapalenia należy przygotować co najmniej 3 próbki tworzywa.
UWAGA:
Tworzywa termoplastyczne mogą się w czasie oznaczania topić i pienić przed procesem
wydzielania
gazów
palnych.
Jeżeli
pienienie
jest
bardzo
obfite
i uniemożliwia wykonanie oznaczenia, masę próbki należy zmniejszyć do 0,5±0,1g. Jeżeli w
dalszym ciągu pienienie jest bardzo obfite i utrudnia prowadzenie oznaczenia temperatury
zapalenia tworzywa nie może być oznaczone opisaną metodą.
2.3.3. Oznaczanie temperatury zapalenia tworzyw sztucznych
(a) Podgrzać blok metalowy do temperatury o 10°C niższej od spodziewanej temperatury
zapalenia tworzywa.
UWAGA:
Potrzebną temperaturę wyznacza się ze wskazań woltomierza przez odczyt określonego
napięcia, a następnie wyznaczenie Z charakterystyki termopary (zależność temperatury od
napięcia) temperatury.
(b) Przygotować próbki badanego tworzywa wg pkt. 2.3.2.
(c) Umieścić w metalowej probówce próbkę.
(d) Przykryć probówkę przykrywką.
(e) Umieścić probówkę w aluminiowym bloku.

(f) Spróbować za pomocą palnika o długości płomienia ok. 10 mm zapalić gazy,
wydzielające się przez otwór przykrywki (rys. 9).
Rys.9. Próba zapalenia gazowych produktów rozkładu termicznego.
Temperatura, przy której następuje zapalenie gazów odczytywana jest z termometru szklane
lub dla ułatwienia z termometru elektronicznego.
UWAGA:
Jeśli w czasie pierwszych 5 minut nad otworem nie pokaże się płomień nie znikający przez
co najmniej 5 sekund, temperatura zapalenia nie została jeszcze osiągnięta
(g) Podnieść temperaturę bloku o dalsze 10°C.
(h) Powtórzyć próbę, używając za każdym razem świeżej próbki wg punktów (c), (d), (e), (t)
aż do zapalenia gazowych produktów rozkładu.
(i) Opracowanie wyników,
Za wynik należy przyjąć średnią arytmetyczną wyników co najmniej trzech oznaczeń
różniących się od siebie nie więcej niż o 10
o
C.
Wyniki zamieścić w tabeli:
Nazwa materiału
Nr próbki Masa tworzywa
[g]
Temperatura
przy której
nastąpił
zapłon[
o
C]
Temperatura
zapłonu
gazowych
produktów
rozkładu
termicznego
[
o
C]

UWAGA:
Temperatura zapalenia, mimo że jako parametr właściwości pożarowych materiałów
mógłby
stanowić
podstawę
do
konstruowania
wymagań
przepisów
ochrony
przeciwpożarowej np. przy ograniczeniu stosowania w budownictwie materiałów
charakteryzujących się szczególnie niską temperaturą zapalenia, nie znalazła zastosowania
w przepisach wykonawczych wydanych do ustawy z dnia 24 sierpnia 1991r, o ochronie
przeciwpożarowej (Dz.U. Nr 81 poz. 351).
Praktycznie temperatura zapalenia jest tylko parametrem porównawczym stosowanym
do porównywania pod tym względem poszczególnych rodzajów materiałów, szczególnie
tworzyw sztucznych.
LITERATURA
1.
S. L. Madorsky: Thermal Degradation of Organic Polymers. John Wiley & Sons. Inc.
1964.
2.
D. Drysdale: An Introduction to Fire Dynamics. John Wiley & Sons Inc. New York
1985.
3.
L. Reich, S. Stivala: Elements of Polymer Degradation Mc Graw-Hill Inc. Book
Company, 1971.
4.
M. Stevens: Wprowadzenie do chemii i technologii polimerów. PWN, Warszawa
1983.
5.
S. Porejko: Chemia związków wielkocząsteczkowych. WNT, Warszawa 1972.
6.
T. Sikorski: Podstawy chemii i technologii polimerów. PWN, Warszawa 1981.
7.
C. J. Hilado: Flammability Handbook for Plastics. Westport: Technic Publ. Company.
1982.
8.
Zbiór wielkości fizykochemicznych. Praca zbiorowa pod red. K. P. Miszczenki i A.A.
Rawdiela. PWN, Warszawa 1974.
9.
Encyclopedia of Polymer Science and Technology. vol. 7. John Wiley & Sons Inc.
1967.
10.
W.Jaskółowski, K.Mojski. K.Ogrodniczuk: Środki ogniochronne do tworzyw
sztucznych: teraźniejszość i przyszłość. Ochrona przeciwpożarowa, 4/2008, s. 12.14
11.
PN-69/C-89022. "Tworzywa sztuczne. Oznaczanie temperatury zapalenia".
Wyszukiwarka
Podobne podstrony:
ozn temp zapalenia tw szt
cw 6 ozn temp zapalenia tw szt dsz
Temp zap onu oleju DOC
cw 1 ozn temp zaplonu cieczy dsz
cw2a ozn temp samozaplonu cieczy dsz
ĆW8 OZN TW WODY WODOCIĄGOWEJ
Zap miesnia sercowego, CMP, omdlenia
Jarek egz tw id 225830 Nieznany
C DOCUME~1 GERICOM USTAWI~1 Temp plugtmp 1 plugin lokalizacja przejsc problemy i dobre praktyki rkur
Mathcad TW kolos 2
więcej podobnych podstron