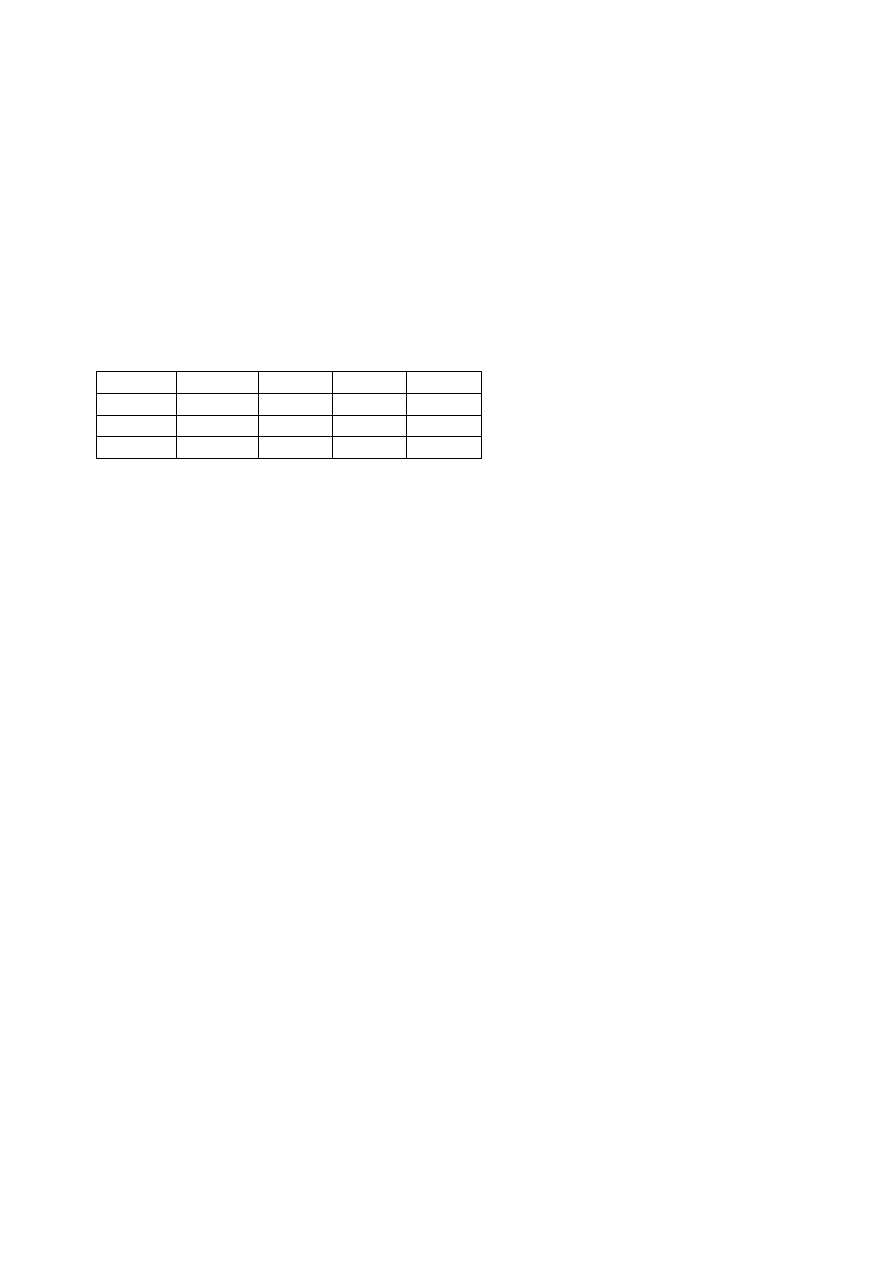
1
Lista 1 (2010)
Przemiany gazowe.
1. 3,25 mola jednoatomowego gazu doskonałego, znajdujący się w temperaturze 298 K i pod ciśnieniem
5 atm (5,05
⋅
10
5
Pa) rozpręża się izotermicznie do końcowego ciśnienia 1 atm (1,01
⋅
10
5
Pa). Obliczyć
ciepło Q pochłonięte przez gaz, jeśli przemiana jest (a) kwazystatyczna i (b) przeciwko stałemu
ciśnieniu 0,75 atm (0,75
⋅
1,01
⋅
10
5
Pa).
Odp.:a) 12,96 kJ, b) 4,83 kJ
2. Obliczyć końcową temperaturę jednego mola jednoatomowego gazu doskonałego znajdującego się w
temperaturze 298 K i pod ciśnieniem 5 atm (5,05
⋅
10
5
Pa), który rozpręża się adiabatycznie (a)
przeciwko stałemu ciśnieniu 1 atm (1,01
⋅
10
5
Pa), (b)
przeciwko stałemu ciśnieniu 0,34 atm
(0,34
⋅
1,01
⋅
10
5
Pa) i (c) kwazystatycznie. Obliczyć dla każdego z tych procesów: temperaturę
końcową gazu, pracę wykonaną przez gaz, zmianę energii wewnętrznej i entalpii.
Odpowiedzi
Warunki
T
k
[K]
W [kJ]
∆∆∆∆
U [kJ]
∆∆∆∆
H [kJ]
a)
202,6
-1,19
-1,19
-1,98
b)
254,0
-0,549
-0,549
-0,914
c)
156,5
-1,765
-1,765
-2,941
3. Trzy mole dwuatomowego gazu doskonałego znajdujące się w temperaturze 298 K i pod ciśnieniem
10 atm ogrzewa się izochorycznie do temperatury końcowej 398 K. Obliczyć zmianę entalpii gazu.
Odp.: 8,73 kJ
4. 2 mole jednoatomowego gazu doskonałego, znajdującego się w temperaturze 298 K i pod ciśnieniem
2,35 atm ochładza się izobarycznie do temperatury końcowej 278 K. Obliczyć zmianę energii
wewnętrznej gazu. Odp.: -498,8 J
5. Mol jednoatomowego gazu doskonałego, znajdującego się w warunkach standardowych ogrzewa się
adiabatycznie, quasi-statycznie do temperatury końcowej 398 K. Obliczyć pracę wykonaną przez gaz.
Odp. 1247 J
6. Do zbiornika z rozcieńczonym kwasem solnym dodano 5 g cynku. Obliczyć pracę wykonaną przez
ten reagujący układ. Założyć, że reakcja zachodzi w warunkach standardowych. Odp.: -189 J
7. Ile ciepła potrzeba do ogrzania powietrza w zamkniętym pokoju o powierzchni 10,7 m
2
i wysokości
2,5 m od 293 do 298 K? Obliczyć ilość ciepła potrzebną do ogrzania tego powietrza w takim samym
zakresie temperatur pod stałym ciśnieniem. Założyć doskonałość gazu oraz, że powietrze składa się z
78% n/n N
2
, 21% n/n O
2
i 1% Ar n/n. Odp.: 115,1 kJ, 161,4 kJ
8. Mol tlenu o temperaturze początkowej 300 K i objętości 5 dm
3
rozprężano adiabatycznie, aż ciśnienie
jego spadło do 10
5
Pa, przy czym gaz przesuwał tłok obciążony ciśnieniem 0,7
⋅
10
5
Pa. Obliczyć a)
temperaturę końcową gazu, b) pracę oraz zmianę energii wewnętrznej i c) zmianę entalpii przyjmując,
ż
e tlen zachowuje się jak gaz doskonały i że jego molową pojemność cieplną można przedstawić
wyrażeniem: C
p
o
=30,0 + 4,1
⋅
10
-3
T J/mol
⋅
K. Odp.:
a)
251,2 K b) -1112,3 kJ/mol, c) -1517,6 kJ/mol
9. Obliczyć Q, W i
∆
U w procesie quasi-statycznego sprężania 1 mola amoniaku w stałej temperaturze
300 K od ciśnienia p
1
=10 MPa do ciśnienia p
2
=40 MPa. Stałe równania van der Waalsa wynoszą
odpowiednio: a=0,422 J m
3
/mol
2
, b=6,14
⋅
10
-5
m
3
/mol. Wskazówka: objętości końcowe wyliczyć w
przybliżeniu gazu doskonałego.
Odp.:-13,32kJ/mol, 8,24 kJ/mol, -5,08 kJ/mol
10. 4 mole metanu ogrzano izobarycznie od temperatury 140K i objętości 2,40 dm
3
do objętości 8,60 dm
3.
Obliczyć a) końcową temperaturę gazu b) ciepło, c) pracę i d) zmianę energii wewnętrznej, jeśli gaz
opisać równaniem van der Waalsa (a=0,228 J m
3
mol
-2
, b=4,28 10
-5
m
3
mol
-1
. Wskazówka:
wykorzystać tablicową funkcję zależności pojemności cieplnej od temperatury.
Odp.: a) 381,4 K; b) 27,77 kJ; -6,93 kJ; 20,84 kJ.
Wyszukiwarka
Podobne podstrony:
(), podstawy chemii fizycznej Ć , przemiany gazowe przykładowe zadania
Komorowski, podstawy chemii fizycznej, zadania na e kolokwium 1
Podstawy Chemii Fizycznej KINETYKA
Podstawy chemii fizycznej P W Atkins, PWN, Warszawa 2002
Podstawy chemii fizycznej II kolokwium
Podstawy Chemii Fizycznej KATALIZA
komorowski, podstawy chemii fizycznej W, pytania na egzamin
Podstawy chemii fizycznej P W Atkins, PWN, Warszawa 2002
Przykładowe zadania z chemii doc(2)
Przykładowe zadania na 2 kolokwium z programowania w języku C, Studia, PWR, 1 semestr, Podstawy prog
Przykładowe zadania na 1 kolokwium z programowania w języku C, Studia, PWR, 1 semestr, Podstawy prog
Przykładowe zadania z równowagi chemicznej CD CH 2010 2011, Technologia chemiczna, Chemia fizyczna,
więcej podobnych podstron