1
Kolorymetryczne oznaczanie stężenia Fe
3+
metodą rodankową
(opracowanie instrukcji: Barbara Krajewska)
Celem ćwiczenia jest zapoznanie się z podstawami spektrofotometrii absorpcyjnej w
świetle widzialnym i jej zastosowaniami analitycznymi. W ćwiczeniu wykonamy oznaczenie
ilościowe jonów Fe
3+
w roztworze metodą rodankową (tiocyjanianową).
1. Podstawy teoretyczne
Spektrofotometria absorpcyjna w świetle widzialnym (kolorymetria) jest techniką
instrumentalną wykorzystującą istnienie barw substancji. Substancje są barwne z powodu
tego, że absorbują światło z zakresu widzialnego w sposób selektywny. Badamy więc jaki
kolor ma substancja (długość absorbowanej fali świetlnej
max
) i jaka jest wielkość absorpcji
tej fali (absorbancja A).
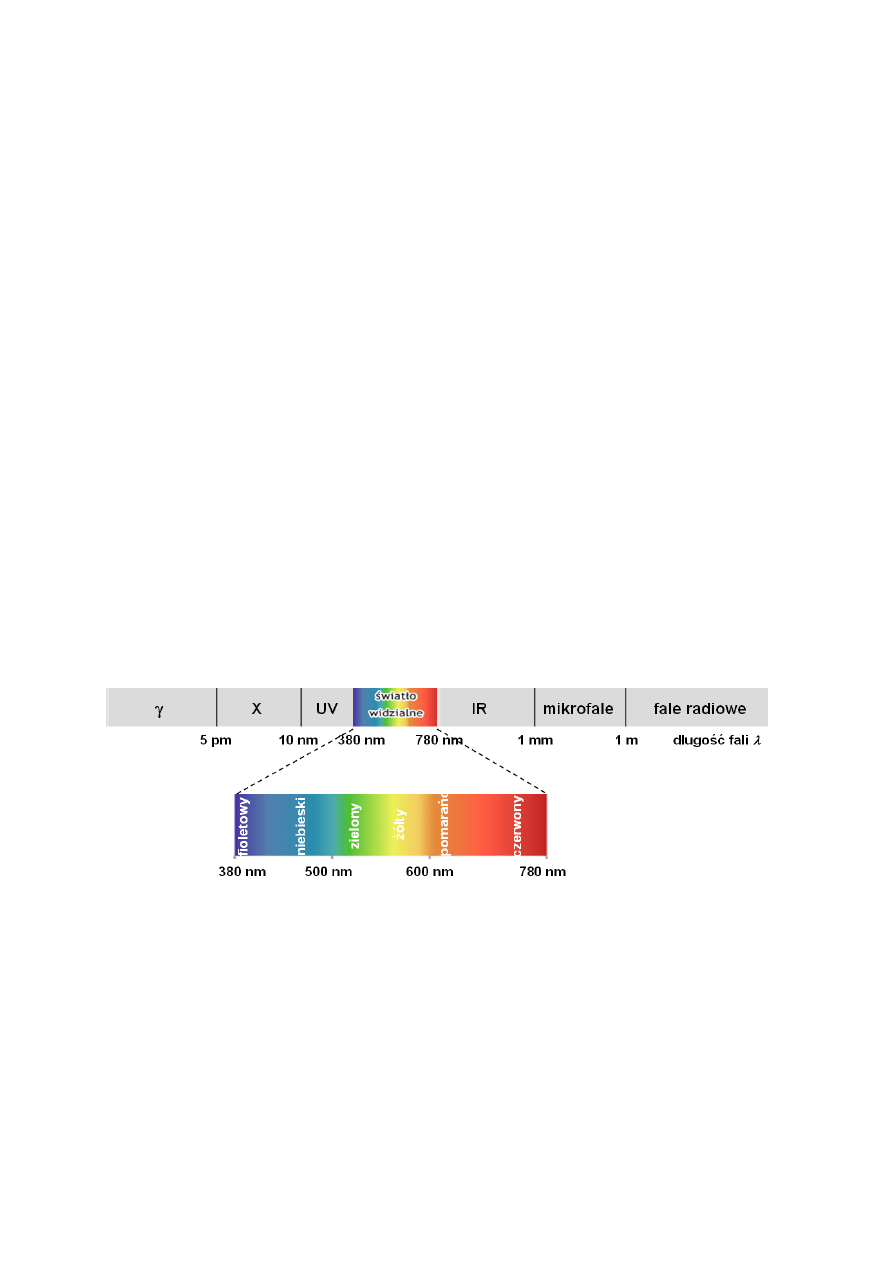
Światło to promieniowanie elektromagnetyczne, czyli zbiór fal elektromagnetycznych
o różnych długościach
(Rys. 1). Światło widzialne (białe) stanowi niewielką część
promieniowania elektromagnetycznego, na którą reaguje siatkówka oka człowieka w procesie
widzenia. Obejmuje ono zakres długości fal w przybliżeniu 380-780 nm.
Rys. 1 Widmo promieniowania elektromagnetycznego
Fale z zakresu światła widzialnego w zależności od swojej długości wywołują w naszym oku
różne wrażenia kolorystyczne (Rys. 1), np. kolor fioletowy to fale o
między ok. 380 i 420
nm, kolor żółty, między ok. 550 i 580 nm, itd., ale wszystkie te fale razem zmieszane dają
wrażenie światła białego. Jeśli jednak z tej mieszaniny fal o różnych długościach
stanowiących światło białe, zostaną usunięte jakieś wybrane fale, to do naszego oka trafią
wszystkie pozostałe, wywołując wrażenie barwne inne niż białe. Tak się dzieje, gdy światło
białe padając na substancję ulegnie selektywnej absorpcji, tzn. część fal o wybranych
2
długościach zostaje przez tę substancję zatrzymana, a reszta nie, wobec czego do naszego oka
dostarczony zostanie zbiór fal, które pozostały niezatrzymane. Odpowiedzialne za tę
selektywną absorpcję światła są oddziaływania fal elektromagnetycznych z zakresu
widzialnego z materią. Fale o tych długościach są mianowicie zdolne do wywołania
wzbudzeń elektronowych, które to wzbudzenia, żeby zaszły muszą mieć dostarczoną
właściwą porcję energii. Wymaga to, by w cząsteczce takiego związku występowały
ugrupowania atomów, których elektronowe poziomy energetyczne odpowiadają kwantom
promieniowania niesionego przez fale światła białego (chromofory).
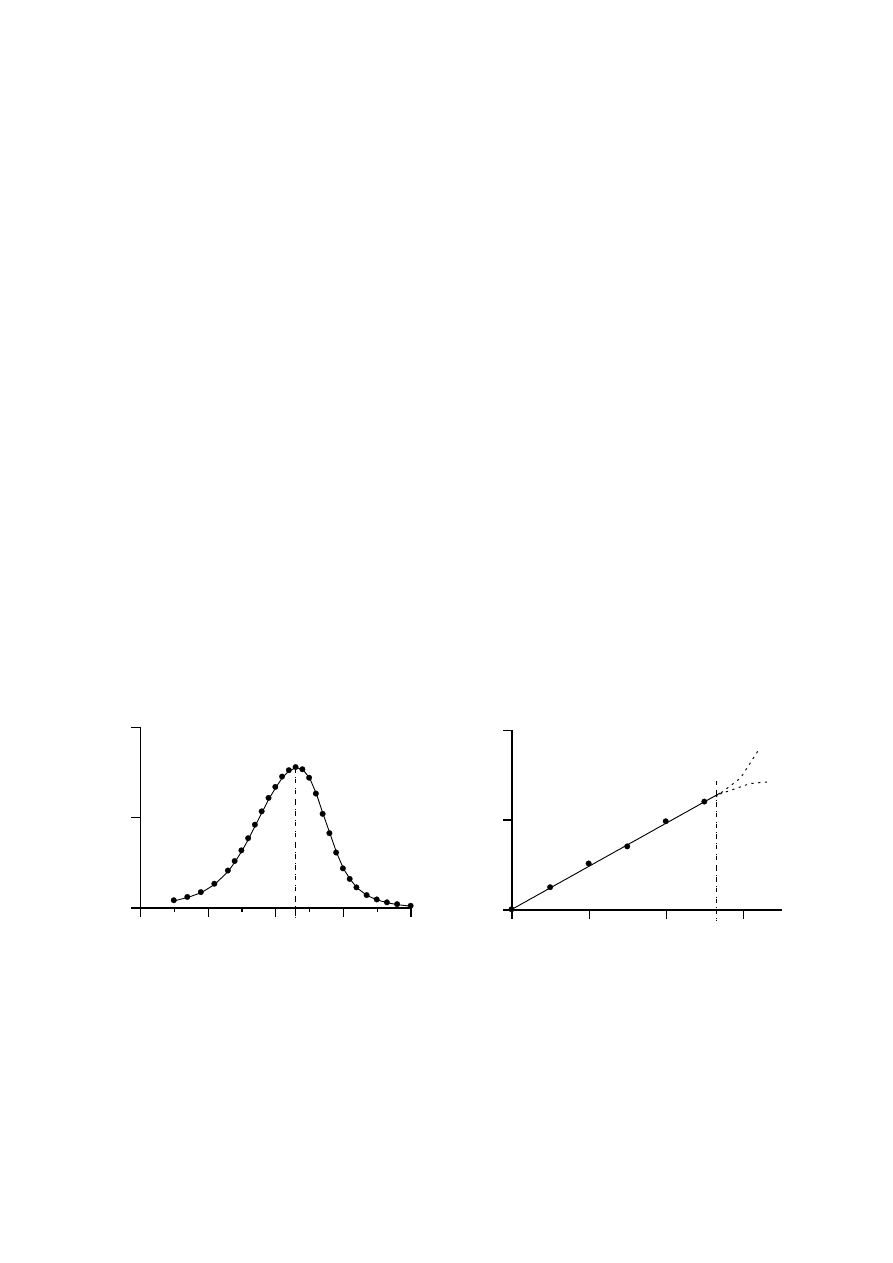
Jeśli dla wybranej substancji zmierzyć, w jakim stopniu absorbuje ona fale o
kolejnych długościach z zakresu widzialnego, to otrzymamy zależność absorbancji A od
długości fali
. Zależność ta nosi nazwę widma absorpcyjnego i jest charakterystyczna dla
danej substancji. Jeśli ta substancja w ogóle nie absorbuje światła (A = 0 dla wszystkich
), to
jej widmo powinno być linią prostą położoną na osi x; jeśliby absorbowała fale o wszystkich
w jednakowym stopniu, to jej widmo byłoby prostą równoległą do osi x; lecz jeśli ta
substancja pochłania fale tylko o niektórych długościach (selektywnie), to otrzymujemy
wówczas charakterystyczne widmo, które pokazuje, które fale (
) i w jakim stopniu (A)
zostały pochłonięte przez tę substancję. Widma absorpcyjne substancji barwnych w świetle
widzialnym mają zwykle nieskomplikowany kształt krzywych dzwonowych, których
maksimum występuje przy długości fali
max
odpowiedzialnej za obserwowaną barwę.
400
500
600
700
800
, nm
A
max
c
A
widmo w świetle widzialnym krzywa wzorcowa
(a)
(b)
Rys. 2. (a) Przykładowe widmo w świetle widzialnym i (b) przykładowa krzywa wzorcowa
(krzywymi przerywanymi zaznaczono odstępstwa absorbancji od prawa Lamberta-Beera)
Przykład takiego widma przedstawiono na Rys. 2a dla roztworu o kolorze niebieskim.
Widmo to pokazuje, że w zakresie światła widzialnego fale o różnych długościach
3
absorbowane są przez tę substancję w różnym stopniu, lecz w największym stopniu
absorbowana jest fala o długości 630 nm (
max
) leżąca w obszarze koloru pomarańczowego
(Rys. 1). Oznacza to, że w największym stopniu przepuszczana jest przez ten roztwór fala o
długości odpowiadającej barwie dopełniającej do pomarańczowej, w rozważanym przypadku,
barwie niebieskiej, którą widzi nasze oko. Reguła ta stosuje się do wszystkich substancji
barwnych, tzn. substancje wykazują określoną barwę wskutek absorpcji fal, z których
najbardziej absorbowana jest fala o długości odpowiadającej barwie dopełniającej do barwy
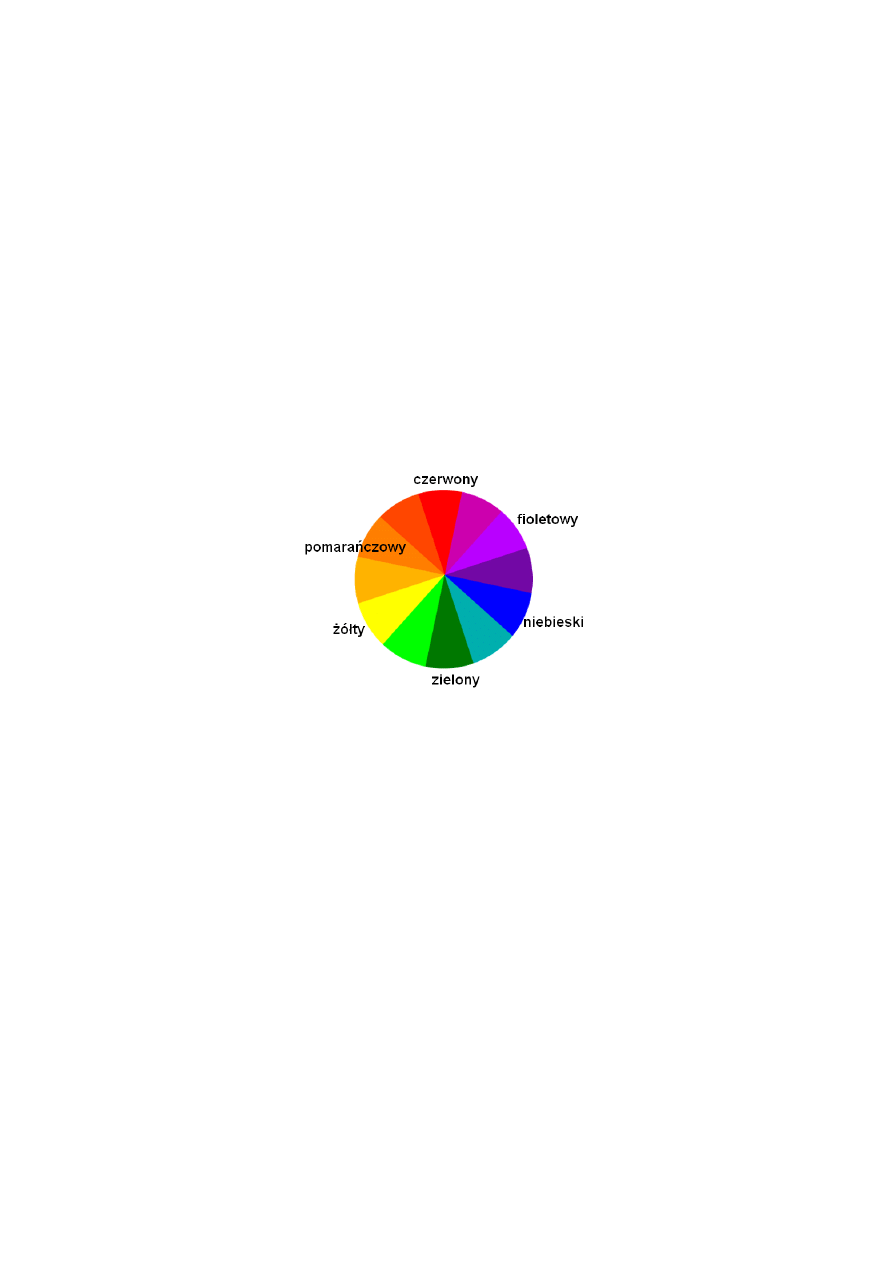
widocznej. W sposób przybliżony barwy dopełniające pokazuje znany ze szkoły krążek barw
(Rys. 3), w którym barwy te znajdują się naprzeciw siebie. Z uwagi na fakt, że
max
daje
najwyraźniejsze zmiany absorbancji zależne od stężenia tej substancji, to właśnie tę długość
wykorzystuje się w analitycznych oznaczeniach spektrofotometrycznych.
Rys. 3. Krążek barw (po obwodzie koła rozciągnięte jest widmo światła białego (Rys. 1);
barwy dopełniające znajdują się w krążku naprzeciw siebie
1.2. Prawo Lamberta-Beera
Jeżeli na próbkę o grubości l pada promieniowanie monochromatyczne (o jednej
długości fali) o natężeniu I
o
, to część promieniowania zostanie rozproszona I
r
, część zostanie
zaabsorbowana I
a
, a część zostanie przepuszczona przez tę próbkę I
t
, więc:
I
o
= I
r
+ I
a
+ I
t
(1)
W oznaczeniach analitycznych dbamy o to, by rozproszona część promieniowania I
r
była jak
najmniejsza, wobec tego w dalszych rozważaniach można ją zaniedbać:
I
o
= I
a
+ I
t
(2)
Stosunek natężenia promieniowania przepuszczonego przez ośrodek absorbujący światło I
t
do
natężenia padającego I
o
, wyrażony w procentach nosi nazwę transmitancji:

4
T =
o
t
I
I
(3)
Natomiast absorbancja (użyta wcześniej na Rys. 2a) zdefiniowana jest jako:
A = log
T
1
= log
t
o
I
I
(4)
Absorpcję światła przez jednoskładnikowy ośrodek homogeniczny (np. roztwór
wodny substancji barwnej) opisuje prawo Lamberta-Beera. Mówi ono, że absorbancja
ośrodka absorbującego jest proporcjonalna do stężenia substancji absorbującej i do grubości
warstwy, przez którą przechodzi promień:
A =
· l · c (5)
gdzie
jest współczynnikiem absorpcji, który jest wielkością charakterystyczną dla danej
substancji (niezależną od stężenia, grubości warstwy absorbującej i natężenia
promieniowania); l jest grubością warstwy, a c jest stężeniem substancji. Wymiar
współczynnika
jest skorelowany z wymiarem stężenia c. Zgodnie z równ. (5) graficzna
zależność absorbancji A od stężenia c ma postać prostej o współczynniku kierunkowym
równym
· l, przechodzącej przez początek układu współrzędnych (Rys. 2b).
Prawo Lamberta-Beera jest podstawą zastosowań spektrofotometrii absorpcyjnej w
oznaczeniach ilościowych. W oznaczeniach tych najczęściej stosuje się metodę krzywej
wzorcowej zgodnie z równ. (5) (Rys. 2b). W tym celu należy wykonać następujące
czynności:
(i) przygotować serię roztworów badanej substancji o znanych stężeniach,
(ii) dla jednego z roztworów wyznaczyć widmo, A w funkcji
(np. jak na Rys. 2a) i z widma
odczytać
max
,
(iii) dla długości fali
max
zmierzyć absorbancje roztworów wzorcowych i wyznaczyć krzywą
wzorcową, A w funkcji c (np. jak na Rys. 2b),
(iv) zmierzyć absorbancję próbki badanej (dla
max
) i z krzywej wzorcowej odczytać
oznaczane stężenie.
Krzywe wzorcowe nadają się do zastosowania tylko wtedy, gdy absorpcja światła
przez oznaczany związek spełnia prawo Lamberta-Beera, tzn. krzywa ma przebieg
prostoliniowy. Dla wyższych stężeń substancji często obserwuje się odstępstwa od
prostoliniowości (zaznaczone przykładowo krzywymi przerywanymi na Rys. 2b); wtedy do
oznaczeń wybieramy tylko część prostoliniową krzywej.

5
Do kolorymetrycznych oznaczeń wykorzystuje się barwę własną oznaczanej
substancji, lub związku, w który ta substancja, jeśli bezbarwna, została stechiometrycznie
przeprowadzona. Zaletą metod kolorymetrycznych jest duża szybkość wykonania oraz
możliwość oznaczania czasami bardzo małych ilości substancji ze stosunkowo dużą
dokładnością. Metody te są wykorzystywane bardzo często np. w diagnostyce medycznej,
kontroli przemysłowej itp. Pomiary absorbancji wykonuje się przy użyciu spektrofotometrów
popularnie nazywanych Spekolami.
Należy pamiętać, że metody spektrofotometryczne z zastosowaniem krzywej
wzorcowej są metodami porównawczymi. Dokładność oznaczeń przy ich użyciu w dużej
mierze zależy od właściwego przygotowania roztworów wzorcowych i dokładności
pomiarów.
2. Wykonanie ćwiczenia – instrukcja
Na ćwiczenia proszę przynieść: papier milimetrowy, linijkę, zaostrzony ołówek i gumkę.
Odczynniki i sprzęt: roztwór podstawowy soli żelaza(III) o stężeniu 0,10 mg Fe
3+
/cm
3
,
2
M
HNO
3
, 10 % KSCN, kolbki na 100 cm
3
, pipety, gruszki do pipetowania; spektrofotometr
w świetle widzialnym (obsługę spektrofotometru wyjaśni prowadzący w czasie pomiaru).
Zasada oznaczenia:
W celu kolorymetrycznego oznaczenia ilościowego jonów Fe
3+
przeprowadza się te
jony w krwisto-czerwony rodanek (tiocyjanian) żelaza:
Fe
3+
+ 3 SCN
−
→ Fe(SCN)
3
(6)
Reakcję przeprowadza się w środowisku słabo kwaśnym. W tych warunkach oprócz rodanku
żelaza w reakcji tej tworzą się kompleksy Fe(III) o różnym składzie: od Fe[SCN]
2+
do
Fe[(SCN)
6
]
3−
, również czerwone. Do oznaczenia zastosujemy metodę krzywej wzorcowej.
Uwaga: Pracujemy w grupach 4-osobowych; sprawozdanie piszą studenci jedno na taką
grupę.
Przygotowanie roztworów wzorcowych i próbki do analizy:
1. Przygotować 8 kolbek miarowych o pojemności 100 cm
3
, ponumerowanych od 0 do 7. W

6
kolbkach od 0 do 6 przygotujemy roztwory wzorcowe o określonych stężeniach Fe
3+
do
wyznaczenia krzywej wzorcowej. Roztwór w kolbce 0 będzie miał stężenie Fe
3+
równe 0
(jest to pełnoprawny punkt krzywej wzorcowej); roztwór ten zastosujemy jako tzw. próbę
ślepą (roztwór porównawczy). W kolbce 7 natomiast studenci przygotują otrzymane do
oznaczenia zadanie Fe
3+
. Oddać czystą kolbkę 7 prowadzącemu na zadanie.
2. Do kolbek 1-6 odmierzyć pipetą 1,00; 2,00; 3,00; 4,00; 5,00 i 6,00 cm
3
roztworu
podstawowego Fe
3+
. Ponieważ roztwór podstawowy zawiera 0,10 mg Fe
3+
/cm
3
, to po
rozcieńczeniu odmierzonych objętości do 100 cm
3
otrzymamy stężenia: 0,10; 0,20; 0,30;
0,40; 0,50 i 0,60 mg Fe
3+
/100 cm
3
.
3. Do wszystkich kolbek 0-7 dodać pipetami po 2 cm
3
2 M HNO
3
i po 10 cm
3
10 % KSCN.
Uważać, by pipetując nie przenosić roztworów z kolbki do kolbki (nawet mikro-ilości),
zwłaszcza do kolbki 0, która ma nie zawierć Fe
3+
(nie może przyjąć koloru różowego).
4. Kolbki dopełnić wodą destylowaną do kreski (pod kreskę z butli; do kreski, plastikową
pipetką lub tryskawką). Kolbki zatkać korkami i roztwory dokładnie wymieszać.
5. W zeszycie laboratoryjnym założyć Tabele 1 i 2:
Tabela 1. Widmo absorpcyjne kompleksu Fe-SCN w świetle widzialnym
Długość fali, nm
Absorbancja
400
410
itd.
…
…
…
Tabela 2. Krzywa wzorcowa
Stężenie Fe
3+
, mg/100 cm
3
Absorbancja dla
max
0,00
0,10
0,20
itd.
analizowana próbka
0,00
...
...
...
…
Pomiar widma absorpcyjnego dla kompleksu Fe-SCN i wyznaczenie
max
6. Dla roztworu nr 4 zmierzyć absorbancje w zakresie długości fal
od 400 do 600 nm w
odstępach długości fal co 10 nm. Wyniki zanotować w Tabeli 1, a na papierze
milimetrowym narysować widmo: A w funkcji
.

7
7. Odczytać
max
, tj. długość fali, przy której występuje maksimum absorbancji dla
kompleksów Fe-SCN.
Wyznaczenie krzywej wzorcowej
8. Zmierzyć absorbancje roztworów wzorcowych 1-6 dla długości fali
max
wobec próby
ślepej (roztwór 0). Wyniki zanotować w Tabeli 2, a na papierze milimetrowym narysować
krzywą wzorcową, A w funkcji stężenia Fe
3+
(mg/100
cm
3
); poprowadzić prostą
(uwzględnić punkt zerowy krzywej wzorcowej). Uwaga: Do sprawozdania wyznaczyć
równanie prostej metodą regresji liniowej (metodą najmniejszych kwadratów).
Pomiar absorbancji dla próbki otrzymanej do analizy
9. Zmierzyć absorbancję próbki otrzymanej do analizy (kolbka nr 7) dla długości fali
max
.
Wynik zapisać w Tabeli 2.
10. Z prostej wzorcowej odczytać stężenie Fe
3+
(mg/100 cm
3
)
w próbce i sprawdzić u
prowadzącego. Uwaga: W sprawozdaniu stężenie Fe
3+
obliczyć z równania prostej.
Środki ostrożności: HNO
3
jest substancją żrącą.
Postępowanie z odpadami: Wszystkie odpady wylać do zlewu.
3. Sprawozdanie:
1. Krótko przedstawić zasadę wykonanego oznaczenia.
2. Krótko opisać wykonanie ćwiczenia.
3. Przedstawić wyniki pomiaru widmowego w postaci Tabeli 1 i wykresu A w funkcji
.
Podać wartość
max
.
4. Przedstawić wyniki pomiarów absorbancji do krzywej wzorcowej, w postaci Tabeli 2 i
wykresu A w funkcji c
Fe+3
(mg/100 cm
3
). Do punktów eksperymentalnych dopasować
prostą metodą regresji liniowej (metodą najmniejszych kwadratów) i podać jej równanie.
5. Z równania prostej wzorcowej obliczyć stężenie Fe
3+
0,01 mg/100 cm
3
:
prawo Lamberta-Beera: A = 0 +
· l · c
wyznaczona prosta: y = a + b · x
gdzie zmienna niezależna x = c, zmienna zależna y = A, a współczynniki prostej są
następujące: punkt przecięcia z osią y, a ≈ 0, współczynnik kierunkowy prostej b =
· l.
Stąd c analizowanej próbki =
b
a
A
_
próbki
Wyszukiwarka
Podobne podstrony:
calka oznaczona Wronicz id 1079 Nieznany
Oznaczenia Samochodow id 343374 Nieznany
Oznaczenia PSP id 343373 Nieznany
oznaczenia miernikow id 343361 Nieznany
oznaczenia stali 2 id 343376 Nieznany
Cwiczenie nr 13 Analiza ilościowa Kolorymetria Kolorymetryczne oznacznie Fe 3 , PO4 3
calka oznaczona Wronicz id 1079 Nieznany
241 id 30843 Nieznany (2)
oznaczenia 2 id 343343 Nieznany
kolorymetria 1 id 241928 Nieznany
Ilustracje Kolory skory id 2107 Nieznany
5 Fe Fe3C id 40712 Nieznany
oznaczenie stali wg norm id 343 Nieznany
8 Oznaczanie utlenialnosci id 4 Nieznany (2)
2wyklad 5 Calka oznaczona id 60 Nieznany (2)
więcej podobnych podstron