
1. Zjawisko fizyczne i przemiana chemiczna.
a)
Zjawisko fizyczne
- polega na zmianie właściwości fizycznych związku chemicznego
lub mieszaniny. Nie zmieniają się wtedy właściwości chemiczne danej substancji i nie
powstaje nowy związek chemiczny.
b)
Przemiana chemiczna
- podczas tej przemiany zmianie ulegają zarówno właściwości
fizyczne jak i chemiczne substancji.
2. Mieszanina fizyczna a związek chemiczny.
a)
Mieszanina fizyczna
- mieszanina dwóch lub więcej pierwiastków chemicznych.
Mieszaniny te mogą być jednorodne lub niejednorodne, a rozdzielić je można przy
pomocy prostych metod fizycznych. Mieszaninę fizyczną sporządzić można przez
zmieszanie dowolnych ilości składników. W miarę zmieniania zawartości składników
właściwości fizyczne mieszaniny, takie jak np. gęstość, zmieniają się w sposób ciągły i
dają się wyliczyć.
b) Pierwiastki wchodzące w skład mieszaniny mogą mieć zdolność reagowania ze sobą
dając w wyniku reakcji syntezy
związek chemiczny
, którego nie da się rozdzielić za
pomocą prostych metod fizycznych. Pierwiastki łączą się w związek chemiczny tylko w
pewnych określonych proporcjach. Właściwości fizyczne powstałego związku są
zupełnie odmienne od własności jego składników lub ich mieszaniny.
3. Substancje proste i złożone
a)
Substancje proste
- formy pierwiastków, które występują w stanie wolnym.
b)
Substancje złożone
- substancje, które metodami chemicznymi można rozłożyć do
substancji prostych.
4.
Pierwiastek chemiczny
- zbiór atomów o identycznym ładunku jądra.
5. Podstawowe pojęcia w chemii:
a)
Masa atomowa
- liczba wskazująca ile razy masa danego atomu jest większa od
1
12
masy atomu węgla
12
C. Wyrażona w atomowych jednostkach masy.
b)
Masa cząsteczkowa
- stanowi sumę mas atomowych pierwiastków wchodzących w
skład cząsteczki związku.
c)
Mol
- miara liczności. materii.
1 mol
- liczba cząstek (atomów, cząsteczek, jonów
elektronów itp.) równa liczbie atomów zawartych w 12g izotopu węgla
12
C. Liczba
cząstek w jednym molu- liczba Avogadro.
d)
Liczba Avogadra
, stała Avogadra- liczba cząstek (np. cząsteczek, atomów, jonów,
elektronów) w jednym molu dowolnej substancji:
N= 6,022137·10
23
mol
-1
.
e) O
bjętość molowa gazu
- w warunkach normalnych 1 mol gazu zajmuje objętość
22,4138dm
3
.
f)
Wartościowość
- cecha pierwiastków chemicznych oraz jonów określająca liczbę
wiązań chemicznych, którymi dany pierwiastek bądź jon może łączyć się z innymi.
6. Typy reakcji chemicznych:

a) Zasadniczo rozróżniamy następujące typy reakcji chemicznych:
˗
Reakcje syntezy
polegają na tworzeniu się nowej substancji (produktu) z dwóch
lub większej liczby składników (substratów).
˗
W
reakcjach analizy (rozkładu)
z substancji złożonej tworzą się dwie lub więcej
nowych substancji.
˗
Reakcje wymiany
polegają na przekształceniu dwóch lub więcej substancji
wyjściowych w nowe substancje o innym ugrupowaniu atomów lub jonów
wchodzących w ich skład. W tej grupie można rozróżnić reakcje wymiany
pojedynczej (prostej) oraz reakcje wymiany podwójnej.
Reakcje wymiany pojedynczej
Reakcje wymiany podwójnej
˗
Reakcje redoks
są to reakcje jednoczesnego utleniania i redukcji, w których
pierwiastki występujące w tych przemianach zmieniają swoją wartościowość, a
dokładniej mówiąc stopień utlenienia.
b) Inne kryteria podziału reakcji chemicznych:
˗
Reakcje egzo- i endotermiczne
˗

˗
Podział wg doprowadzonej energii
˗
Reakcje homo- i heterogeniczne
˗
Reakcje odwracalne i nieodwracalne
7. Równania reakcji chemicznych
˗
Reakcja chemiczna-
proces, w trakcie którego z atomów, cząsteczek lub jonów
substratów powstają cząsteczki, atomy lub jony produktów.
˗
Zapis reakcji chemicznej-
równanie chemiczne:
dostarcza informacji o składzie chemicznym (jakościowym i ilościowym)
substratów i produktów, niekiedy efektach energetycznych towarzyszących
reakcji.
Nie informuje o mechanizmie reakcji ani stopniu przereagowania.
8. Klasyfikacja związków chemicznych:
a)
tlenki
- nieorganiczne związki chemiczne, zbudowane z tlenu i innego pierwiastka
chemicznego. Powstają w wyniku reakcji pierwiastków z tlenem (utlenianie, spalanie)
oraz rozkładu związków zawierających tlen.
˗
Otrzymywanie tlenków:
Bezpośrednia synteza z pierwiastków – tym sposobem można otrzymać

najwięcej tlenków. Np.
Utlenianie niższych tlenków, np.
Redukcja wyższych tlenków, np.
Redukcja lub rozkład nadtlenków i ponadtlenków, np.
Rozkład (analiza), np.
Rozkład soli nietrwałych kwasów tlenowych:
Rozkład niektórych wodorotlenków:
Rozkład nietrwałych kwasów tlenowych:
˗
Podział tlenków:
tlenki kwasowe
- tlenki, które w reakcji z wodą generują kwasy. Reagują z
zasadami, nie reagują z kwasami. Przykłady:
B
2
O
3
(nie reaguje z wodą)
CO
2
SiO
2
(
nie reaguje z wodą)
N
2
O
3
N
2
O
5
SO
2
SO
3
Cl
2
O
Cl
2
O
3

Cl
2
O
5
Cl
2
O
7
CrO
3
P
2
O
3
P
2
O
5
Mn
2
O
7
Tlenki zasadowe
- wszystkie tlenki litowców i berylowców oprócz tlenku
berylu oraz niektóre tlenki metali grup pobocznych na niższych stopniach
utlenienia. Reagują z kwasami, nie reagują z zasadami. Przykłady:
CrO
FeO
MnO
Na
2
O
K
2
O
MgO
Tlenki obojętne
- nieliczna grupa tlenków, które nie posiadają zauważalnych
własności kwasowych ani zasadowych. Nie tworzą one z wodą ani kwasów, ani
zasad, a jedynie mogą się w niej rozpuszczać, nie zmieniając jej pH. Przykłady:
NO
CO
SiO
N
2
O
Tlenki amfoteryczne-
reagują z kwasami i zasadami. Przykłady:
BeO
Al
2
O
3
As
2
O
3
PbO
PbO
2
SnO
SnO
2
Cr
2
O
3
MnO
2
Fe
2
O
3
CuO
ZnO
b)
wodorki-
związki chemiczne wodoru z innymi pierwiastkami. We wzorach związków
chemicznych dwuskładnikowych, a do takich należą wodorki, pierwiastek bardziej

elektroujemny piszemy zawsze na drugim miejscu. A zatem wzory wodorków
pierwiastków o wartościach elektroujemności mniejszych od wartości elektroujemności
wodoru równej 2,2 zapisujemy jako MH
n
, natomiast wzory wodorków pierwiastków o
wartościach elektroujemności większych od elektroujemności wodoru zapisujemy jako
H
n
M. Pierwiastki I i II grupy układu okresowego(metale) tworzą wodorki, w których
stopień utlenienia wodoru wynosi –I. Wodór występuje w tych związkach w postaci
anionu H
-
. Nazwy systematyczne tych wodorków tworzymy dodając do słowa wodorek
nazwę metalu. Na przykład:
NaH - wodorek sodu
CaH
2
- wodorek wapnia
Wodorki metali reagując z wodą tworzą odpowiednią zasadę, a zatem mają charakter
zasadowy. Na przykład:
CaH
2
+
2 H
2
O = Ca(OH)
2
+ 2 H
2
Pierwiastki 16 i 17 grupy układu okresowego(niemetale) tworzą wodorki, w których
wodór jest na dodatnim stopniu utlenienia +I. Nazwy tych wodorków tworzymy dodając
do nazwy niemetalu końcówkę – wodór. Na przykład:
H
2
S - siarkowodór
HCl - chlorowodór
HI - jodowodór
c)
Wodorotlenki
- wszystkie związki nieorganiczne, których cząsteczki zawierają kationy
metali i aniony wodorotlenowe OH
-
.
˗
Otrzymywanie wodorotlenków:
rozpuszczalnych w wodzie:
reakcja metalu aktywnego z wodą (metale grupy 1 i 2 z wyjątkiem berylu,
magnez reaguje dopiero po ogrzaniu), np.:
2K+2H
2
O=2KOH+H
2
Ba+2H
2
O=Ba (OH)
2
+
H
2
reakcja tlenku metalu aktywnego z wodą, np.:
Na
2
O+H
2
O=2NaOH
BaO+H
2
O=Ba (OH)
2
nierozpuszczalnych w wodzie:
działanie silnej zasady na roztwór soli danego metalu (rozpuszczalnej w
wodzie):
FeSO
4
+
2KOH=Fe(OH)
2
+
K
2
SO
4

AlCl
3
+
3KOH=Al(OH )
3
+
3KCL
w przypadku większości wodorotlenków nierozpuszczalnych w wodzie należy
unikać nadmiaru mocnej zasady- te, które przejawiają charakter
amfoteryczny, rozpuszczają się w nadmiarze mocnej zasady.
˗
Podział wodorotlenków:
Zasadowe
- reagują z kwasami, nie reagują z zasadami: wodorotlenki 1 i 2
grupy z wyjątkiem berylu. Wodorotlenki ulegają całkowitej dysocjacji w wodzie;
nie ulega dysocjacji amfoteryczny wodorotlenek berylu i zasadowy wodorotlenek
magnezu i wodorotlenki pozostałych metali.
Amfoteryczne
- reagują z kwasami i zasadami, są to na ogół wodorotlenki
metali bloku d na pośrednich stopniach utlenienia i niektórych metali bloku p
oraz berylu:
Be (OH )
2
, Al (OH )
3
, Cu(OH )
2
, Zn(OH )
2
.
b) Kwasy
- związki zbudowane z atomu wodoru i reszty kwasowej
-Podział:
tlenowe i beztlenowe
mocne i słabe
Otrzymywanie:
reakcja tlenku kwasowego z wodą, np.:
SO
2
+H
2
O=H
2
SO
3
SO
3
+ H
2
O =H
2
SO
4
CO
2
+ H
2
O =H
2
CO
3
N
2
O
3
+ H
2
O =2 HNO
2
N
2
O
5
+H
2
O =2HNO
3
P
2
O
5
+ 3H
2
O =2H
3
P0
4
B
2
O
3
+ H
2
O =2H
3
BO
3
strącanie osadów trudno rozpuszczalnych kwasów, np.:
H
2
SO
4
+ Na
2
SiO
3
=H
2
SiO
3
+ Na
2
SO
4
d)
Sole
- związki chemiczne powstałe w wyniku całkowitego lub częściowego zastąpienia w
kwasie atomów wodoru atomami metali. Atomy metalu są zwykle związane zresztą
kwasową wiązaniem jonowym.
˗
Metody otrzymywania soli:
metal + kwas = sól + wodór (nie dotyczy metali szlachetnych i półszlachetnych)
tlenek metalu + kwas = sól + woda
zasada + kwas = sól + woda
tlenek metalu + tlenek niemetalu = sól (tylko sole kwasów tlenowych)
wodorotlenek metalu + tlenek niemetalu = sól + woda (----||----)

metal + niemetal = sól (tylko sole kwasów beztlenowych)
kwas1 + sól1 = sól2 + kwas2
sól1 + sól2 = sól3 + sól4
sól met. o potencjale niższym+metal aktywny = sól + metal mniej aktywny
˗
Podział soli:
sole nasycone, w których nie występują ani grupy hydroksylowe, ani kwaśne
atomy wodoru;
sole nienasycone, które dzieli się na:
Hydroksosole (sole zasadowe, hydroksysole) – sole zawierające oprócz
kationu metalu i anionu reszty kwasowej również jon wodorotlenowy (OH)
-
.
Hydroksosole powstają w wyniku reakcji kwasów (w ilości poniżej
stechiometrycznej) z zasadami zawierającymi w cząsteczce więcej niż jedną
grupę wodorotlenową, np. Mg(OH)Br
Wodorosole (sole kwaśne) – związki chemiczne, sole kwasów
wieloprotonowych, których aniony zawierają atomy wodoru w grupie
kwasowej. Np. NaHSO
3
hydraty - sole posiadające wbudowane w sieć krystaliczną cząsteczki wody.
9. Elementarne prawa chemiczne.
a) Prawo zachowania masy:
W reakcji chemicznej suma mas protonów jest równa sumie mas substratów.
Σ
m=const.
b) Prawo stosunków stałych:
Każdy związek chemiczny ma stały i niezmienny skład ilościowy.
c) Prawo stosunków wielokrotnych:
Jeżeli dwa pierwiastki łącząc się ze sobą tworzą więcej niż jeden związek chemiczny, to
masy jednego z tych pierwiastków przypadające na stałą masę drugiego pozostają
względem siebie w stosunku prostych liczb całkowitych.
d) Prawo prostych stosunków objętościowych:
Objętości gazów reagujących ze sobą lub tworzących się w wyniku reakcji chemicznej
pozostają do siebie w stosunku małych liczb całkowitych.
10. Współczesny pogląd na atom
Według pierwotnej koncepcji Daltona, utrzymującej się do końca XIX w. Atom miał
stanowić jednostkę niepodzielną. Wiele odkryć, które zbiegły się w latach
dziewięćdziesiątych XIX w. Pozwoliło na stwierdzenie, że atom jest tworem złożonym o

skomplikowanej strukturze.
11.
Budowa i trwałość jądra atomowego.
a) Budowa:
Jądra atomowe (z wyjątkiem atomu wodoru) są złożone z protonów i neutronów,
objętych wspólną nazwą nukleonów. Liczbę protonów znajdujących się w jądrze
atomu pierwiastka nazywamy liczbą atomową Z danego pierwiastka. Sumaryczną
liczbę protonów i neutronów występujących w jądrze aromu pierwiastka nazywamy
liczbą masową A danego pierwiastka. Zbiór atomów o identycznej liczbie atomowej
nazywamy pierwiastkiem chemicznym.
b) Trwałość jądra atomowego:
O trwałości decydują siły pomiędzy neutronami i protonami.
c)
Masa jądra
- suma mas cząstek elementarnych, z których zbudowane jest jądro
pomniejszona o tzw. deficyt masy.
d)
Defekt masy
- energia wydzielona podczas syntezy jądra z jego składników.
e)
Współczynnik upakowana
- stosunek defektu masy do liczby składników.
f)
Jądra lekkie
- suma protonów i neutronów taka sama lub prawie taka sama. Są to
jądra trwałe, np.
12
6
C
.
g)
Jądra ciężkie
- liczba protonów mniejsza od liczby neutronów, są mniej trwałe,
często promieniotwórcze.
h) Jądra atomowe:
˗ parzysto-parzyste: najczęściej spotykane. Parzysta liczba protonów i neutronów.
Najtrwalsze, najbardziej rozpowszechnione w przyrodzie. np.
16
8
O , 24
12
Mg
.
˗ parzysto-nieparzyste: parzysta liczba protonów lub neutronów, np.
26
13
Al
.
˗ nieparzysto-nieparzyste: obie liczby nieparzyste. Najmniej trwałe, np.
45
21
Sc
.
12. Liczba atomowa (liczba porządkowa) Z:
˗
liczba protonów w jądrze,
˗
stanowi podstawę współczesnej definicji pierwiastka,
˗
decyduje o właściwościach chemicznych pierwiastka,

˗
decyduje o położeniu pierwiastka w układzie okresowym.
13. Liczba masowa A:
˗ suma protonów i neutronów,
˗ decyduje o masie jądra atomowego.
14.
Nuklid
- pierwiastek o określonej liczbie protonów i neutronów. Oznaczenie nuklidów:
15.
Izotopy
- atomy tego samego pierwiastka różniące się liczbą masową. Przykład:
izotopy wodoru:
1
0
H , 2
1
D , 3
2
T
16.
Izobary
- nuklidy różnych pierwiastków o takiej samej liczbie masowej, a różnej
liczbie atomowej.
17.
Izotony
- nuklidy różnych pierwiastków i jednakowej liczbie neutronów. Różnią
się liczbą atomową i masową.
Z (L. ATOMOWA)
A (L. MASOWA)
A-Z (NEUTRONY)
IZOTOPY
jednakowa
różna
różna
IZOBARY
różna
jednakowa
różna
IZOTONY
różna
różna
jednakowa
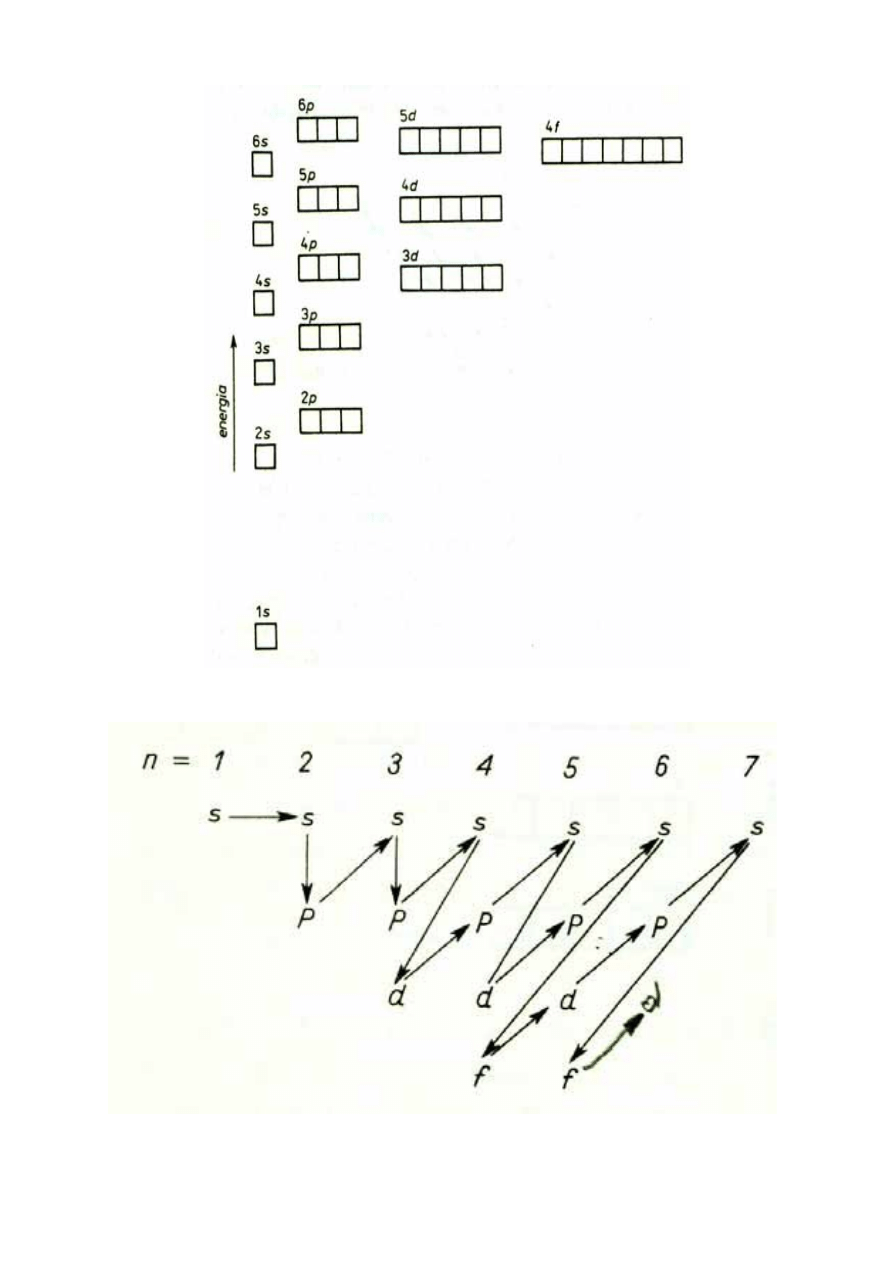
18. Zasady rozbudowy powłok elektronowych.
a)
Zakaz Pauliego-
W atomach wieloelektronowych obowiązuje zakaz Pauliego,
zgodnie z którym w atomie żadne dwa elektrony nie mogą znajdować się w stanie
opisanym przez te same liczby kwantowe. Dwa elektrony muszą różnić się wartością
co najmniej jednej liczby kwantowej. Oznacza to, że nie mogą istnieć dwa elektrony w
identycznym stanie kwantowym, tzn. mające identyczne wartości czterech liczb
kwantowych (n, l, m, m
s
)
b)
Reguła Hunda
- Elektrony obsadzają orbitale w taki sposób, aby liczba
niesparowanych elektronów w danej podpowłoce była możliwie największa. Oznacza
to, że przy zapełnianiu kolejnych orbitali elektronami wszystkie orbitale
odpowiadające (orbitale o tych samych liczbach kwantowych n i l) zostaną zapełnione
najpierw po jednym elektronie o spinie równoległym, a dopiero potem drugim
elektronem o spinie przeciwstawnym.
19. Pojęcie orbitalu:
Orbital atomowy
- najmniejszy obszar przestrzeni wewnątrz którego istenieje duze
(ponad 90%) prawdopodobieństwo znalezienie elektronu. Oznaczenie: ψ(n,l,m).
20. Typy orbitali:
˗
orbital typu s,
- orbital typu p,
˗
orbital typu d,
˗
orbital typu f.
21.
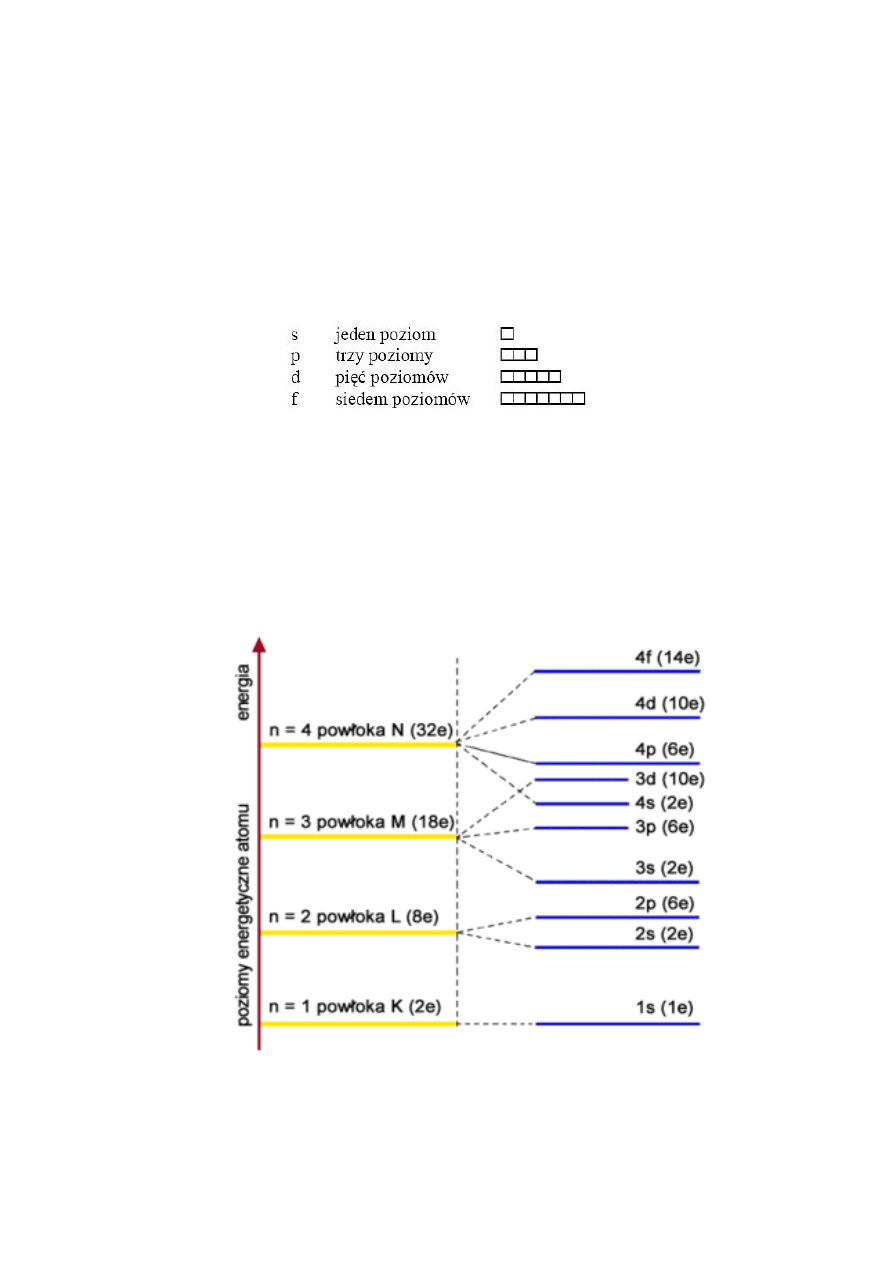
Poziomy energetyczne elektronów w atomach
:

22.Układ okresowy pierwiastków:
Układ okresowy – tabela, która obejmuje wszystkie znane pierwiastki chemiczne
uporządkowane według określonych reguł.
Okresy (1….7)
- nr okresu: ilość powłok elektronowych
- w ramach jednego okresu wzrasta ilość elektronow na ostatniej powłoce
Grupy (1….18)
- nr grupy: ilość elektronow na ostatniej powłoce
- w ramach jednej grupy wrasta ilość zapełnionych powłok
Bloki (s, p, d, f)
- blok s - rozbudowuje powłokę s: ns1-ns2 (grupy 1 i 2)
- blok p – rozbudowuje powłokę p: ns2np1- ns2np6 (grupy 13-18)
- blok d - rozbudowuje powłokę d: ns2(n-1)d1- ns2(n-1)d10 (grupy 3-12)
- blok f - rozbudowuje powłokę f: ns2(n-1)d1(n-2)f1-ns2(n-1)d1(n-2)f14 …(grupa 3)
23.Elektropowinowactwo i elektroujemność pierwiastków
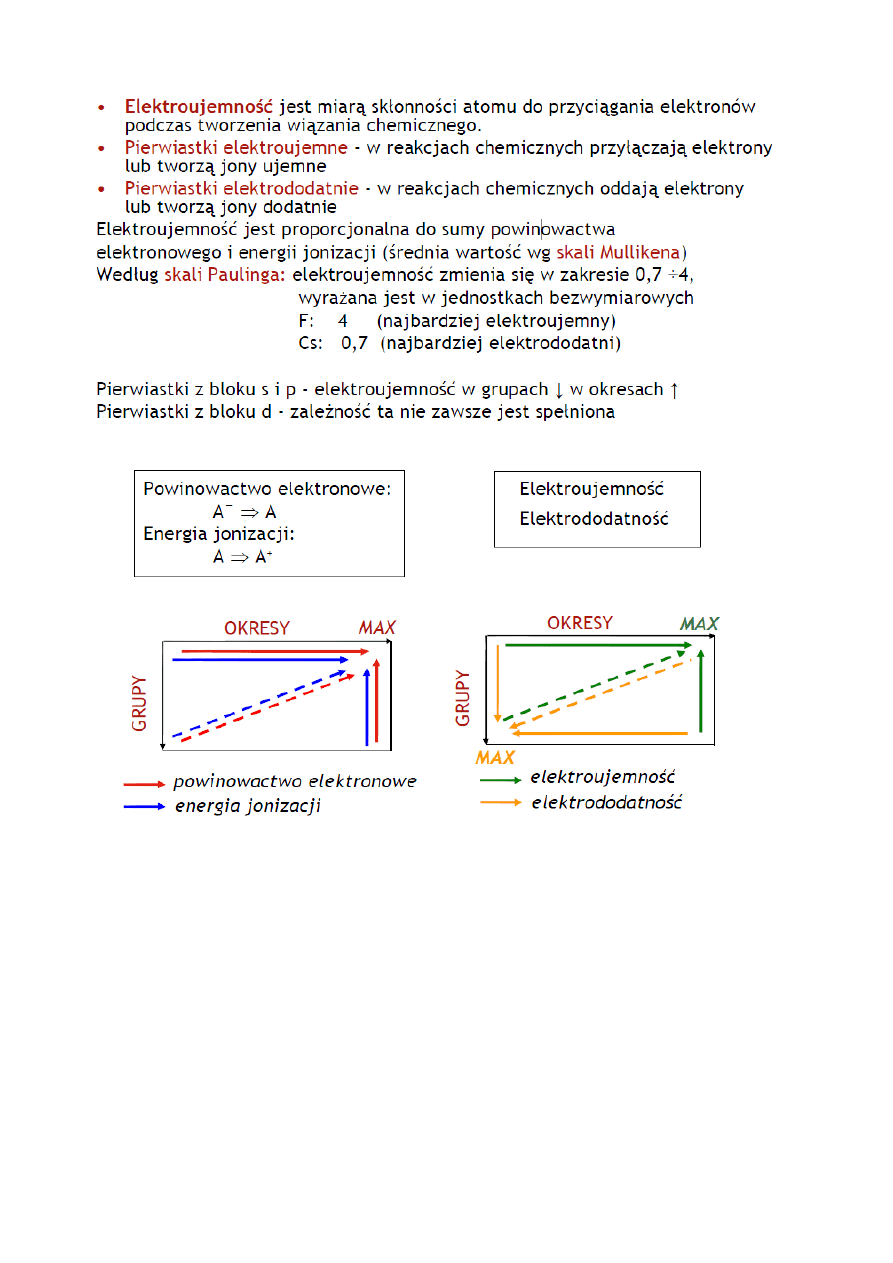
24. Wiązania chemiczne:
a) wiązanie jonowe
Wiązanie Jonowe - powstaje pomiędzy jonami. Jony tworzą sie w w yniku przeniesienia
elektronu lub kilku elektronów z atomów jednego pierwiastka do atomu drugiego> proces taki
może nastąpić w momęcie zetknięcia się atomów pierwistków rózniących sie znacznie
elektoujemnością. x>1,7 - róznica elektoujemności jeste większa od 1,7 Wiązanie Jonowe wystepuje
między - pierwiastkami grupy 1,2, 17 - berylowcami z gr. 16 ,17 - w tlenkach metali - solach
pomiędzy kationem a reszta kwasową przykład - Na Cl , BaO, CaO
W zależności od liczby obsadzonych powłok elektronowych oraz liczby elektronów na ostatniej
(zwykle nie całkiem wypełnionej) powłoce, czyli powłoce walencyjnej, pierwiastki wykazują
różne zdolności tworzenia wiązań chemicznych. Niektóre pierwiastki stosunkowo łatwo oddają
elektron/y z ostatniej powłoki. Zdolność do oddawania elektronów można wyrazić ilościowo,
mierząc tzw. energię jonizacji, czyli energię potrzebną do usunięcia elektronu z ostatniej
powłoki. Do pierwiastków o najniższych energiach jonizacji należą metale, zwłaszcza zaś metale
mające 1 lub 2 elektrony na ostatniej powłoce. Są to metale alkaliczne, litowce – 1 elektron
walencyjny (grupa 1 układu okresowego) oraz metale ziem alkalicznych, berylowce – 2 elektrony
walencyjne (grupa 2 układu okresowego). Oddając swój elektron, do czego potrzebny jest
stosunkowo niski nakład energii, atomy tych pierwiastków zyskują wypadkowy ładunek dodatni.
Inne pierwiastki chemiczne, w których powłoka walencyjna jest prawie całkowicie zapełniona –
fluorowce (grupa 17) – liczba elektronów walencyjnych o 1 mniejsza od maksymalnej możliwej,
tlenowce (grupa 16) – liczba elektronów walencyjnych o 2 mniejsza od maksymalnej możliwej –
charakteryzują się wysokimi wartościami energii jonizacji. Oznacza to, że usunięcie elektronu z ich
ostatniej powłoki jest prawie niemożliwe. Z drugiej zaś strony, całkowite zapełnienie ostatniej
powłoki (charakterystyczne dla helowców – gazów szlachetnych) wiąże się z pewnym obniżeniem
energii atomu, które nosi nazwę powinowactwa elektronowego. Atomy te mogą zatem
przyjmować elektrony na swoją ostatnią powłokę, co oznacza, że uzyskują wypadkowy ładunek
ujemny.
Oddanie elektronu przez atom A oznacza zatem, że stanie się on jonem dodatnim, a przyjęcie
elektronu przez atom B oznacza, że stanie się on jonem ujemnym. Ponieważ dwa różnoimienne
ładunki przyciągają się, jony A i B połączą się trwale wiązaniem jonowym. Jego powstawanie
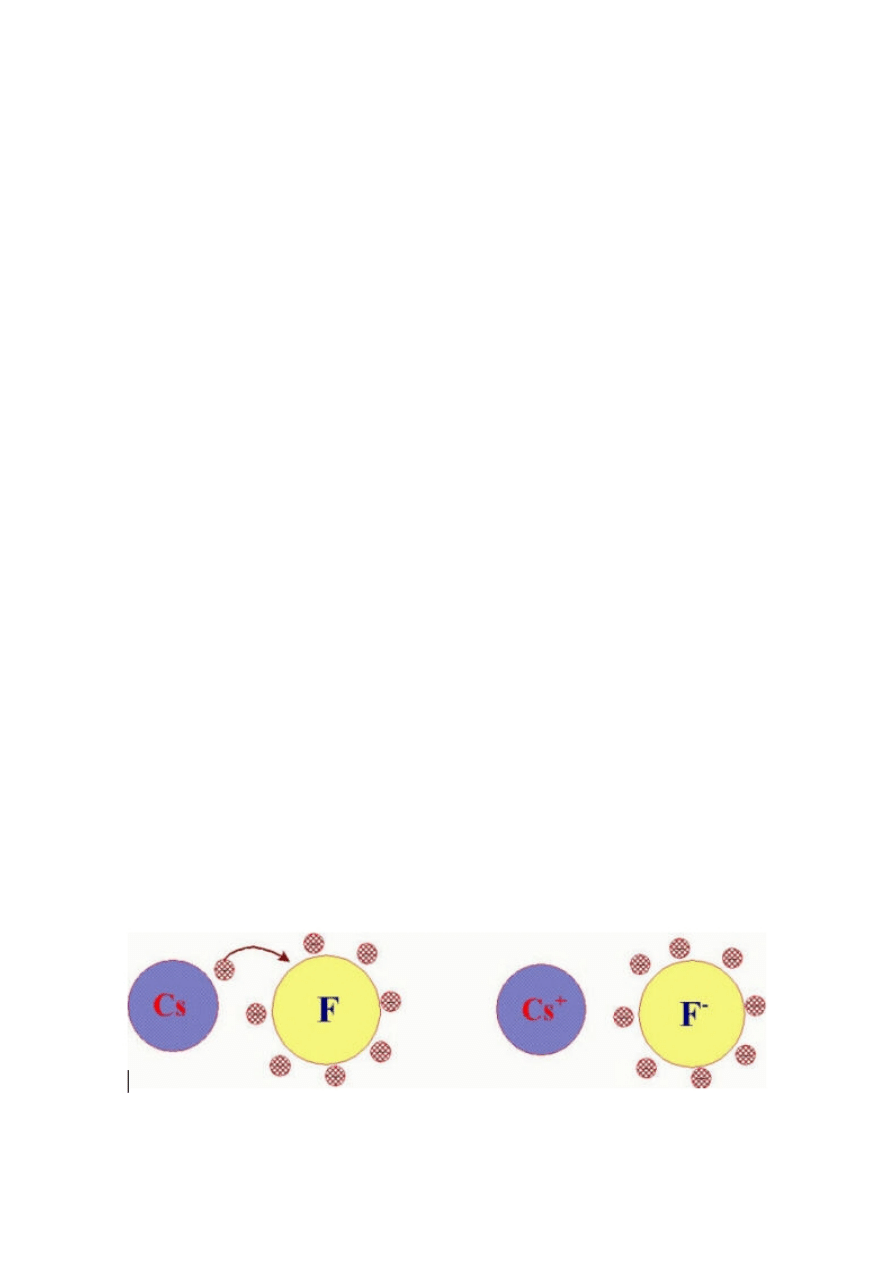
przedstawiono schematycznie na rysunku 1 na przykładzie fluorku cezu. Cez ma niską energię
jonizacji dla elektronu na powłoce walencyjnej, a fluor posiadający wysokie powinowactwo
elektronowe charakteryzuje się również powinowactwem elektronowym. Utworzenie wiązania
polega w tym wypadku na „oddaniu” elektronu walencyjnego atomu cezu atomowi fluoru. Atom
cezu zyskuje wypadkowy ładunek dodatni (ładunek jądra jest o 1 wyższy niż wynosi liczba
pozostałych elektronów) – staje się jonem dodatnim; atom fluoru zyskuje wypadkowy ładunek
ujemny (ładunek jądra jest o 1 niższy niż liczba elektronów po przyjęciu dodatkowego elektronu
cezu) – staje się jonem ujemnym.
Rysunek 1. Tworzenie się wiązania jonowego we fluorku cezu. a/Oba atomy mają zrównoważone

ładunki elektryczne. b/Każdy z jonów uzyskał wypadkowy ładunek elektryczny.
Skutkiem wytworzenia wiązania jonowego cez-fluor – czyli utworzenia się dwóch jonów (Cs
+
oraz
F
-
) jest trwały układ dwóch połączonych atomów. Oddziaływanie pola elektrycznego,
wytworzonego przez oba jony nie zależy od kierunku – jest takie samo zarówno w stronę jonu o
przeciwnym znaku, jak i w innych kierunkach.
Wiązanie jonowe tworzy się tylko wtedy, kiedy różnica potencjału jonizacji i potencjału
elektronowego pomiędzy pierwiastkami, których atomy tworzą wiązanie jest bardzo duża.
Kryształy jonowe:
Sieć krystaliczna składa się z węzłów siedzi obsadzonych na przemian przez jony dodatnie i
ujemne. Między jonami działają siły przyciągania elektrostatycznego. Charakteryzuje je duża
energia wiązania, twardość.
b)
Wiązanie kowalencyjne (atomowe)
- jest to wiązanie między tymi samymi
atomami, polega na utworzeniu wspólnej pary elektronowej dla obu atomów. Występują
dwa
wiązania
kowalencyjne:
- niespolaryzowane zachodzące w cząsteczce O
2
, H
2
, czyli wspólna para elektronów nie
jest
przesunięta
w
stronę
żadnego
atomu.
- spolaryzowane występuje w cząsteczce np. w cząsteczce NH
3
,>CO
2
gdyż para
elektronów przesunięta jest w stronę jednego z atomów (o większej ilości elektronów
walencyjnych).
Jeżeli przybliżamy do siebie dwa atomy o podobnej energii jonizacji i podobnym
powinowactwie elektronowym, to jedynym sposobem na obniżenie sił odpychania
pozostaje umieszczenie elektronów pomiędzy jadrami atomowym. W ten sposób
możemy oczekiwać, że siły przyciągania zrównoważą siły odpychania. Najprostszym
przykładem tworzenia takiego wiązania jest tworzenie się dwuatomowych cząsteczek
gazów, np. wodoru czy fluoru. Mówimy wówczas, że powstaje wspólna para
elektronowa, liczba elektronów pozostających w strefie oddziaływania jądra atomowego
jest równa maksymalnej liczbie elektronów, które mogą znajdować się na powłoce
walencyjnej. Na Rysunku 2 przedstawiono tworzenie się wiązania kowalencyjnego w
cząsteczce wodoru. Każdy z atomów ma po jednym elektronie. walencyjnym. Mogą
zatem utworzyć jedną wspólną parę elektronową (maksymalna możliwa liczba
elektronów na pierwszej powłoce wynosi 2).

Rysunek 2. Tworzenie się wiązania kowalencyjnego – wspólnej pary elektronowej w cząsteczce
wodoru
Nieco inaczej wygląda sytuacja w przypadku utworzenia się cząsteczki fluoru. Atom fluoru posiada
7 elektronów walencyjnych (maksymalna możliwa liczba elektronów na powłoce walencyjnej
wynosi 8). Tutaj również tworzy się wspólna para elektronowa (Rysunek 3).
Rysunek 3. Tworzenie się wiązania kowalencyjnego – wspólnej pary elektronowej w cząsteczce
fluoru
Można zatem uznać, że utworzenie się wiązania kowalencyjnego polega na wytworzeniu wspólnej
pary elektronowej pomiędzy dwoma atomami. Liczba wspólnych par elektronowych, które tworzą
się pomiędzy dwoma atomami może być równa lub większa od 1. W roku 1917 Lewis, Kossel i
Langmuir przyjęli, że liczba par elektronowych (wiązań chemicznych) utworzonych przez dany
pierwiastek równa jest różnicy pomiędzy faktyczną liczbą elektronów walencyjnych, a liczbą
maksymalną liczbą elektronów, która może obsadzić daną powłokę (zazwyczaj 2 lub 8). Zgodnie z
tym, w cząsteczce O
2
tworzą się 2 wspólne pary elektronowe, a w cząsteczce azotu – 3 wspólne pary
elektronowe. Lewis zaproponował, by wspólne pary elektronowe oznaczać kreskami, np. H-H, F-F
oraz O=O i N N.

Kryształy kowalencyjne (atomowe)
–
węzły sieci krystalicznej obsadzone atomami
–
między atomami siły wiązań kowalencyjnych
–
duża energia wiązań
–
Przykłady: diament, S, Ge, Sc, Se, As
–
wysokie temperatury topnienia
–
izolatory
–
duża twardość
c)
Wiązania kowalencyjne spolaryzowane
występują wówczas, gdy wspólna para
jest przesunięta w stronę atomu o większej liczbie elektronów walencyjnych.
np.
CO
2
- 1 cząsteczka dwutlenku węgla
NH
3
- 1 cząsteczka amoniaku
d) wiązania wodorowe
wiązanie wytworzone pomiędzy atomem wodoru, połączonym kowalencyjnie z atomem
X, a atomem Y, posiadającym swobodną parę elektronów i należącym zazwyczaj do
innej cząsteczki. Oba atomy, X i Y, muszą odznaczać się dużą elektroujemnością (np.
X=O,
N,
C,
Y=O,
N,
F).
Przykłady substancji, w których występują wiązania wodorowe: woda (ciecz, lód), kwasy
karboksylowe, KHF
2
, ciekły NH
3
, białka.
24.
Oddziaływania międzycząsteczkowe
– inne niż wiązania chemiczne siły wiążące
atomy i cząsteczki.
25.
Ciało stałe
– rodzaj fazy skondensowanej, każda substancja, która nie jest płynna, czyli
zachowuje kształt i jest nieściśliwa. Ciało stałe jest pojęciem mało precyzyjnym i mogą w
nim występować w rzeczywistości różne stany skupienia materii zwane bardziej precyzyjnie
fazami fizycznymi.
W ciałach stałych mogą występować różne fazy:
•
ciało krystaliczne
•
kryształy plastyczne
•
kryształy condis
•
kwazikryształy
Nie wszystkie ciała stałe mają budowę krystaliczną. Niektóre są w stanie "zamrożonego
nieporządku", który z termodynamicznego punktu widzenia jest niestabilny (choć może
istnieć bardzo długo). Taką fazę nazywa się:
•
fazą szklistą lub fazą amorficzną
Substancja stała w stanie szklistym, której przykładem jest szkło, może być traktowana jak
ciecz o nieskończenie dużej lepkości.
W wielu substancjach, jak np. w tworzywach sztucznych lub w metalach często zdarza się, że
w stanie stałym występują na raz dwie fazy, np. krystaliczna i amorficzna, tworząc złożoną
mikrostrukturę, decydującą o własnościach mechanicznych całego materiału.
Cząsteczki ciała stałego ułożone są stosunkowo blisko siebie. Siły przyciągania między nimi
są bardzo duże, dlatego ciało w tym stanie trudno jest rozerwać lub pokruszyć. Cząsteczki i
atomy w ciałach stałych nie przemieszczają się w większej skali, a tylko wykonują drgania
wokół swoich położeń równowagi.
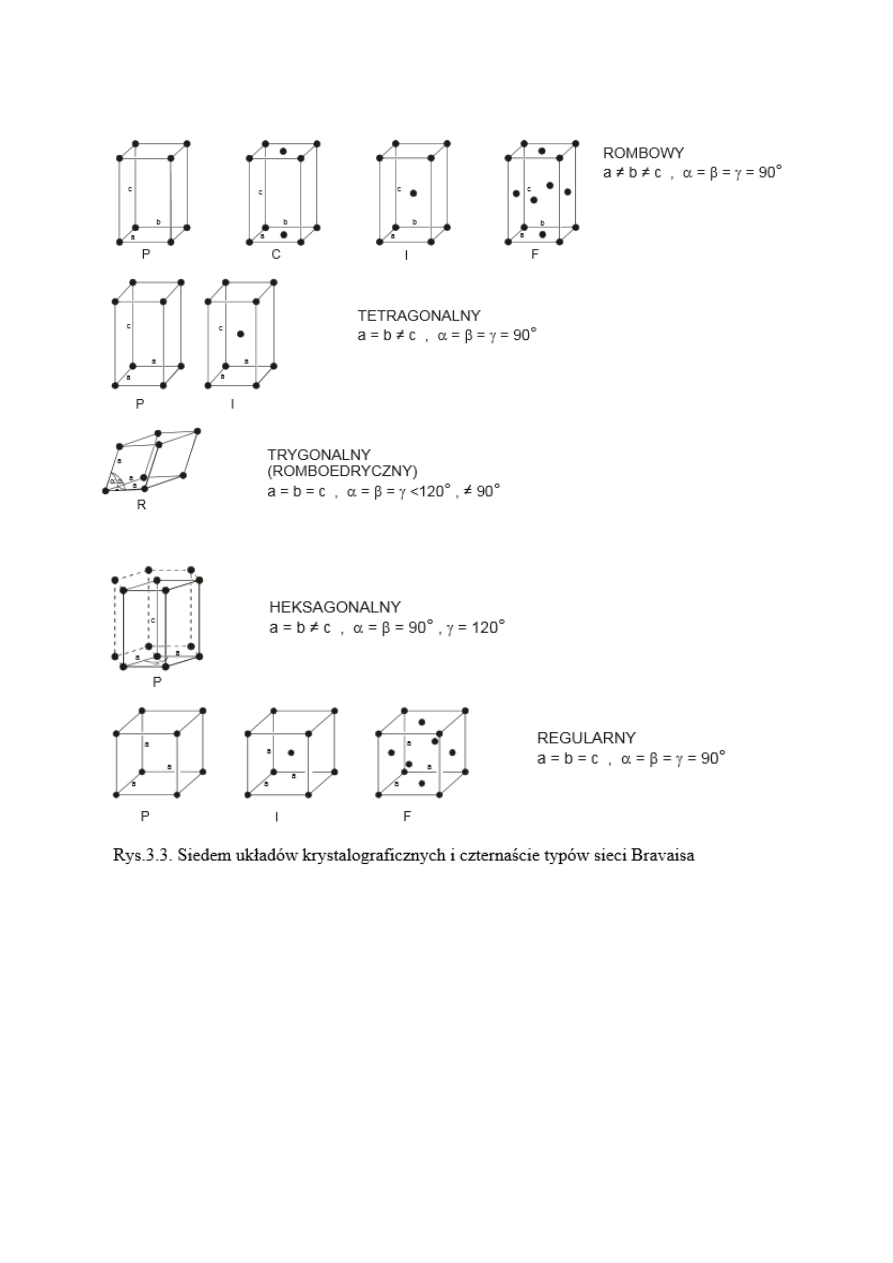
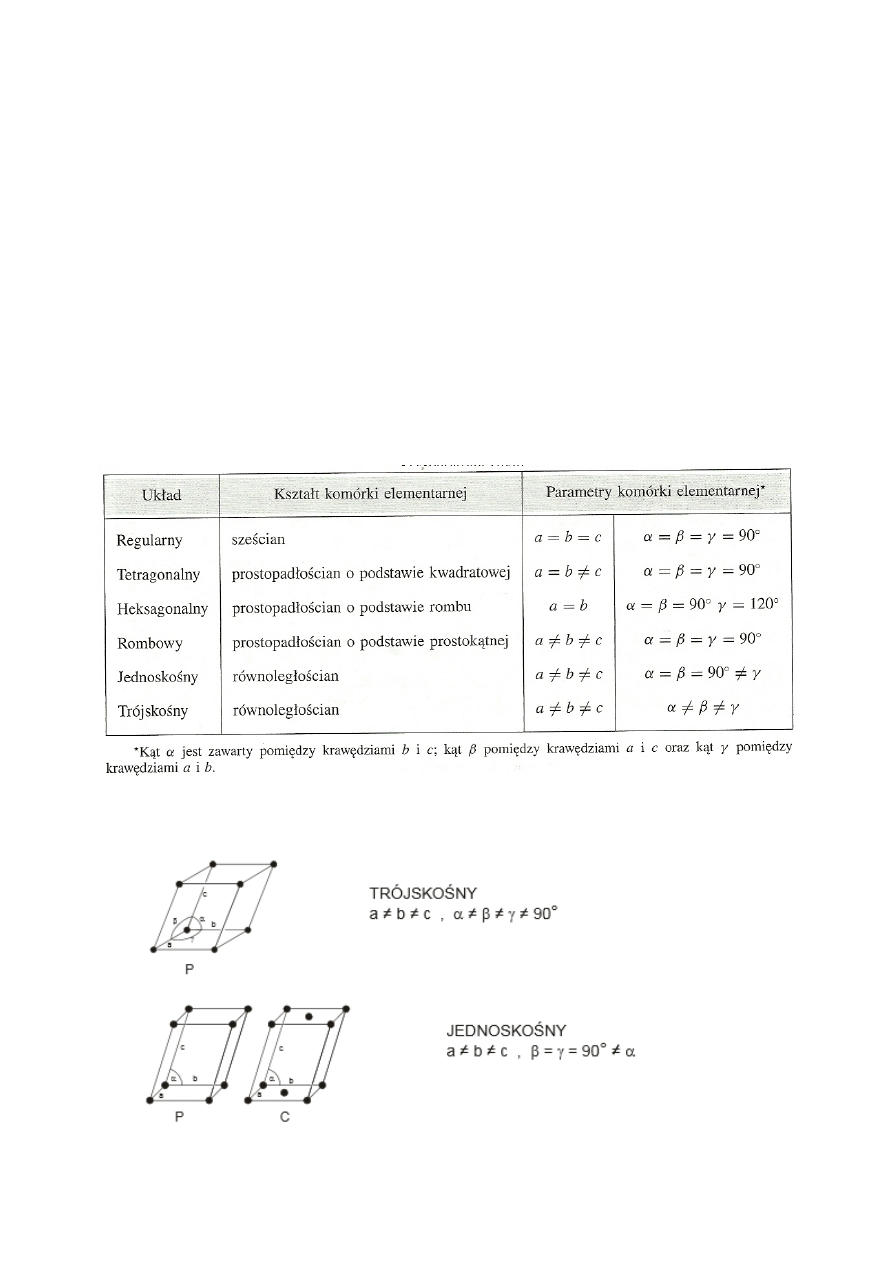
Komórka elementarna
- w krystalografii - najmniejsza, powtarzalna część struktury kryształu,
zawierająca wszystkie rodzaje cząsteczek, jonów i atomów, które tworzą określoną sieć
krystaliczną. Komórka elementarna powtarza się we wszystkich trzech kierunkach, tworząc
zamknięta sieć przestrzenną, której główną cechą jest symetria. Komórka elementarna ma zawsze
kształt równoległościanu.
27.
Kryształ molekularny, kryształ cząsteczkowy
– kryształ, w którym sieć krystaliczną
tworzą dobrze zdefiniowane cząsteczki powiązane słabymi oddziaływaniami
międzycząsteczkowymi (np. siłami van der Waalsa), natomiast nie występują w nich

wiązania jonowe ani wodorowe. Można wyróżnić trzy grupy kryształów molekularnych:
- kryształy zestalonych gazów szlachetnych;
- kryształy prostych niejonowych związków nieorganicznych (np. dwutlenek węgla, azot,
wodór, tritlenek diarsenu);
- kryształy niektórych niejonowych związków organicznych.
Rodzajem kryształów molekularnych są też kryształy plastyczne i ciekłe kryształy.
28.
kryształy kowalencyjne (atomowe)
zbudowane z atomów,które zajmują ściśle
określone miejsca w sieci przestrzennej, nie mogą się swobodnie przemieszczać, ale ulegają
drganiom. Atomy połączone są za pomocą wiązań atomowych (kowalencyjnych), które
mogą łączyć ze sobą bardzo duże ilości atomów, np diament, węglik krzemu, krzemionka,
grafit.
właściwości fizyczne:
- wysokie temp topnienia
- bardzo twarde, duża wytrzymałość mechaniczna
- nie przewodzą prądu w stanie czystym (izolatory), ale z odrobina domieszek mogą stać
się półprzewodnikami (wyjątek grafit przewodzi prąd)
- nierozpuszczalne w rozpuszczalnikach polarnych i niepolarnych
29.
kryształy jonowe
zbudowane są z jonów rozmieszczonych równomiernie w sieci
krystalicznej (układ regularny). Jony te działają na siebie silami przyciągania
elektrostatycznego, których wartości są dość znaczne. Dlatego tez kryształy związków o
wiązaniu jonowym wykazują specyficzne właściwości fizyczne tj:
- wysokie temperatury wrzenia
- wysokie temperatury topnienia
- duża wytrzymałość, twarde
- w stanie stopionym i w roztworze wodnym przewodzą prąd
- najczęściej dobrze rozpuszczalne w rozpuszczalnikach polarnych
np NaCl temp top: 801 st C, temp wrzenia: 1413 st C, inne to: NaF, MgS, K2O, Na2O,
MgCl2,itp
30.
Izomorfizm
- występowanie dwóch lub większej liczby substancji chemicznych w
postaci kryształów należących do tej samej klasy krystalograficznej.
Substancje izomorficzne:
‐ ten sam typ wzoru chemicznego,
‐ ten sam typ sieci przestrzennej,

‐ takie same lub bardzo zbliżone rozmiary komórki elementarnej,
‐ zdolność tworzenia roztworów stałych,
‐ przykłady:
Zn
1−x
N i
x
SO
4
⋅
7H
2
O
31.
Polimorfizm-
występowanie jednej substancji chemicznej w dwu lub więcej postaciach
krystalograficznych lub zmiana budowy krystalicznej w ściśle określonych warunkach.
Przemiany polimorficzne nieodwracalne: monotropowe,
Przemiany polimorficzne odwracalne: enancjotropowe.
Przykłady:
- ZnS, FeS
2
, CaCO
3
- polimorfizm SiO
2
:
32.Zmiany stanu skupienia są szczególnym przypadkiem przemian fazowych. P
rzez fazę
rozumiemy jednorodną część układu chemicznego oddzieloną od pozostałych
części wyraźnymi granicami – granicami międzyfazowymi
. Każdy układ
chemiczny określony jest przez liczbę faz oraz liczbę składników niezbędnych do
zbudowania tego układu. Ilość faz oraz składników jaka może występować w danym
układzie jest zależna od temperatury, ciśnienia. Zależność tę ujmuje
reguła faz Gibbsa:
s=α −β +2
gdzie:
s- Liczba stopni swobody
– liczba parametrów, jakie można zmieniać w układzie,
przynajmniej w pewnym zakresie, bez zmiany liczby istniejących w nim faz. Inaczej –
najmniejsza liczba parametrów wystarczająca do jednoznacznego zdefiniowaniastanu
układu
α- liczba niezależnych składników,
a więc takich, które nie dają się określić za
pomocą zależności chemicznych poprzez stężenia innych składników (niezależnych).Przez
ilość składników niezależnych a rozumiemy minimalną ilość składników potrzebną do
zbudowania układu.
β - liczba faz,
a więc postaci materii jednorodnej chemicznie i fizycznie (np. roztwór, faza
gazowa, kryształy o określonym składzie)

Przykład:
Dla zbudowania trójskładnikowego układu składającego się z
CaO , CaCO
3
i CO
2
wystarczą dwa składniki np.:
CaO i CO
2
gdyż trzeci składnik w
układzie pojawi się wskutek reakcji:
CaO+CO
2
=
CaCO
3
. Tak więc ilość składników
niezależnych dla układu „
CaO−CaCO
3
−
CO
2
” jest równa ilości składników obecnych
w układzie pomniejszonej o jeden (jedno równanie wiąże ze sobą składniki tworzące układ):
β= 2.
Ilość składników niezależnych danego układu jest równa ilości składników obecnych w
układzie pomniejszonej o ilość równań chemicznych wiążących te składniki.
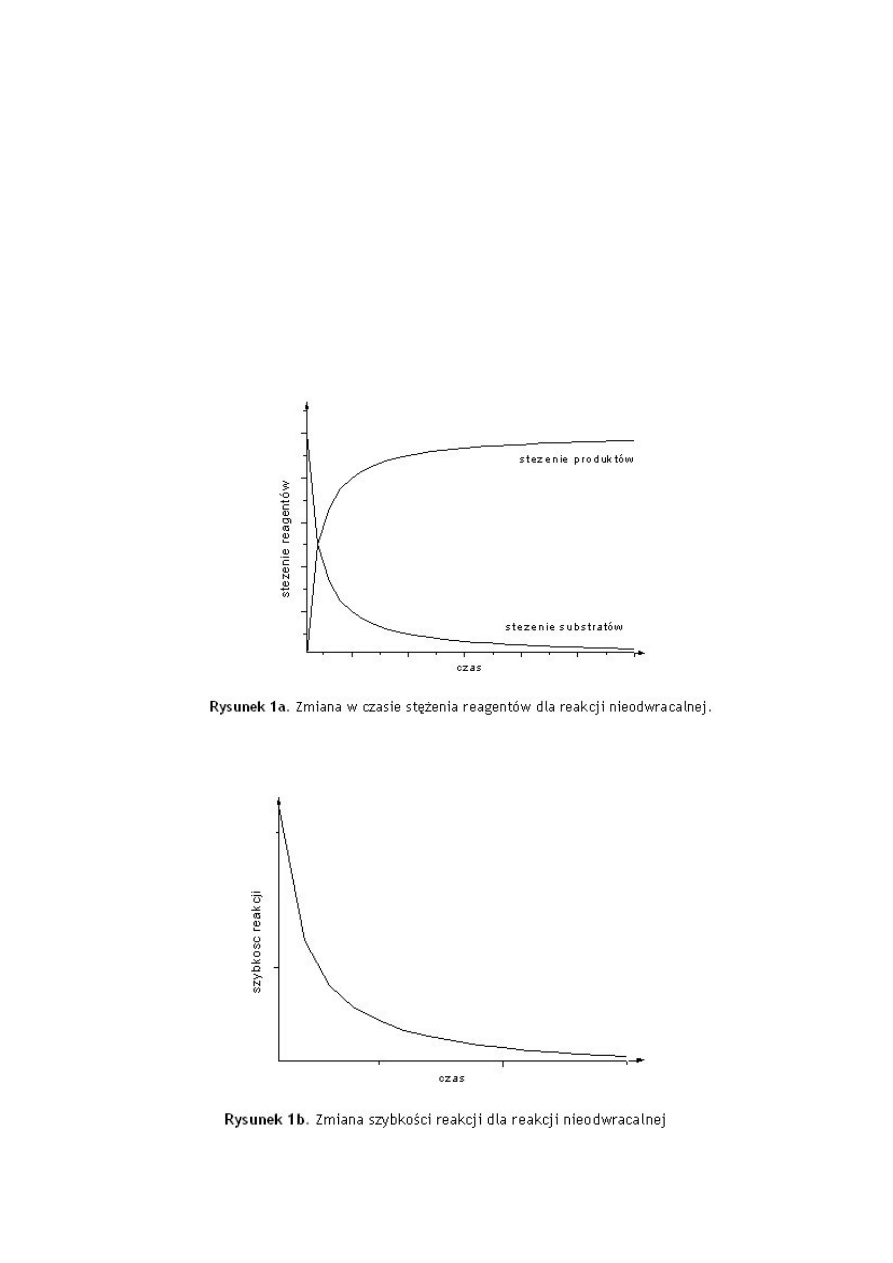
33.Odwracalność reakcji chemicznych:
Przeważająca większość reakcji chemicznych to procesy odwracalne. Odwracalność
chemiczna reakcji polega na możliwości przeprowadzenia jej w obu kierunkach; są to zatem
takie reakcje, które mogą przebiegać zarówno w kierunku tworzenia produktów, jak i
substratów.
Reakcje chemiczne mogą zachodzić aż do całkowitego zużycia substratów, albo dochodzić
do pewnego stanu, w którym substraty współistnieją z produktami. Stan taki wynika z
ustalenia się stanu równowagi. Jeśli szybkość reakcji „w prawo” zdecydowanie dominuje
nad szybkością reakcji „w lewo”, to substraty niemal całkowicie przereagowują w produkty,
a proces uważa się za praktycznie nieodwracalny, czyli biegnący do końca (Rysunek 1a, 1b).
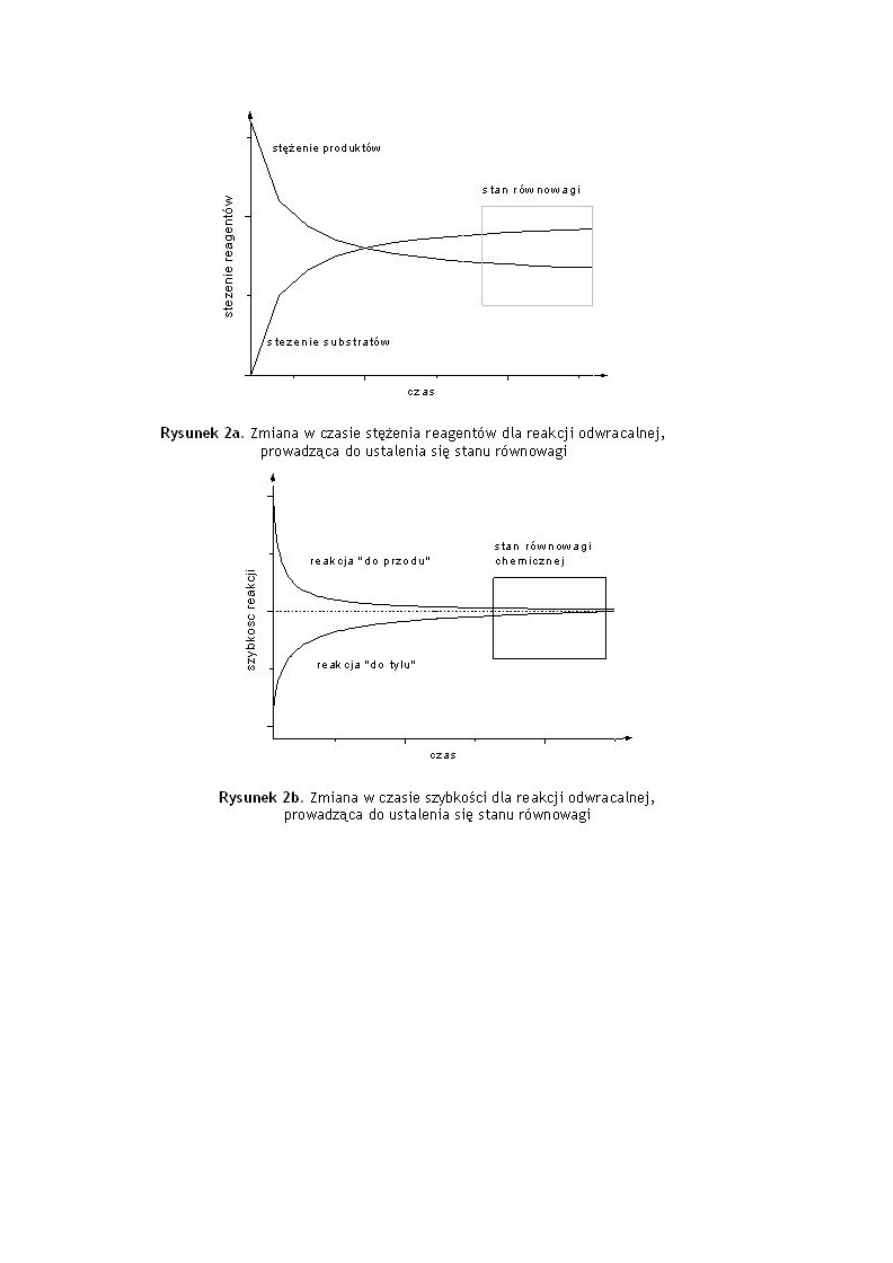
Gdy szybkości reakcji w obu kierunkach są takie same, wówczas mamy do czynienia ze
stanem równowagi chemicznej. W stanie równowagi chemicznej ilość substratów i
produktów nie ulega zmianie, choć obie reakcje zachodzą w dalszym ciągu (Rysunek 2a,2b).
Odwracalność reakcji chemicznej to możliwość równoczesnego jej przebiegu w dwóch
przeciwnych kierunkach.
W równaniu reakcji fakt ten należy zaznaczyć dwustronną strzałką
↔
Przykład: W wysokich temperaturach jod cząsteczkowy częściowo dysocjuje na jod
atomowy zgodnie z reakcją: I
2
(g)
2I(g). Jest to reakcja homogeniczna i jeśli jest
↔
prowadzona w układzie zamkniętym jest reakcją odwracalną. Z doświadczenia wiadomo, że
w 1000K dysocjacji ulega jedynie 3.0% jodu cząsteczkowego. Jeśli układ zawierał
początkowo 1500 cząsteczek I
2
, to dysocjacji uległo ich: 0.03·1500=45, co generuje
powstanie 90 atomów jodu. W stanie równowagi układ zawiera 1500-45=1455I
2
i 2·45=90I.
Równowaga reakcji chemicznych
– stan, gdy reakcja chemiczna zachodzi z jednakową
szybkością w obu kierunkach, a więc stężenia reagentów nie zmieniają się w czasie. Potencjały
termodynamiczne układu, jakim jest środowisko reakcji, osiągają wartości minimalne
(charakterystyczne dla określonych warunków). Minimum osiągają też odpowiednie funkcje
termodynamiczne reakcji.

34.Prawo działania mas w układach w układach homogenicznych i
heterogenicznych.
Prawo działania mas:
W stanie równowagi stosunek iloczynu stężeń molowych produktów, podniesionych do potęg
będących ich współczynnikami stechiometrycznymi, do iloczynu stężeń molowych substratów
podniesionych do potęg będących ich współczynnikami stechiometrycznymi jest wielkością stałą.
Stała równowagi K:
K =
[
C ]
c
⋅[
D]
d
[
A]
a
⋅[
B]
b
Reakcja homogeniczna (synteza amoniaku):
N
2(g)
+3H
2(g)
↔2NH
3(g)
K
x
=
X
NH
3
2
X
N
2
⋅
X
H
2
3
za pomocą ułamków molowych
←
K
p
=
p
NH
3
2
p
N
2
⋅
p
H
2
3
za pomocą ciśnień parcjalnych
←
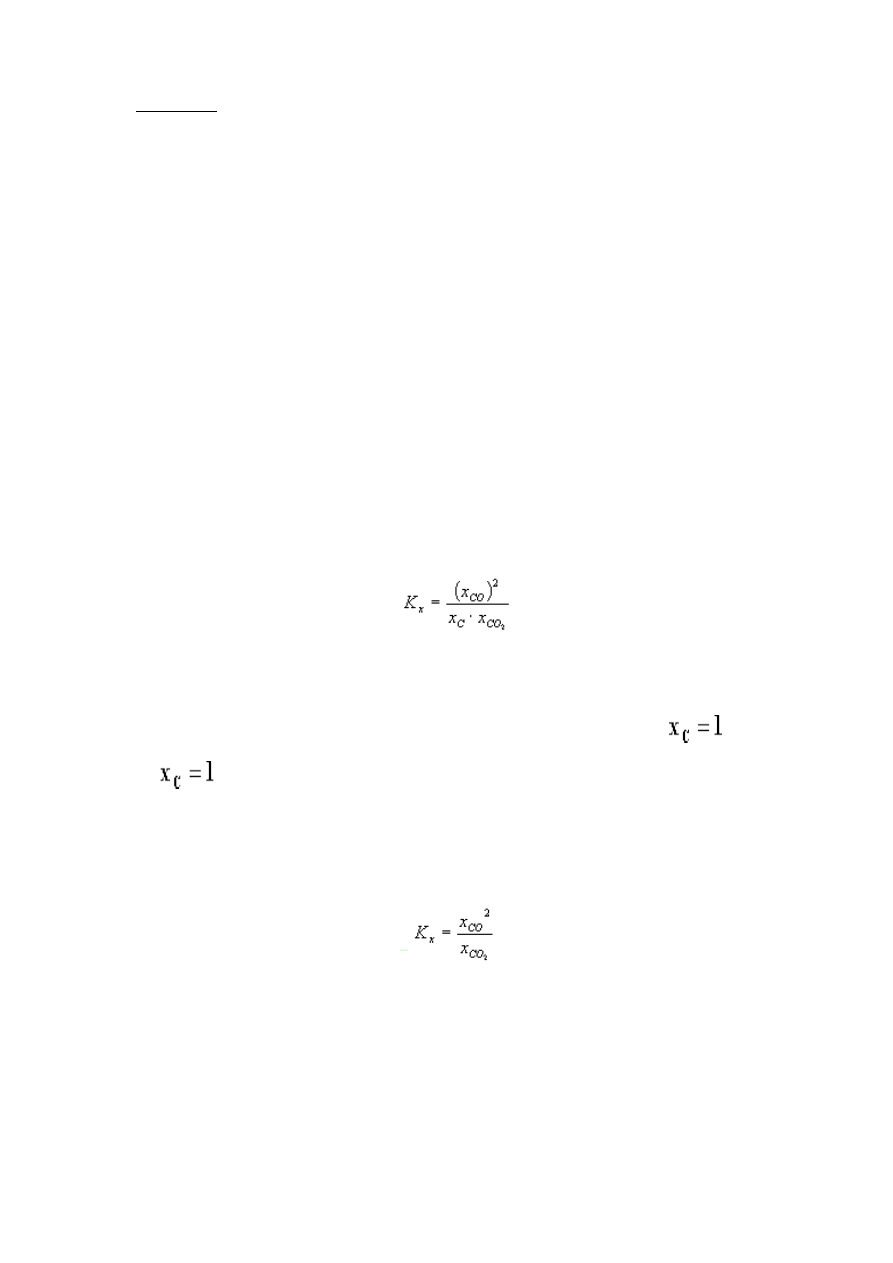
K
c
=
[
NH
3
]
3
[
H
2
]
3
⋅[
N
2
]
za pomocą stężeń
←
Równowaga w układach heterogenicznych
Równowaga C, CO, CO
2
Bardzo często reakcje równowagowe ustalają się pomiędzy reagentami występującymi w różnych
fazach. Przykładem takiej reakcji może być reakcja zachodząca pomiędzy CO
2
a stałym węglem,
zachodząca w wysokich temperaturach:
C(s) + CO
2
(g)
↔ 2CO(g)
symbol (s) – oznacza, że badana substancja występuje w stanie stałym; (g) – gazowym.
Dla stanu równowagi, prawo działania mas można wyrazić za pomocą ułamków molowych:
Tlenki węgla tworzą wspólną fazę gazową, skład jej podają ułamki molowe (lub stężenia molowe,
lub ciśnienia parcjalne).
Węgiel tworzy osobną fazę, występuje w stanie stałym, jako substancja, stąd
. Przyjęcie
równości
oznacza, że w skład fazy stałej nie ulega zmianie w czasie reakcji chemicznej i
rzeczywiście tak jest. W przeciwieństwie do fazy gazowej której skład ulega zmianie w czasie
reakcji faza stała zachowuje swój skład a zmianie ulega jedynie jej masa
Prawo działania mas możemy teraz zapisać w uproszczonej postaci:
Prawo działania mas dla rozpatrywanej równowagi heterogenicznej można również zapisać za
pomocą ciśnień cząstkowych reagentów występujących w fazie gazowej. Wystarczy podstawić za
ułamki molowe następujące wyrażenia:

gdzie:
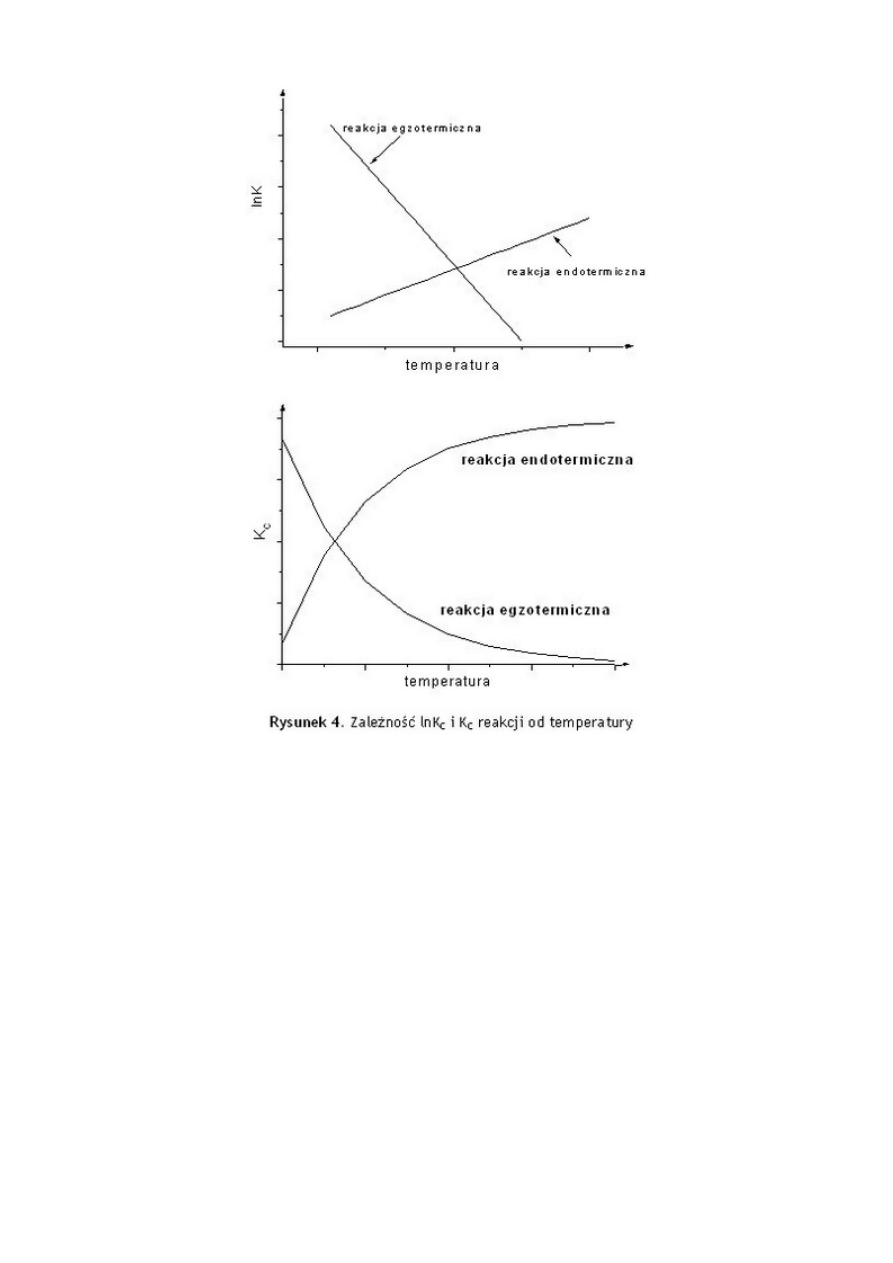
35.Zależność stałej równowagi od temperatury
Doświadczalnie stwierdzono, że w przypadku reakcji egzotermicznej obniżenie temperatury
sprzyja tworzeniu się produktów. Gdy reakcja jest endotermiczna, powstawaniu produktów sprzyja
wzrost temperatury. Te obserwacje doświadczalne można podsumować w następujący sposób:
K wzrasta wraz ze spadkiem temperatury, gdy reakcja jest egzotermiczna
K wzrasta wraz ze wzrostem temperatury, gdy reakcja jest egzotermiczna
Zależności te pokazuje Rysunek 4.
Reguła Le Chateliera i Browna (Reguła przekory)
Zmiana parametrów wyznaczających stan równowagi chemicznej – stężenia reagentów,
temperatury i ciśnienia prowadzą do zaburzenia (przesunięcia) równowagi. Układ chemiczny
dąży wtedy do nowego stanu równowagi wyznaczonego „nowymi”, zmienionymi parametrami.
Wpływ zmiany stężenia reagentów, ich ciśnienia oraz temperatury na stan równowagi określa
reguła Le Chateliera i Browna (reguła przekory).
Reguła ta mówi, że jeżeli zostanie zakłócony stan równowagi przez zmiany T, p, c, w układzie
rozpoczyna się taka przemiana, która będzie przeciwdziałała zakłóceniom prowadząc do
osiągnięcia ponownego stanu równowagi.
Przemiany zainicjowane zakłóceniem równowagi trwają aż do ponownego zrównoważenia się
szybkości reakcji przebiegających w przeciwnych kierunkach. Po pewnym czasie równowaga znów
się ustala, ale już przy innych niż poprzednio stężeniach.

Reasumując reguła przekory brzmi:
Jeżeli układ będący w stanie równowagi poddamy działaniu zewnętrznemu, tj. zmianie stężenia
reagentów, zmianie ciśnienia lub zmianie temperatury, to w układzie tym przesuwa się równowaga
chemiczna w kierunku kompensacji tych zmian.
36.
Dysocjacja elektrolityczna-
rozpad na jony pod wpływem rozpuszczalnika o budowie
dipolowej. Dysocjacji ulegają substancje o wiązaniach jonowych lub silnie spolaryzowanych,
rozpuszczalne lub reagujące z wodą. Zgodnie z tą teorią reakcja zobojętniania polega na
reakcji kwasu i zasady, czyli kationu wodoru (oksoniowego) i anionu wodorotlenowego.
Teoria dysocjacji Arrheniusa:
kwasami
nazywamy substancje, których cząsteczki ulegają w roztworach wodnych
dysocjacji elektrolitycznej połączonej z odszczepieniem kationu wodorowego H
+
zasadami
nazywamy substancje, których cząsteczki ulegają w roztworach wodnych
dysocjacji elektrolitycznej połączonej z odszczepieniem jonu wodorotlenkowego OH
-
Teoria Brønsteda
Kwasami nazywamy związki chemiczne lub jony zdolne do oddawania protonów (donory
protonów), a zasadami związki chemiczne lub jony zdolne do przyłączania protonów (akceptory
protonów). Cząsteczka lub jon kwasu po oddaniu protonu staje się cząsteczką lub jonem zasady i
odwrotnie - cząsteczka zasady po przyłączeniu protonu staje się cząsteczką lub jonem kwasu. W
każdym zapisie reakcji przyłączania i oddawania protonów można wyróżnić po każdej stronie
reakcji sprzężone ze sobą pary: kwas-zasada. Woda jest rozpuszczalnikiem o właściwościach
amfoterycznych, może bowiem spełniać zarówno rolę kwasu, jak i zasady:

37. Dysocjacja wody
Cząsteczki wody, ze względu na znaczny udział wiązania atomowego pomiędzy atomami
tlenu i wodoru, tylko w niewielkim stopniu ulegają dysocjacji. Ze wględu na znaczną różnicę
elektroujemności pomiędzy tymi pierwiastkami (tlen 3,5; wodór 2,1) para elektronów
wiązania przesunięta jest w kierunku tlenu. W wyniku tego procesu atomy wodoru
wykazują ładunek dodatni, atom tlenu – ujemny, a cała cząsteczka ma charakter polarny -
jest dipolem. Cząsteczka wody ulega dysocjacji zgodnie ze schematem:
Iloczyn stałej dysocjacji wody i równowagowego stężenia molowego wody można zatem
również uważać za stałą, zależną jedynie od temperatury. Nosi ona nazwę
iloczynu
jonowego wody K
W
. W temperaturze standardowej (25
0
C) wartość iloczynu jonowego
wody wynosi 10
-14
.
ilości jonów wodorowych i wodorotlenkowych tworzących się podczas dysocjacji cząsteczek
w czystej wodzie są identyczne. Oznacza to, że w temperaturach zbliżonych do temperatury
pokojowej stężenia jonów H
+
i OH
-
są równe i wynoszą 10
-7
mol·dm
-3
38.Wykładnik stężenia jonów hydroniowych (wodorowych)- pH
39.Mocne i słabe elektrolity.
Elektrolitami mocnymi
nazywamy elektrolity, które w roztworze wodnym są całkowicie
zdysocjowane. Najbardziej typowymi przedstawicielami elektrolitów mocnych są sole i
wodorotlenki litowców (za wyjątkiem litu) i berylowców (za wyjątkiem berylu i magnezu), a
także chlorki, bromki, jodki, azotany(V) i chlorany(VII) niektórych metali pozostałych grup.

Można do nich zaliczyć również rozcieńczone roztwory niektórych kwasów, np.
azotowego(V), chlorowego(VII), siarkowego(VI), chlorowodorowego, bromowodorowego,
jodowodorowego oraz i zasad (KOH, NaOH, ...). W przypadku, gdy wiązanie w cząsteczkach
elektrolitu posiada charakter wiązania atomowego-spolaryzowanego, w roztworze
występują obok siebie zarówno jony, jak i niezdysocjowane cząsteczki. Takie elektrolity
nazywamy
słabymi.
40.
Prawo rozcieńczeń Ostwalda
gdzie:
•
α – stopień dysocjacji,
•
C – stężenie elektrolitu,
•
K – stała dysocjacji.
Prawo rozcieńczeń Ostwalda stosuje się do dysocjacji słabych kwasów i zasad a także do hydrolizy
ich soli.
Równanie to spełnione jest jedynie w rozcieńczonych roztworach słabych elektrolitów
Należy przekształcić równanie:
Jeżeli wyrażenie K/C ma wartość poniżej 1/400 lub α wynosi poniżej 5%, wówczas równanie
rozwiązuje się w sposób przybliżony (jeżeli nie, to należy rozwiązać równanie kwadratowe):
skąd otrzymuje się stopień dysocjacji α:
oraz stężenie formy zdysocjowanej αC:
44.
Hydroliza soli
jest reakcją pomiędzy jonami pochodzącymi z dysocjacji soli i
cząsteczkami wody. Jest to odwracalna reakcja wymiany podwójnej, do zajścia której

wymagane jest, aby przynajmniej jeden z produktów reakcji opuścił jej środowisko. Uważa
się przy tym, że fakt ten ma miejsce wówczas, gdy produktem tym jest trudnorozpuszczalny
osad lub słabo zdysocjowany/a kwas/zasada. W przypadku hydrolizy soli produktami
reakcji są zawsze kwas i zasada. O tym, czy taka reakcja zachodzi, powiadamia nas fakt
tworzenia cząsteczek słabego kwasu, słabej zasady, bądź obydwu naraz. W zapisie reakcji
hydrolizy, sól oraz mocny kwas i mocną zasadę zapisujemy w formie jonowej, natomiast
wodę i tworzący się słaby kwas względnie zasadę, w formie cząsteczkowej. W ogólności:
Nie wszystkie sole ulegają reakcji hydrolizy. Solami które nie ulegają reakcji hydrolizy są
sole mocnych kwasów i mocnych zasad (NaCl, KNO
3
, K
2
SO
4
,...)
Miarą zaawansowania procesu hydrolizy jest stopień hydrolizy b
h
, określony stosunkiem
liczby cząsteczek (moli) zhydrolizowanych c
h
do liczby cząsteczek (moli) soli c
wprowadzonych pierwotnie do roztworu.
Drugą wielkością charakteryzującą sól w roztworze jest stała hydrolizy K
h
, która zależy od
temperatury
45.
Roztworami buforowymi
nazywamy roztwory zachowujące stałą wartość pH i nieczułe
na niewielkie dodatki kwasów i zasad. Są to przeważnie roztwory słabych kwasów i ich soli
lub słabych zasad i ich soli.
* * *
46.
Wiązania i kryształy metaliczne.
Wiązanie metaliczne – ogólna nazwa dla wszelkich
wiązań chemicznych występujących bezpośrednio między atomami metali. Wiązania
między atomami metalu, jeśli występują w izolowanej formie (np. w związkach
metaloorganicznych) są w zasadzie typowymi wiązaniami kowalencyjnymi, wyróżniają się
jednak w stosunku do analogicznych wiązań między niemetalami dwiema istotnymi
cechami:
* ulegają one łatwiejszej polaryzacji pod wpływem np. pola elektrycznego ze względu na to,
że ogólnie w metalach elektrony walencyjne są słabiej związane z jądrami atomów niż w
niemetalach
* nawet jeśli formalnie są wiązaniami pojedynczymi, ze względu na występowanie w
metalach dużej liczby walencyjnych orbitali d zachodzi zjawisko ich nakładania się, co
powoduje że wiązania te nabierają często charakteru częściowo wielokrotnego.
Kryształy metali
– struktury występujące w metalach i ich stopach. Zbudowane są z
kationów metalu tworzących sieć krystaliczną, oraz pochodzących z powłok walencyjnych

elektronów, które poruszają się chaotycznie w całej przestrzeni kryształu i tworzą tzw. gaz
elektronowy, umożliwiający łatwy przepływ prądu elektrycznego.
Właściwości wiązania metalicznego:
•
Wiązanie jest bezkierunkowe. Im więcej elektronów uczestniczy w tworzeniu wiązania, tym
lepiej,
•
Duża gęstość upakowania,
•
niezbyt silne wiązania,
•
duże przewodnictwo elektryczne i cieplne
•
łatwo można wytworzyć dyslokację
Kryształy metaliczne:
•
metaliczny połysk,
•
przewodnictwo cieplne i elektryczne,
•
ciągliwość,
•
kowalność.
47.
Alotropia
- zjawisko występowania tego samego pierwiastka chemicznego w odmianach
różniących się budową cząsteczki (np. O2, O3) lub budową sieci krystalicznej (np. siarka
rombowa, siarka jednoskośna)
Przykład:
Tlen:
Ditlen (O2), Ozon (O3)
Węgiel:
grafit, diament, fullereny i nanorurki, polieny.
Siarka:
rombowa, jednoskośna.
48.
Konfiguracje elektronowe:
1
1s
1
1
2
1s
2
2
2
2s
1
1s
2
2s
1
2
1

2
2s
2
1s
2
2s
2
2
2
2
2s
2
2p
1
1s
2
2s
2
2p
1
2
3
2
2s
2
2p
2
1s
2
2s
2
2p
2
2
4
2
2s
2
2p
3
1s
2
2s
2
2p
3
2
5
2
2s
2
2p
4
1s
2
2s
2
2p
4
2
6
2
2s
2
2p
5
1s
2
2s
2
2p
5
2
7
2
2s
2
2p
6
1s
2
2s
2
2p
6
2
8
11 Na
1
1s
2
2s
2
2p
6
3s
1
2
8
1
12 Mg
2
1s
2
2s
2
2p
6
3s
2
2
8
2
2
3p
1
1s
2
2s
2
2p
6
3s
2
3p
1
2
8
3
2
3p
2
1s
2
2s
2
2p
6
3s
2
3p
2
2
8
4
2
3p
3
1s
2
2s
2
2p
6
3s
2
3p
3
2
8
5
2
3p
4
1s
2
2s
2
2p
6
3s
2
3p
4
2
8
6
2
3p
5

1s
2
2s
2
2p
6
3s
2
3p
5
2
8
7
2
3p
6
1s
2
2s
2
2p
6
3s
2
3p
6
2
8
8
1
1s
2
2s
2
2p
6
3s
2
3p
6
4s
1
2
8
8
1
20 Ca
2
1s
2
2s
2
2p
6
3s
2
3p
6
4s
2
2
8
8
2
1
4s
2
1s
2
2s
2
2p
6
3s
2
3p
6
3d
1
4s
2
2
8
9
2
2
4s
2
1s
2
2s
2
2p
6
3s
2
3p
6
3d
2
4s
2
2
8
10
2
3
4s
2
1s
2
2s
2
2p
6
3s
2
3p
6
3d
3
4s
2
2
8
11
2
5
4s
1
1s
2
2s
2
2p
6
3s
2
3p
6
3d
5
4s
1
2
8
13
1
5
4s
2
1s
2
2s
2
2p
6
3s
2
3p
6
3d
5
4s
2
2
8
13
2
6
4s
2
1s
2
2s
2
2p
6
3s
2
3p
6
3d
6
4s
2
2
8
14
2
27 Co
7
4s
2
1s
2
2s
2
2p
6
3s
2
3p
6
3d
7
4s
2
2
8
15
2
8
4s
2
1s
2
2s
2
2p
6
3s
2
3p
6
3d
8
4s
2
2
8
16
2
10
4s
1
1s
2
2s
2
2p
6
3s
2
3p
6
3d
10
4s
1
2
8
18
1
10
4s
2
1s
2
2s
2
2p
6
3s
2
3p
6
3d
10
4s
2
2
8
18
2
10
4s
2
4p
1
1s
2
2s
2
2p
6
3s
2
3p
6
3d
10
4s
2
4p
1
2
8
18
3
10
4s
2
4p
2
1s
2
2s
2
2p
6
3s
2
3p
6
3d
10
4s
2
4p
2
2
8
18
4
10
4s
2
4p
3
1s
2
2s
2
2p
6
3s
2
3p
6
3d
10
4s
2
4p
3
2
8
18
5
10
4s
2
4p
4
1s
2
2s
2
2p
6
3s
2
3p
6
3d
10
4s
2
4p
4
2
8
18
6
10
4s
2
4p
5
1s
2
2s
2
2p
6
3s
2
3p
6
3d
10
4s
2
4p
5
2
8
18
7
10
4s
2
4p
6
1s
2
2s
2
2p
6
3s
2
3p
6
3d
10
4s
2
4p
6
2
8
18
8
1
1s
2
2s
2
2p
6
3s
2
3p
6
3d
10
4s
2
4p
6
5s
1
2
8
18
8
1
2
1s
2
2s
2
2p
6
3s
2
3p
6
3d
10
4s
2
4p
6
5s
2
2
8
18
8
2
1
5s
2
1s
2
2s
2
2p
6
3s
2
3p
6
3d
10
4s
2
4p
6
4d
1
5s
2
2
8
18
9
2
2
5s
2
1s
2
2s
2
2p
6
3s
2
3p
6
3d
10
4s
2
4p
6
4d
2
5s
2
2
8
18
10
2
4
5s
1
1s
2
2s
2
2p
6
3s
2
3p
6
3d
10
4s
2
4p
6
4d
4
5s
1
2
8
18
12
1
42 Mo
5
5s
1
1s
2
2s
2
2p
6
3s
2
3p
6
3d
10
4s
2
4p
6
4d
5
5s
1
2
8
18
13
1
5
5s
2
1s
2
2s
2
2p
6
3s
2
3p
6
3d
10
4s
2
4p
6
4d
5
5s
2
2
8
18
13
2

7
5s
1
1s
2
2s
2
2p
6
3s
2
3p
6
3d
10
4s
2
4p
6
4d
7
5s
1
2
8
18
15
1
8
5s
1
1s
2
2s
2
2p
6
3s
2
3p
6
3d
10
4s
2
4p
6
4d
8
5s
1
2
8
18
16
1
10
1s
2
2s
2
2p
6
3s
2
3p
6
3d
10
4s
2
4p
6
4d
10
2
8
18
18
47 Ag
10
5s
1
1s
2
2s
2
2p
6
3s
2
3p
6
3d
10
4s
2
4p
6
4d
10
5s
1
2
8
18
18
1
10
5s
2
1s
2
2s
2
2p
6
3s
2
3p
6
3d
10
4s
2
4p
6
4d
10
5s
2
2
8
18
18
2
10
5s
2
5p
1
1s
2
2s
2
2p
6
3s
2
3p
6
3d
10
4s
2
4p
6
4d
10
5s
2
5p
1
2
8
18
18
3
10
5s
2
5p
2
1s
2
2s
2
2p
6
3s
2
3p
6
3d
10
4s
2
4p
6
4d
10
5s
2
5p
2
2
8
18
18
4
10
5s
2
5p
3
1s
2
2s
2
2p
6
3s
2
3p
6
3d
10
4s
2
4p
6
4d
10
5s
2
5p
3
2
8
18
18
5
10
5s
2
5p
4
1s
2
2s
2
2p
6
3s
2
3p
6
3d
10
4s
2
4p
6
4d
10
5s
2
5p
4
2
8
18
18
6
10
5s
2
5p
5
1s
2
2s
2
2p
6
3s
2
3p
6
3d
10
4s
2
4p
6
4d
10
5s
2
5p
5
2
8
18
18
7
10
5s
2
5p
6
1s
2
2s
2
2p
6
3s
2
3p
6
3d
10
4s
2
4p
6
4d
10
5s
2
5p
6
2
8
18
18
8
1
1s
2
2s
2
2p
6
3s
2
3p
6
3d
10
4s
2
4p
6
4d
10
5s
2
5p
6
6s
1
2
8
18
18
8
1
2
1s
2
2s
2
2p
6
3s
2
3p
6
3d
10
4s
2
4p
6
4d
10
5s
2
5p
6
6s
2
2
8
18
18
8
2
1
6s
2

1s
2
2s
2
2p
6
3s
2
3p
6
3d
10
4s
2
4p
6
4d
10
5s
2
5p
6
5d
1
6s
2
2
8
18
18
9
2
1
5d
1
6s
2
1s
2
2s
2
2p
6
3s
2
3p
6
3d
10
4s
2
4p
6
4d
10
4f
1
5s
2
5p
6
5d
1
6s
2
2
8
18
19
9
2
3
6s
2
1s
2
2s
2
2p
6
3s
2
3p
6
3d
10
4s
2
4p
6
4d
10
4f
3
5s
2
5p
6
6s
2
2
8
18
21
8
2
4
6s
2
1s
2
2s
2
2p
6
3s
2
3p
6
3d
10
4s
2
4p
6
4d
10
4f
4
5s
2
5p
6
6s
2
2
8
18
22
8
2
5
6s
2
1s
2
2s
2
2p
6
3s
2
3p
6
3d
10
4s
2
4p
6
4d
10
4f
5
5s
2
5p
6
6s
2
2
8
18
23
8
2
6
6s
2
1s
2
2s
2
2p
6
3s
2
3p
6
3d
10
4s
2
4p
6
4d
10
4f
6
5s
2
5p
6
6s
2
2
8
18
24
8
2
7
6s
2
1s
2
2s
2
2p
6
3s
2
3p
6
3d
10
4s
2
4p
6
4d
10
4f
7
5s
2
5p
6
6s
2
2
8
18
25
8
2
7
5d
1
6s
2
1s
2
2s
2
2p
6
3s
2
3p
6
3d
10
4s
2
4p
6
4d
10
4f
7
5s
2
5p
6
5d
1
6s
2
2
8
18
25
9
2
9
6s
2
1s
2
2s
2
2p
6
3s
2
3p
6
3d
10
4s
2
4p
6
4d
10
4f
9
5s
2
5p
6
6s
2
2
8
18
27
8
2
66 Dy
10
6s
2
1s
2
2s
2
2p
6
3s
2
3p
6
3d
10
4s
2
4p
6
4d
10
4f
10
5s
2
5p
6
6s
2
2
8
18
28
8
2
11
6s
2
1s
2
2s
2
2p
6
3s
2
3p
6
3d
10
4s
2
4p
6
4d
10
4f
11
5s
2
5p
6
6s
2
2
8
18
29
8
2
12
6s
2
1s
2
2s
2
2p
6
3s
2
3p
6
3d
10
4s
2
4p
6
4d
10
4f
12
5s
2
5p
6
6s
2
2
8
18
30
8
2
13
6s
2
1s
2
2s
2
2p
6
3s
2
3p
6
3d
10
4s
2
4p
6
4d
10
4f
13
5s
2
5p
6
6s
2
2
8
18
31
8
2
14
6s
2
1s
2
2s
2
2p
6
3s
2
3p
6
3d
10
4s
2
4p
6
4d
10
4f
14
5s
2
5p
6
6s
2

2
8
18
32
8
2
14
5d
1
6s
2
1s
2
2s
2
2p
6
3s
2
3p
6
3d
10
4s
2
4p
6
4d
10
4f
14
5s
2
5p
6
5d
1
6s
2
2
8
18
32
9
2
14
5d
2
6s
2
1s
2
2s
2
2p
6
3s
2
3p
6
3d
10
4s
2
4p
6
4d
10
4f
14
5s
2
5p
6
5d
2
6s
2
2
8
18
32
10
2
73 Ta
14
5d
3
6s
2
1s
2
2s
2
2p
6
3s
2
3p
6
3d
10
4s
2
4p
6
4d
10
4f
14
5s
2
5p
6
5d
3
6s
2
2
8
18
32
11
2
14
5d
4
6s
2
1s
2
2s
2
2p
6
3s
2
3p
6
3d
10
4s
2
4p
6
4d
10
4f
14
5s
2
5p
6
5d
4
6s
2
2
8
18
32
12
2
14
5d
5
6s
2
1s
2
2s
2
2p
6
3s
2
3p
6
3d
10
4s
2
4p
6
4d
10
4f
14
5s
2
5p
6
5d
5
6s
2
2
8
18
32
13
2
14
5d
6
6s
2
1s
2
2s
2
2p
6
3s
2
3p
6
3d
10
4s
2
4p
6
4d
10
4f
14
5s
2
5p
6
5d
6
6s
2
2
8
18
32
14
2
14
5d
7
6s
2
1s
2
2s
2
2p
6
3s
2
3p
6
3d
10
4s
2
4p
6
4d
10
4f
14
5s
2
5p
6
5d
7
6s
2
2
8
18
32
15
2
78 Pt
14
5d
9
6s
1
1s
2
2s
2
2p
6
3s
2
3p
6
3d
10
4s
2
4p
6
4d
10
4f
14
5s
2
5p
6
5d
9
6s
1
2
8
18
32
17
1
14
5d
10
6s
1
1s
2
2s
2
2p
6
3s
2
3p
6
3d
10
4s
2
4p
6
4d
10
4f
14
5s
2
5p
6
5d
10
6s
1
2
8
18
32
18
1
14
5d
10
6s
2
1s
2
2s
2
2p
6
3s
2
3p
6
3d
10
4s
2
4p
6
4d
10
4f
14
5s
2
5p
6
5d
10
6s
2
2
8
18
32
18
2
14
5d
10
6s
2
6p
1
1s
2
2s
2
2p
6
3s
2
3p
6
3d
10
4s
2
4p
6
4d
10
4f
14
5s
2
5p
6
5d
10
6s
2
6p
1
2
8
18
32
18
3
14
5d
10
6s
2
6p
2
1s
2
2s
2
2p
6
3s
2
3p
6
3d
10
4s
2
4p
6
4d
10
4f
14
5s
2
5p
6
5d
10
6s
2
6p
2
2
8
18
32
18
4
14
5d
10
6s
2
6p
3
1s
2
2s
2
2p
6
3s
2
3p
6
3d
10
4s
2
4p
6
4d
10
4f
14
5s
2
5p
6
5d
10
6s
2
6p
3
2
8
18
32
18
5

14
5d
10
6s
2
6p
4
1s
2
2s
2
2p
6
3s
2
3p
6
3d
10
4s
2
4p
6
4d
10
4f
14
5s
2
5p
6
5d
10
6s
2
6p
4
2
8
18
32
18
6
85 At
14
5d
10
6s
2
6p
5
1s
2
2s
2
2p
6
3s
2
3p
6
3d
10
4s
2
4p
6
4d
10
4f
14
5s
2
5p
6
5d
10
6s
2
6p
5
2
8
18
32
18
7
14
5d
10
6s
2
6p
6
1s
2
2s
2
2p
6
3s
2
3p
6
3d
10
4s
2
4p
6
4d
10
4f
14
5s
2
5p
6
5d
10
6s
2
6p
6
2
8
18
32
18
8
1
1s
2
2s
2
2p
6
3s
2
3p
6
3d
10
4s
2
4p
6
4d
10
4f
14
5s
2
5p
6
5d
10
6s
2
6p
6
7s
1
2
8
18
32
18
8
1
88 Ra
2
1s
2
2s
2
2p
6
3s
2
3p
6
3d
10
4s
2
4p
6
4d
10
4f
14
5s
2
5p
6
5d
10
6s
2
6p
6
7s
2
2
8
18
32
18
8
2
1
7s
2
1s
2
2s
2
2p
6
3s
2
3p
6
3d
10
4s
2
4p
6
4d
10
4f
14
5s
2
5p
6
5d
10
6s
2
6p
6
6d
1
7s
2
2
8
18
32
18
9
2
2
7s
2
1s
2
2s
2
2p
6
3s
2
3p
6
3d
10
4s
2
4p
6
4d
10
4f
14
5s
2
5p
6
5d
10
6s
2
6p
6
6d
2
7s
2
2
8
18
32
18
10
2
91 Pa
2
6d
1
7s
2
1s
2
2s
2
2p
6
3s
2
3p
6
3d
10
4s
2
4p
6
4d
10
4f
14
5s
2
5p
6
5d
10
5f
2
6s
2
6p
6
6d
1
7s
2
2
8
18
32
20
9
2
3
6d
1
7s
2
1s
2
2s
2
2p
6
3s
2
3p
6
3d
10
4s
2
4p
6
4d
10
4f
14
5s
2
5p
6
5d
10
5f
3
6s
2
6p
6
6d
1
7s
2
2
8
18
32
21
9
2
4
6d
1
7s
2
1s
2
2s
2
2p
6
3s
2
3p
6
3d
10
4s
2
4p
6
4d
10
4f
14
5s
2
5p
6
5d
10
5f
4
6s
2
6p
6
6d
1
7s
2
2
8
18
32
22
9
2
6
7s
2
1s
2
2s
2
2p
6
3s
2
3p
6
3d
10
4s
2
4p
6
4d
10
4f
14
5s
2
5p
6
5d
10
5f
6
6s
2
6p
6
7s
2
2
8
18
32
24
8
2
7
7s
2
1s
2
2s
2
2p
6
3s
2
3p
6
3d
10
4s
2
4p
6
4d
10
4f
14
5s
2
5p
6
5d
10
5f
7
6s
2
6p
6
7s
2
2
8
18
32
25
8
2
7
6d
1
7s
2
1s
2
2s
2
2p
6
3s
2
3p
6
3d
10
4s
2
4p
6
4d
10
4f
14
5s
2
5p
6
5d
10
5f
7
6s
2
6p
6
6d
1
7s
2
2
8
18
32
25
9
2
9
7s
2

1s
2
2s
2
2p
6
3s
2
3p
6
3d
10
4s
2
4p
6
4d
10
4f
14
5s
2
5p
6
5d
10
5f
9
6s
2
6p
6
7s
2
2
8
18
32
27
8
2
98 Cf
10
7s
2
1s
2
2s
2
2p
6
3s
2
3p
6
3d
10
4s
2
4p
6
4d
10
4f
14
5s
2
5p
6
5d
10
5f
10
6s
2
6p
6
7s
2
2
8
18
32
28
8
2
11
7s
2
1s
2
2s
2
2p
6
3s
2
3p
6
3d
10
4s
2
4p
6
4d
10
4f
14
5s
2
5p
6
5d
10
5f
11
6s
2
6p
6
7s
2
2
8
18
32
29
8
2
12
7s
2
1s
2
2s
2
2p
6
3s
2
3p
6
3d
10
4s
2
4p
6
4d
10
4f
14
5s
2
5p
6
5d
10
5f
12
6s
2
6p
6
7s
2
2
8
18
32
30
8
2
13
7s
2
1s
2
2s
2
2p
6
3s
2
3p
6
3d
10
4s
2
4p
6
4d
10
4f
14
5s
2
5p
6
5d
10
5f
13
6s
2
6p
6
7s
2
2
8
18
32
31
8
2
102 No
14
7s
2
1s
2
2s
2
2p
6
3s
2
3p
6
3d
10
4s
2
4p
6
4d
10
4f
14
5s
2
5p
6
5d
10
5f
14
6s
2
6p
6
7s
2
2
8
18
32
32
8
2
14
7s
2
7p
1
1s
2
2s
2
2p
6
3s
2
3p
6
3d
10
4s
2
4p
6
4d
10
4f
14
5s
2
5p
6
5d
10
5f
14
6s
2
6p
6
7s
2
7p
1
2
8
18
32
32
8
3
104 Rf
14
6d
2
7s
2
1s
2
2s
2
2p
6
3s
2
3p
6
3d
10
4s
2
4p
6
4d
10
4f
14
5s
2
5p
6
5d
10
5f
14
6s
2
6p
6
6d
2
7s
2
2
8
18
32
32
10
2
Document Outline
Wyszukiwarka
Podobne podstrony:
giełda chemia 2009, Edukacyjnie, C, Chemia, Chemia ogólna i nieorganiczna, Różne takie - koła, egzam
kol wykl II zad, Edukacyjnie, C, Chemia, Chemia ogólna i nieorganiczna, Różne takie - koła, egzaminy
sole na zapleczu, ~FARMACJA, I rok, CHEMIA OGÓLNA I NIEORGANICZNA, egzamin sole
Chemia - zagadnienia na egzamin, Science ^^, Farmacja, 1 rok, Chemia, Ogólna i nieorgan, egzamin
pyt egz nieorganiczna, Science ^^, Farmacja, 1 rok, Chemia, Ogólna i nieorgan, egzamin, pytania na e
Zakres materiału obowiązujący na II kolokwium wykładowe, Chemia ogólna i nieorganiczna, giełdy
28, ~FARMACJA, I rok, CHEMIA OGÓLNA I NIEORGANICZNA, Egzamin chemia
praktyczny z soli, ~FARMACJA, I rok, CHEMIA OGÓLNA I NIEORGANICZNA, egzamin sole
2011 info dla studentow sesja letnia OŚ, Studia PŁ, Ochrona Środowiska, Chemia, ogólna i nieorganicz
Egzamin 2009, Chemia ogólna i nieorganiczna, giełdy
Zestaw XV, ~FARMACJA, I rok, CHEMIA OGÓLNA I NIEORGANICZNA, Egzamin chemia
Zadanie liczone, Science ^^, Farmacja, 1 rok, Chemia, Ogólna i nieorgan, egzamin, chemia nieorganicz
25, ~FARMACJA, I rok, CHEMIA OGÓLNA I NIEORGANICZNA, Egzamin chemia
sole pojedyncze, ~FARMACJA, I rok, CHEMIA OGÓLNA I NIEORGANICZNA, egzamin sole
koło z chemii, Płyta farmacja Bydgoszcz, chemia ogólna i nieorganiczna- II sem, egzaminy, koła
więcej podobnych podstron