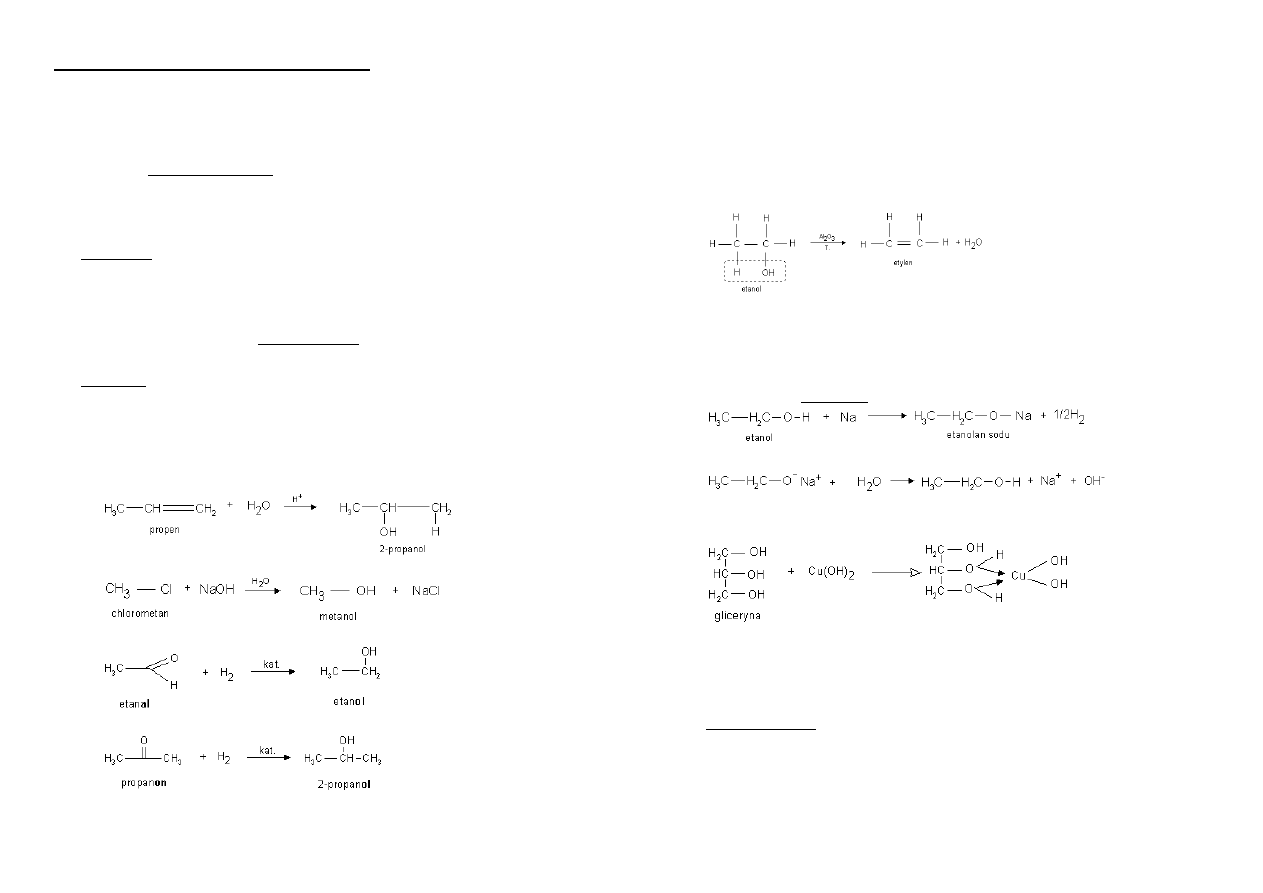
JEDNOFUNKCYJNE POCHODNE WĘGLOWODORÓW
1. ALKOHOLE
Alkohole – pochodne węglowodorów zawierające grupę –OH (grupę hydroksylową)
przy tetraedrycznym atomie węgla.
Alkohole zawierające w cząsteczce 1-10 at. C są cieczami, >10 at. C – ciała stałe.
Tworzenie wiązao wodorowych pomiędzy cząsteczkami alkoholu powoduje, że mają
one wysoką temperaturę wrzenia, a alkohole zawierające do 4 atomów C doskonale
rozpuszczają się w wodzie.
Lotne, bezbarwne, o charakterystycznym ostrym zapachu.
Rzędowośd alkoholi określana jest rzędowością atomu C, do którego przyłączona jest
grupa –OH.
Podział alkoholi na: monohydroksylowe (jednowodorotlenowe) i polihydroksylowe
(wielowodorotlenowe).
Wodny roztwór alkoholu ma odczyn obojętny.
Alkohole nie ulegają dysocjacji.
Kontrakcja – podczas mieszania etanolu z wodą dochodzi do zmniejszenia objętości
powstałej mieszaniny w stosunku do objętości wyjściowej; przyczyną jest tworzenie
się wiązao wodorowych między cząsteczkami etanolu i wody.
Otrzymywanie alkoholi:
Hydratacja alkenu - reakcja alkenu z wodą w obecności kationów H jako
katalizatorów:
Reakcja chlorowcopochodnej z wodnym roztworem KOH lub NaOH:
Redukcja aldehydu do alkoholu I-rzędowego:
Redukcja ketonu do alkoholu II-rzędowego:
Metody specyficzne:
CO + 2H
2
→ CH
3
OH - otrzymywanie metanolu
C
6
H
12
O
6
2C
2
H
5
OH +2CO
2
- otrzymywanie etanolu
CH
2
=CH
2
CH
2
OH-CH
2
OH – otrzymywanie glikolu etylenowego
Reaktywnośd alkoholi:
Ulegają spalaniu:
4 CH
3
-CH
2
-CH
2
-OH + 11 O
2
→ 12 CO
2
+ 2 H
2
O
Reakcja dehydratacji – eliminacja cząsteczki wody z cząsteczki alkoholu,
produktem jest alken:
Odwadnianie w niskich temperaturach może prowadzid do otrzymywania nie
alkenu, ale eteru, np. eteru dietylowego:
2 CH
3
-CH
2
OH
CH
3
-CH
2
-O-CH
2
-CH
3
+ H
2
O
Reakcja alkoholi jedno- i wielowodorotlenowych z metalami aktywnymi –
powstają sole - alkoholany:
Alkoholany ulegają hydrolizie – wodny roztwór ma odczyn zasadowy.
Reakcja alkoholi wielowodorotlenowych z wodorotlenkami nierozpuszczalnymi w
wodzie (NIGDY z KOH czy NaOH):
Reakcja z chlorowcowodorami – następuje podstawienie grupy –OH atomem
chlorowca: (podstawienie następuje najłatwiej w alkoholach III-rzędowych)
CH
3
-CH
2
OH + HBr → CH
3
-CH
2
Br + H
2
O
Ważniejsze alkohole:
Alkohol metylowy – metanol: CH
3
OH [alkohol drzewny]
o Ciecz o charakterystycznym zapachu, lotna, o gęstości mniejszej od wody.
o Spala się na powietrzu jasnoniebieskim płomieniem.
o Dawniej otrzymywany wyłącznie w wyniku suchej destylacji drewna.
o Na skalę przemysłową otrzymywany z gazu syntezowego.
o Stosowany do produkcji farb i formaliny.

o Jest substancją silnie trującą!
Alkohol etylowy CH
3
CH
2
OH
o Bezbarwna ciecz, bardziej lotna od wody.
o Pali się jasnym niekopcącym płomieniem z wydzieleniem dużej ilości
ciepła – stosowany jako paliwo.
o Miesza się z wodą *w każdej proporcji; patrz: kontrakcja+ oraz z wieloma
innymi rozpuszczalnikami polarnymi *związek z budową cząsteczki+
o Na skalę przemysłową otrzymywany w wyniku fermentacji.
o Mieszanina azeotropowa – ciekła mieszanina 2 lub więcej substancji,
których nie można rozdzielid poprzez destylacji, gdyż wszystkie składniki
odparowują w tej samej temperaturze. Mieszanina zawierająca 95%
etanolu i 5% wody jest przykładem azeotropu, wrze w temp. 78,15:C.
o Stosowany jako bardzo dobry rozpuszczalnik, m.in. w perfumiarstwie czy
produkcji lakierów.
o Spożywany jako środek odurzający – nie jest trujący tak jak metanol, ale
także bardzo szkodliwy.
Glikol etylenowy – CH
2
OH-CH
2
OH
o Ciecz bezbarwna, dobrze rozpuszczalna w wodzie, o gęstości większej niż
gęstośd wody *związek z budową cząsteczki+.
o Temp. krzepnięcia wynosi -12:C – stosowany jako niezamarzający płyn do
chłodnic samochodowych.
o Substancja silnie trująca!
o Otrzymywany w wyniku katalitycznego utlenienia etenu.
Glicerol – CH
2
OH-CHOH-CH
2
OH
o Składnik każdego tłuszczu.
o Bezbarwna, oleista ciecz, o dużej gęstości i słodkim smaku.
o Miesza się z wodą w każdej proporcji.
o Identyfikacja glicerolu – jego reakcja z wodorotlenkiem miedzi (II).
o Zdolnośd do reagowania z kwasem azotowym (V):
Produktem głównym jest nitrogliceryna – ester glicerolu i kwasu
azotowego(V), wrażliwy na wstrząsy. Rozkłada się ona wybuchowo:
4 C
3
H
5
(ONO
2
)
3
→ 6 N
2
+ 12 CO
2
+ 10 H
2
O + O
2
o Wykorzystywany do wyrobu mydeł toaletowych i kosmetyków, jako
substancja słodząca (np. w syropach).
o Nie jest trujący.
2. FENOLE
Zbudowane z pierścienia aromatycznego, do którego jest bezpośrednio przyłączona
grupa –OH.
Najprostszy związek to po prostu fenol ,który jest bezbarwnym ciałem stałym,
rozpuszczalnym w wodzie.
Są słabymi kwasami – fenole dysocjują, wodny roztwór ma odczyn kwasowy.
Mogą byd związkami jedno- i wielowodorotlenowymi, a także mogą byd pochodnymi
węglowodorów wielopierścieniowych.
Otrzymywanie fenoli:
Na skalę przemysłową otrzymywane ze smoły pogazowej lub z chlorobenzenu.
Reakcja chlorowcobenzenu z wodnym roztworem mocnej zasady:
Powstaje fenolan. Fenolany ulegają hydrolizie – w ten sposób otrzymamy fenol,
odczyn otrzymanego roztworu jest zasadowy.
W celu otrzymania fenolu można również użyd do reakcji z powstałym fenolanem
mocniejszego kwasu, który wyprze kwas słabszy z jego soli:
Reaktywnośd fenoli:
Reakcje z metalami aktywnymi:
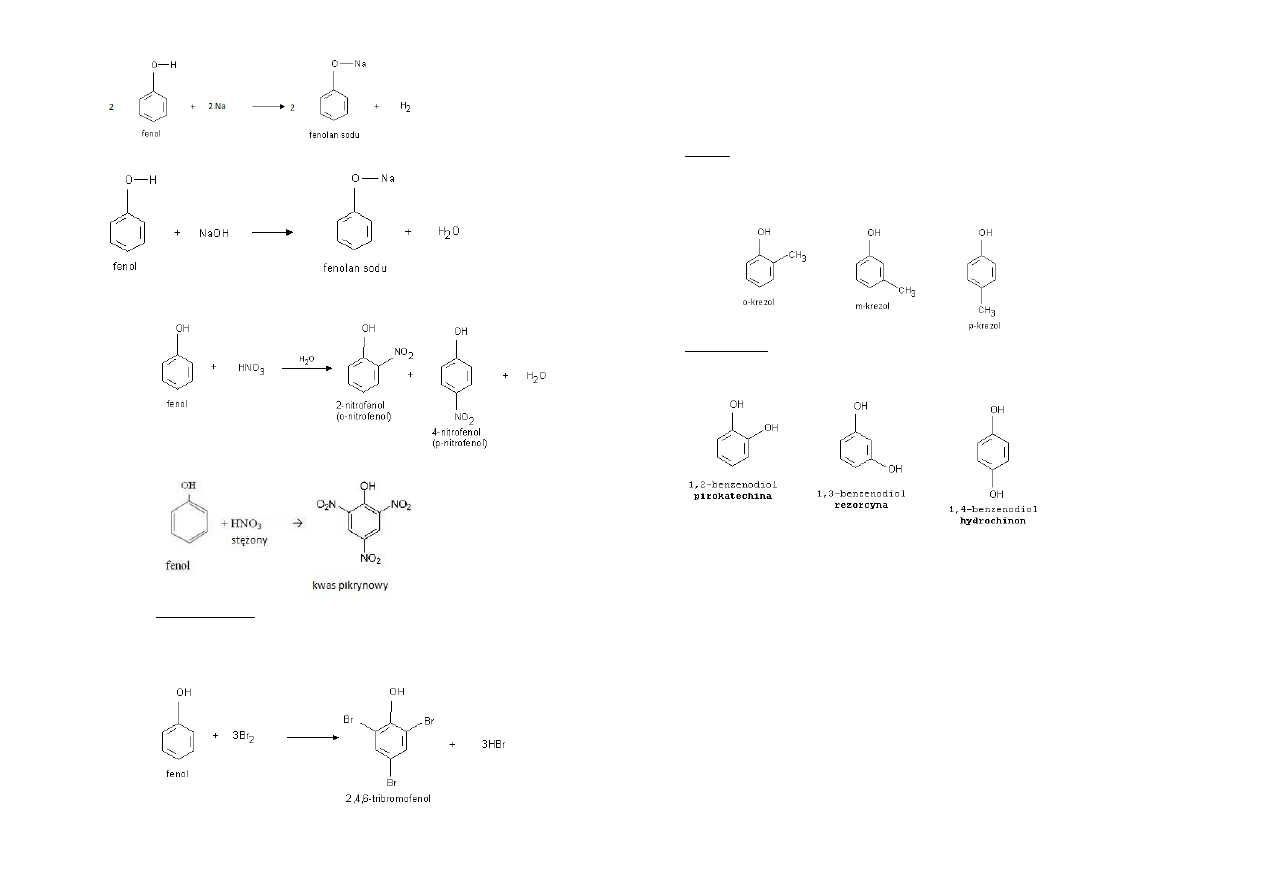
Reakcje z mocnymi zasadami:
Reakcje substytucji elektrofilowej:
o Nitrowanie przy użyciu rozcieoczonego HNO
3
o Nitrowanie przy użyciu stężonego HNO
3
Kwas pikrynowy – dawniej wykorzystywany do produkcji materiałów
wybuchowych; obecnie służyd może do barwienia wełny i jedwabiu na
żółty kolor.
o Bromowanie
Reakcja charakterystyczna – reakcja z solami żelaza (III), w wyniku której powstają
fenolany żelaza (III), mające charakter związków koordynacyjnych.
Nie ulegają reakcji eliminacji wody i oderwania grupy –OH od pierścienia *silne
wiązanie węgiel-tlen].
Krezole – homologi fenolu o strukturze:
Bezbarwne ciała stałe, rozpuszczalne w wodzie.
Wykorzystywane jako substraty w syntezach organicznych.
Są składnikami środków dezynfekcyjnych do pomieszczeo sanitarnych.
Benzenodiole – fenol, którego cząsteczka zawiera dwie grupy –OH. Występuje w
postaci trzech izomerów.
Stosowane do produkcji barwników i leków.
Fenole mają właściwości toksyczne – wchodzą w skład środków ochrony roślin i
substancji bakteriobójczych (np. lizolu). Wykorzystywane są również do otrzymywania
żywic fenolowych i barwników.
3. ALDEHYDY
Aldehydy to pochodne węglowodorów zawierające w cząsteczce grupę karbonylową
-CHO, położoną na koocu cząsteczki.
Najprostszy aldehyd to metanal – aldehyd mrówkowy o wzorze: HCHO (wyjątek!).
Aldehyd może byd zbudowany z połączenia grupy karbonylowej i łaocucha
alifatycznego lub pierścienia aromatycznego.
Rozpuszczalnośd w wodzie i lotnośd aldehydów maleje wraz ze wzrostem wielkości
cząsteczki.
Mają dośd intensywny zapach – często stosowane są w przemyśle perfumeryjnym.
Otrzymywanie aldehydów:
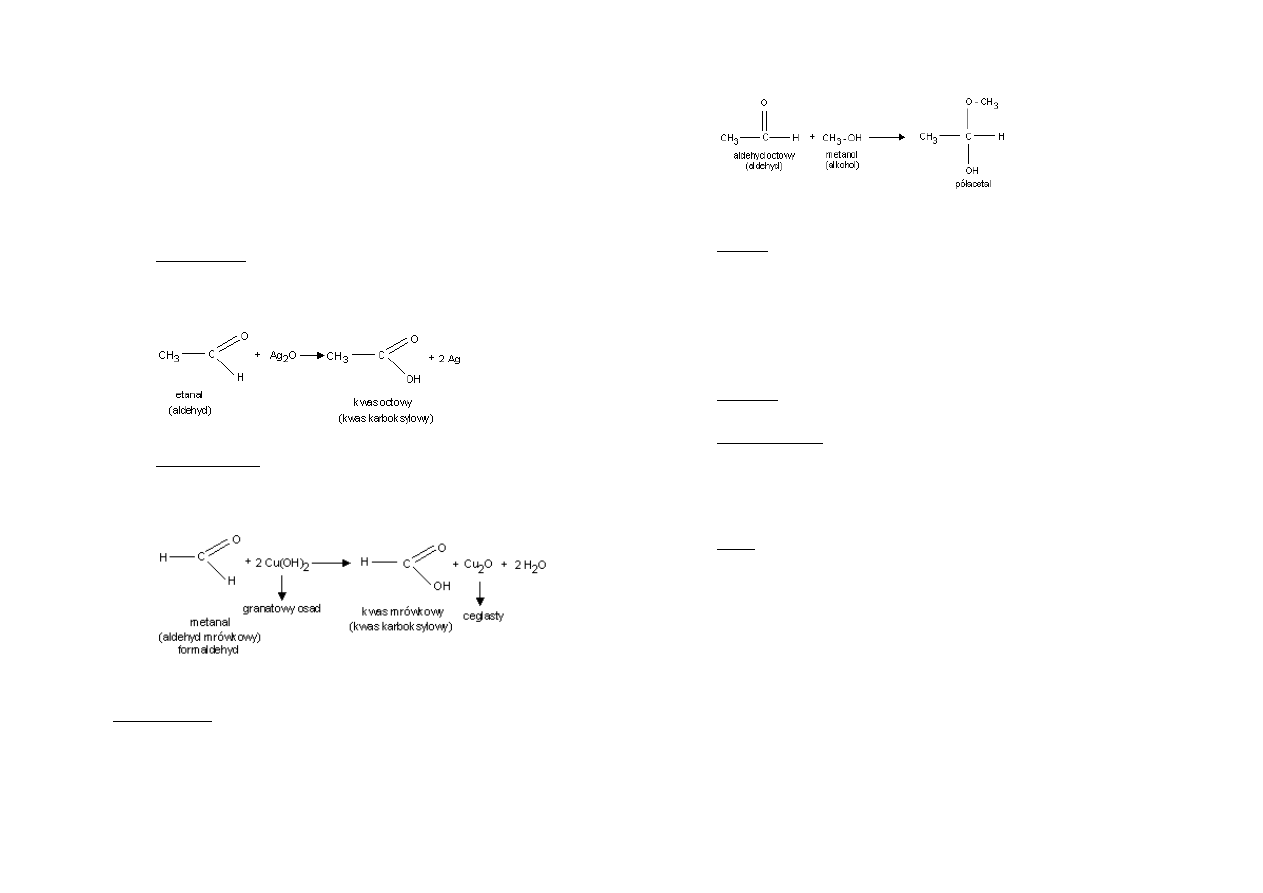
Utlenianie alkoholi I-rzędowych: (przykładowym utleniaczem jest tu CuO):
CH
3
-CH
2
-OH
CH
3
-CHO + CuO + H
2
O
Łagodne utlenianie metanolu prowadzi do otrzymania metanalu:
CH
3
-OH
H-CHO + Cu + H
2
O
Reaktywnośd aldehydów:
Redukcja do alkoholi I-rzędowych:
CH
3
-CH
2
-CH
2
-CHO
CH
3
-CH
2
-CH
2
-CH
2
-OH
Utlenianie do kwasów karboksylowych:
o Próba Tollensa:
Zapis rzeczywisty: CH
3
CHO + 2 Ag(NH
3
)
2
OH CH
3
COONH
4
+ 2 Ag + 3
NH
3
+ H
2
O
Zapis uproszczony: CH
3
CHO + Ag
2
O → CH
3
COOH + 2 Ag
Obserwacja: na ściankach probówki osadza się metaliczne srebro.
o Próba Trommera:
Zapis rzeczywisty: NaOH + CH
3
CHO + 2 Cu(OH)
2
→ CH
3
COONa + Cu
2
O + 3
H
2
O
Zapis uproszczony: CH
3
CHO + 2 CuO → CH
3
COOH + Cu
2
O
Obserwacja: niebieski osad wodorotlenku miedzi (II) przekształca się w
czerwony osad tlenku miedzi (I)
Polikondensacja:
[zapis reakcji]
Addycja alkoholi do wiązania C=O w aldehydach: powstają hemiacetale lub
acetale ( w wypadku nadmiaru alkoholu)
Ważniejsze aldehydy:
Metanal – aldehyd mrówkowy, formaldehyd, HCHO
o Bezbarwny gaz o bardzo nieprzyjemnym zapachu.
o Dobrze rozpuszczalny w wodzie.
o Silna trucizna.
o Roztwór ma słabo kwasowe pH
o Zastosowanie: produkcja tworzyw sztucznych: żywic fenolowo-
formaldehydowych (stosowanych do wyrobu klejów i lakierów)
Formalina – wodny roztwór metanalu o stężeniu ok. 30% (37-40%); silnie
bakteriobójcza, przechowuje się w niej preparaty biologiczne.
Paraformaldehyd – to spolimeryzowany formaldehyd (formaldehyd
przechowywany przez dłuższy czas, samorzutnie polimeryzuje, tworząc
łaocuchy o strukturze (-CH
2
-O-CH
2
-O-)
n
w warunkach pokojowych to ciało stałe,
słabo rozpuszczalne w wodzie; w butelkach z długo przechowywaną formaliną
widoczny w postaci białego osadu.
Etanal – aldehyd octowy CH
3
CHO
o Lotna, bezbarwna ciecz, wrząca w temp. 21:C
o Stosowany w przemyśle jako substancja wyjściowa wielu syntez, np.
syntezy kwasu octowego.
4. KETONY
Ketony – to pochodne węglowodorów zawierające w cząsteczce grupę –CO- położoną
wewnątrz tej cząsteczki.
Najprostszym ketonem jest propanon – aceton, CH
3
-CO-CH
3
Grupa karbonylowa w ketonach może byd połączona z łaocuchem alifatycznym,
pierścieniem aromatycznym, podstawniki mogą byd również identyczne.
Rozpuszczalnośd maleje wraz ze wzrostem wielkości cząsteczki.
Temperatura wrzenia wzrasta wraz ze wzrostem wielkości cząsteczki.
Otrzymywanie ketonów:
Utlenianie alkoholi II-rzędowych: (przykładowym utleniaczem jest tu CuO):
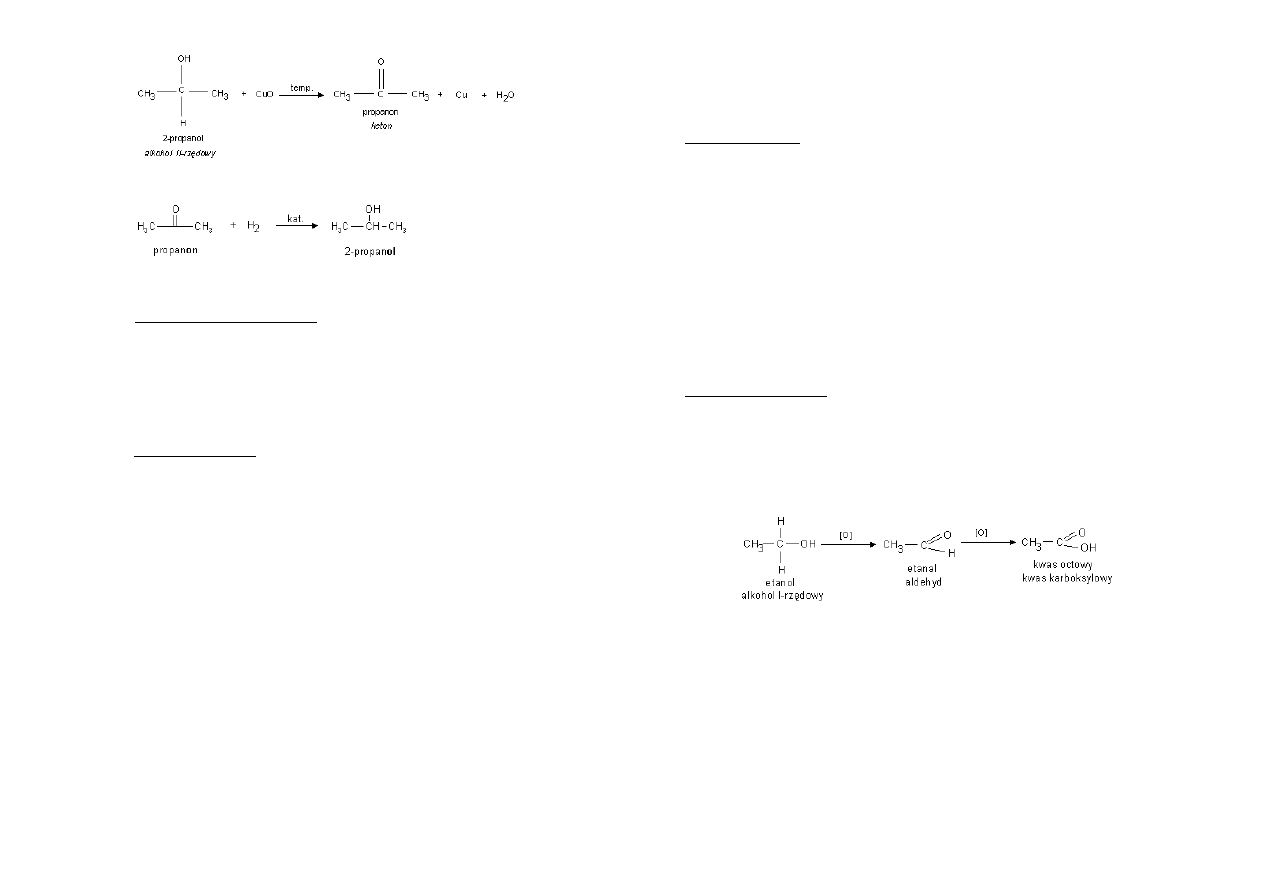
Reaktywnośd ketonów:
Redukcja do alkoholi II-rzędowych
Nie ulegają utlenianiu pod wpływem słabych utleniaczy, czyli nie ulegają
próbom Tollensa i Trommera.
Utlenianie silnym utlenianiem:
CH
3
-CO-CH
2
-CH
3
CH
3
-CO-OH + CH
3
-CH
2
-CO-OH
W reakcji tej dochodzi do zerwania łaocucha przy grupie karbonylowej –
powstaje mieszanina kwasów karboksylowych w cząsteczkach których łączna
liczba atomów jest równa liczbie atomów utlenianego ketonu.
Próba jodoformowa:
R-CO-CH
3
+ 3 I
2
+ 4 NaOH → CHI
3
↓ + RCOONa + 3 NaI + 3 H
2
O
Reakcja ta pozwala na wykrycie ugrupowania CH
3
-CO- w cząsteczce ketonu,
czyli jest charakterystyczna dla metyloketonów. Keton ogrzewany z
zasadowym roztworem jodu, tworzy sól odpowiedniego kwasu i między
innymi jodoform zgodnie z równaniem powyżej.
Przy oziębianiu mieszaniny dochodzi do krystalizacji żółtego osadu o
charakterystycznym zapachu.
Ważniejsze ketony:
Propanon – aceton, CH
3
-CO-CH
3
o Lotna, łatwopalna, bezbarwna ciecz o charakterystycznym zapachu.
o Dobrze rozpuszczalna w wodzie i rozpuszczalnikach organicznych.
o Temperatura wrzenia wynosi 56,2:C.
o W organizmie człowieka powstaje jako pośredni produkt
metabolizmu tłuszczów; występowanie acetonu we krwi może
świadczyd o cukrzycy.
o Aceton otrzymuje się w przemyśle przez hydratację propylenu i
utlenienie izopropanolu (który jest produktem pośrednim) lub przez
syntezę z acetylenu i pary wodnej. Inna metoda polega na
utlenieniu izopropylobenzenu do acetonu i fenolu.
o Aceton stosowany jest m.in. jako rozpuszczalnik oraz surowiec w
syntezach organicznych
Izomeria funkcyjna - izomerami są związki posiadające różne grupy funkcyjne, np.:
etanol i eter dimetylowy, pentanal i pentanon.
5. KWASY KARBOKSYLOWE
Kwasy karboksylowe – to pochodne węglowodorów zawierające w cząsteczce grupę
karboksylową –COOH.
Grupa karboksylowa może łączyd się z podstawnikiem alifatycznym lub
aromatycznym.
Są cieczami lub ciałami stałymi.
W roztworach wodnych ulegają dysocjacji; są słabymi kwasami.
Mają małą lotnośd i wysokie temperatury wrzenia ze względu na tworzenie się silnych
wiązao wodorowych.
Dimeryzacja cząsteczek – łączenie się dwóch cząsteczek w jeden większy układ;
spowodowane symetrycznym rozłożeniem ładunków dodatnich i ujemnych w grupie
karbonylowej.
Otrzymywanie kwasów karboksylowych:
Utlenianie aldehydów:
CH
3
-CH
2
-CHO
CH
3
-CH
2
-COOH
Utlenianie alkoholi:
CH
3
-CH
2
-CH
2
-OH
CH
3
-CH
2
-COOH
o Utlenianie etanolu przy użyciu dichromianu (VI) potasu
3 CH
3
CH
2
OH + 2 K
2
Cr
2
O
7
+ 8 H
2
SO
4
→ 3 CH
3
COOH + 2 Cr
2
(SO
4
)
3
+
+ 2 K
2
SO
4
+ 11 H
2
O
Obserwacja: zawartośd probówki zmienia barwę z pomaraoczowej
*charakterystyczna dla dichromianu(VI) potasu+ na barwę
zielononiebieską *charakterystyczna dla siarczanu(VI) chromu+.
Reakcja ta, ze względu na zmianę barwy, jest wykorzystywana w
podręcznych alkomatach.
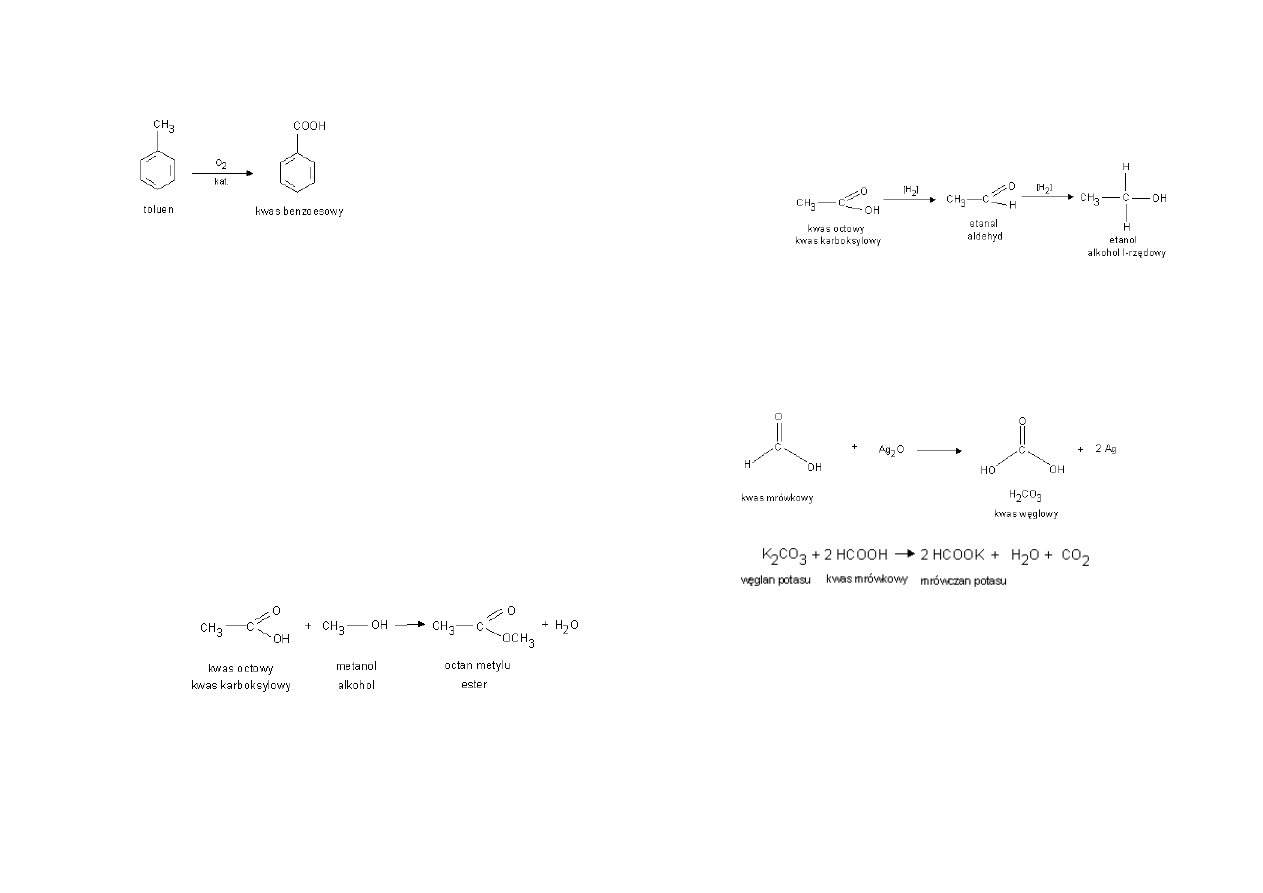
Utlenianie związków aromatycznych prowadzi do powstania kwasów
karboksylowych zbudowanych z grupy karboksylowej i pierścienia
aromatycznego:
Reaktywnośd kwasów karboksylowych:
Reakcje, w których pęka wiązanie RCOO – H. Reakcja zachodzi z metalami –
wyłącznie o potencjałach ujemnych, tlenkami metali, wodorotlenkami, w
wyniku czego powstają sole.
HCOOH + NaOH → HCOONa + H
2
O
(mrówczan sodu, metanian sodu)
2CH
3
COOH +CuO → Cu(CH
3
COO)
2
+ H
2
O
(octan miedzi (II), etanian miedzi (II))
2CH
3
COOH + Mg → (CH
3
COO)
2
Mg + H
2
(octan magnezu, etanian magnezu)
Sole sodowe, amonowe lub potasowe wyższych kwasów tłuszczowych
(głównie kwas stearynowy, palmitynowy) to mydła. Powstają w reakcji
zmydlania.
Reakcje, w których pęka wiązanie RCO – OH.
o Estryfikacja
o Tworzenia amidu kwasowego:
Ogólnie: kwas + amoniak = amid 1: + woda
HCOOH + NH
3
→ HCONH
2
+ H
2
O
Ogólnie: kwas + amina 1: = amid 2: + woda
HCOOH + NH
2
CH
3
→ HCONHCH
3
+ H
2
O
Ogólnie: kwas + amina 2: = amid 3: + woda
HCOOH + NH(CH
3
)
2
→ HCONH(CH
3
)
2
+ H
2
O
Reakcje, w których bierze udział cała grupa karboksylowa.
o Redukcja wodorem poprzez aldehyd do alkoholu.
o Hydroliza rozpuszczalnych soli kwasów karboksylowych
Środowisko kwasowe:
[zapis reakcji]
Środowisko zasadowe:
[zapis reakcji]
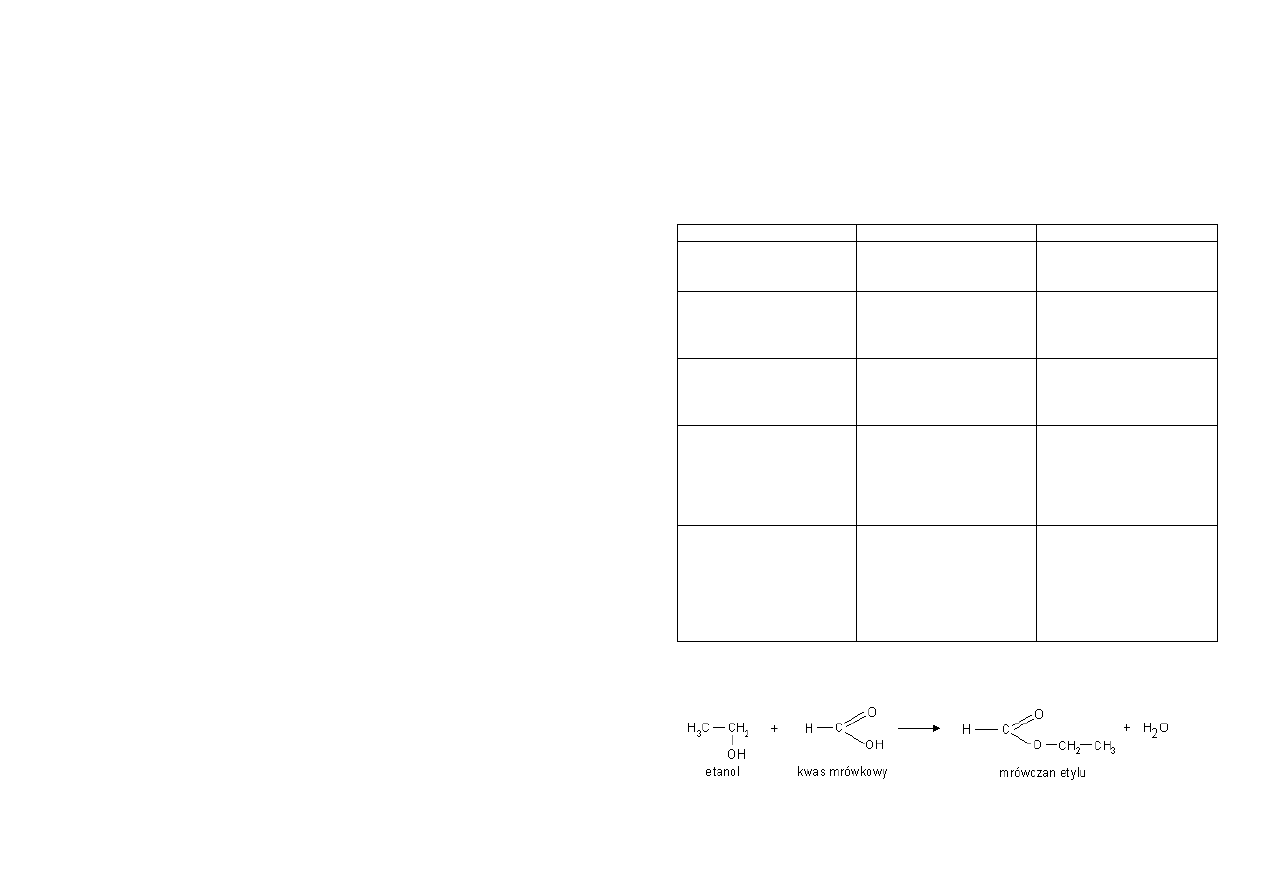
Kwas mrówkowy ulega próbie Trommera i Tollensa:
Uproszczony zapis próby Tollensa
Reakcja kwasu octowego z solą kwasu węglowego
Kwas octowy jest mocniejszy od kwasu węglowego, dlatego wypiera go z
jego soli.
Ważniejsze kwasy monokarboksylowe
Kwas metanowy (mrówkowy) HCOOH
o Posiada łatwe do rozerwania wiązanie węgiel – wodór, dlatego
cząsteczkę tego kwasu łatwo utlenid do CO
2
:
HCOOH
CO
2
+ H
2
O ;
A silne środki odwadniające powoduję rozpad cząsteczki na wodę i
CO.
o W przyrodzie występuje np.: w organizmach mrówek lub we
włoskach parzących pokrzyw.
o Bezbarwna ciecz, o temp. Krzepnięcia 8,4:C, temp. Wrzenia = nieco
powyżej 100:, o ostrym zapachu i bardzo dobrej rozpuszczalności w
wodzie.
Kwas etanowy (octowy) CH
3
COOH
o Ciecz bezbarwna, krzepnąca w 16,6:C i wrząca w 118:C
o Bardzo dobrze rozpuszczalny w wodzie, z wydzieleniem ciepła.
Towarzyszy temu zjawisko kontrakcji.
o Tworzy liczne sole i jest odporny na utlenianie.
o Wykorzystywany w przemyśle i gospodarstwie domowym.
Kwas butanowy (masłowy) CH
3
CH
2
CH
2
COOH
o Ciecz o nieprzyjemnym zapachu, dobrze rozpuszczalna w wodzie.
o W stanie wolnym występuje w pocie; w maśle – w postaci połączeo
z glicerolem.
Kwas heksadekanowy (palmitynowy) C
15
H
31
COOH i kwas oktadekanowy
(stearynowy) C
17
H
3H
COOH
o Bezbarwne ciała stałe o niskich temperaturach topnienia.
o Nierozpuszczalne w wodzie.
o Długo ogrzewane reagują z zasadą sodową, tworząc mydła.
o Wykorzystywane do produkcji mydeł oraz świec.
o Mieszanina obu kwasów to stearyna.
Kwas benzenokarboksylowy (benzoesowy) C
6
H
5
COOH
o Białe ciało stałe, topi się w 121:C.
o Łatwo sublimuje, słabo rozpuszcza się w zimnej wodzie, dośd dobrze
w gorącej.
o Ulega nitrowaniu – powstaje wtedy kwas m-nitrobenzoesowy.
o Sól kwasu benzoesowego – benzoesan sodu – to popularny środek
konserwujący żywności.
Nienasycone kwasy karboksylowe
Główne źródło kwasów długołaocuchowych są tłuszcze (nasycone i
nienasycone kwasy).
Obniżona temperatura topnienia i zwiększona lotnośd spowodowana
obecnością wiązao podwójnych.
Kwas oktadek-9-enowy C
17
H
33
COOH
Izomery cis-trans:
Kwas cis-oktadek-9-enowy to kwas oleinowy;
Kwas trans-oktadek-9-enowy to kwas elaidynowy.
Kwas linolowy C
17
H
31
COOH *2 wiązania podwójne – 9 i 10 at.C oraz 12 i 13
at.C]
Kwas linolenowy C
17
H
29
COOH *3 wiązania podwójne – 9 i 10, 12 i 13 oraz 15 i
16 at. C].
6. ESTRY KWASÓW KARBOKSYLOWYCH
Estry – grupa związków powstających w reakcjach kwasów z alkoholami.
Estry są bardzo rozpowszechnione w przyrodzie.
Porównanie kwasów karboksylowych i estrów:
CECHA PORÓWNAWCZA
KWASY KARBOKSYLOWE
ESTRY
Wiązanie z tlenem
C = O, C – O, O – H jest
wiązaniem kowalencyjnym
spolaryzowanym.
C = O I C – O jest wiązaniem
kowalencyjnym
spolaryzowanym.
Stan skupienia w
temperaturze pokojowej –
temperatury przemian
fazowych.
Ciecze lub ciała stałe.
Temperatury wyższe niż
węglowodorów i alkoholi o
zbliżonych masach.
Ciecze lub ciała stałe.
Odczyn roztworu wodnego
(tylko dla związków o
małych masach –
rozpuszczalnych w wodzie).
Kwasowy
Obojętny
Reaktywność – typ reakcji
Zarówno reakcje
charakterystyczne dla całej
grupy funkcyjnej, jak i reakcje
charakterystyczne dla części
węglowodorowej obecnej w
związku.
Zarówno reakcje
charakterystyczne dla całej
grupy funkcyjnej, jak i reakcje
charakterystyczne dla części
węglowodorowej obecnej w
związku.
Metody odróżniania
Kwasy rozpuszczalne w
wodzie wykazują odczyn
kwasowy – wystarczy
sprawdzid odczyn. Kwasy
nierozpuszczalne w wodzie
można identyfikowad
wykorzystując inne cechy.
Estry wykazują odczyn
obojętny
Otrzymywanie: reakcja estryfikacji – reakcja odpowiednich kwasów z alkoholami, przy
obecności katalizatora – H
2
SO
4
.
Podczas tej reakcji pęka wiązanie C – O w grupie karboksylowej, a nie wiązanie O – H
w tej grupie jak podczas tworzenia soli.
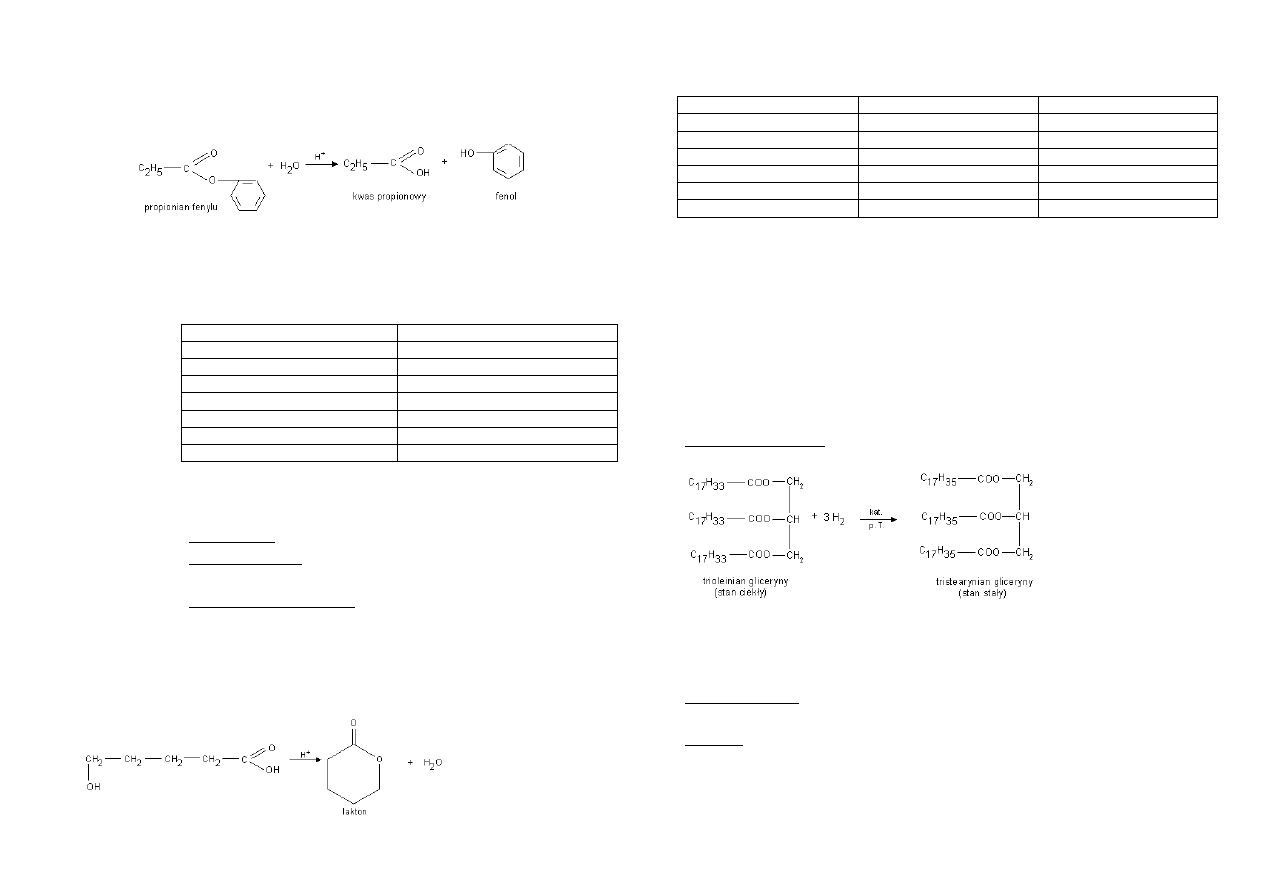
Wpływ budowy cząsteczki na złe rozpuszczanie w wodzie i dobrą lotnośd. *→wiązania
wodorowe]
Reaktywnośd:
Hydroliza w środowisku kwasowym:
Hydroliza w środowisku zasadowym:
[zapis reakcji]
Ze względu na często występujący charakterystyczny zapach, estry wykorzystywane
są w przemyśle perfumeryjnym i spożywczym jako substancje zapachowe.
Wybrane zapachy:
ZAPACH
ESTER
Ananas
Maślan etylu, maślan butylu
Gruszka
Octan etylu
Rum
Mrówczan etylu
Winogrono
Mleczan etylu
Jabłko
Walerian etylu
Kwiatowy
Pentanian metylu
Bananowy
Octan butylu
Istnieją estry kwasów nieorganicznych, np.: azotowego(V), siarkowego(VI),
fosforowego(V). najbardziej znane wśród nich są:
Nitrogliceryna – triazotan(V) gliceryny
Azotan(V) celulozy (bawełna strzelnicza) wykorzystywana do
produkcji prochu bezdymnego i celuloidu.
Estry kwasu siarkowego(VI) i wyższych kwasów są składnikami
detergentów.
Hydroksykwasy – związki posiadające w cząsteczce grupę hydroksylową i
karboksylową. W odpowiednich warunkach łaocuch hydroksykwasu może ulec
wygięciu a wtedy dwie grupy przereagują ze sobą – powstanie wtedy pierścieniowy
ester czyli lakton. Przykładem laktonu jest kumaryna o zapachu świeżego siana.
7. TŁUSZCZE
Tłuszcze (glicerydy) - to estry glicerolu i wyższych kwasów karboksylowych.
NAZWA SYSTEMATYCZNA
NAZWA ZWYCZAJOWA
WZÓR
Heksadekanowy
Palmitynowy
C
15
H
31
COOH
Oktadekanowy
Stearynowy
C
17
H
35
COOH
Oktadek-9-enowy
Oleinowy
C
17
H
33
COOH
Tetradekanowy
Mirystynowy
C
14
H
27
COOH
Oktadeka-9,12-dienowy
Linolowy
C
17
H
31
COOH
Butanowy
Masłowy
C
3
H
7
COOH
Podział tłuszczów:
Ze względu na stan skupienia:
o Stałe: zawierają w swoich cząsteczkach nasycone reszty kwasowe;
np.: masło, smalec, margaryna.
o Ciekłe: zawierają w swoich cząsteczkach nienasycone reszty
kwasowe lub złożone z niewielu atomów; np.: tran, oleje, oliwy.
Ze względu na pochodzenie:
o Zwierzęce: słonina, smalec, tran.
o Roślinne: margaryna, olej, oliwa.
Utwardzanie tłuszczów polega na przemianie oleju (tłuszcz nienasycony) w tłuszcz
stały (nasycony) przez tzw. Uwodornienie (reakcja oleju z wodorem).
Tłuszcze są lżejsze od wody, najczęściej są bezzapachowe.
Rozpuszczalnośd tłuszczów – tłuszcz dobrze rozpuszcza się w benzynie, słabo w
etanolu, nie rozpuszcza się w wodzie.
Nienasycone tłuszcze odbarwiają nadmanganian potasu i wodę bromową.
Próba akroleinowa polega na silnym ogrzaniu tłuszczu, np. oleju roślinnego, w wyniku
czego wydzielają się pary akroleiny, czyli substancji o ostrym, drażniącym zapachu.
Akroleina powstaje w wyniku rozkładu tłuszczu.
Próba akroleinowa służy do odróżnienia tłuszczu od substancji tłustej, np. oleju
silnikowego (olej silnikowy, który jest mieszaniną węglowodorów nie rozkłada się w
wyniku ogrzania i nie wydziela akroleiny).
Hydroliza tłuszczów
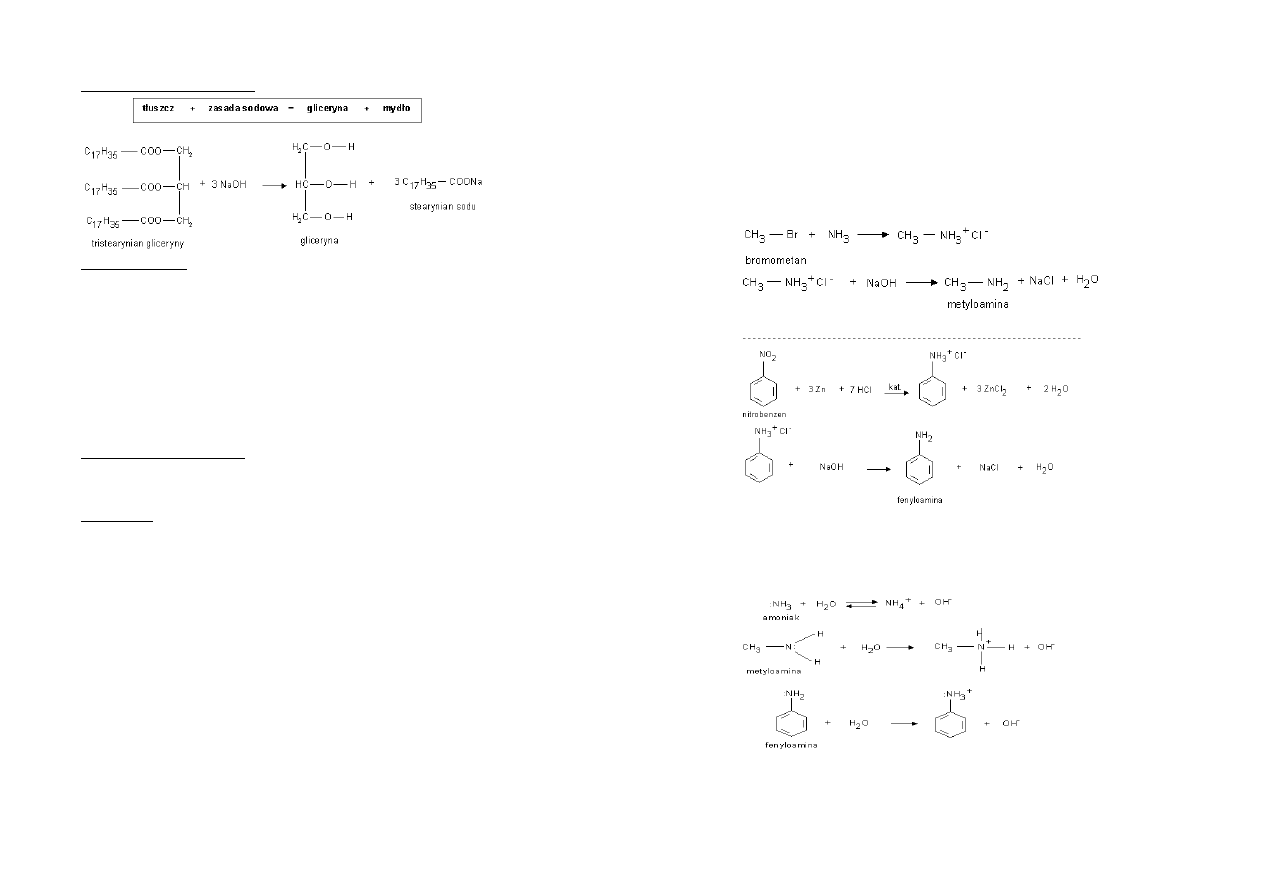
[zapis reakcji]
Reakcja zmydlania tłuszczów: służy do produkcji mydła na skalę przemysłową.
Jełczenie tłuszczu – proces powolnego psucia się tłuszczów w obecności
mikroorganizmów i wilgoci. Tłuszcz świeży jest obojętny, a zjełczały – kwaśny.
8. MYDŁA I DETERGENTY
Mydła to sole sodowe lub potasowe wyższych kwasów tłuszczowych.
Mydła twarde zawierają sole sodowe, a mydła miękkie – potasowe.
Mydła powstają podczas reakcji zmydlania tłuszczów – długiego gotowania tłuszczów
z NaOH lub KOH.
Reakcja mydła z wodą
[zapis reakcji]
Czyszczące działanie mydła: mydło zmniejsza napięcie powierzchniowe i ułatwia
emulgację tłuszczu poprzez wnikanie części hydrofobowych do grudek tłuszczu a
pozostawanie części hydrofilowej na zewnątrz.
Detergenty – posiadają w swej cząsteczce części hydrofilową i hydrofobową.
Cząsteczki detergentów gromadzą się na granicy faz, zmniejszając napięcie
powierzchniowe rozpuszczalnika, tym samym zwiększając zwilżalnośd oczyszczanego
lub barwionego tworzywa. Używane w środkach czyszczących, działają również w
wodzie twardej.
9. AMINY
Aminy to pochodne amoniaku, w którego cząsteczce 1, 2 lub 3 atomy H są
podstawione resztami węglowodorowymi (alkilowymi i/lub aromatycznymi).
Podział wg rzędowości:
pierwszorzędowe – z grupą –NH
2
drugorzędowe – z grupą =NH
trzeciorzędowe – z grupą =N-
Aminy alifatyczne to ciecze o ostrej , rybiej lub amoniakalnej woni.
Gazowe aminy to: metyloamina, dimetyloamina, tri metyloamina i etyloamina.
Dobrze rozpuszczalne w wodzie, źle w rozpuszczalnikach organicznych.
Mają charakter zasadowy.
Aminy aromatyczne to ciecze lub ciała stałe o specyficznym zapachu. Są słabo
rozpuszczalne w wodzie, a ich odczyn jest zasadowy: pamiętaj, że obecnośd
pierścienia aromatycznego zwiększa kwasowośd związku organicznego!
Aminy alifatyczne I-, II- i III-rzędowe oraz aminy aromatyczne I-rzędowe dają z
kwasami sole.
Otrzymywanie amin:
aminy alifatyczne – reakcja chlorowcopochodnych z amoniakiem
aminy aromatyczne – reakcja redukcji nitropochodnych
Cząsteczki amin I- i II-rzędowych ulegają asocjacji (wyższa niż węglowodorów
temperatura wrzenia)
Reaktywnośd:
z wodą:
z kwasem:
[zapis reakcji]
substytucja elektrofilowa:
[zapis reakcji]
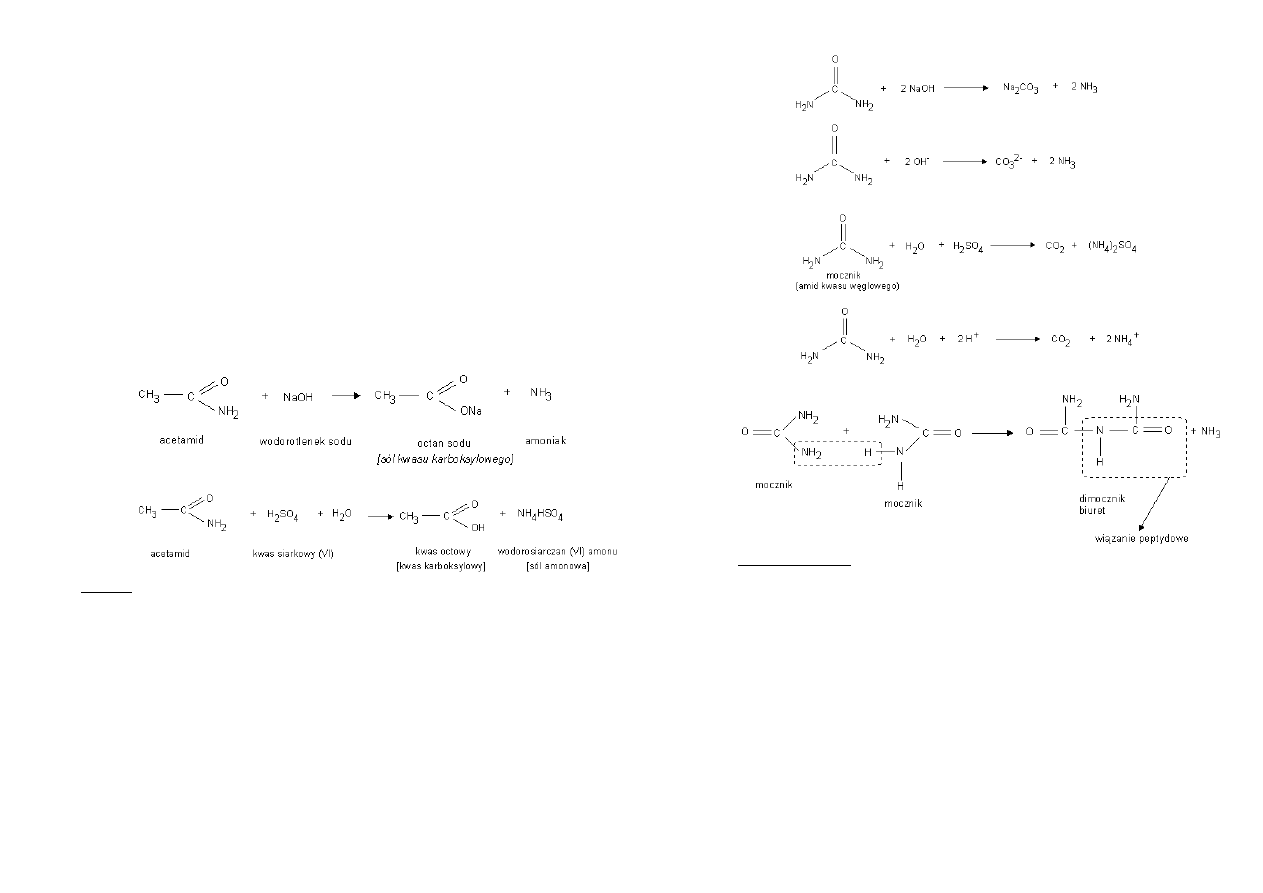
10. AMIDY
Amidy to związki chemiczne będące produktem reakcji grupy karboksylowej COOH
kwasu z amoniakiem, aminą I- lub II-rzędową.
Amidy to zazwyczaj ciała stałe. Jedynie formamid, N-metyloformamid i N,N-
dimetyloformamid to ciecze.
Dobrze rozpuszczalne w wodzie.
Otrzymywanie:
Silne ogrzewanie odpowiednich soli amonowych lub amoniowych kwasów
karboksylowych
[zapis reakcji]
Działaniem amoniaku lub aminy I- lub II-rzędowej na estry – amonoliza
estrów
[zapis reakcji]
Reaktywnośd – hydroliza zasadowa i kwasowa amidów
Hydroliza w środowisku zasadowym
Hydroliza w środowisku kwasowym
Mocznik – diamid kwasu węglowego
Produkt rozkładu białek, główny składnik moczu.
Otrzymywanie syntetyczne:
[zapis reakcji]
Mocznik ulega hydrolizie
o W środowisku zasadowym:
o W środowisku kwasowym:
Mocznik ulega reakcji kondensacji:
Reakcja biuretowa – reakcja stosowana do wykrywania białek; roztwór
siarczanu miedzi(II) i wodorotlenku potasu w obecności białka barwi się na
fioletowo-czerwono, w obecności polipeptydów – na purpurowo-czerwono.
Wyszukiwarka
Podobne podstrony:
HORMONY PRZEMIANY WÄGLOWODANOWEJ
2 Pochodna calkaid 21156 ppt
Rozpuszczalniki organiczne pochodne alifatyczne (oprócz metanolu
potencjal spoczynkowy i jego pochodzenie
Klastry turystyczne, pochodzenie nazwy, co to
Naturalne źródła węglowodorów i ich pochodne
W 5 POCHODNE
3 Pochodne
Kr 029 Zieby Darwina umozliwiaja stestowanie rywalizujacych koncepcji pochodzenia
Pochodne zadania cz 2 id 364419
07 Pochodne WzoryPodstawowe
pochodne i całki
jednofunkcyjne pochodne weglowodorow odpowiedzi
Pochodne II IMiR
więcej podobnych podstron