
1
1.
Podstawowe pojęcia związane z adsorpcją
-
Adsorpcja – zjawisko oraz proces zmiany stężenia (substancje w stanie
ciekłym) lub ciśnienia (w fazie gazowej) pojawiające się na granicy dwóch faz
gazowej i ciekłej, gazowej i stałej lub ciekłej i stałej.
-
Adsorpcja chemiczna (chemisorpcja) – cząsteczki wiążą się wiązaniami
chemicznymi w wyniku reakcji chemicznej zachodzącej na granicy dwóch faz
-
Adsorpcja fizyczna (fizysorpcja) – za związanie cząsteczek odpowiadają siły
van der Waalsa (np. dyspersyjne)
-
Adsorbat – substancja gromadząca się na powierzchni
-
Adsorbent – substancja przyjmująca
-
Centrum adsorpcji – miejsce na powierzchni adsorbentu, w którym może się
zaadsorbować jedna cząsteczka adsorbatu
-
Stopień pokrycia – stosunek ilości zajętych centrów adsorpcji do całkowitej
liczby centrów na powierzchni adsorbentu
2.
Izoterma adsorpcji Langmuira
To podstawowa izoterma adsorpcji wprowadzona w 1916r przez Irwinga Langmuira
(laureata nagrody Nobla w 1932r).
A)
ZAŁOśENIA
Langmuir w swojej teorii adsorpcji założył, że:
1.
powierzchnia ciała stałego posiada określoną liczbę miejsc, zwanych centrami
aktywnymi,
2.
na jednym miejscu aktywnym może zaadsorbować się jedna cząstka adsorbatu
przez pewien określony czas,
3.
wiązanie się cząsteczek adsorbatu z miejscem aktywnym może być fizyczne lub
chemiczne,
4.
zaadsorbowane cząstki tworzą warstwę monomolekularną i nie występuje
między nimi żadne wzajemne oddziaływanie,
zaadsorbowana warstwa jednocząsteczkowa
5.
cząsteczki nie wykazują ruchu translacyjnego (drganie, przemieszczanie się) w
płaszczyźnie powierzchni adsorbatu
6.
energia adsorpcji jest stała i nie zależy od stopnia pokrycia powierzchni
7.
występuje równowaga między cząsteczkami zaadsorbowanymi na powierzchni a
cząsteczkami fazy objętościowej (równowaga ma charakter dynamiczny, tzn. że
w stanie równowagi liczba cząsteczek adsorbujących się w jednostce czasu
równa się liczbie cząsteczek ulegających desorpcji).
Przy takich założeniach równowagę adsorpcyjną możemy przedstawić:
cząsteczka w fazie gazowej
cząsteczka w adsorbencie (kompleks adsorpcyjny)

2
B)
RÓWNANIA
Z założeń 1 i 2 wynika, że na powierzchni może zaadsorbować się skończona liczba
cząsteczek.
W badaniach nad adsorpcją często używa się pojęcia stopień pokrycia
Θ
, który ma
prosty sens geometryczny dla adsorpcji monowarstwowej i jest definiowany jako
stosunek ilości moli zaadsorbowanych na centrach n
a
do ilości moli
odpowiadających obsadzeniu wszystkich centrów aktywnych n
a,max
:
m
max
,
a
a
m
V
V
n
n
a
a
=
=
=
Θ
Przy całkowitym pokryciu wszystkich centrów adsorpcyjnych powierzchni
Θ
= 1 gdyż n
a
= n
a,max
Według modelu adsorpcji Langmuira:
•
Szybkość procesów adsorpcji v
a
jest proporcjonalna do ciśnienia gazu P i
ułamka powierzchni nieobsadzonej (1- Θ):
v
a
= k
a
(1-
Θ
) P
•
Szybkość desorpcji v
d
jest proporcjonalna do ułamka powierzchni pokrytej
adsorbatem Θ:
v
d
= k
d
Θ
Stałe k
a
, k
d
są stałymi szybkości odpowiedniego procesu adsorpcji i desorpcji.
W stanie równowagi (założenie 7) v
a
= v
d
, czyli:
k
a
(1-
Θ
) P= k
d
Θ
Po przekształceniu otrzymujemy równanie izotermy Langmuira:
KP
1
KP
+
=
Θ
gdzie K = k
a
/k
d
określamy jako współczynnik adsorpcji.
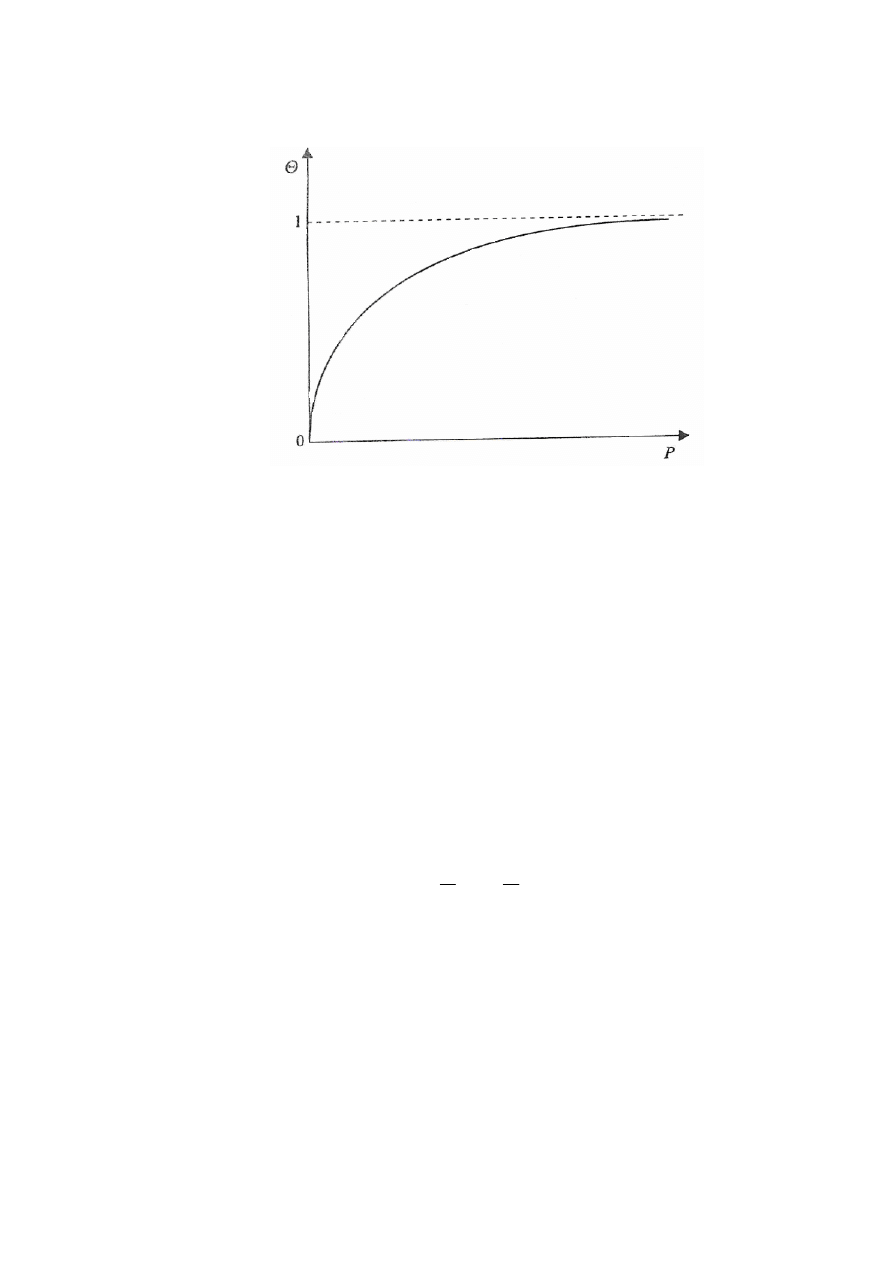
3
Graficzna ilustracja izotermy Langmuira (tj. zależności stopnia pokrycia Θ od
ciśnienia P zaadsorbowanego gazu)
Analiza równania
1) Jeżeli P przyjmuje duże wartości to możemy pominąć 1 w mianowniku i
wówczas stopień pokrycia
Θ
= 1. Oznacza to, że adsorpcja przyjmuje wartość
graniczną.
2) Jeżeli P jest bardzo małe to iloczyn KP w mianowniku można pominąć.
Równanie przyjmie wtedy postać równania adsorpcji Henry’ego
Θ
= KP
Równanie izotermy Langmuira stanowi podstawę wyprowadzenia wielu innych
izoterm w tym izotermy BET oraz równań opisujących adsorpcję na powierzchniach
energetycznie niejednorodnych heterogenicznych.
Inne postacie izotermy Langmuira
Równanie to można sprowadzić do postaci liniowej:
K
1
P
P
+
=
Θ
Wykreślając zależność P/
Θ
od P można wyznaczyć stała K z rzędnej.
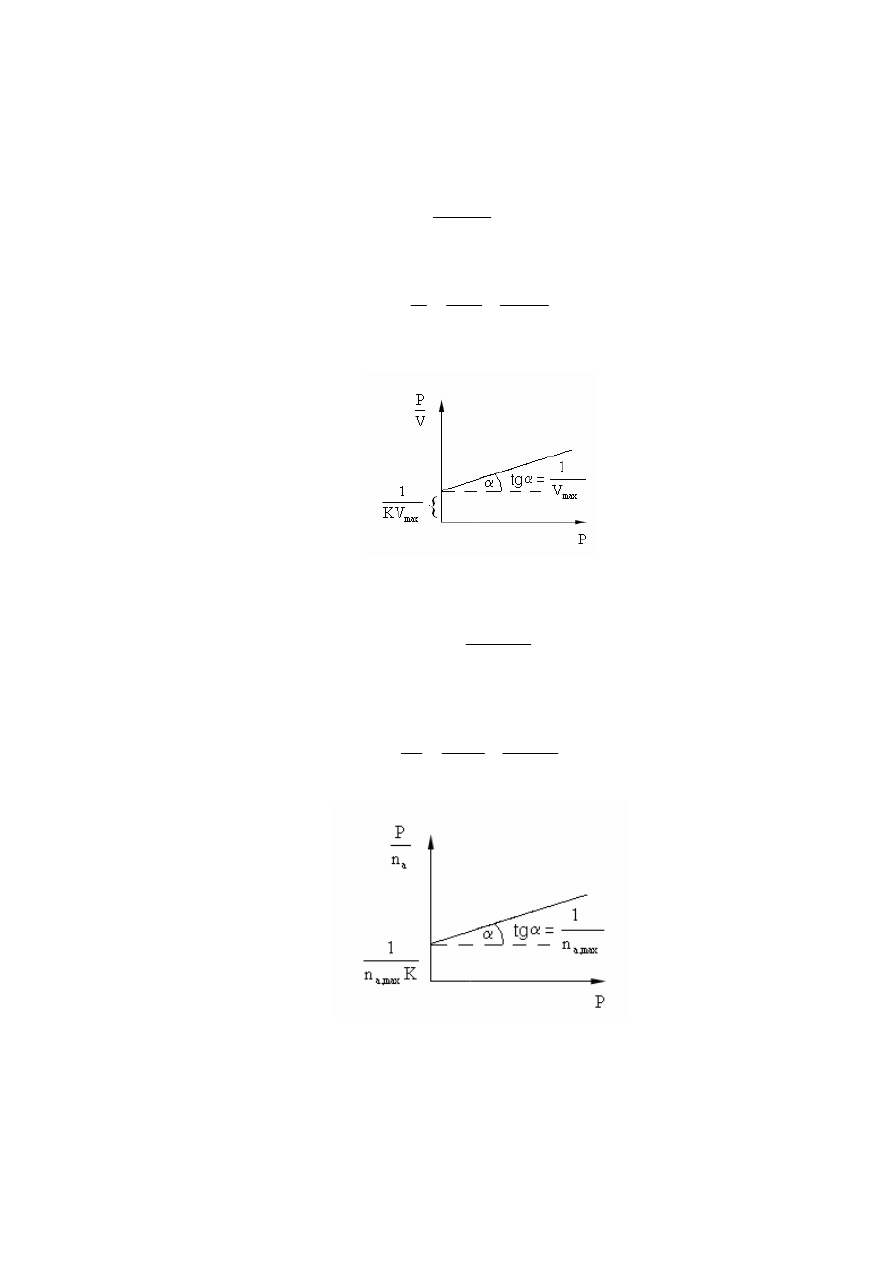
4
Jeżeli zmienna
Θ
wyrazimy jako stosunek objętości gazu zaadsorbowanego do
objętości maksymalnej gazu jaka może zaadsorbować się pod ciśnieniem par P czyli
Θ
= V/V
max
otrzymamy:
KP
1
KP
V
V
max
+
=
a w zapisie liniowej zależności:
max
max
KV
1
V
P
V
P
+
=
Jeżeli stopień pokrycia wyrazimy ilością moli adsorbatu, to:
KP
1
KP
n
n
max
,
a
a
+
=
lub
K
n
1
n
P
n
P
max
,
a
max
,
a
a
+
=

5
C)
ZALETY I WADY
•
ma prostą formę
•
nieskomplikowany obraz fizyczny tego równania
•
dość dobra zgodność bardzo dużej liczby izoterm doświadczalnych z
teoretycznymi
•
sprawdza się najlepiej w przypadku chemisorpcji oraz w przypadku adsorpcji z
roztworów stosunkowo dużych cząsteczek takich jak barwniki
•
pomiary adsorpcji gazów pod niewielkimi ciśnieniami
•
występują
różnego
rodzaju
rozbieżności
spowodowane
adsorpcją
wielowarstwową w miarę obniżania temperatury i niejednorodnością
powierzchni adsorbentu
•
w wielu przypadkach nie wystarcza do całkowitego wyjaśnienia zachodzących
zjawisk
D)
ZASTOSOWANIE
Równanie izotermy Langmuira stanowi podstawę wyprowadzenia wielu innych
równań izoterm oraz równań opisujących adsorpcję na powierzchniach
energetycznie niejednorodnych.
Liniowa forma jest przydatna do wyznaczania stałej równowagi K oraz sprawdzania
zgodności danych doświadczalnych z modelem.
3.
Izoterma BET
Nazwa pochodzi od nazwisk trzech badaczy: Brunauera, Emmetta i Tellera
A)
ZAŁOśENIA
1.
Powierzchnia jest wielowarstwowa tzn. wytworzona w procesie adsorpcji
pierwsza warstwa monomolekularna składająca się z cząstek adsorbatu jest
podłożem, na którym adsorbują się cząstki drugiej warstwy, a na niej trzeciej itd.
2.
Dla każdej z warstw stosuje się równanie izotermy adsorpcji Langmuira
3.
Energie poszczególnych warstw są od siebie różne, przy czym energia warstwy
pierwszej jest o wiele większa niż warstw kolejnych
4.
Kondensacja i parowanie adsorbatu zachodzą na powierzchniach niepokrytych
5.
Wzajemne oddziaływania między zaadsorbowanymi cząsteczkami nie istnieją
6.
Ilość zaadsorbowanych cząsteczek adsorbatu zależy od ciśnienia P jego par.
Wraz ze wzrostem tego ciśnienia zmniejsza się ilość niezajętych miejsc na
powierzchni adsorbentu a jednocześnie tworzą się podwójne, potrójne itd.
kompleksy adsorpcyjne (cząsteczka trafiająca na zajęte miejsce powierzchni
adsorbentu nie opuszcza go natychmiast, krótkotrwały kompleks adsorpcyjny).
6
B)
RÓWNANIA
Brunauer, Emmett, Teller podobnie jak Langmuir przeprowadzili rozważania
kinetyczne otrzymując równanie izotermy adsorpcji wielomolekuarnej.
Analizując równowagę adsorpcyjną rozpatruje się wielomolekularną adsorpcję
pary na jednorodnej powierzchni jako szereg równowag (para + wolne miejsce =
pojedynczy kompleks, para + pojedynczy kompleks = podwójny kompleks).
(
)
−
+
−
=
s
s
s
m
p
p
1
C
1
p
p
1
p
p
C
a
a
(
)
−
+
−
=
s
s
s
p
p
1
C
1
p
p
1
p
p
C
θ
gdzie
kT
H
H
S
k
1
,
s
e
A
C
∆
−
∆
−
=
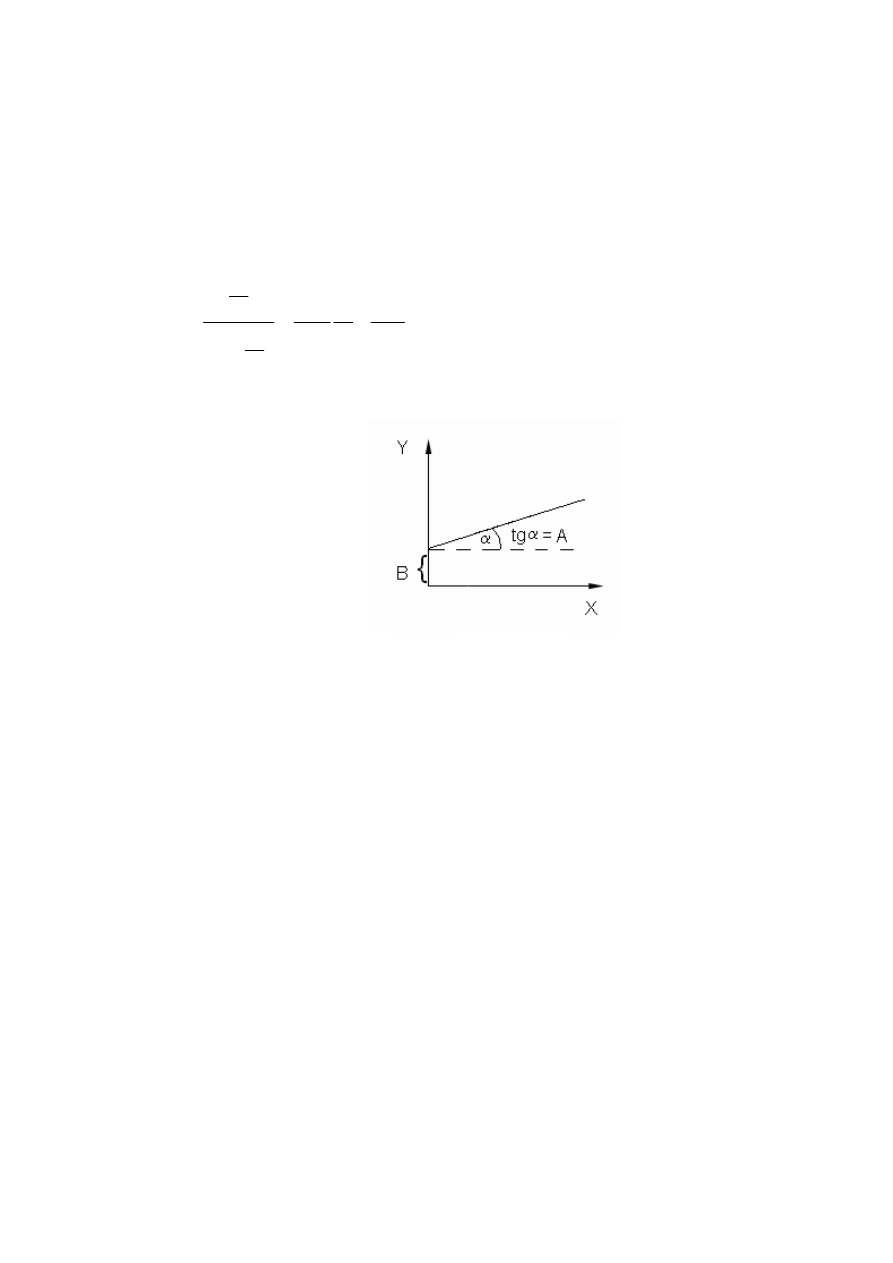
7
Równanie to można przedstawić w postaci liniowej:
C
a
1
p
p
C
a
1
C
p
p
1
a
p
p
m
s
m
s
s
+
−
=
−
Y
= A X + B
C)
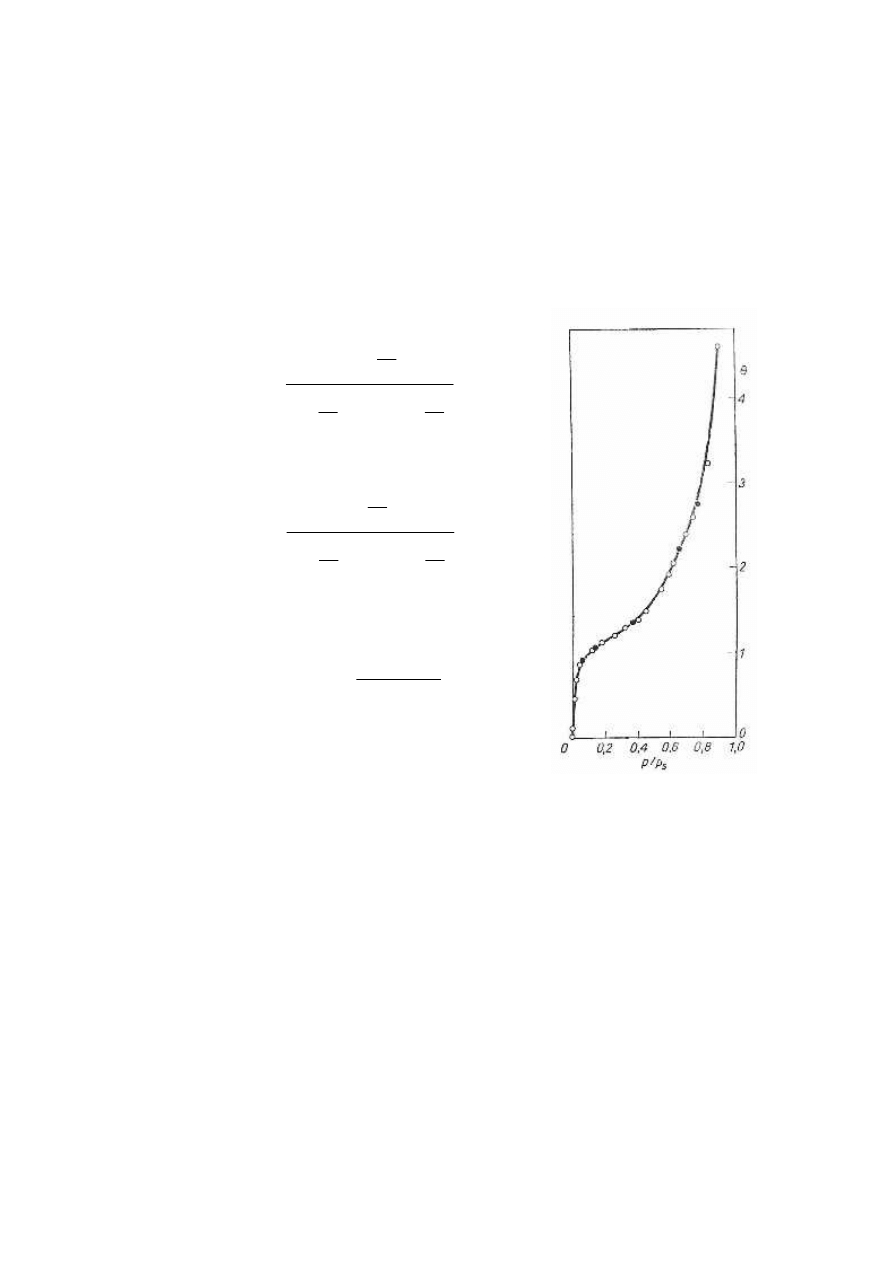
ZALETY I WADY
•
zdolność rozdzielcza metody jest bardzo duża (do kilku nm)
•
równanie BET dobrze spełnia się w zakresie ciśnień względnych (P/P
s
) między
0,05-0,3
•
przy niskich ciśnieniach równanie to przewiduje zbyt małą adsorpcję a przy
wysokich zbyt dużą
D)
ZASTOSOWANIE
Podstawowa metoda badania struktury ciał mikroporowatych i rozdrobnionych.
Dzięki niej można wyznaczyć powierzchnię właściwą, objętość i średnicę porów
różnych materiałów mikroporowatych np. węgla drzewnego, sit molekularnych,
membran, separatorów stosowanych w akumulatorach.
4.
Klasyfikacja izoterm adsorpcji według Brunauera
Według Brunauera istnieje 5 zasadniczych postaci izotermy adsorpcji gazów i par:
1.
Typ I – odpowiada izotermie Langmuira i charakteryzuje się monotonicznym
zbliżaniem do absorpcji granicznej, która prawdopodobnie odpowiada
kompletnej warstwie monomolekularnej.
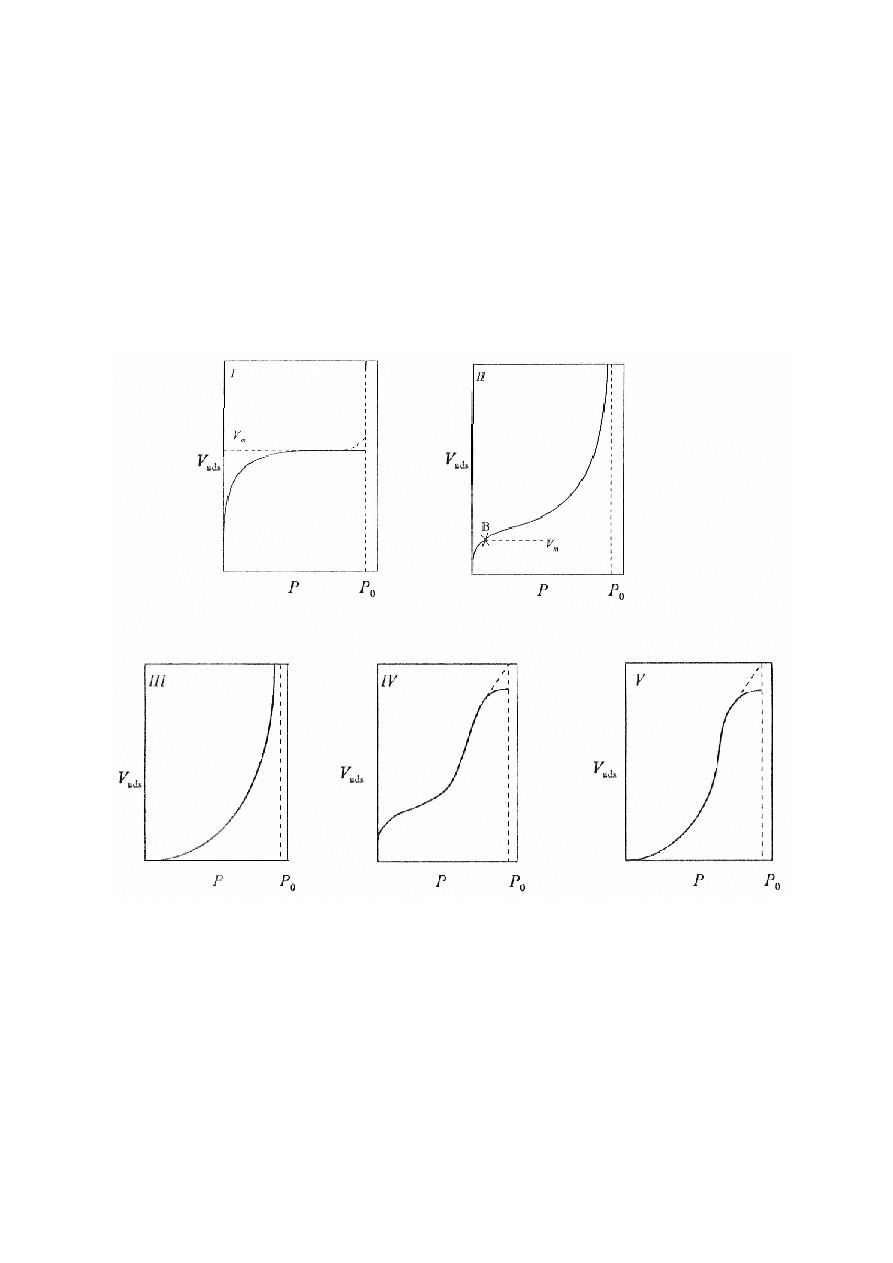
8
2.
Typ II – jest bardzo rozpowszechniony w przypadku adsorpcji fizycznej i
niewątpliwie
wiążę
się
z
powstaniem
wielomolekularnej
warstwy
adsorpcyjnej.
3.
Typ III – jest stosunkowo rzadki –odpowiada przypadkom, gdy oddziaływanie
adsorbatu z adsorbentem jest dużo mniejsze niż międzycząsteczkowe
oddziaływanie cząsteczek adsorbatu, np. wywołane pojawieniem się wiązań
wodorowych..
4.
Typ IV i V – odpowiadają krzywym typu II i III i różnią się od nich jedynie
tym, że maksimum adsorpcji jest osiągane przy ciśnieniu mniejszym od
ciśnienia pary nasyconej p
s
. uważa się że odzwierciedlają one zjawisko tzw.
kondensacji kapilarnej.
Wyszukiwarka
Podobne podstrony:
Izotermiczna?sorpcja okresowa w układzie ciało stałe ciecz (2)
8.5L, Izotermy adsorpcji 8.5L, Izotermy adsorpcji
Wyznaczanie izoterm?sorpcji jednokarboksylowych kwasów organicznych na węglu aktywnym
Przemiana izotermiczna, Fizyka - Lekcje
izotermiczna3
Reaktor przepływowy pracuj±cy izotermicznie (2), 1
Izoterma
Przemiana izotermiczna"
28. Izoterma rozpuszczalności w układzie trójskładnikowym, chemia fizyczna
izoterma rozpuszczalno
izoterma adsorbcji, studia, chemia, chemia fizyczna, sprawozdania, sprawka
PRZEMIANA IZOTERMICZNA, FIZYKA
Reaktor przepływowy pracuj±cy adiabatycznie (3), 1.3 PRZEP?YWOWY REAKTOR ZBIORNIKOWY PRACUJ?CY W WAR
31 wyznaczanie izotermy mieszania trzech cieczy, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, la
Równanie Bernouliego-przemiana izotermiczna
więcej podobnych podstron