
Politechnika Gdańska, międzywydziałowy kierunek „INŻYNIERIA BIOMEDYCZNA”
Projekt „Przygotowanie i realizacja kierunku inżynieria biomedyczna – studia międzywydziałowe”
współfinansowany ze środków Unii Europejskiej w ramach Europejskiego Funduszu Społecznego.
SKRYPT DO LABORATORIUM
Chemia
ĆWICZENIE 12: Koloidy
autor:
dr inż. Radosław Pomećko
Gdańsk, 2010

Politechnika Gdańska, międzywydziałowy kierunek „INŻYNIERIA BIOMEDYCZNA”
2
CHEMIA, R. Pomećko
1. Wymagania wstępne
1.1.Ustawienia
Wymagania wstępne dotyczące uczestników/osób realizujących ćwiczenie:
Znajomość instrukcji. Znajomość różnych rodzajów układów koloidalnych i emulsji
.
Cele ćwiczenia:
Zapoznanie studentów z właściwościami chemiczno-fizycznymi układów koloidalnych.
Wykaz przyrządów, materiałów i aparatury niezbędnej do przeprowadzenia ćwiczenia
Roztwory: AgNO
3
, KI, FeCl
3
, NaCl, NaOH, Na
2
SO
4
, Na
2
S
2
O
3
, H
2
SO
4
Spodziewane efekty kształcenia - umiejętności i kompetencje:
Zrozumienie pojęcia układów koloidalnych oraz ich właściwości chemiczno-fizycznych. Znajomość
technologicznych zastosowań układów koloidalnych.
Metody dydaktyczne:
Otrzymywanie układów koloidalnych organicznych i nieorganicznych.
Zasady oceniania/warunek zaliczenia ćwiczenia
Poprawne wykonanie przewidzianych ćwiczeń, prawidłowa odpowiedź na pytanie związane z
tematem ćwiczenia.
Wykaz literatury podstawowej do ćwiczenia:
1. Praca zbiorowa (Red. E. Luboch, M. Bocheńska, J.F. Biernat). „Chemia ogólna. Ćwiczenia
laboratoryjne” Gdańsk: Wydawnictwo Politechniki Gdańskiej 2003
2. Przebieg ćwiczenia
L.p. Zadanie
1.
Sprawdzian
2.
Realizacja zadań zgodnie z instrukcją do ćwiczenia
3.
Omówienie obserwacji
UWAGI!
1. Wykonanie eksperymentów objętych instrukcją,
2. Sformułowanie wniosków.
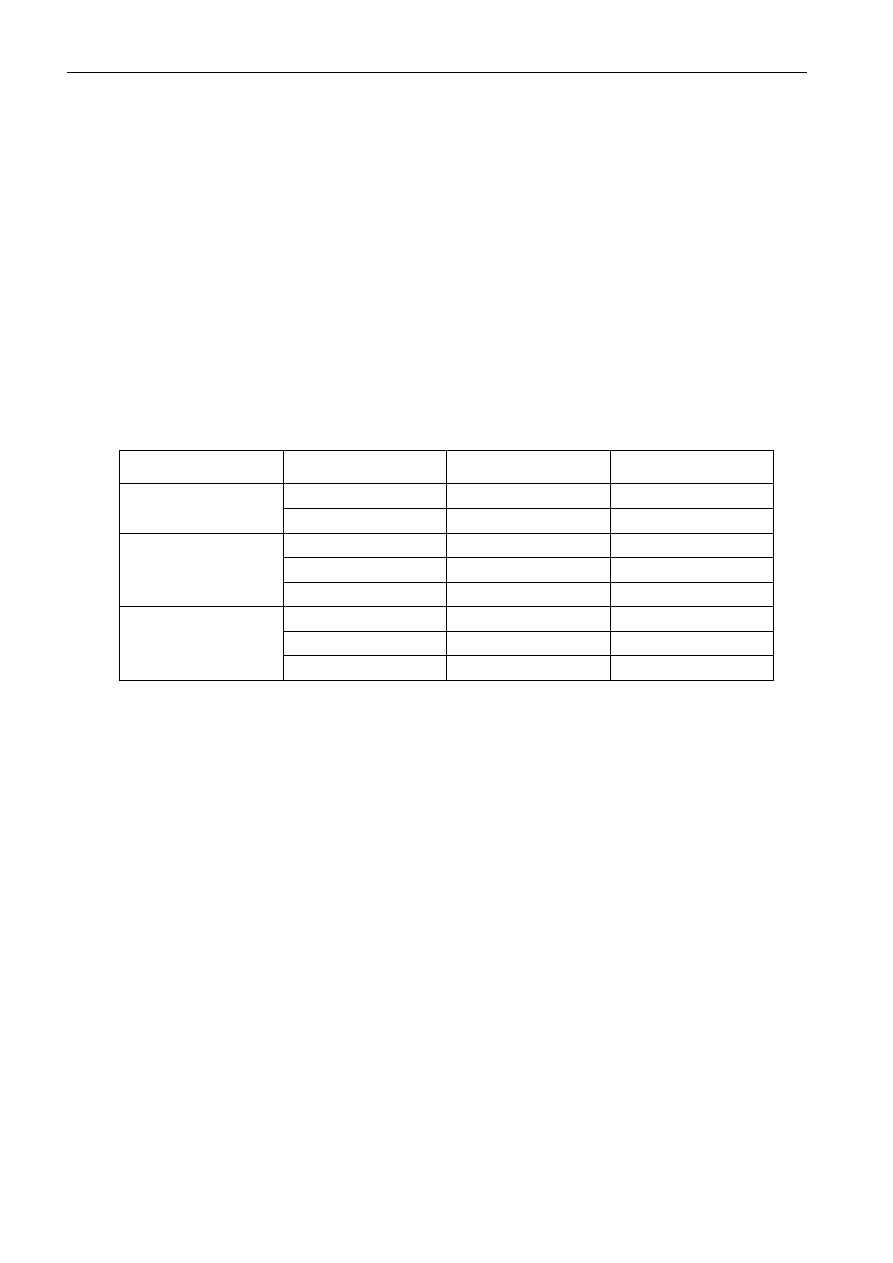
Politechnika Gdańska, międzywydziałowy kierunek „INŻYNIERIA BIOMEDYCZNA”
3
CHEMIA, R. Pomećko
3. Wprowadzenie do ćwiczenia
Stan koloidalny to taki stan materii, w którym dyspersyjny układ dwóch lub więcej składników
zachowuje wygląd układu jednorodnego fizycznie, choć w rzeczywistości jest mieszaniną niejednorodną.
Koloidy są więc stanem pośrednim pomiędzy roztworami rzeczywistymi a zawiesinami i mieszaninami
niejednorodnymi.
Ośrodkiem dyspersyjnym (rozpraszającym) lub fazą ciągłą nazywamy składnik koloidu o rozproszeniu
cząsteczkowym. Drugi składnik (pozostałe składniki) nazywamy zdyspergowanym (rozproszonym), przy czym
wielkość jego cząsteczek waha się od 1 do ok. 200 nm. Jeżeli cząstki fazy rozproszonej mają jednakową wielkość
koloid nazywamy monodyspersyjnym, natomiast układy o zróżnicowanej wielkości cząsteczek fazy rozproszonej
nazywamy polidyspersyjnymi. Podział koloidów wg stanu ośrodka dyspersyjnego i fazy rozproszonej zawiera
tabela 1. W przyrodzie układy koloidalne występują bardzo często, a najczęściej występują koloidy z ciekłym
ośrodkiem dyspersyjnym (roztwory koloidalne).
Tabela 1. Podział koloidów wg stanu ośrodka dyspersyjnego i fazy rozproszonej
Ośrodek dyspersyjny
Faza rozproszona
Nazwa
Przykłady
gaz
ciecz
mgły
mgła, chmury, pary
ciało stałe
gazozole
kurz, dym
ciecz
gaz
piany, zole
piana mydlana
ciecz
emulsje, emulsoidy
mleko, białko jaj
ciało stałe
sunspensje koloidalne
mętne wody
ciało stałe
gaz
piany stałe
pumeks
ciecz
emulsja stała
kwarc mleczny
ciało stałe
zole stałe
kolorowe szkła
Metody otrzymywania koloidów można podzielić na dwie grupy. Pierwszą stanowią metody
dyspersyjne, w których składnik dyspergowany jest rozdrabniany do wielkości właściwej układom koloidalnym.
Do metod takich zalicza się rozdrabnianie w młynach koloidalnych, rozpylanie termiczne czy rozpylanie w łuku
elektrycznym.
Drugą grupą metod są metody kondensacyjne prowadzące do skupiania cząsteczek i narastania
agregatów fazy rozproszonej aż do uzyskania rozdrobnienia koloidalnego. Większość metod kondensacyjnych
to metody chemiczne polegające na wydzieleniu trudno rozpuszczalnych substancji (o rozdrobnieniu
koloidalnym) w wyniku reakcji redukcji, utlenienia czy podwójnej wymiany. Inną metodą z tej grupy jest
stopniowa zmiana właściwości ośrodka dyspersyjnego, polegająca na przeniesieniu roztworu substancji
rozpraszanej do ośrodka, w którym substancja ta się nie rozpuszcza. Cząsteczki rozpuszczalnika pierwotnego
ulegają stopniowemu rozcieńczeniu przez fazę rozpraszającą, przez co substancja rozpraszana zostanie
otoczona molekułami fazy rozpraszającej, w której się nie rozpuszcza.
Cechy układów koloidalnych
Ze względu na małą wielkość cząstek fazy rozproszonej można w koloidach (ciekłych i gazowych)
obserwować ruchy Browna wynikające ze zderzeń fazy rozproszonej z cząsteczkami ośrodka dyspersyjnego.
Dlatego też w układach koloidalnych nie obserwujemy sedymentacji. Innym zjawiskiem wynikającym
bezpośrednio z budowy układów koloidalnych jest efekt Tyndalla, tj. rozpraszanie wiązki światła
przechodzącego przez koloid na cząstkach fazy rozproszonej.
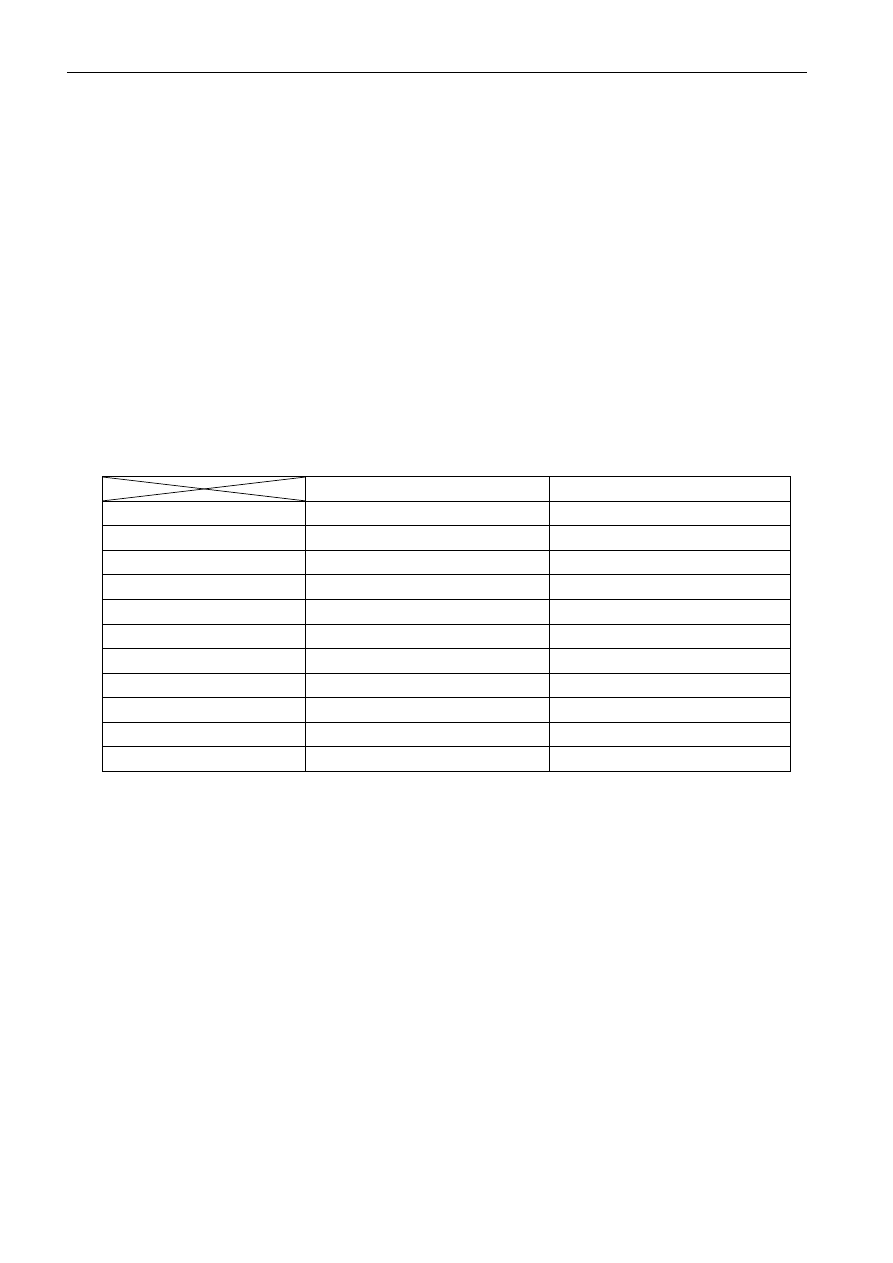
Politechnika Gdańska, międzywydziałowy kierunek „INŻYNIERIA BIOMEDYCZNA”
4
CHEMIA, R. Pomećko
W zależności od powinowactwa fazy rozproszonej do ośrodka dyspersyjnego dzielimy koloidy na liofilowe i
liofobowe. Koloidami liofilowymi są np. białka, żelatyna, które wykazują duże powinowactwo do fazy ciągłej.
Układy koloidów liofilowych są stabilizowane dzięki zjawiskom solwatacji (hydratacji dla wodnej fazy ciągłej), w
wyniku której cząstki fazy rozproszonej zostają otoczone cząsteczkami ośrodka dyspersyjnego, a wytworzone
otoczki przeciwdziałają zlepianiu się cząstek przy zderzeniach.
Koloidami liofobowymi nazywamy koloidy o małym powinowactwie do cząsteczek ośrodka dyspergującego np.
zole metali, sole metaliczne (AgCl) w H
2
O. Koloidy liofobowe stabilizowane są głównie dzięki adsorpcji jonów
elektrolitu z roztworu.
W przypadku, gdy fazą ciągłą jest woda koloidy liofilowe (liofobowe) nazywamy hydrofilowymi
(hydrofobowymi).
Powinowactwo fazy rozproszonej koloidu do ośrodka dyspersyjnego ma duży wpływ na właściwości fizyczne
koloidu (tabela 2).
Tabela 2. Koloidy liofobowe i liofilowe
Koloidy liofobowe
Koloidy liofilowe
Otrzymywanie
metodą dyspersji lub kondensacji
przez zwykłe rozpuszczanie
Stężenie fazy rozproszonej
na ogół nieznaczne
może być duże
Ruchy Browna
występują wyraźnie
często bardzo niewyraźne
Efekt Tyndalla
wyraźny
niewyraźny
Barwa układu
często zabarwione
często bezbarwne
Ładunek elektryczny
cząstki są zawsze naładowane
ładunek nieznaczny lub brak
Lepkość
nieznaczna
znaczna
Tworzenie piany
nie tworzą piany
łatwo tworzą pianę
Tworzenie galaret
nie tworzą
tworzą łatwo
Wrażliwość na elektrolit
duża, zachodzi koagulacja
mała
Charakter koagulacji
nieodwracalna
odwracalna
Zjawiska zachodzące w układach koloidalnych
Koagulacją nazywamy proces polegający na łączeniu się pojedynczych cząstek roztworu koloidalnego w
większe skupienia – agregaty. Następstwem koagulacji może być sedymentacja i całkowite rozdzielenie się
ośrodka rozpraszającego i fazy zdyspergowanej. Proces koagulacji może objawiać się zmianą barwy (np.
roztwór koloidalnego złota ma barwę niebieską lub fioletową), zmętnieniem, wydzielaniem osadu lub
tworzeniem galaretowatej masy. Koagulacja koloidów liofobowych i liofilowych jest spowodowana
odmiennymi czynnikami i przebiega w inny sposób. Proces koagulacji następuje w wyniku osłabienia czynników
stabilizujących, czyli ładunku elektrycznego w przypadku zoli liofobowych, oraz solwatacji cząstek w przypadku
zoli liofilowych.
Rozpoczęty proces koagulacji koloidów liofobowych prowadzi zawsze do wypadania całej fazy rozproszonej,
ponieważ są one z reguły bardzo nietrwałe. W tym przypadku koagulacja może być wywołana: działaniem
elektrolitów, zmianami temperatury, zmianą stężenia, czy ultradźwiękami. Podczas ogrzewania koagulują np.
hydrozole: Cu[Fe(CN)
6
], AgCl, AgBr.
Politechnika Gdańska, międzywydziałowy kierunek „INŻYNIERIA BIOMEDYCZNA”
5
CHEMIA, R. Pomećko
Koagulacja koloidów liofilowych pod wpływem zwiększenia stężeń elektrolitu nazywana jest wysalaniem.
Dodatek elektrolitu powoduje rozładowanie cząstek oraz usuwa z koloidu warstewkę solwatacyjną na zasadzie
konkurencji, dlatego do wysalania koloidów nadają się szczególnie sole o jonach ulegających silnej hydratacji,
np. MgSO
4
i Na
2
SO
4
. Koagulację wywołają także inne substancje zdolne do usunięcia solwatujących cząstek
rozpuszczalnika np. w roztworze wodnym – alkohol, aceton, sacharoza, w roztworze alkoholowym – woda.
Ze względu na działanie wysalające uszeregowano kationy i aniony w tzw. szereg liotropowy:
Li
+
> Na
+
> K
+
> Rb
+
> Cs
+
; Mg
2+
> Ca
2+
> Sr
2+
> Ba
2+
SO
4
2-
> Cl
-
> Br
-
> NO
3
-
> I
-
> SCN
-
Procesem odwrotnym do koagulacji, a zachodzącym tylko w przypadku koloidów liofilowych jest peptyzacja,
może ją powodować dodatek elektrolitów, przemywanie lub dodatek substancji powierzchniowo-czynnych.
Peptyzacja może też sprawić problemy w laboratorium, np. kiedy podczas przemywania osadów wodą osad
przechodzi przez sączek. Dzieje się tak ponieważ osad wytrącany jest zazwyczaj przy dużym nadmiarze
elektrolitów, zapobiegających tworzeniu się roztworu koloidalnego, natomiast przy przemywaniu osadu wodą
dochodzi do rozcieńczenia elektrolitu i powstania hydrozolu.
Niektóre roztwory koloidalne mogą samorzutnie przejść ze stanu ciekłego w stan zbliżony do ciała stałego np.
roztwory żelatyny, krochmalu, mydła, kauczuku w benzenie, itp. Ten stan układu koloidalnego typowego dla
żelatyny - nosi nazwę żelu. Żele mogą być organiczne (przykłady powyżej), jak i nieorganiczne, np.
wodorotlenek żelaza, silikażel. Zjawisko żelowania polega na wytworzeniu przez cząstki fazy rozproszonej
szkieletu zamykającego w sobie fazę ciekłą. Żel na skutek właściwości adsorpcyjnych może dodatkowo
pochłaniać cząsteczki fazy rozpraszającej, w wyniku czego zwiększa swą objętość, co nosi nazwę pęcznienia
żelu.
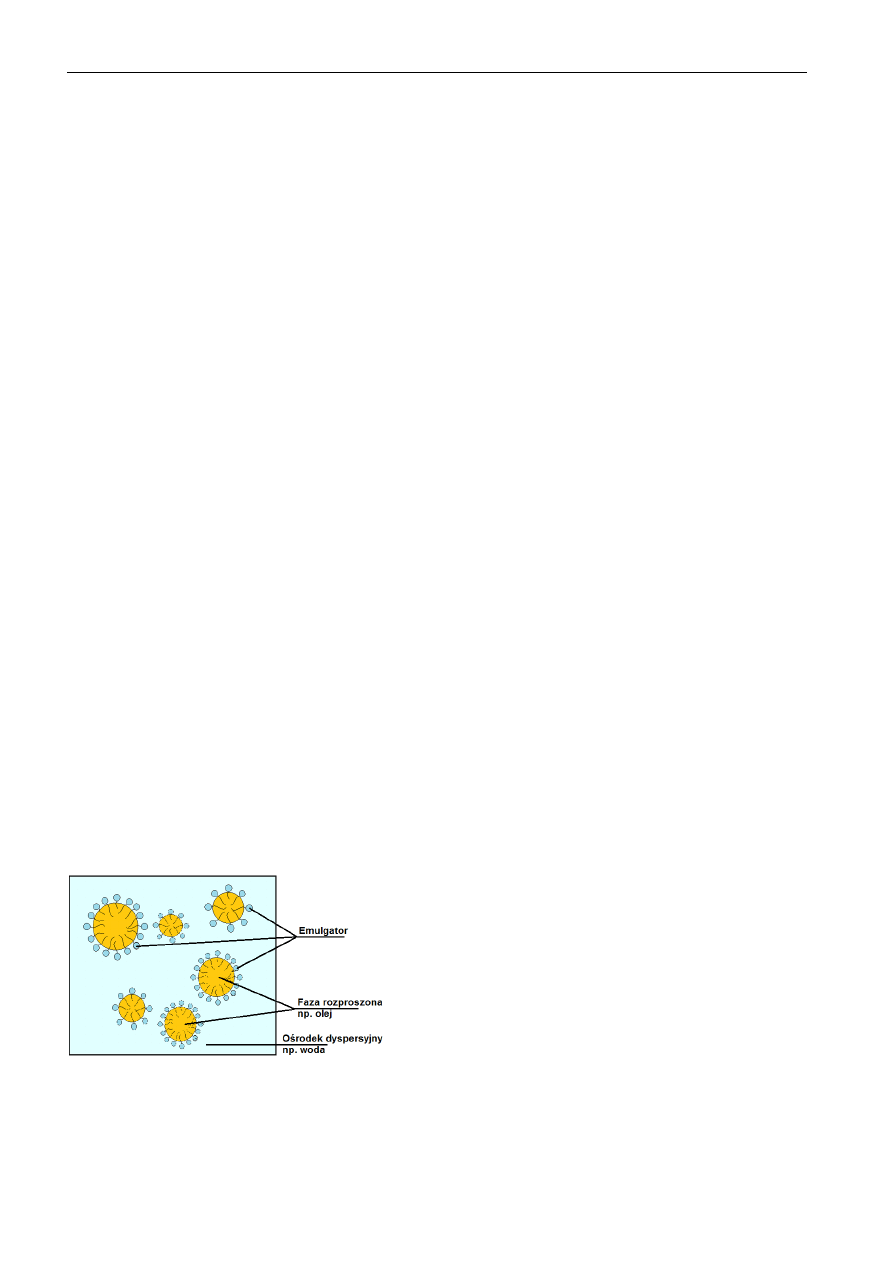
Emulsje
Układ koloidalny (rys.1), w którym zarówno ośrodek rozpraszający, jak i substancja rozproszona jest cieczą
nazywamy emulsją, przy czym warunkiem utworzenia emulsji jest całkowity brak lub bardzo mała ich wzajemna
rozpuszczalność. Średnica kropelek cieczy rozproszonej w takim układzie może dochodzić nawet do 10
-3
cm. Są
to układy termodynamiczne nietrwałe i łatwo ulegają koalescensji, czyli łączeniu się kropelek cieczy
rozproszonej w większe krople. Zjawisku koalescencji zapobiegać może dodatek emulgatorów. Działanie
emulgatorów polega na zmniejszaniu międzyfazowego
napięcia powierzchniowego pomiędzy kropelkami cieczy
zdyspergowanej
a
fazy
rozpraszającej.
Przykładem
powszechnie znanej emulsji jest mleko, w którym kropelki
tłuszczu zawieszone są w wodnym roztworze soli sodu,
wapnia i potasu. W strukturze emulgatora znajdują się
zarówno grupy hydrofilowe np. –OH, -COOH, -NH
2
, jak i
hydrofobowe tj. łańcuchy węglowodorowe. Taka budowa
emulgatora sprawia, że umiejscawia się on na granicy
pomiędzy fazą rozproszoną a ośrodkiem dyspersyjnym i
stabilizuje układ w sposób analogiczny do solwatacji.
Rys. 1. Emulsja stabilizowana emulgatorem

Politechnika Gdańska, międzywydziałowy kierunek „INŻYNIERIA BIOMEDYCZNA”
6
CHEMIA, R. Pomećko
Część doświadczalna
Ćwiczenie 1. Otrzymywanie koloidalnego roztworu wodorotlenku żelaza(III)
Do zlewki o pojemności 50 cm
3
wlać 30 cm
3
wody destylowanej, a następnie umieścić zlewkę na płytce metalowej i ogrzewać
do wrzenia. Ogrzewanie przerwać i wkroplić 2,5 cm
3
0,1 M roztworu FeCl
3
mieszając zawartość zlewki bagietką i ponownie
ogrzać roztwór do wrzenia, pozostawiając go w tym stanie przez 2 – 3 min. Otrzymany zol Fe(OH)
3
zachować do następnych
ćwiczeń. Dla porównania powtórnie wykonać opisywane doświadczenie nie ogrzewając roztworu. Porównać otrzymane
roztwory zwracając uwagę na barwę zolu Fe(OH)
3
. Podać zachodzące reakcje i postacie w jakich występuje Fe(OH)
3
w
poszczególnych doświadczeniach.
Ćwiczenie 2. Koagulacja zolu Fe(OH)
3
w wyniku działania elektrolitów
Do czterech próbówek nalać po 5 cm
3
otrzymanego wcześniej i ostudzonego koloidu Fe(OH)
3
. Wprowadzić do kolejnych
próbówek roztwory 0,5 M NaCl (0,5 cm
3
), 0,5 M Na
2
SO
4
(0,5 cm
3
), nasycony roztwór NaCl, oraz polielektrolit aż do wystąpienia
zmętnienia. Określić wpływ jonu i jego stężenia na proces koagulacji.
Ćwiczenie 3. Termiczna koagulacja jonów siarki
Do próbówki wprowadzić 1 – 2 cm
3
0,5 M roztworu Na
2
S
2
O
3
i taką samą objętość 0,5 M H
2
SO
4
. Zaobserwować stopniowe
zmętnienie roztworu wskutek tworzenia koloidalnej siarki. Przeprowadzić koagulację koloidu, przez ogrzewanie próbówki nad
płomieniem palnika. Opisać obserwowane zjawiska. Omówić wpływ temperatury na koagulację siarki.
Ćwiczenie 4. Otrzymywanie żelu kwasu krzemowego
Do małego cylindra miarowego wlać 1 cm
3
szkła wodnego (stężony roztwór Na
2
SiO
3
lub K
2
SiO
3
) i 4 – 5 cm
3
wody destylowanej.
Przenieść zawartość cylindra do małej zlewki, dodać parę kropli błękitu bromotymolowego, który powoduje powstanie
intensywnej niebieskiej barwy. Wymieszać roztwór bagietką szklaną, a następnie wkraplać 3,5 M roztwór HCl do zmiany barwy
na kolor zielono–niebieski. Dodatek kwasu solnego powoduje tworzenie kwasu krzemowego i jego kondensację do kwasu
polikrzemowego. Zol kwasu przechodzi w żel z wytworzeniem sztywnej, galaretowatej masy. Napisać reakcje przebiegające w
roztworze. Jak zmienia się pH roztworu podczas reakcji.
Literatura:
1.
Praca zbiorowa (Red. E. Luboch, M. Bocheńska J.F. Biernat). „Chemia ogólna. Ćwiczenia laboratoryjne” Gdańsk:
Wydawnictwo Politechniki Gdańskiej 2003
2.
Pajdowski L.: Chemia ogólna. Warszawa: PWN 1993
3.
Bielański A.: Podstawy Chemii nieorganicznej. Cz 2. Warszawa: PWN 2010
4.
Erndt A.: Podstawy chemii ogólnej i nieorganicznej. Warszawa: PWN 1986
Wyszukiwarka
Podobne podstrony:
Cwiczenie 12 id 99084 Nieznany
Fizjologia Cwiczenia 12 id 1743 Nieznany
cwiczenia 7 12 id 124460 Nieznany
Biochemia Cwiczenia 12 id 86309 Nieznany (2)
Biologia Cwiczenia 12 id 87710 Nieznany (2)
Cwiczenie 12 id 99084 Nieznany
Fizjologia Cwiczenia 11 id 1743 Nieznany
Biologia Cwiczenia 11 id 87709 Nieznany (2)
cwiczenie 14 id 125164 Nieznany
lab1 12 id 258878 Nieznany
8 Cwiczenia rozne id 46861 Nieznany
cwiczenia wzrost id 155915 Nieznany
II CSK 330 12 1 id 209820 Nieznany
cwiczenie III id 101092 Nieznany
Cwiczenie 5B id 99609 Nieznany
Cwiczenie nr 8 id 99953 Nieznany
cwiczenie 05 id 125057 Nieznany
F Cwiczenia, cz 3 id 167023 Nieznany
cwiczenie 52 id 41325 Nieznany
więcej podobnych podstron