Kwantowe Podstawy Budowy Materii 2012/2013 IF UJ
Zagadnienie 12. Widma atomów wieloelektronowych: orto- i para- hel. Zasada wariacyjna i przybliżone rozwiązanie dla atomu helu.
12. Widma atomów wieloelektronowych: orto-hel i para-hel.
Zasada wiariacyjna i przybliżone rozwiązanie dla atomu helu.
Najprostszym przykładem atomu wieloelektronowego jest atom helu. W stanie
podstawowym jego dwa elektrony całkowicie wypełniają najgłębszą powłokę o głównej liczbie
kwantowej . W tej powłoce nie ma już miejsca dla następnych elektronów.
W stanie wzbudzonym jeden elektron pozostaje na zapełnionej w połowie powłoce, a drugi
jest wzbudzany do wyższej powłoki. Mamy wtedy:
elektron 1 w stanie i
elektron 2 w stanie
Do tej pory była mowa o atomach, w których liczby kwantowe pojedynczego elektronu
wystarczały do opisania termów, bo albo innych elektronów nie było, albo (jak np. w atomie wodoru)
znajdowały się one na tzw. zapełnionych, zamkniętych powłokach lub podpowłokach. To oznacza,
że takie elektrony nie dają wkładu do całkowitego momentu pędu ani do całkowitego momentu
magnetycznego atomu.
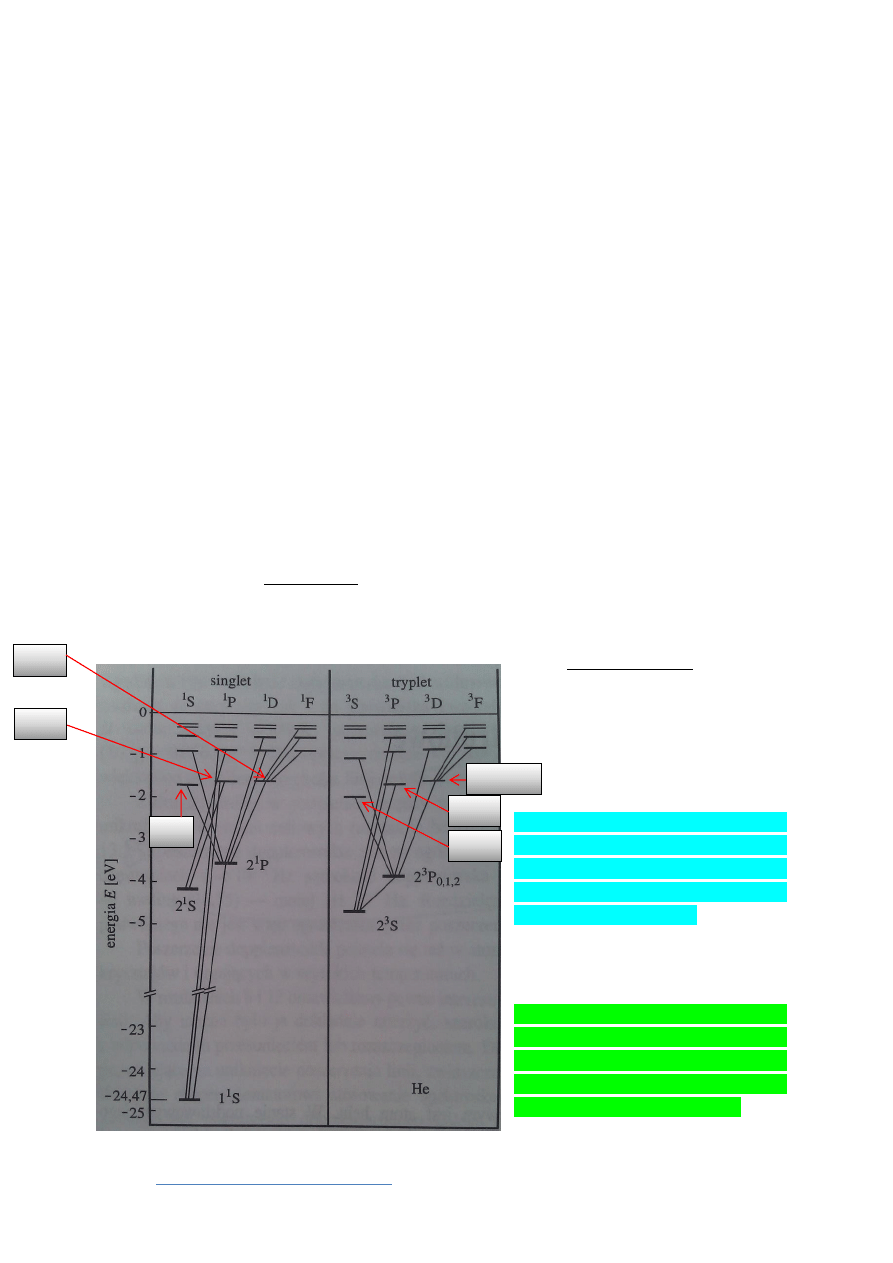
Układ widoczny na Rys. 1 jest układem termów atomu helu (po lewej: para-hel , po prawej:
orto-hel ). Ten układ jest podobny do układów termów w atomach metali alkaicznych z tą
różnicą, że hel ma dwa niemieszające się ze sobą układy: singletowy i trypletowy – zupełnie tak jakby
istniały dwa rodzaje atomów helu. Nazwy tych układów wywodzą się z tego, że w singletowym
wszystkie termy są pojedyncze (ang. single), a trypletowym dzielą się na trzy składowe (ang. triplet).
Uwaga dot. Rys. 1:
Na zajęciach rysowane były tylko
niektóre przejścia. Stanów dr Rycerz
nie brał pod uwagę.
Zakaz Pauliego: stany elektronowe
obsadzone są w taki sposób, aby żadne
2 elektrony nie miały takich samych
zespołów
liczb
kwantowych
(n
1
,l
1
,m
l1
,m
s1
≠ n
2
,l
2
,m
l2
,m
s2
).
Z zakazu Pauliego wynika, że stan np.
1
3
S nie istnieje!
Reguła Hunda: Elektrony o tej samej
wartości n i L w stanie podstawowym
atomu
rozmieszczone
są
na
podpowłokach m
l
w taki sposób, aby
wypadkowy spin był maksymalny.
Z reguły Hunda wynika, że stany n
3
L leżą
poniżej stanu n
1
L.
Rysunek 1 Schemat termów atomu helu. Przejścia w układzie
singletowym pokrywają zakres energii rzędu 25eV, a w trypletowym
tylko 5eV. Przejścia między układami są wzbronione.
3
1
S
3
1
P
3
1
D
3
3
S
1
3
3
P
1
3
3
D
1,2,3

Kwantowe Podstawy Budowy Materii 2012/2013 IF UJ
Zagadnienie 12. Widma atomów wieloelektronowych: orto- i para- hel. Zasada wariacyjna i przybliżone rozwiązanie dla atomu helu.
Hel w stanie singletowym nazywany jest tez parahelem. W odróżnieniu od atomów metali
alkaicznych nie wykazuje struktury subtelnej: wszystkie linie są liniami pojedynczymi. Najniższy stan
opisano symbolem 1
1
S. Pierwsze jedynka oznacza wartość głównej liczny kwantowej, jedynka
w indeksie górnym oznacza multipletowość (tu: singlet), a litera jest symbolem całkowitego
orbitalnego momentu pędu (w tym przypadku ). Wyższe stany mają oznaczenia: 2
1
S, 2
1
P, 3
1
S,
3
1
D itd…
Na podstawie tego, że brak tu struktury subtelnej można wyciągnąć wniosek, że spiny obu
elektronów mają orientację antyrównoległą i dodają się wektorowo do całkowitej wartości spinu S=0.
To samo dotyczy momentu magnetycznego, µ
S
=0. Symbole dużych liter oznaczają stany kwantowe
utworzone przez sprzężenie kilku elektronów (w przypadku helu to dwóch elektronów).
Hel w stanie trypletowym nazywany jest też ortohelem. Widmo tego helu wykazuje strukturę
subtelną. Jego najniższy stan to 2
3
S. Dwójka oznacza elektron wzbudzony o głównej licznie
kwantowej , trójka w górnym indeksie mówi o multipletowości (tu: tryplet), a litera S oznacza,
że . Uwaga: zarówno liczba kwantowa całkowitego spinu, jak i stan o całkowitym orbitalnym
momencie pędu są oznaczane tą samą literą (niestety ).
Spiny w tym układzie są ustawione równolegle do siebie. Liczba kwantowa całkowitego spinu
s
1
+s
2
=S=1. Moment magnetyczny µ
S
≠0.
Widmo parahelu leży głównie w obszarze nadfioletu, a widmo ortohelu w obszarze
widzialnym i w podczerwieni. Między układami singletowym i trypletowym nie ma przejść
optycznych. Jeśli porównamy odpowiednie konfiguracje w tych układach to otrzymamy duże różnice
energii (np. stan 2
1
S
o
leży ok. 0,8 eV wyżej niż stan2
3
S
1
, a 2
1
P leży ok. 0,25 eV wyżej niż stan 2
3
P
2
.
Różnice są spowodowane różnicą w oddziaływaniach elektrostatycznych dwóch elektronów
o równoległej i antyrównoległej orientacji spinów. Nazywana jest ona energią symetrii, bo wynika
z różnicy średnich odległości między dwoma elektronami o funkcjach symetrycznych lub
antysymetrycznych.
Metodę wariacyjną
można stosować zawsze. Stosując tę metodę nawet po wykonaniu
nieskończenie długiego rachunku, możemy otrzymać wynik bardzo odległy od dokładnego. Żeby
otrzymywać dobre wyniki za pomocą metody wariacyjnej, niezbędne jest posiłkowanie się intuicją
fizyczną.

Kwantowe Podstawy Budowy Materii 2012/2013 IF UJ
Zagadnienie 12. Widma atomów wieloelektronowych: orto- i para- hel. Zasada wariacyjna i przybliżone rozwiązanie dla atomu helu.
Wyszukiwarka
Podobne podstrony:
12 Zakladanie pasiekiid 13664 Nieznany (2)
12 Uzytkowanie urzadzen transpo Nieznany (2)
12 Narzedzia promocji miejscowo Nieznany (2)
12 Eksploatacja urzadzen teleko Nieznany
12 Kontrolowanie jakosci wyrobo Nieznany (2)
12 Sporzadzanie rachunku koszto Nieznany (2)
12 Wytwarzanie zakladek, podnos Nieznany (3)
geo 12 Scan01122009 192357 id 6 Nieznany
12 TECHNOLOGIA I KONTROLA ZAGES Nieznany (2)
c3 19 12 2010 id 97134 Nieznany
mat fiz 2003 12 06 id 282350 Nieznany
piae wyklad3 12 13 id 356381 Nieznany
9 16 12 2011 grammaire descrip Nieznany (2)
8 9 12 2011 grammaire descript Nieznany (2)
EZNiOS Log 12 13 w9 ocieplenie Nieznany
12 wartosci i wektory wlasneid Nieznany (2)
kpp arkusz 12 kol id 249459 Nieznany
12 rozklady statystyczneid 132 Nieznany (2)
więcej podobnych podstron