
Gazy
Gazy

W XIX wieku sformułowano prawa
opisujące własności gazów na
podstawie szeregu wyników
eksperymentalnych. Są to :
Prawo Boyle’a-Mariotte’a
Prawo Gay-Lussaca
Prawo Charlesa
Hipoteza Avogadro
Prawo Daltona
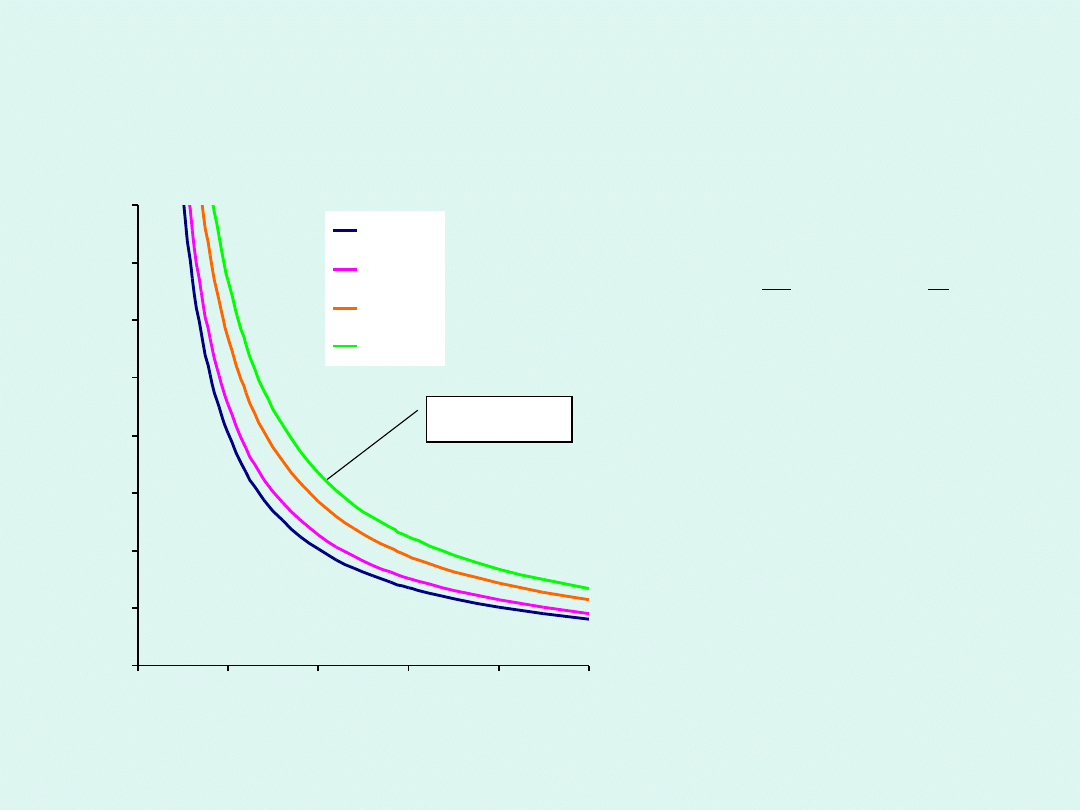
Prawo Boyle’a-Mariotte’a
0.00E+00
5.00E+05
1.00E+06
1.50E+06
2.00E+06
2.50E+06
3.00E+06
3.50E+06
4.00E+06
0
0.001
0.002
0.003
0.004
0.005
V [m
3
]
p [Pa]
T=243 K
T=273 K
T=343 K
T=403 K
p
1
V
lub
V
1
p
const
T
i
const
m
lub
const
n
∝
∝
=
=
=
const
pV
=
Dla pewnej stałej ilości
gazu w stałej temperaturze
ciśnienie jest odwrotnie
proporcjonalne do
objętości czyli iloczyn
ciśnienia i objętości jest
stały.
izoterma
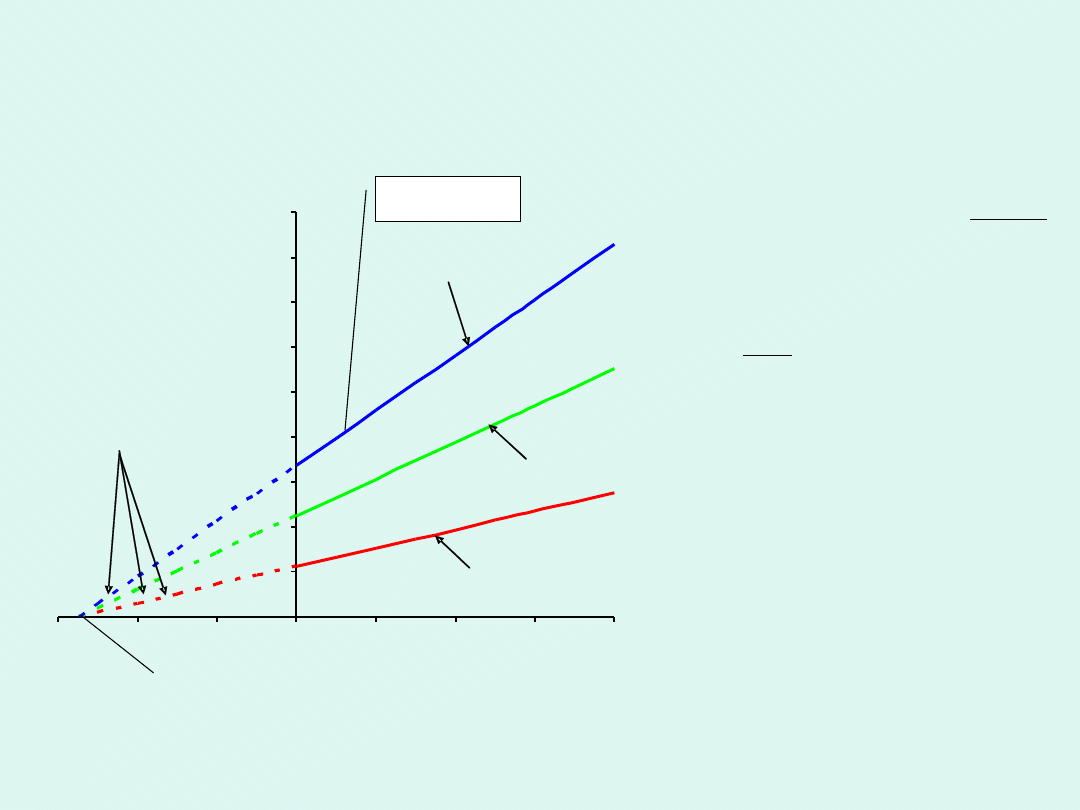
Prawo Gay-Lussaca
(
)
273,15
1
o
t
1
V
V
const
p
i
const
m
lub
const
n
=
α
⋅
α
+
=
=
=
=
const
T
V
=
0
0,02
0,04
0,06
0,08
0,1
0,12
0,14
0,16
0,18
-300
-200
-100
0
100
200
300
400
t [
o
C]
V [m
3
]
n=1 mol
n=2 mole
n=3 mole
ekstrapolacja
0 K lub -273,15
o
C
lub 273,15 K
Dla pewnej stałej ilości
gazu pod stałym
ciśnieniem objętość jest
wprost proporcjonalna do
temperatury.
izobara
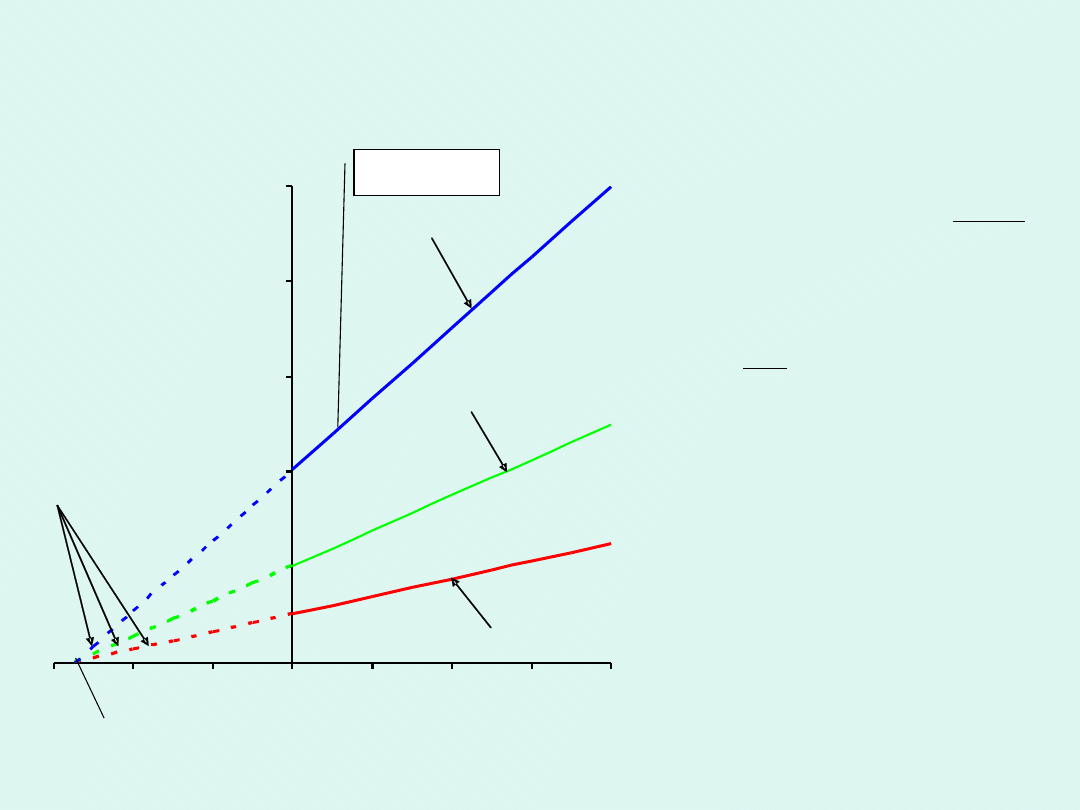
Prawo Charlesa
(
)
273,15
1
o
t
1
p
p
const
V
i
const
m
lub
const
n
=
β
⋅
β
+
=
=
=
=
const
T
p
=
0
100000
200000
300000
400000
500000
-300
-200
-100
0
100
200
300
400
t [
o
C]
p [Pa]
lub 273,15 K
V=0,0112 m
3
V=0,0224 m
3
V=0,0448 m
3
-273,15
o
C lub 0 K
ekstrapolacja
izochora
Dla pewnej stałej ilości
gazu znajdującej się w
stałej objętości ciśnienie
jest wprost
proporcjonalne do
temperatury.

Hipoteza Avogadro
J
e
ś
l
i
m
a
m
y
r
ó
ż
n
e
g
a
z
y
w
t
e
j
s
a
m
e
j
o
b
j
ę
t
o
ś
c
i
i
t
e
m
p
e
r
a
t
u
r
z
e
i
p
o
d
t
y
m
s
a
m
y
m
c
i
ś
n
i
e
n
i
e
m
,
t
o
z
a
w
i
e
r
a
j
ą
o
n
e
t
e
s
a
m
e
i
l
o
ś
c
i
c
z
ą
s
t
e
c
z
e
k
.
1 mol gazu zawiera liczbę cząsteczek
wyrażającą się liczbą Avogadro.
1
23
A
mol
10
022
6
N
−
⋅
=
,

Równanie stanu gazu doskonałego
(Clapeyrona)
nRT
pV
=
p
– ciśnienie [Pa]
V
– objetość [m
3
]
n
– liczba moli [mol]
T
- temperatura w skali bezwzględnej [K]
R
– stała gazowa
K
mol
J
314
8
R
⋅
=
,
[ ] [ ]
15
273
C
t
K
T
,
+
°
=

Warunki normalne
t
o
= 0°C (T = 273,15 K)
p
o
= 1,013·10
5
Pa
Objętość 1 mola gazu w tych warunkach
V
o
= 22,4·10
-3
m
3
/mol
K
mol
J
314
8
K
15
273
mol
m
10
22,4
Pa
10
013
1
T
V
p
R
3
3
-
5
o
o
o
⋅
=
⋅
⋅
⋅
=
=
,
,
,

Gaz, który spełnia równanie
Clapeyrona nazywamy
doskonałym.
Wszystkie gazy, z jakimi mamy do czynienia są, gazami
rzeczywistymi i wykazują odchylenia od równania stanu
doskonałego (nie spełniają go).
Własności gazów rzeczywistych stają się zbliżone do
własności gazu doskonałego, gdy ich ciśnienie dąży do
zera.
Inaczej mówiąc im ciśnienie gazu niższe tym lepiej
spełnia on równanie Clapeyrona.

Prawo Daltona
i
i
i
i
i
i
i
x
n
n
P
p
n
n
V
nRT
P
V
RT
n
p
p
P
=
=
=
=
=
=
∑
∑
Prawo to dotyczy mieszanin gazów.
Ciśnienie całkowite mieszaniny gazów jest sumą ciśnień
cząstkowych poszczególnych składników. Ciśnienie cząstkowe
danego składnika gazowego, to ciśnienie jakie wywierałby, gdyby
sam znajdował się w danych warunkach.
Wniosek z prawa Daltona
P
x
p
i
i
⋅
=

Teoria kinetyczno-molekularna
gazów – model gazu
doskonałego
Wymiary cząsteczek są znikomo małe w
porównaniu z odległościami pomiędzy nimi.
Można traktować je jako punkty materialne.
Cząsteczki są w ciągłym, chaotycznym
ruchu.
Cząsteczki nie oddziaływują na siebie na
odległość, jedynie dochodzi do doskonale
elastycznych zderzeń.
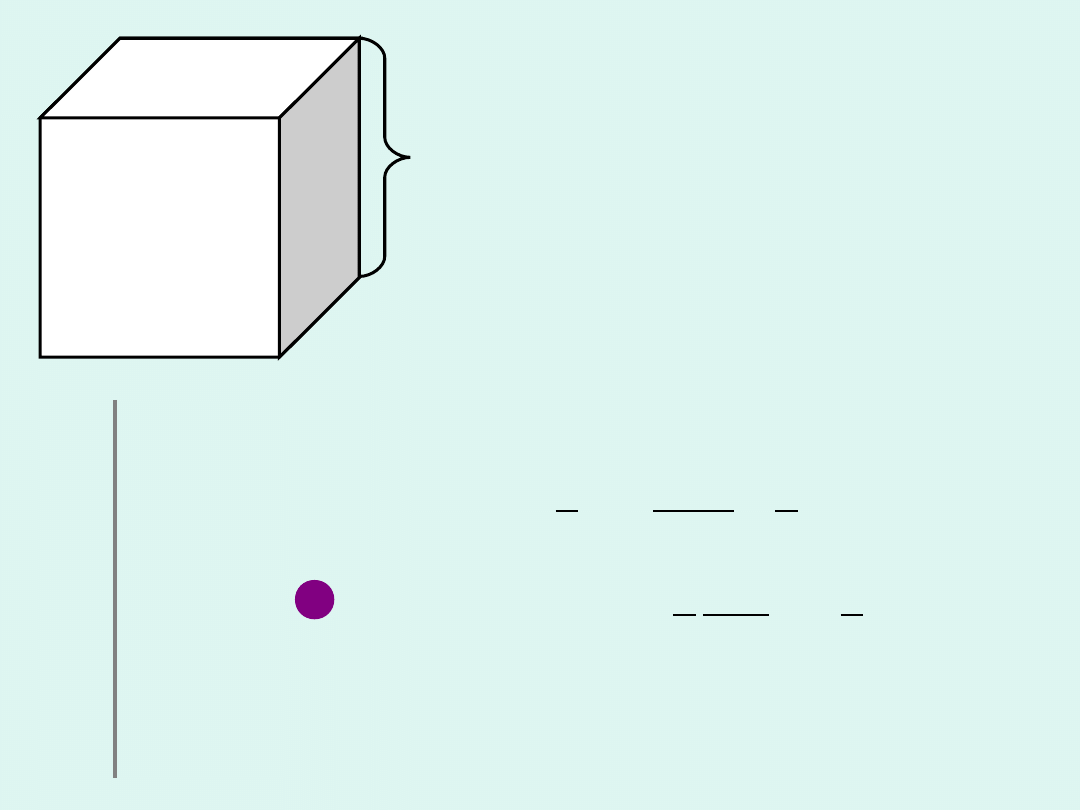
l
N
A
W sześcianie o boku
l
zamknięty
jest
1 mol (N
A
)
cząsteczek, każda o
masie
m
poruszająca się ze średnią
szybkością
v
.
Cząsteczki zderzając się ze
ścianami naczynia przekazują im
pęd, wywierając na nie ciśnienie.
2
A
A kin
kin
B
A
2
mv
2
pV
N
N E
RT
3
2
3
3 R
3
E
T
k T
2 N
2
=
=
=
=
=
Stała Boltzmanna
k
B
= R/N
A
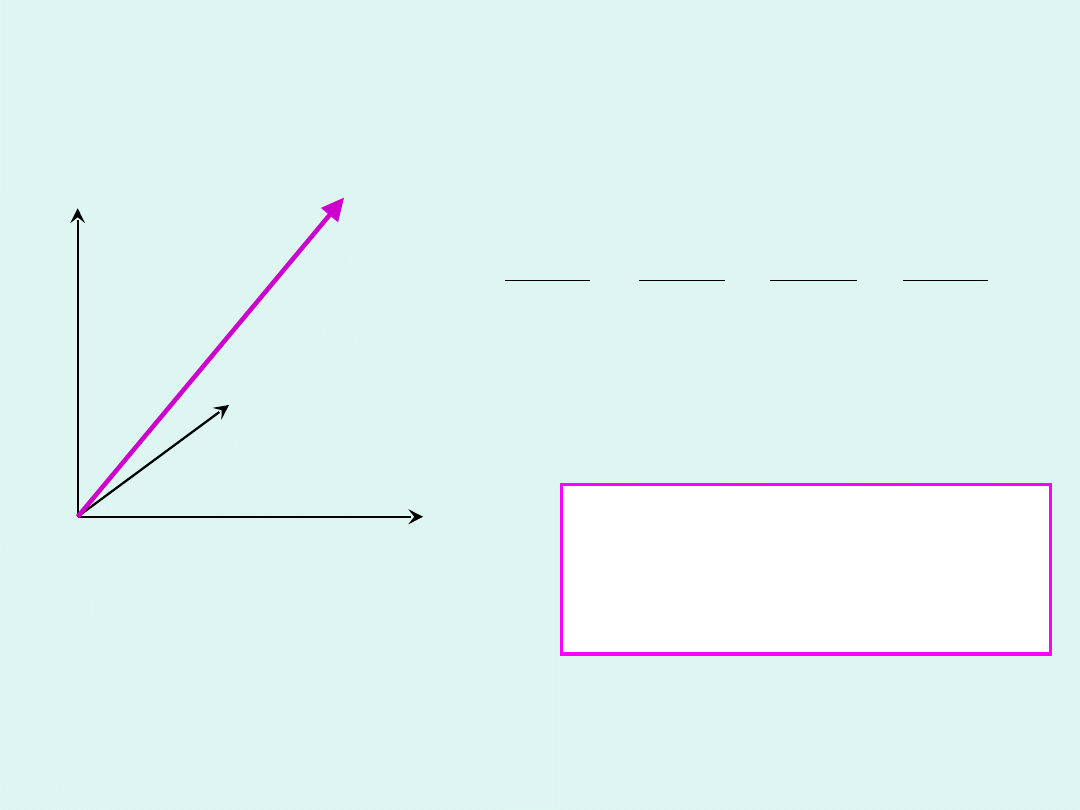
x, v
x
z, v
z
y, v
y
v
Zasada ekwipartycji (równego podziału) energii
z
,
kin
y
,
kin
x
,
kin
kin
2
z
2
y
2
x
2
z
y
x
E
E
E
E
2
mv
2
mv
2
mv
2
mv
v
v
v
v
+
+
=
+
+
=
+
+
=
Na każdy stopień swobody
ruchu cząsteczki przypada
energia wynosząca
½k
B
T
.

Gazy rzeczywiste
Wszystkie gazy są gazami rzeczywistymi. Nie spełniają
równania Clapeyrona.
nRT
z
pV
⋅
=
z
– współczynnik ściśliwości
Zależy od temperatury i ciśnienia. Dla gazu doskonałego
z = 1; dla gazu rzeczywistego dąży do 1, gdy ciśnienie
dąży do zera.
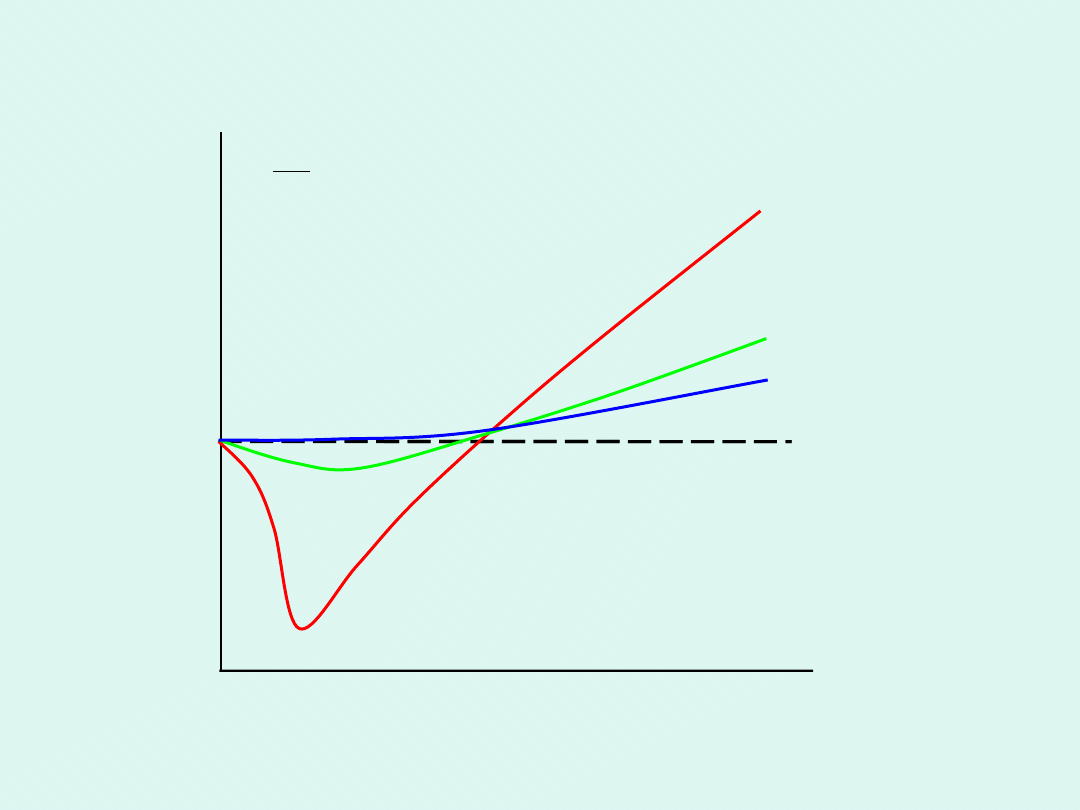
RT
pV
z
=
Zależność współczynnika ściśliwości od ciśnienia
p
T
2
T
3
T
1
<
T
2
<
T
3
T
1
1
gaz doskonały
z = 1

Gazy rzeczywiste
Do gazu rzeczywistego nie można zastosować modelu opisującego
gaz doskonały.
Cząsteczki gazu rzeczywistego posiadają pewną objętość, której
nie można zaniedbać.
Cząsteczki gazu rzeczywistego oddziaływają ze sobą na
odległość.
Oddziaływania międzycząsteczkowe mają charakter odpychający i
przyciągający. Gdy odległość pomiędzy cząsteczkami jest niewielka
i energia termiczna cząsteczek jest też stosunkowo mała, zderzenia
pomiędzy nimi nie są elastyczne. Przeważają oddziaływania
przyciągające i cząsteczki „sklejają się” z sobą, a gaz się skrapla.
Równanie opisujące gaz rzeczywisty musi uwzględniać objętość
własną
cząsteczek
i
oddziaływania
międzycząsteczkowe
(przyciąganie cząsteczek).

Równanie van der Waalsa
(
)
RT
b
V
V
a
p
2
=
−
+
dla 1 mola gazu
dla
n
moli gazu
(
)
nRT
nb
V
V
an
p
2
2
=
−
+
a,b
– stałe charakterystyczne dla danego gazu, niezależne od
temperatury
a
– stała związana z oddziaływaniami międzycząsteczkowymi
(przyciąganiem)
b
- stała związana z objętością własną cząsteczek
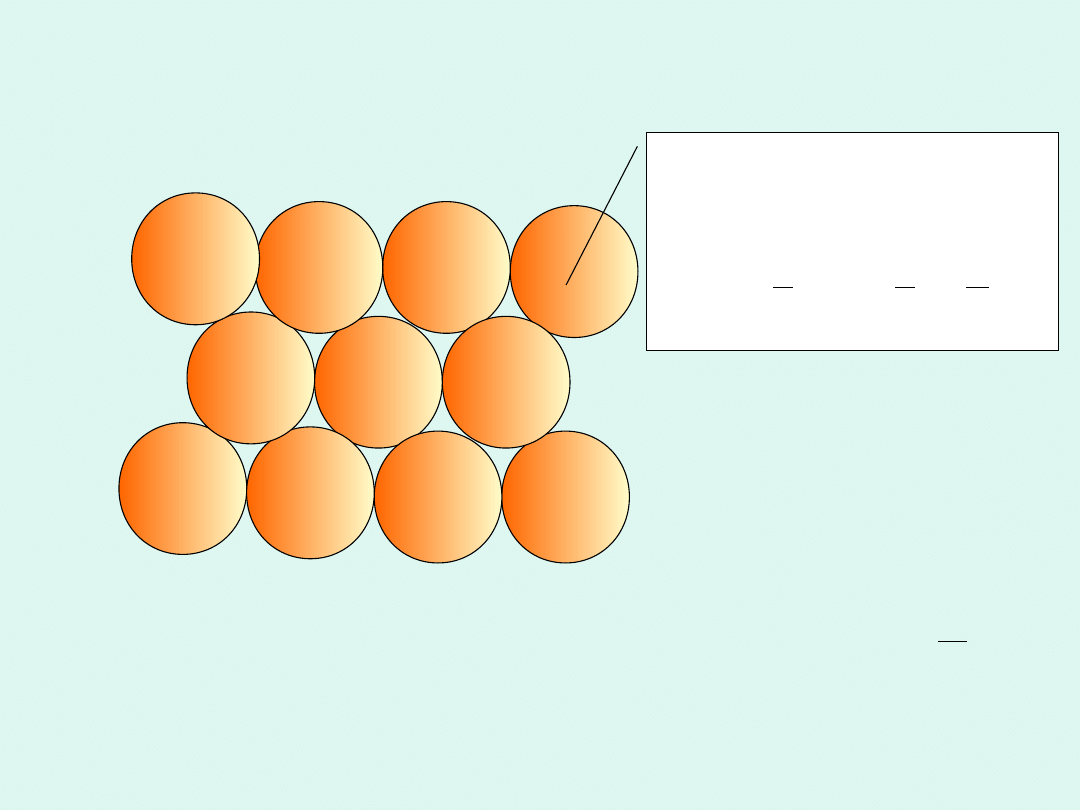
Pojedyncza cząsteczka
ma objętość :
3
3
cz
2
3
4
r
3
4
V
σ
Π
=
Π
=
1 mol cząsteczek może
zająć najgęściej
upakowany, objętość :
3
A
cz
A
r
3
4
N
4
V
N
4
b
Π
=
=
Interpretacja stałej van der Waalsa b
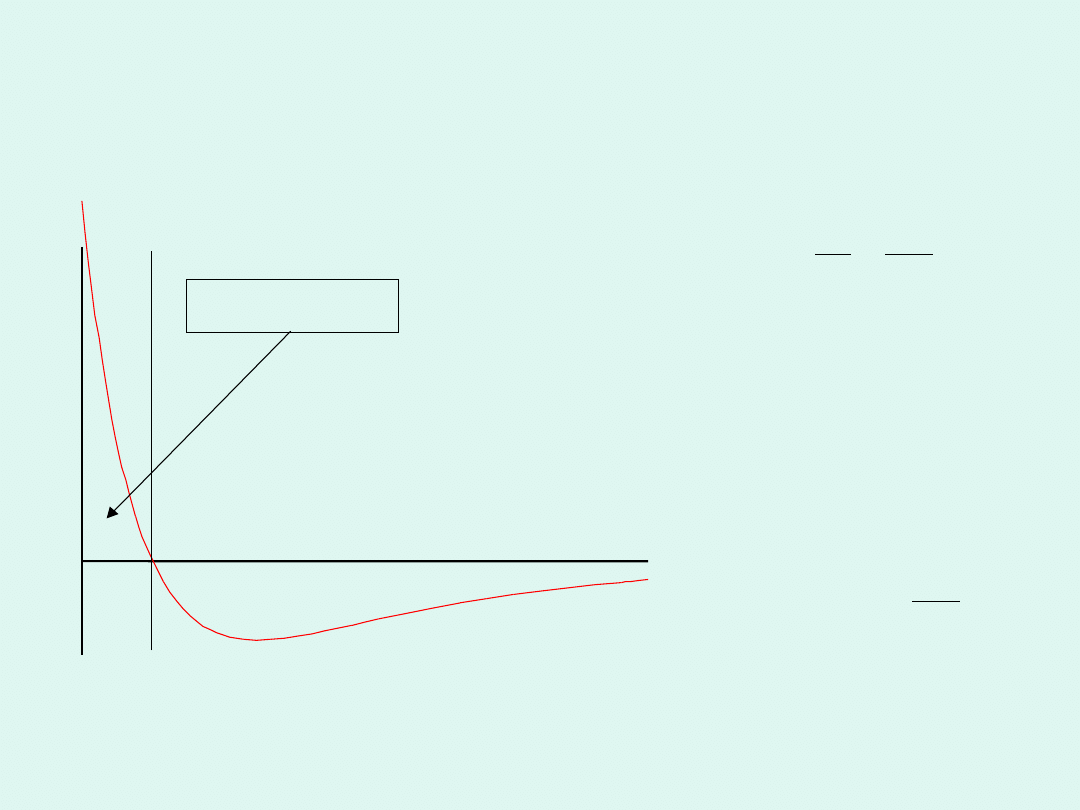
Oddziaływania pomiędzy rzeczywistymi
cząsteczkami
12
6
r
B
r
A
E
+
−
=
odległość pomiędzy cząsteczkami
E
przewaga przyciągania
przewaga odpychania
0
Siły odpychające są
istotne tylko dla bardzo
małych odległości
pomiędzy cząsteczkami,
wobec tego :
6
r
A
E
−
≈

Punkt krytyczny
jest to taki stan substancji,
określony przez parametry : ciśnienie krytyczne,
temperatura krytyczna i objętość krytyczna, w
którym zanika różnica pomiędzy cieczą a parą.
Gazu nigdy nie można skroplić w temperaturze
wyższej od temperatury krytycznej.
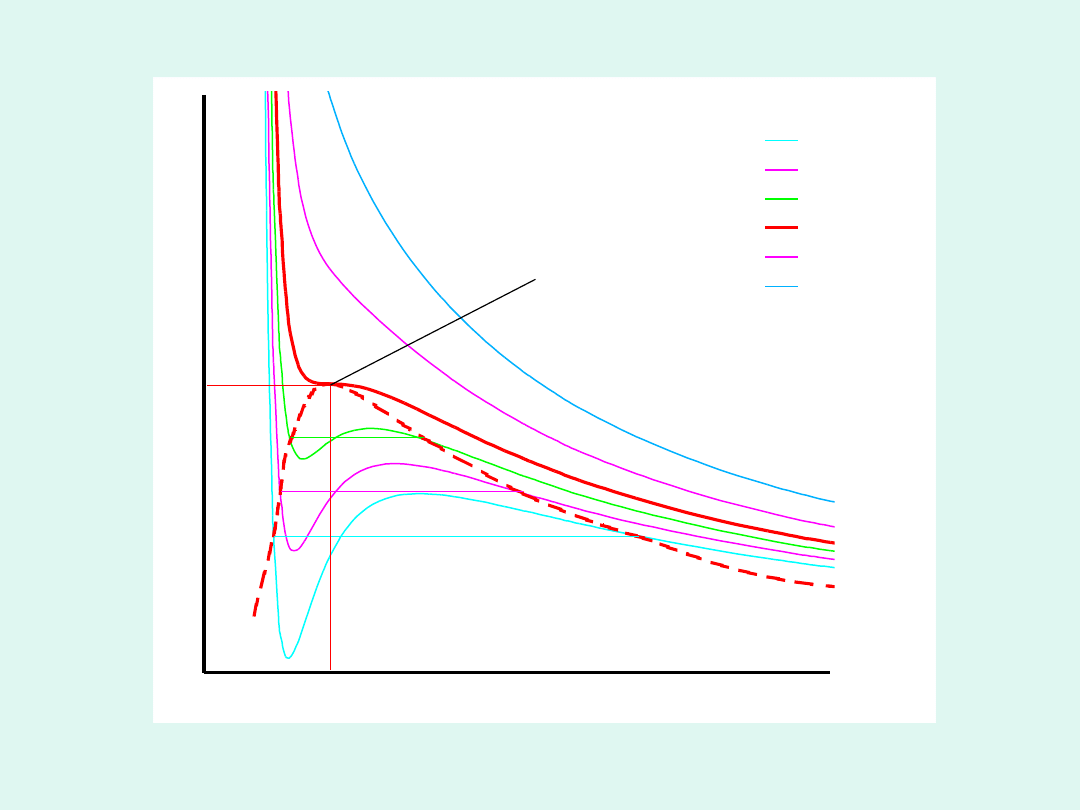
V
p
T1
T2
T3
T4
T5
T6
T
1
< T
2
< T
3
<
T
4
< T
5
< T
6
punkt krytyczny
V
c
p
c
Izotermy van der Waalsa
W punkcie krytycznym mamy punkt przegięcia na
izotermie.
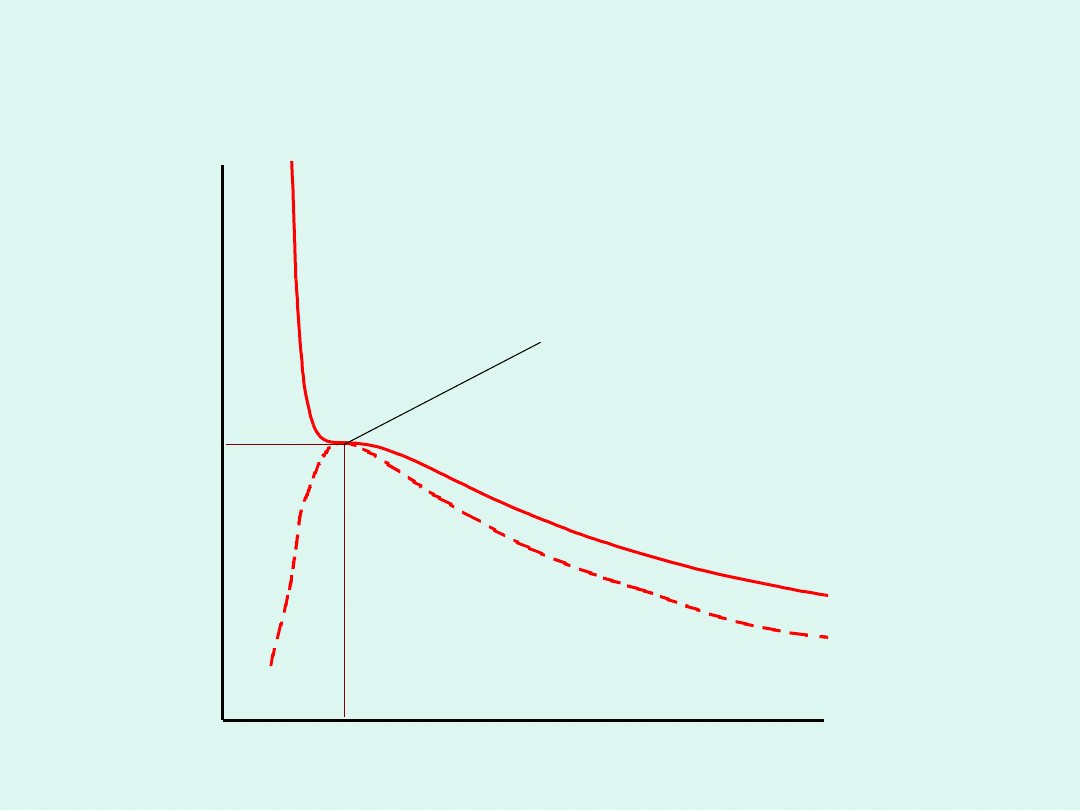
Obszary występowania gazu i cieczy dla gazu
rzeczywistego
V
p
punkt krytyczny
V
c
p
c
gaz + ciecz
gaz
gaz
ciecz
Document Outline
- Slajd 1
- Slajd 2
- Slajd 3
- Slajd 4
- Slajd 5
- Slajd 6
- Slajd 7
- Slajd 8
- Slajd 9
- Slajd 10
- Slajd 11
- Slajd 12
- Slajd 13
- Slajd 14
- Slajd 15
- Slajd 16
- Slajd 17
- Slajd 18
- Slajd 19
- Slajd 20
- Slajd 21
- Slajd 22
Wyszukiwarka
Podobne podstrony:
Pojecie zrodel prawa id 370403 Nieznany
Filozofia prawa id 170654 Nieznany
Ekspertyza prawa id 156870 Nieznany
3 Zrodla prawa id 33311 Nieznany
28 10 Podstawy Prawa id 31911 Nieznany (2)
encyklopedia prawa id 161301 Nieznany
Pojecie zrodel prawa id 370403 Nieznany
8 Cwiczenia rozne id 46861 Nieznany
Prawa czlowieka id 385273 Nieznany
Prawa czlowieka a policja id 38 Nieznany
Prawa gazowe 2 id 385360 Nieznany
kartki rozne id 729745 Nieznany
kmd prawa logiczne id 236768 Nieznany
gazy laserowe id 186804 Nieznany
PRAWA PRZEPLYWU A id 385444 Nieznany
Zrodla prawa UE id 106182 Nieznany
Gazy doskonale id 186794 Nieznany
PRAWA PRZEPLYWU B id 385446 Nieznany
więcej podobnych podstron