
Chemia Fizyczna, ćwiczenia rachunkowe
Chemia, semestr IV
(1) Przewodnictwo roztworów elektrolitów
1. Naczyńko konduktometryczne napełnione 0,1 mol
.
dm
-3
roztworem KCl w temp. 298 K ma
opór 420 Ω. Przewodnictwo właściwe 0,1 mol
.
dm
-3
roztworu KCl w tej temp. wynosi 0,012852
Ω
-1.
cm
-1
. Jeżeli to samo naczyńko napełniono 0,02 mol
.
dm
-3
roztworem CuSO
4
, to ma ono opór
1440 Ω. Oblicz przewodnictwo równoważnikowe roztworu CuSO
4
o tym stężeniu.
2. Oblicz stopień dysocjacji kwasu mrówkowego w 1,01 mol
.
dm
-3
roztworze wodnym, jeżeli ten
roztwór ma przewodnictwo właściwe równe 1,25
.
10
-4
S
.
cm
-1
, a graniczne przewodnictwo
równoważnikowe kwasu mrówkowego jest równe 364,5 S
.
cm
2.
mol
-1
.
3. Po uwzględnieniu poprawki na przewodnictwo właściwe wody użytej do sporządzenia
roztworu, przewodnictwo właściwe nasyconego roztworu wodnego AgCl w temp. 25
o
C wynosi
1,887 μS
.
cm
-1
. Oblicz iloczyn rozpuszczalności chlorku srebra w tej temp. wiedząc, że λ
∞
(Ag
+
) =
62 S
.
cm
2.
mol
-1
, λ
∞
(Cl
-
) = 75 S
.
cm
2.
mol
-1
.
4. Oblicz graniczne przewodnictwo równoważnikowe kwasu fosforowego (zaniedbując dalsze
stopnie dysocjacji poza pierwszym) na podstawie następujących danych: Λ
∞
(HCl) = 378,3
S
.
cm
2.
mol
-1
, Λ
∞
(NaH
2
PO
4
) = 70,0 S
.
cm
2.
mol
-1
, Λ
∞
(NaCl) = 109,0 S
.
cm
2.
mol
-1
.
5. Próbkę wody pobraną z dużego zbiornika umieszczono w naczyńku konduktometrycznym.
Zmierzona rezystancja wynosiła R
1
= 9200 Ω. Gdy to samo naczyńko napełniono 0,02 mol
.
dm
-3
roztworem KCl, rezystancja wynosiła R
2
= 85 Ω. Do zbiornika wsypano 0,50 kg chlorku potasu
i zawartość wymieszano. Stwierdzono, że tym razem rezystancja naczyńka pomiarowego
wypełnionego próbką zawartości zbiornika wynosiła R
3
= 7800 Ω. Wyznacz objętość zbiornika,
znając dodatkowo: Λ(0,02 M KCl) = 138,3 S
.
cm
2.
mol
-1
, Λ
∞
(KCl) = 148,9 S
.
cm
2.
mol
-1
.
6. 100 cm
3
0,01 M roztworu HCl miareczkowano za pomocą 1 M roztworu KOH. Przewodnictwo
mierzono w sposób ciągły, stosując zanurzeniowe naczyńko konduktometryczne o stałej równej
0,3 cm
-1
. Przyjmując, że przewodnictwa równoważnikowe jonów H
+
, OH
-
, Cl
-
i K
+
wynoszą
odpowiednio 350, 200, 75 i 70 S
.
cm
2.
mol
-1
, oblicz (zaniedbując efekt rozcieńczenia):
(a) przewodnictwo właściwe i rezystancję wyjściowego roztworu HCl,
(b) przewodnictwo właściwe roztworu w punkcie zobojętnienia oraz roztworu zawierającego
20% nadmiar KOH.

Chemia Fizyczna, ćwiczenia rachunkowe
Chemia, semestr IV
(2) Ruchliwość jonowa i liczby przenoszenia
1. Przewodnictwo właściwe 0,1 mol
.
dm
-3
roztworu KCl wynosi 0,01289 S
.
cm
-1
. Jaką rezystancję
posiada naczyńko wypełnione tym roztworem, jeżeli powierzchnia elektrod wynosi 1,920 cm
2
,
a odległość pomiędzy nimi 1,112 cm? Z jaką prędkością poruszają się jony Cl
-
, jeżeli przyłożono
napięcie 2 V? λ
∞
(Cl
-
) = 75 S
.
cm
2.
mol
-1
.
2. Liczba przenoszenia jonu K
+
w roztworze KBr w zakresie stężeń 0–0,2 mol
.
dm
-3
spełnia
równanie:
t
+
= 0,4849 – 0,00596 c
Przewodnictwo molowe 0,1 mol
.
dm
-3
roztworu KBr wynosi 131,4 S
.
cm
2.
mol
-1
. Oblicz ruchliwość
jonu K
+
w tym roztworze oraz prędkość jego poruszania się w polu o natężeniu 1000 V
.
cm
-1
.
3. Oblicz liczbę przenoszenia jonu Cu
2+
w roztworze, który jest jednocześnie 0,1 M względem
KBr i 0,01 M względem CuBr
2
. Przyjmij: λ(Cu
2+
) = 120 S
.
cm
2.
mol
-1
, λ(K
+
) = 63,7 S
.
cm
2.
mol
-1
,
λ(Br
-
) = 67,7 S
.
cm
2.
mol
-1
.
4. W temperaturze 25
o
C ruchliwości jonów H
+
i Cl
-
w wodzie wynoszą odpowiednio 3,623
.
10
-3
cm
2.
V
-1.
s
-1
oraz 7,91
.
10
-4
cm
2.
V
-1.
s
-1
. Jaki ułamek prądu przenoszony jest przez protony w 1,0
mol
.
dm
-3
roztworze wodnym kwasu solnego? Jaką część prądu będą one przenosić, jeśli do kwasu
wprowadzono taką ilość NaCl, aby końcowe stężenie soli wynosiło 1,0 mol
.
dm
-3
? Ruchliwość
jonu Na
+
wynosi 5,19
.
10
-4
cm
2.
V
-1.
s
-1
.
5. Metodę ruchomej granicy zastosowano do wyznaczenia liczby przenoszenia jonu NH
4
+
w ciekłym amoniaku. Stały prąd o natężeniu 5 mA przepuszczano przez 2500 s, w wyniku czego
granica utworzona pomiędzy jodkiem rtęci(II) a jodkiem amonu w roztworze amoniakalnym
przesunęła się o 286,9 mm w roztworze o stężeniu 0,01365 mol
.
kg
-1
, natomiast w roztworze
o stężeniu 0,04255 mol
.
kg
-1
o 92,03 mm. Oblicz liczbę przenoszenia NH
4
+
przy tych stężeniach.
Średnica rurki wynosi 4,146 mm, a gęstość ciekłego amoniaku 0,682 g
.
cm
-3
.
6. W rurze stosowanej do pomiaru liczb przenoszenia metodą ruchomej granicy znajdują się dwa
elektrolity: na dole CdCl
2
, u góry 0,05 m roztwór NaCl o = 4,785
.
10
-3
S
.
cm
-1
. Przekrój rury
wynosi 0,950 cm
2
. Przy natężeniu prądu 5,45 mA granica między roztworami przesunęła się o 1,80
cm w ciągu 50 min. Wyznacz natężenie pola elektrycznego w roztworze NaCl oraz ruchliwość
jonów Na
+
.
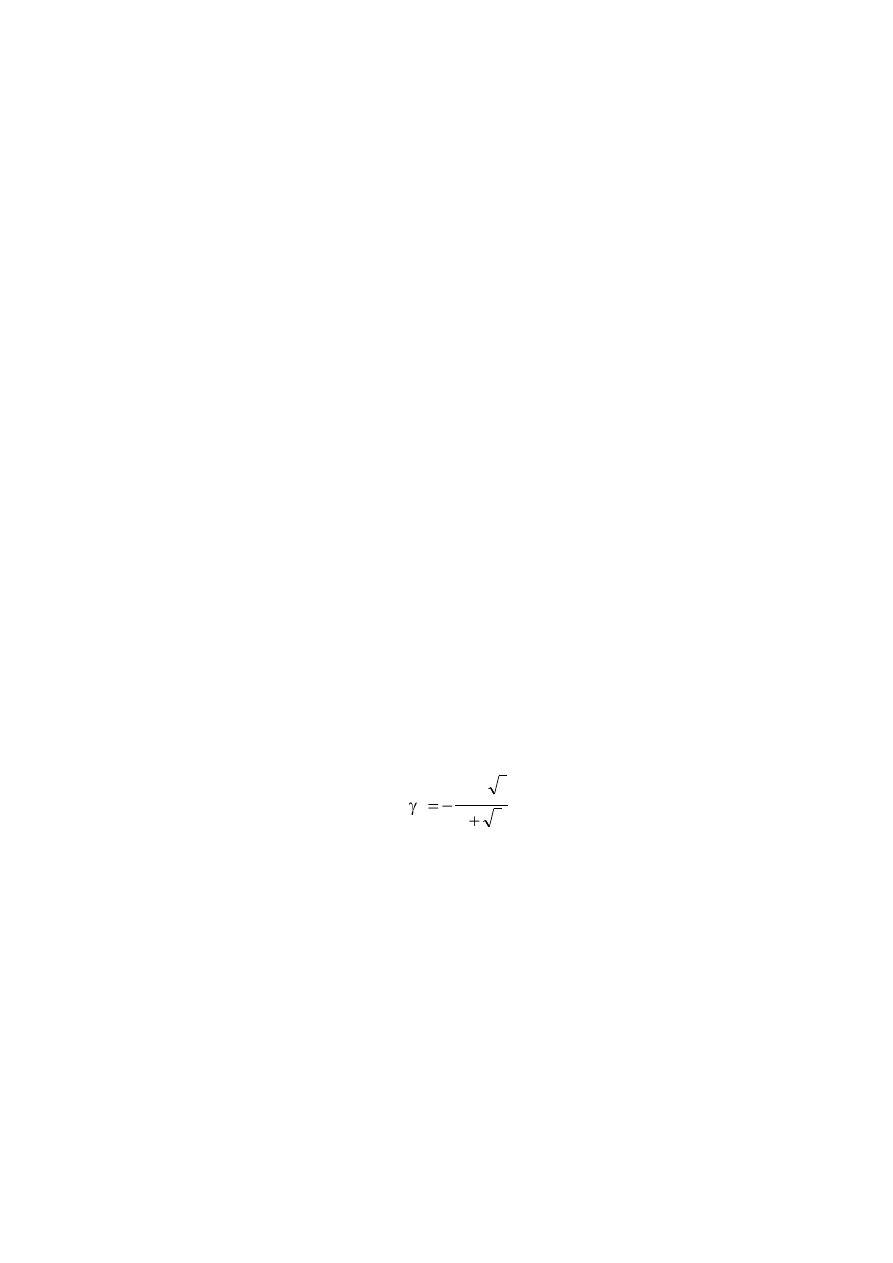
Chemia Fizyczna, ćwiczenia rachunkowe
Chemia, semestr IV
(3) Aktywność elektrolitów
1. Oblicz siłę jonową 0,01 mol
.
dm
-3
roztworów następujących elektrolitów: NaCl, CaCl
2
, AlCl
3
,
Al
2
(SO
4
)
3
, a także siłę jonową roztworu 0,1 mol
.
dm
-3
KCl + 0,1 mol
.
dm
-3
CuSO
4
.
2. Oblicz średni współczynnik aktywności elektrolitu w 0,001 mol
.
dm
-3
roztworach KCl, CaCl
2
,
oraz AlCl
3
, korzystając z granicznej postaci równania Debye’a-Hückla, a także średni
współczynnik aktywności KCl w roztworze 0,002 mol
.
dm
-3
KCl + 0,001 mol
.
dm
-3
AlCl
3
.
3. W temperaturze 25
o
C średni współczynnik aktywności CaCl
2
w roztworze wodnym
o molalności 0,100 mol
.
kg
-1
wynosi 0,524. Jaki błąd procentowy popełnia się, obliczając wartość
tego współczynnika na podstawie granicznego prawa Debye’a-Hückla?
4. W środowisku obojętnym dominującymi formami występowania wanadu(V) w roztworze
wodnym są H
2
VO
4
-
oraz V
4
O
12
4-
. W temperaturze 50
o
C stała równowagi reakcji
4H
2
VO
4-(aq)
→ V
4
O
124-(aq)
+ 4H
2
O
wynosi 106,4. Jaki jest rozkład wanadu w 50
o
C pomiędzy oba powyższe aniony dla całkowitego
stężenia wanadu 0,01 mol
.
kg
-1
i przy jednostkowej sile jonowej roztworu? W celu obliczenia
współczynników aktywności skorzystaj z poniższej postaci rozszerzonego równania Debye’a-
Hückla, biorąc A = 0,5373 i I = 1,0.
I
1
I
Az
log
2
i
i
5. Oblicz pH 0,03 mol
.
dm
-3
roztworu H
2
SO
4
jako wykładnik stężenia jonów wodorowych,
a następnie korzystając z definicji termodynamicznej (pH = -log a
H+
). Porównaj otrzymane wyni-
ki, zaś współczynnik aktywności H
+
oszacuj na podstawie granicznego prawa Debye’a-Hückla.
6. Oblicz stężenie molowe roztworu CuCl
2
, jeżeli aktywność jonów chlorkowych wynosi 1,84
.
10
-2
mol
.
dm
-3
i moc jonowa roztworu I = 0,07. Do oszacowania współczynnika aktywności wykorzystaj
postać równania Debye’a-Hückla podaną w zad. 4.

Chemia Fizyczna, ćwiczenia rachunkowe
Chemia, semestr IV
(4) Ogniwa galwaniczne
1. Rozpuszczalność AgIO
3
wynosi 1,77
.
10
-4
mol
.
dm
-3
w temperaturze 25
o
C. Wyznacz potencjał
standardowy półogniwa Ag|AgIO
3
|IO
3
-
w tej temperaturze wiedząc, że potencjał standardowy
półogniwa Ag|Ag
+
wynosi 0,799 V.
2. Standardowa siła elektromotoryczna ogniwa Ag|Ag
2
SO
4,(s)
|H
2
SO
4
(0,1 m)|H
2
(P
o
)|Pt wynosi
0,627 V. Oblicz E
298
przyjmując γ
±
(H
2
SO
4
) = 0,7.
3. W temperaturze 25
o
C siła elektromotoryczna ogniwa Na|NaI (0,1 m w C
2
H
5
NH
2
)|
Na (0,206% w Hg) wynosi 0,8453 V. W tej samej temperaturze SEM ogniwa Na (0,206% w Hg)|
NaCl
(aq)
(0,1005 m)|Hg
2
Cl
2,(s)
|Hg wynosi 2,2676 V. Wiedząc, że średni jonowy współczynnik
aktywności 0,1005 m NaCl wynosi 0,778, a potencjał standardowy półogniwa Cl
-
|Hg
2
Cl
2,(s)
|Hg =
0,2681 V, oblicz potencjał standardowy półogniwa Na|Na
+
(aq)
w temperaturze 25
o
C.
4. Podaj schemat ogniwa, w którym zachodzi reakcja:
Pb + Hg
2
SO
4,(s)
= PbSO
4,(s)
+ 2Hg
Jaka jest siła elektromotoryczna tego ogniwa w temperaturze 25
o
C, gdy jako elektrolit zastosuje
się nasycony roztwór obydwu soli? K
so
(Hg
2
SO
4
) = 6,6
.
10
-7
, K
so
(PbSO
4
) = 1,6
.
10
-8
.
5. Oblicz SEM ogniwa Pt|H
2
(10
5
Pa)|HCl (m
1
)¦HCl (m
2
)|H
2
(10
5
Pa)|Pt, mając dane: m
1
= 0,01;
γ
±
(0,01 m HCl) = 0,904; m
2
= 0,001; γ
±
(0,001 m HCl) = 0,965; t(H
+
) = 0,825.
6. Potencjał standardowy półogniwa miedziowego w roztworze jonów miedzi świadczy o tym, że
nieskompleksowany jon Cu
+
jest niestabilny w roztworze wodnym i ulega reakcji dysproporcjonacji
2Cu
+
= Cu
2+
+ Cu. Oblicz równowagową aktywność jonów Cu
+
w roztworze wodnym w temp.
25
o
C, jeśli równowagową aktywność jonów Cu
2+
przyjąć za równą jedności. Dane są potencjały
standardowe następujących półogniw:
Cu
2+
+ e = Cu
+
E
o
1
= 0,153 V
Cu
2+
+ 2e = Cu
E
o
2
= 0,337 V
Cu
+
+ e = Cu
E
o
3
= 0,521 V

Chemia Fizyczna, ćwiczenia rachunkowe
Chemia, semestr IV
(5) Termodynamika reakcji biegnącej w ogniwie
1. W pewnym zakresie temperatury zmierzono bardzo dokładnie potencjał standardowy
półogniwa Ag, AgCl|Cl
-
. Uzyskane wyniki opisano za pomocą następującego wyrażenia:
E
o
/V = 0,23659 – 4,8564
.
10
-4
(t/
o
C) – 3,4205
.
10
-6
(t/
o
C)
2
+ 5,869
.
10
-9
(t/
o
C)
3
Oblicz standardową entalpię i standardową entalpię swobodną tworzenia oraz entropię jonu
Cl
-
(aq)
w temperaturze 25
o
C.
2. W ogniwie Zn|ZnCl
2
(0,005 m)|Hg
2
Cl
2
|Hg zachodzi reakcja:
Zn + Hg
2
Cl
2,(s)
= ZnCl
2,(aq)
+ 2Hg
Wiedząc, że E
o
(Zn|Zn
2+
) = -0,7628 V i E
o
(Cl
-
|Hg
2
Cl
2
|Hg) = +0,2676 V, oraz że zmierzona
SEM ogniwa wynosi +1,2272 V, oblicz: (1) standardową SEM ogniwa, (2) ΔG, ΔG
o
oraz K
a
dla reakcji zachodzącej w ogniwie, (3) γ
±
(0,005 m ZnCl
2
) na podstawie pomiaru SEM ogniwa,
(4) γ
±
(0,005 m ZnCl
2
) na podstawie granicznego prawa Debye’a-Hückla. Znając współczynnik
temperaturowy SEM ogniwa, (∂E/∂T)
P
= -4,8564
.
10
-4
V
.
K
-1
, oblicz ponadto ΔS i ΔH reakcji.
3. Znane są następujące dane (w temp. 25
o
C): E
o
(Ag|Ag
+
) = +0,799 V, K
so
(Ag
2
SO
4
) = 7,7
.
10
-5
.
Na tej podstawie oblicz SEM ogniwa Ag, Ag
2
SO
4
|H
2
SO
4
(0,001 m)|H
2
(10
5
Pa)|Pt, stosując
średni jonowy współczynnik aktywności elektrolitu wyznaczony na podstawie granicznego prawa
Debye’a-Hückla. Oblicz ΔG, ΔS i ΔH reakcji w ogniwie wiedząc, że (∂E/∂T)
P
= +0,002 V
.
K
-1
.
4. Oblicz E
o
, ΔG
o
oraz K
a
reakcji:
½Cu + ½Cl
2,(g)
= ½Cu
2+
+ Cl
-
w oparciu o znalezione w tablicach potencjały standardowe odpowiednich półogniw.
5. Potencjał standardowy półogniwa redoks Fe
3+
|Fe
2+
wynosi E
o
298
= +0,771 V. Standardowe
entropie tworzenia jonów Fe
3+
(aq)
i Fe
2+
(aq)
wynoszą odpowiednio –293,3 i –113,4 J
.
K
-1.
mol
-1
.
Oblicz wartość E
o
273
tego półogniwa.
6. Dla reakcji 2Fe
3+
+ 2Hg = 2Fe
2+
+ Hg
2
2+
stała równowagi wynosi 0,018 w temp. 21
o
C
i 0,054 w temp. 35
o
C. Oblicz E
o
ogniwa, w którym zachodzi powyższa reakcja w temp. 45
o
C.

Chemia Fizyczna, ćwiczenia rachunkowe
Chemia, semestr IV
(6) Elektroliza. Prawa Faradaya. Wyznaczanie liczb przenoszenia metodą Hittorfa
1. Jak długo musi przepływać prąd o natężeniu 20 A przez wodny roztwór KCl w temp. 70
o
C,
aby otrzymać 1 kg KClO
3
? Załóż wydajność prądową procesu 100%.
2. Jak długo musi przepływać prąd o natężeniu 4 A przez wodny roztwór NiSO
4
, aby przedmiot
o powierzchni 400 cm
2
pokryć warstewką niklu o grubości 2
.
10
-3
mm? Załóż d(Ni) = 8,9 g
.
cm
-3
.
3. Prąd elektryczny przepływa przez dwa kulometry włączone szeregowo w obwód. Elektrody
w obu kulometrach są platynowe. Pierwszy kulometr zawiera wodny roztwór azotanu nieznanego
metalu. Drugi kulometr zawiera wodny roztwór H
2
SO
4
. Po upływie pewnego czasu na katodzie
pierwszego kulometru wydzieliło się 0,675 g metalu, a na katodzie drugiego kulometru wydzieliło
się 73,1 cm
3
H
2
w temperaturze 16
o
C pod ciśnieniem 770 mm Hg. Oblicz równoważnik
elektrochemiczny metalu.
4. Przez wodny roztwór 0,05 M KOH przepłynął prąd, wskutek czego w kulometrze miedzianym
wydzieliło się 31,8 mg miedzi. Roztwór z przestrzeni katodowej ważył 80 g, a miareczkując go
stwierdzono, że był on 0,0532 N. Oblicz liczbę przenoszenia jonów potasowych.
5. W aparacie Hittorfa posiadającym srebrną katodę i kadmową anodę poddano elektrolizie
0,8964 m roztwór CdI
2
. W czasie elektrolizy w szeregowo włączonym kulometrze srebrnym
wydzieliło się 1,3424 g srebra. Roztwór anodowy o wadze 34,1876 g poddano analizie wagowej
strącając 13,444 g jodku srebrowego. Oblicz liczbę przenoszenia jonów kadmowych i jodkowych
oraz skomentuj otrzymany wynik. Przyjmij M(AgI) = 234,80 g
.
mol
-1
, M(CdI
2
) = 366,25 g
.
mol
-1
.
6. Przed elektrolizą przestrzeń anodowa aparatu Hittorfa zawierała 0,1473 mval CuSO4 w 1 g H
2
O.
Przez aparat przepuszczono ładunek 1,372
.
10
-3
F. Liczba przenoszenia jonu Cu
2+
wynosi 0,366.
Oblicz końcowe stężenie Cu w przestrzeni anodowej zawierającej 28 g H
2
O dla przypadku:
(a) anody platynowej, (b) anody miedzianej.
Wyszukiwarka
Podobne podstrony:
elektrotechnika zadanie id 1593 Nieznany
Prad elektryczny zadania id 384 Nieznany
chemia zadania 2 id 113035 Nieznany
ELEKTRONIKA cw00 id 158827 Nieznany
ELEKTRONIKA cw05 id 158833 Nieznany
elektroforeza page id 158050 Nieznany
me zadanie 2 id 290295 Nieznany
elektrochemia simr03pl id 15797 Nieznany
plyta zadanie id 363191 Nieznany
elektrochemia simr09pl id 15797 Nieznany
ELEKTRONIKA cw02 id 424650 Nieznany
Dodatkowe zadania id 138777 Nieznany
formularze zadania id 179681 Nieznany
(budzet zadaniowy)id 1238 Nieznany (2)
ELEKTRONIKA cw01 id 158830 Nieznany
Elektronika W10 id 159018 Nieznany
CO zadania id 118396 Nieznany
więcej podobnych podstron