
Zjawiska powierzchniowe
Sorpcja
Sorpcja
Adsorpcja –
oddziaływanie między
cząsteczkami na
powierzchni sorbenta
Absorpcja –
oddziaływanie miedzy
cząsteczkami w całej
objętości sorbenta
Adsorpcja
Adsorpcja fizyczna –
oddziaływania
pomiędzy cząstkami to
głównie słabe siły Van
der Waalsa
Adsorpcja chemiczna -
oddziaływania mają
charakter wiązań
chemicznych

Pojęcia podstawowe
Adsorber –
faza adsorbująca
Adsorbat –
faza adsorbowana
Ilość adsorbatu oddziaływującego z adsorberem
w stałej temperaturze określa krzywa, nosząca
nazwę
izotermy adsorpcji
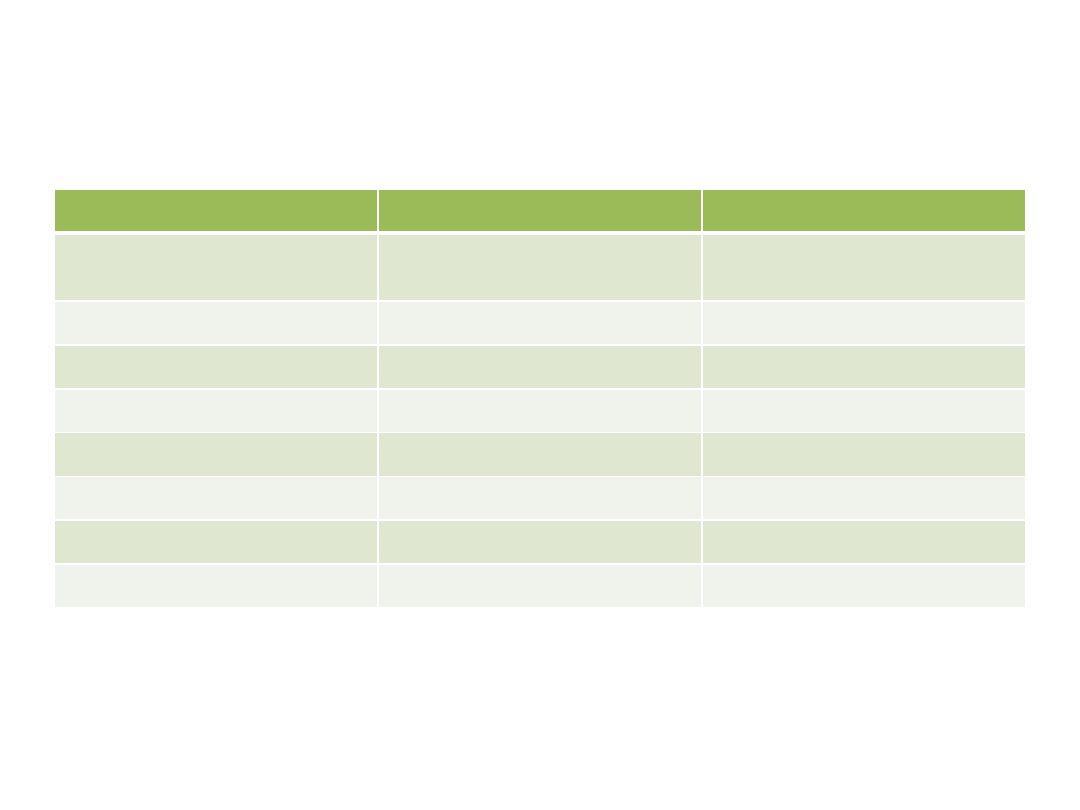
Porównanie adsorpcji fizycznej
i chemisorpcji
Adsorpcja fizyczna
Chemisorpcja
Przyczyna
oddziaływanie van der
Waalsa
wiązania jonowe lub
kowalencyjne,
Adsorbent
wszystkie ciała stałe
niektóre
Odwracalność procesu
odwracalna
raczej nieodwracalna
Temp.
niskie
generalnie wysokie
Ciepło sorpcji
niskie, 10 kJ/mol
wysokie, 80-200 kJ/mol
Szybkość
bardzo szybka
silnie zależy od temp.
Energia aktywacji
niska
wysoka
Pokrycie powierzchni
wielowarstwowe
jednowarstwowe

Izotermy adsorpcji
• Izoterma Langmuira,
• Izoterma Freundlicha,
• Izoterma BET

Założenia modelu Langmuira
• powierzchnia stałych adsorbentów ma na swej
powierzchni szczególnie aktywne miejsca zwane
centrami aktywnymi,
• proces adsorpcji zachodzi na centrach aktywnych,
• każde centrum może zaadsorbować tylko jedną cząstkę,
czyli adsorbent pokrywa się tylko jedną warstwą,
• cząsteczki zaadsorbowane na centrach adsorpcji nie
oddziałują wzajemnie na siebie,
• proces adsorpcji ma charakter dynamicznej równowagi
pomiędzy adsorpcją i procesem odwrotnym do
adsorpcji – desorpcją.

Stopień pokrycia powierzchni θ lub inaczej, ułamek
zapełnienia powierzchni określa wyrażenie:
gdzie:
n — liczba moli substancji zaadsorbowanej przez daną
masę adsorbentu (liczba zajętych centrów
adsorpcyjnych),
n
m
– liczba moli przy której następuje zapełnienie
wszystkich centrów adsorpcyjnych.
m
n
n

Zgodnie z tą definicją:
Szybkość adsorpcji jest proporcjonalna do
ciśnienia gazu i do ułamka powierzchni nie
obsadzonej:
Szybkość desorpcji jest proporcjonalna do
ułamka powierzchni pokrytej:
W stanie równowagi, szybkość adsorpcji i
desorpcji są sobie równe.
1
0
p
k
r
ads
1
'
k
r
ads
'
1
k
p
k
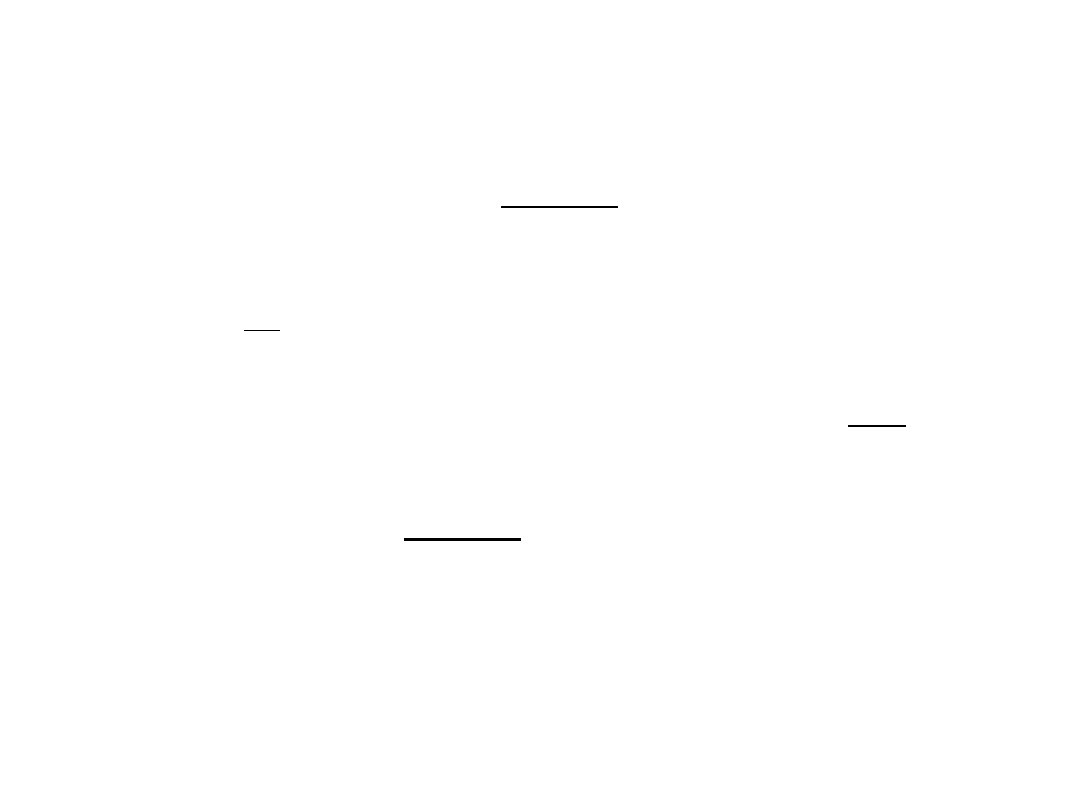
Po prostych przekształceniach otrzymujemy związek między
stopniem pokrycia powierzchni, a ciśnieniem w postaci:
gdzie: zwany jest współczynnikiem adsorpcji.
Uwzględniając definicję stopnia obsadzenia :
Zależność powyższa nosi nazwę izotermy Langmuira.
bp
bp
1
'
k
k
b
m
n
n
mol
bp
bp
n
n
m
1
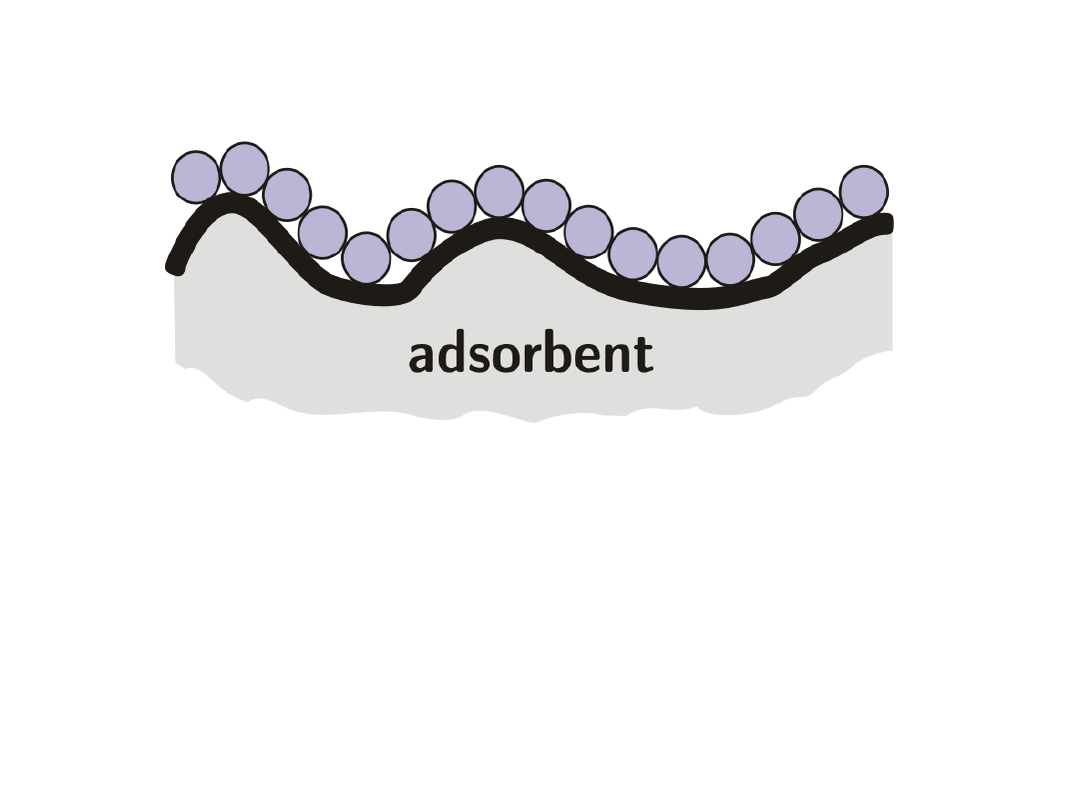
Schemat adsorpcji wg teorii Langmuira,
powierzchnia pokryta monowarstwą adsorbatu:
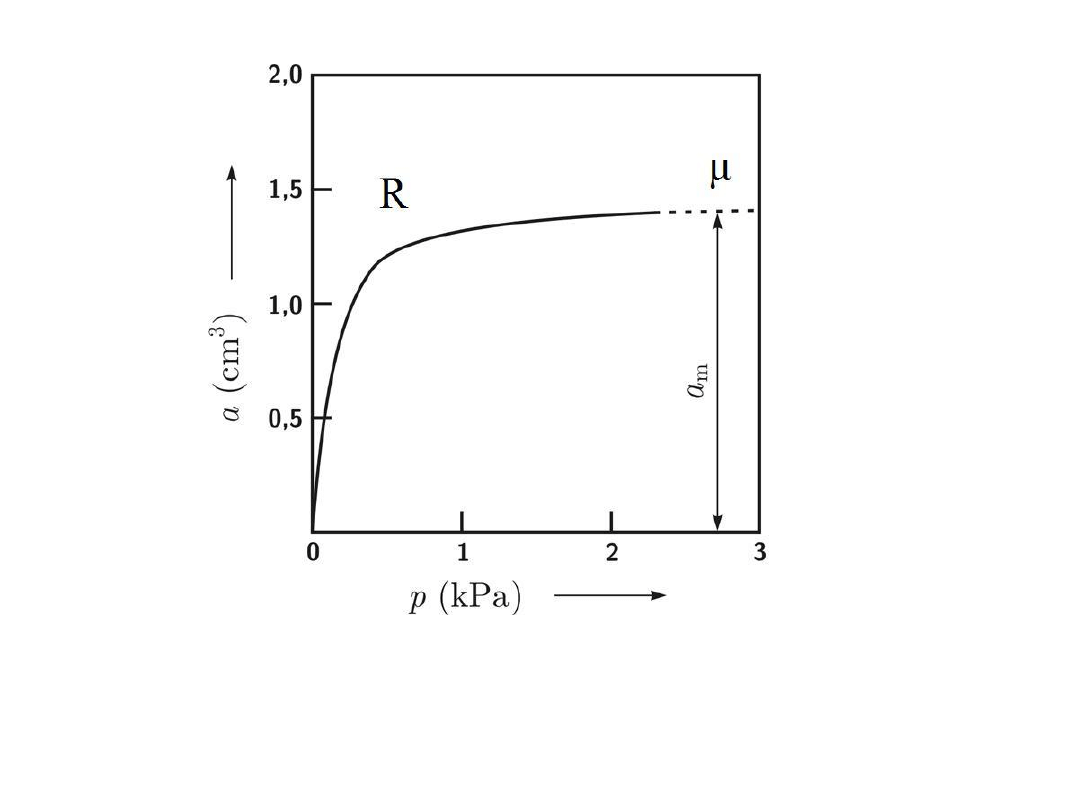
Izoterma adsorpcji wg teorii Langmuira
Izoterma Langmuira, opisuje dobrze przypadki chemisorpcji

Izoterma Fruendlicha
Adsorpcja na granicy faz ciało stał roztwór ciekły,
jest procesem bardziej złożonym od adsorpcji
gazów. Wielkość adsorpcji zależy tutaj od
oddziaływania pomiędzy adsorbentem, a
każdym ze składników roztworu. Najczęściej
stan równowagi adsorpcyjnej opisywany jest
przez empiryczne równanie Freundlicha.

Równanie empiryczne Freundlicha
a – oznacza jak poprzednio, liczbę moli substancji
zaadsorbowanej przez 1g adsorbentu,
c – stężenie molowe roztworu w stanie równowagi
adsorpcyjnej,
k i n – wielkości stałe (zależne od temperatury,
rodzaju adsorbentu i rodzaju substancji
adsorbowanej), n<1.
n
kc
a
Często stosuje się postać równania, określającą
masę substancji zaadsorbowanej i ułamkową
wartość wykładnika potęgowego:
gdzie:
x – oznacza masę substancji zaadsorbowanej z
roztworu przez m gramów adsorbentu,
k, c, n – pozostałe oznaczenia jak wyżej.
n
kc
m
x
1
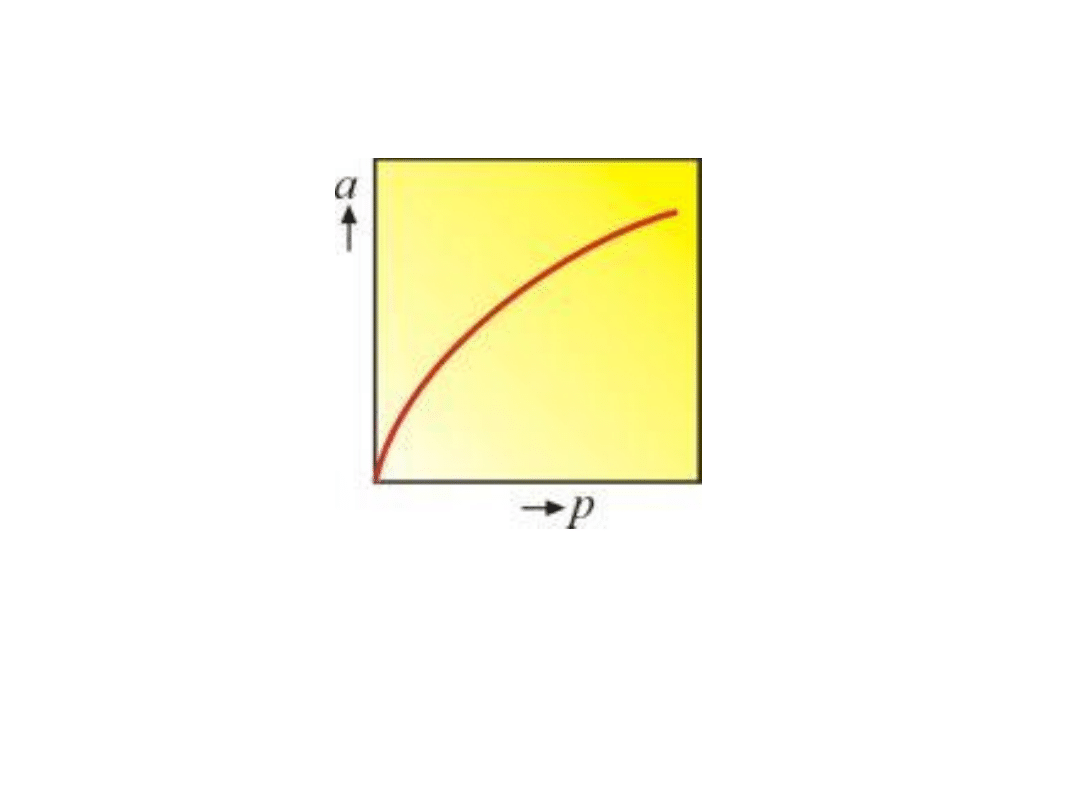
Izoterma adsorpcji Freundlicha
Wykres izotermy Freundlicha przypomina w ogólnym
przebiegu wykres izotermy Langumira, różni się od niej
jednakże brakiem prostej proporcjonalności między
ilością zaadsorbowanej substancji a stężeniem w
zakresie małych stężeń.
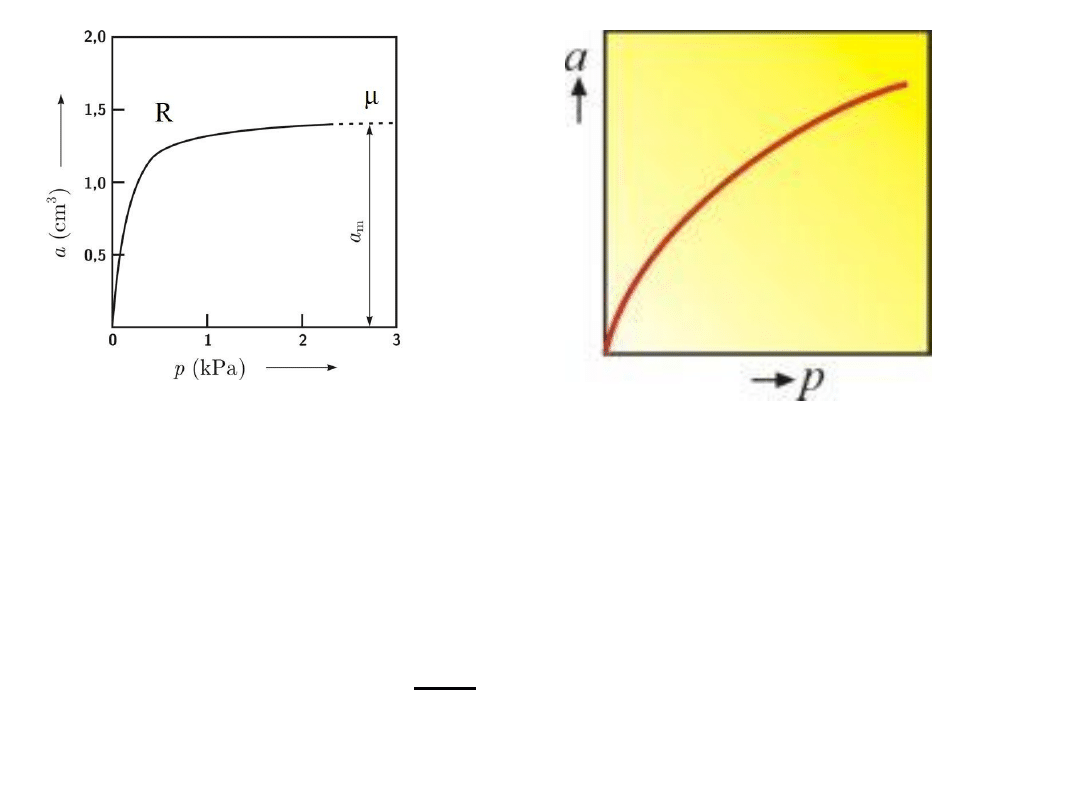
Wykres izotermy Freundlicha przypomina w ogólnym przebiegu
wykres izotermy Langumira, różni się od niej jednakże brakiem
prostej proporcjonalności między ilością zaadsorbowanej
substancji a stężeniem w zakresie małych stężeń.
e
dc
da
n 1
Izoterma BET
W przypadku adsorpcji fizycznej dochodzi do tworzenia się warstw
wieloczasteczkowych. Dzieje się tak dlatego, że ten sam rodzaj sił,
które odpowiedzialne są za adsorpcję fizyczna pierwszej warstwy
adsorbatu, działa też pomiędzy nią a dalszymi, zbliżającymi się do
powierzchni adsorbentu cząsteczkami.
http://upload.wikimedia.org/wikipedia/commons/thumb/6/6e/BET_izoterma_pl.png/800px-BET_izoterma_pl.png

Równanie opisujące ilość substancji zaadsorbowanej w takich warunkach
przez jednostkową masę adsorbentu, jako funkcję ciśnienia gazu
wyprowadzili S. Brunauer, H. Emmett, J. Teller (1938r). Równanie to znane
jest pod nazwą BET.
Równanie BET ma postać:
gdzie:
a, a
m
, p – mają znaczenie identyczne jak w równaniu Langumira,
p
0
–
jest prężnością pary nasyconej adsorbatu w temperaturze, w której
odbywa się adsorpcja,
C – jest pewną funkcją temperatury, określoną przez różnicę pomiędzy
ciepłem adsorpcji w pierwszej monomolekularnej warstwie i ciepłem
skraplania.
0
0
0
1
1
1
p
p
C
p
p
p
p
C
a
a
m
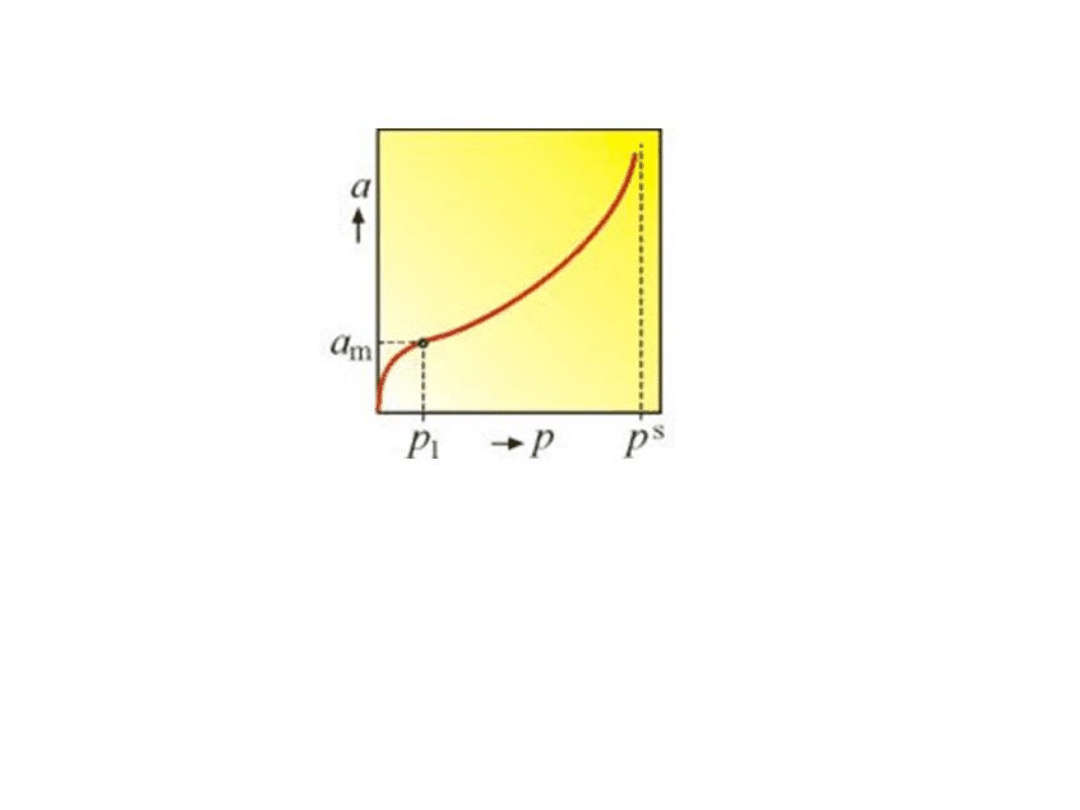
Izoterma adsorpcji typu BET
Na wykresie został zaznaczony punkt przegięcia krzywej. Położenie tego
punktu w przybliżeniu określa wartość a
m
tj. powierzchnię właściwą
adsorbentu.
Jeżeli C >> 1 i ciśnienie gazu zaadsorbowanego jest znacznie mniejsze od
prężności pary nasyconej, równanie BET przechodzi w równanie
Langmuira.

Układ dyspersyjny
Jest to układ dwóch faz, z których jedna, dzięki
znacznemu rozdrobnieniu, zyskała bardzo
dużą powierzchnię.
W każdym układzie dyspersyjnym wyróżnia się
fazę rozproszoną i fazę rozpraszającą
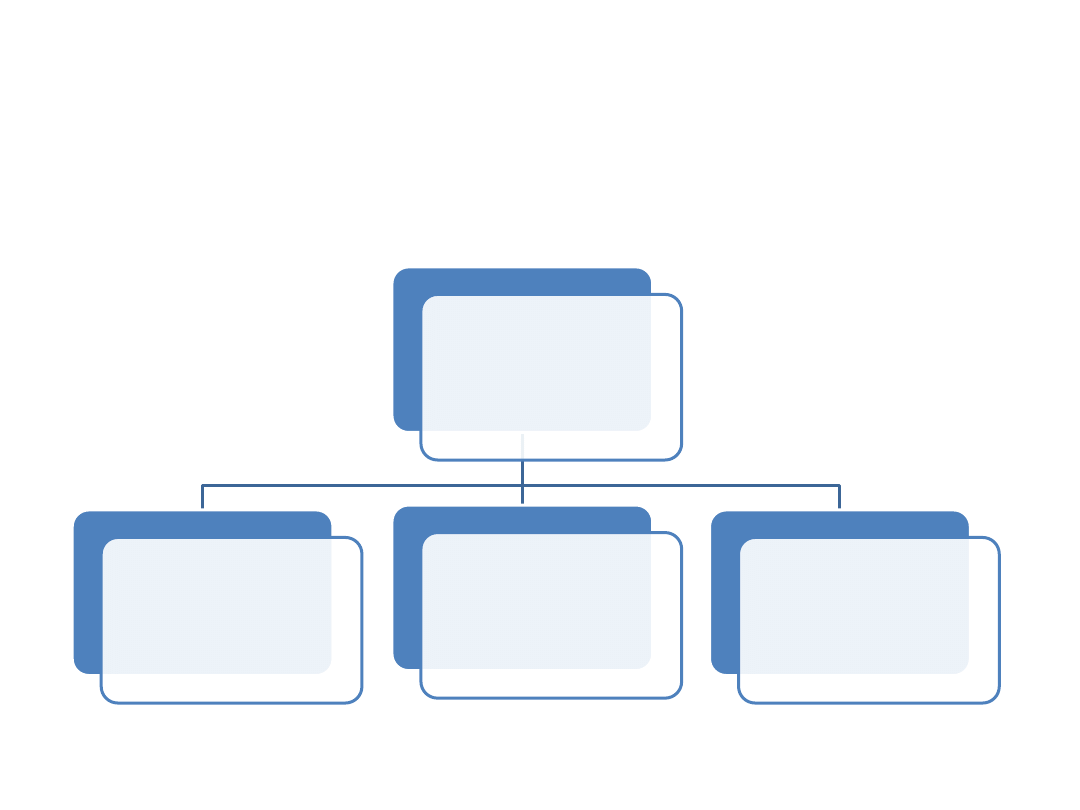
Podział układów dyspersyjnych
• Ze względu na rozmiar cząstek rozproszonych
Układy dyspersyjne
Roztwory
rzeczywiste
rozmiar cząstek
< 10 Å
Koloidy
10 Å < rozmiar
cząstek < 2000 Å
Mieszaniny
rozmiar cząstek >
2000 Å

Koloidy (zole)
Własności fizyczne roztworów koloidalnych:
• Efekt Tyndalla
http://www.google.pl/imgres?hl=pl&biw=1352&bih=639&tbm=isch&tbnid=oVb4fJbpDHHCsM:&imgrefurl=http://www.eszkola-wielkopolska.pl/eszkola/projekty/liceum1-
pleszew/swiatlo_i_dzwiek_wokol_nas/php/15.php&docid=cxEGbhiXPQdR7M&imgurl=http://www.eszkola-wielkopolska.pl/eszkola/projekty/liceum1-
pleszew/swiatlo_i_dzwiek_wokol_nas/images/zjawisko_Tyndalla.jpg&w=640&h=431&ei=3o-
xUev4Dqmq0QWUn4HIDg&zoom=1&ved=1t:3588,r:32,s:0,i:197&iact=rc&dur=683&page=3&tbnh=184&tbnw=273&start=32&ndsp=18&tx=201&ty=77
Koloidy (zole)
Własności fizyczne roztworów koloidalnych:
• Ruchy Browna
http://www.google.pl/url?sa=i&rct=j&q=&esrc=s&source=images&cd=&cad=rja&docid=uTIEE9_GbY0OaM&tbnid=kFxttFm_jGUpMM:&ved=&url=htt
p%3A%2F%2Fedukator.pl%2FCiecze%2C3805.html&ei=LJexUe6IE-Ky0QWf2oG4Aw&bvm=bv.47534661,d.d2k&psig=AFQjCNHvqQqo7jTKIrI7jpQ3ch2-
OUkc0w&ust=1370679409225099

Koloidy (zole)
Otrzymywanie koloidów:
• Metody dyspersyjne: rozdrabnianie w młynach
koloidalnych, za pomocą ultradźwięków,
rozpylanie katodowe, peptyzacja
• Metody kondensacyjne: hydroliza soli, reakcja
wymiany, reakcja redox, reakcja kondensacji i
polimeryzacji, zmiana rozposzczalnika
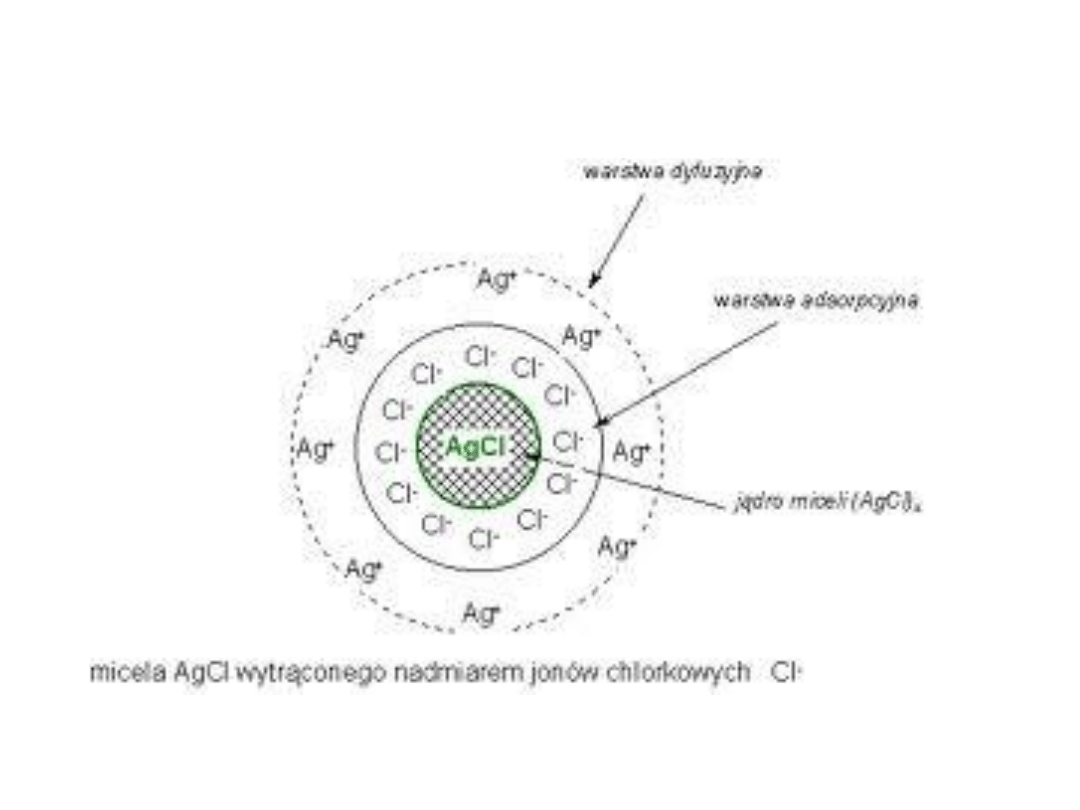
Budowa cząstki koloidalnej (micelii)
http://www.mlyniec.gda.pl/~chemia/images/micela.gif

Podział koloidów
Rozpuszczalnikiem jest woda:
• Koloidy hydrofilowe: ulegają hydratacji, a
woda wchodzi także w skład większych
agregatów
• Koloidy hydrofobowe: w mniejszym stopniu
hydratacji, a woda tworzy cienką warstwę na
powierzchni koloidu

Podział koloidów
Rozpuszczalnikiem jest inna ciecz:
• Koloidy liofilowe: ulegają solwatacji, a
rozpuszczalnik
wchodzi także w skład
większych agregatów
• Koloidy liofobowe: w mniejszym stopniu
solwatacji, a rozpuszczalnik tworzy cienką
warstwę na powierzchni koloidu

Koagulacja
Koagulacja
jest to proces zmniejszenia dyspersji
układu, powodujący sedymentację
(wytrącanie się) koloidu.
Zol Żel
Punkt
izoelektryczny
– jest to punkt, w którym
micele są całkowicie rozładowane (posiadają
zerowy potencjał), a koagulacja zachodzi
najszybciej.

Metody koagulacji
• dodanie do koloidalnego roztworu elektrolitu obniżającego
potencjał elektrokinetyczny, np. soli metali wielowartościowych,
polielektrolitów, surfaktantów, mocnych kwasów lub zasad;
• wytworzenie wodorotlenków metali, na których absorbują się
koloidy i cząstki zawiesinowe, (np. wodorotlenek żelaza lub glinu);
• stworzenie warunków do wzajemnego przyciągania się i aglomeracji
cząstek dzięki neutralizacji ładunków lub wytworzeniu ładunków
powierzchniowych o różnym znaku, (np. przez zmianę pH);
• mechaniczne mieszanie lub wstrząsanie;
• stężanie lub rozcieńczanie zolu;
• ogrzewanie;
• zamrażanie;
• naświetlanie promieniami rentgenowskimi, krótkofalowymi lub
ultrafioletem;
• naświetlanie radiochemiczne;
• wyładowania elektryczne;
• ultradźwięki.
Wyszukiwarka
Podobne podstrony:
Obróbka powierzchniowa i cieplna ściąga, Automatyka i Robotyka, Semestr 3, Obróbka cieplna i powierz
skrót wykładu, Automatyka i Robotyka, Semestr 3, Obróbka cieplna i powierzchniowa, wykłady
Fazy rozwoju materiałów - ściaga, Automatyka i Robotyka, Semestr 3, Obróbka cieplna i powierzchniowa
Pomiary twardości, Automatyka i Robotyka, Semestr 3, Obróbka cieplna i powierzchniowa, wykłady
Sprawozdanie - Zjawiska powierzchniowe. Adsorpcja kwasu, Studia, Chemia
Obróbka powierzchniowa i cieplna - ściąga 01, Automatyka i Robotyka, Semestr 3, Obróbka cieplna i po
Krystaliczna struktura metali - laborka, Automatyka i Robotyka, Semestr 3, Obróbka cieplna i powier
Wyzarzanie i hartowanie 01.txt, Automatyka i Robotyka, Semestr 3, Obróbka cieplna i powierzchniowa,
Niepełnosprawność jako zjawisko wieloaspektowe - wyklady z 2007 WSFiZ, PSYCHOLOGIA(1), Psychologia(1
Wyzarzanie i hartowanie 03, Automatyka i Robotyka, Semestr 3, Obróbka cieplna i powierzchniowa, wykł
Odpuszczanie, Automatyka i Robotyka, Semestr 3, Obróbka cieplna i powierzchniowa, wykłady
zjawiska powierzchniowe i transportu zadania
Otrzymywanie Stali, Automatyka i Robotyka, Semestr 3, Obróbka cieplna i powierzchniowa, wykłady
Ćw - II Zjawiska powierzchniowe, Inżynieria środowiska, inż, Semestr III, Chemia fizyczna
Napięcie powierzchniowe, ZJAWISKA POWIERZCHNIOWE
Ekstremalne zjawiska pogodowe wykłady
Wyklad 7b Zjawisko indukcji magnetycznej
więcej podobnych podstron