
Przypadki szczególne przemiany politropowej
Opracowanie: Ewa Fudalej-Kostrzewa
1
CZĘŚĆ 2
SZCZEGÓLNE PRZYPADKI PRZEMIANY POLITROPOWEJ
(PRZEMIANY CHARAKTERYSTYCZNE)
Równanie politropy:
p
1
∙v
1
n
= p
2
∙v
2
n
= const.
Wykładnik politropy:
Ciepło właściwe politropy:
Przypadki szczególne:
a)
Gdy wykładnik politropy n = 1, to:
-
ciepło właściwe:
c
-
równanie przemiany:
p
1
∙v
1
= p
2
∙v
2
= const.
czyli: T
1
= T
2
= const.
Przemiana odbywa się przy stałej temperaturze; jest to przemiana izotermiczna.
b)
Gdy wykładnik politropy n = k, to:
-
ciepło właściwe:
c = 0
-
równanie przemiany:
p
1
∙v
1
k
= p
2
∙v
2
k
= const.
Przemiana odbywa się bez wymiany ciepła z otoczeniem (q
1,2
= 0). Jest to przemiana
adiabatyczna.
Jeśli jest to przemiana odwracalna to spełnia również warunek:
czyli: s
1
= s
2
= const.
W takiej przemianie entalpia jest stała. Jest to przypadek, gdy przemianie poddany jest gaz
doskonały nielepki - a więc nie występują siły tarcia wewnętrznego powodujące wydzielanie się
ciepła podczas przemiany, a w konsekwencji zmianę entropii.
v
p
c
c
c
c
n
v
p
v
c
c
k
n
k
n
c
c
,
1
)
(
0
T
dq
ds

Przypadki szczególne przemiany politropowej
Opracowanie: Ewa Fudalej-Kostrzewa
2
Z tego względu odwracalna przemiana adiabatyczna bywa nazywana przemianą izentropową
lub ściślej adiabatyczno-izentropową.
c)
Gdy wykładnik politropy n = 0, to:
-
ciepło właściwe:
c = c
p
-
równanie przemiany:
p
1
= p
2
= const.
lub po podstawieniu z równania stanu gazu:
równanie przemiany ma postać:
Przemiana o
dbywa się przy stałym ciśnieniu; jest to przemiana izobaryczna.
d) Gdy n
, to:
-
ciepło właściwe:
c = c
v
-
równanie przemiany:
v
1
= v
2
= const.
lub po podstawieniu z równania stanu gazu:
równanie przemiany ma postać:
Przemiana odbywa się przy stałej objętości; jest to przemiana izochoryczna.
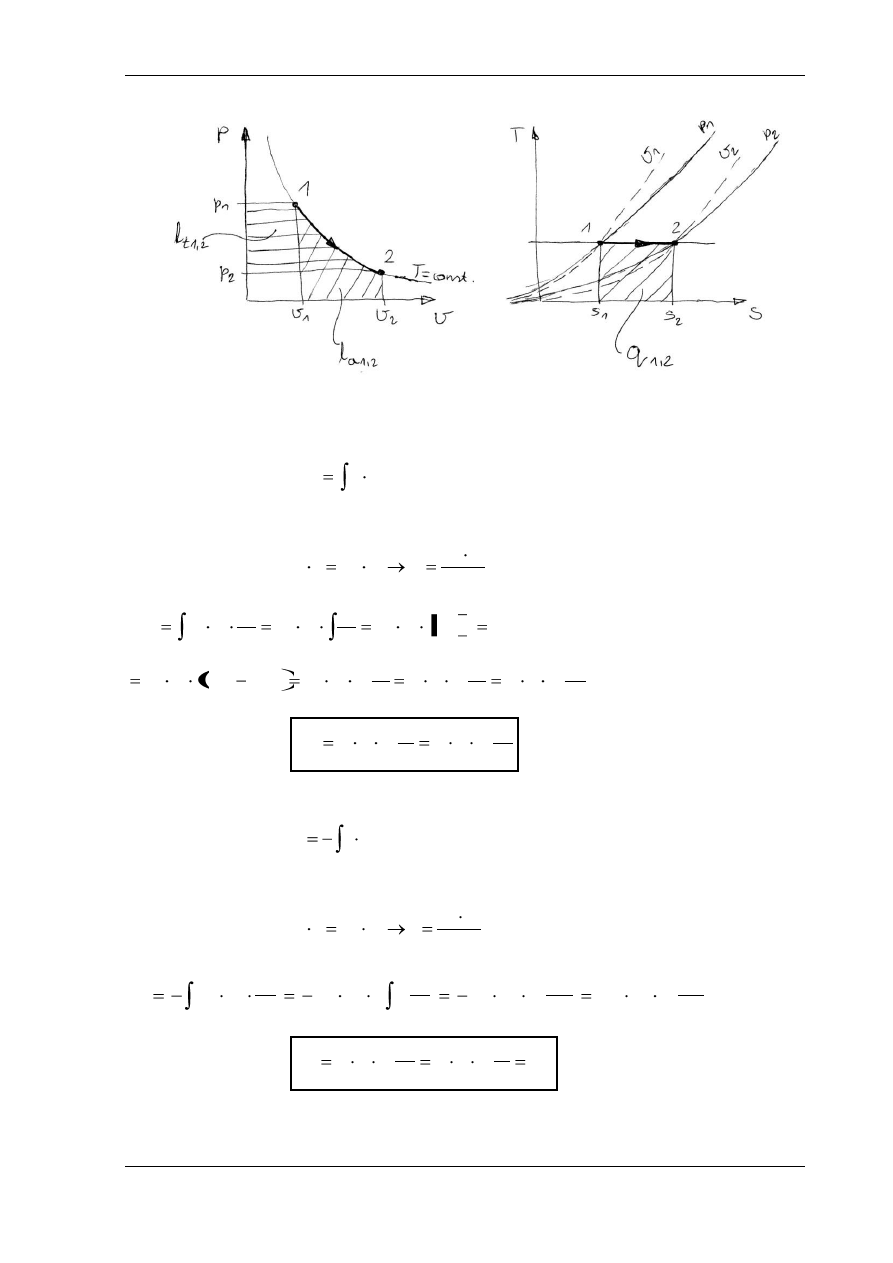
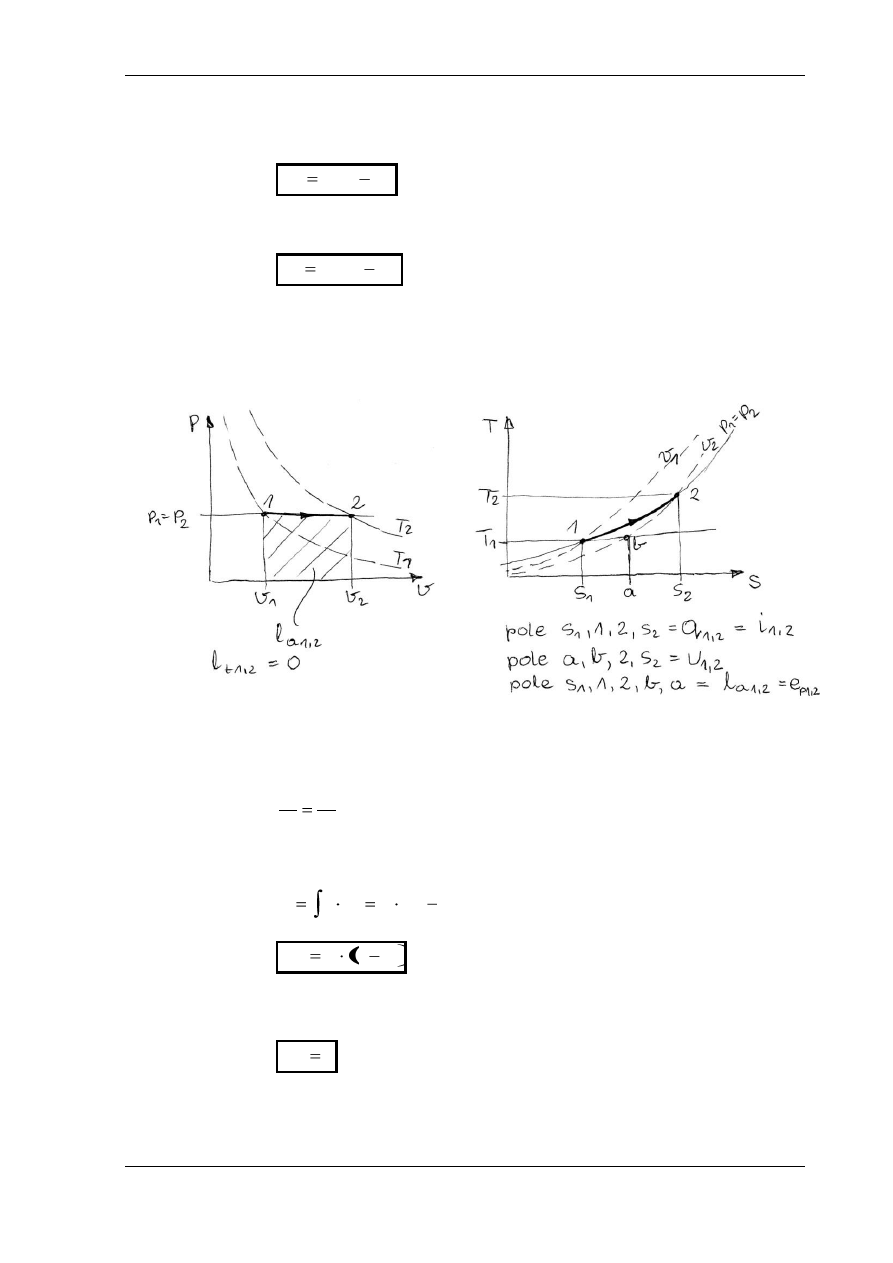
PRZEMIANA IZOTERMICZNA
W
ykładnik politropy n = 1, ciepło właściwe c , T
1
= T
2
= const.
Równanie przemiany:
T
R
v
p
v
p
2
2
1
1
1
1
1
v
T
*
R
p
2
2
2
v
T
*
R
p
2
1
2
1
T
T
v
v
2
1
2
1
T
T
p
p
1
1
1
p
T
*
R
v
2
2
2
p
T
*
R
v
Przypadki szczególne przemiany politropowej
Opracowanie: Ewa Fudalej-Kostrzewa
3
Praca absolutna:
2
1
2
,
1
dv
p
l
a
Z równania izotermy:
v
v
p
p
v
p
v
p
1
1
1
1
2
1
1
2
1
2
1
1
1
2
1
1
1
1
2
1
1
1
2
1
1
1
2
,
1
ln
ln
ln
ln
ln
ln
2
1
p
p
T
R
v
v
T
R
v
v
v
p
v
v
v
p
v
v
p
v
dv
v
p
v
dv
v
p
l
v
v
a
2
1
1
2
2
,
1
ln
ln
p
p
T
R
v
v
T
R
l
a
Praca techniczna:
2
1
dp
v
l
t
Z równania izotermy:
p
v
p
v
v
p
v
p
1
1
1
1
2
1
1
1
1
2
1
1
1
1
1
1
2
1
1
ln
ln
2
p
p
v
p
p
p
v
p
dp
p
v
p
p
dp
v
p
l
t
2
,
1
1
2
2
1
2
,
1
ln
ln
a
t
l
v
v
T
R
p
p
T
R
l
Przypadki szczególne przemiany politropowej
Opracowanie: Ewa Fudalej-Kostrzewa
4
Przyrost energii wewnętrznej
Zgodnie z definicją:
)
(
1
2
2
,
1
T
T
c
u
v
Ponieważ :
2
1
T
T
p
rzyrost energii wewnętrznej w przemianie izotermicznej:
0
2
,
1
u
Przyrost entalpii
Zgodnie z definicją:
)
(
1
2
2
,
1
T
T
c
i
p
Ponieważ :
2
1
T
T
przyrost entalpii w przemianie izotermicznej:
0
2
,
1
i
Ciepło przemiany
Z pierwszej zasady termodynamiki:
2
,
1
2
,
1
2
,
1
A
l
q
u
2
,
1
2
,
1
2
,
1
t
l
q
i
po uwzględnieniu:
0
2
,
1
u
0
2
,
1
i
wynika:
2
,
1
2
,
1
2
,
1
t
a
l
l
q
Przyrost entropii
Z definicji entropii:
T
dq
ds
a zatem:
1
2
,
1
2
,
1
T
q
s
Przypadki szczególne przemiany politropowej
Opracowanie: Ewa Fudalej-Kostrzewa
5
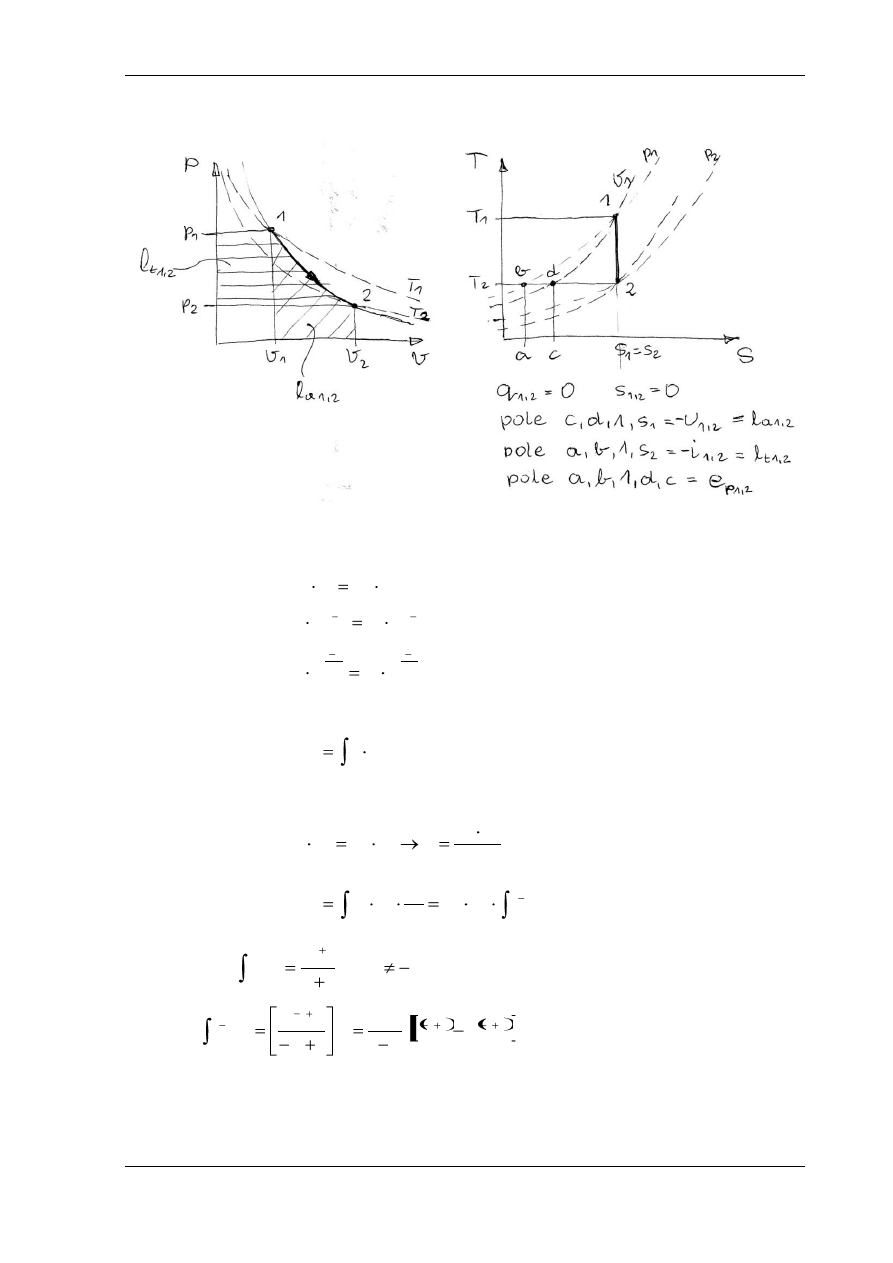
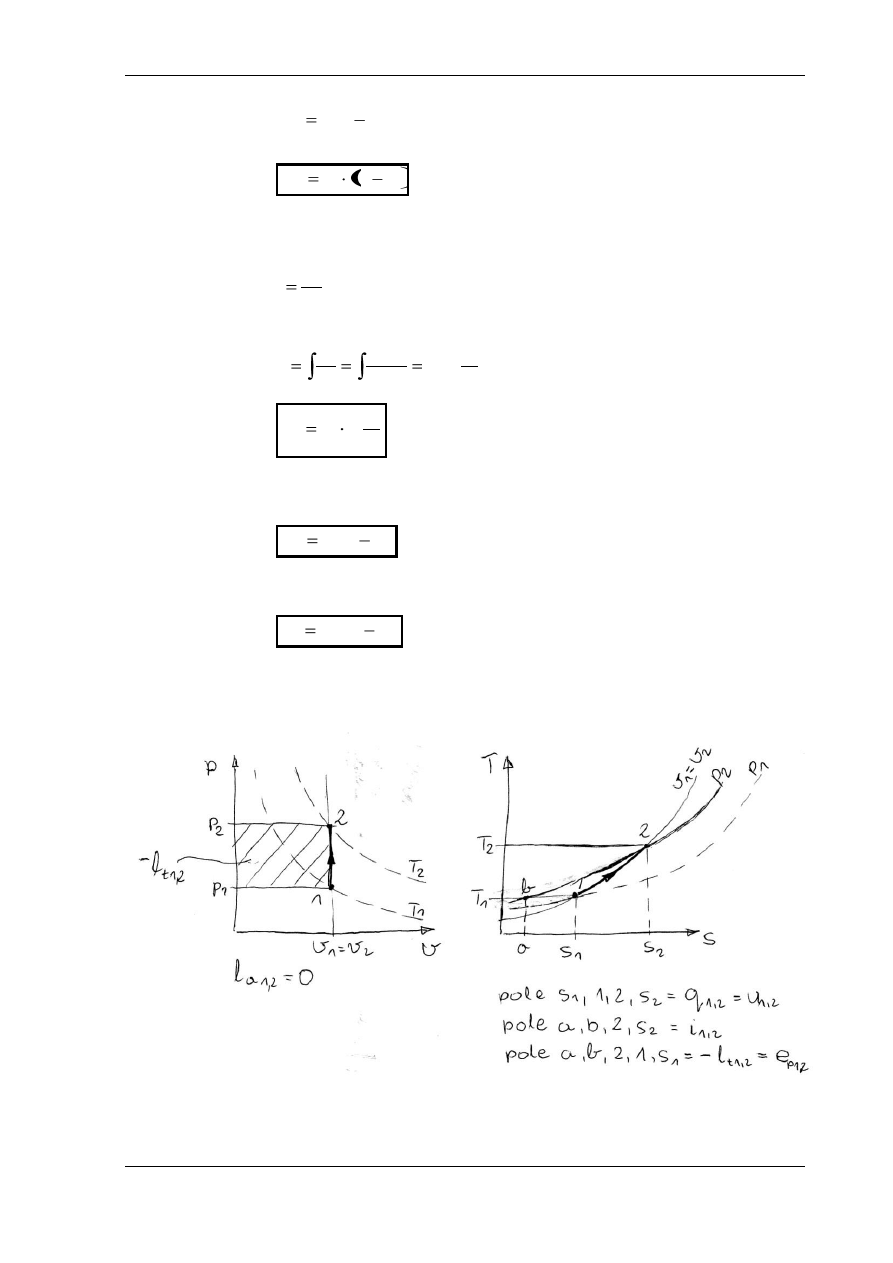
PRZEMIANA IZENTROPOWA
W
ykładnik politropy n = k, ciepło właściwe c = 0, s
1
= s
2
= const.
Równanie przemiany:
k
k
v
p
v
p
2
2
1
1
lub
)
1
(
2
2
)
1
(
1
1
k
k
v
T
v
T
lub
k
k
k
k
p
T
p
T
1
2
2
1
1
1
Praca absolutna:
2
1
2
,
1
dv
p
l
a
Z równania izentropy:
k
k
k
k
v
v
p
p
v
p
v
p
1
1
1
1
2
1
1
1
2
1
1
1
2
,
1
dv
v
v
p
v
dv
v
p
l
k
k
k
k
a
Wiadomo, że:
1
1
1
n
n
x
dx
x
n
n
A zatem:
1
1
1
2
2
1
1
2
1
1
1
1
k
k
v
v
k
k
v
v
k
k
v
dv
v
Przypadki szczególne przemiany politropowej
Opracowanie: Ewa Fudalej-Kostrzewa
6
2
,.
1
1
2
1
2
1
1
2
2
1
1
1
1
1
2
2
2
1
1
1
1
1
2
1
1
1
1
1
2
1
1
2
,
1
1
1
1
1
1
1
1
1
1
u
T
T
c
T
T
k
R
v
p
v
p
k
v
v
p
v
v
p
k
v
v
p
v
v
p
k
v
v
k
v
p
l
v
k
k
k
k
k
k
k
k
k
k
k
a
2
,
1
1
2
2
,
1
1
u
T
T
k
R
l
a
Praca techniczna:
2
1
dp
v
l
t
Zrównania izentropy:
1
1
1
1
1
1
v
p
p
v
v
p
v
p
k
k
k
k
dp
p
v
p
p
dp
v
p
l
k
k
k
k
t
2
1
1
1
1
1
1
1
2
1
1
1
k
k
k
k
k
k
k
p
p
k
k
p
p
k
k
p
p
k
k
p
dp
p
1
1
1
2
1
1
1
1
1
2
1
1
2
1
1
1
1
1
1
1
1
2
1
2
,
1
1
2
1
2
1
1
2
2
1
1
2
2
1
1
1
1
1
1
2
1
1
1
1
1
1
2
1
1
1
2
,
1
)
(
1
1
1
1
1
i
T
T
c
T
T
R
k
k
v
p
v
p
k
k
v
p
v
p
k
k
p
v
p
p
v
p
k
k
p
p
k
k
v
p
l
p
k
k
k
k
k
k
k
k
k
k
k
t
2
,
1
2
,
1
1
2
2
,
1
1
i
u
k
T
T
k
R
k
l
t
Ciepło przemiany
Zgodnie z definicją:
)
(
1
2
2
,
1
T
T
c
q
W
obec tego, że c =0:
0
2
,
1
q
Przyrost entropii
Zgodnie z definicją:
T
dq
ds
Wobec tego, że c =0, q
1,2
=0:
0
2
,
1
s
Przypadki szczególne przemiany politropowej
Opracowanie: Ewa Fudalej-Kostrzewa
7
Przyrost energii wewnętrznej
Zgodnie z definicją:
)
(
1
2
2
,
1
T
T
c
u
v
Przyrost entalpii
Zgod
nie z definicją:
)
(
1
2
2
,
1
T
T
c
i
p
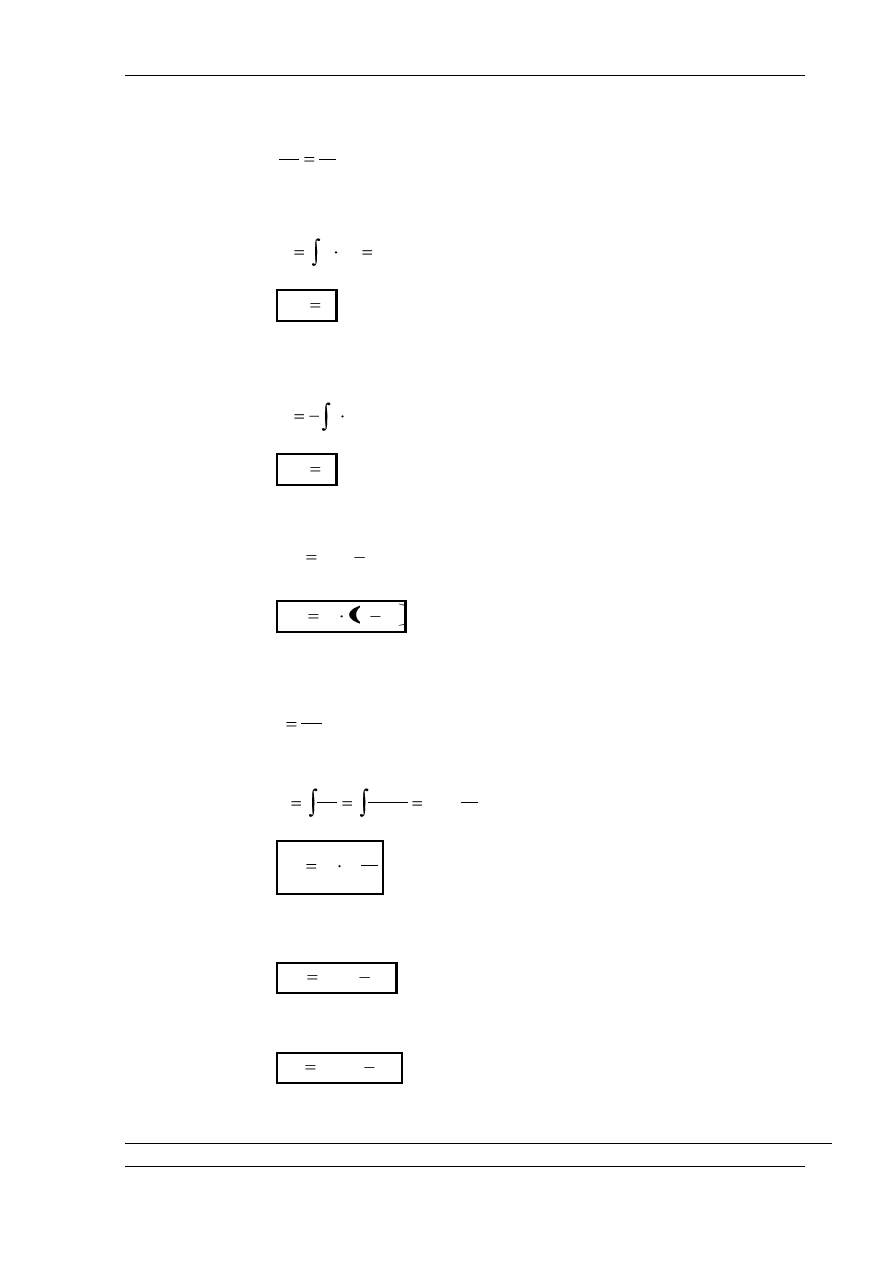
PRZEMIANA IZOBARYCZNA
W
ykładnik politropy n = 0, ciepło właściwe c = c
p,
p
1
= p
2
= const.
Równanie przemiany
2
1
2
1
T
T
v
v
Praca absolutna
2
1
1
2
2
,
1
)
(
v
v
p
dv
p
l
a
1
2
2
,
1
v
v
p
l
a
Praca techniczna
0
2
,
1
t
l
Ciepło przemiany
Zgodnie z definicją:
Przypadki szczególne przemiany politropowej
Opracowanie: Ewa Fudalej-Kostrzewa
8
)
(
1
2
2
,
1
T
T
c
q
Wobec tego, że c =c
p
:
1
2
2
,
1
T
T
c
q
p
Przyrost entropii
Z definicji entropii:
T
dq
ds
a zatem:
1
2
2
1
2
1
2
,
1
ln
T
T
c
T
dT
c
T
dq
s
p
p
1
2
2
,
1
ln
T
T
c
s
p
Przyrost energii wewnętrznej
Zgodnie z definicją:
)
(
1
2
2
,
1
T
T
c
u
v
Przyrost entalpii
Zgodnie z definicją:
)
(
1
2
2
,
1
T
T
c
i
p
PRZEMIANA IZOCHORYCZNA
W
ykładnik politropy n = ∞, ciepło właściwe c = c
v,
v
1
= v
2
= const.
Przypadki szczególne przemiany politropowej
Opracowanie: Ewa Fudalej-Kostrzewa
9
Równanie przemiany
2
1
2
1
T
T
p
p
Praca absolutna
2
1
2
,
1
0
dv
p
l
a
0
2
,
1
a
l
Praca techniczna
2
1
dp
v
l
t
0
2
,
1
t
l
Ciepło przemiany
Zgodnie z definicją:
)
(
1
2
2
,
1
T
T
c
q
Wobec tego, że c =c
v
1
2
2
,
1
T
T
c
q
v
Przyrost entropii
Z definicji entropii:
T
dq
ds
a zatem:
1
2
2
1
2
1
2
,
1
ln
T
T
c
T
dT
c
T
dq
s
v
v
1
2
2
,
1
ln
T
T
c
s
v
Przyrost energii wewnętrznej
Zgodnie z definicją:
)
(
1
2
2
,
1
T
T
c
u
v
Przyrost entalpii
Zgodnie z definicją:
)
(
1
2
2
,
1
T
T
c
i
p

Przypadki szczególne przemiany politropowej
Opracowanie: Ewa Fudalej-Kostrzewa
10
PRZEMIANY - ZADANIA (WAT)
PRZEMIANA IZOTERMICZNA
1. 8 m
3
powietrza o parametrach p
1
=0,9 bar i t=20
C jest sprężane izotermicznie do ciśnienia
p
2
=8,1
bar. Obliczyć objętość końcową, pracę zużytą na sprężenie gazu, ciepło przemiany oraz
przyrost entropii. R
pow.
=287 J/(kg
.
K), c
p
/c
v
=k=1,4
Odp.:L
A
=-1,58 MJ, Q=-1,58 MJ, S
1,2
=-5,4 kJ/K
2. 60 kg tlenu o temperaturze t=15
C jest sprężane izotermicznie od ciśnienia p
1
=1 bar do objętości
V
2
=7,2 m
3
. Obliczyć ciśnienie końcowe, pracę zużytą na sprężenie gazu, ciepło przemiany oraz
przyrost entropii.
Odp.: p
2
=6,25 bar, L
A
=-8,23 MJ, Q=-8,23 MJ, S
1,2
=-28,6 kJ/K
3. 1 kilomol powietrza o temperaturze t=20
C sprężono izotermicznie do p
2
=40 bar zmniejszając
objętość do połowy. Obliczyć ciepło i pracę przemiany, zmianę entropii oraz ciśnienie
początkowe. Skład objętościowy powietrza: r
O2
=0,21, r
N2
=0,79.
Odp.: p
1
=20 bar, L
A
=-1,68 MJ, Q=-1,68 MJ, S
1,2
=-5,73 kJ/K
4.
1 kilomol gazu doskonałego o temperaturze t=20 C sprężono izotermicznie do p
2
=40 bar
zmniejszając objętość do połowy. Obliczyć ciepło i pracę przemiany, zmianę entropii oraz
ciśnienie początkowe.
Odp.: p
1
=20 bar, L
A
=-1,68 MJ, Q=-1,68 MJ, S
1,2
=-5,73 kJ/K
5. 0,8 kg metanu (CH
4
) sprężono izotermicznie przy temperaturze t=15 C odprowadzając Q=-200
kJ ciepła. Ciśnienie końcowe wynosi p
2
=100 bar. Obliczyć ciśnienie początkowe, objętość
początkową i końcową, pracę sprężania gazu oraz zmianę entropii.
Odp.: p
1
=18,82 bar, V
1
=0,0637 m
3
, V
2
=1,199
.
10
-2
m
3
, L
A
=-200 kJ, S
1,2
=-694 J/K
6. 10 m
3
powietrza jest sprężane izotermicznie od p
1
=0,9 bar, t
1
=17 C do p
2
=7,2 bar. Obliczyć
objętość końcową, pracę zużytą na sprężenie gazu, ilość odprowadzonego ciepła oraz masę
wody chłodzącej, która ogrzała się o t=12 C. Ciepło właściwe wody 4,19 kJ/(kg
.
K). Skład
objętościowy powietrza: r
O2
=0,21, r
N2
=0,79.
Odp.: V
2
=1,25 m
3
, L
A
=-18,75 MJ, Q=-18,75 MJ, M
w
=0,373
.
10
3
kg
PRZEMIANA IZOCHORYCZNA
1.
W zbiorniku o objętości V=2 m
3
znajduje się dwutlenek węgla (CO
2
) o ciśnieniu p
1
=20 bar
i temperaturze t
1
=150
C. Zbiornik jest ochładzany do chwili osiągnięcia przez gaz ciśnienia
p
2
=2
bar. Obliczyć ciepło wymienione z otoczeniem, temperaturę końcową, zmianę energii
wewnętrznej, entalpii i entropii.
Odp.: Q=-10,8 MJ, T
2
=42,3 K, U
1,2
=-10,8 MJ, I
1,2
=-14,36 MJ, S
1,2
=-65,3 kJ/K
2. Zbiornik zawiera V=0,15 m
3
azotu o ciśnieniu p
1
=1,4 bar i temperaturze t
1
=100 C. Zbiornik jest
ochładzany do temperatury t
2
=15
C. Obliczyć ciepło wymienione z otoczeniem, ciśnienie
końcowe, zmianę energii wewnętrznej, entalpii i entropii.
Odp.: Q=-12 kJ, p
2
=1,08 bar, U
1,2
=-12 kJ, I
1,2
=-16,8 kJ, S
1,2
=-36,5 J/K
3.
3 kg powietrza umieszczone w zamkniętym zbiorniku jest podgrzewane aż do osiągnięcia
przyrostu entalpii właściwej i
1,2
=80 kJ/kg. Ciśnienie początkowe wynosi p
1
=7 bar a temperatura
końcowa t
2
=200
C. Obliczyć ciśnienie końcowe, ciepło przemiany i zmianę energii wewnętrznej.
Stała gazowa powietrza R=287J/(kg*K), k = c
p
/c
v
= 1,4.
Odp.: p
2
=8,4 bar, Q=172,2 kJ, U
1,2
=172,2 kJ

Przypadki szczególne przemiany politropowej
Opracowanie: Ewa Fudalej-Kostrzewa
11
PRZEMIANA IZOBARYCZNA
1. 1 kilogram powietrza o parametrach t
1
=47 C i p
1
=1,5 bar zwiększa objętość przy stałym ciśnieniu
dopóki entropia nie zmieni się o 0,04 kJ/(kg
.
K). Obliczyć temperaturę końcową, ciepło i pracę
przemiany, zmianę energii wewnętrznej i entalpii. Stała gazowa powietrza R=287 J(kg
.
K),
k=c
p
/c
v
=1,4.
Odp.:T
2
=333 K, Q=13,06 kJ, L
A
=3,75 kJ, U
1,2
=9,33 kJ, I
1,2
=13,06 kJ
2.
W cylindrze z ruchomym tłokiem znajduje się 0,5 m
N
3
wodoru o parametrach p
1
=100658 Pa,
t
1
=80
C. W wyniku doprowadzenia pewnej ilości ciepła temperatura wzrosła do t
2
=610 C.
Obliczyć ilość doprowadzonego ciepła, pracę absolutną, zmianę energii wewnętrznej i entalpii,
jeśli ciśnienie nie zmieniło się.
Odp.: Q=344 kJ, L
A
=97,64 kJ, U
1,2
=245,6 kJ, I
1,2
=343,8 kJ
3.
Azot podlega przemianie przy stałym ciśnieniu dopóki nie nastąpi przyrost energii wewnętrznej
o 20
kJ/kg, a temperatura końcowa wyniesie 150 C. Obliczyć ciepło i pracę przemiany.
Odp.: q=28 kJ/kg, l
A
=8 kJ/kg
4. Powietrze o temperaturze t
1
=27
C ogrzano przy stałym ciśnieniu aż do podwojenia objętości,
podc
zas gdy entropia wzrosła o 0,06 kJ/K. Obliczyć masę powietrza, przyrost energii
wewnętrznej, ciepło i pracę absolutną przemiany. Stała gazowa powietrza R=287J/(kg
.
K), k =
c
p
/c
v
= 1,4.
Odp.: M=0,086 kg, U
1,2
=18,5 kJ, Q=25,9 kJ, L
A
=7,4 kJ,
PRZEMIANA IZENTROPOWA
1.
1 kilomol azotu o temperaturze początkowej t
1
=300
C rozpręża się izentropowo od p
1
=7 bar do
p
2
=0,7 bar. Obliczyć ciepło i pracę absolutną przemiany, zmianę energii wewnętrznej i entalpii.
Odp.: Q=0 kJ, L
A
=5,74 MJ, U
1,2
=-5,74 MJ, I
1,2
=-8,033 MJ
2. 0,
4 kg powietrza sprężono izentropowo od temperatury t
1
=50
C, przy czym objętość zmniejszyła
się do połowy. Obliczyć pracę absolutną przemiany, przyrost energii wewnętrznej i entalpii. Stała
gazowa powietrza R=287 J/(kg
.
K) k = c
p
/c
v
= 1,4.
Odp.: L
A
=-29,56 kJ, U
1,2
=29,56 kJ, I
1,2
=41,38 kJ
3. 1 kg argonu Ar (M
=40 kg/kmol) rozprężył się izentropowo od temperatury t
1
=150 C, przy czym
ciśnienie spadło do połowy. Obliczyć pracę absolutną przemiany, zmianę energii wewnętrznej,
entalpii i entropii oraz stosunek objętości po i przed rozprężeniem.
Odp.: L
A
=32,13 kJ, U
1,2
=-32,13 kJ, I
1,2
=-53,33 kJ, S
1,2
=0, (V
2
/V
1
)=1,518
4.
1 kmol tlenu o ciśnieniu p
1
=1,4 bar i temperaturze t
1
=37
C sprężono izentropowo aż do
podwojenia ciśnienia. Obliczyć temperaturę końcową i pracę absolutną przemiany.
Odp.: T
2
=378 K, L
A
=-1,41 MJ
5.
1 kmol gazu dwuatomowego o ciśnieniu p
1
=1,4 bar i temperaturze t
1
=37
C sprężono izentropowo
aż do podwojenia ciśnienia. Obliczyć temperaturę końcową i pracę absolutną przemiany.
Odp.: T
2
=378 K, L
A
=-1,41 MJ
Wyszukiwarka
Podobne podstrony:
Kolokwium II, przemiany część 1
kolokwium organiczna II id 2408 Nieznany
kolokwia, II semestr id 240233 Nieznany
Kolokwuium II opisowa 29 styczn Nieznany
Kolokwium II, Ewolucja Chrztu, Cześć I - chrześcijaństwo do roku 150
Kolokwium II, Ewolucja Eucharystii, Cześć I - chrześcijaństwo do roku 150
BIOCHEMIA kolokwium II poprawa Nieznany (2)
S II [dalsza część prezentacji]
Kolos ekonimika zloz II 2 id 24 Nieznany
kolokwium probne boleslawiec id Nieznany
kolokwium nr 1 ze statsystyki o Nieznany (3)
mechanika budowli II analiza ki Nieznany
Anatomia Kolokwium I p4 id 6275 Nieznany
Inhibitory enzymów jako leki, materiały medycyna SUM, biochemia, Kolokwium II
pytania kolokwium II
Kolokwium II immuny czyjeś krótkie opracowanie
Kolokwium II Ekologia i Ochrona przyrody
Anatomia Kolokwium I p6 id 6275 Nieznany (2)
więcej podobnych podstron