
Ewelina Dudek
1.04.2008 r.
Rok I, chemia podstawowa
dr Bogusław Kosturek
Wtorek, 12
45
-15
00
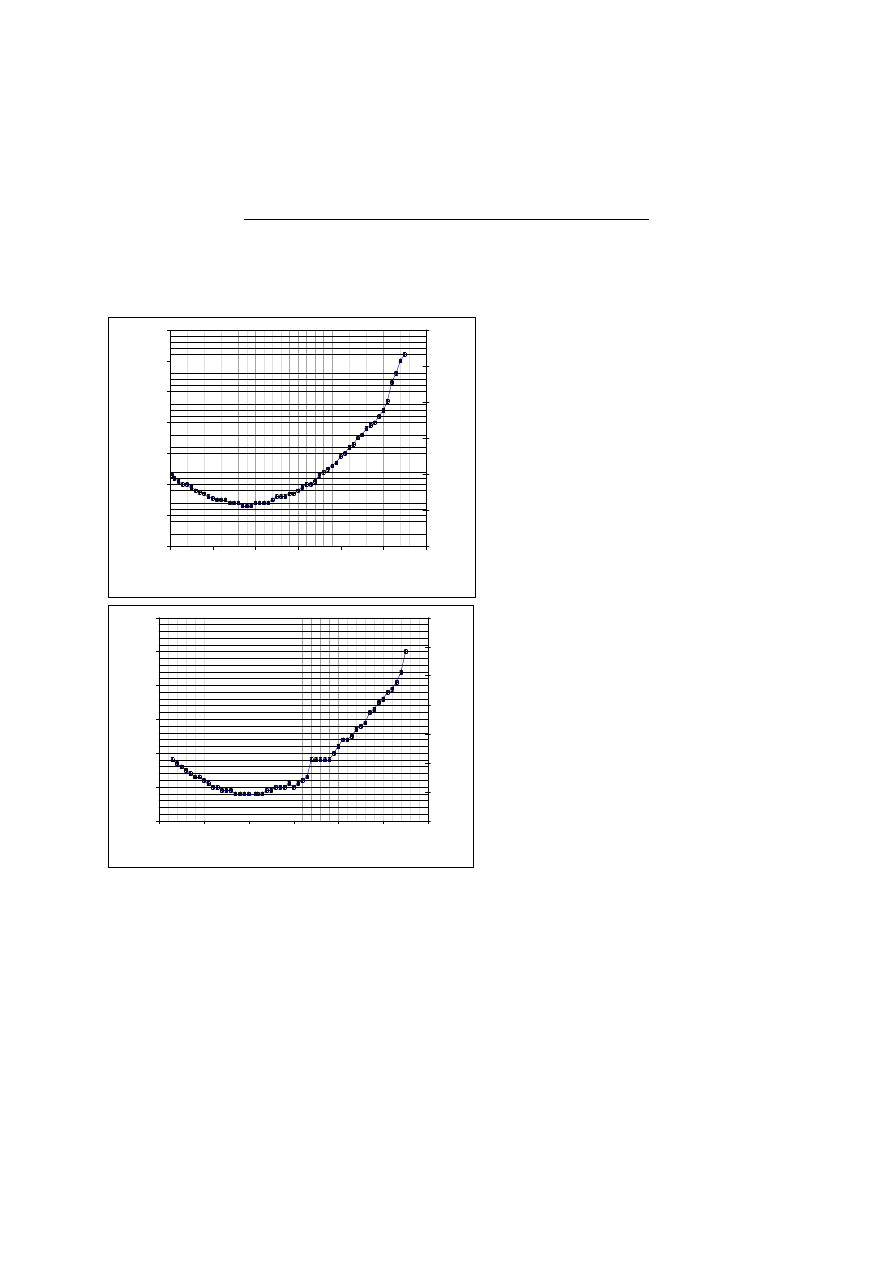
29. Anomalia rozszerzalności cieplnej wody.
1.
Wykresy zależności wysokości h słupa wody oraz objętości V od temperatury
T.
3,0
4,0
5,0
6,0
7,0
8,0
9,0
10,0
0,0
2,0
4,0
6,0
8,0
10,0
12,0
Tem peratura [
o
C]
W
y
s
o
k
o
ś
ć
h
[c
m
]
0,09
0,14
0,19
0,24
0,29
0,34
0,39
O
b
j
ę
to
ś
ć
V
[
c
m
3
]
Rys. Pomiar I. Naczynie z lodem.
3,0
4,0
5,0
6,0
7,0
8,0
9,0
0,0
2,0
4,0
6,0
8,0
10,0
12,0
Temperatura [
o
C]
W
y
s
o
k
o
ś
ć
h
[c
m
]
0,11
0,14
0,17
0,20
0,23
0,26
0,29
0,32
O
b
j
ę
to
ś
ć
V
[
c
m
3
]
Rys. Pomiar II. Naczynie bez lodu.
2.
Wartość temperatury odpowiadająca maksymalnej gęstości wody wynosi:
a) dla pomiaru I-go - 3,4 – 3,8ºC
b) dla pomiaru II-go - 3,4 – 4,6ºC
3.
Wartość względnej zmiany gęstości wody między 4ºC a 10ºC dla obu
pomiarów wynosi: 1,00.
4.
Niepewności standardowe:
C
T
u
°
=
06
,
0
)
(
mm
h
u
58
,
0
)
(
=
I.
Zagadnienia teoretyczne
Budowa cieczy – ciecze zbudowane są z cząsteczek gęsto upakowanych, ale nie
powiązanych ze sobą. Cząsteczki podczas poruszania się ulegają ciągłym zderzeniom.
Z budowy cieczy wynika kilka ich własności, m.in.: przyjmują kształt naczynia, są
nieściśliwe.
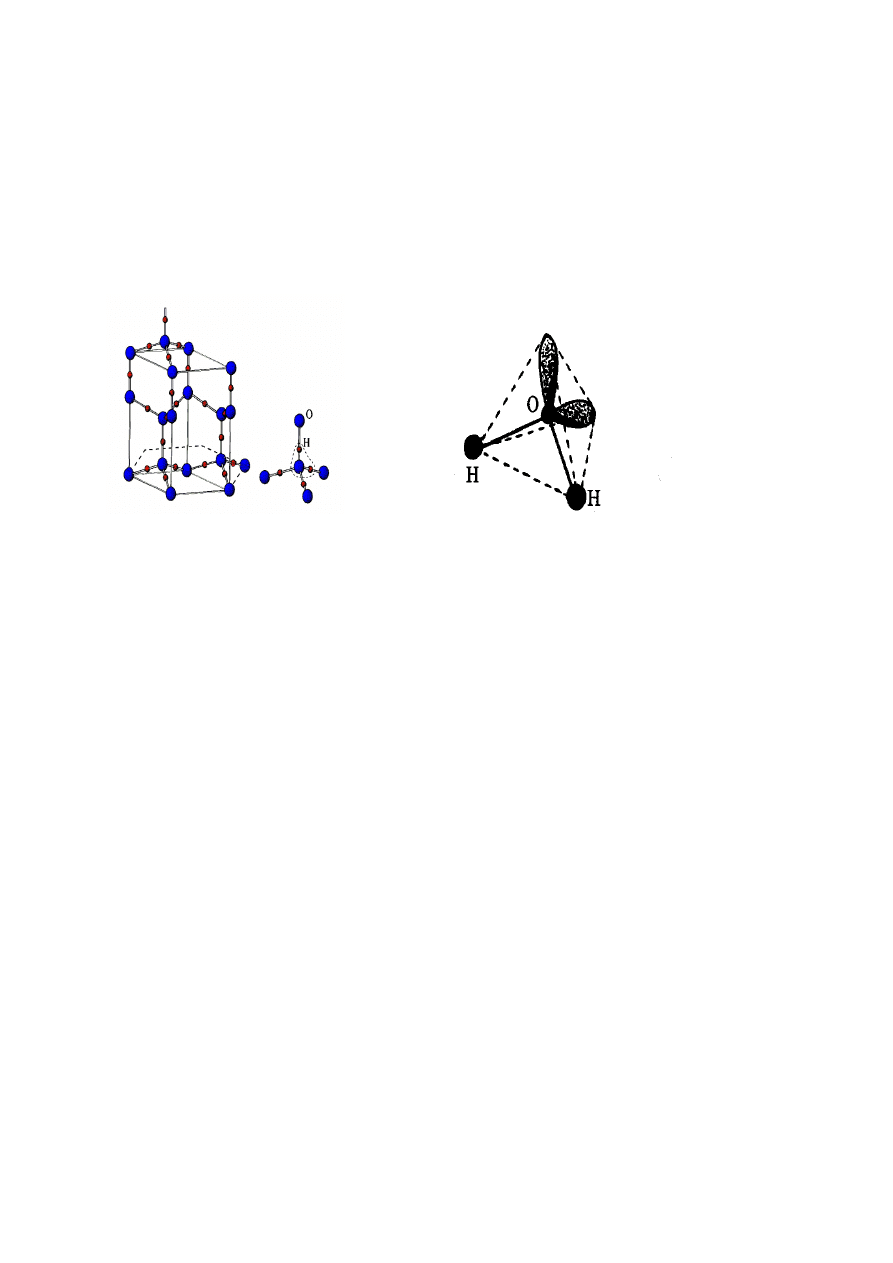
Struktura cząsteczki wody i lodu –
Rys.1. Struktura lodu. Rys. 2. Struktura cząsteczki wody.
Wiązanie kowalencyjne – wiązanie pomiędzy pierwiastkami o identycznej
elektroujemności. Polega na uwspólnieniu pary elektronów( wiązanie pojedyncze) lub
par elektronów( wiązanie podwójne i potrójne).
Wiązanie kowalencyjne spolaryzowane – wiązanie pomiędzy pierwiastkami
różniącymi się nieznacznie elektroujemnością. Uwspólniona para elektronowa jest
przesuwana w stronę pierwiastka bardziej elektroujemnego.
Wiązanie jonowe – wiązanie, które tworzy się pomiędzy atomami pierwiastków o
skrajnej różnicy elektroujemności. Podczas powstawania wiązania dochodzi do
wymiany elektronów walencyjnych. Bardziej elektroujemny atom pierwiastka odbiera
elektrony od atomu pierwiastka o mniejszej elektroujemności i powstają jony.
Wiązania te tworzą się najczęściej w związkach o budowie krystalicznej.
Wiązanie metaliczne – wiązanie to polega na przekształcaniu atomów tego samego
metalu lub różnych metali w zbiór kationów i swobodnie poruszających się między
nimi elektronów. Wiązanie to istnieje tylko w stanie ciekłym lub stałym.
Wiązanie wodorowe – jest to słabe oddziaływanie typu elektrostatycznego między
kowalencyjnie związanym atomem wodoru i należącym do innej cząsteczki atomem
silnie elektroujemnym.
Oddziaływanie van der Waalsa – wzajemne oddziaływania elektrostatyczne
pomiędzy dipolami cząsteczkowymi, pomiędzy cząsteczkami pozbawionymi
momentów dipolowych lub atomami. Przyczyną wystąpienia oddziaływania van der
Waalsa są trwałe oraz wyindukowane momenty dipolowe w cząsteczkach lub - w
przypadku oddziaływań dyspersyjnych - chwilowe asymetrie rozkładu ładunku w
cząsteczce lub atomie. Oddziaływania van der Waalsa są oddziaływaniami bliskiego
zasięgu (do 0,5 nm).

Energia wiązania – energia, która jest potrzebna do rozszczepienia danego wiązania
chemicznego lub jest wydzielana przy jego powstawaniu. Energia wiązania
podwójnego jest większa niż pojedynczego, ale mniejsza niż potrójnego.
Anomalna rozszerzalność wody - zmniejszanie się objętości wody w miarę wzrostu
temperatury w przedziale 0ºC - 4ºC. Jednocześnie wiąże się to ze wzrostem gęstości
wody.
Mieszanina chłodząca – mieszanina substancji tworzących roztwory o niskiej
temperaturze krzepnięcia, np. mieszanina lodu i soli.
Klastery – struktury nadcząsteczkowe, w których istnieją dwie grupy cząsteczek,
które tworzą wspólną sieć powiązań.
Model zjawiska – w czasie ogrzewania lodu do temperatur bliskich temperaturze
topnienia zwiększone ( na skutek dostarczania ciepła) drgania cząsteczek powodują
zerwanie coraz większej liczby wiązań wodorowych. W temperaturze 0ºC liczba
zerwanych wiązań jest tak duża, że lód zamienia się w wodę. Uwolnione cząsteczki
wody zapełniają dziury, w skutek czego objętość maleje, a gęstość wody rośnie.
Jednak w 0ºC nie zostają zerwane wszystkie wiązania wodorowe. W bardzo zimnej
wodzie pozostają resztki „tuneli” rozpadających się w miarę wzrostu temperatury.
Powoduje to, że gęstość wody początkowo w czasie ogrzewania wzrasta i w
temperaturze 4ºC osiąga największą wartość, bowiem wtedy całkowicie rozpadają się
wiązania wodorowe. Od tego momentu woda zachowuje się jak już normalne ciecze i
zwiększa swoją objętość wraz ze wzrostem temperatury. Przy obniżaniu temperatury
w zakresie 0ºC-4ºC obserwujemy anomalny wzrost objętości. Dzieje się tak, dlatego
ż
e poniżej 4ºC cząsteczki wody zaczynają intensywnie asocjować, w wyniku czego w
temperaturze 0ºC tworzy się heksagonalna struktura lodu z dużymi otwartymi
przestrzeniami między ściankami kryształu. Powstała struktura lodu daleka jest od
struktury gęstego opakowania. Każdy atom tlenu ma czterech bezpośrednich sąsiadów,
gdy tymczasem w strukturze gęstego upakowania sąsiadów tych byłoby dwunastu. W
konsekwencji zamarzająca woda zwiększa objętość o ok. 10% względem fazy ciekłej,
a powstające kryształki lodu odznaczają się dużą kruchością.
II.
Przebieg doświadczenia
Na mieszadle magnetycznym ustawiłam plastikowe naczynie, w którym
umieściłam kolbę pomiarową. Kolbę pomiarową obłożyłam wcześniej rozdrobnionym
lodem, przesypując 4 łyżeczkami soli. Włączyłam mieszadło magnetyczne oraz
ustawiłam pokrętło regulacji obrotów mieszadła na 5. Następnie dokonałam pomiarów
w dwóch etapach:
1)
W momencie obniżenia się temperatury wody do +11
o
C rozpoczęłam pomiar
zmian wysokości słupa wody w kapilarze co 0,2ºC. Pomiar był prowadzony do
osiągnięcia +0,1
o
C. Wyniki pomiarów umieściłam w tabeli 1.
2)
Po wyjęciu kolby z mieszaniny chłodzącej kontynuowałam pomiar wysokości
słupa wody, przez ogrzewanie kolby powietrzem atmosferycznym, do
temperatury +11
o
C. Wyniki pomiarów widnieją w tabeli 2.
III.
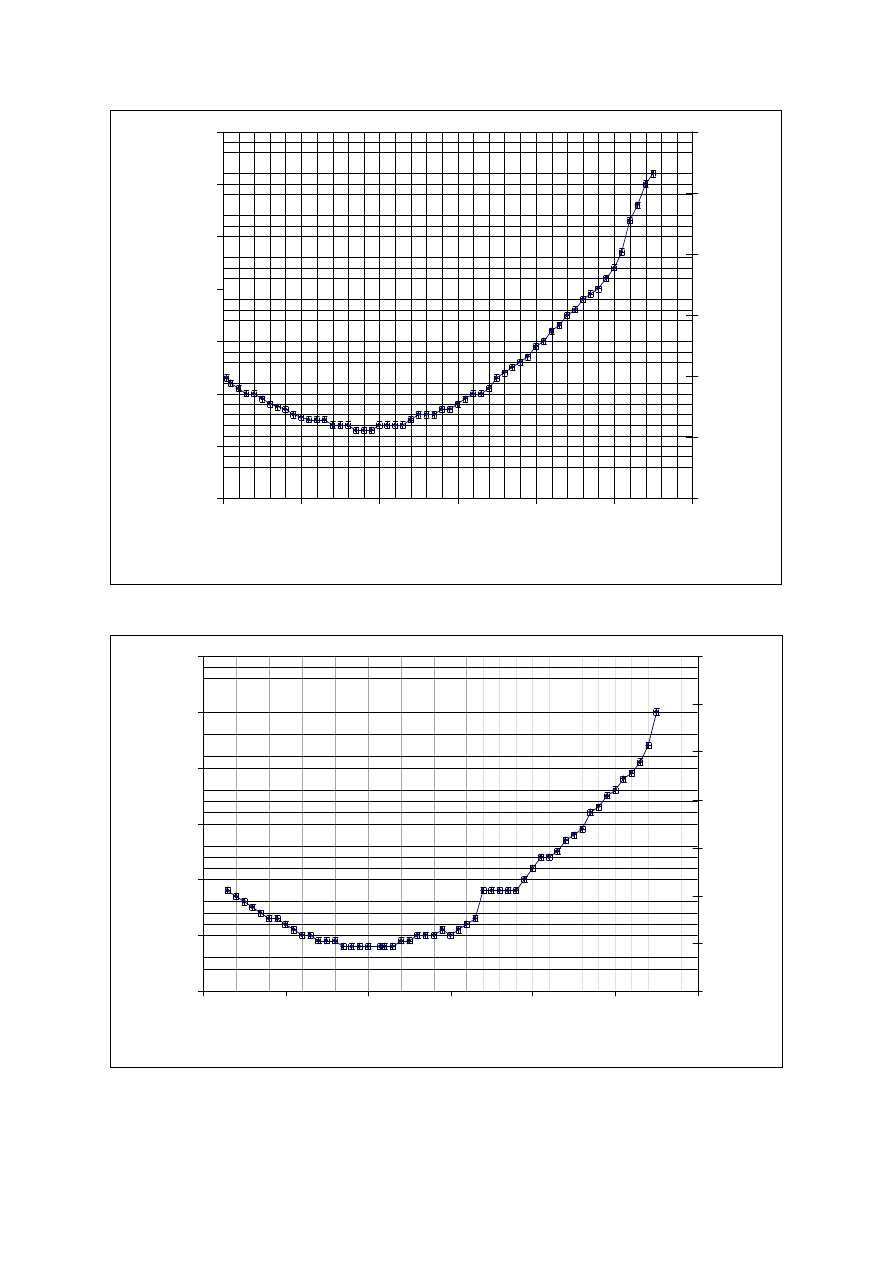
Opracowanie wyników pomiarów
1)
Poniżej sporządziłam wykresy zależności wysokości h słupa wody w kapilarze
od temperatury T , podczas ochładzania i ogrzewania wody. Na dodatkowej osi
rzędnych umieściłam odpowiadającą wysokości h objętość wody V, obliczoną
na podstawie znajomości średnicy wewnętrznej kapilary, z następującego
wzoru:
h
r
V
⋅
⋅
=
2
π
,
gdzie:
r- promień przekroju kapilary,
h – wysokość słupa wody w kapilarze.
Tabela.1 Naczynie z lodem.
Temperatura T [
o
C]
Wysokość h [mm]
Objętość V [cm
3
]
11,0
9,2
0,33
10,8
9,0
0,33
10,6
8,6
0,31
10,4
8,3
0,30
10,2
7,7
0,28
10,0
7,4
0,27
9,8
7,2
0,26
9,6
7,0
0,25
9,4
6,9
0,25
9,2
6,8
0,25
9,0
6,6
0,24
8,8
6,5
0,24
8,6
6,3
0,23
8,4
6,2
0,23
8,2
6,0
0,22
8,0
5,9
0,21
7,8
5,7
0,21
7,6
5,6
0,20
7,4
5,5
0,20
7,2
5,4
0,20
7,0
5,3
0,19
6,8
5,1
0,19
6,6
5,0
0,18
6,4
5,0
0,18
6,2
4,9
0,18
6,0
4,8
0,17
5,8
4,7
0,17
5,6
4,7
0,17
5,4
4,6
0,17

5,2
4,6
0,17
5,0
4,6
0,17
4,8
4,5
0,16
4,6
4,4
0,16
4,4
4,4
0,16
4,2
4,4
0,16
4,0
4,4
0,16
3,8
4,3
0,16
3,6
4,3
0,16
3,4
4,3
0,16
3,2
4,4
0,16
3,0
4,4
0,16
2,8
4,4
0,16
2,6
4,5
0,16
2,4
4,5
0,16
2,2
4,5
0,16
2,0
4,6
0,17
1,8
4,6
0,17
1,6
4,7
0,17
1,4
4,8
0,17
1,2
4,8
0,17
1,0
4,9
0,18
0,8
5,0
0,18
0,6
5,0
0,18
0,4
5,1
0,19
0,2
5,2
0,19
0,1
5,3
0,19
Tabela.2 Naczynie bez lodu.
Temperatura T [
o
C]
Wysokość h [mm]
Objętość V [cm
3
]
0,6
4,8
0,17
0,8
4,7
0,17
1,0
4,6
0,17
1,2
4,5
0,16
1,4
4,4
0,16
1,6
4,3
0,16
1,8
4,3
0,16
2,0
4,2
0,15
2,2
4,1
0,15
2,4
4,0
0,15
2,6
4,0
0,15
2,8
3,9
0,14
3,0
3,9
0,14
3,2
3,9
0,14

3,4
3,8
0,14
3,6
3,8
0,14
3,8
3,8
0,14
4,0
3,8
0,14
4,3
3,8
0,14
4,4
3,8
0,14
4,6
3,8
0,14
4,8
3,9
0,14
5,0
3,9
0,14
5,2
4,0
0,15
5,4
4,0
0,15
5,6
4,0
0,15
5,8
4,1
0,15
6,0
4,0
0,15
6,2
4,1
0,15
6,4
4,2
0,15
6,6
4,3
0,16
6,8
4,8
0,17
7,0
4,8
0,17
7,2
4,8
0,17
7,4
4,8
0,17
7,6
4,8
0,17
7,8
5,0
0,18
8,0
5,2
0,19
8,2
5,4
0,20
8,4
5,4
0,20
8,6
5,5
0,20
8,8
5,7
0,21
9,0
5,8
0,21
9,2
5,9
0,21
9,4
6,2
0,23
9,6
6,3
0,23
9,8
6,5
0,24
10,0
6,6
0,24
10,2
6,8
0,25
10,4
6,9
0,25
10,6
7,1
0,26
10,8
7,4
0,27
11,0
8,0
0,29
3,0
4,0
5,0
6,0
7,0
8,0
9,0
10,0
0,0
2,0
4,0
6,0
8,0
10,0
12,0
Tem peratura [
o
C]
W
y
s
o
k
o
ś
ć
h
[c
m
]
0,09
0,14
0,19
0,24
0,29
0,34
0,39
O
b
j
ę
to
ś
ć
V
[
c
m
3
]
Rys.1. Zależność h oraz V od temperatury T wody (stopniowe ochładzanie lodem).
3,0
4,0
5,0
6,0
7,0
8,0
9,0
0,0
2,0
4,0
6,0
8,0
10,0
12,0
Temperatura [
o
C]
W
y
s
o
k
o
ś
ć
h
[c
m
]
0,11
0,14
0,17
0,20
0,23
0,26
0,29
0,32
O
b
j
ę
to
ś
ć
V
[
c
m
3
]
Rys.2. Zależność h oraz V od temperatury T wody (stopniowe ogrzewanie powietrzem
atmosferycznym).

2)
Maksimum gęstości wody odpowiada najmniejszej jej objętości w kapilarze.
Temperatura, przy której gęstość jest największa to zakres:
•
pierwszy pomiar: 3,4 – 3,8ºC
•
drugi pomiar:
3,4 – 4,6ºC
3)
Przyjmując, że cała objętość wody w kolbie wynosi 350cm
3
, obliczyłam
względną zmianę gęstości wody pomiędzy 4
o
C i 10
o
C, w następujący sposób:
•
pierwszy pomiar (z lodem):
1
2
2
1
V
V
d
d
=
,
gdzie:
2
1
, d
d
- gęstości dla 4
o
C i 10
o
C,
1
V
- różnica objętości dla 4
o
C i 10
o
C,
2
V
- objętość kolby
Zatem względna zmiana gęstości wynosi:
4
-
3
3
1
2
2
1
10
3,14
350
11
,
0
⋅
=
=
=
cm
cm
V
V
d
d
•
drugi pomiar (bez lodu)
Obliczenia przeprowadzono analogicznie, jak dla poprzedniego pomiaru i otrzymano:
4
-
3
3
1
2
2
1
10
2,86
350
10
,
0
⋅
=
=
=
cm
cm
V
V
d
d
.
4) Niepewności standardowe pomiaru temperatury i wysokości słupa wody obliczyłam
z następującego wzoru:
3
)
(
x
x
u
d
∆
=
,
gdzie:
x
d
∆
- niepewność wzorcowania równa najmniejszej działce skali przyrządu.
Tak więc, dla termometru przyjmujemy
x
d
∆
= 0,10°C, zatem niepewność
standardowa u(T) wynosi 0,06°C. W przypadku pomiaru wysokości, przyjmujemy
x
d
∆
= 0,1mm, stąd niepewność standardowa u(h) wynosi 0,58mm. Powyższe
niepewności standardowe zaznaczyłam na wykresach.

IV.
Ocena błędów
Obliczając niepewność standardową, należy zauważyć, że dla przyrządów
takich, jak miarka lub termometr lekarski, producenci zwykle nie określą ich
dokładności. Dlatego też, uważa się, że ich „dokładność” (tzw. niepewność
wzorcowania) równa jest najmniejszej wartości działki elementarnej skali (np. 0,1ºC
dla termometru). Wartość niepewności wzorcowania może zostać dodatkowo
skorygowana w górę lub w dół zależnie od warunków pomiaru i doświadczenia osoby
mierzącej.
V.
Wnioski
Wyniki pomiarów zmian objętości wody w funkcji temperatury potwierdzają
założenia teoretyczne, mówiące o tym, że ciecz ta w zakresie temperatur od 0
o
C do
4
o
C zmniejsza swoją objętość i w temperaturze 4
o
C przyjmuje minimalną objętość, a
tym samym maksymalną gęstość. Woda od 4ºC zachowuje się jak pozostałe ciecze i ze
wzrostem temperatury zwiększa swoją objętość.
Wyszukiwarka
Podobne podstrony:
Cw 29 szablon id 97632 Nieznany
cw 29 cwn029a id 663913 Nieznany
cw 29 cwn029 id 663912 Nieznany
Cw 29 szablon id 97632 Nieznany
CW przykladowe zaliczenie id 9 Nieznany
cw PAiTS 05 id 122324 Nieznany
CW 8 pytania kontrolne id 12215 Nieznany
lekcja 29 str 2 id 265129 Nieznany
cw PRI harmonogram id 122354 Nieznany
Cw 1 Czworniki bierne id 122391 Nieznany
cw 03 formularz id 121361 Nieznany
Cw 25 Zaklocenia id 122416 Nieznany
cw 05 instrukcja id 121376 Nieznany
lekcja 29 str 5 id 265132 Nieznany
cw 15 formularz id 121556 Nieznany
normy do cw I PN B 19301 id 787 Nieznany
Cw 24 cw070 id 648300 Nieznany
cad 1 I Cw 14 2013 id 107655 Nieznany
Cw 2 Biochemia OS id 121642 Nieznany
więcej podobnych podstron