
1
MEDYCYNA BIOMOLEKULARNA
DLACZEGO ANALIZUJEMY SK£AD MINERALNY W£OSÓW
tosowane analityczne metody oceny stany od¿ywienia opieraj¹ siê g³ównie
na badaniach krwi i moczu. Nale¿y jednak zauwa¿yæ, ¿e okreœlenie
S
zawartoœci pierwiastków w surowicy mo¿e nie oddawaæ aktualnej iloœci
tych pierwiastków w organizmie, poniewa¿ dzia³aj¹ mechanizmy homeostatyczne
wyrównuj¹ce poziom pierwiastków we krwi kosztem rezerw w tkankach. Mimo
pozornie prawid³owego stê¿enia w surowicy zawartoœæ pierwiastków w organizmie
mo¿e byæ niedostateczna. [K³os J., Lichodziejowska B. Czy pomiary stê¿enia magnezu
odzwierciedlaj¹ tkankowe zasoby tego jonu? Kardiol. Pol. 1996, 44, 516-527].
Spowodowane jest to tym, i¿ sk³ad osocza zale¿y od mechanizmów
homeostatycznych i koñcowe stê¿enie jest rezultatem wyrównywania stê¿eñ przez
poszczególne mechanizmy homeostatyczne.
Na podstawie badañ humoralnych trudno wykazaæ, ¿e istnieje niedobór
biopierwiastków w ustroju. Mo¿e on byæ spowodowany wieloma czynnikami, m.in.
wynikiem nieprawid³owego ¿ywienia, uwarunkowaniami œrodowiskowymi lub
stanami patologicznymi [Karczewski J. Pierwiastki chemiczne we w³osach aspekty
biochemiczne i diagnostyczne. Post. Hig. Med. Doœw. 1998, 52, 3, 283 295].
Wykazano, i¿ dobr¹ ocen¹ stanu przemiany mineralnej organizmu jest analiza
pierwiastkowa w³osów [Radomska K. Graczyk A. Konarski J. Analiza w³osów jako
metoda oceny stanu mineralnego organizmu. Pol. Tyg. Lek. 1991, 46, 479 481].
Iloœæ biopierwiastków we w³osach jest znacznie wy¿sza ni¿ w surowicy np.
zawartoœæ wapnia we w³osach jest oko³o dwieœcie razy wiêksza, magnezu oko³o
trzydzieœci razy [Stolarska K., Stêpniewski M., Pach J. Concentration of magnesium
in hair of inhabitans of down-town Krakow, the protestivezone et steel-Mill Huta im
Sêdzimira” and Tokarnia Village. Przegl. Lek. 1995, 52, 263 266] , cynku oko³o sto
razy, miedzi kilkanaœcie razy [K³os A., Franczyk H., Kosiñski J.,
Bertrandt J., Radomska K. ZawartoϾ magnez, cynku i miedzi
w diecie i we w³osach m³odych mê¿czyzn przebywaj¹cych
w ujednoliconych warunkach bytowania. Lek. Woj. 1990, 11, 139
143].
Dziêki temu we w³osach mo¿na oznaczaæ stê¿enia
biopierwiastków, których iloœæ w organizmie jest bardzo ma³a
przez co oznaczanie iloœciowe w surowicy jest bardzo trudne
[Kozielec T., Drybañska Kalita A., Hornowska I., Sa³acka A.
Zawartoœæ wapnia, magnezu, cynku, miedzi i ¿elaza we w³osach
dzieci i m³odzie¿y Polski. Merkuriusz Lekarski 1, 1996, 150-154].
Wi¹zanie biopierwiastków przez tworz¹ce siê bia³ko w³osa
jest uzale¿nione od iloœci i jakoœci spo¿ywanego bia³ka,
wêglowodanów, t³uszczy, witamin, sk³adników mineralnych i wody, a tak¿e
od wch³anialnoœci w uk³adzie pokarmowym zwi¹zków, w których pierwiastek
wystêpuje oraz od sprawnoœci mechanizmów dystrybucji.
W³osy stanowi¹ integraln¹ biologicznie i homogenn¹ chemicznie strukturê
tkankow¹. Keratynowa zewnêtrzna otoczka w³osa w pe³ni zapobiega zarówno utracie
sk³adników wewnêtrznych, jak i przedostawaniu siê do œrodka zanieczyszczeñ
zewnêtrznych. Zapewnia to sta³oœæ sk³adu chemicznego. Biopierwiastki
s¹ wbudowywane stale w strukturê w³osów w trakcie ich wzrostu. Tym samym
stê¿enie kationów metali we w³osach dostarcza informacji o ich zawartoœci
w organizmie w d³u¿szym czasie, tj. 1-2 miesiêcy. Wynik analizy pierwiastkowej
w³osów nie jest obci¹¿ony wp³ywem krótkoterminowych zmian stê¿eñ kationów
metali, np. w przebiegu cyklu dobowego. Stê¿enia kationów metali w surowicy nie
informuj¹ nas w sposób pe³ny o ich iloœci w przedziale wewn¹trzkomórkowym
,a ponadto mo¿e byæ, jak w przypadku cynku, w du¿ym stopniu uzale¿nione od
stê¿enia bia³ek w surowicy. Szczególnie cenna jest analiza pierwiastków œladowych
toksycznych we w³osach. Analiza stê¿eñ pierwiastków œladowych we w³osach jest
wiêc najlepsz¹ metod¹ oceny stanu przemiany
mineralnej organizmu.
Wiele oœrodków naukowych na œwiecie
prowadzi pracê nad ocen¹ korelacji pomiêdzy
stê¿eniem pierwiastków œladowych we
w³osach, a iloœci¹ tych pierwiastków
w organizmie zarówno w przypadku
równowagi fizjologicznej, jak i podczas
zaburzeñ typu patologicznego.
Analiza pierwiastkowa w³osów jest coraz
b a r d z i e j d o c e n i a n y m n a r z ê d z i e m
diagnostycznym s³u¿¹cym do oceny stanu
od¿ywienia organizmu [Skorkowska-
Zieleniewska J. Biochemiczna ocena stanu
od¿ywienia mineralnego. Czêœæ II. Wapñ i
magnez. Przegl. Pediatr. 1987, 17, 95-103]
[Karczewski J. Próba oceny œrodowiska
cz³owieka w oparciu o zawartoœæ magnezu w
wybranych materia³ach biologicznych.
( r o z p r a w a h a b i l i t a c y j n a ) . O f i c y n a
Wydawnicza AM w Bia³ymstoku].
Przy coraz pe³niejszym wykorzystaniu
n o w o c z e s n y c h m e t o d a n a l i t y c z n y c h
weryfikowana jest hipoteza, ¿e wszystkie
pierwiastki wystêpuj¹ce we
w s z e c h œ w i e c i e
s¹ obecne w organizmie ludzkim.
Dot¹d ustalono, ¿e olbrzymia
wiêkszoœæ, bo a¿ 81, znajduje siê
w t k a n k a c h i p ³ y n a c h
fizjologicznych. Pozwala to
w i d z i e æ c z ³ o w i e k a j a k o
integraln¹ czêœæ przyrody.
S p o œ r ó d 1 0 4 z n a n y c h
pierwiastków wystêpuj¹cych w
przyrodzie cztery z nich (wêgiel,
wodór, azot i tlen) stanowi¹ a¿
96% masy naszego cia³a.
Zgodnie z zaleceniem The Food and Nutrition
Boaed of the National Akademy of Sciences
U S A - p i e r w i a s t k i w y s t ê p u j ¹ c e
w organizmie ludzkim w iloœciach wiêkszych
ni¿ 0,01% nosz¹ nazwê makroelementów lub
makrobio-pierwiastków (nale¿¹ do nich wapñ,
magnez, fosfor, siarka, potas, sód, chlor),
pozosta³e wystêpuj¹ce w iloœciach poni¿ej
0,01% nosz¹ nazwê mikroelementów lub
mikrobiopierwiastków (¿elazo, cynk, miedŸ,
molibden, nikiel, kobalt, chrom, mangan ).
Do trzeciej grupy nale¿¹ pierwiastki silnie
toksyczne, których obecnoœæ w organizmie
w ka¿dym stê¿eniu jest niepo¿¹dana (tal, o³ów,
rtêæ, glin). Szkodliwoœæ ich zale¿y od wielu
Chiñskie przys³owie
mówi:
„Je¿eli nie znasz ojca
choroby
to na pewno z³a dieta
jest jej matk¹ ...”

2
MEDYCYNA BIOMOLEKULARNA
czynników, ale najwa¿niejszymi s¹: stê¿enie danego pierwiastka i czas jego dzia³ania.
Istotn¹ rolê odgrywa zdolnoœæ organizmu do eliminacji tych pierwiastków; funkcje
takie spe³niaj¹ nerki, w¹troba i przewód pokarmowy.
Pierwiastki toksyczne maj¹ jednak¿e tendencje do gromadzenia siê w narz¹dach
mi¹¿szowych, przede wszystkim w w¹trobie, nerkach, trzustce. Przy przewlek³ym
nara¿eniu na nie mog¹ odk³adaæ siê równie¿ w innych tkankach np.: o³ów i aluminium
w koœciach, o³ów, rtêæ, aluminium w tkance mózgowej, a kadm w cebulkach w³osów.
Najnowsze badania wykazuj¹, ¿e lista pierwiastków zaliczanych do
mikroelementów nie zosta³a jeszcze zamkniêta. Nie wypowiedziano siê do koñca o
roli niklu, cyny, strontu.
Makro-i mikroelementy winny wystêpowaæ w organizmie w œciœle okreœlonych
zakresach stê¿eñ, ich niedobory prowadz¹ do powa¿nych zaburzeñ metabolicznych
wywo³uj¹cych chorobê, a nawet œmieræ. Tylko niektóre z nich (magnez, cynk, jod)
mog¹ osi¹gaæ wiêksze stê¿enia nie przynosz¹c wiêkszych szkód organizmowi.
Fizjologiczne procesy ¿yciowe zale¿¹ nie tylko od sk³adu i stê¿enia
poszczególnych pierwiastków, lecz równie¿ od ich proporcji w ustroju. Niektóre
„wspó³pracuj¹” ze sob¹, inne s¹ wobec siebie „konkurencyjne”. Nadmiar czy niedobór
jednego pierwiastka wp³ywa na zmianê zawartoœci innych.
W z a j e m n e o d d z i a ³ y w a n i e w y s t ê p u j ¹ c e m i ê d z y p o s z c z e g ó l n y m i
biopierwiastkami, a tak¿e metalami toksycznymi, ma ogromny wp³yw na ich
przyswajanie w przewodzie pokarmowym, jak równie¿ na wch³anianie komórkowe.
Ustalono, ¿e niedobór magnezu w organizmie u³atwia wch³anianie o³owiu,
niedobór cynku sprzyja wch³anianiu kadmu, natomiast nadmiar fosforanów utrudnia
przyswajanie zarówno wapnia, jak i magnezu..
W przypadku niedoboru pierwiastków zwiêksza siê zdolnoœæ przyswajania,
w przypadku nadmiaru maleje, chroni¹c organizm przed zatruciem. Dla
poszczególnych obszarów organizmu istnieje œciœle okreœlona równowaga jonowa,
która utrzymuje siê na sta³ym poziomie. Na podstawie proporcji pomiêdzy pewnymi
pierwiastkami mo¿na oceniæ aktywnoœæ metaboliczn¹ i prawid³owoœæ procesów
fizjologicznych. Pomiêdzy pierwiastkami œladowymi istniej¹ zwi¹zki synergistyczne
i antagonistyczne wp³ywaj¹ce bezpoœrednio na metabolizm ustroju. Zachowanie
w³aœciwych relacji pomiêdzy poszczególnymi pierwiastkami jest w wielu
przypadkach wa¿niejsze od ich prawid³owego stê¿enia.
Obok wymienionych czynników, które decyduj¹ o przyswajalnoœci
poszczególnych biopierwiastków nale¿y wspomnieæ o wp³ywie witamin na
przyswajalnoœæ poszczególnych pierwiastków. Wiele z nich ma odpowiedni¹
witaminê, która u³atwia jego wch³anianie i wspó³dzia³a w jego biodostêpnoœci
komórkowej (szczegó³y w dalszym tekœcie).
Wch³anianie pierwiastków odbywa siê równie¿ podczas oddychania i przez skórê.
Dziêki mechanizmom obronnym organizm usi³uje wydaliæ szkodliwe pierwiastki
z moczem i ka³em. Je¿eli jednak nastêpuje drastyczne ska¿enie œrodowiska toksynami
organizm ludzki, mimo wspomnianych mechanizmów obronnych reaguje chorob¹.
Istnieje prawdopodobieñstwo chemicznego oddzia³ywania miêdzy metalami
toksycznymi i toksynami organicznymi, w wyniku czego powstaj¹ po³¹czenia
o niezbadanej jeszcze szkodliwoœci dla organizmu.
W 1983 r. w New Delhi odby³a siê pierwsza miêdzynarodowa konferencja pod
patronatem Œwiatowej Organizacji Zdrowia (WHO) na temat: „Pierwiastki w zdrowiu
i chorobie”. W Polsce pionierem badañ nad rol¹ biopierwiastków by³ prof. Julian
Aleksandrowicz.
Postêp nauki i rozwój techniki spowodowa³, ¿e metody iloœciowego oznaczania
pierwiastków s¹ coraz dok³adniejsze i bardziej precyzyjne. Wysok¹ czu³oœæ badañ
zapewnia absorpcyjna spektrometria atomowa (ASA), spektometria emisji atomowej
ze wzbudzeniem plazmowym (ICP -AES), czy te¿ technika aktywacji neutronowej
(NAA). Nowoczesna aparatura analityczna pozwala przeprowadziæ analizê stê¿eñ
pierwiastków z jednej próby. Daje to mo¿liwoœæ wykonania pomiaru wielu
pierwiastków w krótkim czasie z niewielkiej iloœci materia³u, co w przypadku badañ
biologicznych odgrywa niebagateln¹ rolê. Laboratorium biomol do oznaczania
pierwiastków wykorzystuje technikê ICP (spektrometr emisji atomowej PERKIN
ELMER OPTIMA 200).
Analiza pierwiastkowa w³osów i moczu
dobowego jest wygodn¹ i niedrog¹ metod¹
oceny mineralnego stanu cz³owieka przy:
! wyst¹pieniu objawów klinicznych zespo³u
z ³ e g o w c h ³ a n i a n i a ( z a b u r z e n i a
gastrologiczne),
! z a b u r z e n i a c h r e g u l a c j i g r u c z o ³ ó w
wewnêtrznego wydzielania (zaburzenia
hormonalne),
! zaburzeniach neurologicznych,
! z a b u r z e n i a c h d e r m a t o l o g i c z n y c h
(³uszczyca, bielactwo, wypadanie w³osów),
! leczeniu oty³oœci,
! schorzeniach kostno-stawowych,
! zaburzeniach kardiologicznych,
! zatruciach pierwiastkami toksycznymi,
! d³ugotrwa³ym wysi³ku fizycznym w pracy
i sporcie,
! rehabilitacji,
! profilaktyce.
Na podstawie profilu pierwiastków
mo¿na wysnuwaæ wnioski o:
! istnieniu zwiêkszonego ryzyka wyst¹pienia
okreœlonych schorzeñ,
! potencjalnie szkodliwym wp³ywie
pierwiastków toksycznych na metabolizm
osoby badanej,
! mo¿liwym zwi¹zku okreœlonego schorzenia
z wykazanymi np. niedoborami bio-
pierwiastków.
Ponadto, znaj¹c okreœlone schorzenia
pacjenta mo¿na wspomagaæ proces leczenia
p o p r z e z s e l e k t y w n ¹ s u p l e m e n t a c j ê
(wybiórcze uzupe³nianie) biopierwiastkami
nie tylko w schorzeniach ustalonej etiologii,
lecz tak¿e, w których patogeneza choroby jest
nieznana.
Znaczenie analizy pierwiastkowej
! Analiza pierwiastkowa w³osów ilustruje
iloœæ pierwiastków magazynowanych
przez organizm badanego.
! Analiza pierwiastkowa moczu dobowego
okreœla iloœæ pierwiastków wydalanych
przez organizm badanego
! Analiza pierwiastkowa w³osów i moczu
dobowego okreœla stan przemiany
mineralnej, na podstawie której mo¿na
oceniæ typ metabolizmu osoby badanej i
w s k a z a æ o d p o w i e d n i e z a l e c e n i a
dietetyczne.
! Stosowanie w³aœciwej diety i selektywnej
suplementacji zabezpiecza organizm przed
wieloma chorobami
! Zastosowanie odpowiedniej suplementacji
witaminowo mikroelementowej u osoby
chorej mo¿e wspomagaæ farmakoterapiê
przynosz¹c szybciej oczekiwane efekty

3
MEDYCYNA BIOMOLEKULARNA
i chroniæ organizm przed jej ubocznymi skutkami.
Podsumowanie
W mechanizmach przemiany materii uczestnicz¹ substancje mineralne odgrywaj¹ce wa¿n¹ ¿yciow¹ rolê ze wzglêdu na w³asnoœci
fizyko-chemiczne i udzia³ w strukturach biochemicznych. Przemiana zwi¹zków nieorganicznych, a szczególnie kationów metali
(makro- i mikroelementów) jest zwi¹zana z reakcjami enzymatycznymi ustroju. Metabolizm makro- i mikroeleentów jest regulowany
przez sk³adniki organiczne odgrywaj¹ce decyduj¹c¹ rolê w procesach metabolicznych. Procesy te uzale¿niony s¹ od sprawnoœci uk³adu
hormonalnego i nerwowego.
Analiza makro- i mikroelementów we w³osach daje dok³adny opis stanu metabolicznego organizmu. Sk³ad mineralny ustroju w du¿ej
mierze zale¿y od czynników zewnêtrznych. W zale¿noœci od rodzaju po¿ywienia, aktywnoœci fizycznej i stopnia ska¿enia œrodowiska
przebiegaj¹ w ustroju procesy mineralizacji (odk³adanie siê substancji mineralnych), demineralizacji (zubo¿enie ustroju w sk³adniki
mineralne) lub transmineralizacji (przegrupowanie siê sk³adników mineralnych w ustroju). Pierwiastki uwolnione w wyniku przemiany
materii mog¹ zostaæ ponownie u¿yte do nowych zadañ w przemianie materii.
Analiza sk³adu mineralnego w³osów sta³a siê testem analitycznym maj¹cym szerokie zastosowanie w rozpoznawaniu stanów
patologicznych.
W XX wieku wyjaœniono procesy powsta-wania i leczenia wielu chorób. Rozwój nauk medycznych pozwala na coraz dok³adniejsze
zbadanie natury cz³owieka. W d¹¿eniu do rozwi¹zywania niewyjaœnionych problemów medycznych nie wolno zapominaæ o podstawie
funkcjonowania ludzkiego organizmu, a mianowicie o w³aœciwym od¿ywianiu.
METABOLIZM ¯ELAZA
elazo jest po tlenie, krzemie, glinie, czwartym najbardziej
rozpowszechnionym pierwiastkiem na kuli ziemskiej. W roztworach
+2
¯
wodnych wystêpuje w dwóch stopniach utleniania - jako jon ¿elazawy (Fe )
+3
i ¿elazowy (Fe ). Zwi¹zki ¿elaza trójwartoœciowego s¹ s³abo rozpuszczalne.
Organizmy ¿ywe musia³y wytworzyæ mechanizmy umo¿liwiaj¹ce przekszta³cenie
+3
zwi¹zków ¿elazowych (Fe ), zwi¹zków nieprzyswajalnych w sole ¿elaza dostêpne dla
ustroju. Przemiana ¿elaza sk³ada siê z kilku etapów: wch³aniania, transportu i udzia³u
w procesach metabolicznych i magazynowania.
¯elazo spo¿yte w pokarmach lub suplementach trafiaj¹c do ¿o³¹dka, w którym jest
+3
kwaœne œrodowisko, utlenia siê do Fe . Dlatego wraz z suplementami ¿elaza nale¿y
spo¿ywaæ odpowiednie iloœci zwi¹zków redukuj¹cych, np. witaminy C (kwasu L-
askorbinowego).
Wch³anianie ¿elaza odbywa siê w dwunastnicy i górnej czêœci jelita cienkiego.
Œluzówka ¿o³¹dka te¿ ma zdolnoœæ wch³aniania ¿elaza dwuwartoœciowego. Sok
trzustkowy hamuje procesy wch³aniania ¿elaza, dlatego w przypadkach uszkodzenia
trzustki mo¿na zaobserwowaæ wzmo¿one wch³anianie ¿elaza.
Przyswajanie ¿elaza zmniejszaj¹ sole wapnia, fosforu, mleko, sery, herbata
(tanina), kawa i fityniany znajduj¹ce siê w nasionach zbó¿. Nadmiar w pokarmach
jednego z takich pierwiastków jak wapñ, cynk, mangan i ¿elazo powoduje blokowanie
przyswajania innych pierwiastków tej grupy. Nie wolno popijaæ suplementów
¿elazowych napojami typu Cola lub za¿ywaæ ich po posi³kach bogatych w fosforany,
jak np. ryby.
W organizmie cz³owieka znajduje siê od trzech do piêciu gramów ¿elaza. Oko³o
70% tej iloœci jest zwi¹zane w krwi, g³ównie w postaci hemoglobiny. W miêœniach
¿elazo wchodzi w sk³ad mioglobiny, czerwonego barwnika miêœni pe³ni¹cego funkcjê
przenoszenia tlenu wewn¹trz komórki.
W porównaniu z osobami zdrowymi, posiadaj¹cymi zrównowa¿one zapasy
¿elaza, przyswajalnoœæ ¿elaza roœnie nawet dziesiêciokrotnie u osób wykazuj¹cych
niedobory tego pierwiastka. Jest to swoisty mechanizm organizmu reguluj¹cy
gospodarkê ¿elazem. Ogólnie mo¿na przyj¹æ, ¿e zale¿nie od czynników
moduluj¹cych bioprzyswajalnoœæ, wch³anianie ¿elaza waha siê od 5 do ok. 25%.
Przyswajanie ¿elaza poprawia siê przy wyst¹pieniu jego niedoborów w organizmie.
¯elazo przechodzi przez nab³onek jelitowy jako dwuwartoœciowe i utlenia siê do
trójwartoœciowego. W komórkach nab³onka jelitowego ³¹czy siê z bia³kiem zwanym
apoferrytyn¹ tworz¹c ferrytynê. ¯elazo
przechodz¹c z komórek nab³onka do krwi
³¹czy siê z transferyn¹ - bia³kiem transportu-
j¹cym ¿elazo do szpiku kostnego, gdzie jest
wykorzystywane w procesie erytropoezy
(tworzenia krwinek czerwonych).
Pobieranie ¿elaza przez komórki odbywa
siê poprzez receptory wi¹¿¹ce transferynê
+ 3
Fe , bêd¹ce bia³kiem trans-b³onowym
sk³adaj¹cym siê z dwóch monomerów
glikoproteinowych po³¹czonych mostkiem
siarczkowym. Po stronie wewnêtrznej b³ony
komórkowej znajduj¹ siê kwasy t³uszczowe
zwi¹zane z tymi bia³kami kowalencyjnie.
Kompleks receptor transferyna ¿elazo ulega
inwaginacji na drodze endocytozy tworz¹c w
cytoplazmie wakuole. Kwasowe œrodowisko
wakuoli powoduje uwolnienie ¿elaza
z transferyny, natomiast kompleks receptor
transferyna powraca na powierzchniê b³ony
komórkowej odzyskuj¹c zdolnoœæ do
transportu nastêpnych kationów ¿elaza.
Pomiêdzy ekspresj¹ receptorów transferyny
a proliferacj¹ komórek stwierdzono œcis³¹
z a l e ¿ n o œ æ , k t ó r ¹ w y k o r z y s t y w a n o
w próbach leczenia nowotworów poprzez
blokowanie kompleksu receptor transferyna,
np. zwi¹zkami galu.
¯elazo wystêpuje w organizmie
w nastêpuj¹cych zwi¹zkach:
! hemoproteiny: hemoglobina, mioglobina,
cytichriomy, enzymy;
transferyna (b-globulina osocza):
DR N. MED. S£AWOMIR PUCZKOWSKI

laktoferyna, laktotransferyna z wydzielin zewn¹trz-komórkowych (mleko, ³zy,
sok trzustkowy) i z wydzielin wewn¹trzkomórkowych (leukocyty);
!
ferrytyna, bia³ko bêd¹ce podstawowym magazynem „rozpuszczalnego” ¿elaza
w komórkach;
!
hemosyderyna, trwa³e po³¹czenie ¿elaza z bia³kiem;
!
enzymy zawieraj¹ce ¿elazo: katalaza, peroksydaza, reduktaza rybonukleotydowa,
dehydrogenaza bursztynianowa, oksydaza cytochromowa i inne;
!
poœrednia pula ¿elaza: chelatowe kompleksy z niskocz¹steczkowymi zwi¹zkami:
z cytrynianami, nukleotydami, aminokwasami, cukrami itd.;
zewn¹trzkomórkowych. Ferrytyna H ma
wiêksze powinowactwo do ¿elaza od formy L.
Wi¹zanie ¿elaza cz¹steczce ferrytyny
przebiega po uprzednim utlenieniu
do
. T e m u p r o c e s o w i t o w a r z y s z y
powstawanie reaktywnych form tlenu
(rodników), które mog¹ powstawaæ jedynie
we wnêtrzu cz¹steczki ferrytyny. Otoczka
b i a ³ k o w a z a b e z p i e c z a s t r u k t u r y
wewn¹trzkomórkowe przed toksycznym
dzia³aniem wolnych rodników.
W okresach niedoboru ¿elaza nastêpuje
mobilizacja ¿elaza z ferrytyny. Aby
„odzyskaæ” wolne ¿elazo z ferrytyny
konieczne s¹ zwi¹zki posiadaj¹ce potencja³
+3
+2
redukuj¹cy Fe do Fe . Rolê reduktorów
m o g ¹ p e ³ n i æ t i o l e , f l a w o e n z y m y
i anionorodnik ponadtlenkowy. Wymagana
j e s t r ó w n i e ¿ o b e c n o œ æ z w i ¹ z k ó w
chelatuj¹cych, które wi¹¿¹c ¿elazo tworz¹
„pulê poœredni¹”. Proces uwalniana ¿elaza
z f e r r y t y n t j e s t b a r d z o z ³ o ¿ o n y .
Prawdopodobnie uczestniczy w nim równie¿
apoferrytyna.
Równowaga pomiêdzy ¿elazem puli
poœredniej i ¿elazem zwi¹zanym z bia³kami
decyduje o nasileniu generacji wolnych
rodników (reaktywnych form tlenu)
w reakcjach Fentona i peroksydacji lipidowej.
Najbardziej niebezpieczny rodnik hydroksy-
lowy mo¿e niszczyæ struktury komórkowe
prowadz¹c do licznych patologii. Szczególnie
niebezpieczne jest pojawienie siê zbyt du¿ej
iloœci ¿elaza w puli poœredniej w samoistnej
hemochromatozie.
Wolne rodniki niszcz¹ strukturê bia³kow¹
ferrytyny i prawdopodobnie w ten sposób
powstaje hemosyderyna. ¯elazo uwiêzione
w hemosyderynie nie mo¿e byæ powtórnie
wykorzystane przez organizm. Jednak
hemosyderyna wi¹¿¹c trwale ¿elazo
zabezpiecza organizm przed generacj¹
reaktywnych form tlenu. Na podstawie
p o w y ¿ s z e g o p o m i ê d z y m o ¿ l i w o œ c i ¹
generowania wolnych rodników a przemian¹
¿elaza i transferyny istnieje dynamiczna
równowaga, której stan decyduje o w³aœciwej
przemianie ¿elaza jak o potencjale anty-
oksydacyjnym ustroju.
W s u r o w i c y w y s t ê p u j e j e d y n i e
podjednostka ferrytyny L, która zawiera
+3
najmniej Fe . Jest ona ualniana przez komórki
uk³adu siateczkowo-œródb³onkowego.
ZawartoϾ ferrytyny w osoczu odzwierciedla
stan zmagazynowanego ¿elaza w organizmie.
Oznaczania iloœci ferrytyny jest wa¿nym
parametrem oceniaj¹cym gospodarkê ¿elaza.
+2
Fe
+ 3
F e
Jelito
¿elazo pokarmowe
+3
+2
Fe + Fe
+3
+2
Fe
Fe
+3
ferrytyna Fe
Komórka b³ony œluzowej
zwi¹zek niebia³kowy
+2
Fe
+2
Fe
enzymy
+3
ferrytyna Fe
apoferrytyna
Osocze
+2
Fe +apotransferyna
+3
transferyna Fe
Pula poœrednia zwi¹zków ¿elaza bierze udzia³ w przenoszeniu w komórkach
¿elaza z transferyny do ferrytyny, syntezy hemoprotein i aktywacji enzymów.
W enterocytach tylko ¿elazo z puli poœredniej zostaje wch³oniête i przetransportowane
do krwi, natomiast ¿elazo trójwartoœciowe zwi¹zane w ferrytynie jest wydalane
w z³uszczaj¹cych siê komórkach ok³adzinowych.
¯elazo staje siê noœnikiem tlenu w organizmie w chodz¹c w sk³ad hemoglobiny
w czerwonych krwinkach. W procesie tworzenia hemoglobiny uczestniczy równie¿
witamina B . W krwi doros³ego cz³owieka znajduje siê oko³o 35 trylionów
6
czerwonych cia³ek. W ci¹gu jednej sekundy nastêpuje rozpad oko³o 10 milionów
krwinek, a na ich miejsce powstaj¹ nowe krwinki. Szczególnie szybki rozpad krwinek
nastêpuje podczas intensywnych i d³ugotrwa³ych wysi³ków fizycznych.
Ka¿da ¿ywa komórka dla utrzymania procesów matabolicznych potrzebuje m.in.
¿elaza. Bez niego komórka obumiera. Fakt ten by³ wykorzystywany w próbach
leczenia chorób nowotworowych. Mechanizm ten jest równie¿ wykorzystywany
przez laktoferynê chroni¹c¹ mleko, œrodowisko oczu, p³yn jelitowy i nasienie przed
inwazj¹ bakteryjn¹. W osoczu latkoferyna pochodzi z ziarnistoœci wtórnych neutrofili
i uwalniana jest w czasie zakwaszenia organizmu, tj. podczas stanów zapalnych lub
w ketozie. Laktoferyna wykazuje wy¿sze powinowactwo do ¿elaza ni¿ transferyna,
dlatego przejmuje funkcje bakteriostatyczn¹ w czasie infekcji. W d³ugotrwa³ej ketozie
laktoferyna mo¿e wi¹zaæ ¿elazo z puli poœredniej, co mo¿e prowadziæ do nadmiernego
zmagazynowania ¿elaza. Manifestuje siê to zwiêkszeniem iloœci ¿elaza we w³osach.
Laktoferyna w osoczu pe³ni wiele istotnych funkcji, m.in.: ma wp³yw na agregacje
neutrocytów, supresjê produkcji przeciwcia³, inhibicje wytwarzania CSF.
Feerrytyna jest bia³kiem wykazuj¹cym swoistoœæ narz¹dow¹ przez co bierze
udzia³ w mechanizmie magazynowania i uwalniania ¿elaza. Ferrytyna jest sferyczn¹
cz¹steczk¹ bia³kow¹ zbudowan¹ z 24 podjednostek polipeptydowych, we wnêtrzu
której znajduje siê oko³o 2000 atomów ¿elaza w postaci ufosforylowanego zwi¹zku
hydroksy-¿elazowego. Ferrytyna jest rozpuszczalna w œrodowisku wodnym
i dlatego pe³ni funkcjê zarówno magazynu ¿elaza jak detoksykacji cytozolu.
Opisano trzy typy struktur ferrytyny: lekk¹ (L), ciê¿k¹ (H) i glikozylowan¹ (G).
Forma L znajduje siê przede wszystkim we w¹trobie, œledzionie i ³o¿ysku, czyli
w tkankach magazynuj¹cych du¿e iloœci ¿elaza. Ferrytyna H wystêpuje w komórkach
serca, nerek, erytrocytach, limfocytach i monocytach. Stwierdzono jej obecnoϾ
w komórkach nowotworowych. Ferrytyna G wystêpuje jedynie w p³ynach
4
MEDYCYNA BIOMOLEKULARNA

5
MEDYCYNA BIOMOLEKULARNA
Umo¿liwia wykrycie przed i utajone stany niedoboru ¿elaza. Oznaczanie ferrytyny
jest przydatne w ró¿nicowaniu niedokrwistoœci na tle rzeczywistego niedoboru od
niedo-krwistoœci objawowych (stany zapalne, nowotwory).
Do oceny niedokrwistoœci przyjêto nastêpuj¹ce wskaŸniki:
ferrytyna surowicy hemoglobina rozpoznanie
prawid³owa
prawid³owa
nie ma niedoboru
obni¿ona
prawid³owa
zmniejszenie iloœci ¿elaza zmagazynowanego
obni¿ona
obni¿ona
niedokrwistoœæ na tle niedoboru ¿elaza
prawid³owa
b. niska
inna przyczyna niedokrwistoœci
W piœmiennictwie przyjmuje siê doœæ rozbie¿ne wartoœci referencyjne: 20 250 ug/L (mê¿czyŸni); 12 125 ug/L (kobiety).
U osób zmar³ych na chorobê Parkinsona stwierdzono w istocie szarej
zmniejszenie aktywnoœci peroksydazy glitationowej, zredukowanego glutationu i
katalazy. Stwierdzono równie¿ zwiêkszenie aktywnoœci dusmutazy ponadtlenkowej.
+2
Wskazuje to na mo¿liwoœæ zwiêkszenia iloœci nadtlenku wodoru. Obecnoœæ Fe w
substancji czarnej (w makrofagach, astrocytach, reakty-wnym mikrogleju,
Stê¿enie ferrytyny w surowicy jest bardzo ma³e, dlatego oznaczane jest ona
testami ELISA., w po³¹czeniu z oznaczeniem spektrometrofluorymetrycznym.
Ta technika oznaczania nie jest ogólnie dostêpna, dlatego dobr¹ alternatyw¹ jest
analiza pierwiastkowa w³osów. Dziêki oznaczaniu innych biopierwiastków, tj. miedŸ,
kobalt, mo¿emy oceniæ stan przemiany ¿elaza.
Niedobór ¿elaza powoduje wiele niekorzystnych skutków zdrowotnych jak;
spadek sprawnoœci fizycznej, obni¿enie mo¿liwoœci koncentracji i sprawnoœci
umys³owej, niesprawnoœæ pamiêci i z³y nastrój, zmniejszenie odpornoœci
na przeziêbienia i infekcje lub zaburzenia rytmu pracy serca. Charakterystycznym
objawem niedoboru ¿elaza jest, ³aknienie spaczone, czyli apetyt na produkty nie
zaliczane do pokarmów, jak krochmal, lód, tynk i inne. Ostatnim stadium niedoboru
¿elaza jest anemia, podczas której skutki niedoboru ¿elaza przyjmuj¹ stan ostry.
Niedokrwistoœæ spotyka siê bardzo czêsto gdy¿ nawet, pozornie zdrowa i urozmaicona
dieta mo¿e dostarczaæ zbyt ma³o ¿elaza. Szczególnie na niedobory ¿elaza nara¿one s¹
dzieci, dziewczêta (odchudzaj¹ce siê) i kobiety z powodu utraty krwi
w cyklach miesi¹czkowych, kobiety w ci¹¿y, kobiety po menopauzie, sportowcy
uprawiaj¹cy sporty wytrzyma³oœciowe a zw³aszcza osoby starsze, uprawiaj¹ce takie
sporty. Poniewa¿ ¿elazo jest niezbêdne do rozwoju i funkcjonowania mózgu
w wypadku jego braku w okresie p³odowym i niemowlêcym nastêpuje niedorozwój
umys³owy i niedorozwój fizyczny z zaburzeniem koordynacji wzroku i r¹k. Stosuje
siê wtedy dodatkowe podawanie preparatów ¿elaza, zreszt¹ nie zawsze dobrze
przyswajanych. Zbyt du¿e dawki tych preparatów mog¹ wywo³ywaæ zaburzenia
trawienne, biegunkê lub nudnoœci.
¯elazo w chorobach neurozwyrodnieniowych
Z poœród wszystkich mikroelementów mózg zawiera najwiêksz¹ iloœæ ¿elaza
(zwi¹zanego z bia³kiem, o którym jeszcze niewiele wiadomo) rozmieszczonego
nierównomiernie. Najwiêcej wystêpuje w zwojach podstawy mózgu, j¹drze
czerwonym i zêbatym. Wystêpuje g³ównie zwi¹zane w ferrytynie. ¯elazo jest
magazynowane w mózgu przed zamkniêciem bariery krew mózg. Rola ¿elaza w pacy
mózgu jest jeszcze nie rozpoznana. Jednak stwierdzono, i¿ jest ono niezbêdne
do prawid³owego przebiegu procesu uczenia siê i zapamiêtywania. Metabolizm ¿elaza
w mózgu jest bardzo wolny, a sam mózg ma mo¿liwoœæ powstrzymania ubytku ¿elaza.
D³ugotrwa³y niedobór ¿elaza prowadzi jednak do zubo¿enia zawartoœci ¿elaza
w mózgu, szczególnie w zwojach podstawy mózgu. Wystêpuje wtedy upoœledzenie
funkcji poznawczych i przekaŸnictwa dopaminergicznego, co jest zwi¹zane
z regulacj¹ receptorów D1 i D2, jak równie¿ w wtórnym zaburzeniem wychwytu i
katabolizmu monoamin. Wp³ywanie na iloœæ ¿elaza w mózgu jest niezwykle trudne. W
chorobach neurozwyrodnieniowych i pod wp³ywem neurotoksyn nastêpuje
zwiêkszenie iloœci ¿elaza w miejscach uszkodzeñ. Mo¿na ten fakt wyt³umaczyæ
zak³adaj¹c prawdziwoœæ teorii przypisuj¹cej
niszczycielsk¹ rolê procesom wolnorodniko-
wym, które generowane s¹ g³ównie w reakcji
+2
Fentona, przy udziale Fe . Kaskada reakcji
wolnorodnikowych, g³ównie peroksydacja
lipidów powoduje niszczenie b³on komórko-
wych zwiêkszaj¹c ich przepuszczalnoœæ
g³ównie dla wapnia. w pr¹¿kowiu i ga³ce
+3
+2
bladej) i zmiana proporcji Fe : Fe z 2:1 (w
mózgach osób zdrowych) na 1:2 w mózgach
pacjentów z chorob¹ Parkinsona, wskazuje na
wzmo¿on¹ generacj¹ rodnika hydroksylo-
wego, który mo¿e niszczyæ strukturê komórek
mózgu. Potwierdzaj¹ to badania post mortem
w których stwierdzono zwiêkszon¹ iloœæ
TBARS w substancji czarnej, co jest
bezpoœrednim dowodem na wolnorodnikow¹
etiologiê choroby Parkinsona.
W chorobie Alzheimera iloœæ ¿elaza jest
zwiêkszona w niektórych regionach mózgu, tj.
hipokamp i kora ciemieniowa. Stwierdzono
zwiêkszone iloœci ¿elaza w mózgu u osób ze
s t w a r d n i e n i e m z a n i k o w y m b o c z n y m
i otêpieniem w przebiegu choroby Parkinsona.
S t w a r d n i e n i e b o c z n e z a n i k o w e j e s t
z a b u r z e n i e m c h a r a k t e r y z u j ¹ c y m s i ê
postêpuj¹c¹ utrat¹ neuronów ruchowych
w korze, pniu mózgu i rdzeniu krêgowym.
Zwiêkszona iloœæ ¿elaza mo¿e byæ wynikiem
z w y r o d n i e n i a n e u r o n a l n e g o ( a n i e
specyficznym wyk³adnikiem choroby) lub
mo¿e wskazywaæ na powi¹zanie wolnorodni-
kowej peroksydacji lipidowej prowadz¹cej do
œmierci komórek nerwowych. Stwierdzono
równie¿, i¿ nie ulega zmianie zawartoœæ
innych metali, tj. miedŸ, cynk i magnez.
W mózgu ¿elazo zawarte w surowicy
stanowi bardzo ma³¹ czêœæ, poniewa¿ nie
przekracza bariery mózg krew. Zwiêkszona
iloœæ ¿elaza w substancji czarnej w chorobie
Parkinsona i w innych zaburzeniach neuro-
zwyrodnieniowych jest spowodowane albo
uszkodzeniem bariery mózg krew albo
mobilizacj¹ ¿elaza z ferrytyny komórkowej
(równie¿ z nieneuronalnych komórek mózgu).
Wszystkie reduktory mog¹ uwalniaæ ¿elaza
z ferrytyny. Zalicza siê do nich dopaminergi-
czne neurotoksyny 6-OHDA i MPTM,
wywo³uj¹ce chorob¹ Parkinsona.
Na podstawie opublikowanych badañ
mo¿na wysnuæ wniosek o œcis³ym powi¹zaniu
przemiany ¿elaza z przebiegiem chorób
neurozwyrodnieniowych. Dlatego nale¿a³oby
zbadaæ pod tym wzglêdem leki przeciw-
zapalne i chelatory ¿elaza (przekraczaj¹ce
barierê krew mózg). Mog¹ one opóŸniaæ lub
z a p o b i e g a æ p i e r w o t n y m i W t ó r n y m
zwyrodnieniom neurologicznym.

6
MEDYCYNA BIOMOLEKULARNA
Bibligrafia
1. Wilhelm R. Frisell Human biochemistry, Macmillan publishing Co., Inc. New York 1982
2. Ludwig Heilmeyer Patofizjologia szczegó³owa, Pañstwowy Zak³ad Wydawnictw Lekarskich, Warszawa 1973
3. Alina Kabata-Pendias, Henryk Pendias Biogeochemia Pierwiastów Œladowych, Wydawnictwo Naukowe PWN, Warszawa 1999
ZASTOSOWANIE PIERWIASTKOWEJ ANALIZY W£OSA W REHABILITACJI
NA PRZYK£ADZIE IDIOPATYCZNEJ BOCZNEJ SKOLIOZY
oczne skrzywienie krêgos³upa to odchylenie osi anatomicznej od osi
mechanicznej krêgos³upa w p³aszczyŸnie czo³owo - strza³kowej (Wejsflog
B
1950). Za rzeczywiste boczne skrzywienie krêgos³upa nale¿y uznaæ jego
wielop³aszczyznowe zniekszta³cenie, w którym obok wyboczenia w p³aszczyŸnie
czo³owej wystêpuj¹ zmiany wielkoœci krzywizn w p³aszczyŸnie strza³kowej oraz
rotacja i torsja krêgów (Tylman 1972).
Etiologia bocznych idiopatycznych skrzywieñ krêgos³upa jest przedmiotem badañ
ju¿ od bardzo wielu lat. Powstanie i rozwój skoliozy zale¿¹ od dwóch czynników
etiologicznego i biochemicznego. Pierwszy mo¿e byæ bardzo ró¿norodny
i zapocz¹tkowuje powstawania skrzywienia, drugi jest wspólny dla wszystkich
skrzywieñ (bez wzglêdu na etiologie) i dzia³a zgodnie z prawami fizyki oraz z prawami
wzrostu. Czynnik ten steruje rozwojem skoliozy.
Szereg teorii, które powsta³y na przestrzeni ostatnich kilkunastu lat nie zosta³y
ostatecznie potwierdzone i przyjête [ 1 ]. Teorie te mo¿na podzieliæ na (wg Tylmana):
!
Teoria zmian wrodzonych
!
Teoria skrzywieñ fizjologicznych
!
Teoria zmian krzywiczych
!
Teoria anatomiczno- czynnoœciowa
!
Teoria osteoplastyczna
!
Teoria zaburzeñ wzrostowych
!
Teoria zaburzeñ równowagi napiêæ miêœniowych
!
Teoria zmian dziedzicznych
W podejœciu do zagadnienia patogenezy i patomechaniki skolioz istniej¹ dwie
grupy pogl¹dów. Jedni badacze (Heuer, Mac Lennan i inni) dopatruj¹ siê patologii
w krêgach i kr¹¿kach miêdzykrêgowych lub wiêzad³ach, a wiec w biernym aparacie
podpórczym krêgos³upa. Druga grupa badaczy (Bayer , Gruca) uwa¿a za pierwotne
zaburzenia w równowadze miêœniowej [1,2 ].
Prawdopodobnie jedni i drudzy badacze maj¹ racjê z uwagi, bowiem, istnieje
wysokie prawdopodobieñstwo, ¿e w skoliozach w³aœnie ta tkanka jest mniej
wartoœciowa lub jej synteza jest zaburzona. W po³¹czeniu z zaburzeniami napiêcia
miêœniowego mo¿e powodowaæ skoliozy.
Tkanka ³¹czna sk³ada siê z komórek (fibroblasty, osteoblasty) elementów
w³óknistych i tzw. bezpostaciowej substancji miêdzykomórkowej. G³ównymi
bia³kami tkanki ³¹cznej s¹ kolagen, elastyna i keratyna i s¹ to bia³ka o bardzo wolnym
turnover.
W okresie wzrostu turnover kolagenu i innych bia³ek tkanki ³¹cznej jest znacznie
przyœpieszony.
Na podstawie w³asnych doœwiadczeñ i przegl¹du czasopiœmiennictwa wynika,
¿e mimo nagromadzonej wiedzy szczególnie w ostatnich latach, koniecznoœæ pokrycia
zapotrzebowania na pierwiastki œladowe i witaminy u dzieci i m³odzie¿y nie jest
nale¿ycie doceniana.
Mo¿na, wiêc wysnuæ hipotezê, ¿e w okresie intensywnego wzrostu przy doœæ
szybkim zmianach metabolicznych i czêstych niedoborach ¿ywieniowych dzieci [3,4]
mo¿e dojœæ do zaburzeñ prawid³owego formowania siê tkanki ³¹cznej i w rezultacie
prowadziæ do du¿ej podatnoœci na jej uszkodzenia lub zniekszta³cenia.
Istotnymi sk³adnikami biochemicznym
maj¹cymi wp³yw na prawid³ow¹ syntezê
tkanki ³¹cznej s¹:
!
MiedŸ bierze udzia³ w tworzeniu wi¹zañ
poprzecznych w kolagenie [5].
!
¯elazo przy niedoborze tego pierwiastka
stwierdza siê zmniejszenie aktywnoœci
enzymu hydroksylujacego i maleje iloϾ
hydroksy proliny w protokolagenie ulega to
jeszcze nasileniu przy niedostatecznej iloœci
kwasy askorbinowego [6,7].
!
Mangan bierze udzia³ w aktywacji
glikozylotransferazy enzymu bioracego
udzia³ w syntezie mukopolisacharydów
chrz¹stek
[ 8].
!
Cynk, poniewa¿ jest stymulatorem syntezy
bia³ek to jego niedobór powoduje
zmniejszenie siê syntezy kolagenu [9].
!
Kwas askorbinowy uczestniczy on
w hydroksylacji reszt proliny, a tak¿e
lizyny, do hydoksyproliny i hydro-
ksylizyny, co przy jego niedoborze daje
zaburzenia w prawid³owym przebiegu
tworzenia siê kolagenu [6].
DoϾ istotny jest tez stosunek wapnia do
magnezu. Wapñ i magnez s¹ wa¿nymi
pierwiastkami, które odgrywaj¹ zasadnicza
role w reakcjach skurczu i rozkurczu miêœni.
Magnez, bowiem pe³ni rolê modyfikatora
d z i a ³ a n i a w a p n i a , k t ó r y j e s t j o n e m
p o b u d z a j ¹ c y m m i ê œ n i e d o s k u r c z u , .
Zachowanie równowagi tej równowagi bêdzie
mia³o istotny wp³yw na prawid³owe napiêcie
miêœniowe. W badaniach Dobosiewicz i wsp.
[9] stwierdzono u dzieci z idiopatyczn¹
skolioz¹ niskie stê¿enie fosforu w surowicy.
Z uwagi na jego antagonistyczny wp³yw
fosforu na wapñ, bêdzie siê to przyczyniaæ do
zwiêkszonego gromadzenia wapnia i zaburzaæ
prawid³owy stosunek Ca/Mg czêsto nawet
przy prawid³owym stê¿eniu magnezu [ 10].
Istnieje tylko pytanie, w jaki sposób mo¿na
oceniaæ najdok³adniej przemianê mineraln¹
w organizmie cz³owieka. Badanie „
DR N. MED. S£AWOMIR PUCZKOWSKI

7
MEDYCYNA BIOMOLEKULARNA
klasycznego „ materia³u analitycznego, jakim jest surowica krwi ¿ylnej nie jest
optymalnym wyk³adnikiem zaburzeñ równowagi biochemicznej metali niezbêdnych.
Zachêcaj¹c¹ alternatyw¹ analityczna wydaje siê w tym kontekœcie badanie w³osów
[4,11,12].Na jego przyk³adzie mo¿na stwierdziæ zaburzenia równowagi pomiêdzy
pierwiastkami a tak¿e skutek antago-nistycznych i synergistycznych wp³ywów
pierwiastków na witaminy i wnioskowaæ o ewentualnych niedoborach lub nadmiarach
poszczególnych witamin. [14]
Pierwszymi badaczami, którzy zbadali zawartoœci] pierwistków we w³osach ludzi
z idiopatycznym skrzywieniem krêgos³upa byli Pratt i Phippen w 1980 roku. [13]
Przebadano wówczas 74 pacjentów z idiopatycznym skrzywieniem krêgos³upa od
9 do 18 lat, stanowi³o 25 dzieci w podobnym wieku. W porównaniu z grup¹
odniesienia w badanej grupie stwierdzono znacz¹cy wzrost stê¿enia miedzi. Podobne
badania przeprowadzone przez naukowca z Dallas Dr. Artura Copesa, by³y zbie¿ne z
wynikami Pratta i Phippena. [13]
Badania Pratta i Phippena pokaza³y, ¿e stosunek Zn/Cu u dzieci z idiopatycznym
skrzywieniem krêgos³upa wynosi 3:12. W innych badaniach stosunek ten wyniós³ 3:7,
[ wartoϾ idealna 8:1].
MiedŸ wykazuje antagonistyczne dzia³anie w stosunku do cynku, ¿elaza,
i manganu. Kumulacja miedzi w tkankach powoduje wzglêdny niedobór w/w
pierwistków.
Niedobór cynku odbije siê niekorzystnie na syntezie bia³ka, zmniejsza siê tez
synteza kolagenu. Dlatego niski stosunek Zn/Cu mo¿e wzbudzaæ zaniepokojenie
o prawid³owej budowie kolagenu. ¯elazo i mangan s¹ równie¿ potrzebne do syntezy
prawid³owego kolagenu, ich niskie stê¿enia w tkankach usposabia do zaburzeñ
syntezy kolagenu.
Badacze znajdowali zmniejszone stê¿enia glikozoaminoglikanu w j¹drach
mia¿d¿ystych pacjentów z m³odocianym skrzywieniem krêgos³upa, jak i równie¿
niskie stê¿enia siarczanu keratyny. Nieprawid³owa budowa szkieletu, zaburzenia
rozwojowe chrz¹stek i œciêgien mog¹ byæ kojarzone z niedoborem manganu..
Niedobór tego pierwiastka mo¿e byæ zwi¹zany z chorob¹ Osgood Schlatera,
i Perthesa.
MiedŸ wykazuje antagonistyczne dzia³anie w stosunku do pierwiastków
wp³ywaj¹cych na prawid³ow¹ syntezê kolagenu, ale tak¿e na witaminê C. Nadmierne
gromadzenie siê miedzi zwiêksza utlenienie witaminy C i mo¿e przyczyniaæ siê do jej
wzglêdnego deficytu. Wysokie stê¿enia miedzi i niski stosunek, Zn/Cu mo¿e, wiêc
wskazywaæ na zwiêkszone zapotrzebowanie na witaminê C.
Witaminy B3 [niacyna], B5 [kwas pantotenowy], B6 [ pirydoksyna], s¹
antagonistami miedzi w przyswajaniu miedzi przez przewód pokarmowy. W chorych
ze skrzywieniem bocznym krêgos³upa mo¿e istnieæ zwiêkszone zapotrzebowanie na
w/w witaminy.
Fakt czêstego wystêpowania skoliozy idiopatycznej u wielu cz³onków tej samej
rodziny mo¿e te¿ potwierdziæ wp³yw zaburzeñ przemiany mineralnej na powstawanie
skolioz. Poniewa¿ dzieci dziedzicz¹ biochemiczne i mineralne zaburzenia po
rodzicach to bêdzie siê przyczyniæ do powstawania idiopatycznych skolioz.
W publikacji 1994 Lonstain [15] stwierdzi³, ¿e je¿eli u obojga rodziców wystêpuje
skrzywienie boczne idiopatyczne, to dzieci bêd¹ 80 wymaga³y specjalnego
od¿ywiania a wyst¹pienie tej choroby zwiêksza siê o 50%. Je¿eli w rodzinie jest ju¿
dziecko, z idiopatyczn¹ skolioz¹, to nastêpni potomkowie powinni byæ równie¿ pod
specjalna opiek¹. Dzieci dziedzicz¹ biochemiczne i mineralne zaburzenia po
rodzicach, a sprzyja to powstawaniu idiopatycznych skolioz.
Badania przeprowadzone w Trace Elements Inc. Z Dallas na ca³ych rodzinach
i bliŸniakach potwierdzi³y przedstawion¹ tezê [13]. Na podstawie przeprowadzonych
badañ mo¿na z ca³¹ pewnoœci¹ stwierdziæ, ¿e istnieje œcis³y zwi¹zek idiopatycznej
skoliozy z stanem mineralnym ustroju, i scriningowa analiza tkanki w³osa mo¿e byæ
wa¿nym narzêdziem w ocenie równowagi ¿ywieniowej i jest coraz bardziej doceniane
przez badaczy.
Szczególne miejsce powinna zaj¹æ rehabilitacja, gdy¿ jest jedn¹ a z nielicznych
dyscyplin medycznych traktuj¹cych cz³owieka jako ca³oœæ. Nowoczesna koncepcja
rehabilitacji zak³ada jej kompleksowoœæ, wiêc wa¿nym elementem bêdzie równowaga
¿ywieniowa- jej ocena i wp³yw na
postêpowanie rehabilitacyjne. Niestety czêsto
jest pomijany wp³yw odpowiednich substancji
¿ywieniowych jak witaminy i minera³y na
usprawnianie chorych. Rutynowe stosowanie
preparatów witaminowo-mineralnych nie
uwzglêdnia indywidualnoœci biochemicznej
cz³owieka, który wymaga indywidualnego
zapotrzebowania na substancje od¿ywcze
w ró¿nych okresach choroby i rehabilitacji.
Na przyk³adzie schorzenia, jakim jest
idiopatyczne skrzywienie boczne , mo¿emy
z a u w a ¿ y æ i s t o t n a r o l ê r ó w n o w a g i
¿ywieniowej opartej o analizê pierwiastkow¹
w³osa. Wzbogacenie diety o okreœlone
minera³y i witaminy, bêdzie bardzo pomocne
w rehabilitacji -poprzez zapobieganie
postêpowi skoliozy, prewencjê w przypadku
obci¹¿enia dziedzicznego. Poniewa¿ jest to
problem dotycz¹cy oko³o 70% uczniów [16] a
zaburzenia w uk³adzie ruchu czêsto pojawiaj¹
siê i utrwalaj¹ siê w okresie wzrostu, by³oby
p o ¿ ¹ d a n e z a s t o s o w a n i e c e l o w a n e j
suplementacji ¿ywieniowej.
Z uwagi na s³ab¹ znajomoœæ i rozpowsze-
chnienie tej metody w Polsce wymagaæ bêdzie
ona dalszych badañ i obserwacji klinicznych
w ró¿nych jednostkach chorobowych.
Bibligrafia
1. Kasperczyk T.: Wady postawy cia³a . Kraków 1998.
2. Dobosiewicz K: Boczne idiopatyczne skrzywienie
krêgos³upa .Œl. A. M. Katowice 1997
3. Szotowa W. Rola pierwiastków œladowych w ¿ywieniu
dzieci i m³odzie¿y. Przeg. Ped. 1987 XVII, 2
4. Radomska K. I wsp. Zawartoœc makro i
mikroelementów w organizmie dzieci polskich w oparciu
o analizê w³osów: Biuletyn Magnezologiczny 1994 nr.5
5. Miniuk K. i wsp. Biodostêpnoœæ oraz stany chorobowe
przy niedoborze miedzi. Pol. Tyg. Lek. 1991 XLVI , 24-
26
6. Darr D. i wsp. Ascorbic Acid and Collagen Synthesis.
Arch. Biochem. And Bioph. 1993 307 , 2
7. Angielski S. Rogulski J. Biochemia kliniczna PZWL
1993
8.Watts D. Trace elements and other essential nutriens :
Dallas 1995
9.Kulikowska E. i wsp. Rola cynku w procesach
fizjologicznych i patologicznych organizmu. Pol. Tyg.
Lek. 1991 XLVI, 24-26
10. Durlach J. Magnez w praktyce klinicznej PZWL 1991.
11.Karczewski K. Pierwiastki we w³osach aspekty
biochemiczne i diagnostyczne. Pos.Hig. Med. Doœw.
1998,52,3
12.Paszkowski T. Sikorski R. Przydatnoœæ w³osów
ludzkich w badaniach metabolizmu metali œladowych.
Wiad. Lek. 1987 XL, 19
13.Watts .D Hair tissue mineral patterns in children with
idiopathic scoliosis: Newsletter 1995, 6,3
14. Hamu³ka J. Brzozowska A. Zawartoœæ wybranych
sk³adników mineralnych we w³osach jako kryterium stanu
od¿ywienia. Roczniki.PZH,1998 XXXIX ,4
15. Lonstein J.E. Adolescent idiopathic scoliosis .Lancet
1994 Nov.19.
16. Lutyñski R.i wsp. Ocena zmian w zakresie bocznych
skrzywieñ krêgos³upa u uczniów , szkó³ podstawowych w
woj. Krakowskim.: Postêpy Rehabilitacji 1995 IV, 2
LEK. MED. KRZYSZTOF J, KRUPKA
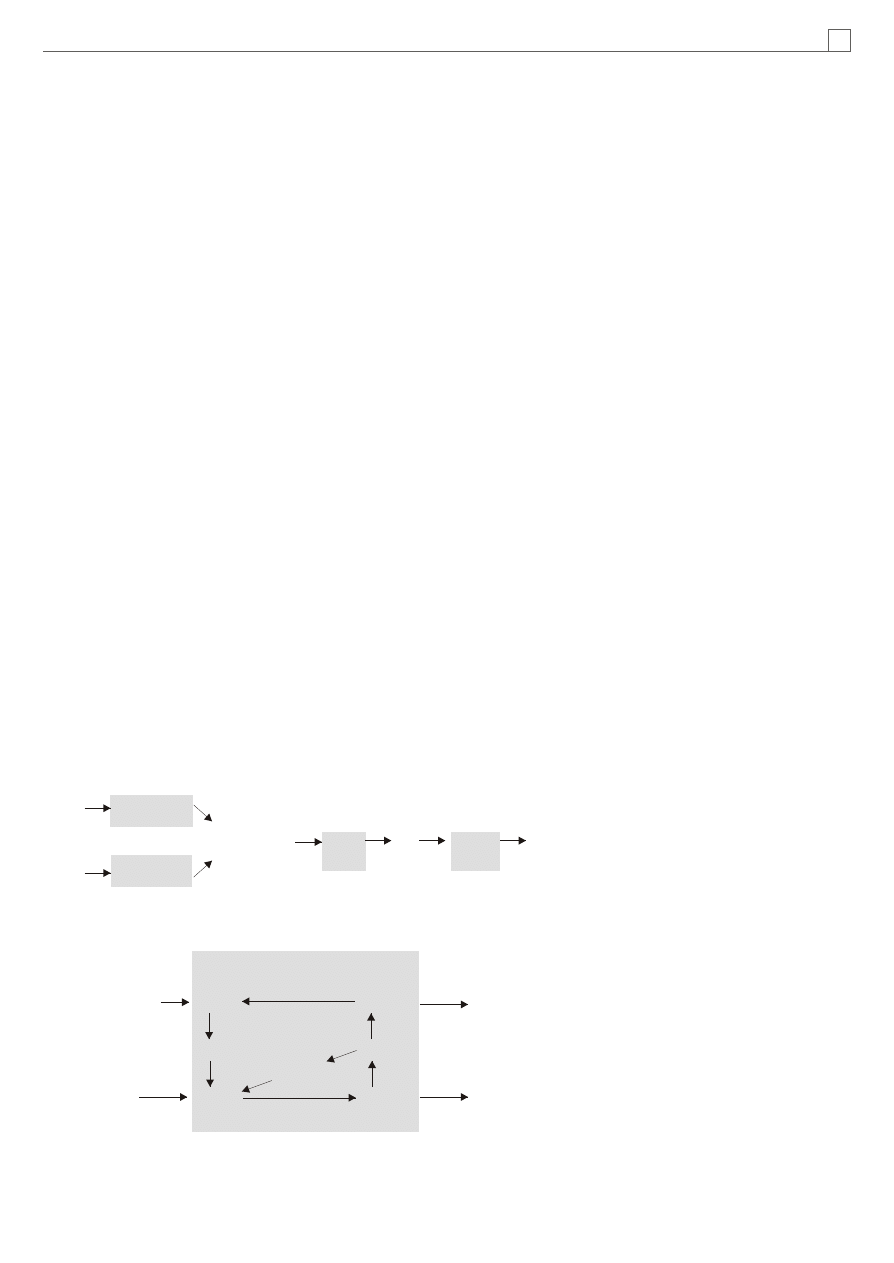
MATRIKS
wewnêtrzna b³ona mitochondrialna
CYTOZOL
KOMPLEKS I lub II
Q
Q
Fe-S c
1
(KOPLEKS III)
-
-
Q
Q
b
566
b
560
+
+
2H
QH QH
2H
2
2
KOMPLEKS I
KOMPLEKS III
NADH
FMN (Fe-S)
7
KOENZYM Q
b b
c
a a
O
10
560
566
3
2
Fe-S c
Cu Cu
1
A
B
SUKC.
FAD (Fe-S)
3
KOMPLEKS II
KOMPLEKS IV
8
MEDYCYNA BIOMOLEKULARNA
KOENZYM Q - WSPÓ£CZESNE POGL¥DY NA ROLÊ W ¯YWIENIU I TERAPII
10
Biochemiczny i fizjologiczny aspekt obecnoœci koenzymu Q w organizmie cz³owieka
10
oenzym Q (ubichinon, ubidekarenon) jest pochodn¹ 2-metylo-5,6-
dimetoksychinonu, zawieraj¹c¹ przy 3 atomie wêgla zmienn¹ liczbê
K
reszt izoprenoidowych. Okreœlenia ubichinon i koenzym Q stosuje siê
zamiennie, przy czym indeks przy literze Q mówi o liczbie reszt izoprenoidowych
w ³añcuchu bocznym koenzymu (koenzym Q - 10 reszt), natomiast ubichinon 50
10
zawiera tak¹ sam¹ liczbê atomów wêgla w ³añcuchu, co odpowiada 10 resztom
izoprenoidowym (koenzym Q = ubichinon 50, koenzym Q = ubichinon 45).
10
9
Szerokie rozpowszechnienie ubichinonów w przyrodzie wynika z funkcji, jak¹
pe³ni¹ w ¿ywych komórkach; stwierdzono ich obecnoœæ w mikroorganizmach,
roœlinach, w œwiecie zwierzêcym u krêgowców i bezkrêgowców. W ludzkich tkankach
wystêpuje przede wszystkim koenzym Q i Q , przy czym wszystkie cz¹steczki
9
10
o krótszym ³añcuchu s¹ w koñcu przekszta³cane w koenzym Q (1-3).
10
Synteza tych zwi¹zków ma miejsce w b³onach mitochondriów. Materia³em
wyjœciowym dla pierœcienia benzochinonu s¹ fenyloalanina lub tyrozyna, grupy
niezbêdne do jego metylo-wania przenoszone s¹ przy wspó³udziale kwasu foliowego
i kobalaminy, z metioniny, natomiast izoprenoidowy ³añcuch boczny powstaje
z mewalonianu (3,4).
Dzia³anie koenzymu Q w organizmie ¿ywym uwarunkowane jest faktem, i¿ mo¿e
on ulegaæ odwracalnym przemianom z postaci chinonowej, poprzez wolny rodnik -
semiubichinon, do ca³kowicie zredukowanego ubichinolu. Mo¿e równie¿ powstawaæ
metabolit - ubichromenol, którego rola nie jest jednak dotychczas znana.
W zwi¹zku z powy¿szym koenzym Q pe³ni w organizmie ssaków dwie
podstawowe funkcje:
!
jest przenoœnikiem elektronów i protonów w mitochondrialnym ³añcuchu
oddechowym, w wyniku czego wspomaga biosyntezê wysokoenergetycznych
zwi¹zków fosforanowych (ATP) oraz
!
jako przeciwutleniacz w uk³adzie chinon-hydrochinon chroni organizm przed
dzia³aniem wolnych rodników.
Rola koenzymu Q w mitochondrialnym
³añcuchu oddechowym jest dobrze znana,
poœredniczy on w przenoszeniu elektronów
z flawoprotein na uk³ad cytochromu b i c
w wewnêtrznej b³onie mitochondrialnej
(Rycina 1). Na powierzchni b³ony wewnê-
trznej znajduj¹ siê bia³kowe „jednostki
fosforyluj¹ce", odpowiedzialne za biosyntezê
wysokoenergetycznego ATP.
Zgodnie z teori¹ Mitchella (5-7) ka¿dy
z kompleksów ³añcucha oddechowego I, II i III
dzia³a jako pompa protonowa. Cykl Q
wyjaœniaj¹cy ten mechanizm przedstawia
Rycina 2.
W tym miejscu nale¿y dodaæ, ¿e
jakkolwiek izoprenoidowy ³añcuch boczny
nie bierze udzia³u w reakcji redoks, jest on
niezbêdny do „zakotwiczenia" i orientacji
chinonu w podwójnej b³onie mitocho-
ndrialnej, gdy¿ od d³ugoœci ³añcucha zale¿y
ró¿na rozpuszczalnoœæ chinonów w b³onach
(8).
Stwierdzenie udzia³u semiubichinonu
w transporcie elektronów sta³o siê przyczyn¹
spekulacji na temat mo¿liwoœci jego wp³ywu
na powstawanie rodników nadtlenkowych
podczas oddychania mitochondrialnego (9).
Z drugiej strony dowiedziono, ¿e ca³kowicie
zredukowana postaæ ubichinonu - ubichinol
mo¿e pe³niæ rolê przeciwutleniacza w procesie
peroksydacji lipidów w mitochondriach
i uk³adach submitochondrialnych. Ubichinol
zapobiega zarówno inicjacji, jak i propagacji
peroksydacji lipidów (Rycina 2), podczas gdy
witamina E dzia³a tylko na etapie propagacji.
Takie zachowanie zawdziêcza ubichinol
lokalizacji w hydrofobowej czêœci b³ony
fosfolipidowej, gdzie te reakcje maj¹ miejsce
oraz, co wa¿niejsze, uczestniczy on
w mechanizmie pompy protonowej cyklu Q,
który umo¿liwia regeneracjê ubichinolu
z postaci rodnika semiubichinonu (5).
Pojawia siê jednak pytanie, czy
mitochondrialny ubichinol zapobiega
wy³¹cznie peroksydacji lipidów, czy te¿ jego
dzia³anie ochronne obejmuje równie¿ proteiny
i DNA. Dalej - czy proces uszkadzania bia³ek i
DNA w wyniku ich utleniania przebiega
nastêpczo lub równolegle do peroksydacji
lipidów. Wyniki badañ Castiiho i wsp. (10)
wskazuj¹, ¿e jakkolwiek koenzym Q pe³ni
Rycina 1. Miejsce koenzymu Q w mitochondrialnym ³añcuchu oddechowym (schemat górny) oraz
10
pompuj¹cy protony cykl koenzymu Q (schemat dolny) (wg 3-5); Fs-S - bia³ko ¿elazosiarkowe, FMN i FAD
- flawoproteiny, a,b,c - odpowiednie cytochromy.
1

LH
-
INICJACJA
Fe -O2
UQH
+3
2
-
Fe +H O
UQ
+3
2
2
L
PROPAGACJA
O
2
LOO
LH
UQH
2
-
E-QH
Asc / UQ
E-Q
Asc / UQH
2
-
L
UQ
LOOH
9
MEDYCYNA BIOMOLEKULARNA
wa¿n¹ rolê jako przeciwutleniacz lipidów b³ony mitochondrialnej, to jednak jego
dzia³anie nie rozci¹ga siê na bia³ka. Inni autorzy przede wszystkim podkreœlaj¹ jego
rolê ochronn¹ w stosunku do lipidów oraz udzia³ w regeneracji b-tokoferolu (11-13).
Prieme i wsp. (14) nie stwierdzili wp³ywu suplementacji koenzymem Q na
10
zmniejszenie stê¿enia biomarkera oksydacji DNA w moczu palaczy. Z kolei wyniki
badañ Tomasettiego i wsp. (15) wskazuj¹, ¿e jakkolwiek suplementacja koenzymem
Q zwiêksza odpornoœæ DNA limfocytów na peroksydacjê, w której poœrednicz¹
10
utlenione lipidy, jednak nie zapobiega rozrywaniu nici DNA.
Obok omówionych wy¿ej dwóch podstawowych funkcji koenzymu Q
10
w organizmie cz³owieka, wtórne jego dzia³anie objawia siê tym, i¿ stabilizuje on b³onê
mitochondrialn¹, wp³ywa na aktywnoœæ ATP-azy sodowo-potasowej, zmniejsza
deficyt elektronów w mitochondriach, hamuje aktywnoœæ wewn¹trzkomórkowych
fosfolipaz, a w dalszym etapie wp³ywa na reakcje obronne organizmu oraz poprawia
samopoczucie psychiczne i fizyczne cz³owieka (3,16,17).
Biosynteza ubichinonów ma miejsce przede wszystkim w b³onach
mitochondrialnych, st¹d te¿ 40-50% ich wewn¹trzkomórkowej zawartoœci przypada
na mitochondrium, 25-30% wystêpuje w j¹drze i 5-10% w cytozolu (3). Ograniczona
iloœæ ubichinonów przenika przez b³onê komórkow¹ do krwi, gdzie wi¹¿e siê
z lipoproteinami osocza. Jednak w przeciwieñstwie do innych produktów przemian
mewalonianu (cholesterol, dolichol), ubichinon prawdopodobnie nie jest
rozprowadzany do poszczególnych tkanek drog¹ uk³adu krwionoœnego (5).
Egzogenny koenzym Q po resorpcji z uk³adu pokarmowego przenoszony jest do
10
w¹troby drog¹ uk³adu limfatycznego. Poza w¹trob¹ du¿¹ zawartoœæ tej substancji
stwierdzono w sercu, nerkach, trzustce, œledzionie i tkance p³uc (Tabela l) powolne jej
zmniejszanie (Tabela 2). Zjawisku postêpuj¹cego z wiekiem zmniejszania zawartoœci
ubichinonu, towarzyszy drastyczny wzrost zawartoœci dolicholu, przy czym poziom
cholesterolu raczej siê nie zmienia.
Lipofilnoœæ cz¹steczki ubichinonu 50 warunkuje jego z³o¿on¹ farmakokinetykê.
Rozk³ad cz¹steczki nastêpuje poprzez oksydacjê i odczepienie ³añcucha
izoprenoidowego, a powstaj¹ce w koñcowym etapie glukuronidy, wydalane s¹ przez
nerki w iloœci 10-20 ug (kobiety) i 50-55 ug (mê¿czyŸni) (3,16). Pó³okres wydalania
ubichinonu z tkanek wynosi 50-125 h (19).
Rola koenzymu Q w ¿ywieniu cz³owieka
10
Koenzym Q pe³ni w ustroju rolê witaminy niezbêdnej do ¿ycia ka¿dej komórki,
10
poniewa¿ jednak jest w organizmie cz³owieka syntetyzowany, okreœla siê go mianem
substancji witaminopodobnej lub tzw. witaminy warunkowej.
Ze wzglêdu na nieustannie powiêkszaj¹cy siê zasób wiedzy na temat roli witamin
i substancji od¿ywczych w reakcjach przebiegaj¹cych na poziomie komórkowym lub
molekularnym, pogl¹dy dotycz¹ce niedoboru tych zwi¹zków s¹ ci¹gle korygowane.
Wspó³czesne spojrzenie na ten problem sformu³owa³ Challem (20):
!
niedobory substancji od¿ywczych mog¹ wystêpowaæ na poziomie molekularnym
lub reakcji biochemicznych na d³ugo zanim wyst¹pi¹ objawy kliniczne;
!
okreœlenie ,,niezbêdne substancje od¿ywcze" powinno zostaæ rozszerzone na
niektóre karotenoidy i flawonoidy, a tak¿e metabolity ludzkie jak koenzym Q ,
10
karnityna i kwas
b-liponowy, które s¹ sk³adnikami diety;
!
indywidualne zapotrzebowanie na sk³adniki od¿ywcze jest uwarunkowane
genetycznie, zale¿y tak¿e od intensywnoœci aktualnych procesów
biochemicznych organizmu oraz od warunków zewnêtrznych;
!
rozró¿nianie dawki od¿ywczej i leczniczej witamin nie ma sensu, poniewa¿
u niektórych ludzi podtrzymanie fizjologicznych procesów metabolicznych
wymaga du¿ych dawek witamin.
Decyduj¹c¹ rolê w niedostatecznym zaopatrzeniu organizmu w substancje
od¿ywcze pe³ni fakt, ¿e wraz z rozwojem cywilizacyjno-technicznym
zapotrzebowanie energetyczne cz³owieka zmala³o, natomiast zapotrzebowanie na
niezbêdne substancje od¿ywcze pozosta³o niezmienione.
Dlatego by dopasowaæ iloœæ pobranej w po¿ywieniu energii do zmniejszonego
zapotrzebowania energetycznego organizmu,
ludzie ograniczaj¹ iloœæ po¿ywienia. Prowadzi
to czêsto do równoczesnego zmniejszenia
iloœci dostarczonych sk³adników nieenerge-
tycznych, a w konsekwencji do niedoboru
witamin i innych œrodków od¿ywczych, tak¿e
ubichinonów. Jednak g³ównym Ÿród³em
pochodzenia ubichinonów nie jest po¿ywienie
lecz biosynteza.
Dotychczas nie ustalono, z jak¹ szybkoœci¹
przebiega ta reakcja oraz czy jest ona
regulowana wewnêtrznie, w zale¿noœci od
aktualnego zapotrzebowania ustroju.
Niektórzy autorzy (16) twierdz¹, ¿e
dostarczenie egzogennego koenzymu Q nie
10
ma wp³ywu na jego biosyntezê.
Przyjmuje siê, ¿e zawartoœæ ubichinonów
w organizmie doros³ego cz³owieka wynosi
0,5-1,5 g, w tym oko³o 5-10 mg dostarczane
jest z po¿ywieniem. Zarówno u ludzi, jak
i u zwierz¹t oko³o 80% koenzymu wystêpuje
w postaci zredukowanej (ubichinol), przy
czym stosunek obu form tego zwi¹zku ró¿ni
siê w poszczególnych tkankach (Tabela l).
Kalen i wsp. (18) wykazali, ¿e maksy-
malna zawartoϾ ubichinonu w tkankach
cz³owieka wystêpuje ok. 20 roku ¿ycia, po
czym nastêpuje zmniejszenie spowodowane
zbyt ma³¹ iloœci¹ egzogennego koenzymu Q ,
10
dostarczonego z po¿ywieniem wystêpuj¹ce
w stanach podwy¿szonego zapotrzebowania
organizmu na koenzym Q .
10
G³ówn¹ przyczyn¹ os³abionej biosyntezy
ubichinonów jest niedobór substratów
potrzebnych do jej przebiegu, niektórych
aminokwasów (fenyloalanina, tyrozyna,
metionina) oraz witamin (kobalamina, kwas
foliowy, tak¿e niacyna, pirydoksyna, kwas
pantotenowy). Stan taki najczêœciej jest
skutkiem niew³aœciwego od¿ywiania,
Rycina 2. Prawdopodobny mechanizm wp³ywu
ubichinolu (UQH;), witaminy E (E-OH) oraz kwasu
askorbowego (Asc) na peroksydacjê lipidów (LH) (wg 5).

szczególnie podczas kuracji odchudzaj¹cych lub chorób metabolicznych,
wymagaj¹cych stosowania specjalnej diety, jak np. feny-loketonuria. Znamiennie
ni¿sze stê¿enie koenzymu Q w osoczu chorych na fenyloketonuriê autorzy badañ
10
t³umaczyli diet¹ ubog¹ w bia³ko (21) prowadziæ do równoczesnego os³abienia
biosyntezy ubichinonów (3-5,22) u ludzi starszych (Tabela 2). Jednak Emster (5)
t³umaczy to zjawisko inaczej, sk³aniaj¹c siê ku wolnorodnikowej teorii starzenia.
Uwa¿a on, ¿e to spowodowane obecnoœci¹ wolnych rodników nasilenie procesów
niszczenia bia³ek i DNA w tkankach starszych ludzi, jest przyczyn¹ wiêkszego
zu¿ycia ubichinolu na neutralizowanie tych rodników tego sk³adnika diety
w organizmie cz³owieka. Szacuje siê, ¿e dziennie z po¿ywieniem dostarczane jest 5-10
mg ubichinonów, oraz ¿e resztê niezbêdnej organizmowi iloœci pokrywa biosynteza.
Nie mo¿na jednak wykluczyæ, ¿e przy okreœlonych nawykach ¿ywieniowych oraz
jednostronnej diecie iloœæ egzogennego koenzymu Q mo¿e ulec znacznemu
10
obni¿eniu. Taka sytuacja wystêpuje w przypadku od¿ywiania parenteralnego lub diety
zerowej, gdy jego poda¿ spada praktycznie do zera. Równie¿ œcis³y wegetarianizm,
dieta niskot³uszczowa w hipercholesteremii lub jednostronne diety stosowane
w kuracjach odchudzaj¹cych albo u osób z chorobami uk³adu trawiennego, prowadz¹
do znacznego zmniejszenia iloœci przyjmowanego koenzymu Q .
10
Osobn¹ przyczynê obni¿enia zawartoœci ubichinonów w spo¿ywanej przez
cz³owieka diecie, stanowi obróbka ¿ywnoœci. Jakkolwiek niewiele jest prac na temat
trwa³oœci tych zwi¹zków w œrodkach spo¿ywczych, jednak wynika z nich, ¿e sposób
obróbki ¿ywnoœci nie pozostaje bez wp³ywu na trwa³oœæ koenzymu Q. Gotowanie lub
pieczenie soi prowadzi do ubytków zawartoœci ubichinonów rzêdu 50%, podczas
suszenia i fermentacji straty s¹ jeszcze wiêksze (3). Badaj¹cy dietê Duñczyków Weber
i wsp. (23) stwierdzili 14-32% rozk³ad koenzymu Q , zawartego w ¿ywnoœci poddanej
10
sma¿eniu oraz brak zmian w gotowanej. Wyp³ywa st¹d wniosek, ¿e podczas
przetwarzania i przechowywania œrodków spo¿ywczych nale¿y siê liczyæ
ze znacznymi ubytkami zawartych w nich ubichinonów.
Istniej¹ przes³anki, ¿e w sytuacjach zwiêkszonego zapotrzebowania
energetycznego organizmu, na przyk³ad intensywnego uprawiania sportu, ciê¿kiej
pracy fizycznej, ci¹¿y, stresów, wzrasta zapotrzebowanie organizmu na ubichinon i
nie jest ono w wystarczaj¹cym stopniu pokrywane przez biosyntezê. Zjawisko
powy¿sze t³umaczy siê faktem, ¿e zwiêkszone zapotrzebowanie energetyczne silniej
obci¹¿a uk³ad transportu elektronów, zwiêkszaj¹c miêdzy innymi zu¿ycie koenzymu
Q . Z drugiej strony, w sytuacji tzw. stresu oksydacyjnego do zobojêtnienia nadmiaru
10
powsta³ych wolnych rodników tlenowych potrzebna jest wiêksza iloœæ ubichinolu.
Potwierdzaj¹ to wyniki badañ Quilesa i wsp. (24) przeprowadzone na zwierzêtach
doœwiadczalnych karmionych pokarmem bogatym w ubichinony, u których
wywo³ano stres oksydacyjny. W grupie zwierz¹t poddanych wysi³kowi fizycznemu
poziom koenzymu Q w osoczu by³ ni¿szy, a w mitochondriach miêœni szkieletowych
wy¿szy ni¿ u zwierz¹t odpoczywaj¹cych. Wynika z tego, ¿e w odpowiedzi na stres
oksydacyjny w organizmie zmianie ulega równowaga miêdzy poziomem
przeciwutleniaczy w osoczu krwi i w mitochondriach tkanek. Kontush i wsp. (25)
wykazali, ¿e zawartoœæ ubichinolu w osoczu pacjentów z hiperlipidemi¹ oraz palaczy
by³a znamiennie ni¿sza ni¿ u ludzi zdrowych. Na tej podstawie stwierdzili, ¿e poziom
ubichinolu w osoczu mo¿e byæ wskaŸnikiem, czy organizm zosta³ poddany stresowi
oksydacyjnemu in vivo, co jest szczególnie wa¿ne w wykrywaniu wczesnych
uszkodzeñ spowodowanych dzia³aniem wolnych rodników tlenowych. U sportowców
efektem wysi³ku fizycznego by³o zwiêkszenie intensywnoœci utleniania lipidów
osocza, a w konsekwencji wzrost aktywnoœci ubichinolu. Suplementacja koenzymem
Q spowodowa³a dodatkowe zwiêkszenie stê¿enia ubichinolu (26), lecz wydajnoœæ
10
organizmu pozosta³a bez zmian (27).
Osobn¹ grupê ludzi z obni¿onym poziomem endogennego koenzymu Q ,
10
w tkankach stanowi¹ nara¿eni na dzia³anie substancji toksycznych, w tym tak¿e
niektórych leków, tytoniu i innych u¿ywek. W ich przypadku zwiêkszona iloœæ
endogennego koenzymu Q zu¿ywana jest na neutralizowanie niektórych zwi¹zków
toksycznych oraz powsta³ych w wyniku ich dzia³ania wolnych rodników.
Podsumowuj¹c omówione przyczyny
niedoboru koenzymu Q w organizmie
10
cz³owieka mo¿na sformu³owaæ sposoby
zapobiegania im przez:
!
celowy dobór sk³adników po¿ywienia,
!
wzbogacenie niektórych œrodków
spo¿ywczych w koenzym Q ,
10
!
delikatne obchodzenie siê z ¿ywnoœci¹
p o d c z a s o b r ó b k i , p r z e t w a r z a n i a
i przechowywania,
!
substytucjê egzogennym koenzymem Q ,
10
!
ograniczenie nadmiaru u¿ywek,
!
unikanie stresów.
B³êdy w od¿ywianiu odgrywaj¹ znacz¹c¹
rolê dla wyst¹pienia niedoborów endo-
gennego koenzymu Q , poniewa¿ z jednej
10
strony zaburzaj¹ biosyntezê ubichinonów gdy
w po¿ywieniu brak któregoœ z substratów,
z drugiej natomiast s¹ przyczyn¹ niedoboru
egzogennego koenzymu Q.
Ubichinony s¹ naturalnymi sk³adnikami
ludzkiego po¿ywienia, przy czym przewa¿aj¹
w nim zwi¹zki z 10, 9 i rzadziej z 8-
cz³onowym izoprenoidowym ³añcuchem
bocznym (koenzymy Q , Q i Q ). Szczególnie
10
9
8
bogate w koenzym Q s¹ ziarna zbó¿ i otrêby
9
(Tabela 3). Dlatego wyroby z pe³nego ziarna
zawieraj¹ wiêksze iloœci ubichinonów ni¿
wypieki z bia³ej m¹ki. Z kolei w soi, roœlinach
motylkowych oraz orzechach wystêpuje
g³ównie koenzym Q . Koenzym ten zawieraj¹
10
w du¿ych iloœciach przede wszystkim miêso i
ryby. W grupie warzyw na czele s¹ szpinak
i broku³y, podczas gdy ogórki i sa³ata,
podobnie jak ziemniaki, nie zawieraj¹
koenzymu Q. Du¿e iloœci ubichinonów, sub-
stancji dobrze rozpuszczalnych w t³uszczach,
wystêpuj¹ w niektórych olejach (3).
Wspominani ju¿ Weber i wsp. (23) zbadali,
i¿ w przeciêtnej diecie populacji duñskiej,
zawieraj¹cej 3-5 mg koenzymu Q dziennie,
10
64% tej iloœci pochodzi z miêsa i drobiu,
natomiast zbo¿a, owoce, t³uszcze roœlinne
i zwierzêce maj¹ mniejsze znaczenie. •ród³em
koenzymu Q (l mg dziennie) s¹ t³uszcze
9
roœlinne i roœliny zbo¿owe. Autorzy pracy
zwrócili uwagê, ¿e zawartoœæ koenzymu Q
w diecie dobowej jest ni¿sza ni¿ dawka
zalecana jako suplementacja diety (10-30 mg
dziennie).
Ci sami autorzy (28) porównali w osoczu
ludzi poziom koenzymu Q pochodz¹cego
10
z naturalnego po¿ywienia (gotowane serca
wieprzowe) lub kapsu³ek. Stwierdzili, ¿e
jakkolwiek stê¿enie tego zwi¹zku u osób
spo¿ywaj¹cych pokarm naturalny by³o nieco
wy¿sze, nie by³a to ró¿nica statystycznie
10
MEDYCYNA BIOMOLEKULARNA

NARZ¥D GRUPA WIEKOWA
39-43 lata 77-91 lat
Serce
-32%
-57%
Nerki
-5%
-17%
W¹troba
-27%
-35%
Trzustka
-30%
-48%
P³uca
-8%
-69%
NARZ¥D ZAWARTOŒÆ % UDZIA£
UBICHINONU FRAKCJI
(ug/g tkanki) ZREDUK.
Serce
114,0
61
Nerki
66,5
75
W¹troba
54,9
95
Miêœnie
39,7
65
Trzustka
32,7
100
P³uca
7,9
25
znamienna, oraz ¿e poziom koenzymu Q w osoczu zale¿y raczej od iloœci podanej
10
z zewn¹trz, ni¿ od Ÿród³a pochodzenia.
Dzia³anie koenzymu Q jako przeciwutleniacza nie jest uwarunkowane
10
obecnoœci¹ witaminy E i selenu w diecie (30), natomiast po¿¹dany jest cynk.
Jak wynika z badañ Olssena i wsp., (31) szybkoœæ regeneracji ubichinolu z ubichinonu,
w obecnoœci cynku wzrasta dziesiêciokrotnie.
Inn¹ interesuj¹c¹ w³aœciwoœæ koenzymu Q zaobserwowali Edenharder
10
i wsp. (32). Stwierdzili oni, i¿ koenzym ten zmniejsza aktywnoœæ mutagenn¹ szeœciu
wybranych amin heterocyklicznych pochodz¹cych z gotowanego po¿ywienia.
Rola koenzymu Q w terapii
10
Wyniki badañ ró¿nych autorów, opublikowane w ostatnich dwudziestu latach
wskazuj¹, ¿e wielu stanom chorobowym organizmu ludzkiego towarzysz¹ zmiany
stê¿enia endogennych ubichinonów w ró¿nych tkankach. Ich podwy¿szony poziom
w tkance mózgowej cz³owieka towarzyszy chorobie Alzheimera lub zmianom
spowodowanym prionami w mózgu myszy (5). Znacznie czêœciej stwierdza siê jednak
obni¿enie zawartoœci ubichinonu w tkankach, szczególnie w przypadku
kardiomiopatii, chorób zwyrodnieniowych miêœni, niektórych nowotworów,
cukrzycy, paradontozy. Dotychczas nie wyjaœniono dok³adnie, czy te zmiany s¹
przyczyn¹ czy skutkiem wymienionych chorób.
Równie¿ za¿ywanie pewnych leków mo¿e ubocznie powodowaæ zmiany
zawartoœci ubichinonów w tkankach. Szczególnie dotyczy to stosowanych
w hipercholesteremii inhibitorów reduktazy HMG-CoA, które równoczeœnie hamuj¹
biosyntezê koenzymu Q. Natomiast poliferatory peroksysomów (np. klofibrat)
prowadz¹ do wzrostu poziomu ubichinonu w tkance w¹troby, serca i miêœni
szkieletowych szczurów (32). Efekt ten przypisuje siê spowodowanemu podaniem
leku intensywnemu wytwarzaniu nadtlenku wodoru, a w konsekwencji
zwiêkszonemu zapotrzebowaniu na przeciwutleniacze.
Biesalski (16) zak³ada, ¿e mechanizm wywo³uj¹cy schorzenia o pod³o¿u
zwyrodnieniowym, jak nowotwory, mia¿d¿yca, stany zapalne, mo¿e polegaæ na
niszczeniu struktur komórkowych (b³ony lipidowe) oraz pozakomórkowych (bia³ka,
kwasy nukleinowe) przez wolne rodniki. Czêstoœæ wystêpowania w organizmie
wysoko reaktywnych rodników tlenowych, alkoksylowych i peroksylowych jest
silnie zwi¹zana z przemianami tlenowymi komórek, jednak egzogenne czynniki, jak
promieniowanie jonizuj¹ce czy zatrucie œrodowiska, mog¹ wp³ywaæ na zwiêkszenie
ich iloœci. Do uszkodzeñ wewn¹trzkomórkowych w wyniku stresu oksydacyjnego
dochodzi, kiedy wolne rodniki w niekontrolowanej reakcji ³añcuchowej zaczynaj¹
odci¹gaæ elektrony od innych substancji, inicjuj¹c w ten sposób powstawanie
nastêpnych wolnych rodników. Wynika st¹d, ¿e w stanach patologicznych organizmu,
spowodowanych niszcz¹cym dzia³aniem tych rodników, celowe bêdzie podawanie
koenzymu Q .
10
Zastosowanie lecznicze koenzymu Q zosta³o bardzo szeroko omówione w pracy
10
Danysw i Kwieciñskiego (17) z 1997 roku, dlatego zajmê siê tylko pewnymi aspektami
tego zagadnienia.
Wskazaniem do uzupe³nienia terapii chorób miêœnia sercowego koenzymem Q
10
s¹ kardiomiopatie, niewydolnoœæ serca, niewydolnoœæ wieñcowa oraz niemiarowoœæ.
Mechanizm dzia³ania leczniczego tej substancji w chorobach serca nie zosta³
wyjaœniony, jednak sk³ada siê na niego ochrona komórek miêœnia sercowego przed
skutkami niedokrwienia lub zaburzeñ dyfuzji, stabilizowanie b³ony mitochondrialnej
oraz wp³yw na aktywnoœæ ATP-azy sodowo-potasowej. Kukliñski (16) unikn¹³
powik³añ u chorych po przebytym zawale miêœnia sercowego, którym podawano
dodatkowo koenzym Q . Nie wyst¹pi³y u nich zaburzenia rytmu, niewydolnoœæ serca
10
lub wtórny zawa³. Z kolei Danysz (17) donosi, ¿e koenzym równoczeœnie zmniejsza
toksycznoœæ glikozydów nasercowych, przeciwdzia³a niektórym dzia³aniom
niepo¿¹danym powodowanym przez b
-adrenolityki, z drugiej strony przed³u¿a
dzia³anie enalaprylu i nitrendypiny.
Bior¹c po uwagê dzia³anie ochronne ubichinonu w stosunku do miêœnia
sercowego, ponadto jego rolê w procesach wytwarzania energii w komórce
oraz w stresie oksydacyjnym, mo¿na za³o¿yæ,
¿e bêdzie poprawia³ wydolnoœæ fizyczn¹
organizmu. Wyniki badañ wielu autorów
potwierdzaj¹ to za³o¿enie, dotycz¹ one przede
w s z y s t k i m t r e n u j ¹ c y c h s p o r t o w c ó w ,
stwierdzono tak¿e poprawê u ludzi chorych na
polimiopatie i nu¿liwoœæ miêœni.
Przedstawiono jednak równie¿ odmienne
rezultaty: u biegaczy maratoñskich nie
stwierdzono wp³ywu podawania koenzymu
Q na obni¿enie stê¿enia kinazy kreatynowej
10
lub mleczanów w osoczu, natomiast zwiêkszy³
siê udzia³ frakcji ubichinolu, a wiêc zdolnoœci
przeciwutleniaj¹ce osocza (26). Równie¿
Malin i wsp. (27), badaj¹cy wydolnoœæ
fizyczn¹ osób poddanych intensywnemu
treningowi sportowemu, nie stwierdzili ró¿nic
miêdzy grup¹ suplementowan¹ koenzymem
Q i placebo. Na pewno jednak w przypadku
10
niedoborów endogennego koenzymu Q
w wyniku stresu oksydacyjnego spowo-
d o w a n e g o i n t e n s y w n y m w y s i ³ k i e m
fizycznym, celowe jest uzupe³nienie tych
niedoborów egzogennym koenzymem Q.
Nastêpn¹ grup¹ schorzeñ zwi¹zanych
z uk³adem kr¹¿enia, w których uzyskano
poprawê po zastosowaniu koenzymu Q s¹
10
nadciœnienie têtnicze i mia¿d¿yca. Danysz i
Kwieciñski (17), podsumowuj¹c wyniki badañ
dotycz¹cych choroby nadciœnieniowej
stwierdzili, ¿e pozytywny wynik leczenia
uzyskuje siê przede wszystkim u pacjentów
Tabela 1. ZawartoϾ ubichinonu w tkankach ludzkich oraz
udzia³ jego frakcji zredukowanej (wg 5).
Tabela 2. Postêpuj¹ce z wiekiem zmiany zawartoœci
koenzymu Q w narz¹dach cz³owieka (grupa
1 0
porównawcza - 19-21 lat) (wg 3,5).
11
MEDYCYNA BIOMOLEKULARNA

z niskim stê¿eniem wyjœciowym koenzymu Q we krwi, oraz ¿e wynik ten zale¿y
10
równie¿ od aktywnoœci oksydoreduktazy bursztynianu i endogennego koenzymu Q.
Od dawna wiadomo, ¿e decyduj¹c¹ rolê dla rozwoju mia¿d¿ycy ma wysoki poziom
cholesterolu we krwi, zw³aszcza frakcji LDL. Lipoproteiny o ma³ej gêstoœci (LDL),
zmienione w wyniku utlenienia przez wolne rodniki, uzyskuj¹ dzia³anie aterogenne,
jednak w obecnoœci ubichinolu nastêpuje zatrzymanie peroksydacji lipidów i dopiero
po jego ca³kowitym zu¿yciu dochodzi do tworzenia nadtlenków z estrów cholesterolu,
trójglicerydów i fosfolipidów. Serebruany i wsp. (33) stwierdzili, ¿e koenzym Q
10
powodowa³ zmniejszenie wielkoœci p³ytek i blokowa³ receptor powierzchniowy
witronektyny, przez co utrudnia³ tworzenie z³ogów na œcianach naczyñ u pacjentów
ze schorzeniami uk³adu kr¹¿enia.
Niedobór endogennego koenzymu Q stwierdzono równie¿ u chorych na cukrzycê
i wykazano, ¿e uzupe³nienie tego niedoboru powodowa³o obni¿enie stê¿enia glukozy
we krwi. Przyczyn tego zjawiska McCarty (34) upatruje w zwi¹zku miêdzy
intensywnoœci¹ procesów mitochondrialnego ³añcucha oddechowego oraz
m e c h a n i z m e m , z a p o m o c ¹ k t ó r e g o p o d w y ¿ s z o n y p o z i o m g l u k o z y
w osoczu pobudza wydzielanie insuliny przez komórki beta trzustki. Uwa¿a on, ¿e
wy¿sze stê¿enie koenzymu Q wzmaga procesy ³añcucha oddechowego oraz
10
aktywnoϾ dehydrogenazy glicerolo-3-fosforanowej, czego efektem jest
usprawnienie stymulowanego poziomem glukozy dzia³ania komórek beta.
Korzystne efekty podawania koenzymu Q uzyskano w dziedzicznej chorobie
10
neurodegeneracyjnej - pl¹sawicy Huntingtona. Koroshetz i wsp. (35) stwierdzili, ¿e
w³¹czenie do terapii koenzymu spowodowa³o znamienne obni¿enie poziomu
mleczanów w korze mózgowej chorych, ponadto wyjaœnili przyczynê ogólnego
deficytu energii towarzysz¹cego tej chorobie.
W osobnym opracowaniu (36), dotycz¹cym zastosowania koenzymu Q
10
w leczeniu przyzêbicy, Danysz podkreœla jego dzia³anie immunopobudzaj¹ce oraz
korzystny wp³yw na procesy reparacji i regeneracji w organizmie. Wymienione wy¿ej
w³aœciwoœci ubichinonu oraz fakt, ¿e u 60-90% pacjentów z przyzêbic¹ stwierdzono
jego niedobory, sta³y siê bodŸcem do zastosowania koenzymu w leczeniu tej choroby.
Na podstawie wyników badañ ró¿nych autorów ustalono, ¿e zwi¹zek ten, podawany
zarówno ogólnie w wiêkszych dawkach (90 mg/24 h), jak i do kieszonek
oko³ozêbowych, wywiera korzystny wp³yw na niektóre objawy przyzêbicy z efektem
zmniejszenia liczby bakterii, zmniejszenia g³êbokoœci kieszonek oraz sk³onnoœci do
krwawieñ.
Aktywuj¹cy wp³yw koenzymu Q na uk³ad odpornoœciowy jest wynikiem
10
zwiêkszenia aktywnoœci fagocytów, zwiêkszenia liczby komórek NK i limfocytów,
a tak¿e wzmo¿onej produkcji immunoglobulin G. Ten kierunek dzia³ania koenzymu
wykorzystano równie¿ w³¹czaj¹c go z pozytywnymi rezultatami do terapii niektórych
chorób nowotworowych, AIDS oraz zaka¿eñ niektórymi drobnoustrojami
chorobotwórczymi.
Istnieje grupa doniesieñ o pozytywnym wp³ywie ubichinonu na sferê psychiczn¹
cz³owieka, szczególnie u osób sk³onnych do depresji (3,16). Suplementacja
koenzymem Q spowodowa³a u nich poprawê samopoczucia zwi¹zan¹ ze zmian¹
10
usposobienia, wiêkszym zainteresowaniem otoczeniem, lepszymi mo¿liwoœciami
adaptacyjnymi; ustêpowa³a tak¿e depresja wystêpuj¹ca w ubogich w œwiat³o
s³oneczne porach roku.
Niedobory endogennego koenzymu Q towarzysz¹ czêsto pewnym stanom nie
10
chorobowym organizmu, jak starzenie lub oty³oœæ. W przypadku osób oty³ych
niedobory te mog¹ byæ odpowiedzialne za zwolnienie metabolicznych procesów
komórkowych, tym bardziej, ¿e po ich uzupe³nieniu nastêpowa³ spadek masy cia³a.
St¹d czêste w³¹czanie ubichinonu do diety osób odchudzaj¹cych siê. Podawanie tego
zwi¹zku osobom oty³ym jest dodatkowo wskazane ze wzglêdu na sk³ad diet
odchudzaj¹cych, zwykle zubo¿onych w egzogenny koenzym Q lub substraty do jego
syntezy.
Wiadomo, ¿e wykorzystanie koenzymu Q w geriatrii powinno przynieœæ ulgê
10
w pewnych dolegliwoœciach lub chorobach nasilaj¹cych siê u ludzi starszych, gdy¿
udowodniono, ¿e starzeniu organizmu
t o w a r z y s z y z m n i e j s z e n i e z a w a r t o œ c i
koenzymu w tkankach. Jak wspomniano
wy¿ej, poprawê stwierdzono w przypadku
chorób serca, niewydolnoœci kr¹¿enia,
zaburzeñ ukrwienia koñczyn, w profilaktyce
i leczeniu mia¿d¿ycy, w obni¿onej wydolnoœci
fizycznej. Natomiast dyskusyjny jest problem
wp³ywu ubichinonu na d³ugoœæ ¿ycia.
W c y t o w a n y c h p r z e z D a n y s z a ( 1 7 )
doœwiadczeniach przeprowadzonych na
m y s z a c h , s t o s o w a n i e k o e n z y m u Q
1 0
przed³u¿y³o ich ¿ycie o 56%, przy zachowanej
normalnej aktywnoœci i dobrym wygl¹dzie
zewnêtrznym. Z kolei z badañ Lonnrota i wsp.
(37) wynika, ¿e trwaj¹ca przez ca³y okres
¿ycia szczurów suplementacja koenzymem
Q nie wp³ynê³a ani na przed³u¿enie czasu
10
jego trwania, ani na zmniejszenie iloœci
odk³adanych wraz z wiekiem lipopigmentów
œwiadcz¹cych o peroksydacji nienasyconych
kwasów t³uszczowych.
ŒRODEK
ZAWARTOή
SPO¯YWCZY
UBICHINONU (ug/g)
Produkty zbo¿owe
pszenica
6
ziarno
103
kie³ki
23
kukurydza
10
jêczmieñ
12
owies
29
Warzywa
broku³y
9
ziemniaki
1
kalafior
1
Nasiona
soja
19
orzeszki ziemne
27
orzechy laskowe
17
Miêso
Wo³owina
31
wieprzowina
24-41
drób
21
Produkty mleczne
mleko krowie
0,2
ser
0,42
mas³o
7
Ryby
makrela
43
sardynki
64
wêgorz
11
Oleje
s³onecznikowy
21
sojowy
8
Tabela 3. Zawartoœæ koenzymu Q w œrodkach spo¿ywczych.
12
MEDYCYNA BIOMOLEKULARNA

Mimo niekiedy sprzecznych doniesieñ ró¿nych autorów na temat roli
egzogennego koenzymu Q w terapii niektórych schorzeñ, nie ulega w¹tpliwoœci, ¿e
10
zwi¹zek ten po przenikniêciu do krwioobiegu chroni komórki œródb³onka oraz
lipoproteiny (LDL) osocza, zapobiega uszkodzeniom powodowanym przez wolne
rodniki w stanach zapalnych. Szerokie mo¿liwoœci przeciwdzia³ania skutkom
obecnoœci wolnych rodników oraz udzia³ w procesach energetycznych organizmu
uzasadniaj¹ w³¹czenie koenzymu Q do terapii niektórych chorób, jego zastosowanie
10
w pewnych stanach niechorobowych lub suplementacjê diety.
Dotychczas nie opisano toksycznych objawów spowodowanych podaniem
koenzymu Q tym bardziej, ¿e ubichinony s¹ naturalnymi produktami biosyntezy
10
organizmu. Odnotowano wprawdzie przypadki nadwra¿liwoœci ze strony uk³adu
pokarmowego, a tak¿e nerwowoœæ lub zaburzenia koncentracji u niektórych
pacjentów, jednak nie s¹ to objawy swoiste tylko dla ubichinonów. Podczas badania
toksycznoœci przewlek³ej, w ci¹gu 52 tygodni podawania koenzymu Q zwierzêtom
10
doœwiadczalnym, nie odnotowano zmian apetytu ani masy cia³a, nie wyst¹pi³y ¿adne
objawy kliniczne, nie zmieni³a siê te¿ umieralnoœæ zwierz¹t (38).
Poezzi i wsp. (39) opracowuj¹c postaæ farmaceutyczn¹ koenzymu Q , stwierdzili
10
najwy¿sze stê¿enie badanego zwi¹zku w osoczu psów, którym podano preparat
w postaci kapsu³ek z lecytyn¹ sojow¹. Inni autorzy (40) wykazali, ¿e podczas d³ugo-
trwa³ej suplementacji biodostêpnoœæ koenzymu z granulatu i preparatu olejowego by³a
podobna, przy czym jednorazowa dawka 30 mg nie zmienia³a jego poziomu w osoczu
ludzi. Ustalono, ¿e aby uzyskaæ efekt terapeutyczny, koenzym Q powinien byæ
10
podawany przez d³u¿szy czas w dawce 30-100 mg/24h. Zawsze jednak alternatyw¹ dla
syntetycznego koenzymu Q pozostaje odpowiednio zestawiona dieta, tym bardziej,
10
¿e jak wspomniano wczeœniej, stê¿enie w plazmie koenzymu pochodz¹cego
z gotowanych serc wieprzowych oraz kapsu³ek nie ró¿ni³o siê znamiennie.
Podsumowuj¹c, ewentualnym niedoborom endogennego koenzymu Q mo¿na
10
zapobiec stosuj¹c racjonalnie zestawion¹ dietê, która powinna zawieraæ koenzym Q
(substancja rozpuszczalna w t³uszczach) oraz substraty potrzebne do jego biosyntezy
(aminokwasy, witaminy). Natomiast w przypadku niedoborów towarzysz¹cych
pewnym schorzeniom lub stanom niechorobowym wskazane jest w³¹czenie do terapii
nietoksycznego, syntetycznego koenzymu Q .
10
13
MEDYCYNA BIOMOLEKULARNA
Bibliografia
l. Folkres K., Yamainura Y. (red): Bidfriedical and Clinical Aspects ot Coenzyme Q , Elsevier Science
10
Publishers B. V., Volume 4, 1984.
2. Folkers K.,Brown R., Judy W.V., Morita M:. Biochem. Biophys. Re.s.Comm. 192,241. 1993.
3. Hozel D.: DAZ 135, 2501, 1995.
4. Murray R. K., Ganmer D. K., Mayes P.A„ Bodwell V.W.: Biochemia Harpera, PZWL,
Warszawa 1994.
5. Emster L, Daliner.: Biochim. Biophys. Acta 1271, 195, 1995.
6. Mitchell P.: FEBS Lett. 56, l 1975.
7. Milchell P.: J. Theor. Biol. 62, 327, 1976.
8. Landi L., Cabrini L.,.Fiorentini D. i wsp.: Free Rad. Res. Comm. 14. 1,1991.
9. Cadenas E., Hochstem P., Emster L.: Adv. Enzymol. 65, 97, 1992.
10. Castilho R.F., Kowaltowski A.J., Meinicke A.R., Yercesi A.E.: Free Rad.
Biol. Med. 18, 55,1995.
11. Matsura T., Yamada K., Kawasaki T.: Redox Report
l. 343, 1995.
12. Mukai K., ItohS., Morimotoh.: J. Biol. Chem. 267,
22277, 1992.
13. Pobezimowa T.P., Wojnikow W.K: Biol. Membr. 16,
485, 1999
14. Prieme H., Loft S., Nyyssonen K., Salonen J.T.,
Poulsen H.E..: Am. J. Clin. Nutr. 65,
503, 1997.
15. Tomasetti M., Litrami G.F., Stocker R., AlleraR:
Free Rad. Biol. Med. 27, 1027, 1999.
16. Apoth. J. 15, 26, 1993 - Dyskusja redakcyjna „Co-
Enzym Q Prophylaxe und Therapie degenerative'"
10
Erkrankungen".
17. Danysz A., Kwieciñski A.: Farm. Pol. 53, 589, 1997.
18. Kalen A., Appelkvist S.. Daliner G.: Lipids 24, 579
1989.
19.Thelin A., Sched³n S., Daliner G.: FEBS Lett. 313,
118, 1992.
20. Challem J.J.: Med. Hypotheses 52. 417, 1999.
21. Artuch R., Yilaseca M. A., Moreno J. i wsp.: Am. J.
Clin. Nutr. 70, 892, 1999.
22. Goidstein J.L, Browns M.S.: Nature 343, 425, 1990.
23. Weber C, Bysted A., Holmer G.: Int. J. Vitam. Nutr.
Res. 67, 123, 1997.
24. Quiles J.L, Huertas J.R.. Manas M. i wsp.: Int. J.
Vitam. Nutr. Res. 69, 243, 1999.
25. Kontush A., Reich A., Baum K. i wsp.:
Atheroscierosis 129. 119, 1997.
26. Kaikkonen J., Kosonen L., .Nyyssonen K. i wsp.:
Free Rad. Res. 29, 85,1998.
27. Malm C., Svensson M., Ekdom B., Sjodin B.: , Acta
Physiol. Scand. 161, 379, 1997.
28. Weber C, Bysted A., Holmer G.: Nutr. Res. 17, 941,
1997.
29. Navarro F., Navas P., Burgess J.R. i in.: Faseb. J. 12,
1665, 1998.
30. Olsson J.M., Xia L, Eriksson L.C., Bjomstedt M.:
FEBS Lett. 448,198,1999.
31. Edenharder R, Wolf-Wandeiburg A., Decker M..
Platt K.L: Mutat. Res. Genet. Toxicol. Environ. Mutagen
444, 235, 1999.
32. Aberg F., Zhang Y., Appelkvist E.-L., Daliner G.:
Chem. Biol. Interact. 1.l, 1994.
33. Serebruany V.L., Ordonez J.Y., Herzog W.R. i wsp.:
J. Cardiovasc. Pharmacol. 29, 16, 1997.
34. McCarty M.F.: Med. Hypotheses 52, 397, 1999.
35. Koroshetz W.J., Jenkins B.G., Rosen B.R., Beal
M.F.: Ann. Neurol 41, 160, 1997.
36. Danysz A.: Koenzym Q - ubichinon i jego
10
zastosowanie w stomatologii. Agencja Reklamy
Karneol, Warszawa.
37. Lonnrot K., Metsa-Ketela T., Allw H.: Gerontology
41 Suppl. 2, 109,1995.
38. Williams K.D., Maneke J.D., AbdelHameed M. i in.:
J.Agric.Food.Chem. 47, 3756, 1999.
39. Poezzl F., Longo A., Lazzarmi C., Carenzi A.: Eur. J.
Pharm. Biopharm.
37, 243, 1991.
40. Kaikkonen J., Nyyssonen K., Porkkalasarataho E
i wsp.: Free. Radic. Biol. Med. 22, 1195, 1997.
LEK. MED. ZDZIS£AW KUBAT
Document Outline
Wyszukiwarka
Podobne podstrony:
miedzynarod pomoc humanit id 29 Nieznany
Miernictwo 08 Oscyloskopy id 29 Nieznany
Medycyna Nuklearna id 292418 Nieznany
Historia Medycyny KARTKI id 203 Nieznany
Medycyna katastrof id 292310 Nieznany
mcga shs capt guide chap4 id 29 Nieznany
Miazgowiec parkietowiec 2 id 29 Nieznany
metabolizm drobnoustrojow id 29 Nieznany
MIASTA NA PRAWACH POWIATU id 29 Nieznany
miedzynarod pomoc humanit id 29 Nieznany
ATMiA 29 1 3 id 71755 Nieznany (2)
lekcja 29 str 2 id 265129 Nieznany
Cw 29 szablon id 97632 Nieznany
lekcja 29 str 5 id 265132 Nieznany
9 29 id 47954 Nieznany (2)
29 PE Events id 32202 Nieznany (2)
BBN NR 29 id 81911 Nieznany
5 29 id 39528 Nieznany (2)
DYREKTYWA 2001 29 WE id 145671 Nieznany
więcej podobnych podstron