ĆWICZENIE 5
WIRUJĄCA ELEKTRODA DYSKOWA (RDE)
Celem ćwiczenia jest zapoznanie się z podstawami woltamperometrii hydrodynamicznej
na przykładzie wirującej elektrody dyskowej (RDE) oraz zasadami interpretacji wyników
dotyczących reakcji elektrodowych.
WYKONANIE ĆWICZENIA
1. Przygotować roztwór p-chinonu o stężeniu 1 mM w buforze octanowo-fosforanowym o pH
ok. 2.2. W tym celu odważyć obliczoną masę analitu i przenieść ilościowo do kolby
miarowej o poj. 50 mL. Do przemywania naczynka i lejka oraz uzupełniania kolby użyć
roztworu buforowego. Tak przygotowany roztwór dokładnie wymieszać.
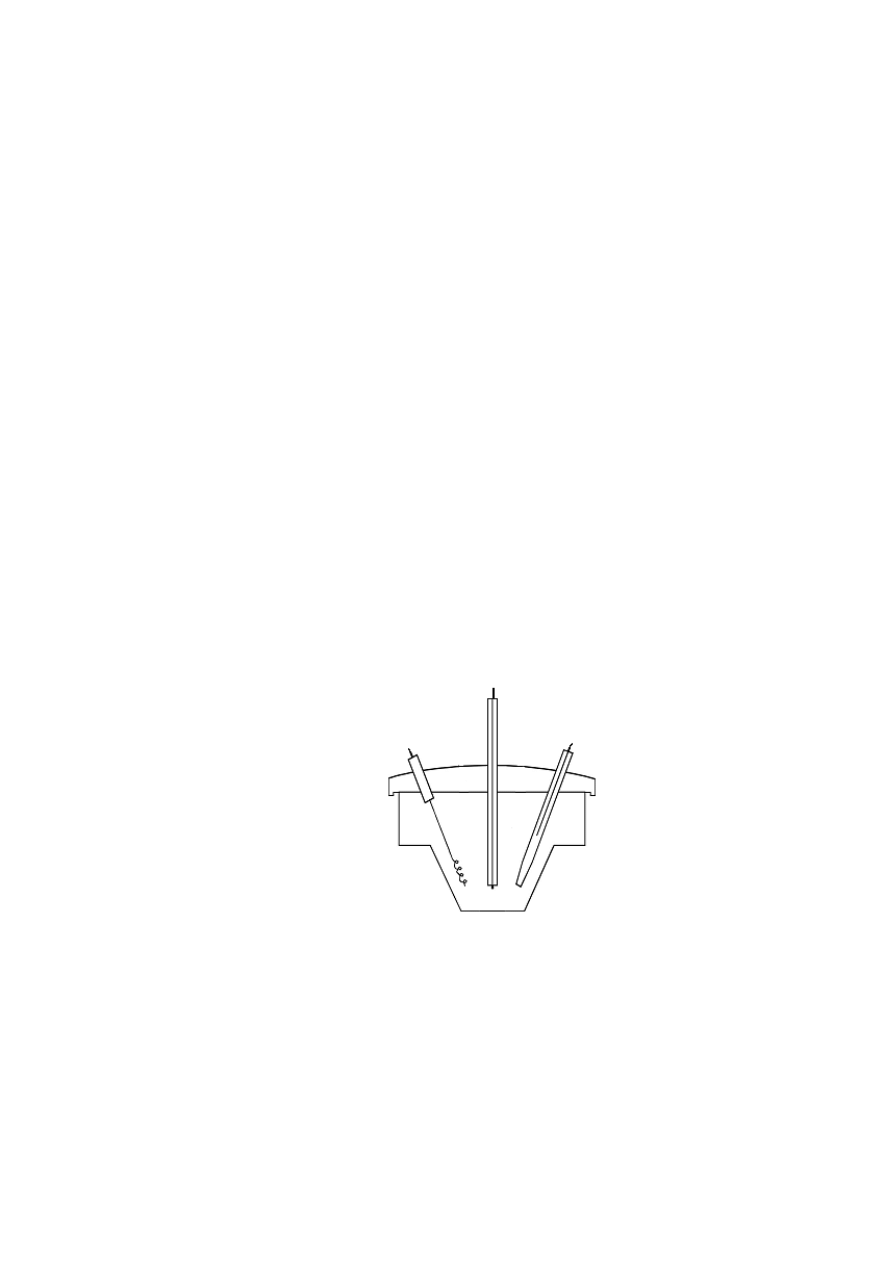
2. Przygotować naczynko woltamperometryczne według schematu:
Uwaga!
Przed zamontowaniem elektrod do uchwytu należy:
-
elektrodę wskaźnikową oczyścić przez polerowanie na tlenku glinu(III), opłukać
i osuszyć za pomocą bibuły,
-
elektrodę odniesienia opłukać, osuszyć i umieścić w naczyniu przejściowym
wypełnionym badanym roztworem,
-
elektrodę przeciwną opłukać i osuszyć za pomocą bibuły.
E
WORK
E
AUX
E
REF

Podłączyć elektrody do odpowiednich przewodów analizatora elektrochemicznego:
- elektrodę wskaźnikową, E
w
(RDE, GC, Φ = 4 mm) do przewodu opisanego symbolem
WORK,
- elektrodę odniesienia (Ag/AgCl) do przewodu opisanego jako REF,
- elektrodę przeciwną (Pt) do przewodu opisanego jako AUX.
3. Do naczynka woltamperometrycznego nalać roztwór badany w ilości umożliwiającej
zanurzenie elektrod. Naczynko wraz z roztworem zamontować w uchwycie z elektrodami.
4. Uruchomić komputer i analizator elektrochemiczny EA9C.
Wybrać program:
EA9_PL5
Rozwinąć okno dialogowe:
POMIAR
Wybrać technikę pomiarową:
LSV – parametry (woltamperometria z liniowo zmieniającym się potencjałem).
Wybrać:
dE/dt = 10 mV/s (szybkość zmiany potencjału polaryzującego elektrodę wskaźnikową, v)
czułość w osi prądowej:
Zakres: 0.1 mA
Pomiar cykliczny
Elektroda: stała
Naczynie: 3-elektrodowe
Ep = 500 mV (potencjał początkowy)
Ek = -300 mV (potencjał zmiany kierunku polaryzacji elektrody)
td = 500 ms (czas wyczekiwania przed rozpoczęciem rejestracji).
5. Wprawić elektrodę wskaźnikową w ruch obrotowy z częstotliwością f = 8 Hz.
6. Naciśnięcie przycisku POMIAR uruchamia rejestrację krzywej.
Po zarejestrowaniu krzywej CVA zapisać ją w pliku o nazwie RDE1.vol. Nazwa krzywej
powinna zawierać szybkość zmiany potencjału, przy której ją zarejestrowano, np. 8Hz1
(cyfra 1 oznacza numer zarejestrowanej krzywej).
Powtórzyć rejestrację jeszcze dwukrotnie (do odtwarzalności) bez zmiany parametrów.
Kolejno rejestrowane krzywe zapisać zmieniając nazwę (8Hz2, 8Hz3 itd.).
7. Postępując w identyczny sposób, zarejestrować krzywe CVA dla f = 16, 24, 30 i 40 Hz.
Nie zmieniać pozostałych parametrów pomiaru.
8. Po zakończeniu pomiaru wyłączyć analizator, usunąć naczynko z roztworem, przepłukać
i osuszyć elektrody.
OPRACOWANIE WYNIKÓW
1.
Wpływ rodzaju transportu depolaryzatora na przebieg krzywych woltamperometrycznych.
Porównać krzywe rejestrowane techniką RDE i CVA (z poprzedniego ćwiczenia). W tym
celu sporządzić rysunek będący złożeniem odpowiednich krzywych (Rys. 1). Uzasadnić różnice
w przebiegu omawianych krzywych.
2.
Wpływ szybkości wirowania elektrody na przebieg krzywych rejestrowanych techniką
RDE.
Wydrukować i opisać przebieg krzywych rejestrowanych przy różnych szybkościach
wirowania elektrody (Rys. 2).
Odczytać natężenia prądów granicznych utleniania hydrochinonu, I
D,L
dla krzywych
zarejestrowanych techniką RDE. Wyniki zestawić w Tabeli 1.
Tabela 1. Analiza krzywych redukcji p-chinonu o stężeniu .... mM rejestrowanych na RDE (GC,
Φ = 4 mm) w buforze octanowo-fosforanowym przy różnych częstotliwościach wirowania
elektrody, f. Szybkość zmiany potencjału, v = 10 mV s
-1
V
f,
Hz
ω = 2πf,
rad s
-1
ω
1/2
,
(rad s
-1
)
1/2
I
D,L
,
μA
8
16
24
30
40

Na podstawie wyników z Tabeli 1 narysować wykres zależności natężenia prądu granicznego
redukcji p-chinonu od pierwiastka kwadratowego z szybkości kątowej wirowania elektrody,
I
D,L
= f(ω
1/2
) (Rys. 3). Zinterpretować jego przebieg. Do interpretacji zastosować równanie
Lewicza (podać i wyjaśnić symbole). Wyciągnąć wnioski dotyczące charakteru procesu
elektrodowego.
3.
Analiza logarytmiczna
Wykonać analizę logarytmiczną krzywych rejestrowanych przy dwóch skrajnych
szybkościach wirowania elektrody (8 i 40 Hz). W tym celu odczytać natężenia prądów
dyfuzyjnych przy potencjałach, E
D
odpowiadających wzrastającym częściom krzywych
(w odstępach co 10 mV). Wyniki zestawić w Tabeli 2.
Tabela 2.
E
D
/ mV
Częstotliwość wirowania elektrody, f / Hz
8
40
I
D,L
= ...μA
I
D,L
= ...μA
I
D
/ μA
( I
D,L
- I
D
)/ I
D
log[( I
D,L
- I
D
)/ I
D
]
I
D
/ μA
( I
D,L
- I
D
)/ I
D
log[( I
D,L
- I
D
)/ I
D
]
Uwaga! Wartości log[( I
D,L
- I
D
)/
I
D
powinny zawierać się w granicach od –1.0 do 1.0.
Na podstawie wyników z Tabeli 2 narysować wykres zależności log[( I
D,L
- I
D
)/
I
D
]
=
f(E
D
) (Rys. 4). Omówić i uzasadnić jej przebieg. Podać (wyprowadzić) równanie opisujące
omawianą krzywą. Odczytać jej nachylenie i wyciągnąć wnioski na temat odwracalności procesu
elektrodowego oraz liczby elektronów wymienianych w procesie elektrodowym. W przypadku
stwierdzenia, że proces elektrodowy ma charakter odwracalny, określić potencjał formalny, E
0’
badanego układu redoks.
Z A G A D N I E N I A
1.
Charakterystyka procesów elektrochemicznie odwracalnych i nieodwracalnych.
2.
Teoretyczne podstawy techniki RDE:
-
etapy procesu elektrodowego,
-
wirująca elektroda dyskowa i jej zasada działania,

-
rodzaje transportu i profil stężeniowy (zmiany stężenia depolaryzatora
w zależności od odległości od elektrody wskaźnikowej),
-
prąd dyfuzyjny i jego powstawanie,
-
wpływ częstotliwości wirowania elektrody na grubość warstwy dyfuzyjnej
i stopień odwracalności procesu elektrodowego
-
przebieg i interpretacja krzywych rejestrowanych techniką RDE,
3.
Równanie Lewicza i jego interpretacja.
4.
Równanie opisujące przebieg krzywych w warunkach stacjonarnych, analiza logarytmiczna
krzywych woltamperometrycznych i jej znaczenie w badaniu procesów elektrodowych.
5.
Zastosowanie techniki RDE.
6.
Obsługa aparatury i sposób wykonania ćwiczenia.
L I T E R A T U R A
1.
J. Garaj, Fizyczne i fizykochemiczne metody analizy, WNT, Warszawa 1981.
2.
A. Cygański, Metody elektroanalityczne, WN-T, Warszawa 1995.
3.
A. Cygański, Podstawy metod elektroanalitycznych, WN-T, Warszawa 1999.
4.
A.J. Bard, L.R. Faulkner, Electrochemical Methods. Fundamentals and Applications, John
Wiley, New York
5.
Z. Galus, Teoretyczne podstawy elektroanalizy chemicznej, PWN, Warszawa 1977.
6.
Elektroanalityczne metody wyznaczania stałych fizykochemicznych, red. Z. Galus, PWN,
Warszawa 1979.
7.
Z. Galus, Fundamentals of Electrochemical Analysis, Ellis Horwood, New York 1994.

Wyszukiwarka
Podobne podstrony:
Analiza Instrumentalna Wirująca elektroda dyskowa tabelki
Analiza Instrumentalna Wirująca elektroda dyskowa Wykres 1
Analiza Instrumentalna Wirująca elektroda dyskowa Wykres 2
Analiza Instrumentalna Wirująca elektroda dyskowa Wykres 3
Wyznaczanie charakterystyki elektrody szklanej, analiza instrumentalna
Analiza Laborki, 1 Elektrody, ANALIZA INSTRUMENTALNA
Jonoselektywne elektrody membranowe, Studia - materiały, Analiza instrumentalna
Analiza Instrumentalna Analiza elektrograwimetryczna Sprawozdanie 3 kam
7.Czy możliwa jest rejestracja czystych widm elektronowych, BIO, Diagnostyka Laboratoryjna, analiza
Spektroskopia Elektronowego Rezonansu Paramagnetycznego, AGH, Analiza instrumentalna, EPR
Analiza Instrumentalna Analiza elektrograwimetryczna 3 (2)
Analiza Instrumentalna Konduktometria KONDUKTOMETRYCZNE WYZNACZANIE STAEJ I STOPNIA DYSOCJACJI S
Wyznaczanie charakterystyki elektrody szklanej, analiza instrumentalna
Instr. kontr.urz.gaszącego, Instrukcje w wersji elektronicznej
Chromatografia, Technologia chemiczna, Analiza instrumentalna
więcej podobnych podstron