3.Związki fluorowców z wodorem
Fluorowce łączą się z wodorem dając fluorowcowodory HX. Fluorowodór i chlorowodór otrzymuje
się działając stężonym kwasem siarkowym na odpowiednie sole. Do otrzymania fluorowodoru
służy fluoryt CaF
2
:
CaF
2
+ H
2
SO
4
→CaSO
4
+ 2HF
Chlorowodór dla celów laboratoryjnych najdogodniej jest otrzymywać z salmiaku NH
4
Cl,gdyż
powstający wodorosiarczan amonowy NH
4
HSO
4
jest dobrze rozpuszczalny i wywiązywanie HCl
przebiega dzięki temu bardziej równomiernie. Dla celów przemysłowych jako surowiec do
otrzymywania chlorowodoru służy NaCl. Produktem reakcji zachodzącej na zimno jest
wodorosiarczan sodu NaHSO
4
i HCl
NaCl+ H2SO
4
→NaHS
4
+ HCl
W temp. ciemnego żaru reakcja postepuje dalej:
NaCl+NaHSO
4
→Na
2
SO
4
+ HCl
W zakładach przemysłowych otrzymuje się także HCl przeprowadzając bezpośrednia syntezę z
pierwiastków,spalając wodór w chlorze.
Metod polegających na działaniu H
2
SO
4
na odpowiednie halogenki nie można stosować w celu
otrzymania bromowodoru i jodowodoru,ponieważ związki te mogą się utleniać pod wpływem stęż.
H
2
SO
4
. Dla otrzymania HBr kwas siarkowy można zastąpić fosforowym. Najczęściej jednak HBr i
HI otrzymuje się w wyniku hydrolizy trój bromku lub trój jodku fosforu. W przypadku syntezy
bromowodoru wkrapla się brom do mieszaniny czerwonego fosforu i wody:
2P +Br
2
→2PBr
3
PBr
3
+ 3H
2
O →H
3
PO
4
+3HBr
W analogicznym procesie otrzymywania jodowodoru wkrapla się wodę do mieszaniny fosforu i
jodu.
Wiązania chemiczne występujące w cząsteczkach tych związków mają w przeważającym stopniu
charakter kowalencyjny. Udział wiązania jonowego jest największy w przypadku HF,ponieważ
fluor jest najbardziej elektroujemnym spośród halogenów.
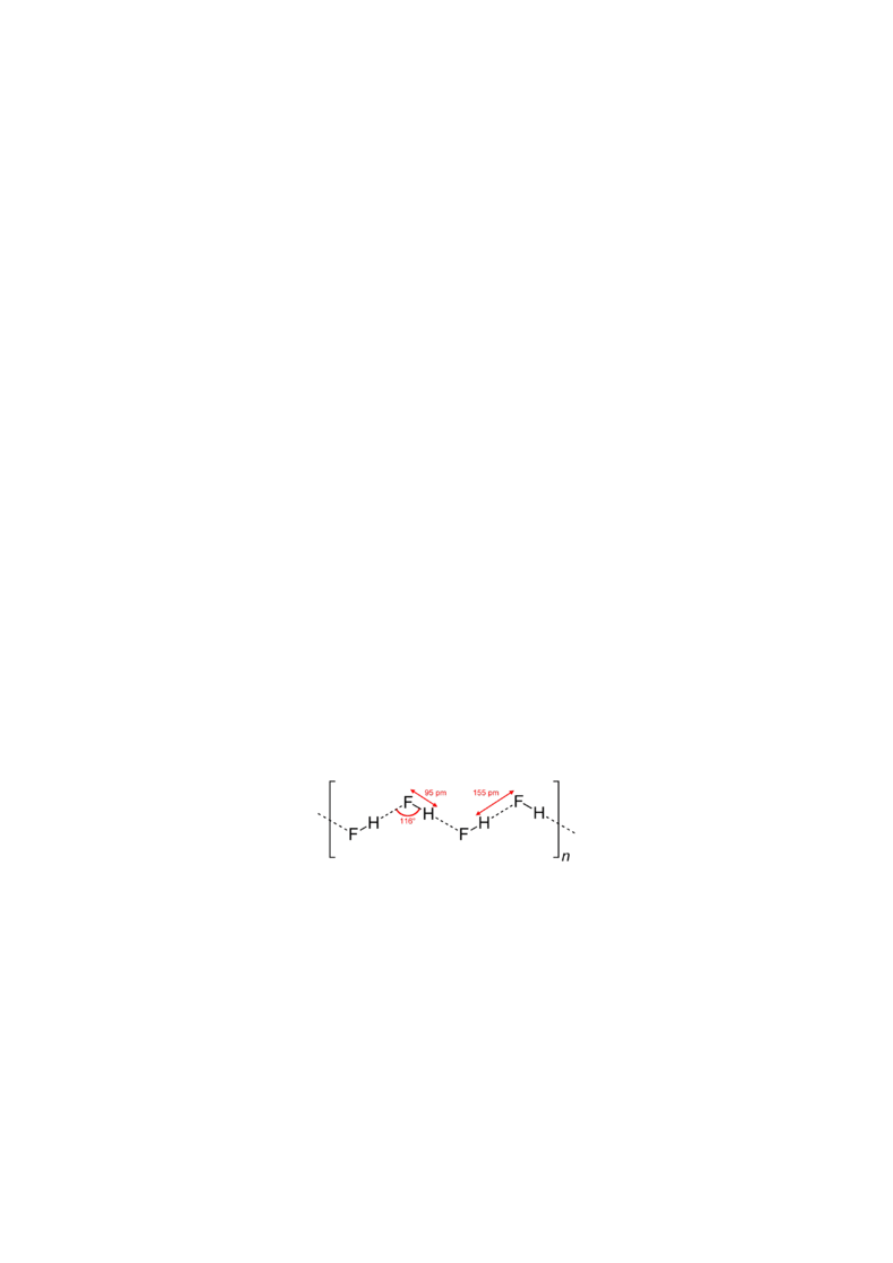
Z wysoką elektroujemnością fluoru i momentem dipolowym fluorowodoru,znacznie większym niż
pozostałych chlorowcowodorów wiąże się zdolność cząsteczek HF do asocjacji na skutek
wytwarzania się wiązań wodorowych. Asocjacja HF prowadzi do powstania zygzakowatych
łańcuchów,obecnych w zestalonym fluorowodorze.
Fluorowodór ma najwyższą temp. wrzenia (19,9 ºC) spośród wszystkich halogenowodorów. Jest to
spowodowane asocjacją HF. Tak więc w warunkach normalnych tylko HF jest cieczą,a reszta
halogenowodorów gazami.
Wszystkie cztery halogenowodory dobrze rozpuszczają się w wodzie. HF miesza się z nią w
każdym stosunku,pozostałe dają natomiast roztwory,które po nasyceniu pod ciśnieniem gazu
równym 1 atmosferze,wykazują różne stężenia. Podczas destylacji rozcieńczonych roztworów
fluorowcowodorów otrzymuje się destylat bogatszy w wodę niż ciecz wrząca,kwas ulega więc
zagęszczeniu. W trakcie destylacji roztworów stężonych obserwuje się zjawisko odwrotne,pary są
bogatsze we fluorowcowodór,a kwas ulega rozcieńczeniu. Dla każdego z roztworów istnieje jednak
stężenie zwane stężeniem azeotropowym,przy którym skład destylatu i cieczy jest jednakowy.
W roztworach wodnych halogenowodory ulegają dysocjacji elektrolitycznej wg równania:
HX+H
2
O↔ H
3
O
+
+X
-
Kwas fluorowodorowy jest kwasem umiarkowanie słabym,a pozostałe kwasy zaczynając od HCl są
bardzo mocne. Moc kwasu zależy od promienia atomowego fluorowca,który wzrasta w miarę

wzrostu liczby atomowej.
W wodnych roztworach HF część anionów fluorkowych F
-
łączy się z obojętnymi cząsteczkami
kwasu dając aniony FHF
-
F
-
+HF ↔ HF
2
-
Anion wodorofluorkowy występuje też w stałych wodorofluorkach (kwaśnych fluorkach), np. w
wodorofluorku potasu KHF
2
. Znane są ponadto kwaśne fluorki wywodzące się od jeszcze silniej
spolimeryzowanych postaci fluorowodoru, jak KF·2HF oraz KF·3HF. Pozostałe fluorowcowodory
nie ulegają polimeryzacji i nie tworzą soli kwaśnych..
Ważna cechą różniącą fluorowcowodory są ich właściwości redukujące. HF nie ulega działaniu
żadnych środków utleniających,HCl daje się utlenić mocnymi środkami utleniającymi(KMnO
4
,
KClO
3
,a także stężonym kwasem azotowym). Najłatwiej utlenieniu ulega HI,który jest uważany za
dość skuteczny środek redukujący.
Zastosowanie
Spośród związków fluorowców z wodorem najwięcej zastosowań ma HCl, który należy do kwasów
mineralnych używanych w przemyśle chemicznym i spożywczym oraz w laboratoriach.
Zastosowania HF wiążą się przede wszystkim z jego zdolnością do trawienia szkła. Pod wpływem
zarówno gazowego,jak i ciekłego roztworu HF, krzemionka SiO
2
,wolna i związana (krzemiany),
ulega przemianie w łatwo lotny czterofluorek krzemu SiF4:
SiO
2
+4HF↔ SiF
4
+ 2H2O
Właściwość tą wykorzystuje się w analizie krzemianów.
Nagryzanie szkła przez HF powoduje,że jego roztworów nie można przechowywać z butelkach
szklanych. Używa się do tego celu naczyń z parafiny lub organicznych mas plastycznych.
Kwas fluorowodorowy jest silnie toksyczny,a jego roztwory wywołują trudno gojące się oparzenia
ciała. HF ma tez właściwości bakteriobójcze i dlatego używa się jego rozcieńczonych roztworów do
celów dezynfekcyjnych. Fluorki stosuje się ponadto do impregnacji drewna.
Magdalena Majewska
Wyszukiwarka
Podobne podstrony:
ZW LAB USTAWY, OCHRONA
05 BIOCHEMIA Zw wysokoenergetyczne ATP
DMB ZW nr 02(30) luty 1993
zw rozniczk
szkar tk zw, Ochrona Środowiska, Biologia
ZW nr 3 4 2001 Zimowe wyprawy ze nieżynk
ziola dla zw (2)
LC zw
Zw magnezoorganiczne
zjawisko fluoroscencji, MiBM UWM 1 i 2 semestr
36 terr Podział DN zw wzgl. na rozmach walki zbr., STUDIA EDB, Obrona narodowa i terytorialna
XVII niedziela zw. rok A, rok A
GLOBALNA MŁODZIEŻ opracowanie, Socjologia wychowania - wykład - prof. zw. dr hab. Zbyszko Melosik
kazania - 23 Niedziela zw.Rok C, Homilie i kazania
zw koordynacyjne
więcej podobnych podstron