69
PRĄD ELEKTRYCZNY
Natężenie prądu. Prawo Ohma
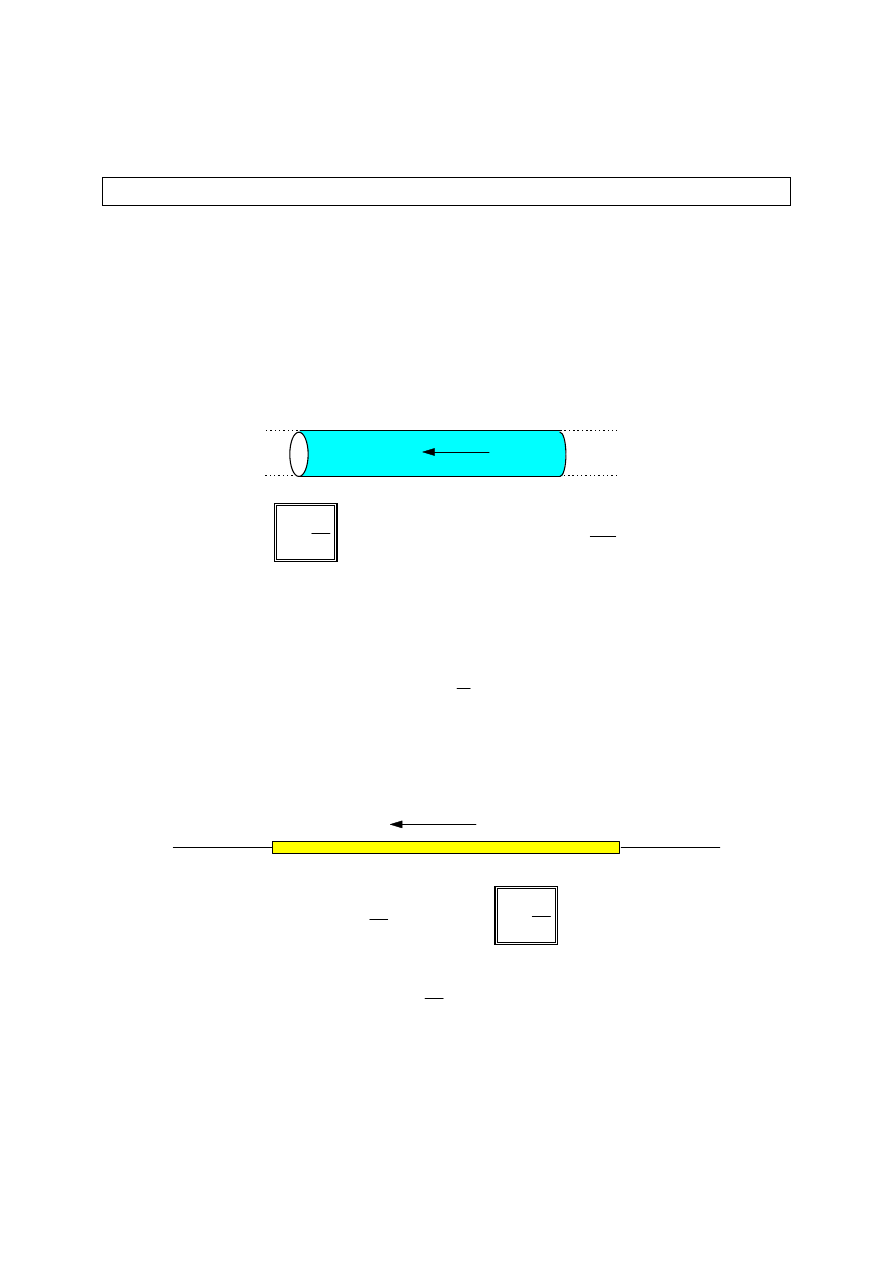
Prądem elektrycznym nazywamy uporządkowany ruch ładunków elektrycznych,
który zachodzi w przewodniku pod wpływem pola elektrycznego
wytworzonego w tym przewodniku. Prąd elektryczny w metalach polega na
ruchu swobodnych elektronów zawartych w sieci krystalicznej metalu. Prąd
elektryczny w cieczach lub gazach polega na ruchu jonów obojga znaków.
Miarą natężenia prądu jest stosunek ładunku przepływającego przez przekrój
poprzeczny przewodnika do czasu jego przepływu.
I
Q
t
====
1
1
1
A
C
s
====
Gęstością prądu nazywamy stosunek natężenia prądu płynącego przez
przewodnik do pola przekroju poprzecznego przewodnika.
J
I
S
====
Zgodnie z prawem Ohma, natężenie prądu w przewodniku jest wprost
proporcjonalne do napięcia na końcach tego przewodnika.
I
R
U
====
1
I
U
R
====
Współczynnik proporcjonalności
1
R
zależy od rodzaju przewodnika i
temperatury.
R
- opór elektryczny przewodnika. Jednostką oporu elektrycznego jest
1
Ω
Ω
Ω
Ω
.
Przewodnik ma opór 1
Ω
Ω
Ω
Ω
, jeżeli pod napięciem 1V przez ten przewodnik płynie
prąd o natężeniu 1A.
L
- długość przewodnika
S
- pole przekroju poprzecznego
I
S
∅
∅
∅
∅
∅
∅
∅
∅
U
-
+
I

70
R
l
S
==== ρρρρ
ρρρρ
-
opór właściwy zależny od rodzaju materiału
[
ρ ] =
ρ ] =
ρ ] =
ρ ] = Ω
Ω
Ω
Ω⋅⋅⋅⋅
m
((((
))))
R
R
t
====
++++
0
1
α∆
α∆
α∆
α∆
R
- opór przewodnika w temperaturze
t
Ro
- opór w temp.
t
0
= 0
0
C
αααα
- współczynnik temperaturowy oporu
αααα ====
−−−−
R
R
R
t
0
0
∆∆∆∆
[[[[ ]]]]
αααα ====
1
K
Prawa Kirchhoffa
I
. Suma prądów wpływających do dowolnego punktu obwodu jest równa sumie
prądów wypływających z tego punktu .
I
1
+ I
2
+ I
3
= I
4
+ I
5
II
. Spadki napięcia na wszystkich przewodnikach łączących dwa dowolnie
wybrane punkty obwodu są jednakowe.
U
1
= U
2
= U
3
I
1
R
1
= I
2
R
2
= I
3
R
3
I
I
R
R
1
2
2
1
====
Prądy w rozgałęzieniach są odwrotnie proporcjonalne do oporów tych
rozgałęzień.
Ł
ą
czenie oporów
I
5
I
4
I
3
I
2
I
1
I
1
R
1
I
2
R
2
I
3
R
3
∅
∅
∅
∅
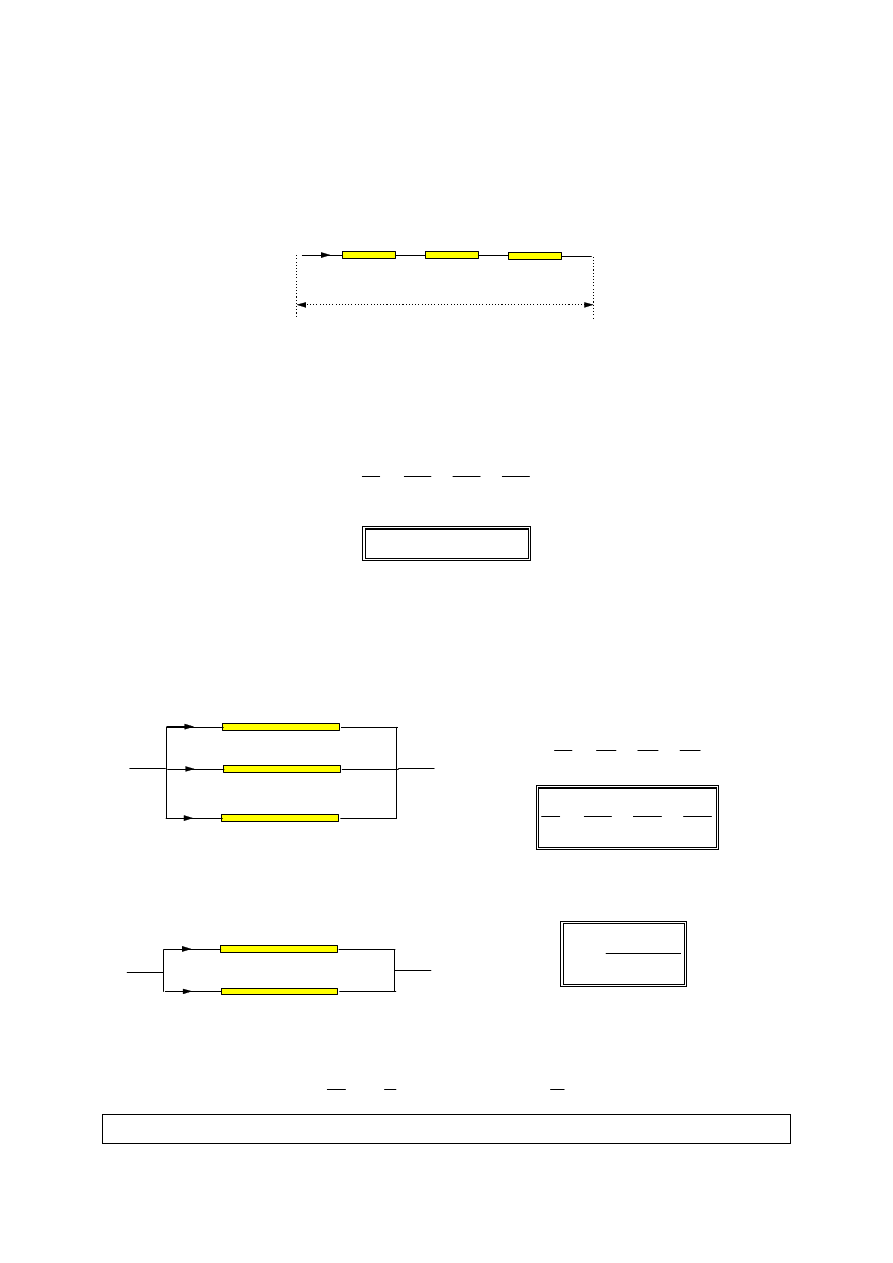
71
1. Ł
ą
czenie szeregowe
.
Cechą charakterystyczną szeregowego łączenia oporów jest jednakowe
natężenie prądu płynącego przez każdy z oporów.
I
U
U
1
R
1
∅
∅
∅
∅
∅
∅
∅
∅
U
2
R
2
U
3
R
3
Spadek napięcia na końcach układu jest równy sumie spadków napięcia na
poszczególnych oporach.
U = U
1
+ U
2
+ U
3
|:I
U
I
U
I
U
I
U
I
====
++++
++++
1
2
3
R
R
R
R
====
++++
++++
1
2
3
2. Ł
ą
czenie równoległe
.
Cechą charakterystyczną równoległego łączenia oporów jest jednakowe
napięcie na poszczególnych oporach.
I = I
1
+ I
2
+ I
3
|:U
W przypadku dwóch oporów połączonych równolegle otrzymujemy:
R
R R
R
R
====
++++
1
2
1
2
Dla
n
jednakowych oporów
r
połączonych równolegle otrzymujemy:
1
1
R
n
r
R
r
n
====
⇒
⇒
⇒
⇒
====
Pomiar oporu elektrycznego
I
1
R
1
I
2
R
2
I
3
R
3
∅
∅
∅
∅
∅
∅
∅
∅
I
U
I
U
I
U
I
U
====
++++
++++
1
2
3
1
1
1
1
1
2
3
R
R
R
R
====
++++
++++
I
1
R
1
I
2
R
2
∅
∅
∅
∅
∅
∅
∅
∅
I
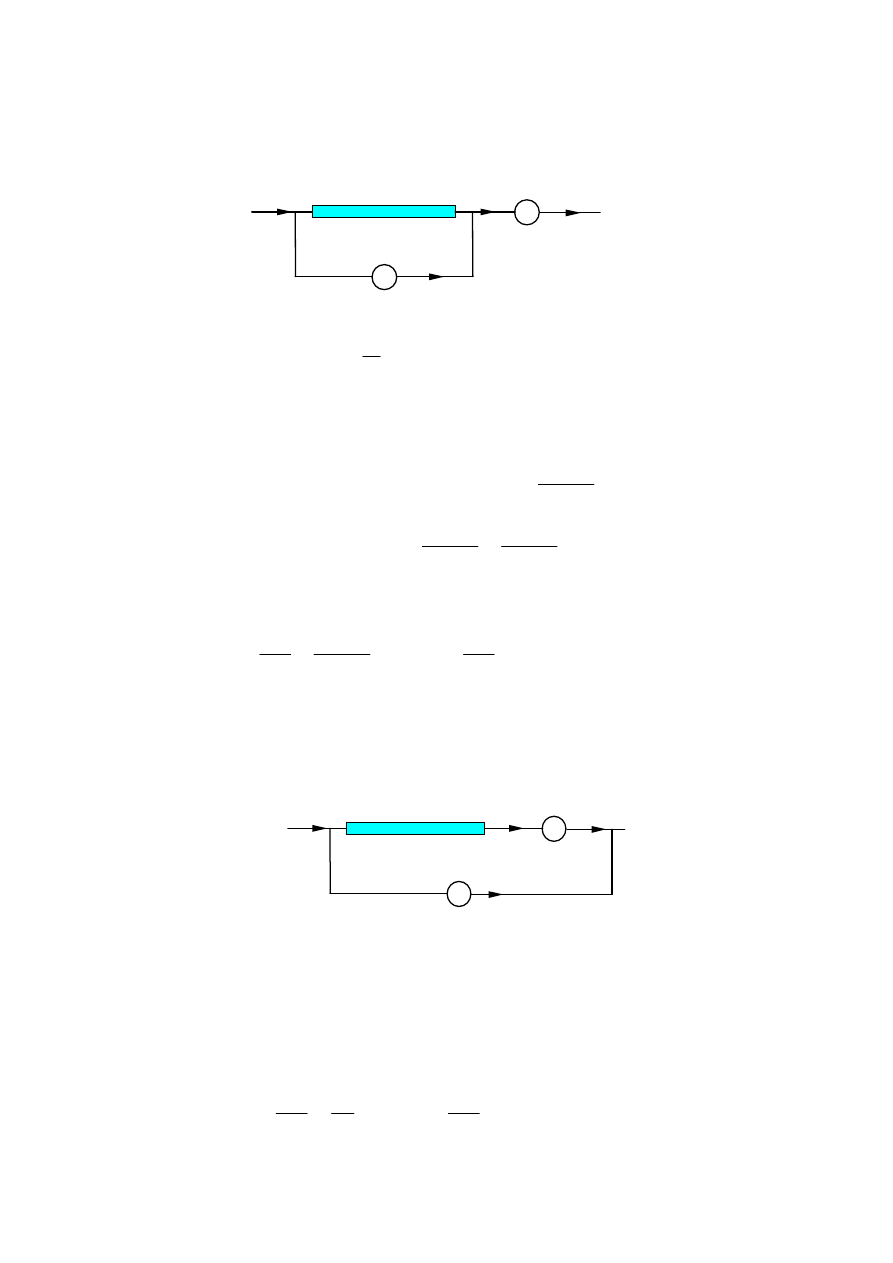
72
1. Pomiar oporu poprzez pomiar napi
ę
cia i nat
ęż
enia.
Amperomierz wskazuje sumę natężeń prądów płynących przez mierzony opór i
przez woltomierz. Stosunek
I
U
wyraża zatem opór zastępczy układu - opór
mierzony, woltomierz - połączonych równolegle. Przyjmując ten stosunek za
wartość mierzonego oporu (
R
) popełniamy błąd. Błąd bezwzględny pomiaru
wynosi:
v
v
r
R
Rr
'
R
;
'
R
R
R
++++
====
−−−−
====
∆∆∆∆
v
2
v
v
r
R
R
r
R
Rr
R
R
++++
====
++++
−−−−
====
∆∆∆∆
Błąd względny pomiaru jest równy:
∞
∞
∞
∞
→
→
→
→
⇔
⇔
⇔
⇔
→
→
→
→
∆∆∆∆
++++
====
∆∆∆∆
v
v
r
0
R
R
;
r
R
R
R
R
Ten sposób mierzenia oporu jest stosowany do pomiaru małych oporów (dużo
mniejszych od oporu użytego woltomierza). Do pomiaru dużych oporów stosuje
się następujący układ pomiarowy:
Tym razem woltomierz wskazuje zbyt duże napięcie stanowiące sumę spadków
napięcia na mierzonym oporze i na amperomierzu. Błąd bezwzględny pomiaru
wynosi:
∆∆∆∆
R
R
R
R
R
r
A
====
−−−−
==== ++++
'
;
'
∆∆∆∆
R = r
A
Błąd względny pomiaru jest równy:
∆∆∆∆
∆∆∆∆
R
R
r
R
R
R
r
A
A
====
→
→
→
→ ⇔
⇔
⇔
⇔
→
→
→
→
;
0
0
V
r
A
U
I
A
R
r
v
I
U
V
A
R
73
Ten sposób mierzenia oporu jest stosowany do pomiaru dużych oporów (dużo
większych od oporu użytego amperomierza).
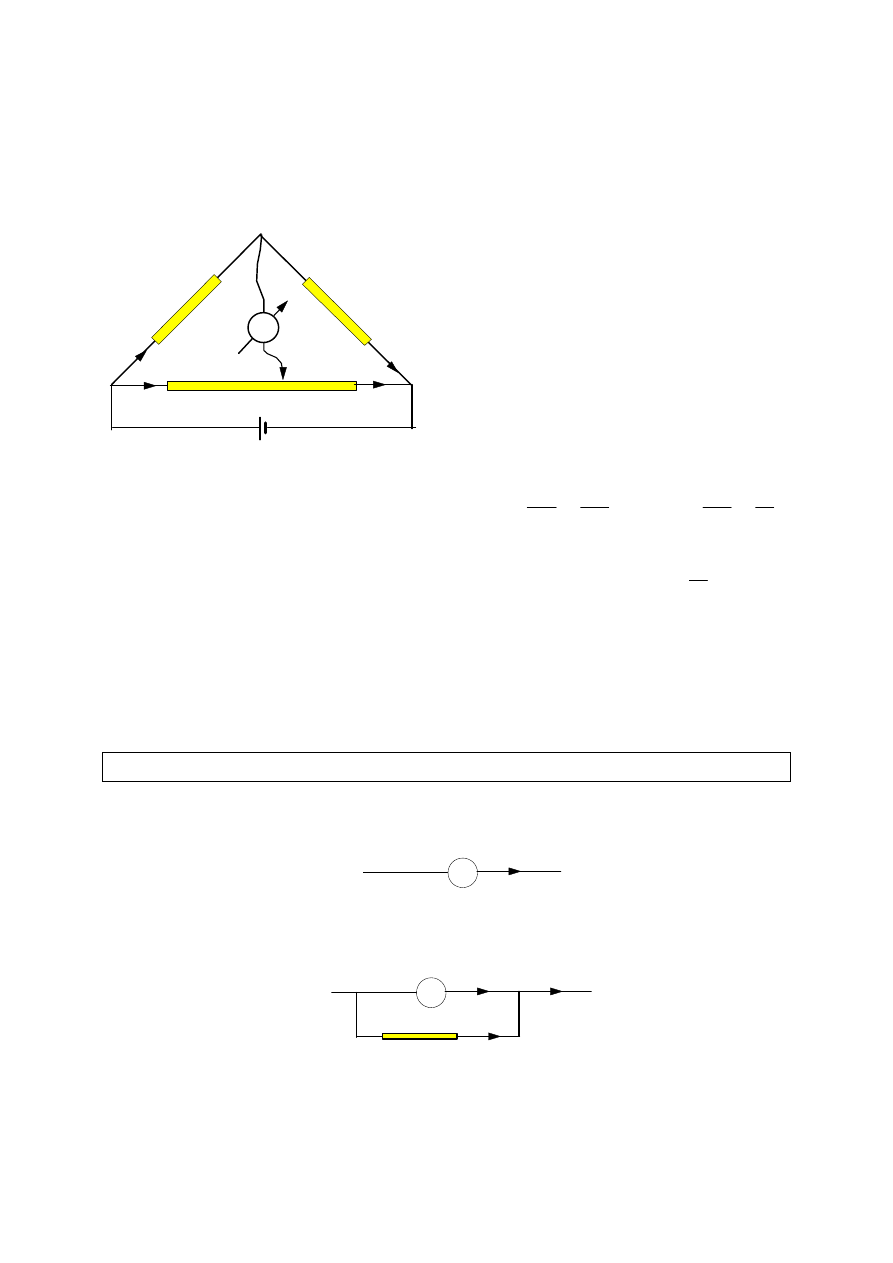
2. Pomiar oporu za pomocą mostka Wheatstone'a.
Przesuwając
suwak
wzdłuż
mostka
ustalamy takie jego położenie, aby
galwanometr nie wskazywał różnicy
potencjałów. Ma to miejsce wtedy, gdy
spadki napięcia na oporach R
x
i R
1
oraz
R
0
i R
2
są odpowiednio równe.
R
x
- opór mierzony
R
0
- opór wzorcowy
R
1
, R
2
- opory poszczególnych części mostka
l
1
, l
2
- długości poszczególnych części mostka
Pomiar oporu za pomocą mostka Wheatstone'a jest najbardziej dokładny, gdy
opór mierzony jest bliski oporu wzorcowego. Punkt równowagi mostka wypada
wtedy blisko środka mostka i błąd w określeniu długości l
1
i l
2
jest względnie
mały.
Zmiana zakresu amperomierza
Maksymalne natężenie prądu, które może mierzyć amperomierz nazywamy jego
zakresem.
Amperomierz o oporze wewnętrznym r
A
i zakresie I może służyć do mierzenia
prądu o natężeniu n razy większym, jeśli zastosujemy bocznik, przez który
popłynie część prądu.
Maksymalne wychylenie wskazówki amperomierza ma miejsce wtedy, gdy
płynie przez niego prąd o natężeniu I, ale natężenie prądu w obwodzie wynosi
n
⋅⋅⋅⋅
I
. Korzystając z II prawa Kirchhoffa otrzymujemy:
l
2
R
2
I
2
I
2
I
1
I
1
l
1
R
1
R
0
G
R
x
R I
R I
R I
R I
x
2
1 1
0
2
2 1
====
====
R
R
R
R
R
R
l
l
R
R
l
l
x
x
0
1
2
1
2
1
2
0
1
2
====
====
====
;
r
A
I
A
r
A
R
nI - I = (n - 1)
⋅⋅⋅⋅
I
nI
I
A
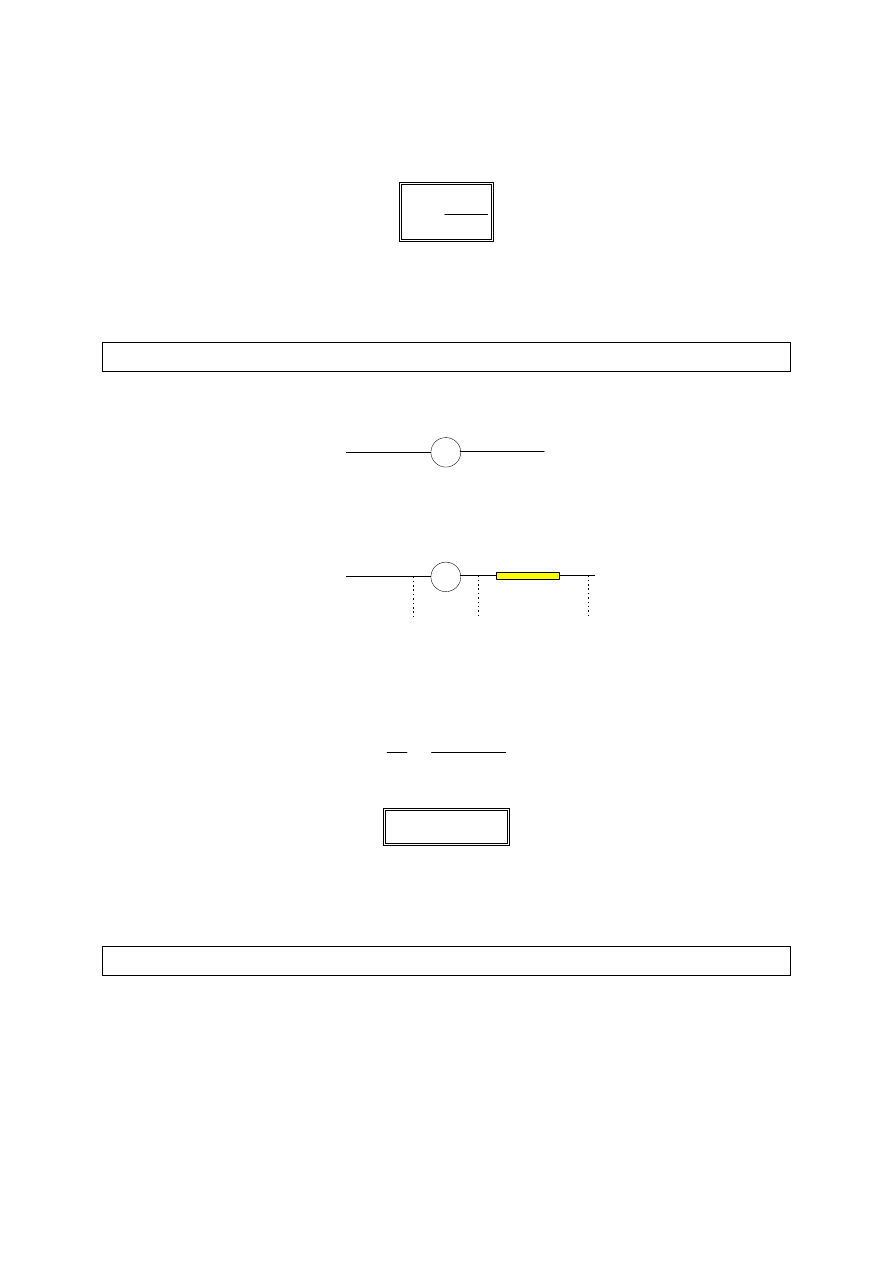
74
R (n - 1)
⋅⋅⋅⋅
I = r
A
⋅⋅⋅⋅
I
R
r
n
A
====
−−−−
1
Aby zwiększyć zakres amperomierza
n
razy, trzeba zastosować bocznik o
oporze
n - 1
razy mniejszym od oporu wewnętrznego amperomierza.
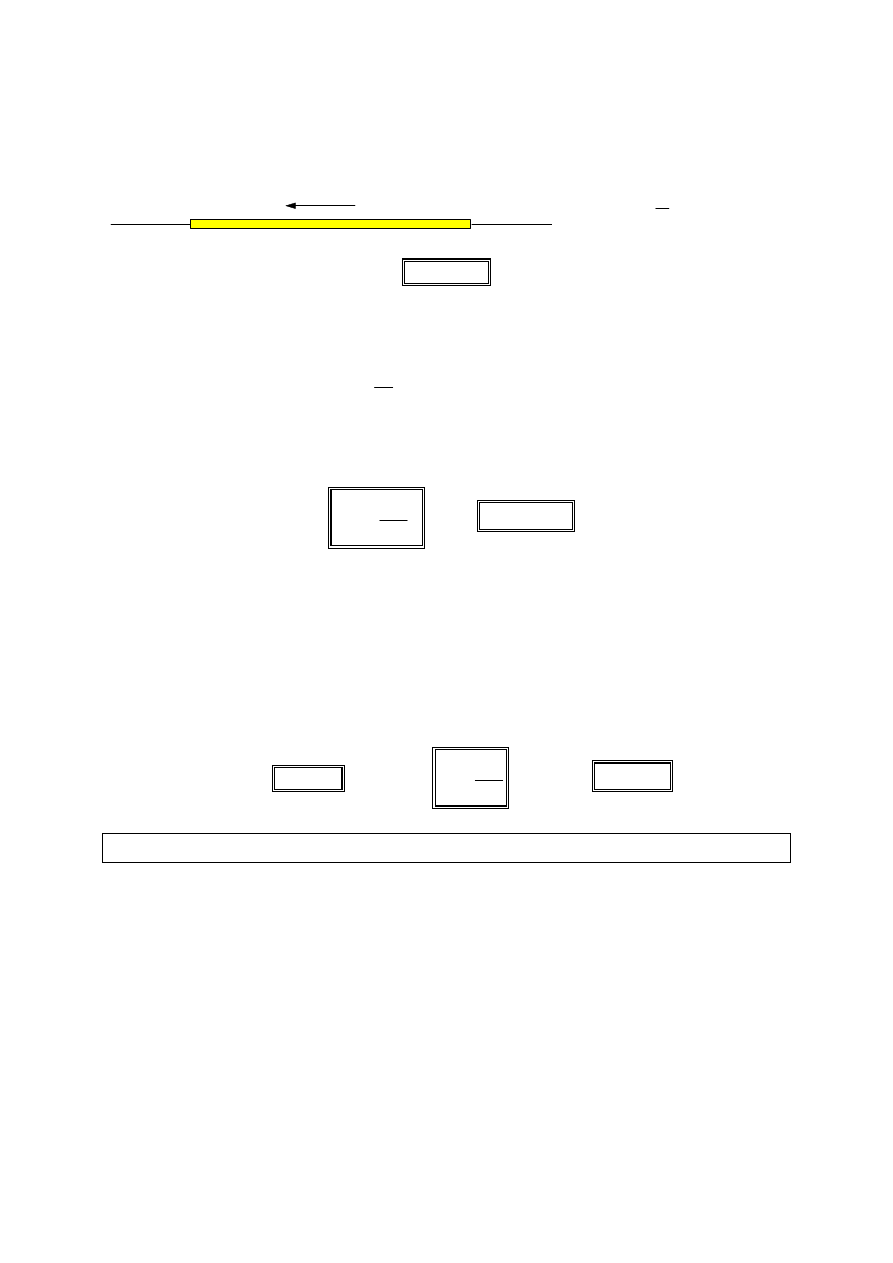
Zmiana zakresu woltomierza
Woltomierz o oporze wewnętrznym
r
v
ma zakres
U
. Aby jego zakres zwiększyć
n
razy, należy włączyć do niego szeregowo taki opór
R
, aby maksymalne
wychylenie wskazówki woltomierza nastąpiło po przyłożeniu do zacisków
obwodu napięcia
n
⋅⋅⋅⋅
U
.
Przez woltomierz i opór zabezpieczający płynie prąd o tym samym natężeniu.
Korzystając z prawa Ohma otrzymujemy:
((((
))))
U
r
n
U
R
v
====
−−−−
1
((((
))))
R
r n
v
====
−−−−
1
Aby zwiększyć zakres woltomierza
n
razy, należy zabezpieczyć go oporem o
wartości
n - 1
razy większym od oporu wewnętrznego woltomierza.
Praca i moc pr
ą
du
Pole elektryczne przenosząc ładunek
q
między dwoma punktami o różnicy
potencjałów
U
wykonuje pracę równą:
W = q
⋅⋅⋅⋅
U
U
r
v
V
∅
∅
U
(n - 1)
⋅⋅⋅⋅
U
r
v
V
∅
∅
75
Jeśli proces przenoszenia ładunku odbywa się w przewodniku, w którym płynie
prąd o natężeniu
I
, to otrzymujemy:
I
q
t
q
It
====
⇒
⇒
⇒
⇒
====
W
UIt
====
Korzystając z prawa Ohma otrzymujemy:
I
U
R
U
IR
====
====
;
Pracę prądu można zatem wyrazić również w postaci:
W
U
R
t
====
2
W
I Rt
====
2
Praca wykonana przez prąd płynący w oporze R zwykle prowadzi do wzrostu
energii wewnętrznej przewodnika, co poznajemy po wzroście temperatury.
Efektem wykonania pracy może być również energia mechaniczna (silnik
elektryczny), lub energia świetlna (żarówka).
Moc prądu stałego wyraża stosunek pracy wykonanej przez prąd do czasu, w
którym praca ta została wykonana i wynosi:
P
UI
====
P
U
R
====
2
P
I R
====
2
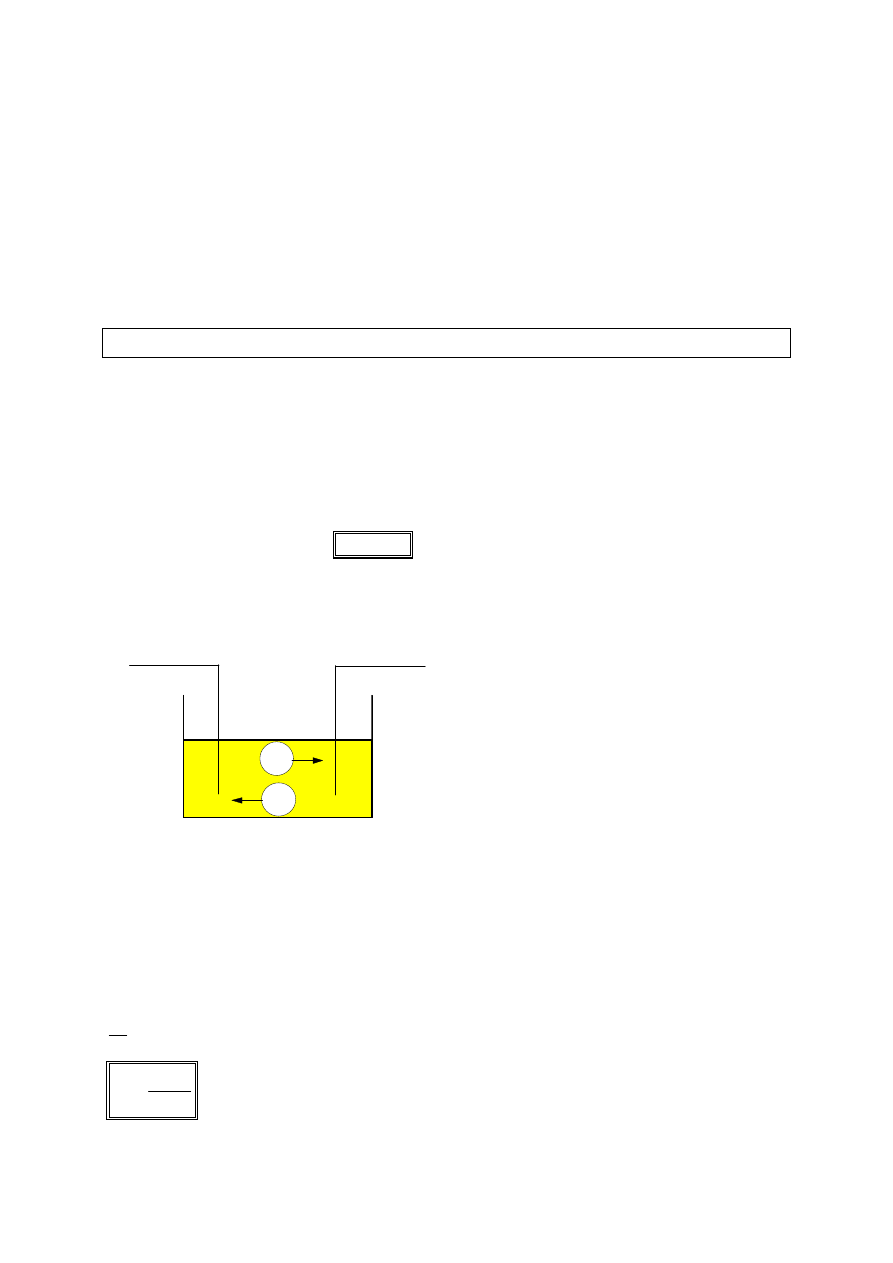
Elektroliza
Woda ma znaczną wartość stałej dielektrycznej (
εεεε
= 81
). Cząsteczki wody
wnikając między atomy cząsteczek kwasów, zasad i soli zmniejszają znacznie
siły, dzięki którym istnieje struktura ciała stałego, co prowadzi do rozpadu
cząsteczek tych substancji na poszczególne jony. Proces ten nazywamy
dysocjacją elektrolityczną. Rozpad substancji na jony może być również
spowodowany wzmożonym ruchem termicznym. Taki proces nazywamy
dysocjacją termiczną. W wyniku dysocjacji powstaje ciecz zawierająca jony
obojga znaków, zwana elektrolitem.
∅
∅
∅
∅
∅
∅
∅
∅
U
-
+
I
76
Pole elektryczne powoduje ruch jonów elektrolitu. W sąsiedztwie elektrod
następuje wymiana ładunków między jonami i elektrodą, a także szereg reakcji
chemicznych, w wyniku których na elektrodach wydzielają się różne substancje.
Zespół zjawisk fizycznych i chemicznych, które towarzyszą przepływowi prądu
elektrycznego przez elektrolit nazywamy elektrolizą. Przebieg elektrolizy
zależy przede wszystkim od rodzaju elektrolitu i rodzaju elektrod, ale pewne
znaczenie ma również stężenie elektrolitu i natężenie prądu płynącego przez
elektrolit.
Pierwsze prawo elektrolizy
Dwa prawa elektrolizy zostały odkryte doświadczalnie przez M. Faraday'a
(1791-1867).
W
wyniku
wielokrotnych
pomiarów
mas
substancji
wydzielających się podczas elektrolizy na poszczególnych elektrodach ustalono,
ż
e są one dla danej substancji wprost proporcjonalne do natężenia płynącego
prądu i do czasu trwania elektrolizy.
m
kIt
====
lub
m = kQ
Współczynnik proporcjonalności k jest zależny od rodzaju substancji i
nazywamy go równoważnikiem elektrochemicznym danej substancji. Aby na
jednej z elektrod wydzieliła się jakaś
substancja, to do tej elektrody muszą
dotrzeć jakieś jony. W przypadku
elektrolizy stopionej soli kuchennej,
podczas elektrolizy, do katody dążą
jony sodu, a do anody - jony chloru.
W
wyniku
zobojętnienia,
na
elektrodach wydziela się Na i Cl.
NaCl
Na
Cl
temp.
→
→
→
→
++++
++++
−−−−
Pierwsze prawo elektrolizy jest spełnione dla każdej ilości wydzielonej
substancji, a w szczególności dla pojedynczego jonu:
m
j
= kQ
j
m
j
-
masa jonu
Q
j
-
ładunek jonu
µµµµ
A
k we
==== ⋅⋅⋅⋅
µµµµ
- masa molowa
A
- liczba Avogadra
k
ewA
==== µµµµ
w
- wartościowość e - ładunek elektronu
∅
∅
Cl
-
Na
+
(-)
K
(+)
A
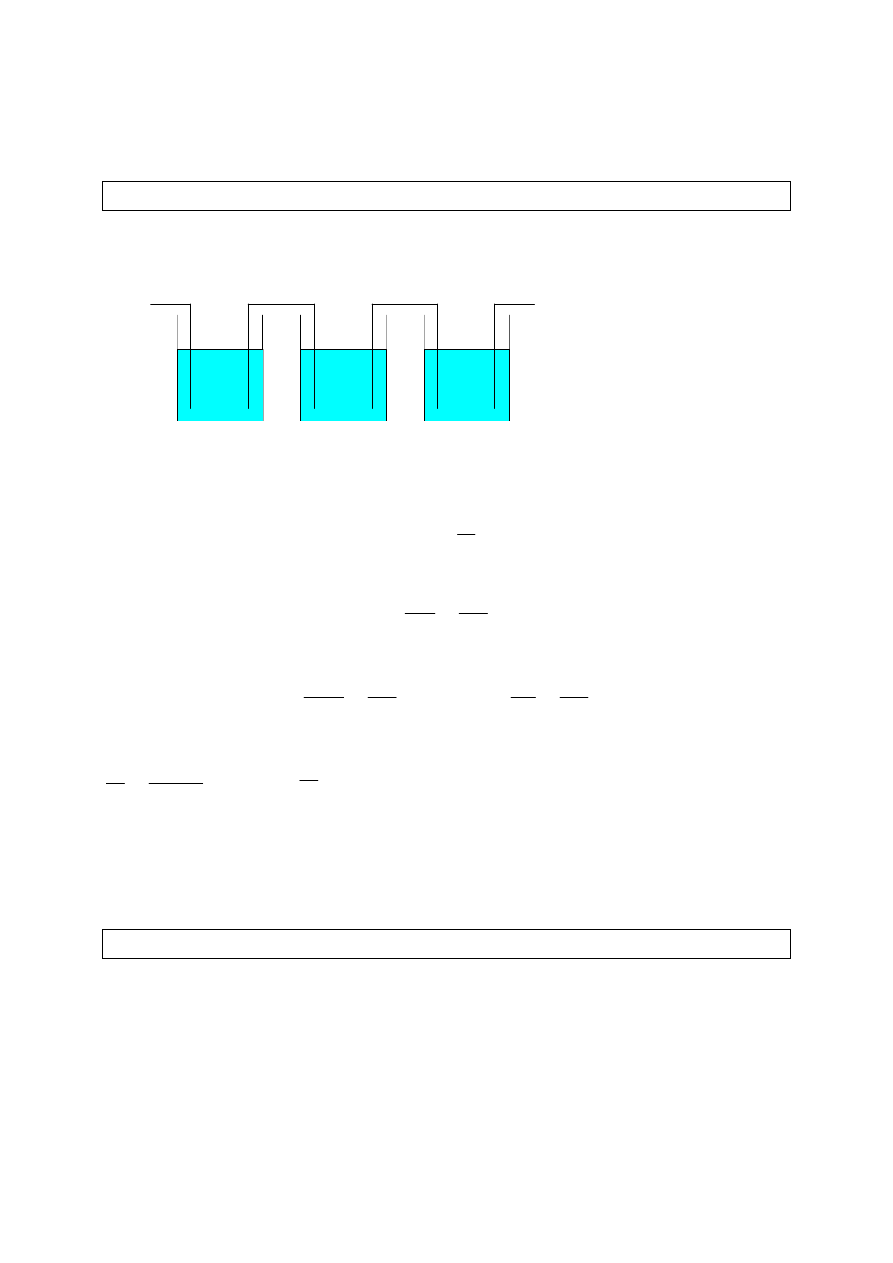
77
Równoważnik elektrochemiczny substancji można wyznaczyć doświadczalnie,
mierząc m, l oraz t, ale można go również wyliczyć znając stałe: , e, w i A.
Drugie prawo elektrolizy
Przeprowadzając elektrolizę w kilku woltametrach połączonych szeregowo,
Faraday stwierdził, że wydzielone tam substancje są w takich stosunkach
wagowych w jakich
substancje te łączą się
w związki. Wiadomo,
ż
e substancje łączą się
w związki w takich
stosunkach wagowych
w jakich są ich gramo- równoważniki chemiczne.
Przez gramorównoważnik chemiczny rozumiemy stosunek masy molowej do
wartościowości:
R
w
==== µµµµ
m
m
R
R
1
2
1
2
====
k Q
k Q
R
R
k
k
R
R
1
2
1
2
1
2
1
2
====
⇒
⇒
⇒
⇒
====
R
k
F
F
eA
C
====
====
≈≈≈≈
;
96500
; F - stała Faradaya
Równoważniki elektrochemiczne są wprost proporcjonalne do odpowiednich
gramorównoważników chemicznych. Stała Faradaya wyraża ładunek jednego
mola elektronów.
Energetyka reakcji chemicznych
Każdy atom i każdą cząsteczkę można traktować jak zbiór ładunków
elektrycznych, między którymi zachodzą oddziaływania. Takiemu układowi
można przypisać pewną energię potencjalną. Samorzutnie zachodzą takie
reakcje chemiczne, podczas których układ cząsteczek przechodzi do stanu
niższej energii. Dla przykładu: w wyniku reakcji cynku z kwasem siarkowym
powstaje układ cząstek o mniejszej energii, co oznacza, że ta reakcja jest
ź
ródłem energii. Reakcja miedzi z kwasem siarkowym prowadziłaby do
∅
∅
∅
∅
(-)
(+)
∅
∅
∅
∅
O
2
H
2
H
2
SO
4
Cl
2
Cu
CuCl
2
O
2
Ag
AgNO
3
R
k
ewA
w
==== µµµµ
µµµµ
78
powstania układu cząstek o większej energii i dlatego reakcja taka samorzutnie
nie zachodzi. Można ją jednak przeprowadzić przy dopływie energii z zewnątrz
(w odpowiednio wysokiej temperaturze).
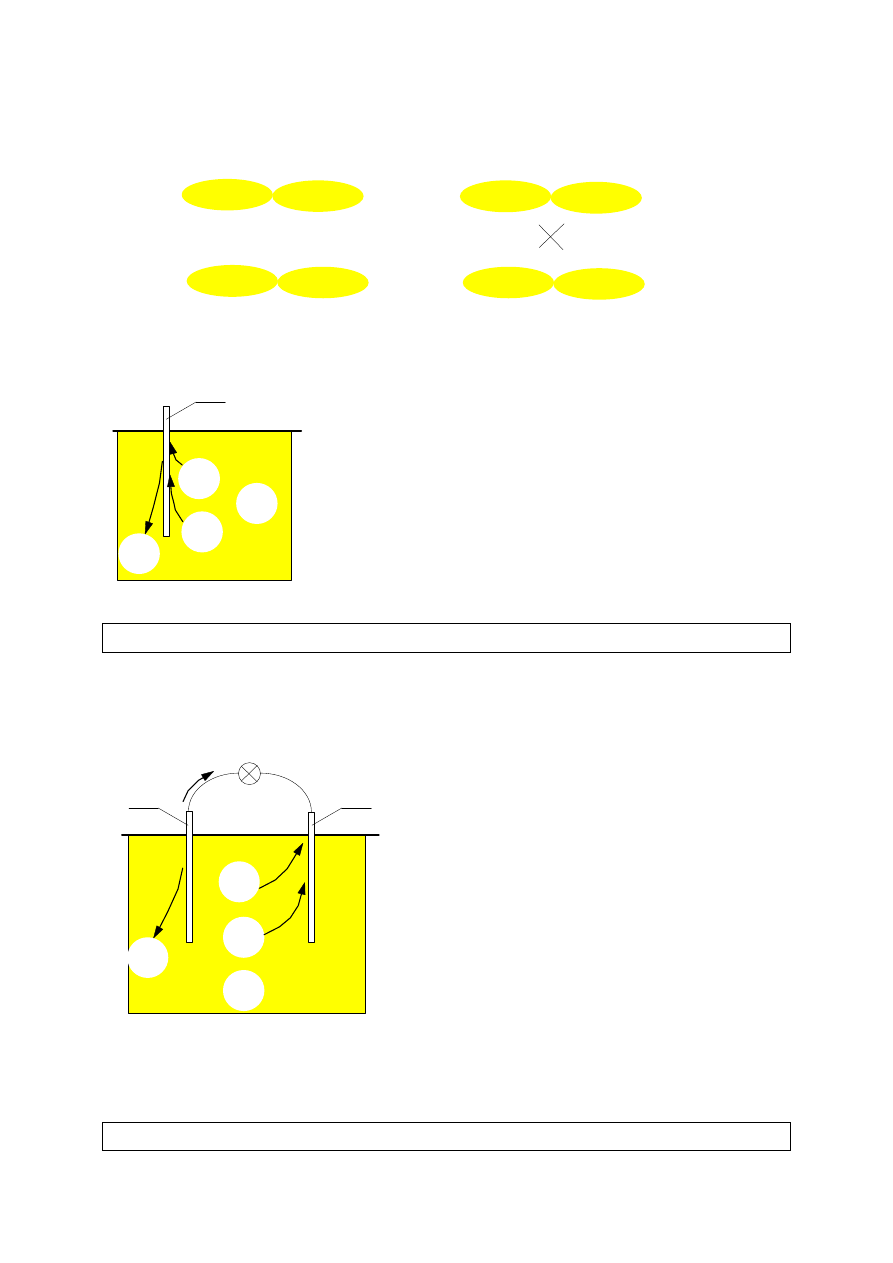
Podczas reakcji cynku z kwasem siarkowym, do kwasu przechodzą jony cynku i
płyta cynkowa ładuje się ujemnie. Wypierane z
roztworu jony wodorowe ulegają zobojętnieniu na
płycie cynkowej i wydziela się wodór.Wydzielona przy
tym energia powoduje wzrost energii wewnętrznej
układu, co oznacza, że podnosi się jego temperatura.
W ogniwach elektrycznych wykorzystuje się tak
wyzwoloną
energię
chemiczną
jako
energię
uporządkowanego ruchu ładunków elektrycznych, czyli
energię prądu elektrycznego.
Ogniwo Volty
Ogniwo Volty stanowią dwie elektrody - cynkowa i miedziana, zanurzone w
roztworze wodnym kwasu siarkowego. Cynk przechodzi do roztworu w postaci
dodatnich jonów, a płyta cynkowa ładuje się ujemnie. W wyniku połączenia
elektrod, część elektronów przepływa na
elektrodę miedzianą, gdzie zobojętniają się
wypierane z roztworu jony wodorowe.
Energia wydzielona w reakcji cynku z kwasem
przekształca się częściowo w energię prądu
elektrycznego
płynącego
w
obwodzie
zewnętrznym, a częściowo - w energię
wewnętrzną roztworu. Wodór wydzielający się
podczas pracy ogniwa pokrywa częściowo
elektrody co utrudnia dopływ elektrolitu do
elektrod i natężenie prądu w obwodzie maleje.
Ogniwo Leclanche'go
Zn
H
2
SO
4
H
2
ZnSO
4
Cu
H
2
SO
4
H
2
CuSO
4
↓↓↓↓
↓↓↓↓
E
2
> E
1
E
2
< E
1
E
1
E
1
--
Zn
SO
4
-2
Zn
+2
H
+
H
+
-
-
-
Cu
e
Zn
SO
4
-2
Zn
+2
H
+
H
+
79
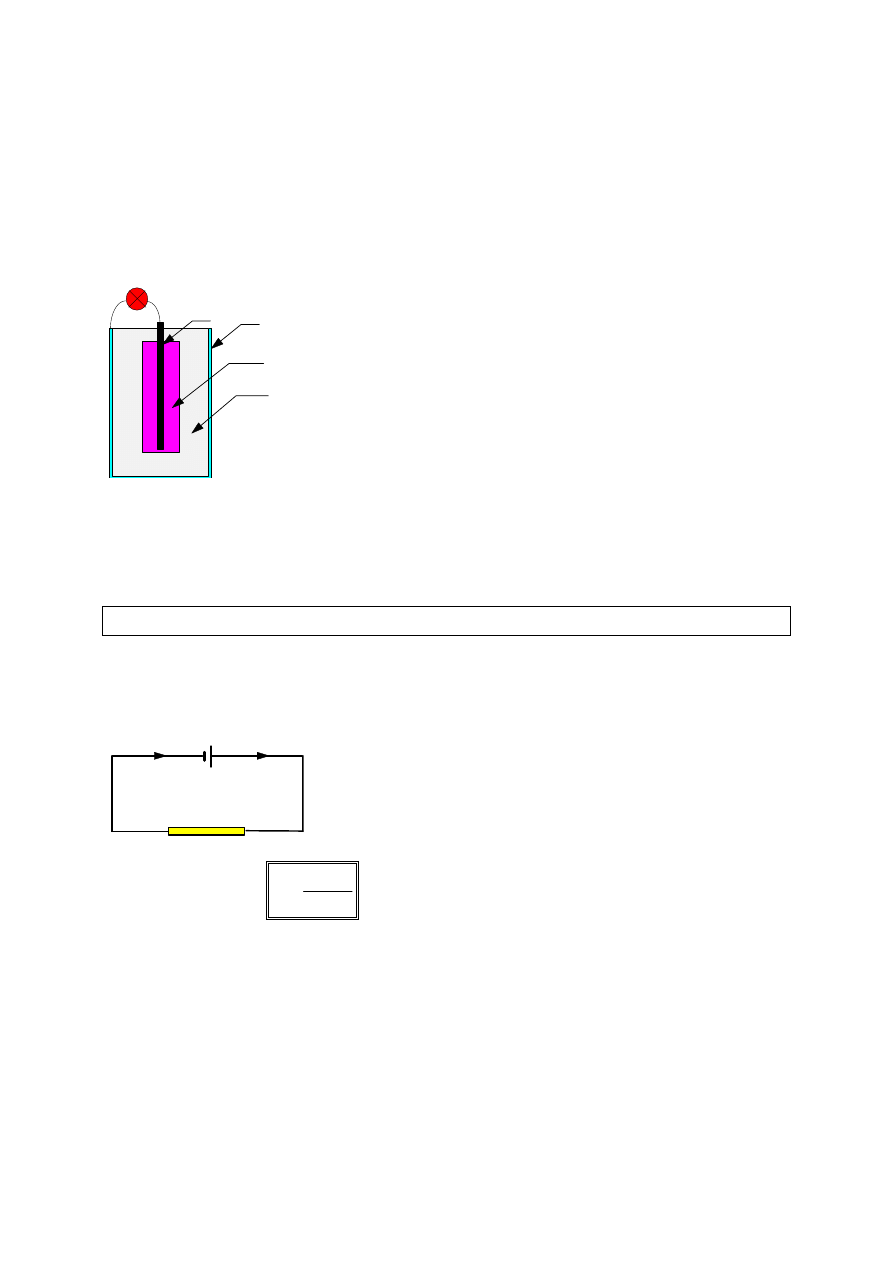
Ogniwo Leclanche'go stanowią elektrody - cynkowa i węglowa, zanurzone w
roztworze wodnym NH
4
Cl
. Elektroda węglowa otoczona jest warstwą MnO
2
z
dodatkiem węgla. Braunsztyn (MnO
2
) utlenia wodór wydzielający się podczas
pracy ogniwa. Salmiak (NH
4
Cl
) jest zmieszany z krochmalem lub żelem
krzemionkowym (uwodniony dwutlenek krzemu), stanowiąc półpłynną papkę.
Podczas pracy ogniwa zachodzą następujące reakcje:
Zn: Zn
→
→
→
→
Zn
+2
+ 2e
C:
2NH
4
+
+ 2e
→
→
→
→
2NH
3
+ H
2
2MnO
2
+ H
2
→
→
→
→
MnO
2
+ H
2
O
Zn
+2
+ 4NH
3
→
→
→
→
[Zn(NH
3
)
4
]
+2
Cynk przechodzi do roztworu w postaci dodatnich jonów i elektroda cynkowa
ładuje się ujemnie. W wyniku połączenia elektrod, część elektronów przechodzi
na elektrodę węglową, gdzie zobojętniają się wypierane z roztworu jony
amonowe.
Siła elektromotoryczna ogniwa
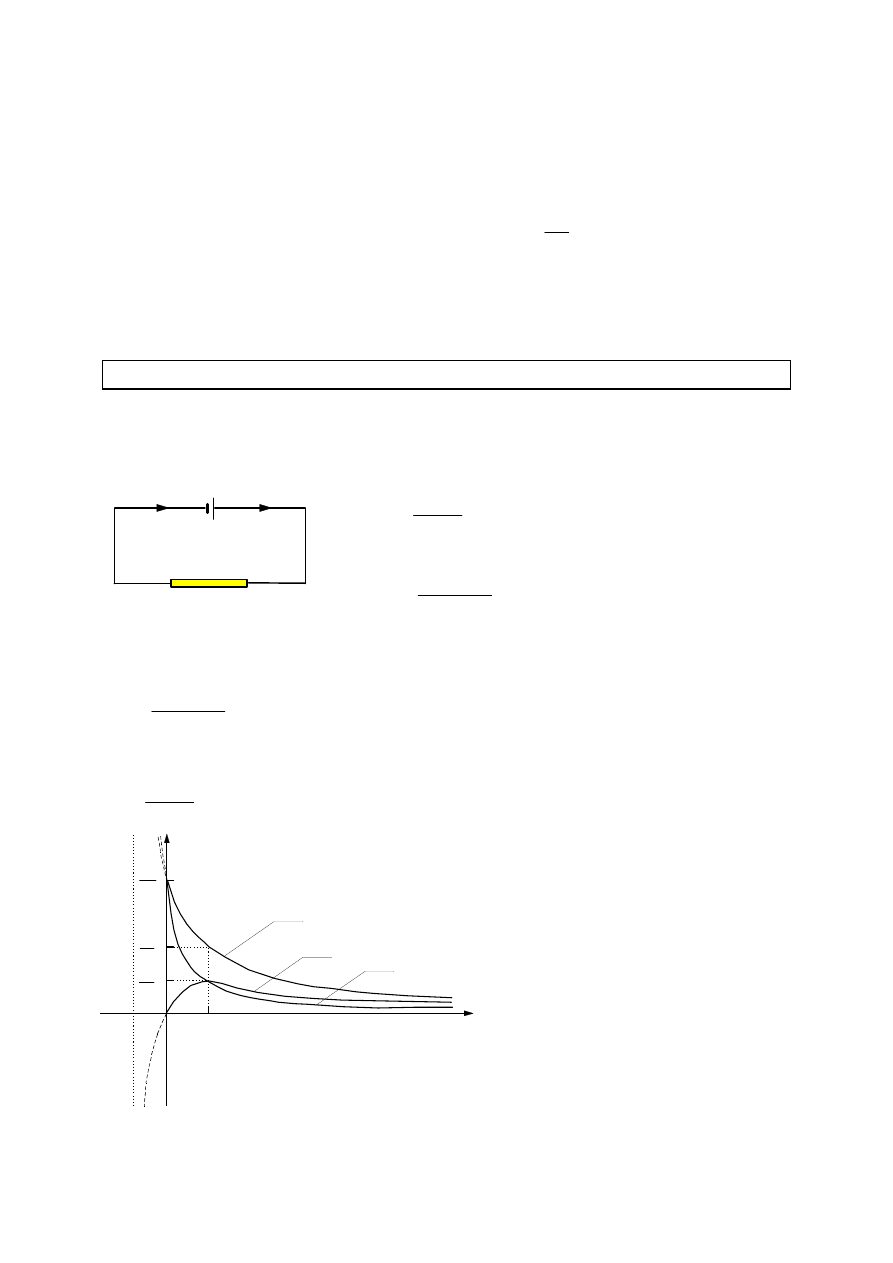
Siłą elektromotoryczną ogniwa nazywamy napięcie, które powoduje przepływ
prądu w obwodzie zamkniętym zawierającym ogniwo.
E
- siła elektromotoryczna ogniwa (SEM)
r
- opór wewnętrzny ogniwa
R
- opór zewnętrzny
I
- natężenie prądu w obwodzie
I
E
R
r
====
++++
- prawo Ohma dla obwodu zamkniętego
E = IR + Ir
SEM ogniwa stanowi sumę spadków napięcia na oporze zewnętrznym i
wewnątrz ogniwa.
R
→
→
→
→
∞
∞
∞
∞
⇒
⇒
⇒
⇒ I
→
→
→
→
0 ⇒
⇒
⇒
⇒ Ir
→
→
→
→
0 ⇒
⇒
⇒
⇒ IR
→
→
→
→
E
NH
4
Cl
MnO
2
Zn
C
I
r E
R
80
SEM ogniwa stanowi spadek napięcia na biegunach ogniwa otwartego (tzn. na
biegunach ogniwa połączonych nieskończenie wielkim oporem). Prąd płynący
w obwodzie zawierającym ogniwo wykonuje pracę:
W
EIt
EQ
E
W
Q
====
====
⇒
⇒
⇒
⇒
====
SEM ogniwa wyraża stosunek energii wydzielonej w obwodzie zawierającym
ogniwo do ładunku jaki w tym czasie przepłynął przez obwód. SEM ogniwa
Volty wynosi 1 V, a ogniwa Leclanche'go - 1,5 V.
Sprawność ogniwa
Jeśli prąd płynie w obwodzie zamkniętym zawierającym ogniwo, to część
energii wydziela się na oporze zewnętrznym, a część wewnątrz ogniwa.
I
E
R
r
====
++++
- natężenie prądu w obwodzie
((((
))))
P
E R
R
r
u
====
++++
2
2
- moc użyteczna (wydzielona w
obwodzie zewnętrznym)
((((
))))
P
E r
R
r
s
====
++++
2
2
- moc stracona (wydzielona wewnątrz ogniwa)
P
E
R
r
====
++++
2
- moc całkowita.
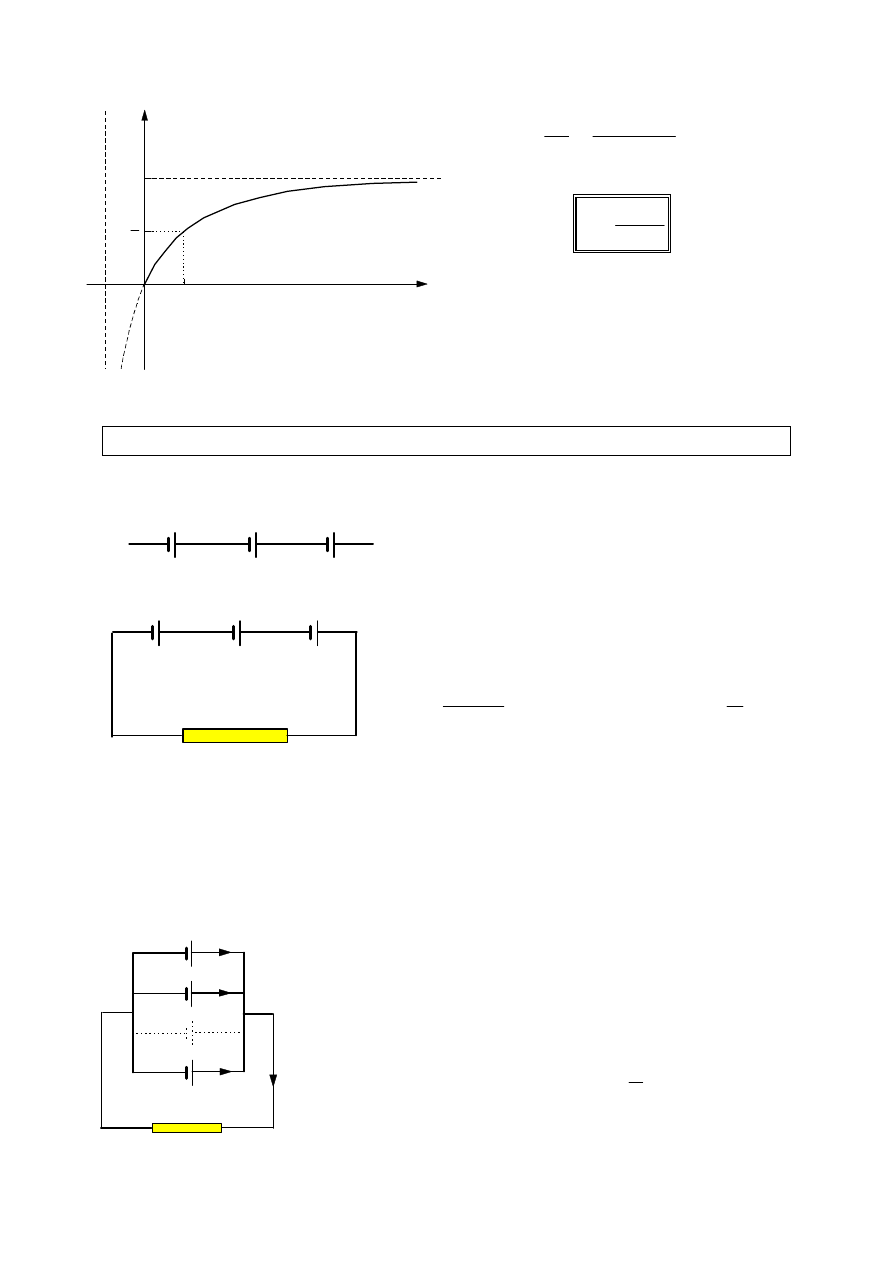
Wykresy mocy użytecznej, mocy
straconej i mocy całkowitej w
funkcji
oporu
zewnętrznego
zamieszczono obok. Wykres mocy
użytecznej ma maksimum dla
oporu
zewnętrznego
równego
oporowi wewnętrznemu ogniwa.
Stosunek mocy użytkowej do mocy
całkowitej
wyraża
sprawność
ogniwa.
I
r E
R
E
r
2
4
E
r
2
2
E
r
2
R = r
R
P
s
P
u
P
81
((((
))))
ηηηη ====
====
++++
P
P
I R
I R
r
u
2
2
ηηηη ====
++++
R
R
r
Sprawność ogniwa rośnie ze wzrostem
oporu
zewnętrznego.
Przy
takim
obciążeniu, przy którym moc
użyteczna jest największa, sprawność
ogniwa wynosi 50 %.
Łączenie ogniw
1. Łączenie szeregowe.
E
b
= E
1
+ E
2
+ E
3
r
b
= r
1
+ r
2
+ r
3
W przypadku n jednakowych ogniw połączonych szeregowo otrzymujemy:
E
b
= nE r
b
= nr
I
nE
R
nr
R
I
I
E
r
====
++++
→
→
→
→
⇒
⇒
⇒
⇒
→
→
→
→
====
;
max
0
Wadą szeregowego łączenia ogniw jest ograniczone natężenie prądu, jaki
można uzyskać z takiej baterii. Maksymalne natężenie prądu nie zależy od
liczby ogniw. Szeregowe łączenie ogniw stosujemy do zasilania odbiorników o
dużym oporze, nie wymagających prądu o dużym natężeniu.
2. Łączenie równoległe.
Równolegle łączy się zwykle ogniwa o jednakowej SEM.
W przypadku ogniw o różnych SEM, ogniwa silniejsze
ulegają rozładowaniu przez słabsze nawet wtedy, gdy
bateria nie jest używana. Dla n jednakowych ogniw
połączonych równolegle otrzymujemy:
E
b
= E
r
b
=
r
n
1
2
1111
ηηηη
R
R = r
E
1
r
1
E
1
r
1
E
1
r
1
∅
∅
∅
∅
∅
∅
∅
∅
E r
E r
E r
R
E r
E r
E r
R

82
I
E
R
r
n
R
I
I
nE
r
====
++++
→
→
→
→
⇒
⇒
⇒
⇒
→
→
→
→
====
;
max
0
Zaletą równoległego łączenia ogniw jest możliwość uzyskania prądu o
znacznym natężeniu. Takie połączenie stosujemy do zasilania odbiorników o
niewielkim oporze, lecz wymagających prądu o dużym natężeniu.
Maksymalna moc jaką można uzyskać z baterii ogniw nie zależy od sposobu
połączenia ogniw.
Akumulatory
Procesy zachodzące podczas pracy ogniwa elektrycznego są nieodwracalne.
Można jednak tak dobrać elektrody i elektrolit, aby procesy chemiczne
zachodzące podczas pracy ogniwa można było odwrócić na drodze elektrolizy.
Takie ogniwa elektryczne nazywamy akumulatorami.
1. Akumulator ołowiowy.
W stanie rozładowanym, obie płyty akumulatora są pokryte PbSO
4
i są
zanurzone w roztworze wodnym H
2
SO
4
. Podczas ładowania zachodzą
następujące reakcje:
K: PbSO
4
+ 2H
+
+2e
H
2
SO
4
+ Pb
A: PbSO
4
+ SO
-2
- 2e + 2H
2
O
2H
2
SO + PbO
2
Podczas rozładowania reakcje te zachodzą w przeciwnym kierunku. SEM
akumulatora ołowiowego wynosi ok. 2V. Podczas ładowania, gęstość kwasu
siarkowego wzrasta od 1.16 kg/dm
3
do 1,25 kg/dm
3
.
Wielkością charakteryzującą akumulator jest jego pojemność. Jest to ładunek
jaki przepływa przez akumulator podczas jego rozładowania. Mierzymy ją w
amperogodzinach (Ah). Sprawność akumulatora ołowiowego wynosi ok. 80 %.
2. Akumulator żelazo-niklowy.
W stanie rozładowanym obie płyty akumulatora są zanurzone w wodnym
roztworze KOH, przy czym elektroda ujemna jest pokryta Fe(OH)
2
, a elektroda
dodatnia - Ni(OH)
2
. Podczas ładowania zachodzą następujące reakcje:
K: Fe(OH)
2
+ 2K
+
2KOH + Fe
A:
2Ni(OH)
2
+
2OH
-
2Ni(OH)
3

83
Podczas rozładowania reakcje te zachodzą w przeciwnym kierunku. SEM
akumulatora wynosi ok. 1,4 V, a jego sprawność - ok. 60 %. Akumulatory
zasadowe mają w porównaniu z akumulatorem ołowiowym większą trwałość.
Obraz mikroskopowy prądu w metalach
Atomy metalu są rozmieszczone tak gęsto, że elektrony walencyjne stają się
swobodne. Mogą one przemieszczać się w sieci krystalicznej metalu. Najlepsze
przewodniki, takie jak Cu i Ag mają jeden elektron walencyjny.
1. Koncentracja elektronów w przewodniku. Prędkość nośna.
Koncentracja elektronów swobodnych w przewodniku wyraża ilość elektronów
swobodnych
w
jednostce
objętości
przewodnika.
Dla
najlepszych
przewodników, koncentracja elektronów swobodnych równa jest koncentracji
atomów.
n
N
V
m
A
V
m
V
====
====
====
µµµµ
ρρρρ
;
- gęstość metalu
A
- liczba Avogadra
µ
µ
µ
µ
- masa molowa
n
A
====
ρρρρ
µµµµ
Przyłożenie napięcia do końców przewodnika wytwarza w nim pole
elektryczne. Pod wpływem tego pola, elektrony swobodne zawarte w
przewodniku zaczynają się przemieszczać. Zderzają się przy tym sprężyście z
jonami sieci krystalicznej pobudzając je do drgań. Oznacza to wzrost
temperatury przewodnika. Ruch elektronów przypomina dyfuzję.
Jeśli w przewodniku płynie prąd o natężeniu
I
, to przez przekrój poprzeczny
tego przewodnika w czasie
t
przepływa
N
elektronów, z których każdy przenosi
ładunek
e
.
I
Ne
t
N
nsl
====
====
;
I
nsle
t
l
t
V
====
====
;
- prędkość nośna elektronów
I
S

84
Prędkość nośna elektronów w przewodniku jest zatem proporcjonalna do
natężenia płynącego prądu.
2. Prawo Ohma w uj
ę
ciu molekularnym
.
Zgodnie z prawem Ohma, natężenie prądu w przewodniku jest wprost
proporcjonalne do napięcia na końcach tego przewodnika.
I
R
U
R
l
s
l
s
====
====
====
1
1
;
'
;
ρρρρ
σσσσ
σσσσ
- przewodnictwo właściwe
I
Us
l
U
l
E
====
====
σσσσ
;
- natężenie pola elektrycznego w przewodniku
I
sE
==== σσσσ
Natężenie prądu w przewodniku jest zatem wprost proporcjonalne do natężenia
pola elektrycznego w tym przewodniku.
Wyszukiwarka
Podobne podstrony:
2.4, Prąd elektryczny 69-84
Fizyka Prad elektryczny test id Nieznany
Fizyka Uzupelniajaca Prad elektryczny I id 177229
prąd elektryczny stały, Notatki lekcyjne ZSEG, Fizyka
II 2 Prad elektryczny
Prąd elektryczny
Prąd elektryczny stały
Prad elektryczny w przewodnikach
prad elektryczny 76R5T3OQBKHZDZEME77PJ2JF77YNLI6AQ26MB3Y
prad elektryczny2
Ciecze izolacyjne - referat, dielektryki ciekle, Dielektryki izolatory materiały które bardzo słabo
fizyka, Prąd elektryczny do piórnika, Prądem nazywamy uporządkowany ruch ładunków elektrycznych
prad elektryczny, 1) czym jest prąd elektryczny w cieczach i gazach
Prąd elektryczny stały
Prąd elektryczny, Instalacje budowlane, inne
FIZYKA PRĄD ELEKTRYCZNY
Prąd elektryczny, prąd stały - zadania2
fizyka.org, prąd II, Fizyka - Zadania - Prąd elektryczny II
więcej podobnych podstron