Postępy Biochemii 59 (3) 2013
295
Sabina Lip
Marzena Kurowska
*
Iwona Szarejko
Katedra Genetyki, Wydział Biologii i Ochrony
Środowiska, Uniwersytet Śląski, Katowice
*
Katedra Genetyki, Wydział Biologii i
Ochrony Środowiska, Uniwersytet Śląski, ul.
Jagiellońska 28, 40-032 Katowice; tel.: (32) 20 09
360, e-mail: mkurowsk@us.edu.pl
Artykuł otrzymano 27 maja 2013 r.
Artykuł zaakceptowano 31 sierpnia 2013 r.
Słowa kluczowe: czynniki transkrypcyjne, su-
sza, SNAC1
Wykaz skrótów: ABA — kwas abscysynowy;
ABRE — ang. ABA responsive element; ANAC
— ang. Arabidopsis thaliana NAC protein; AP2
— APETALA2; AREB/ABF — ang. ABA-re-
sponsive element (ABRE) binding protein/ABRE
binding factor; ATAF — ang. Arabidopsis thaliana
transcription factor; bZIP — ang. basic leucine
zipper; CE — ang. coupling element; CUC —
ang. cup-shaped cotyledon; DREB/CBF — ang.
dehydration-responsive element binding protein/C-
repeat binding factor; DRE/CRT — ang. dehydra-
tation-responsive element/C-repeat; ERF — ang.
ethylene responsive factor; MYB/MYC — ang.
myelocytomatosis oncogene/myeloblastosis onco-
gene; MYBR/MYCR — ang. MYB recognition
sequence/MYC recognition sequence; NAC —
NAM, ATAF, CUC; NACR — ang. NAC recog-
nition sequence; NAM — ang. no apical meristem;
NLS — ang. nuclear localization signal; ONAC
—ang. Oryza membrane NAC; ROS — ang. re-
active oxygen species; SAM — ang. shoot apical
meristem; SNAC — ang. stress-related NAC; TF
— ang. transcription factors; TIP — ang. Turnip
crinkle virus interacting protein; TRR — ang.
transcriptional regulation region; WT — ang. wild
type
Podziękowanie: Praca ta została wykonana w
ramach projektu POLAPGEN-BD „Narzędzia
biotechnologiczne służące do otrzymania zbóż
o zwiększonej odporności na suszę”, WND-
-POIG.01.03.01-00-101/08; koordynator pro-
jektu Instytut Genetyki Roślin PAN. Autorzy
bardzo dziękują prof. dr hab. Mirosławowi
Małuszyńskiemu za cenne uwagi odnośnie ni-
niejszego artykułu.
Rodzina czynników transkrypcyjnych NAC a zwiększenie
tolerancji na stres niedoboru wody u roślin
STRESZCZENIE
C
zynniki transkrypcyjne to białka zdolne do regulacji ekspresji genów docelowych,
poprzez specyficzne wiązanie się z DNA i kontrolę aktywności kompleksu inicju-
jącego transkrypcję. Białka te stanowią również kluczowy element w procesie adaptacji
roślin do warunków środowiska zewnętrznego. Do czynników transkrypcyjnych zwią-
zanych z odpowiedzią na stres należą białka rodzin DREB/CBF, AREB/ABF, MYB/MYC
oraz NAC. Rodzina NAC jest jedną z największych rodzin czynników transkrypcyjnych,
jej członkowie zostali zidentyfikowani u wielu gatunków roślin. Białka rodziny NAC
pełnią rolę związaną ze wzrostem i rozwojem oraz odpowiedzią roślin na stres biotyczny
i abiotyczny. Wiele czynników transkrypcyjnych, należących do rodziny NAC, wśród
nich SNAC1, bierze udział w reakcji roślin na stres niedoboru wody. Susza jest najbar-
dziej szkodliwym stresem środowiskowym w rolnictwie na całym świecie. Metody bio-
logii molekularnej stwarzają nowe możliwości dla współczesnej hodowli roślin w uzy-
skiwaniu odmian roślin uprawnych o podwyższonej tolerancji na stres niedoboru wody.
WPROWADZENIE
Regulacja ekspresji większości genów eukariotycznych odbywa się z wy-
korzystaniem czynników transkrypcyjnych. TF są to białka zdolne do specy-
ficznego wiązania się do krótkich sekwencji DNA (elementy cis) w obrębie
promotora regulowanego genu oraz do oddziaływania z kompleksem pre-
inicjacyjnym transkrypcji, co prowadzi do aktywacji lub hamowania aktyw-
ności polimerazy RNA II. System regulacji, w którym jeden czynnik trans-
krypcyjny kontroluje ekspresję wielu genów docelowych, poprzez wiązanie
do elementów cis w ich promotorach, nazywany jest regulonem [1]. Jeden
czynnik transkrypcyjny może regulować ekspresję wielu genów funkcjonal-
nych, a także genów kodujących inne czynniki transkrypcyjne, prowadząc
do zmiany aktywności komórki i organizmu. Czynniki transkrypcyjne sta-
nowią kluczowy element w procesie adaptacji roślin do warunków środowi-
ska zewnętrznego, nawet drobne zmiany w kodujących je sekwencjach lub w
sekwencjach elementów cis regulatorowych, mogą w dużym stopniu zmie-
niać sieć regulacji genów, a co za tym idzie, fizjologię i morfologię rośliny.
Dlatego czynniki transkrypcyjne stanowią przedmiot zainteresowania wielu
badań mających na celu podniesienie tolerancji roślin na stres [2].
U roślin zidentyfikowano ponad 50 różnych rodzin czynników transkryp-
cyjnych, na podstawie analiz sekwencji genomów gatunków modelowych
takich jak Arabidopsis thaliana i Oryza sativa [3]. Główne regulony zaangażo-
wane w odpowiedź na stres abiotyczny to DREB/CBF, AREB/ABF, MYB/
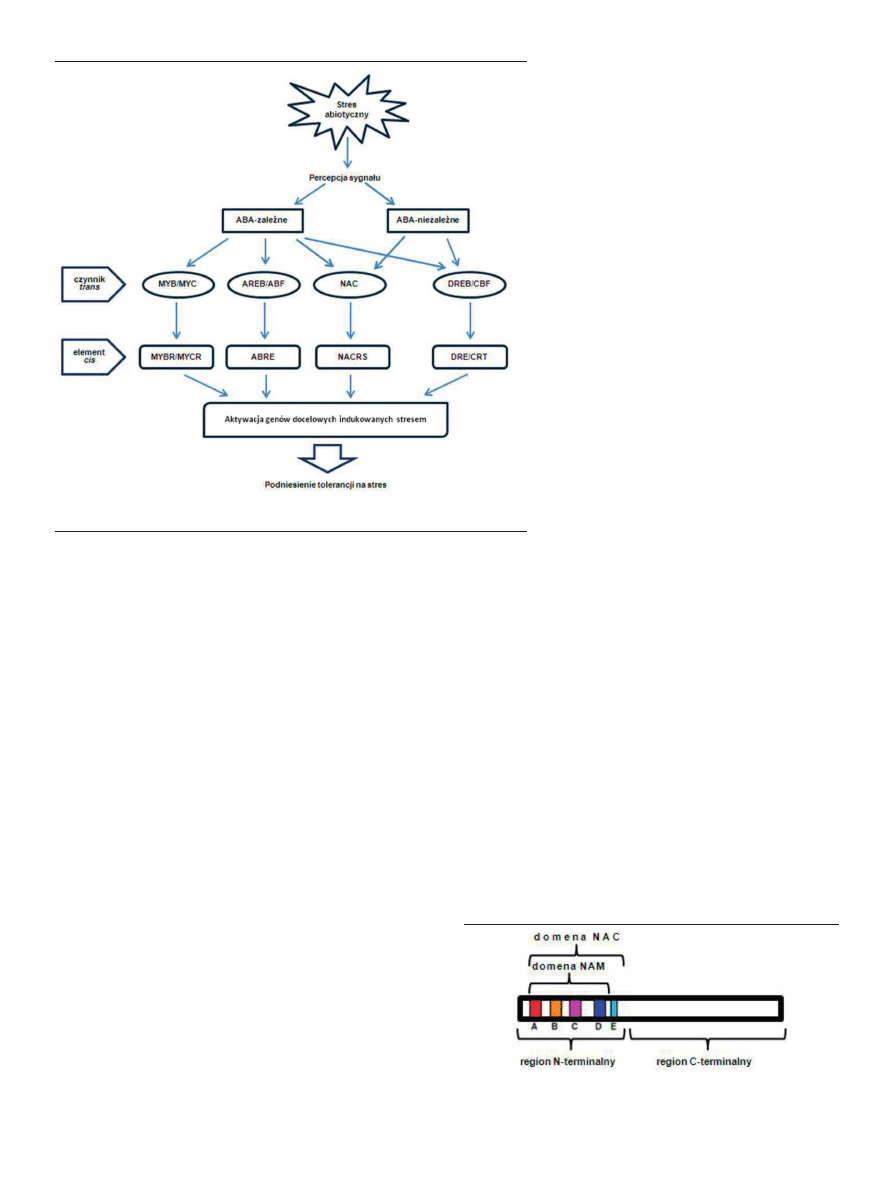
MYC i NAC (Ryc. 1) [4]. Aktywacja białek należących do rodzin AREB/ABF
i MYB/MYC związana jest z obecnością kwasu abscysynowego. Czynniki
transkrypcyjne rodzin DREB/CBF i NAC mogą wykazywać aktywność za-
leżnie lub niezależnie od ABA [4,5].
Białka DREB/CBF należą do rodziny czynników transkrypcyjnych ERF i są
specyficzne dla roślin. W tej rodzinie białek wyróżnić można dwie podklasy,
DREB1/CBF i DREB2. Białka te zawierają motywy AP2/ERF, pełniące funk-
cję domeny wiążącej DNA, która rozpoznaje sekwencję DRE/CRT (A/GCC-
GAC) w promotorach regulowanych genów. Synteza czynników DREB1/
CBF aktywowana jest przede wszystkim przez obniżoną temperaturę. U
A. thaliana zidentyfikowano sześć genów należących do tej podklasy, trzy
z nich: DREB1A/CBF3, DREB1B/CBF1 i DREB1C/CBF2, uważane są za głów-
ne czynniki, regulujące ekspresję genów odpowiedzi na niską temperaturę.
Czynniki transkrypcyjne DREB/CBF zidentyfikowano u wielu gatunków
roślin uprawnych, m.in. O. sativa, Zea mays, Hordeum vulgare, Triticum aesti-
vum, Triticum monococcum, Sorghum bicolor, Secale cereale, Avena sativa, Brassica
napus i Pennisetum glaucum. Natomiast synteza czynników DREB2 zachodzi
296
www.postepybiochemii.pl
głównie w odpowiedzi na dehydratację i wysokie zasole-
nie. Genom A. thaliana zawiera osiem genów należących
do tej podklasy, dwa z nich: DREB2A i DREB2B to głów-
ne czynniki regulujące ekspresję genów indukowanych w
tych warunkach stresowych [4,6].
Czynniki transkrypcyjne AREB/ABF należą do ro-
dziny białek o strukturze zamka leucynowego (bZIP),
ekspresja ich genów zachodzi głównie w odpowiedzi na
stres suszy, wysokie zasolenie i podczas dojrzewania na-
sion. Białka te wiążą się do elementów cis regulatorowych
ABRE (PyACGTGG/TC) w regionach promotorowych
regulowanych genów. Do transkrypcji zależnej od ABA
konieczne jest występowanie, oprócz elementu ABRE,
dodatkowych elementów CE. Elementy te są zazwyczaj
podobne do ABRE, ale ich funkcje mogą pełnić także ele-
menty DRE/CRT, co wskazuje na możliwość występowa-
nia oddziaływania pomiędzy regulonami ABRE i DREB
[1,6].
Do kolejnej rodziny czynników transkrypcyjnych nale-
żą białka MYB/MYC, zidentyfikowane zarówno u roślin
jak i u zwierząt. Domena wiążąca DNA, białek MYB ro-
ślin i zwierząt, składa się odpowiednio z dwóch (R2 i R3)
lub trzech (R1, R2, i R3) nieidealnych powtórzeń długości
około 50 aminokwasów. Białka MYB/MYC rozpoznają
elementy cis regulatorowe MYBR/MYCR (odpowiednio
sekwencje C/TAACNA/G oraz CANNTG). Czynniki
MYB/MYC pełnią zróżnicowane funkcje. Przykładem
jest gen OsMYB4, którego ekspresja aktywuje odpowiedź
na różne stresy, zależnie od gatunku rośliny, do której
był transformowany. U A. thaliana i H. vulgare nadekspre-
sja genu OsMYB4 wywołuje podwyższoną tolerancję na
mróz, rośliny rzodkiewnika wykazują wtedy fenotyp
karłowaty, podczas gdy rośliny jęczmienia
charakteryzują się niezmienioną wysoko-
ścią. Natomiast transformanty Lycopersicon
esculentum i Malus pumila charakteryzują się
podwyższoną tolerancją na suszę, a także
odpowiednio, odpornością na choroby wi-
rusowe i tolerancją na niską temperaturę
[4,6,7].
CHARAKTERYSTYKA RODZINY
CZYNNIKÓW TRANSKRYPCYJNYCH NAC
Specyficzną dla roślin rodziną czynni-
ków transkrypcyjnych jest rodzina NAC.
Nazwa NAC pochodzi od nazw pierwszych
zidentyfikowanych członków tej rodziny:
NAM u
Petunia hybrida, ATAF1-2 i CUC2
u A. thaliana [8].
Rodzina NAC jest jedną z
największych rodzin czynników transkryp-
cyjnych, jej członkowie zostali zidentyfiko-
wani nie tylko u roślin jedno- i dwuliścien-
nych, ale także u nagonasiennych i mchu
Physcomitrella patens (Tab. 1) [9].
Białka tej rodziny charakteryzują się
występowaniem domeny NAC o sekwen-
cji zachowanej w ewolucji
po stronie N-
-terminalnej, pełniącej funkcję domeny wią-
żącej DNA. Domena może formować struk-
turę helisa-skręt-helisa, a białko może wiązać się z DNA
w postaci multimerów. Elementem cis regulatorowym,
rozpoznawanym przez białka NAC w promotorach regu-
lowanych genów, jest NACR (CATGTG). W obrębie do-
meny NAC wyróżnić można pięć poddomen (A-E) oraz
domenę NAM z czterema poddomenami (A-D), będące
podstawą klasyfikacji białek NAC [6,10]. Z kolei C-koń-
cowa część u tych białek jest regionem regulującym trans-
krypcję (TRR) i ma zróżnicowaną budowę. Domena ta jest
odpowiedzialna za aktywowanie lub represję transkryp-
cji genów regulowanych przez białka NAC. Ponadto w
tej części białek NAC mogą się znajdować motywy trans-
-błonowe oraz sekwencje umożliwiające oddziaływania
białko-białko (Ryc. 2) [10,11].
PODZIAł CZYNNIKóW
TRANSKRYPCYJNYCh RODZINY NAC
Pierwszy podział czynników transkrypcyjnych ro-
dziny NAC powstał w oparciu o podobieństwo struktu-
ry domeny NAC. Wyodrębniono w nim 3 podrodziny:
NAM, ATAF i OsNAC3 [12]. Wraz z identyfikacją dużej
Rycina 1. Kontrola transkrypcyjna szlaków odpowiedzi na stres abiotyczny [4; zmienione].
Rycina 2. Schemat lokalizujący domeny i poddomeny białek NAC [11; zmienio-
ne].

Postępy Biochemii 59 (3) 2013
297
liczby genów NAC lub wykazujących podobieństwo do
genów NAC (ang. NAC-like), powstały inne podziały kla-
syfikujące czynniki transkrypcyjne należące do tej rodzi-
ny. Bazując na zależnościach filogenetycznych rodzinę
NAC podzielono na 5 podrodzin (I-V). Do podrodziny
I należą 54 geny, podzielone dodatkowo na 5 podgrup:
I-1 OsNAC7, I-2 NAC1, I-3 NAM/CUC, I-4 GRAB2 i I-5
NAC2. Wszystkie scharakteryzowane geny, związane z
rozwojem rośliny należą do podgrup I-2, I-3 i I-4. Do pod-
rodziny II zaklasyfikowano 54 geny NAC. Podrodzina
III (14 genów ONAC) została nazwana SNAC ponieważ
należą do niej wszystkie scharakteryzowane geny NAC
związane z odpowiedzią na stres, są to m.in. gen SNAC1
i OsNAC6 ryżu, ANAC019, ANAC055 i ANAC072 rzod-
kiewnika, StNAC i TERN zidentyfikowane odpowiednio
u ziemniaka i tytoniu. Do podrodziny IV należy 14 ge-
nów NAC ryżu, do podrodziny V oprócz
genów ryżowych należy m.in. gen SENU5
pomidora [13].
Inny podział zaproponowali Nuruzza-
man i współpracownicy [14]. Podzielili
oni białka NAC na dwie grupy: A i B, a
te z kolei na odpowiednio 7 i 9 podgrup.
Nazwa każdej podgrupy pochodzi od
znanego białka NAC do niej zaklasyfi-
kowanego. W grupie A wyróżniono na-
stępujące podgrupy: ONAC4, ONAC5,
ONAC2, ONAC3, ONAC7, ONAC1 i
ONAC6. Z kolei do grupy B zaklasyfi-
kowano następujące podgrupy: SNAC,
ANAC34, NEO, SND, NAC22, NAC1,
NAM/CUC3, OMNAC i TIP.
Z kolei najnowszy podział białek
NAC zaproponowany przez Nakashi-
mę i współpracowników [15] wydziela
6 grup: NAM/CUC3, SND, TIP, SNAC,
ANAC034 i ONAC4. Dodatkowo grupa
SNAC została podzielona na 3 podgru-
py: SNAC-A, SNAC-B i SNAC-C. Analiza
filogenetyczna została przeprowadzona
z wykorzystaniem sekwencji genów ko-
dujących białka NAC zidentyfikowanych
u A. thaliana, O. sativa, Selaginella moellen-
dorffii i Physcomitrella patens.
ROLA CZYNNIKóW
TRANSKRYPCYJNYCh NALEżąCYCh
DO RODZINY NAC
Duża liczba zidentyfikowanych czyn-
ników transkrypcyjnych rodziny NAC i
fakt, iż występują w różnych tkankach i
na różnych etapach rozwoju, przekłada
się na różnorodność i mnogość funkcji
pełnionych przez te białka. Pomimo tego,
że scharakteryzowano tylko małą część
genów należących do rodziny NAC, to
wiadomo że mogą one pełnić różne funk-
cje w czasie wzrostu i rozwoju roślin oraz
w ich odpowiedzi na stres biotyczny i
abiotyczny (Tab. 2) [16-32].
ROLA CZYNNIKóW NAC
W ODPOWIEDZI NA STRES SUSZY
Wzrost i produktywność roślin zaburzane są przez
różne stresy abiotyczne, takie jak niedobór wody, wy-
sokie zasolenie i ekstremalne temperatury, wśród nich
susza jest największym zagrożeniem [33,34]. Wiele czyn-
ników transkrypcyjnych należących do rodziny NAC bie-
rze udział w reakcji roślin na stres niedoboru wody. U
ryżu ponad 40 genów należących do rodziny NAC bierze
udział w odpowiedzi rośliny na stres suszy i/lub zasole-
nia [13]. Geny należące do rodziny NAC, zaangażowane
w reakcję roślin na stres niedoboru wody zidentyfikowa-
no także u A. thaliana, T. aestivum, Gossypium hirsutum, Se-
taria italica, Cicer arietinum i Saccharum officinarum (Tab. 3)
[10,30,35-50].
Tabela 1. Liczba zidentyfikowanych genów rodziny NAC u różnych gatunków [9].
Gromada/Klasa
Gatunek
Liczba zidentyfikowanych
genów NAC
Jednoliścienne
Brachypodium distachyon
100
Hordeum vulgare
54
Oryza sativa subsp. indica
163
Oryza sativa subsp. japonica
186
Sorghum bicolor
125
Triticum aestivum
42
Zea mays
190
Dwuliścienne
Arabidopsis thaliana
135
Arabidopsis lyrata
121
Arachis hypogaea
8
Brassica napus
65
Brassica rapa
44
Glycine max
183
Gossypium hirsutum
50
Medicago truncatula
73
Nicotiana tabacum
42
Populus trichocarpa
182
Solanum lycopersicum
41
Solanum tuberosum
40
Vitis vinifera
142
Nagonasienne
Picea glauca
26
Pinus taeda
30
Mszaki
Physcomitrella patens
42

298
www.postepybiochemii.pl
SNAC1 (ANG. STRESS-RESPONSIVE NAC1) U RYżU
Gen SNAC1 jest członkiem rodziny czynników trans-
krypcyjnych NAC i należy do podrodziny III (SNAC), do
której należą wszystkie scharakteryzowane geny NAC
związane z odpowiedzią na stres [13]. Gen ten został zi-
dentyfikowany i scharakteryzowany u O. sativa [42]; do-
tychczas zidentyfikowano jego homologi m.in. u H. vul-
gare [51] oraz u Z. mays [52]. Gen OsSNAC1 (Acc. num.:
DQ394702.1) jest genem nie zawierającym intronów, o
długości 945 bp. Produktem genu jest białko długości 314
aa, w jego obrębie zidentyfikowano domenę NAC o se-
kwencji zachowanej w ewolucji po stronie N-końcowej,
z dwoma przewidywanymi sekwencjami NLS oraz rejon
C-końcowy [42]. Domena NAC (Met1-Lys174) ma struk-
turę β-beczułki złożonej z siedmiu antyrównoległych
β-harmonijek oraz trzech α-helis. Budowa domeny wska-
zuje, że białko SNAC1 występuje w postaci dimeru, co
jest nabytą w trakcie ewolucji cechą rodziny NAC. Rejon
pętli pomiędzy strukturą β1 i β2 jest prawdopodobnie
odpowiedzialny za wiązanie białka do DNA [3].
Ekspresja genu SNAC1 może być indukowana przez
suszę, zasolenie, obniżoną temperaturę i ABA. Gen ten
ulega ekspresji w kalusie, a w normalnych warunkach
wzrostu w korzeniu, języczku liścia, pręcikach i słupku.
Znacznie podwyższoną ekspresję genu SNAC1 zaobser-
Tabela 2. Przykłady genów NAC, pełniących różne funkcje w czasie wzrostu i rozwoju rośliny oraz w reakcji obronnej na stres biotyczny i abiotyczny.
Gen (Gatunek)
Rola genów NAC
Piśmiennictwo
AtNAC1 (Arabidopsis thaliana)
rozwój roślin
formowanie korzeni bocznych i udział w przekazy-
waniu sygnałów (auksyny)
[16]
AtNAC2 (Arabidopsis thaliana)
formowanie korzeni bocznych, signaling auksyny i
etylenu
[17]
NAM (Petunia hybrida)
formowanie organów i SAM
[18]
CUC1,2,3 (Arabidopsis thaliana)
[19]
CUP (Antirrhinum majus)
ustalanie zasięgu organów naziemnych
[20]
NAP (Arabidopsis thaliana)
ustalanie tożsamości organów kwiatowych
[21]
SND1 (Arabidopsis thaliana)
formowanie ściany wtórnej
[22]
NST1,3 (Arabidopsis thaliana)
[23]
VND6, 7 (Arabidopsis thaliana)
formowanie ksylemu
[24]
NAM-B1 (Triticum sp.)
przyspieszenie dojrzewania, wzmożony transport
składników odżywczych z liści do ziarniaków
[25]
StNAC (Solanum tuberosum)
odpowiedź na
stres biotyczny
Phytophthora infestans (grzyb), wywołującego zarazę
ziemniaczaną
[26]
BnNACs (Brassica napus)
Sclerotinia sclerotiorum (grzyb)
[27]
GRAB1, 2 (Triticum sp.)
wirusa karłowatości pszenicy (WDV)
[28]
ATAF1 (Arabidopsis thaliana)
Botrytis cinerea (grzyb)
[29]
GhNACs (Gossypium hirsutum)
odpowiedź na
stres abiotyczny
zasolenie, suszę, ABA, obniżoną temperaturę
[30]
TaNAC4 (Triricum aestivum)
obniżoną temperaturę, zasolenie, zranienie, etylen,
MeJA
[31]
BnNACs (Brassica napus)
zranienie, suszę, obniżoną temperaturę
[27]
ATAF1,2 (Arabidopsis thaliana)
zranienie, suszę,
zasolenie, ABA, JA
[32]
StNAC (Solanum tuberosum)
zranienie
[26]
NAM — ang. no apical meristem; CUC — ang. cup-shaped cotyledon; CUP — CUPULIFORMIS; NAP — ang. NAC-like, activated
by APETALA3/PISTILLAT; SND1 — ang. secondary wall–associated NAC domain; NST — ang. NAC secondary wall thickening
promoting factor; VND — ang. vascular-related NAC-domain; GRAB — ang. geminivirus RepA binding protein; ATAF — ang.
Arabidopsis thaliana transcription factor; SAM — ang. shoot apical meristem; WDV — ang. wheat dwarf virus.

Postępy Biochemii 59 (3) 2013
299
wowano w liściach, szczególnie w komórkach szparko-
wych, w warunkach niedoboru wody.
Nadekspresja genu SNAC1 powoduje podwyższenie
tolerancji roślin ryżu na stres niedoboru wody i zasolenia.
W stadium kwitnienia, które jest najbardziej wrażliwe na
niedobór wody, w warunkach dotkliwej suszy, trans-
formowane rośliny charakteryzują się znacznie wyższą
płodnością kłosa, dającą do 34% wyższy plon w stosunku
do formy wyjściowej (WT). W normalnych warunkach
wzrostu, nadekspresja genu SNAC1 nie wpływa na cechy
agronomiczne rośliny takie jak, wysokość rośliny, liczba
wiech na roślinę, liczba kłosków na wiechę, plon ziarna z
jednej rośliny oraz długość i objętość korzeni. W porów-
naniu z formą wyjściową, transgeniczny ryż jest bardziej
wrażliwy na ABA i wolniej traci wodę w wyniku zwięk-
szonej częstotliwości zamykania aparatów szparkowych,
co nie wpływa jednak na wydajność fotosyntezy [42].
Czynnik transkrypcyjny SNAC1 reguluje komplekso-
wą sieć genów, prowadząc do zwiększonej tolerancji ryżu
na stres wywołany niedoborem wody i zasoleniem. Ana-
Tabela 3. Geny należące do rodziny NAC, biorące udział w zwiększaniu tolerancji na stres niedoboru wody u różnych roślin.
Gatunek
Gen
Czynnik indukujący ekspresję
Liczba regulow-
anych genów
Piśmiennictwo
Arabidopsis thaliana
ATAF1
susza (negatywny regulator), ABA
?
[35]
ANAC019
susza, zasolenie
8
[10]
AtNAC3
(ANAC055)
susza
9
RD26
(ANAC072)
susza, ABA
22
[10,36]
Arachis hypogaea
AhNAC2
susza, zasolenie
4
[37]
Arachis hypogaea
AhNAC3
susza, zasolenie, ABA
4
[38]
Cicer arietinum
CarNAC3
susza, ABA, IAA, etefon
?
[39]
CarNAC5
susza, podwyższona temperatura,
SA, IAA, zranienie
?
[40]
Glycine max
GmNAC20
susza, zasolenie, obniżona temperatura
?
[41]
Gossypium hirsutum
GhNAC2
susza, obniżona temperatura, ABA
?
[30]
GhNAC4
susza, zasolenie, ABA, obniżona temperatura
?
GhNAC5
susza, obniżona temperatura, ABA
?
GhNAC6
susza, zasolenie, ABA, obniżona temperatura
?
Oryza sativa
SNAC1
(ONAC033)
susza, zasolenie, obniżona temperatura, ABA
80
[42]
SNAC2 (OsNAC6)
susza, zasolenie, obniżona temperatura
36 (+), 9 (-)
[43]
OsNAC5
(ONAC009/ONAC071)
susza, zasolenie, niska temperatura, ABA, MeJA
18
[44]
OsNAC10
susza, zasolenie, ABA
34 (korzeń),
4 (liść)
[45]
OsNAC45
susza, zasolenie
OsLEA3-1, OsPM1 [46]
OsNAC52
susza, ABA
?
[47]
Setaria italica
SiNAC
susza, zasolenie, MeJA, etefon
?
[48]
Saccharum officinarum
SsNAC23
susza, obniżona temperatura
?
[49]
Triticum aestivum
TaNAC2
susza, zasolenie, niska temperatura, ABA
?
[50]
ATAF1 — ang. Arabidopsis thaliana transcription factor 1; ABA — kwas abscysynowy; IAA — ang. indole-
3-acetic acid; SA — kwas salicylowy; (Me)JA — (metylowany) kwas jasmonowy.

300
www.postepybiochemii.pl
Tabela 4. Przykłady genów kodujących czynniki transkrypcyjne z rodziny NAC, których nadekspresja powoduje zwiększenie tolerancji na stres niedoboru wody.
Gen/ gatunek
Roślina
transgeniczna Promotor
Efekt
transformacji
Charakterystyka transformanta
Literatura
AhNAC2
Arachis hypogaea
Arabidopsis
thaliana
konstytutywny
— CaMV35S
nadekspresja
podwyższona tolerancja na dehydratację i zasolenie,
nadwrażliwość na ABA podczas wzrostu korzeni,
kiełkowania nasion i zamykania aparatów
szparkowych, podwyższona ekspresja 12 badanych
genów: RD29A, RD29B, RAB18, AtMYB2, AtMYC2,
ERD1, COR47, COR15a, KIN1, AREB1, CBF1 i AMY1
[37]
AhNAC3
Arachis hypogaea
Nicotiana
tabacum
konstytutywny
— CaMV35S
nadekspresja
podwyższona tolerancja na dehydratację, suszę,
większa akumulacja proliny, mniejsza akumulacja
anionorodników ponadtlenkowych (O
2
–
) — większe
zdolności antyoksydacyjne, podwyższona ekspresja
genów: NtSOD, NtLEAs, NtERD10C i NtP5CS
[38]
ANACO19
Arabidopsis thaliana
Arabidopsis
thaliana
konstytutywny
— CaMV35S
nadekspresja
podwyższona tolerancja na suszę, nadwrażliwość
na egzogenne ABA (tylko RD26), podwyższona
ekspresja wielu genów tzw. „odpowiedzi
na stres” m.in. RAFL06-15-P15
[10]
AtNAC3 (ANAC055)
Arabidopsis thaliana
RD26 (ANAC072)
Arabidopsis thaliana
ONAC045
Oryza sativa
Oryza sativa
konstytutywny
— CaMV35S
nadekspresja
podwyższona tolerancja na suszę i zasolenie,
podwyższona ekspresja genów: OsLEA3-1 i OsPMI
[46]
ONAC052
Oryza sativa
Arabidopsis
thaliana
konstytutywny
— CaMV35S
nadekspresja
podwyższona tolerancja na suszę, nadwrażliwość
na egzogenne ABA, podwyższona regulacja tzw.
„genów odpowiedzi na stres” m.in. RD29B i KIN1
[47]
OsNAC5
(ONAC009/
ONAC071)
Oryza sativa
Oryza sativa
konstytutywny
— GOS2;
korzeniowo-
specyficzny RCc3
nadekspresja
podwyższona tolerancja na suszę i zasolenie;
podwyższona ekspresja wielu genów m.in. GLP, PDX,
MERI5; rośliny transgeniczne testowano także w
warunkach polowych i potwierdzono podwyższoną
tolerancje na suszę tych, u których wykorzystano
promotor RCc3; większy rozmiar sytemu korzeniowego
[56]
OsNAC5
(ONAC009/
ONAC071)
Oryza sativa
Arabidopsis
thaliana,
Oryza sativa
konstytutywny
— CaMV35S,
konstytutywny
— UBI
nadekspresja
podwyższona tolerancja na suszę, zasolenie i niską
temperaturę, podwyższona akumulacja proliny,
zmniejszona akumulacja h
2
O
2
, MDA oraz Na+
[57]
OsNAC5
(ONAC009/
ONAC071)
Oryza sativa
Oryza sativa
konstytutywny
— UBI
nadekspresja
podwyższona tolerancja na suszę i zasolenie,
podwyższona ekspresja wielu genów tzw.
„odpowiedzi na stres” np. OsLEA3
[44]
OsNAC9
Oryza sativa
Oryza sativa
konstytutywny
— GOS2;
korzeniowo-
specyficzny RCc3
nadekspresja
podwyższona tolerancja na suszę; podwyższona
ekspresja wielu genów; rośliny transgeniczne
testowano także w warunkach polowych i
potwierdzono podwyższoną tolerancje na suszę
tych, u których wykorzystano promotor RCc3;
większy rozmiar sytemu korzeniowego
[58]
OsNAC10
Oryza sativa
Oryza sativa
konstytutywny
— GOS2;
korzeniowo-
specyficzny RCc3
nadekspresja
podwyższona tolerancja na suszę, zasolenie i niską
temperaturę; rośliny transgeniczne testowano
także w warunkach polowych i potwierdzono
podwyższoną tolerancje na suszę tych, u których
wykorzystano promotor RCc3 — zmieniony system
korzeniowy; większy rozmiar komórek epidermy,
kory, walca osiowego; uzyskano większy plon
[45]
SNAC1 (ONAC033)
Oryza sativa
Oryza sativa
konstytutywny
— CaMV35S
nadekspresja
podwyższona tolerancja na suszę i zasolenie;
podwyższona ekspresja genów kodujących:
osmoprotektanty, białka pełniące funkcje w
detoksykacji i utrzymaniu potencjału redoks;
większa wrażliwość na ABA — zamykanie
większej liczby aparatów szparkowych; rośliny
transgeniczne testowano w warunkach polowych i
potwierdzono ich podwyższoną tolerancje na suszę
[42]
SNAC2 (OsNAC6)
Oryza sativa
Oryza sativa
konstytutywny
— UBI
nadekspresja
podwyższona tolerancja na suszę, zasolenie i choroby,
podwyższona ekspresja wielu genów tzw.
„odpowiedzi na stres”, niska produktywność
i spowolnienie wzrostu transformantów
[59]

Postępy Biochemii 59 (3) 2013
301
lizy transkryptomu roślin z nadekspresją genu SNAC1,
wykazały podwyższony poziom ekspresji 80 genów,
połowa z nich uczestniczy w mechanizmach obronnych
rośliny, wywołanych niedoborem wody. Regulowane
geny związane są m.in. ze szlakiem przekazywania sy-
gnału prowadzącym do zamknięcia aparatów szparko-
wych, produkcją osmolitów, detoksykacją i utrzymaniem
potencjału redoks oraz ochroną ważnych makromolekuł
przed degradacją [2,42].
MOŻLIWOŚCI UZYSKIWANIA ROŚLIN
O ZWIĘKSZONEJ TOLERANCJI NA
SUSZĘ Z WYKORZYSTANIEM NARZĘDZI
BIOLOGII MOLEKULARNEJ
Susza jest poważnym problemem, który będzie się
pogłębiał w wyniku zachodzących, globalnych zmian
klimatycznych. Rośliny wykształciły różne strategie
obronne przed stresem suszy, należą do nich ucieczka,
unikanie i tolerancja niedoboru wody. Ucieczka polega
na osiągnięciu sukcesu reprodukcyjnego przed wystą-
pieniem warunków dotkliwej suszy, poprzez skrócenie
cyklu życiowego, szybki wzrost i maksymalne wykorzy-
stanie dostępnej wody. Unikanie suszy to zdolność rośli-
ny do utrzymania dużego poziomu uwodnienia, nawet w
warunkach niedoboru wody, poprzez zamknięcie apara-
tów szparkowych i zwinięcie liści oraz zwiększenie po-
wierzchni korzeni. Aparaty szparkowe odgrywają głów-
ną rolę w adaptacji roślin do warunków suszy i znajdują
się one pod kontrolą fitohormonów takich jak kwas ab-
scysynowy, kwas jasmonowy, brasinosteroidy, cytokini-
ny i etylen [53]. Tolerancja suszy, w ekstremalnych przy-
padkach, przejawia się zdolnością rośliny do przetrwania
po utracie 90% wody i dalszego wzrostu i rozwoju po
przywróceniu normalnych warunków [34,54].
Niedobór wody i często towarzyszący mu wzrost zaso-
lenia, to główne przyczyny małej produktywności roślin.
Niedobór żywności w krajach rozwijających się jest nadal
dużym problemem ze względu na wzrost liczby ludności
i poziomu życia. Aby sprostać wzmożonej konsumpcji i
przeciwdziałać szkodliwym dla roślin zmianom klimatu,
konieczne jest uzyskanie nowych upraw, efektywniej wy-
korzystujących dostępną wodę i charakteryzujących się
podwyższoną tolerancją na stres suszy [54]. Zwiększenie
ilości i jakości plonów podczas suszy jest jednym z głów-
nych celów hodowli roślin [55].
Różne metody w biologii molekularnej pozwalają na
uzyskanie roślin o podwyższonej tolerancji na dehydrata-
cję, są to m.in. nadekspresja, czy wyciszanie genów kodu-
jących odpowiednio pozytywne i negatywne regulatory
odpowiedzi rośliny na stres niedoboru wody. Wyciszanie
genów nie było do tej pory często stosowane w badaniach
genów należących do rodziny NAC. Przykładem takiego
genu jest ATAF1 u A. thaliana. Uzyskane mutanty inser-
cyjne charakteryzowały się podwyższoną tolerancją na
suszę [35].
Przykłady roślin transgenicznych o zwiększonej tole-
rancji na suszę spowodowanej nadekspresją genów ko-
dujących czynniki transkrypcyjne należące do rodziny
NAC zostały przedstawione w tabeli 4. Badano geny
NAC pochodzące z Arachis hypogaea, A. thaliana, O. sativa,
T. aestivum i Z. mays. Natomiast transformowano rośliny:
A. thaliana, Nicotiana tabacum i O. sativa. Dodatkowo ba-
dania mające na celu określenie lokalizacji białek NAC
w komórce dowiodły, że występują one w jądrze [38,42-
44,46,50,56,59-62]. Białka NAC regulują ekspresję wielu
genów. Z kolei białka przez nie kodowane uczestniczą
w bardzo różnych szlakach sygnałowych stresu. Dużo
informacji na ten temat dostarczyły badania transfor-
mantów z wykorzystaniem globalnej analizy ekspresji
genów — mikromacierzy, czy też analiza ekspresji ge-
nów w czasie rzeczywistym — qPCR (ang. quantitative
real-time PCR). Wśród genów, których ekspresja została
podwyższona u transformantów z nadekspresją genów
NAC, co miało istotne znaczenie w uzyskaniu przez te
rośliny zwiększonej odporności na suszę były te kodujące
osmoprotektanty, między innymi białka LEA [38,44,46],
malondialdehyd [57], prolinę [57]. Są to cząsteczki stabi-
lizujące składniki błony komórkowej oraz chroniące ko-
mórkę przed utratą turgoru. Białka LEA pełnią funkcję
białek opiekuńczych, pozwalają zachować odpowiednią
SNAC2 (OsNAC6)
Oryza sativa
Oryza sativa
konstytutywny
— UBI
nadekspresja
podwyższona tolerancja na zimno, suszę i
zasolenie, podniesiona wrażliwość na ABA,
podwyższona ekspresja genów tzw. „odpowiedzi
na stres” związanych z detoksykacją, utrzymaniem
potencjału redoks, proteolityczną degradacją
[43]
TaNAC2a
Triticum aestivum
Nicotiana
tabacum
konstytutywny
— CaMV35S
nadekspresja
podwyższona tolerancja na suszę
[60]
TaNAC2
Triticum aestivum
Arabidopsis
thaliana
konstytutywny
— CaMV35S
nadekspresja
podwyższona tolerancja na suszę, zasolenie
i niska temperaturę, podwyższona ekspresja
wielu genów tzw. „odpowiedzi na stres”
[50]
ZmSNAC1
Zea mays
Arabidopsis
thaliana
konstytutywny
— CaMV35S
nadekspresja
podwyższona tolerancja na suszę w stadium
siewek, podwyższona wrażliwość na
ABA podczas kiełkowania nasion
[61]
ABA — ang. abscisic acid; AMY1 — ang. alpha-amylase-like 1; CaMV35S — promotor wirusa mozaiki kalafiora (ang. Cauliflower mosaic virus); CBF
— ang. C-repeat-binding factor 1; COR47 — ang. cold regulated 47; ERD10 — ang. early-responsive to dehydration stress 10; GLP — ang. germin-like
protein; LEA — ang. late embrogenic abundant proteins; MERI5 — ang. meristem protein; MDA — ang. malondialdehyde; NtSOD — ang. superoxidase
dismutase; OsPM1 — homolog genu pszenicy WPM1; PDX — ang. pyridoxine biosynthesis protein; P5SC — ang. pyrroline-5-carboxylate synthetase;
RAB18 — ang. responsive to ABA 18; RAFL06-15-P15 — ang. glyoxalase I family protein; RD22 — ang. responsive to desiccation 22; UBI — ang. ubiquitin.

302
www.postepybiochemii.pl
Postępy Biochemii 59 (3) 2013
302
strukturę białek błonowych podczas stresu suszy. Białka
te są silnie hydrofilowe, wykazują tolerancję na wysokie
temperatury, dzięki czemu mogą chronić komórkę przed
uszkodzeniem [63] (Tab. 4).
Podczas stresu niedoboru wody zachodzi akumula-
cja reaktywnych form tlenu (ROS), takich jak nadtlenek
wodoru (h
2
O
2
) czy aniorodniki ponadtlenkowe (O
2
-
),
w komórce. ROS mogą prowadzić do uszkodzeń wielu
struktur komórkowych w tym do uszkodzenia błon. En-
zymy detoksykacyjne, będące antyoksydantami, służą do
redukcji ROS [64,65]. U transformantów z nadekspresją
genów należących do rodziny NAC zidentyfikowano
wyższy poziom dysmutazy ponadtlenkowej (SOD, ang.
superoxide dismutase) [38], czy też zmniejszoną akumula-
cje h
2
O
2
[57].
Inna drogą mogącą prowadzić do uzyskania przez ro-
śliny podwyższonej tolerancji na suszę jest zwiększenie
rozmiaru komórek budujących korzeń — epidermy, kory
i walca osiowego. Taką modyfikację uzyskano u tranfor-
mantów z nadekspresją następujących genów z rodziny
NAC: OsNAC5 [56], OsNAC9 [58], OsNAC10 [45]. Ziden-
tyfikowano u nich podwyższoną ekspresję genów zaan-
gażowanych w wzrost i rozwój komórek [56].
W określeniu reakcji transformantów na stres niedo-
boru wody szczególnie istotna wydaje się ich charakte-
rystyka w testach polowych, prowadzonych na większą
skalę niż eksperymenty w szklarniach [66]. Pozwalają
one na określenie plonu roślin, bardzo ważnej cechy w
hodowli roślin. Rośliny transgeniczne O. sativa z nade-
kspresją genów: OsNAC5 [56], OsNAC9 [58], OsNAC10
[45] oraz SNAC1 [42] były testowane w warunkach polo-
wych. Potwierdzono ich podwyższoną tolerancję na su-
szę i uzyskanie przez nie wyższego plonu w porównaniu
z kontrolą. Nie wszystkie badania zakończyły się jednak
sukcesem. Niektóre transformanty mimo podwyższonej
tolerancji na suszę, wykazywały jednocześnie wiele cech
negatywnych, jak niska produktywność i spowolnienie
wzrostu [59].
PIŚMIENNICTWO
1. Nakashima K, Ito Y, Yamaguchi-Shinozaki K (2009) Transcriptional
regulatory networks in response to abiotic stresses in Arabidopsis and
grasses. Plant Physiol 149: 88-95
2. Khong GN, Richaud F, Coudert Y, Pati P, Santi C, Périn C, Breitler JC,
Meynard D, Vinh DN, Guiderdoni E, Gantet P (2008) Modulating rice
stress tolerance by transcription factors. Biotechnol Genet Eng Rev 25:
381-404
3. Chen Q, Wang Q, Xiong L, Lou Z (2011) A structural view of the conse-
rved domain of rice stress-responsive NAC1. Plant Cell 2: 55-63
4. Lata C, Yadav A, Prasad M (2011) Role of plant transcription factors in
abiotic stress tolerance. W: Shanker A, Venkateswarlu B (red) Abio-
tic stress response in plants — physiological, biochemical and genetic
perspectives. InTech, Rijeka, str. 269-296
5. Nakashima K, Yamaguchi-Shinozaki K (2010) Promoters and transcrip-
tion factors in abiotic stress-responsive gene expression. W: Pareek A,
Sopory SK, Bohnert hJ (red) Abiotic stress adaptation in plants. Sprin-
ger, Dordrecht, str. 199-216
6. Agarwal PK, Jha B (2010) Transcription factors in plants and ABA de-
pendent and independent abiotic stress signalling. Biol Plantarum 54:
201-212
7. Soltesz A, Vagujfalyi A, Rizza F, Kerepesi I, Galiba G, Cattivelli L, Co-
raggio I, Crosatti C (2012) The rice Osmyb4 gene enhances tolerance
to frost and improves germination under unfavourable conditions in
transgenic barley plants. J Appl Genet 53: 133-143
8. Tang Y, Liu M, Gao S, Zhang Z, Zhao X, Zhao C, Zhang F, Chen X (2012)
Molecular characterization of novel TaNAC genes in wheat and over-
expression of TaNAC2a confers drought tolerance in tobacco. Physiol
Plant 144: 210-24
9. Zhang h, Jin JP, Tang L, Zhao Y, Gu XC, Gao G, Luo JC (2011)
PlantTFDB 2.0: update and improvement of the comprehensive plant
transcription factor database. Nucleic Acids Res 39: D1114-D1117
10. Tran LSP, Nakashima K, Sakuma Y, Simpson SD, Fujita Y, Maruy-
ama K, Fujita M, Seki M, Shinozaki K, Yamaguchi-Shinozakia K (2004)
Isolation and functional analysis of Arabidopsis stress-inducible NAC
transcription factors that bind to a drought-responsive cis-element in
the early responsive to dehydration stress 1 promoter. Plant Cell 16: 2481-
2498
11. Shen h, Yin Y, Chen F, Xu Y, Dixon RA (2009) A bioinformatic analysis
of NAC genes for plant cell wall development in relation to lignocellu-
losic bioenergy production. Bioenerg Res 2: 217-232
12. Kikuchi K, Ueguchi-Tanaka M, Yoshida KT, Nagato Y, Matsusoka M,
hirano hY (2000) Molecular analysis of the NAC gene family in rice.
MGG 262: 1047-1051
13. Fang Y, You J, Xie K, Xie W, Xiong L (2008) Systematic sequence ana-
lysis and identification of tissue-specific or stress-responsive genes of
NAC transcription factor family in rice. Mol Genet Genomics 280: 547-
563
14. Nuruzzaman M, Manimekalai R, Sharoni AM, Satoh K, Kondoh h,
Ooka h, Kikuchi S (2010) Genome-wide analysis of NAC transcription
factor family in rice. Gene 465: 30-44
15. Nakashima K, Takasaki h, Mizoi J, Shinozaki K, Yamaguchi-Shinoza-
ki K (2012) NAC transcription factors in plant abiotic stress responses.
Biochim Biophys Acta 1819: 97-103
16. Xie Q, Frugis G, Colgan D, Nam-hai C (2000) Arabidopsis NAC1 trans-
duces auxin signal downstream of TIR1 to promote lateral root devel-
opment. Genes Dev 14: 3024-3036
17. he XJ, Mu RL, Cao Wh, Zhang ZG, Zhang JS, Chen SY (2005) At-
NAC2, a transcription factor downstream of ethylene and auxin sig-
naling pathways, is involved in salt stress response and lateral root
development. Plant J 44: 903-916
18. Souer E, van houwelingen A, Kloos D, Mol J, Koes R (1996) The no
apical meristem gene of petunia is required for pattern formation in
embryos and flowers and is expressed at meristem and primordia
boundaries. Cell 85: 159-170
19. Aida M, Ishida T, Fukaki h, Fujisawa h, Tasaka M (1997) Genes
involved in organ separation in Arabidopsis: an analysis of the cup-
shaped cotyledon mutant. Plant Cell 9: 841-857
20. Weir I, Lu J, Cook h, Causier B, Schwarz-Sommer B, Davies B (2004)
CUPULIFORMIS establishes lateral organ boundaries in Antirrhinum.
Development 131: 915-922
21. Sablowski RWM, Meyerowitz EM (1998) A homolog of NO API-
CAL MERISTEM is an immediate target of the floral homeotic genes
APETALA3/PISTILLATA. Cell 92: 93-103
22. Zhong R, Demura T, Ye. Zh (2006) SND1, a NAC domain transcrip-
tion factor, is a key regulator of secondary wall synthesis in fibers of
Arabidopsis. Plant Cell 18: 3158-3170
23. Mitsuda N, Iwase A, Yamamoto h, Yoshida M, Seki M, Shinozaki K,
Ohme-Takagi M (2007) NAC transcription factors, NST1 and NST3,
are key regulators of the formation of secondary walls in woody tis-
sues of Arabidopsis. Plant Cell 19: 270-280
24. Kubo M, Udagawa M, Nishikubo N, horiguchi G, Yamaguchi M, Ito
J, Mimura M, Fukuda h, Demura T (2005) Transcription switches for
protoxylem and metaxylem vessel formation. Genes Dev 19: 1855-1860
25. Uauy C, Distelfeld A, Fahima T, Blechl A, Dubcovsky J (2006) A NAC
gene regulating senescence improves grain protein, zinc, and iron con-
tent in wheat. Science 314: 1298-1301

Postępy Biochemii 59 (3) 2013
303
Postępy Biochemii 59 (3) 2013
302
26. Collinge M, Boller T (2001) Differential induction of two potato genes,
Stprx2 and StNAC, in response to infection by Phytophthora infestans
and to wounding. Plant Mol Biol 5: 521-529
27. hegedus D, Yu M, Baldwin D, Gruber M, Sharpe A, Parkin I, Whitwill
S, Lydiate D (2003) Molecular characterization of Brassica napus NAC
domain transcriptional activators induced in response to biotic and
abiotic stress. Plant Mol Biol 53: 383-397
28. Xie O, Sanz-Burgos AP, Guo h, García JA, Gutiérrez C (1999) GRAB
proteins, novel members of the NAC domain family, isolated by their
interaction with a geminivirus protein. Plant Mol Biol 39: 647-656
29. Wu Y, Deng Z, Lai J, Zhang Y, Yang C, Yin B, Zhao Q, Zhang L, Li Y,
Yang C, Xie Q (2009) Dual function of Arabidopsis ATAF1 in abiotic
and biotic stress responses. Cell Res 19: 1279-1290
30. Meng C, Cai C, Zhang T, Guo W (2009) Characterization of six novel
NAC genes and their responses to abiotic stresses in Gossypium hirsu-
tum L. Plant Sci 176: 352-359
31. Xia N, Zhang G, Liu XY, Deng L, Cai GL, Zhang Y, Wang XJ, Zhao J,
huang LL, Kang ZS (2010) Characterization of a novel wheat NAC
transcription factor gene involved in defense response against stripe
rust pathogen infection and abiotic stresses. Mol Biol Rep 8: 3703-3712
32. Olsen AN, Ernst hA, Leggio LL, Skriver K (2005) NAC transcription
factors: structurally distinct, functionally diverse. Trends Plant Sci 10:
79-87
33. Gao JP, Chao DY, Lin hX (2008) Toward understanding molecular
mechanisms of abiotic stress responses in rice. Rice 1: 36-51
34. Amudha J, Balasubramani G (2011) Recent molecular advances to
combat abiotic stress tolerance in crop plants. BMBR 6: 31-58
35. Lu PL, Chen NZ, An R, Su Z, Qi BS, Ren F, Chen J, Wang XC (2007) A
novel drought-inducible gene, ATAF1, encodes a NAC family protein
that negatively regulates the expression of stress-responsive genes in
Arabidopsis. Plant Mol Biol 63: 289-305
36. Fujita M, Fujita Y, Maruyama K, Seki M, hiratsu K, Ohme-Takagi M,
Tran LS, Yamaguchi-Shinozaki K, Shinozaki K (2004) A dehydration-
-induced NAC protein, RD26, is involved in a novel ABA-dependent
stress-signaling pathway. Plant J 39: 863-876
37. Liu X, hong L, Li XY, Yao Y, hu B, Li L (2011) Improved drought and
salt tolerance in transgenic Arabidopsis overexpressing a NAC tran-
scriptional factor from Arachis hypogaea. Biosci Biotechnol Biochem 75:
443-450
38. Liu X, Liu S, Wu J, Zhang B, Li X, Yan Y, Li L (2013) Overexpression of
Arachis hypogaea NAC3 in tobacco enhances dehydration and drought
tolerance by increasing superoxide scavenging. Plant Physiol Biochem
doi: 10.1016/j.plaphy.2013.05.018
39. Peng h, Cheng hY, Chen C, Yu XW, Yang JN, Gao WR, Shi Qh, Zhang
h, Li JG, Ma h (2009) A NAC transcription factor gene of Chickpea
(Cicer arietinum), CarNAC3, is involved in drought stress response and
various developmental processes. J Plant Physiol 166: 1934-1945
40. Peng h, Cheng hY, Yu XW, Shi Qh, Zhang h, Li JG, Ma h (2009)
Characterization of a chickpea (Cicer arietinum L.) NAC family gene,
CarNAC5, which is both developmentally- and stress-regulated. Plant
Physiol Biochem 47: 1037-1045
41. hao YJ, Wei W, Song QX, Chen hW, Zhang YQ, Wang F, Zou hF,
Lei G, Tian AG, Zhang WK, Ma B, Zhang JS, Chen SY (2011) Soybean
NAC transcription factors promote abiotic stress tolerance and lateral
root formation in transgenic plants. Plant J 68: 302-313
42. hu h, Dai M, Yao J, Xiao B, Li X, Zhang Q, Xiong L (2006) Overexpres-
sing a NAM, ATAF, and CUC (NAC) transcription factor enhances dro-
ught resistance and salt tolerance in rice. Proc Natl Acad Sci USA 103:
12987-12992
43. hu h, You J, Fang Y, Zhu X, Qi Z, Xiong L (2008) Characterization of
transcription factor gene SNAC2 conferring cold and salt tolerance in
rice. Plant Mol Biol 67: 169-181
44. Takasaki h, Maruyama K, Kidokoro S, Ito Y, Fujita Y, Shinozaki K,
Yamaguchi-Shinozaki K, Nakashima K (2010) The abiotic stress-re-
sponsive NAC-type transcription factor OsNAC5 regulates stress-in-
ducible genes and stress tolerance in rice. Mol Genet Genomics 284:
173-183
45. Jeong JS, Kim YS, Baek Kh, Jung h, ha Sh, Choi YD, Kim M, Reuzeau
C, Kim JK (2010) Root-specific expression of OsNAC10 improves dro-
ught tolerance and grain yield in rice under field drought conditions.
Plant Physiol 153: 185-197
46. Zheng X, Chen B, Lu G, han B (2009) Overexpression of a NAC trans-
cription factor enhances rice drought and salt tolerance. Biochem Bio-
phys Res Commun 379: 985-989
47. Gao F, Xiong A, Peng R, Jin X, Xu J, Zhu B, Chen J, Yao Q (2010)
OsNAC52, a rice NAC transcription factor, potentially responds to
ABA and confers drought tolerance in transgenic plants. Plant Cell
100: 255-262
48. Puranik S, Bahadur RP, Srivastava PS, Prasad M (2011) Molecular clo-
ning and characterization of a membrane associated NAC family gene,
SiNAC from foxtail millet [Setaria italica (L.) P. Beauv.]. Mol Biotechnol
49: 138-150
49. Ditt R F, Gentile A, Tavares RG, Camargo SR, Fernandez Jh, da Silva
MJ, Menossi M (2011) Analysis of the stress-inducible transcription
factor SsNAC23 in sugarcane plants. Sci Agric 68: 454-461
50. Mao X, Zhang h, Qian X, Li A, Zhao G, Jing R (2012) TaNAC2, a NAC-
-type wheat transcription factor conferring enhanced multiple abiotic
stress tolerances in Arabidopsis. J Exp Bot 63: 2933-2946
51. Kurowska M, Goraus S, Daszkowska-Golec A, Maluszynski M, Szarej-
ko I (2011) Hordeum vulgare subsp. vulgare cultivar Sebastian stress-in-
duced transcription factor SNAC1 gene. NCBI GeneBank. Acc.num.:
JF796130
52. Nuruzzaman M, Sharoni AM, Satoh K, Moumeni A, Venuprasad R,
Serraj R, Kumar A, Leung h, Attia K, Kikuchi S (2012) Comprehen-
sive gene expression analysis of the NAC gene family under normal
growth conditions, hormone treatment, and drought stress conditions
in rice using near-isogenic lines (NILs) generated from crossing Aday
Selection (drought tolerant) and IR64. Mol Genet Genomics 287: 389-
410
53. Daszkowska-Golec A, Szarejko I (2013) Open or close the gate — sto-
mata action under the control of phytohormones in drought stress
conditions. Front Plant Sci doi: 10.3389/fpls.2013.00138
54. Cominelli E, Tonelli C (2010) Transgenic crops coping with water scar-
city. N Biotechnol 27: 473-477
55. Cattivelli L, Rizza F, Badeck FW, Mazzucotelli E, Mastrangelo AM,
Francia E, Mare C, Tondelli A, Stanca AM (2008) Drought tolerance
improvement in crop plants: An integrated view from breeding to ge-
nomics. Field Crop Res 105: 1-14
56. Jeong JS, Kim YS, Redillas MC, Jang G, Jung h, Bang SW, Choi YD,
ha Sh, Reuzeau C, Kim JK (2013) OsNAC5 overexpression enlarges
root diameter in rice plants leading to enhanced drought tolerance and
increased grain yield in the field. Plant Biotechnol J 11: 101-111
57. Song SY, Chen Y, Chen J, Dai XY, Zhang Wh (2011) Physiological
mechanisms underlying OsNAC5-dependent tolerance of rice plants
to abiotic stress. Planta 234: 331-345
58. Redillas MC, Jeong JS, Kim YS, Jung h, Bang SW, Choi YD, ha Sh,
Reuzeau C, Kim JK (2012) The overexpression of OsNAC9 alters the
root architecture of rice plants enhancing drought resistance and grain
yield under field conditions. Plant Biotechnol J 10: 792-805
59. Jeong JS, Kim YS, Baek Kh, Jung h, ha Sh, Do Choi Y, Kim M, Re-
uzeau C, Kim JK (2010) Root-specific expression of OsNAC10 im-
proves drought tolerance and grain yield in rice under field drought
conditions. Plant Physiol 153: 185-197
60. Nakashima K, Tran LS, Van Nguyen D, Fujita M, Maruyama K, To-
daka D, Ito Y, hayashi N, Shinozaki K, Yamaguchi-Shinozaki K (2007)
Functional analysis of a NAC-type transcription factor OsNAC6 in-
volved in abiotic and biotic stress-responsive gene expression in rice.
Plant J 51: 617-630
61. Tang Y, Liu M, Gao S, Zhang Z, Zhao X, Zhao C, Zhang F, Chen X
(2012) Molecular characterization of novel TaNAC genes in wheat
and overexpression of TaNAC2a confers drought tolerance in tobacco.
Physiol Plant 144: 210-224
62. Lu M, Ying S, Zhang DF, Shi YS, Song YC, Wang TY, Li Y (2012) A
maize stress-responsive NAC transcription factor, ZmSNAC1, confers

304
www.postepybiochemii.pl
Postępy Biochemii 59 (3) 2013
304
NAC transcription factors family and increased
tolerance to water deficiency in plants
Sabina Lip, Marzena Kurowska
*
, Iwona Szarejko
Department of Genetics, University of Silesia, 28 Jagiellońska St., 40-032 Katowice, Poland
*
e-mail:mkurowsk@us.edu.pl
Key words: transcription factors, drought, SNAC1
ABSTRACT
Transcription factors are proteins that are able to regulate the expression of target genes by specifically binding with DNA sequences and
regulating the activity initiation complex of transcription. These proteins are key elements in the adaptation of plants to environmental condi-
tions. Families of transcription factors that are associated with a response to stress are DREB/CBF, AREB/ABF, MYB/MYC and NAC. The NAC
gene family is one of the largest families of transcription factors. Members of the NAC family have been identified in many plant species.
NAC TFs are involved in the growth, development and response of plants to biotic and abiotic stress. Many transcription factors belonging
to the NAC family, including SNAC1, are involved in the response of plants to water deficiency. Drought is the most harmful environmental
stress in worldwide agriculture. Obtaining plants with an increased tolerance to water deficiency by using the methods of molecular biology
has become a major goal of plant breeding.
enhanced tolerance to dehydration in transgenic Arabidopsis. Plant Cell
Rep 31: 1701-1711
63. Valliyodan B, Nguyen hT (2006) Understanding regulatory networks
and engineering for enhanced drought tolerance in plants. Curr Opin
Plant Biol 9: 189-195
64. Wu L, Zhang Z, Zhang h, Wang XC, huang R (2008) Transcriptional
modulation of ethylene response factor protein JERF3 in the oxida-
tive stress response enhances tolerance of tobacco seedlings to salt,
drought, and freezing. Plant Physiol 148: 1953-1963
65. Kwasniewski M, Chwialkowska K, Kwasniewska J, Kusak J, Siwinski
K, Szarejko I (2013) Accumulation of peroxidase-related reactive oxy-
gen species in trichoblasts correlates with root hair initiation in barley.
J Plant Physiol 170: 185-195
66. Gaudin AC, henry A, Sparks Ah, Slamet-Loedin Ih (2013) Taking
transgenic rice drought screening to the field. J Exp Bot 64: 109-117
Wyszukiwarka
Podobne podstrony:
304
Mazowieckie Studia Humanistyczne r2004 t10 n1 2 s284 295
I CSK 304 07 1 id 208210 Nieznany
304 Ustawa o emeryturach pomostowych
295
304
1 (295)
KSH, ART 295 KSH, II CSK 118/08 - wyrok z dnia 24 września 2008 r
295 Manuskrypt przetrwania
Sprawa C - 295-05, Prawo europejskie
295
4 M Kabaj, Ekonomia tworzenia i likwidacji miejsc pracy Dezaktywizacja Polski Warszawa 2005(292 295)
Metodologia podsumowanie id 295 Nieznany
294 295 id 32249 Nieznany
304 , Przemoc w rodzinie
304-02, Informacje dodatkowe.
295 834101 kierowca ciagnika rolniczego
więcej podobnych podstron