Chemia Organiczna-konwersatorium; gr. D1; 2011/12Z (B. Kozik)
1
Spektroskopia w podczerwieni (IR)
- przykład spektroskopii absorbcyjnej
(pomiar ilości światła zaabsorbowanego przez związek chem., jako funkcja długości fali świetlnej)
Zależność między energią kwantu promieniowania (
εεεε [J]), długością fali (λ
λ
λ
λ [m]),
i częstością (
ν
ν
ν
ν [Hz = 1/s]):
λ
ν
ε
hc
h
=
=
λ
ν
c
=
W spektroskopii IR fala charakteryzowana jest przez liczbę falową
ν
~
[cm
-1
]:
liczba falowa
ν
~
[cm
-1
] = 1 /
λ
λ
λ
λ [cm]
∼
∼
∼
∼ ν
ν
ν
ν (częstość)
]
m
[
]
cm
/
m
[
10000
]
cm
[
1
]
cm
[
1
µ
λ
µ
λ
ν
=
=
−
;
]
cm
[
]
cm
/
m
[
10000
]
m
[
1
−
=
v
µ
µ
λ
- Spektroskopia IR umożliwia obserwację drgań atomów połączonych wiązaniami
→
identyfikacja grup funkcyjnych w cząsteczce
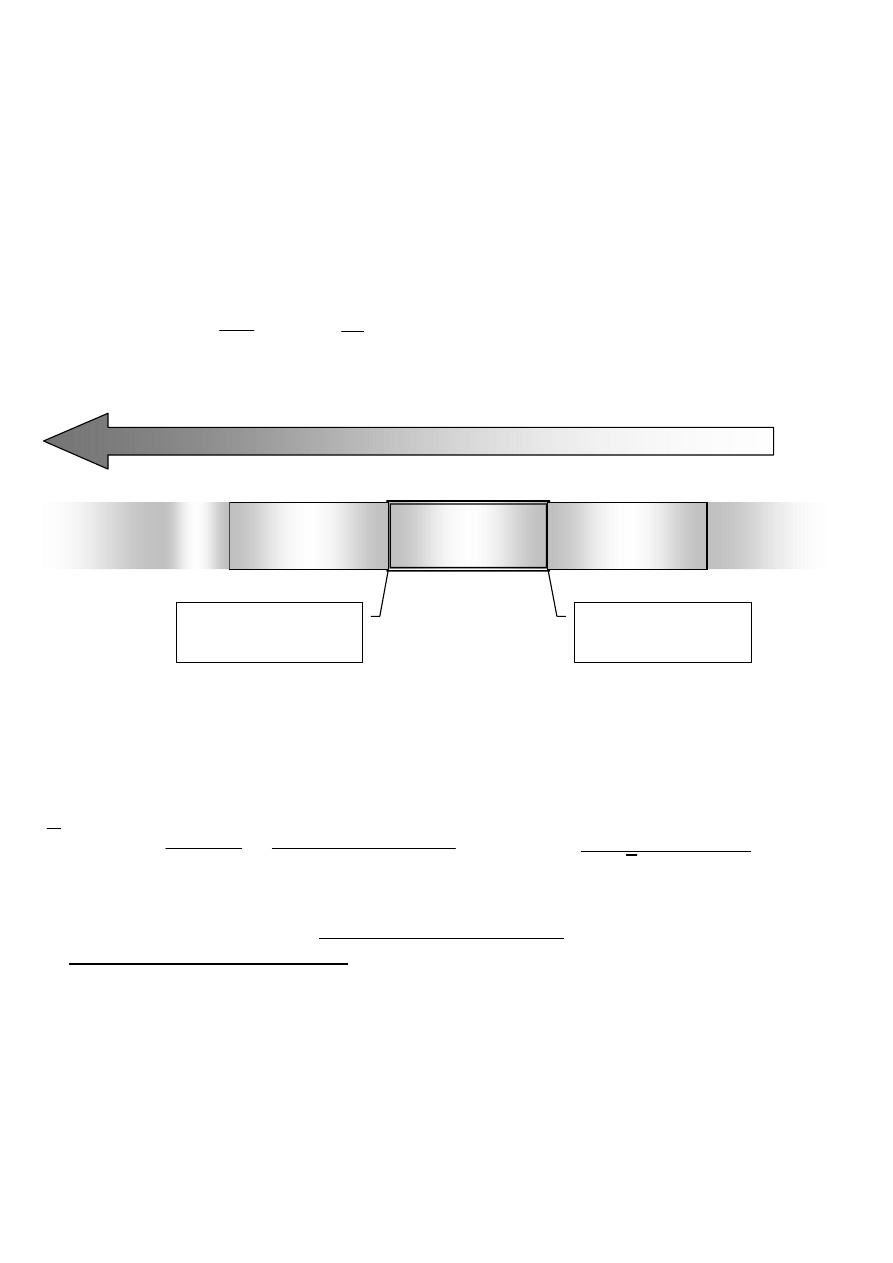
Drgania oscylacyjne są wzbudzane falami z zakresu
λ
= 25-2,5
µm (
ν
~
=400-4000 cm
-1
)
ENERGIA
λ = 2,5 µm
ν = 4000 cm
-1
λ = 25 µm
ν = 400 cm
-1
przejścia elektronowe
podczerwień
IR
bliska
podczerwień
UV
mikrofale
daleka
podczerwień
VIS
przejścia oscylacyjne
przejścia rotacyjne
gdzie: h - stała Plancka: 6,62
× 10
-34
J
×s
c - prędkość światła: 3
×10
8
m/s
Chemia Organiczna-konwersatorium; gr. D1; 2011/12Z (B. Kozik)
2
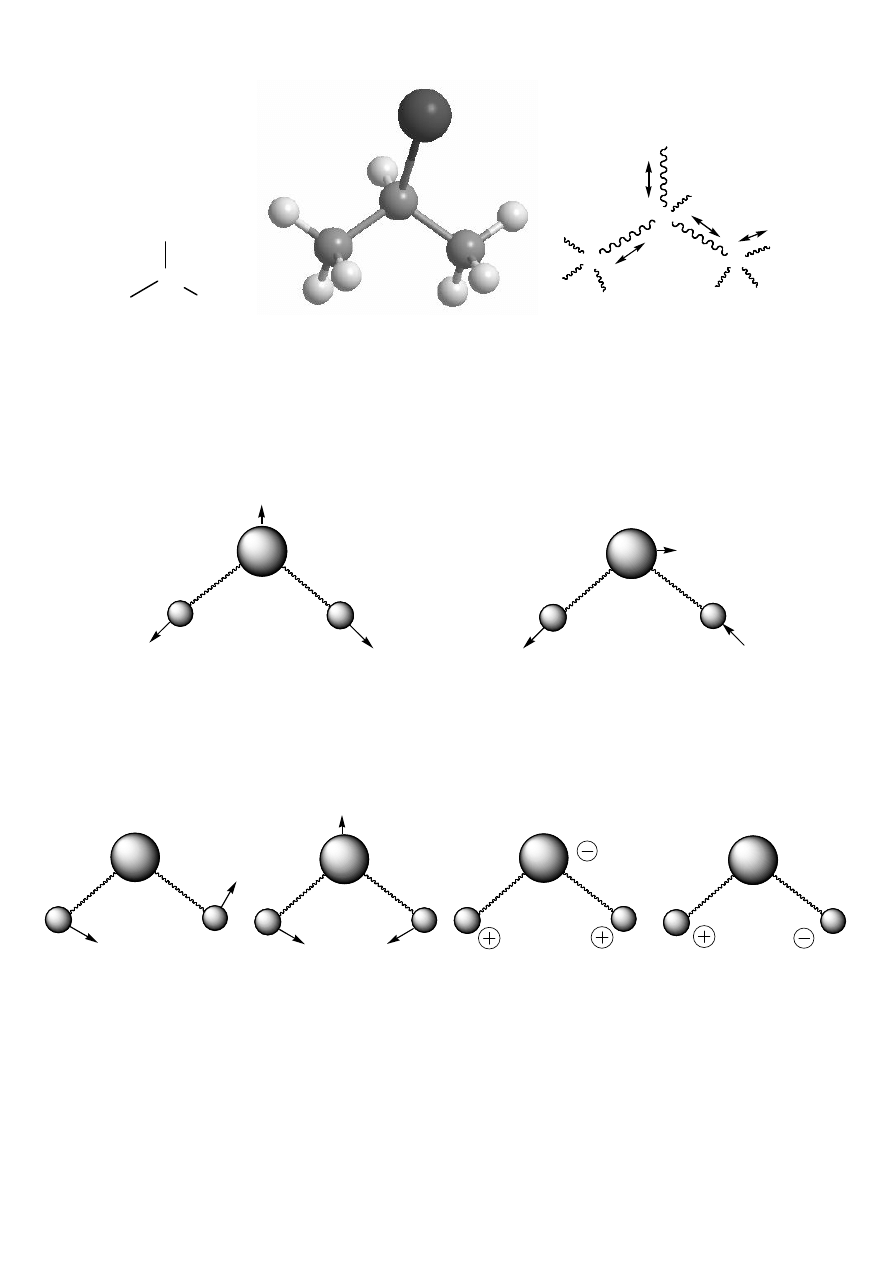
• Drgania wiązań w cząsteczkach:
CH
CH
3
I
CH
3
2-jodopropan
C
C
I
C
H
H
H
H
H
H
H
Ruchy oscylacyjne atomów w cząsteczce można rozłożyć na tzw. drgania normalne
(niezależne, brak rotacji, zachowany środek ciężkości-brak translacji).
np. drgania szkieletu węglowego jodku izopropylu:
DRGANIA ROZCIĄGAJĄCE (WALENCYJNE); oznaczane:
ν
ν
ν
ν
symetryczne
asymetryczne
(następuje zmiana głównie długości wiązań)
DRGANIA (ZGINAJĄCE) DEFORMACYJNE; oznaczane:
δ
δ
δ
δ ((((ω
ω
ω
ω,,,, ρ
ρ
ρ
ρ,,,, ττττ,,,, εεεε,,,, ........))))
wachlarzowe
nożycowe
(dominuje zmiana kątów między wiązaniami)
wahadłowe
wachlarzowe
(poza płaszczyzną)
(w płaszczyźnie)
Chemia Organiczna-konwersatorium; gr. D1; 2011/12Z (B. Kozik)
3
•
Absorbcja fal elektromagnetycznych
Przejście cząsteczki do wyższego stanu oscylacyjnego (E
0
→ E
1
, E
0
→ E
2,
E
1
→ E
2
itp.) może nastąpić pod wpływem promieniowania elektromagnetycznego.
WARUNKI:
I. Spośród wiązki fal o różnych długościach (
λ
λ
λ
λ
1
,
λ
λ
λ
λ
2
,
λ
λ
λ
λ
3
...) absorbowana jest
tylko fala o energii
εεεε dopasowanej do różnicy między poziomami stanu
wyjściowego i wzbudzonego.
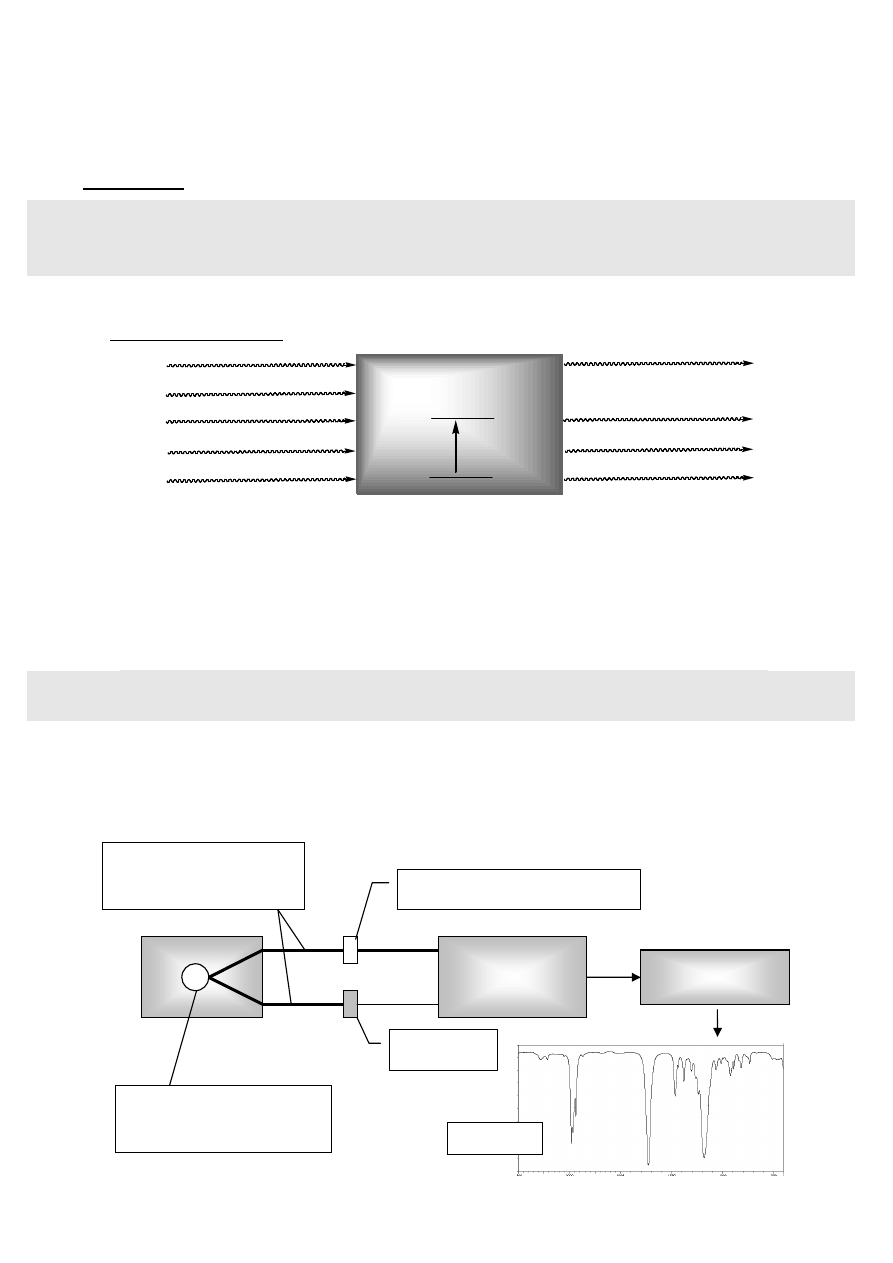
Schemat absorbcji:
PRÓBKA
v=0
v=1
E
0
E
1
∆E = ε
2
ε
1
(λ
1
)
λ
1
λ
3
λ
4
λ
5
ε
2
(λ
2
)
ε
3
(λ
3
)
ε
4
(λ
4
)
ε
5
(λ
5
)
Przedstawiono tylko przejście E
0
→ E
1
, gdyż
w temperaturze pokojowej ok. 99 %
cząsteczek znajduje się w stanie podstawowym (v = 0), a przejścia E
0
→ E
2
,
E
0
→ E
3
itp. są mało prawdopodobne.
II. Tylko drganie, któremu towarzyszy zmiana momentu dipolowego
cząsteczki (
∆
∆
∆
∆µ
µ
µ
µ ≠
≠
≠
≠0) jest wzbudzane falami IR (jest aktywne w podczerwieni).
Np. drganie wiązania
C-C w CH
3
-CH
3
jest
nieaktywne w podczerwieni
•
Schemat spektrometru IR (dwuwiązkowego, dyspersyjnego)
detektor
i analizator
rejestrator
próbka
kuweta odnośnikowa
źródło promieni IR
(np. pręt Nernsta)
wiązka pomiarowa
i porównawcza
widmo
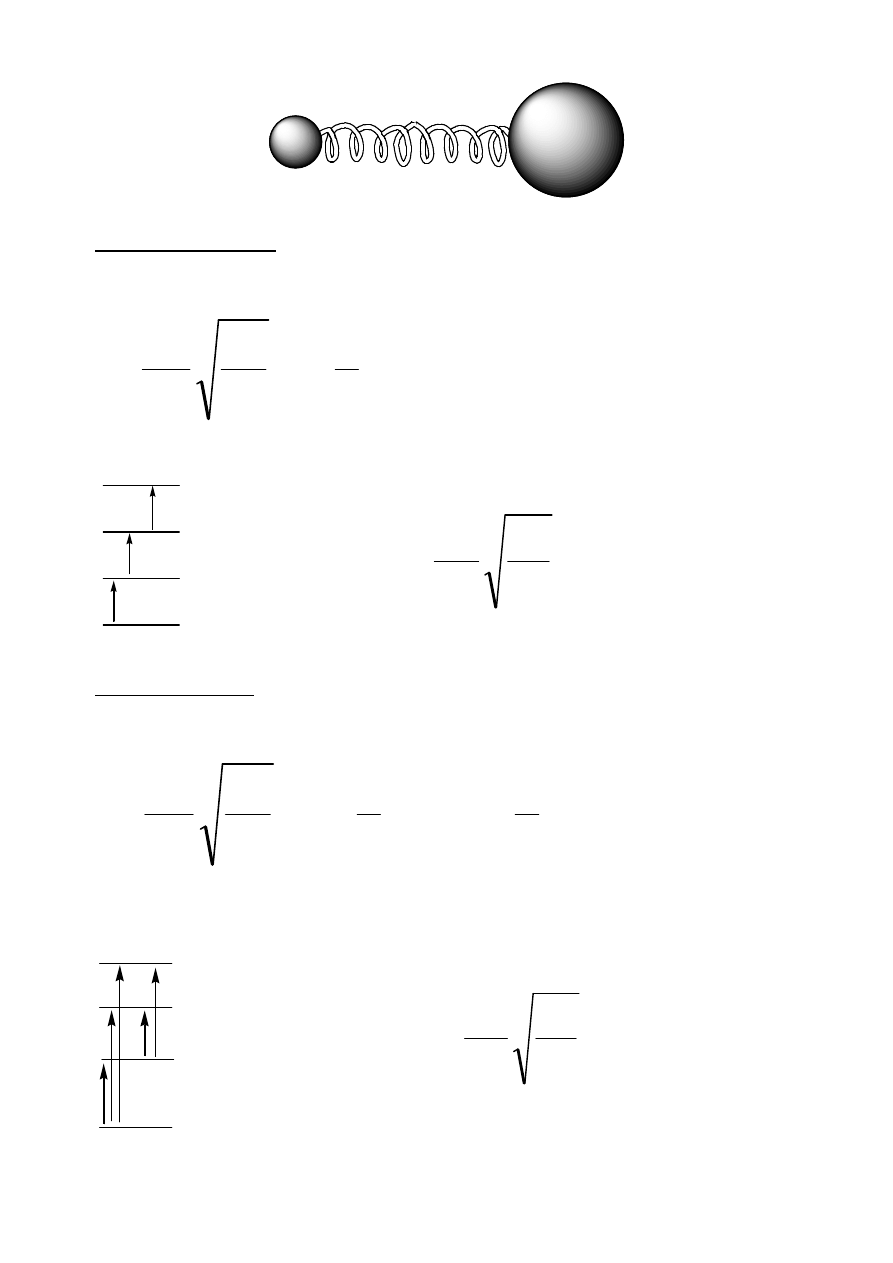
Chemia Organiczna-konwersatorium; gr. D1; 2011/12Z (B. Kozik)
4
•
Modele drgań rozciągających
m
1
m
2
f
Model uproszczony
(niezgodny z rzeczywistością): oscylator harmoniczny
(energia potencjalna oscylatora jest proporcjonalna do kwadratu jego odkształcenia),
w ujęciu mechaniki kwantowej prowadzi do:
)
2
1
(
2
+
=
v
m
f
h
E
r
osc
π
w konsekwencji:
v=0
v=1
v=2
v=3
E
0
E
1
E
2
E
3
Model optymalny: oscylator anharmoniczny (złożona zależność energii
potencjalnej oscylatora od jego odkształcenia), w ujęciu mechaniki kwantowej
prowadzi do:
+
−
+
=
2
)
2
1
(
)
2
1
(
2
v
x
v
m
f
h
E
r
osc
π
w konsekwencji:
v=0
v=1
v=2
v=3
E
0
E
1
E
2
E
3
E
osc
- energia oscylatora
v -
oscylacyjna liczba kwantowa
(v = 0, 1, 2, ...)
m
r
- masa zredukowana m
r
= m
1
m
2
/(m
1
+m
2
)
f -
stała siłowa wiązania
- odległości między poziomami identyczne:
r
m
f
h
E
π
2
=
∆
- jedyne dopuszczalne przejście dla
∆v = ± 1
- różne odległości między poziomami:
[
]
)
1
(
2
1
2
1
+
−
=
∆
+
v
x
m
f
h
E
r
v
v
π
- możliwe są przejścia o
∆v = ±1, ±2, ±3,...
(
∆v = +1: ton podstawowy, ∆v = +2, +3,... : nadtony)
x - współczynnik anharmoniczności
Chemia Organiczna-konwersatorium; gr. D1; 2011/12Z (B. Kozik)
5
•
Widmo IR, przewidywanie zakresów absorbcji
Położenie pasm absorbcji
drgań rozciągających
można przewidzieć
korzystając z zależności:
r
osc
m
f
E
~
~
~
∆
ν
Przykłady:
rozc. C-C (alkan) 1200 cm
-1
rozc. C
sp
3
-H
2840-3000 cm
-1
rozc. C=C (alken) 1660 cm
-1
rozc. C
sp
2
-H
3010-3100 cm
-1
rozc. C
≡
C (alkin)
2100-2200 cm
-1
rozc. C
sp
-H
3300 cm
-1
rozc. C-N
1200 cm
-1
rozc. C=N
1645 cm
-1
rozc. C
≡
N
2210-2260 cm
-1
(intensywniejsze niż C
≡
C)
rozc. C
sp
3
-H
2840-3000 cm
-1
rozc. N-H
3300-3500 cm
-1
rozc. O-H
2500-3600 cm
-1
rozc. C=C (izolowane) 1640-1680 cm
-1
rozc. C=O (izolowane) ok. 1705-1740 cm
-1
(aldehydy i ketony)
4000
3000
2000
1500
1000
400
liczba falowa [cm
-1
]
T
ra
n
s
m
it
a
n
c
ja
[
%
]
(p
rz
e
p
u
s
z
c
z
a
ln
o
ś
ć
)
50
0
obszar "finger-print"
rozc.
O-H
N-H
i C-H
ro
z
c
. C
≡
C
o
ra
z
C
≡
N
rozc.
C=O
C=C
i
C=N
wiele pasm:
rozc. C-O, C-C,...
deformacyjne, ...
f - stała siłowa
, miara "sztywności
wiązania", wzrasta z:
- rzędem ("krotnością") wiązania
- jonowością wiązania
- zmniejszeniem długości
m
r
- masa zredukowana
zależy od
mas atomów tworzących oscylator
Chemia Organiczna-konwersatorium; gr. D1; 2011/12Z (B. Kozik)
6
•
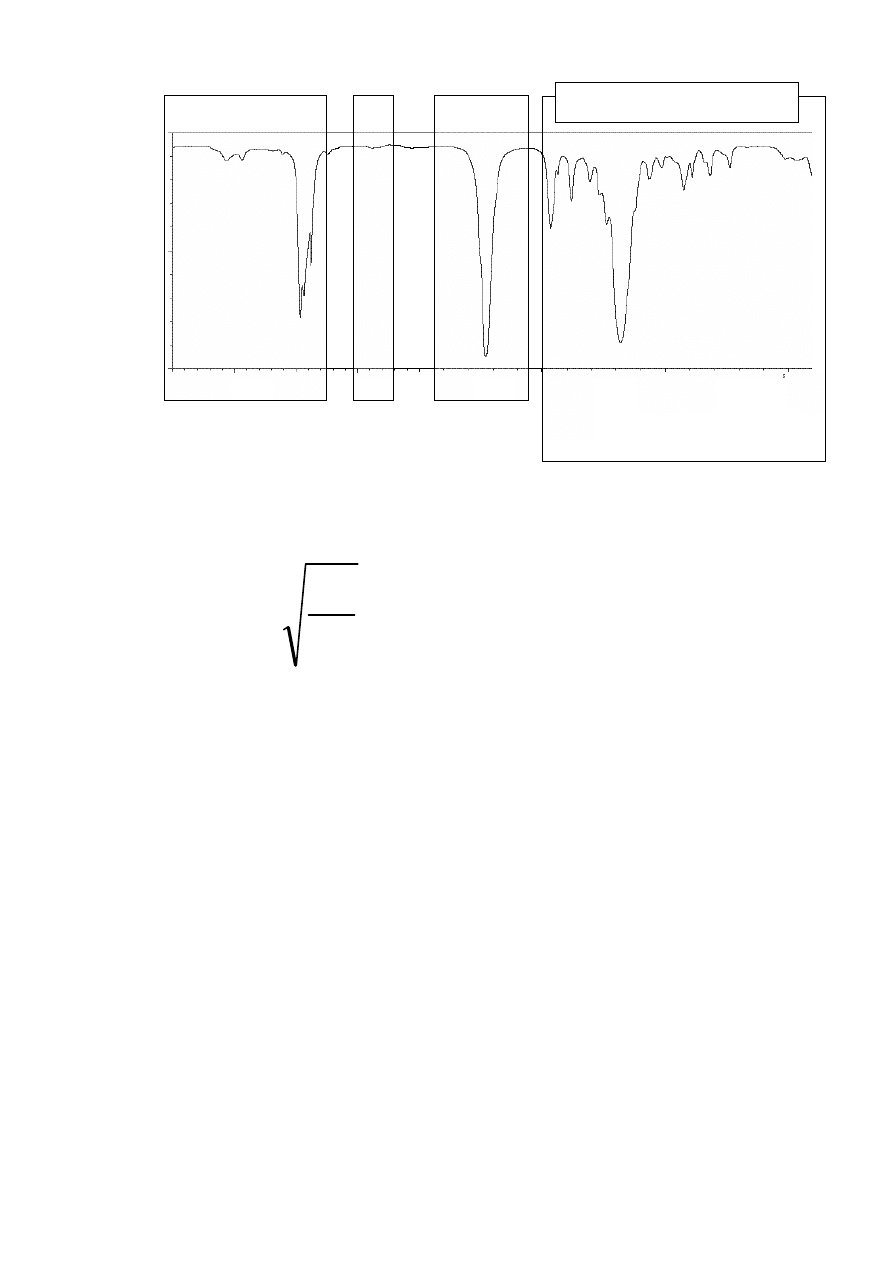
Wpływ sprzężenia na położenie pasm absorbcji (m. in. C=C i C=O)
rozc. C=C (izolowane)
1640-1680 cm
-1
rozc. C=C (sprzężone)
1620-1640 cm
-1
rozc. C=C (aromatyczne) ok. 1600 cm
-1
np.:
cykloheksen
1645 cm
-1
cykloheksa-1,3-dien
1620 cm
-1
benzen
1600 cm
-1
ν
maleje
H
O
H
O
butanal
1731 cm
-1
but-2-enal
1690 cm
-1
O
O
cykloheksanon
1718 cm
-1
cykloheks-2-enon
1675 cm
-1
O
O
O
O
octan fenylu
1760 cm
-1
benzoesan metylu
1715 cm
-1
•
Standardowe przygotowanie próbki
- < 2 mg związku;
- ciecze: film (kropla cieczy rozprowadzona między płytkami NaCl - nie absorbuje
w zakresie 2.5 – 25
µm);
- ciała stałe - "pastylka" sprasowana ze związku roztartego z KBr
- zawiesina substancji w
nujolu (mieszanina wyższych węglowodorów) lub
HCB (heksachlorobutadien)
- roztwory – w specjalnych kuwetach (rzadziej stosowane).
Chemia Organiczna-konwersatorium; gr. D1; 2011/12Z (B. Kozik)
7
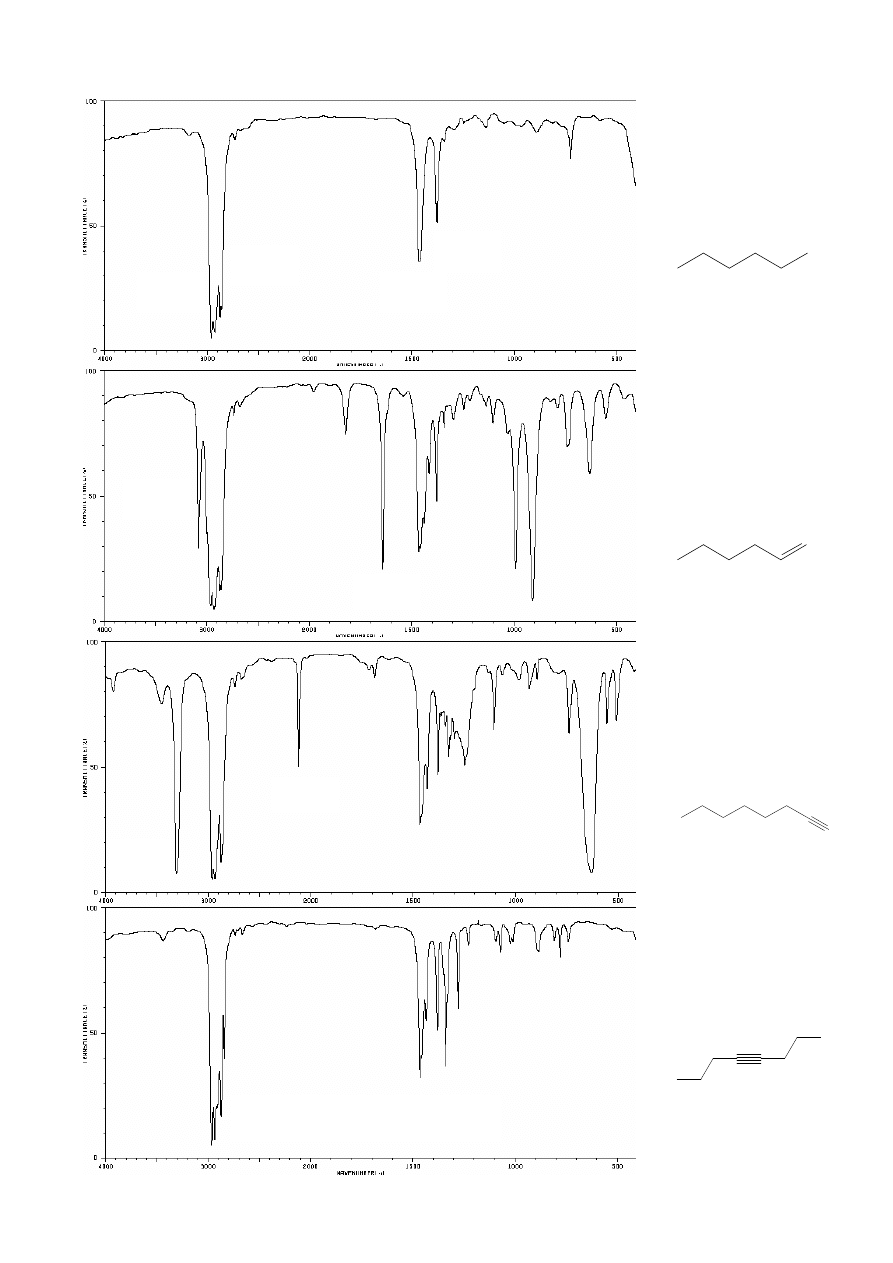
•
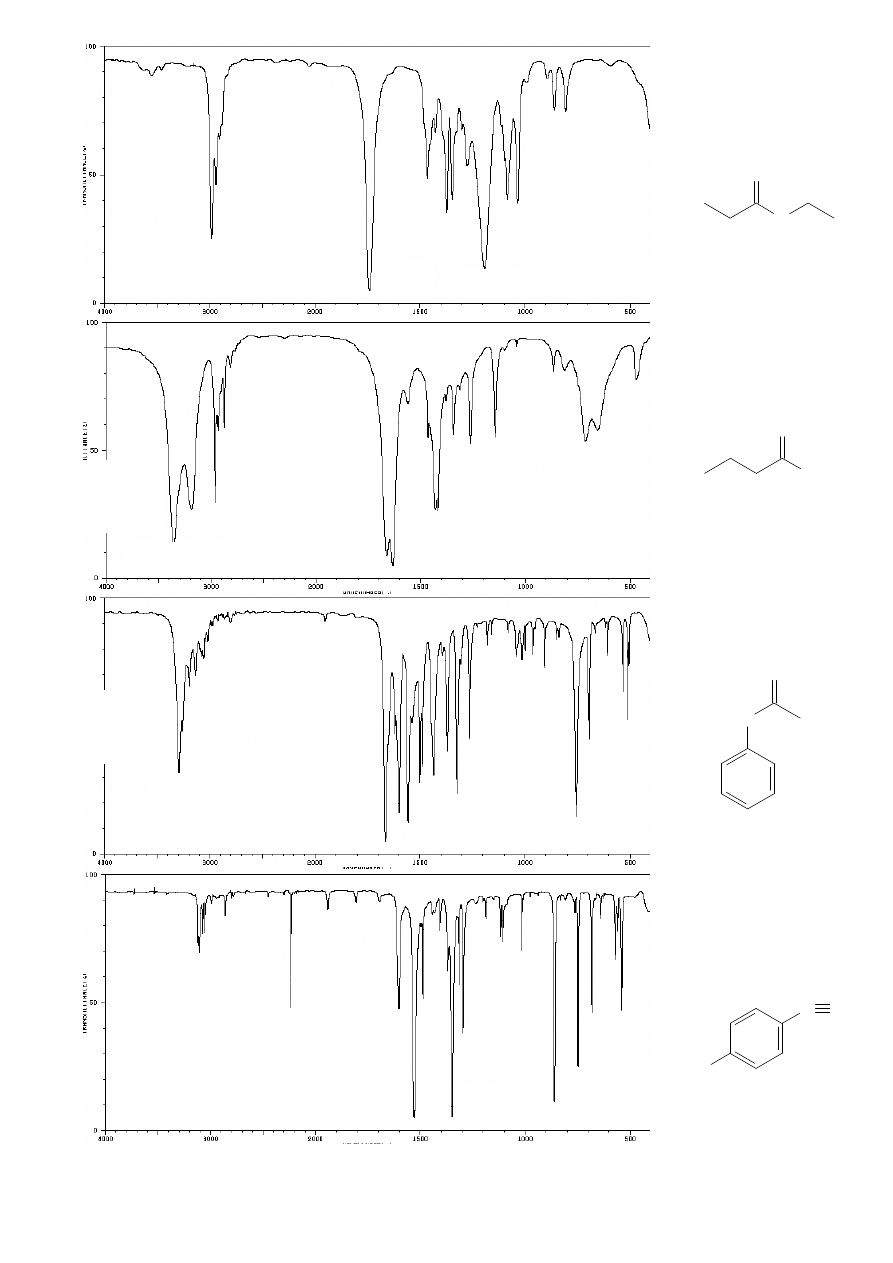
Rozpoznawanie grup funkcyjnych (wiązań obecnych w cząsteczce) na
podstawie widm:
2928
2959
1465
3079
1650
3316
2120
ALKENY:
np. heks-1-en
ALKANY:
np.
n
-heksan
ALKINY:
np. heks-1-yn
(terminalny)
okt-4-yn
1380
brak pasm
ν
C
≡C
oraz
ν
C
sp
-H
!!

Chemia Organiczna-konwersatorium; gr. D1; 2011/12Z (B. Kozik)
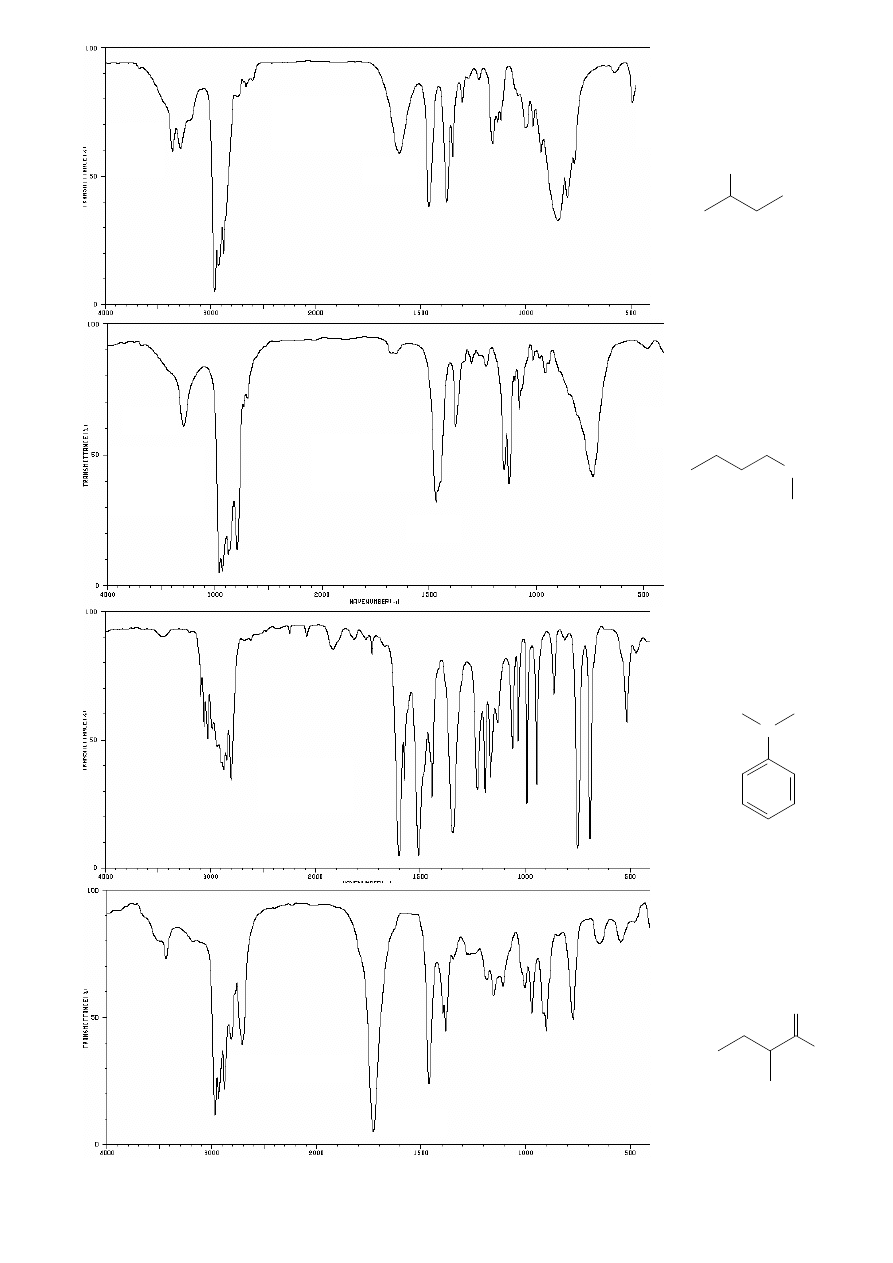
8
3016
3084
nadtony
1584
1478
Cl
ZW. AROMATYCZNE:
np. chlorobenzen
ALKOHOLE:
np. butan-1-ol
OH
szerokie
pasmo
ν
O-H
3000-3600
1073
ETERY:
np. eter dietylowy
O
1130
eter etylowo-fenylowy
(fenetol)
/niesymetryczny/
O
1246
1050
pasmo
ν
C-O
1070-1150
2 pasma
ν
C-O
:
1020-1075 (asym.)
1200-1275 (sym.)
pasmo
ν
C-O
1060-1150
(położenie zależy
od rzędowości
alkoholu)
Uwaga!: dla alkoholi
niezasocjowanych (bez
wiąz. wodorowych) ostre
pasmo
ν
O-H
3550-3650
pasma
ν
C
Ar
=C
Ar
przy ok. 1600
oraz 1475-1500
pasma
ν
C
sp
2
-H
3010-3100
Chemia Organiczna-konwersatorium; gr. D1; 2011/12Z (B. Kozik)
9
2 (lub 3)
pasma
ν
N-H
3300-3500
pasmo
δ
N-H
ok. 1600
AMINY:
np. butano-2-amina (1
o
)
NH
2
N,N
-dimetyloanilina (3
o
)
N
1728
N
-metylobutanoamina (2
o
)
NH
ALDEHYDY:
np. 2-metylobutanal
O
H
1711 i 2811
1 pasmo
ν
N-H
3300-3500
brak pasm
ν
N-H
i
δ
N-H
pasmo
ν
C=O
1720-1740
2 pasma
ν
CO-H
przy ok.
2720 i 2820 !!
pasmo
δ
N-H
ok. 1600
3292
1578
3286 i
3362
1603

Chemia Organiczna-konwersatorium; gr. D1; 2011/12Z (B. Kozik)
10
szerokie pasmo
dimerów
2500-3400
KETONY:
np. pentan-3-on
1716
O
1775
KWASY
KARBOKSYLOWE:
np. kw. izowalerianowy
(3-metylobutanowy)
O
OH
BEZWODNIKI
KWASOWE
np. bezwodnik octowy
O
O
O
CHLORKI
KWASOWE
np. chlorek benzoilu
O
Cl
1733
1710
zwykle 2 pasma
ν
C=O
przy ok. 1800-1775
ν
C-Cl
671
1827
1766
2 pasma
ν
C=O
:
1800-1830 (asym.)
1740-1775 (sym.)
ν
C-O
1224
pasmo
ν
C=O
1680-1750
pasmo
ν
C=O
1705-1725
Chemia Organiczna-konwersatorium; gr. D1; 2011/12Z (B. Kozik)
11
ESTRY:
np. propionian etylu
O
O
1740
1200
3294
1557
acetanilid (2
o
)
1665
HN
O
AMIDY:
np. butyroamid (1
o
)
O
NH
2
3366 i 3184
1662 i 1634
2234
1530
1350
NITRYLE,
ZW. NITROWE:
np. nitryl kwasu
p
-nitrobenzoesowego
C
O
2
N
N
2 pasma
ν
N-H
przy ok.
3180 i 3350
pasmo
ν
C=O
1700-1750
2 pasma
ν
C-O
:
sym. oraz
asym. (wyższe
wart. cm
-1
; int.
zbliżona do
pasma
ν
C=O
)
1 pasmo
ν
N-H
przy ok.
3300
2 pasma
tzw.
amidowe
:
I.
ν
C=O
ok. 1650
II.
δ
N-H
1620-1650
/faza stała/
2 pasma
tzw.
amidowe
:
I.
ν
C=O
1630-1680
II.
δ
N-H
1515-1570
/faza stała/
(w amidach 3
o
tylko
1 pasmo 1630-1670)
Uwaga!: położenie pasm
amidowych zależy od tego,
czy pomiar dokonywany
jest w fazie stałej czy
w rozc. roztworze
2 silne pasma
ν
N=O
:
1300-1350 (sym.)
1500-1560 (asym.)
pasmo
ν
C
≡N
powyżej 2200
(intensywniejsze niż
ν
C
≡C
)

Chemia Organiczna-konwersatorium; gr. D1; 2011/12Z (B. Kozik)
12
•
Podstawowe, łatwe do interpretacji pasma absorbcji w spektroskopii IR
zakres absorbcji
[cm
-1
]
wiązanie
typ związku
uwagi
3550-3650
O-H
alkohole, fenole
monomeryczne, bez wiązań wodorowych - ostre pasmo
3000-3600
O-H
alkohole, fenole
zasocjowane, wiązania wodorowe - szerokie pasmo
3300-3500
N-H
aminy
zwykle dwa pasma dla NH
2
, jedno dla NH
ok. 3300
≡C-H
alkiny
tylko dla terminalnych
3100-3400
N-H
amidy
zwykle dwa pasma dla NH
2
, jedno dla NH
2500-3400
O-H
kwasy
bardzo szerokie pasmo
3010-3100
=C-H
alkeny, areny
zazwyczaj słabe
2840-3000
-C-H
alkany
kilka pasm, intensywność zależy od ilości grup alifat.
ok. 2700 i 2820
O=C-H
aldehydy
słabe pasma
2210-2260
C
≡N
nitryle
2100-2200
C
≡C
alkiny
dobrze widoczne tylko dla terminalnych alkinów
1650-1830
C=O
- chlorki kwasowe: 1775-1800;
- bezwodniki: dwa pasma różniące się o ok. 60 cm
-1
– jedno w zakresie
1800-1830, drugie 1740-1775 cm
-1
;
- estry: 1700-1750
(cykliczne laktony: 5 czł.-1780; 4 czł.- 1840)
- kwasy: 1680-1750 (często szerokie)
- aldehydy i ketony: 1660-1740
(ketony cykliczne 4 i 5-członowe: do 1780)
- amidy (-CONH
2
) dwa pasma ok. 1630 i 1650 (w KBr),
ok. 1600 i 1690 w roztworze;
(-CONHR) dwa pasma 1515-1570 i 1630-1680 (w KBr),
1510-1550 i 1670-1700 (w roztworze);
(CONR
2
) jedno pasmo: 1630-1670 (w KBr i w roztworze);
(gdy C=O sprzężone z Ar lub C=C - niższe wartości !!)
1640-1680
C=C
alkeny
niższe wartości gdy C=C sprzężone z Ar, C=O lub C=C
ok. 1600
oraz 1475-1500
C
Ar
=C
Ar
zw.
aromatyczne
zmienna intensywność
ok. 1540 i 1360
NO
2
zw. nitrowe
intensywne
1050 - 1300
C-O
- fenole: 1180-1260;
-alkohole: 1050-1200;
- estry: dwa pasma ok. 1150 i 1200-1300;
- etery dialifatyczne: 1070-1150;
- etery nienasyc.: dwa pasma ok. 1050 i ok. 1250
Wyszukiwarka
Podobne podstrony:
MS materialy dodatkowe gr D1 II rok 2011 12Z
IR zadania gr D1 II rok 2011 12Z
MS zadania gr D1 II rok 2011 12Z
Egzamin 2011 - I termin + dodatkowe, lekarski2rok, lekarski II rok, fizjologia, Egzamin teoretyczny
MATERIAŁY BUDOWLANE-cementy, Studia, II rok, Materiały Budowlane 2
Cwiczenie Piknometr, Materiały na studia ZIP, II Rok, Fizyka, Labolatorium
fiza, Materiały na studia ZIP, II Rok, Fizyka, Labolatorium, Piknometr
Sprawozdanie Efekt Halla 2, Materiały na studia ZIP, II Rok, Fizyka, Labolatorium
wypracowanie- materiały, Gospodarka przestrzenna licencjat, II rok, Semestr IV, GIS
materialy bud- skały, Studia, II rok, Materiały Budowlane 2
Wyn.Hist.UE.gr.L31.II sem.2011, STUDIA-Administracja
Ergonomia 41-49, Materiały na studia ZIP, II Rok, Ergonomia
Chem nieorg egzamin II rok 2011 2012 grupy od 15 do 18 egzamin, Chemia
IR materialy dodatkowe id 22019 Nieznany
Nasiennictwo-materiały dla studentów, Studia, II rok, II rok, IV semestr, Nasiennictwo
SPrawozdanie Hall, Materiały na studia ZIP, II Rok, Fizyka, Labolatorium
przykady rozgrzewkowe do wykadlw 2013 LISTA 3, Materiały na studia ZIP, II Rok, Rachunek kosztów dla
Gr 1 IM II rok PiK zagadnienia
więcej podobnych podstron