
SZKOŁA GŁÓWNA GOSPODARSTWA WIEJSKIEGO
WYDZIAŁ TECHNOLOGII ŻYWNOŚCI
KATEDRA INŻYNIERII ŻYWNOŚCI I ORGANIZACJI PRODUKCJI
Katarzyna Samborska
Praca doktorska
Wpływ procesu suszenia rozpyłowego
na degradację preparatu
α
-amylazy
z
Aspergillus oryzae
Promotor pracy:
Dr hab. Dorota Witrowa-Rajchert, Prof. SGGW
Warszawa 2004

Część badań wykonano w Laboratory of Food Technology,
Katholieke Universiteit Leuven,
pod opieką naukową Prof. Marc’a Hendrickx’a,
w czasie pobytu na stypendium Marie Curie Fellowship

Pragnę złożyć serdeczne podziękowania Pani Profesor dr hab. Dorocie Witrowej-Rajchert za
trud włożony w pomoc przy realizacji niniejszej pracy. Dziękuję również za wiarę w moje
możliwości i zachęcenie do rozpoczęcia studiów doktoranckich. Za wsparcie, troskę
i poświęcony mi czas. Za cierpliwość i wyrozumiałość, zwłaszcza podczas mojego pobytu na
stypendium zagranicznym. Za cenne uwagi i porady w trakcie przygotowywania publikacji oraz
niniejszej rozprawy. W sposób szczególny dziękuję za stosowanie pozytywnych metod
motywowania mnie do pracy.
Dziękuję kierownikowi Katedry Inżynierii Żywności i Organizacji Produkcji, Panu Profesorowi
dr hab. Piotrowi P. Lewickiemu, za cenne i krytyczne uwagi na temat mojej pracy, stworzenie
naukowej atmosfery oraz warunków do prowadzenia badań, a przede wszystkim – za
motywowanie do dążenia, aby odpowiadać nie tylko na pytanie „jak”, ale i na pytanie
„dlaczego”.
Kierownikowi studiów doktoranckich, Panu Profesorowi dr hab. Andrzejowi Lenartowi, dziękuję
za pomoc w spełnieniu wszystkich formalnych wymagań niezbędnych do zakończenia studiów,
konsekwentne przypominanie o priorytetach oraz życzliwość i wsparcie.
Wszystkim pracownikom Katedry Inżynierii Żywności i Organizacji Produkcji serdecznie dziękuję
za pomoc w realizacji badań i obowiązków dydaktycznych związanych ze studiami
doktoranckimi.
Wszystkim współuczestnikom studium doktoranckiego, a w szczególności Ani Kamińskiej
i Anecie Ogonek, dziękuję za wsparcie i przyjaźń.
In this place I want also to express my thanks to the whole staff of Laboratory of Food
Technology, Katholieke Universiteit Leuven, where I spent one year working on my PhD thesis.
My special profound thanks goes to Prof. Marc Hendrickx, Prof. Ann Van Loey and
Yann Guiavarc’h (even if they never can see this page), for their kindness, scientific support
and fruitful discussions. Dank U Wel!
Dziękuję firmie Novozymes A/S za przekazanie próbki enzymu do badań.

Niniejszą pracę dedykuję Rodzicom

Dziękuję mojemu mężowi Piotrowi za trwanie,
dobroć, cierpliwość i wyrozumiałość

1. WSTĘP .................................................................................................................1
2. PRZEGLĄD LITERATURY .....................................................................................2
2.1. ENZYMY .........................................................................................................2
2.1.1. Definicja i podstawowe właściwości enzymów ...............................2
2.1.2. Budowa enzymów ..............................................................................2
2.1.2.1. Budowa chemiczna .........................................................................2
2.1.2.2. Struktura przestrzenna ....................................................................3
2.1.3. Kinetyka reakcji enzymatycznych .................................................... 5
2.1.4. Czynniki wpływające na aktywność enzymów ................................7
2.1.4.1. Temperatura ..................................................................................7
2.1.4.2. Stężenie jonów wodorowych ............................................................8
2.2. ENZYMY W TECHNOLOGII ŻYWNOŚCI ........................................................9
2.2.1. Zastosowanie enzymów ....................................................................9
2.2.1.1. Skrobia i enzymy amylolityczne ........................................................11
2.2.2. Metody produkcji preparatów enzymatycznych ..............................14
2.2.3. Jakość i formy preparatów enzymatycznych ...................................15
2.3. SUSZENIE ENZYMÓW ................................................................................... 16
2.3.1. Metody suszenia ................................................................................16
2.3.1.1. Suszenie rozpyłowe .........................................................................17
2.4. ROLA WODY W PROCESACH FIZYCZNYCH I BIOCHEMICZNYCH .............. 19
2.4.1. Aktywność wody ................................................................................20
2.4.2. Hydratacja i interakcje wody z innymi składnikami ........................22
2.4.2.1. Interakcje w układach trójskładnikowych ......................................... 23
2.4.3. Izotermy sorpcji ................................................................................ 25
2.4.4. Stan szklisty .......................................................................................26
2.5. INAKTYWACJA CIEPLNA ENZYMÓW ............................................................28
2.5.1. Wpływ aktywności wody na inaktywację cieplną enzymów .......... 32
2.5.2. Wpływ dodatków stabilizujących na inaktywację
cieplną enzymów................................................................................34
2.6. PODSUMOWANIE...........................................................................................36
3. CEL I ZAKRES PRACY ..........................................................................................37
4. METODYKA BADAŃ .............................................................................................38
4.1 MATERIAŁY .....................................................................................................38
4.1.1. Preparat
α
-amylazy Fungamyl 800L .................................................38
4.1.1.1. Oznaczenie masy molowej białka enzymatycznego ............................38
4.1.1.2. Oznaczenie zawartości białka ...........................................................39
4.1.1.3. Oznaczenie zawartości suchej substancji .......................................... 40

4.1.2. Maltodekstryna ..................................................................................41
4.2. SUSZENIE ROZPYŁOWE PREPARATU
α
-AMYLAZY ......................................41
4.2.1. Charakterystyka otrzymanych suszy ................................................42
4.2.1.1. Oznaczenie aktywności
α
-amylazy ................................................... 42
4.2.1.2. Oznaczenie zawartości suchej substancji........................................... 46
4.2.1.3. Oznaczenie morfologii cząstek.......................................................... 46
4.2.1.4. Właściwości fizyczne proszków......................................................... 47
4.2.1.5. Oznaczenie zawartości sacharydów redukujących.............................. 47
4.2.2. Parametry opisujące przebieg suszenia rozpyłowego..................... 47
4.3. KINETYKA INAKTYWACJI CIEPLNEJ
α
-AMYLAZY .......................................49
4.3.1. Oznaczenie aktywności
α
-amylazy ...................................................49
4.3.1.1. Optymalizacja oznaczenia ................................................................50
4.3.2. Kinetyka inaktywacji cieplnej
α
-amylazy w systemach
o wysokiej zawartości wody .............................................................51
4.3.2.1. Przygotowanie próbek .....................................................................51
4.3.2.2. Obróbka cieplna ..............................................................................52
4.3.3. Kinetyka inaktywacji cieplnej
α
-amylazy w systemach
o niskiej zawartości wody ................................................................ 54
4.3.3.1. Liofilizacja i dosuszanie ................................................................... 54
4.3.3.2. Adsorpcja pary wodnej i izoterma sorpcji ..........................................55
4.3.3.3. Obróbka cieplna ..............................................................................56
4.3.4. Wpływ dodatków stabilizujących na kinetykę inaktywacji
cieplnej
α
-amylazy.............................................................................57
4.3.4.1. Przygotowanie próbek .....................................................................57
4.3.4.2. Obróbka cieplna ..............................................................................58
4.3.5. Wyznaczenie parametrów kinetycznych inaktywacji cieplnej
α
-amylazy ..........................................................................................59
4.4. METODY STATYSTYCZNE ..............................................................................61
4.4.1. Analiza wariancji................................................................................61
4.4.2. Test t-Studenta...................................................................................62
5. OMÓWIENIE I DYSKUSJA WYNIKÓW................................................................63
5.1. CHARAKTERYSTYKA MATERIAŁÓW DO BADAŃ...........................................63
5.1.1. Preparat
α
-amylazy Fungamyl 800L .................................................63
5.1.1.1. Masa molowa .................................................................................63
5.1.1.2. Zawartość białka .............................................................................64
5.1.1.3. Zawartość suchej substancji ............................................................65
5.1.2. Maltodekstryna ..................................................................................65
5.2. SUSZENIE ROZPYŁOWE PREPARATU
α
-AMYLAZY ......................................65
5.2.1. Parametry opisujące przebieg suszenia rozpyłowego..................... 65
5.2.1.1. Temperatura powietrza wylotowego..................................................65

5.2.1.2. Strumień odparowanej wody............................................................ 67
5.2.1.3. Wilgotność powietrza wylotowego.....................................................68
5.2.1.4. Właściwe zużycie powietrza .............................................................68
5.2.1.5. Właściwe zużycie ciepła ..................................................................69
5.2.2. Charakterystyka otrzymanych proszków .........................................70
5.2.2.1. Zawartość wody ..............................................................................70
5.2.2.2. Morfologia cząstek ..........................................................................72
5.2.2.3. Właściwości fizyczne........................................................................73
5.2.2.4. Zawartość sacharydów redukujących.................................................74
5.2.3. Podsumowanie – przebieg suszenia..................................................75
5.2.4. Aktywność
α
-amylazy w otrzymanych suszach ...............................75
5.2.5. Podsumowanie ...................................................................................80
5.3. KINETYKA INAKTYWACJI CIEPLNEJ
α
-AMYLAZY .......................................80
5.3.1. Optymalizacja oznaczenia aktywności
α
-amylazy .......................... 80
5.3.2. Kinetyka inaktywacji cieplnej
α
-amylazy w systemach
o różnej zawartości wody..................................................................81
5.3.2.1. Adsorpcja pary wodnej i izoterma sorpcji...........................................81
5.3.2.2. Parametry kinetyczne inaktywacji cieplnej
α
-amylazy......................... 83
5.3.3. Wpływ dodatków stabilizujących na kinetykę inaktywacji
cieplnej
α
-amylazy ............................................................................102
5.3.4. Podsumowanie....................................................................................107
6. WNIOSKI..............................................................................................................109
7. STRESZCZENIE ....................................................................................................111
8. ABSTRACT.............................................................................................................114
9. SPIS LITERATURY................................................................................................116
10. ANEKS.................................................................................................................126

Wstęp
1. WSTĘP
Przetwórstwo żywności jest jednym z największych odbiorców preparatów
enzymatycznych wśród wszystkich gałęzi przemysłu. Ich stosowanie ułatwia i przyspiesza
zachodzenie korzystnych zmian w surowcach, zwiększając wydajność gotowych produktów,
a przez to zmniejszając koszty produkcji. Do najdawniej i najczęściej stosowanych enzymów
należą te z grupy amylaz, wykorzystywane na szeroką skalę w przemyśle piekarskim,
skrobiowym i gorzelniczym.
Produkcja i modyfikowanie właściwości enzymów są ważnymi obszarami działalności
współczesnej biotechnologii. Jednym z kierunków tych działań są prace nad doskonaleniem
procesu suszenia enzymów jako metody ich utrwalania. Ponieważ o jakości i przydatności
preparatów enzymatycznych decyduje ich aktywność i zdolność do spełniania określonej funkcji
biologicznej oraz trwałość, to celem suszenia jest otrzymanie aktywnych preparatów zdatnych
do długiego przechowywania. W praktyce jest to bardzo trudne do osiągnięcia, ponieważ
w czasie suszenia w enzymach może zachodzić wiele niekorzystnych zmian chemicznych,
fizycznych i biochemicznych, jak np. denaturacja białek, które są przyczyną utraty aktywności
enzymatycznej.
Ze względu na znaczne zróżnicowanie budowy i właściwości fizycznych poszczególnych
enzymów, a także na zmiany tych właściwości pod wpływem towarzyszących suszeniu
przemian fizykochemicznych i biologicznych, metoda suszenia i optymalne parametry tego
procesu powinny być dobierane do każdego enzymu indywidualnie. W celu doboru
odpowiedniej metody i warunków suszenia konieczna jest na przykład znajomość kinetyki
inaktywacji cieplnej danego enzymu przy różnej zawartości wody.
Do suszenia enzymów najczęściej stosowana jest metoda rozpyłowa. Wielu autorów
stwierdza, że jest to odpowiednia metoda suszenia materiałów termolabilnych, ze względu na
stosunkowo niską temperaturę materiału w czasie procesu oraz krótki czas działania
podwyższonej temperatury na suszony materiał. Brak jednak prac, które wyjaśniałyby wpływ
zmian parametrów suszenia na aktywność enzymu w otrzymanym suszu, czego można
dokonać na podstawie znajomości kinetyki inaktywacji cieplnej enzymu w warunkach różnej
zawartości wody.

Przegląd literatury – Enzymy
2. PRZEGLĄD LITERATURY
2.1. ENZYMY
2.1.1. Definicja i podstawowe właściwości enzymów
Enzymy, dawniej zwane fermentami, są wytwarzanymi przez żywe organizmy
katalizatorami (biokatalizatorami) przemian chemicznych. Jedynie w ich obecności może
zachodzić wiele reakcji metabolicznych we względnie łagodnych warunkach,
tzn.: w temperaturze poniżej 100°C, przy ciśnieniu atmosferycznym i obojętnym pH (Whitaker
2003). Jak wynika z definicji katalizatora, enzymy są substancjami, które zwiększając szybkość
przemiany substratów w produkty po zakończeniu reakcji zachowują niezmienioną budowę
i właściwości. Enzymy znacznie ułatwiają i przyspieszają zajście reakcji chemicznej poprzez:
zwiększenie prawdopodobieństwa zderzeń reagujących cząsteczek, zmniejszenie bariery
energetycznej oraz ukierunkowanie cząsteczek substratów względem siebie (Kączkowski 1999).
W reakcjach enzymatycznych uzyskuje się zwiększenie szybkości reakcji od 100 do 1000 razy
(Zgirski 1999).
Najważniejszą cechą enzymów, odróżniającą je od innych katalizatorów, jest ich duża
specyficzność działania, wyrażająca się katalizowaniem reakcji chemicznej określonego typu
i ograniczonej do substratu o określonej budowie. Enzymy mają zdolność wybierania
i katalizowania tylko jednej z termodynamicznie możliwych reakcji, jakim może podlegać dany
substrat. Jeżeli może się on przekształcać w kilku różnych kierunkach, to każda z tych reakcji
jest katalizowana przez odrębny enzym, zdolny do przekształcania wiązania określonego typu
(Zgirski 1999, Kączkowski 1999). Szacuje się, że liczba enzymów w komórce organizmu żywego
może wynosić od 2 do 10 tys. (Reps 2003).
2.1.2. Budowa enzymów
2.1.2.1. Budowa chemiczna
Polemika co do chemicznej natury enzymów toczyła się w świecie naukowym od końca
XIX w. do lat 30-tych XX w., prowadząc do ostatecznego stwierdzenia, że są one białkami. Do
tej pory uzyskano ponad 600 enzymów w postaci krystalicznej, spośród których wszystkie są
białkami (Whitaker 2003).
Pod względem budowy chemicznej wyróżnia się trzy kategorie enzymów. Do kategorii
pierwszej należą białka proste zbudowane tylko z aminokwasów. Rolę grupy czynnej w tym
przypadku spełniają specyficzne zespoły aminokwasów, których nie można odszczepić bez
zmiany struktury białka, a więc bez zniszczenia enzymu jako substancji katalitycznej. Do grupy
tej należą min. enzymy proteolityczne i
α
-amylaza. Enzymy z drugiej i trzeciej kategorii są
2

Przegląd literatury – Enzymy
białkami złożonymi zawierającymi grupy nieaminokwasowe zwane koenzymami, związane
z cząsteczką białkową zwaną apoenzymem. Podział tego rodzaju enzymów na dwie grupy
wynika z różnic w sposobie związania dwóch wyżej wymienionych części. W drugiej grupie
enzymów wiązanie to ma charakter trwały (kowalencyjny), a związany w ten sposób koenzym
nosi nazwę grupy prostetycznej. Oddzielenie i ponowne złączenie apoenzymu i tej grupy nie
zawsze prowadzi do odtworzenia katalitycznie czynnego enzymu. Enzymy należące do trzeciej
grupy zawierają luźno związany koenzym, którego nie można traktować jako integralnej części
enzymu na podobieństwo grupy prostetycznej. W tym przypadku obie części enzymu dają się
łatwo oddzielić i każda z nich jest nieczynna, a złączone ze sobą dają ponownie aktywny enzym
(Zgirski 1999, Rodwell 1995).
Każda z części składowych enzymu ma inny wpływ na jego właściwości. Część białkowa
(apoenzym) odpowiada za specyficzność substratową, czyli za to, jaki rodzaj substratu ulega
przemianie. Grupa prostetyczna i koenzym są narzędziami pozwalającymi na przetworzenie
wcześniej wybranego substratu. Koenzymy określają z reguły typ katalizowanej reakcji,
decydując np., jakie grupy chemiczne czy atomy mogą być przenoszone z donora na akceptor.
Rolą grupy prostetycznej jest utrzymywanie struktury enzymu optymalnej dla katalizy (Zgirski
1999, Kączkowski 1999).
2.1.2.2. Struktura przestrzenna
Ponieważ enzymy są białkami, ich budowa strukturalna jest charakterystyczna dla
substancji białkowych, tzn. wykazuje kilka poziomów organizacji, od struktur
pierwszorzędowych do czwartorzędowych.
Budowę pierwszorzędową stanowi sekwencja aminokwasów, czyli
kolejność ich
występowania w łańcuchu polipeptydowym, która przesądza o tym, w jaki sposób zwinie
się ta cząsteczka, przybierając swój charakterystyczny kształt. Łańcuchy polipeptydowe ulegają
przestrzennemu skręceniu i pofałdowaniu, w wyniku czego cząsteczki uzyskują trójwymiarowy
kształt, czyli konformację.
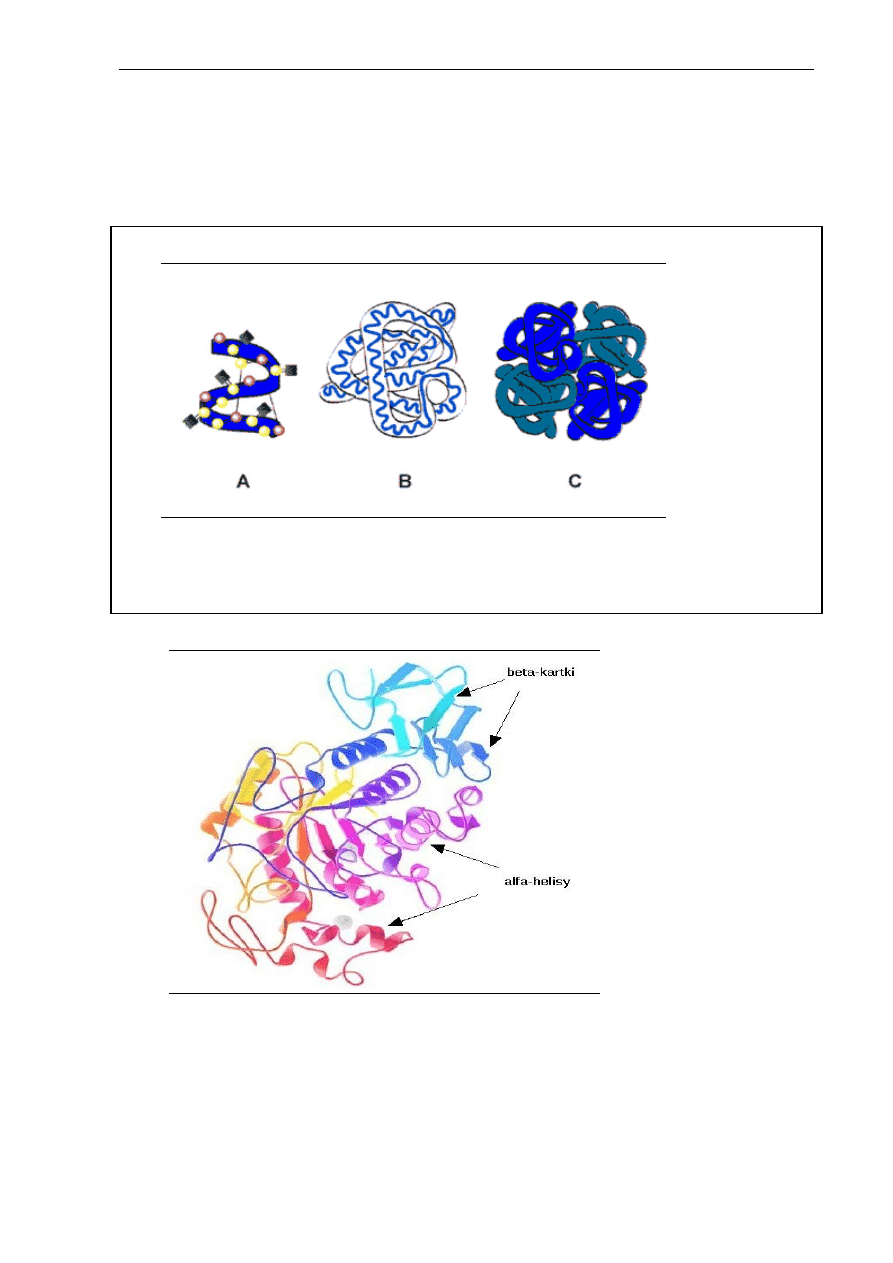
Sposób ułożenia łańcuchów polipeptydowych w przestrzeni stanowi strukturę
drugorzędową białka (Rys. 2.1.A), która jest stabilizowana przez wiązania wodorowe
pomiędzy aminokwasami znajdującymi się obok siebie w przestrzeni (niesąsiadującymi
w łańcuchu polipeptydowym). Strukturę drugorzędową cząsteczek białkowych charakteryzuje
skręcenie łańcuchów polipeptydowych w rodzaj spirali, zwanej alfa-helisą lub inny regularny
układ przestrzenny, np. „kartki beta” (Rys 2.2).
Trzeciorzędowa struktura białka (Rys. 2.1.B i 2.2) powstaje na skutek oddziaływań
pomiędzy aminokwasami znajdującymi się w różnych miejscach skręconej, drugorzędowej
3
Przegląd literatury – Enzymy
struktury białka. Decyduje ona o ostatecznym trójwymiarowym kształcie łańcucha
polipeptydowego. Ogromną rolę w powstawaniu tej struktury odgrywają wiązania
dwusiarczkowe -S-S-, które powstają pomiędzy dwoma resztami cysteiny w tym samym
łańcuchu lub łączące dwa różne łańcuchy.
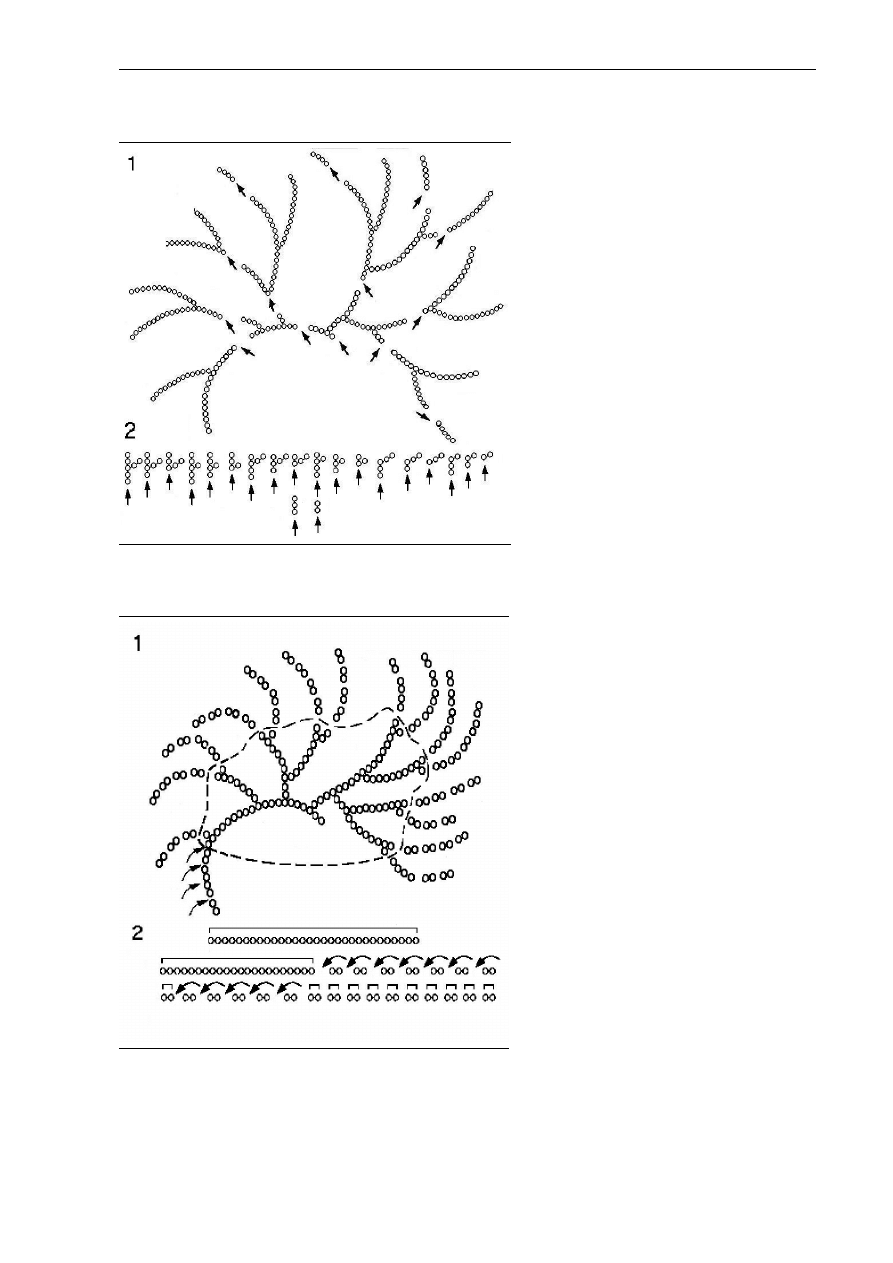
Rys. 2.1. Struktura przestrzenna białka: drugorzędowa (A), trzeciorzędowa
(B), czwartorzędowa (C)
Rys. 2.2. Przykładowa
struktura trzecio-
rzędowa cząsteczki
białka (w strukturze
drugorzędowej
widoczne
α
-helisy
i
β
-kartki)
Struktura czwartorzędowa (Rys. 2.1.C) określa wzajemne ułożenie dwóch lub
większej liczby łańcuchów polipeptydowych, z których każdy ma określoną organizację
pierwszo-, drugo- i trzeciorzędową.
4
Przegląd literatury – Enzymy
Enzymy mogą spełniać swoją funkcję biologiczną tylko wtedy, gdy występują w ściśle
określonej konformacji przestrzennej. Najistotniejszym elementem budowy enzymów,
decydującym o ich właściwościach katalitycznych, jest centrum aktywne, w którym w czasie
katalizowanej reakcji następuje związanie substratu. Zazwyczaj jest to względnie niewielka
część całej cząsteczki enzymu, stanowiąca określoną trójwymiarową przestrzeń, utworzoną
przez grupy funkcyjne aminokwasów. Aminokwasy te są zwykle oddalone od siebie w łańcuchu
polipeptydowym, a sąsiadują w przestrzeni wskutek powyginania tego łańcucha. Mogą to
również być reszty aminokwasów znajdujących się w odrębnych łańcuchach (Zgirski 1999,
Kączkowski 1999, Whitaker 2003).
2.1.3. Kinetyka reakcji enzymatycznych
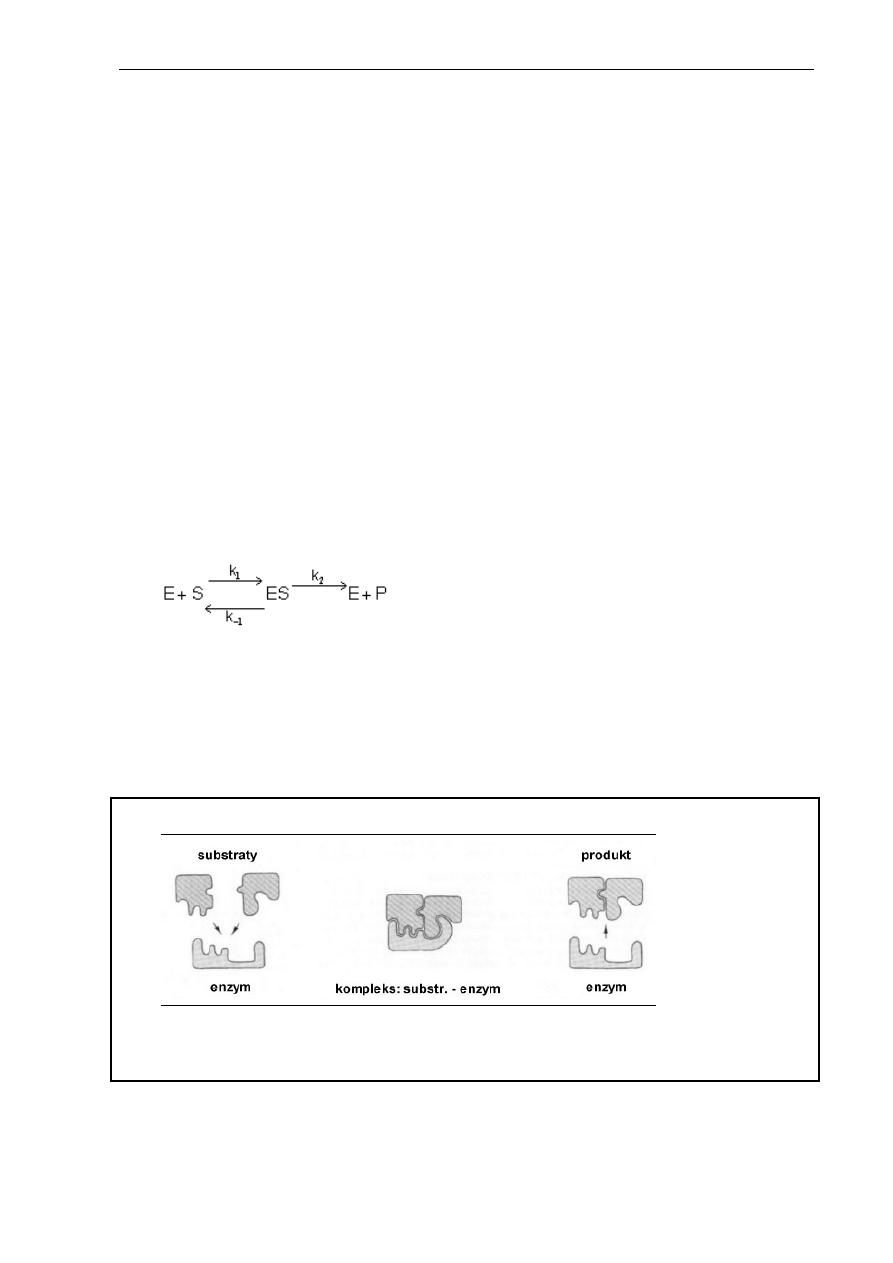
Koncepcję reakcji katalizowanej enzymatycznie zaproponowaną przez Michaelisa i Menten
przedstawiono równaniem 2.1. i na rysunku 2.3. Cząsteczki substratu (S) są wiązane
w określonym obszarze cząsteczki enzymu (E), w tzw. centrum aktywnym, tworząc kompleks
enzym-substrat (ES) (Marangoni 2003, Lee 1996b):
(2.1)
Mechanizm łączenia się enzymu z substratem ma charakter indukowanego dopasowania,
opierającego się na dopasowaniu kształtu enzymu do substratu lub odpowiedniej grupy
substratów i przekształceniu ich w produkty. W kompleksie ES cząsteczka enzymu wymusza
optymalne dla reakcji ułożenie cząsteczek substratów w przestrzeni. W trakcie tworzenia
kompleksu również w cząsteczce enzymu następują zmiany budowy przestrzennej (Rys. 2.3).
Rys. 2.3. Mechanizm reakcji katalizowanej enzymatycznie
5
Przegląd literatury – Enzymy
Po utworzeniu produktu (P) cząsteczka enzymu zostaje uwolniona, przybiera pierwotny
kształt i wchodzi w reakcję tworzenia kompleksu z kolejnymi cząsteczkami substratów. Taki
cykl przemian nosi nazwę „obrotu enzymu”.
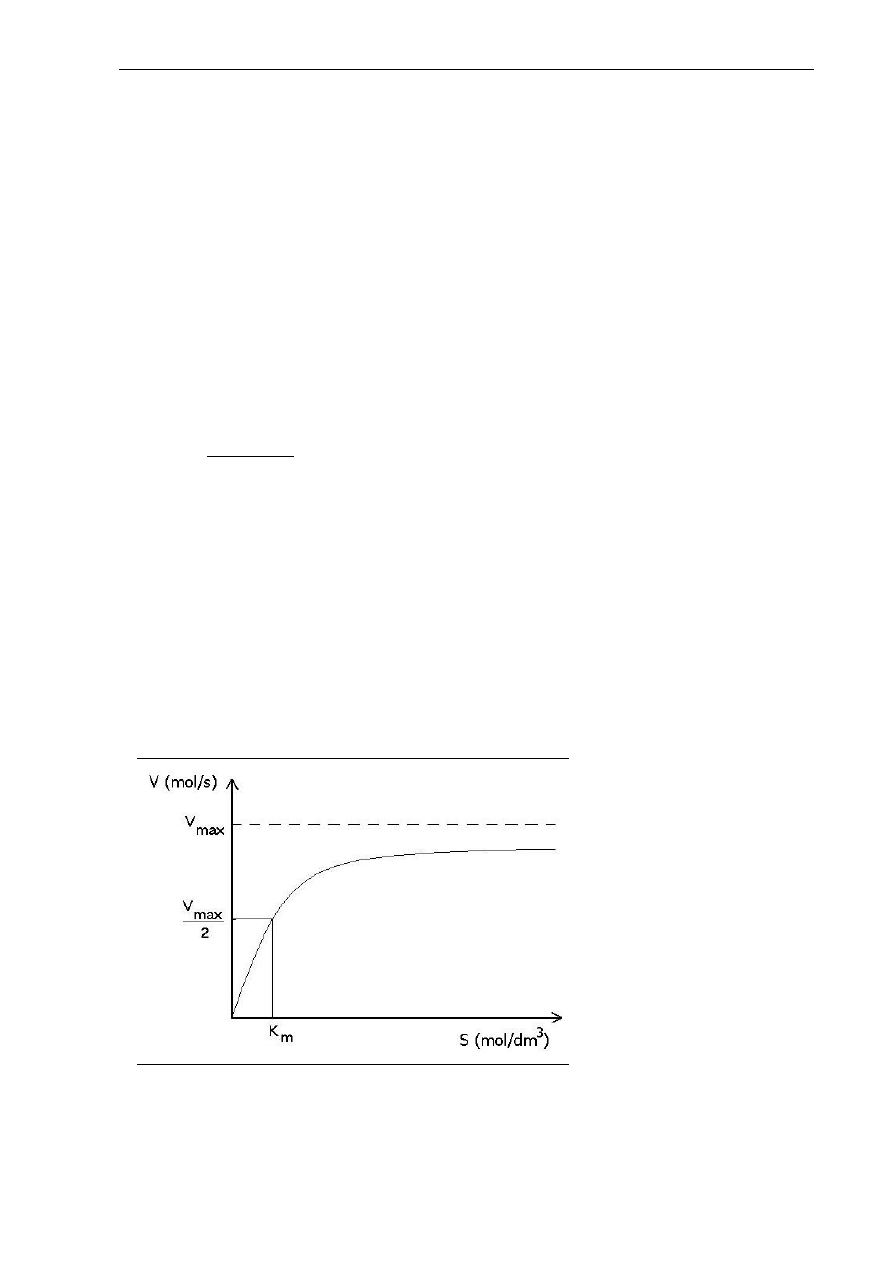
Szybkość procesu enzymatycznego zależy od łatwości tworzenia kompleksu enzymu
z substratem (powinowactwo enzymu do substratu). Przy małych stężeniach substratu
początkowa szybkość reakcji jest wprost proporcjonalna do stężenia substratu, natomiast przy
dużych stężeniach szybkość zmierza do wartości maksymalnej, to znaczy, że szybkość staje się
niezależna od stężenia substratu. W celu opisania tych obserwacji Michaelis i Menten
wyprowadzili równanie nazwane równaniem Michaelisa – Menten, określające zależność
szybkości reakcji enzymatycznych od stężenia substratu (Marangoni 2003):
]
[
]
[
max
S
K
S
V
V
m
+
⋅
=
(2.2)
gdzie:
V
- szybkość reakcji (mol produktu/s)
V
max
- maksymalna szybkość reakcji (mol produktu/s)
[
S
]
- stężenie substratu (mol/dm
3
)
K
m
- stała Michaelisa-Menten (mol/dm
3
)
Równanie to jest opisane krzywą hiperboliczną jak na rysunku 2.4. (Marangoni 2003, Lee
1996b).
Rys. 2.4. Zależność
między stężeniem
substratu a szybkością
reakcji enzymatycznej
Wprowadzając to równanie, Michaelis i Menten zdefiniowali nową stałą, zwaną stałą
Michaelisa-Menten K
m
. Stała ta jest wielkością charakterystyczną dla danego enzymu, zależy
6

Przegląd literatury – Enzymy
od substratu, na który działa enzym, temperatury i pH, nie zależy natomiast od stężenia
enzymu. Stała Michaelisa jest miarą powinowactwa enzymu do substratu: im wyższa tym
mniejsze powinowactwo. K
m
to wielkość liczbowa, określająca stężenie substratu (w molach na
litr roztworu), przy którym szybkość reakcji enzymatycznej jest równa połowie szybkości
maksymalnej, osiąganej przy wysyceniu enzymu substratem i niezależnej już od dalszego
wzrostu jego stężenia. Wartość K
m
jest różna dla poszczególnych substratów danego enzymu,
a dla większości enzymów znajduje się w granicach 10
-5
-10
-2
mol/dm
3
(Kączkowski 1999, Lee
1996b).
Kolejne czynniki wpływające na aktywność enzymów i szybkość reakcji enzymatycznych
opisano poniżej.
2.1.4. Czynniki wpływające na aktywność enzymów
Jedną z cech enzymów, stwarzającą duże trudności w badaniu ich struktury
i wykorzystaniu w praktyce, jest labilność powodująca inaktywację. Enzymy jako substancje
białkowe łatwo ulegają zmianom struktury pod wpływem takich warunków środowiska jak: pH,
temperatura, stężenie soli, co może wiązać się z utratą ich zdolności do pełnienia funkcji
katalitycznych. Ponieważ w procesie katalizy szczególną rolę odgrywa centrum aktywne
enzymu, ważne dla aktywności enzymu jest, aby konformacja właśnie tego fragmentu
pozostała w naturalnym stanie. Wiadomo jednak, że w skład centrum aktywnego wchodzą
grupy aminokwasów z oddalonych miejsc łańcucha polipeptydowego lub nawet z odrębnych
łańcuchów, dlatego czynniki oddziałujące na budowę całego enzymu mają wpływ na jego
funkcje. Zmiany w konformacji cząsteczki enzymu, uszkodzenie struktury przestrzennej białka
(denaturacja), prowadzą do utraty zdolności katalitycznych. Może to również być spowodowane
zablokowaniem centrum aktywnego, bez rozległych zmian w strukturze całej cząsteczki
(Kączkowski 1999, Zgirski 1999).
Głównymi czynnikami denaturującymi, powodującymi utratę aktywności enzymów są
podwyższona temperatura i pH.
2.1.4.1. Temperatura
Temperatura jest jednym z czynników wpływających istotnie na szybkość reakcji
enzymatycznych. Zgodnie z regułą van’t Hoffa szybkość reakcji wzrasta wraz ze wzrostem
temperatury, jednakże tylko w granicach temperatury, powyżej której rozpoczyna się
denaturacja białka. Szybkość denaturacji cieplnej białek enzymatycznych jest również wprost
proporcjonalna do temperatury, dlatego krzywa zależności szybkości reakcji enzymatycznej od
temperatury posiada najczęściej „optimum” (Rys. 2.5). Za temperaturę optymalną uważa
7
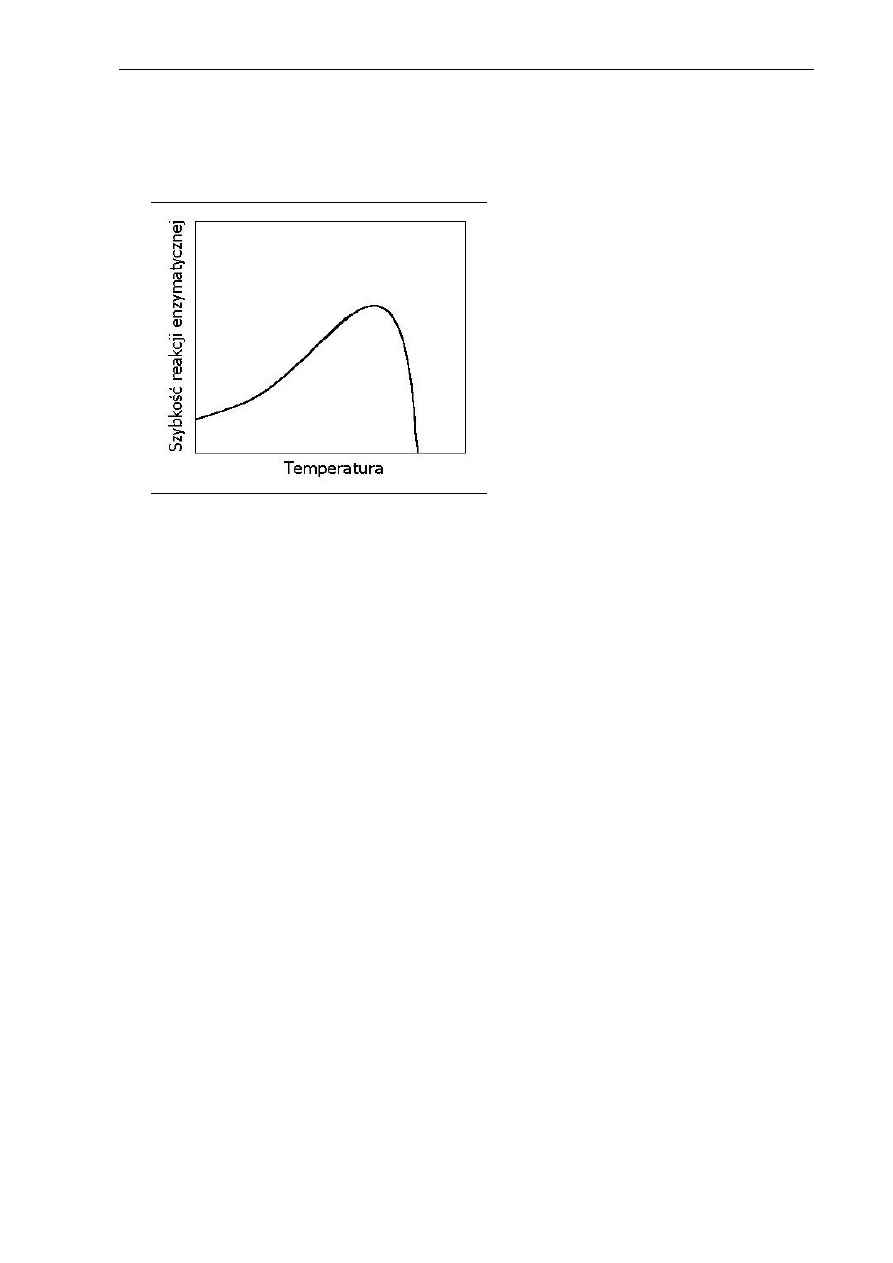
Przegląd literatury – Enzymy
się taką, przy której reakcja enzymatyczna przebiega najszybciej, ale równocześnie nie
obserwuje się denaturacji białka enzymu (Kączkowski 1999, Whitaker 2003).
Rys. 2.5. Wpływ temperatury na
szybkość reakcji enzymatycznej
Optymalna temperatura działania enzymów zależy od ich pochodzenia. Wartość ta dla
enzymów zwierzęcych znajduje się w pobliżu ciepłoty ciała, enzymy pochodzenia roślinnego
i mikrobiologicznego wykazują duże zróżnicowanie temperatury optymalnej, nawet do 90°C.
Denaturacja termiczna białek enzymatycznych wynika ze zwiększonej ruchliwości
atomów, prowadzącej do rozrywania wiązań stabilizujących strukturę przestrzenną białka oraz
wytwarzania połączeń powodujących przejście konformacji aktywnej cząsteczki w konformację
nieaktywną (Kączkowski 1999).
2.1.4.2. Stężenie jonów wodorowych
Każdy enzym ma optymalne pH działania, w którym szybkość katalizowanej reakcji jest
maksymalna. Niewielkie odchylenia od tej wartości powodują zmniejszenie szybkości reakcji.
Zmiany stopnia dysocjacji grup dysocjujących, występujących w resztach aminokwasowych
łańcucha peptydowego (zwłaszcza w sąsiedztwie centrum aktywnego enzymu) pod wpływem
wahań pH, powodują zmianę układu ładunków, a tym samym struktury trzeciorzędowej białka,
co zmniejsza aktywność enzymu. Większe odchylenia pH od wartości optymalnej prowadzą do
denaturacji białka, w wyniku zakłócania licznych słabych oddziaływań niekowalencyjnych
utrzymujących trójwymiarową strukturę cząsteczki.
Optimum pH dla większości enzymów występuje przy wartościach bliskich odczynu
obojętnego, ale ogólnie istnieje duże zróżnicowanie tej wartości wywołane różnicami
środowiska, w których enzymy działają. Przykładowo, enzym trawienny pepsyna jest
8

Przegląd literatury – Enzymy w technologii żywności
przystosowany do działania w kwaśnym środowisku żołądka (pH około 2) (Kączkowski 1999,
Whitaker 2003).
2.2. ENZYMY W TECHNOLOGII ŻYWNOŚCI
Człowiek praktycznie wykorzystywał działanie enzymów na długo przed tym, zanim
potrafił uzasadnić je naukowo. Na przykład dojrzewanie mięsa, produkcja napojów
alkoholowych praktykowane były już przez człowieka jaskiniowego. Opis słodowania jęczmienia
i fermentacji piwa znaleziono w dokumentach egipskich sprzed 2500 lat.
Termin „enzym” (z greckiego: w drożdżach) wprowadził do literatury William Kuhne
w 1897 r., po stwierdzeniu, że ekstrakt z komórek drożdży powoduje przemianę glukozy
w alkohol i dwutlenek węgla
(Warchalewski 2001).
Na początku XX wieku rozpoczęto wykorzystywanie enzymów w przetwórstwie żywności
na skalę przemysłową. Druga połowa XX wieku charakteryzowała się wysoką dynamiką
modernizacji procesów technologicznych w produkcji żywności, w której preparowane enzymy
zaczęły odgrywać znaczącą rolę. Wzrost przemysłowego zapotrzebowania na preparaty
enzymatyczne stymulował jednocześnie dynamiczny rozwój ich produkcji. W roku 1990 wartość
wyprodukowanych preparatów wynosiła ponad 600 milionów dolarów, z czego ponad 60 %
zastosowano w technologii żywności. W roku 1995 rynek enzymów sięgnął miliarda dolarów
(Warchalewski 2001).
Na początku XXI wieku trudno znaleźć przykład produkcji żywności przetworzonej bez
udziału preparatów enzymatycznych, a liczba stosowanych enzymów w przetwórstwie
spożywczym jest miarą jego nowoczesności. Jednocześnie produkcja i doskonalenie właściwości
enzymów jest ważnym obszarem działalności współczesnej biotechnologii (Bednarski 1997,
Warchalewski 2001).
2.2.1. Zastosowanie enzymów
Jak wcześniej wspomniano, enzymy są naturalnymi katalizatorami o wysokiej
specyficzności działania, znacznie przyspieszającymi lub wręcz umożliwiającymi zachodzenie
określonych przemian chemicznych w surowcach we względnie łagodnych warunkach. To
głównie te cechy enzymów wpłynęły na ich tak błyskawiczną i wcale nie mającą się ku końcowi
„karierę” w technologii żywności.
Wysoka specyficzność działania enzymów pozwala na sterowanie procesami
produkcyjnymi poprzez przeprowadzanie w danym surowcu przemiany, która na danym etapie
produkcji jest pożądana. Jednocześnie proces enzymatyczny może być łatwo kontrolowany
i przerwany. Łagodne warunki działania większości enzymów pozwalają na zachowanie
w surowcach składników mało odpornych na działanie podwyższonej temperatury (np.
9

Przegląd literatury – Enzymy w technologii żywności
witamin), co umożliwia otrzymanie produktów o wysokiej wartości żywieniowej. Kolejnymi
cechami enzymów wpływającymi na atrakcyjność ich zastosowania w przemyśle spożywczym
są: nietoksyczność (wynikająca z naturalnego pochodzenia), działanie w małych stężeniach
oraz brak ujemnego wpływu na cechy organoleptyczne produktu (Kączkowski 1999, Reps 2003,
Warchalewski 2001).
W nowoczesnej technologii żywności trudno wyobrazić sobie wytwarzanie wielu
podstawowych produktów żywnościowych, o cechach znanych i akceptowanych przez
konsumentów, bez udziału w procesach technologicznych odpowiednich preparatów
enzymatycznych. Najważniejsze korzyści płynące z ich zastosowania to:
-
możliwość uruchomienia produkcji nowych asortymentów żywności, w tym żywności
funkcjonalnej o właściwościach probiotycznych,
-
podniesienie jakości i atrakcyjności oraz wydłużenie trwałości produktów
żywnościowych,
-
przyspieszenie procesów technologicznych,
-
możliwość zwiększenia wydajności tradycyjnie stosowanych surowców,
-
możliwość włączenia do produkcji nowych surowców,
-
racjonalniejsze wykorzystanie produktów ubocznych,
-
zmniejszenie kosztów produkcji.
Większość enzymów stosuje się w przetwarzaniu surowców spożywczych jako substancje
pomocnicze. Po zakończeniu procesu są one inaktywowane i nie pełnią żadnej funkcji
w produkcie końcowym (Grajek 1999).
Zastosowanie preparatów enzymatycznych w praktyce jest szerokie, gdyż obejmuje
prawie wszystkie gałęzie przemysłu spożywczego.
Największe zastosowanie znalazły enzymy rozkładające skrobię (enzymy amylolityczne):
amylazy, amyloglukozydazy, glukoamylazy, pullanaza i izomeraza glukozowa. Enzymatyczną
hydrolizę skrobi przeprowadza się podczas wytwarzania maltodekstryn i syropów skrobiowych,
maltozowych i glukozowych, stosowanych m.in. w produkcji odżywek dla niemowląt, wyrobów
cukierniczych i piekarskich, mleka w proszku, sosów, keczupów, zabielaczy do kawy, słodzików,
dżemów. Wysokoscukrzone syropy służą także do otrzymywania karmelu używanego do
barwienia i nadawania specyficznego aromatu i smaku żywności oraz do wytwarzania glukozy
i syropów fruktozowych (Lee 1996a, Grajek 1999, Kączkowski 1999).
W przemyśle owocowym od dziesięcioleci stosowane są enzymy pektynolityczne
(katalizujące rozpad wiązań glikozydowych w pektynach). Główne kierunki ich zastosowania to:
obniżanie lepkości i ułatwianie klarowania soków, zapobieganie żelowaniu koncentratów,
10

Przegląd literatury – Enzymy w technologii żywności
zwiększanie wydajności tłoczenia soków owocowych i warzywnych, usuwanie pektyn lub
modyfikowanie ich struktury chemicznej (Grajek 1999).
Ważną rolę w przetwórstwie żywności odgrywają także enzymy proteolityczne
(rozkładające wiązania peptydowe). Stosuje się je w przemyśle mięsnym do zmiękczania mięsa
i produkcji hydrolizatów, piwowarskim do zapobiegania zmętnieniu piwa, serowarskim do
koagulacji białek mleka i dojrzewania serów (Kączkowski 1999).
Lista zastosowań preparatów enzymatycznych jest bardzo długa i ma tendencję wyraźnie
rosnącą, a przedstawione w tym punkcie mają charakter przykładowy.
2.2.1.1. Skrobia i enzymy amylolityczne
Skrobia jest głównym roślinnym materiałem zapasowym. Ze względu na
rozpowszechnienie w surowcach roślinnych jest głównym źródłem węglowodanów w diecie
człowieka. Produkty degradacji i modyfikacji enzymatycznej skrobi są szeroko stosowane jako
surowce w przetwórstwie żywności, z czego wynika duże zapotrzebowanie na enzymy
degradujące skrobię – enzymy amylolityczne.
Pod względem budowy chemicznej skrobia jest polisacharydem zbudowanym
z cząsteczek glukozy. Rozróżnia się dwie frakcje skrobi: amylozę i amylopektynę. Amyloza
tworzy proste długie łańcuchy, w których reszty glukozowe są połączone wyłącznie wiązaniami
α
-1,4-glikozydowymi. Amylopektyna jest tworem rozgałęzionym zbudowanym z krótkich,
prostych łańcuchów połączonych wiązaniami
α
-1,4-glikozydowymi, powiązanych między sobą
wiązaniami
α
-1,6-glikozydowymi.
Podstawą klasyfikacji enzymów i nadawania im numerów EC przez Międzynarodową Unię
Biochemii i Biologii Molekularnej (International Union of Biochemistry and Molecular Biology)
jest rodzaj katalizowanego wiązania (Kuriki i Imanaka, 1999). W przypadku grupy enzymów
nazywanych
α
-amylazami (4-glukanohydrolaza-
α
-1,4-glukanu, EC 3.2.1.1.) reakcją tą jest
hydroliza wiązania
α
-1,4-glikozydowego znajdującego się w środku łańcucha w oligo-
i polisacharydach zawierających grupy
D
-glukozy połączone wiązaniami
α
-1,4-glikozydowymi.
Występujące w amylopektynach wiązania
α
-1,6-glikozydowe nie stanowią przeszkody dla
działania tego enzymu (Nielsen i Borchert 2000, Achremowicz i Wójcik 2000). Produktami
działania
α
-amylaz są dekstryny niskocząsteczkowe. Schematycznie działanie
α
-amylazy na
amylopektynę przedstawiono na rysunku 2.6.
11
Przegląd literatury – Enzymy w technologii żywności
Rys. 2.6. Działanie
α
-amylazy na
amylopektynę: miejsce działania
enzymu (), amylopektyna
częściowo rozłożona (1), amylo-
pektyna całkowicie rozłożona (2),
reszty glukozowe (o)
Rys. 2.7. Działanie
β
-amylazy na
skrobię: miejsce działania enzymu
(), frakcja amylopektyny (1)
i amylozy (2), obszar dekstryny
granicznej (
), reszty glukozowe
(o)
Inny mechanizm działania na skrobię wykazują
β
-amylazy. Są to enzymy egzogenne,
atakujące łańcuchy wielocukru, poczynając od nieredukującego końca, kolejno odszczepiając
12

Przegląd literatury – Enzymy w technologii żywności
cząsteczki maltozy. Wiązania
α
-1,6-glikozydowe występujące w amylopektynach stanowią
przeszkodę dla działania tych enzymów, więc końcowym produktem reakcji jest maltoza i tzw.
dekstryna graniczna (Rys. 2.7).
Pod względem budowy chemicznej i strukturalnej
α
-amylazy stanowią charakterystyczną,
jednorodną grupę białek o masie molowej pomiędzy 45 a 60 kDa. Kompletna sekwencja
aminokwasowa łańcucha polipeptydowego jest znana dla ponad pięćdziesięciu rodzajów
α
-amylaz. Wszystkie składają się z jednego łańcucha polipeptydowego, a w ich strukturze
trzeciorzędowej wyróżnia się dwie główne domeny A i B oraz trzecią, nieregularnie poskręcaną
domenę C (Janeček i Baláž 1992, Kuriki i Imanaka 1999, Lévêque i wsp. 2000). Są to białka
lekko kwaśne (co wynika ze znacznej zawartości kwasu asparaginowego i glutaminowego),
rozpuszczalne w wodzie. Zawierają prawie wszystkie aminokwasy, bogate są w tyrozynę
i tryptofan. Jedynie w amylazie z
Bacillus subtilis
nie wykryto cysteiny i cystyny. Biologiczna
aktywność oraz trwałość
α
-amylaz jest uwarunkowana zawartością jonów wapniowych
(Achremowicz i Wójcik 2000). Wszystkie
α
-amylazy są metalo-enzymami zawierającymi
przynajmniej jeden jon Ca
2+
w cząsteczce, który jest istotny dla ich aktywności i stabilności
(Janeček i Baláž 1992).
Dekstrynizująca
α
-amylaza z
Aspergillus oryzae
(np. Fungamyl 800L firmy
Novozymes A/S), w literaturze nazywana Taka-amylazą A, jest najdawniej i najczęściej
wykorzystywanym enzymem w przemyśle spożywczym, a także jednym z lepiej poznanych
enzymów z grupy
α
-amylaz. To właśnie produkcji tego enzymu dotyczył pierwszy patent
otrzymywania preparatu enzymatycznego syntetyzowanego przez drobnoustroje uzyskany
w 1894 r. w USA. W piekarstwie enzym ten jest szeroko stosowany, ze względu na
przyspieszanie procesu fermentacji ciasta przez drożdże (Reps 2003, Rutkowski i Sawicka-
Żukowska 2002). Poza tym znalazł szereg zastosowań, np. w browarnictwie, przemyśle
cukierniczym oraz przy produkcji napojów, maltodekstryny, koncentratów spożywczych (Grajek
1999).
Strukturę przestrzenną
α
-amylazy z
Aspergillus oryzae
przedstawiono na rysunku 2.8. Po
raz pierwszy została ona przedstawiona przez Matsuura i wsp. w 1984 r (Kuriki i Imanaka,
1999). Enzym ten jest zbudowany z 478 grup aminokwasowych w strukturze
pierwszorzędowej, zawiera jeden jon wapnia (Ninomiya i wsp. 2001, Janeček i Baláž 1992).
W strukturze trzeciorzędowej wyróżnia się trzy domeny stabilizowane czterema mostkami
siarczkowymi. W skład centrum aktywnego wchodzą trzy grypy aminokwasowe oddalone od
siebie w łańcuchu polipeptydowym: Asp-206, Glu-230, Asp-297 (Kuriki i Imanaka 1999,
Janeček i Baláž 1992). Optymalna temperatura działania tego enzymu wynosi 50 - 55°C,
a optymalne pH to 4,8 – 5,8 (Achremowicz i Wójcik 2000).
13

Przegląd literatury – Enzymy w technologii żywności
Rys. 2.8. Struktura przestrzenna
α
-amylazy z Aspergillus oryzae
2.2.2. Metody produkcji preparatów enzymatycznych
Enzymy mogą być otrzymywane z tkanek roślinnych i zwierzęcych, jednak ze względu na
ograniczenie tych źródeł ich produkcji coraz większego znaczenia nabiera wykorzystywanie
metod biotechnologicznych (Reps 2003). Obecnie zdecydowana większość preparatów enzyma-
tycznych stosowanych w przemyśle spożywczym jest otrzymywana metodą mikrobiologiczną.
Wynika to z możliwości biosyntezy przez mikroorganizmy enzymów o różnej specyficzności przy
niskich kosztach ich wytwarzania (Czapski 2001). Dzięki rozwojowi biotechnologii istnieje także
możliwość otrzymywania nowych preparatów, których nie można było uzyskać ze źródeł
tradycyjnych (Reps 2003). Najczęściej stosowanymi mikroorganizmami są te z gatunków
Bacillus
i
Aspergillus
.
W połowie lat 70–tych po raz pierwszy do produkcji enzymów w skali przemysłowej
została wykorzystana inżynieria genetyczna (Czapski 2001). Podstawową przyczyną
prowadzenia ukierunkowanych modyfikacji genów mikroorganizmów odpowiedzialnych za
wytwarzanie enzymów do celów przemysłowych stanowił fakt, że biokatalizatory wytwarzane
przez swych naturalnych producentów zazwyczaj nie wykazywały odpowiednio wysokiej
aktywności i stabilności w warunkach optymalnych z technologicznego punktu widzenia (pH,
temperatura, ciśnienie itp.). Natomiast odpowiednio skonstruowane mikroorganizmy
modyfikowane genetycznie (GMO) mogą wytwarzać enzymy charakteryzujące się wysoką
stabilnością i aktywnością biologiczną. Metodami inżynierii genetycznej doprowadza się do
zmian w budowie strukturalnej białek enzymów, zmieniając także ich cechy, jak
np.: właściwości kinetyczne, termostabilność, temperaturę i pH optymalnego działania,
14

Przegląd literatury – Enzymy w technologii żywności
stabilność i aktywność w niewodnych roztworach, specyficzność substratową i reakcyjną
(Bednarski 1997, Warchalewski 2001).
Zoptymalizowane biokatalizatory, wytwarzane przez GMO, pozwoliły na podniesienie
wydajności produkcji, obniżenie jej kosztów oraz lepsze wykorzystanie surowców i zmniejszenie
ilości odpadów w wielu gałęziach przemysłu spożywczego. Ułatwiły ponadto produkcję licznych
prozdrowotnych składników żywności (prebiotyki, błonnik pokarmowy itp.). GMO mogą też
wytwarzać z odpowiednią wydajnością wiele enzymów roślinnych i zwierzęcych, których
pozyskiwanie ze źródeł naturalnych jest niewystarczające w stosunku do potrzeb (Kalinowska
i wsp. 2000). Przykładem potwierdzającym osiągnięcia w tej dziedzinie jest wdrożenie
technologii produkcji reniny (której deficyt wynika z ograniczenia uboju cieląt) przez
genetycznie modyfikowane szczepy
Kluyveromyces marxianus
,
Aspergillus niger, Escherichia
coli
, do genomu których wprowadzono geny trawieńców cielęcych odpowiedzialnych za
biosyntezę wymienionego enzymu (Bednarski 1997, Dajnowiec i wsp. 1997, Warchalewski
2001).
Żywność genetycznie modyfikowana budzi w społeczeństwie wiele obaw. W przypadku
enzymów produkowanych przez mikroorganizmy modyfikowane genetycznie obawy te powinny
być znacznie mniejsze, ponieważ preparaty nie zawierają zmodyfikowanego materiału
genetycznego, a produkt końcowy jest taki sam, jak otrzymany z zastosowaniem tradycyjnych
preparatów enzymatycznych.
2.2.3. Jakość i formy preparatów enzymatycznych
Aby preparaty enzymatyczne mogły właściwie spełniać swoje funkcje w procesie
produkcyjnym, muszą się charakteryzować wysoką jakością. O jakości decyduje ich aktywność,
czyli zdolność do spełniania określonej funkcji biologicznej (Strumiłło i wsp. 1991). Równie
istotną cechą wpływającą na przydatność preparatów jest ich trwałość, która jest ściśle
związana z formą preparatu.
Preparaty materiałów pochodzenia mikrobiologicznego są produkowane w dwóch
podstawowych formach: jako preparaty płynne lub w formie suchej sproszkowanej. Preparaty
w formie płynnej charakteryzują się niską aktywnością jednostkową (zwłaszcza te o niskim
stężeniu) oraz małą trwałością, wynikającą ze znacznej zawartości wody w układzie. Ponadto
ich wadami są: trudności w transporcie i przechowywaniu oraz wysokie koszty tych operacji
(wynikające z dużej objętości), konieczność instalowania kosztownej armatury oraz trudności
w utrzymaniu higieny linii produkcyjnej w miejscu dozowania preparatu.
W porównaniu z tymi preparatami materiały w postaci suchej sproszkowanej lub
unieruchomione na nośnikach odznaczają się wieloma zaletami. Przede wszystkim, dzięki
15

Przegląd literatury – Suszenie enzymów
usunięciu znacznej ilości wody, uzyskuje się zwiększoną aktywność jednostkową i wysoką
trwałość. Nie występuje też problem transportowania i przechowywania dużych ilości płynu,
przez co koszty tych operacji ulegają zmniejszeniu. Stosowanie tej formy preparatów sprzyja
także utrzymaniu higieny produkcji oraz ułatwia jej automatyzację i mechanizację.
2.3. SUSZENIE ENZYMÓW
Suszeniem nazywa się zespół operacji technologicznych mających na celu obniżenie
zawartości wody w produkcie poprzez jej odparowanie (lub niekiedy sublimację) (Pijanowski
i wsp. 1996). Jest to najstarsza metoda utrwalania żywności, w prymitywnych formach
stosowana już w epoce neolitu.
Suszenie jest procesem równoczesnej wymiany ciepła i masy. Ciepło przemiany fazowej
dostarczane jest z zewnątrz, najczęściej poprzez ogrzewanie konwekcyjne. Siłą napędową
procesu jest różnica między prężnością pary wodnej na powierzchni materiału a prężnością
pary wodnej w otaczającym gazie. Odparowywana woda jest w sposób ciągły usuwana
z otoczenia produktu, najczęściej w wyniku konwekcji, za pomocą tego samego czynnika, za
pomocą którego dostarczane jest ciepło. Proces odparowania rozpoczyna się od
odparowywania wody znajdującej się na powierzchni materiału, do chwili, gdy opory
wewnętrznego ruchu masy zaczynają być większe od oporów konwekcyjnego przenoszenia
masy. Następnie o przebiegu procesu decyduje wewnętrzne przenoszenie masy – woda
zawarta w materiale jest transportowana do powierzchni, a następnie wnika do
przepływającego strumienia gazu (Lewicki 1999b).
Szybkość suszenia można zwiększać poprzez zwiększenie szybkości przepływu gazu,
zwiększanie jego temperatury i obniżanie jego wilgotności (Lewicki 1999b, Pijanowski i wsp.
1996)
Suszenie enzymów jest trudnym zadaniem ze względu na ich termolabilność, wynikającą
z charakteru białkowego, oraz ze względu na zmiany właściwości w czasie suszenia. Metoda
suszenia powinna być dobierana indywidualnie dla każdego enzymu. Pod uwagę muszą być
brane początkowe właściwości enzymu, konieczna jest także znajomość zmian (np. odporności
na podwyższoną temperaturę), jakie powoduje proces suszenia (Witrowa-Rajchert i Samborska
2002, Adamiec i wsp. 1995).
2.3.1. Metody suszenia
Do suszenia materiałów biologicznie czynnych, jakimi są enzymy, mogą być stosowane
różne metody. Możliwość zastosowania tradycyjnego suszenia konwekcyjnego (w tym np.
fluidyzacyjnego) jest w znacznym stopniu ograniczona, ze względu na długi czas procesu
(przebywania materiału w środowisku o podwyższonej temperaturze). Utrudnieniem
16

Przegląd literatury – Suszenie enzymów
w przeprowadzeniu tego rodzaju suszenia jest również fakt, że enzymy po procesie fermentacji
występują w formie płynnej. Metodą, która w znacznym stopniu umożliwia wyeliminowanie
wpływu podwyższonej temperatury jest suszenie sublimacyjne. Proces ten polega na
usunięciu wody z materiału poprzez jej zamrożenie, a następnie sublimację lodu do pary
wodnej. Proces odwadniania odbywa się przy obniżonym ciśnieniu i może trwać nawet
kilkanaście godzin. Zaletą tej metody suszenia jest dobre zachowanie w produkcie pierwotnych
biologicznych cech surowca, ze względu na to, że materiał nie jest poddawany działaniu
podwyższonej temperatury. Wadami są długi czas oraz wysokie koszty procesu (Pijanowski
i wsp. 1996, Witrowa-Rajchert i Samborska 2002, Mellor i Bell 2003).
W porównaniu z wymienionymi metodami, bardzo atrakcyjną metodą suszenia enzymów
jest suszenie rozpyłowe. W praktyce jest to najczęściej stosowana metoda dehydracji tego
rodzaju materiałów.
2.3.1.1. Suszenie rozpyłowe
Suszenie rozpyłowe jest najbardziej rozpowszechnionym sposobem suszenia żywności
płynnej oraz produkcji stałych preparatów enzymatycznych (Fu i wsp. 1995, Okello i wsp.
1998). Jest to proces prowadzący do otrzymania z wyjściowego płynnego surowca suchego
produktu końcowego w postaci proszku, w wyniku jednej ciągłej i krótkiej operacji. Operacja ta
polega w zasadzie na rozdrobnieniu cieczy do postaci mgły (kropelki o średnicy 10 – 200
µ
m),
która wewnątrz zamkniętej przestrzeni (komory suszarki) styka się z gorącym nienasyconym
powietrzem. Dzięki uzyskanej olbrzymiej powierzchni cieczy woda jest odparowywana w bardzo
krótkim czasie (1 – 20 s).
Bardzo istotnym zjawiskiem obserwowanym w czasie suszenia jest tzw. „efekt
chłodzący odparowania”. Prawie całe ciepło dostarczone do komory suszenia ze
strumieniem gazu suszącego jest zużywane na proces odparowania. Z suszonych cząstek
pobierane jest ciepło przemiany fazowej parującej wody. W rezultacie, pomimo wysokiej
temperatury powietrza wprowadzanego do komory suszarki, temperatura materiału suszonego
jest względnie niska. Przyjmuje się, że temperatura powierzchni suszonych cząstek osiąga
temperaturę termometru mokrego powietrza wylotowego (Van Arsdel 1963, Pijanowski
i wsp. 1996, Adamiec i wsp. 1995, Ståhl i wsp. 2002, Brennan 2003). Ta właściwość suszenia
rozpyłowego sprawia, że metoda ta może być stosowana do suszenia materiałów o małej
odporności na podwyższoną temperaturę, jak np. kultury starterowe bakterii czy enzymy.
Końcowy materiał o wysokiej aktywności można otrzymać tylko po starannym doborze
odpowiednich warunków suszenia do każdego materiału. Najistotniejszymi parametrami są
17

Przegląd literatury – Suszenie enzymów
temperatura powietrza wylotowego oraz różnica temperatury pomiędzy powietrzem wlotowym
a wylotowym (Belghith i wsp. 2001, Ståhl i wsp. 2002).
Okello i wsp. (1998), susząc rozpyłowo oksydazę polifenolową, stwierdzili, że jej
aktywność zależy od temperatury powietrza wylotowego, a w mniejszym stopniu od
zawartości suchej substancji w wyjściowym surowcu. Przykładowo, aktywność enzymu
wyniosła 86,5 % początkowej aktywności przed suszeniem, gdy temperatura powietrza
wylotowego była równa 80
°
C, a wzrost temperatury wylotowej do 100
°
C spowodował
obniżenie aktywności do 18,8 %. Natomiast produkt uzyskiwany w warunkach, gdy
temperatura powietrza opuszczającego suszarkę osiągnęła 120
°
C charakteryzował się
zerową aktywnością. Wyniki badań przedstawione przez Etzel’a i wsp. (1996) wskazują na
prostoliniową zależność między temperaturą wylotową w czasie suszenia rozpyłowego a
aktywnością suszonej fosfatazy. Enzym ten, suszony w temperaturze powietrza wylotowego
80
°
C, wykazywał aktywność względną 81 %, w temperaturze 100
°
C – 45 % a w
temperaturze 120
°
C – 8,1 %.
Istotnym parametrem jest również wielkość kropel rozpylonego materiału w czasie
suszenia. Wielkość ta jest wynikiem zastosowanego natężenia przepływu surowca przy
wlocie do dysku rozpylającego (lub dyszy) lub prędkości obrotowej dysku, oraz warunkuje
całkowitą wielkość powierzchni odparowania, czas suszenia cząstek, ilość ciepła zużytego na
odparowanie, a przez to temperaturę powietrza wylotowego.
Według Fu i wsp. (1995) inaktywacja enzymów w czasie suszenia rozpyłowego może
być zredukowana poprzez zmniejszanie rozmiaru rozpylanych kropel oraz obniżanie
temperatury powietrza wylotowego. Meerdink i van’t Riet (1991, 1995), porównując dane
dotyczące kinetyki inaktywacji
α
-amylazy przy różnej zawartości wody z inaktywacją w
czasie suszenia rozpyłowego, stwierdzili, że ta metoda dehydracji jest korzystna do suszenia
tego enzymu. Wynika to z właściwości
α
-amylazy, która charakteryzuje się zwiększającą
odpornością na podwyższoną temperaturę wraz z obniżaniem zawartości wody. Suszenie
metodą rozpyłową pozwala na otrzymanie aktywnego preparatu enzymatycznego, ponieważ
w czasie szybkiego odparowania osiąga się szybkie przejście przez zakres zawartości wody,
w którym
α
-amylaza ma niższą termostabilność. Również Sadykow i wsp. (1997) podają, że
podczas suszenia rozpyłowego temperatura, do której może być ogrzewana
α
-amylaza, bez
powodowania zwiększenia inaktywacji, wzrasta wraz z usuwaniem wody.
Według Ståhl i wsp. (2002) inaktywacja enzymów w czasie suszenia rozpyłowego
zależy głównie od czynników wpływających na temperaturę powietrza wylotowego, która
powinna być utrzymywana na odpowiednio niskim poziomie. Zwiększanie temperatury
powietrza wlotowego oraz zmniejszanie szybkości podawania surowca do dysku
rozpylającego powodują wzrost
18
Przegląd literatury – Rola wody w procesach fizycznych i biochemicznych
temperatury powietrza wylotowego, a zatem i wzrost degradacji suszonego enzymu. Badano
wpływ temperatury powietrza wlotowego i szybkości podawania surowca do dysku
rozpylającego na degradację insuliny. Miarą degradacji insuliny było stężenie białek wysoko
cząsteczkowych (HMWP) – produktów agregacji i denaturacji insuliny. Przykładowo, po
suszeniu w temperaturze powietrza wlotowego 120°C stężenie produktów degradacji
wynosiło 1,29 %, gdy szybkość podawania surowca do dysku rozpylającego wynosiła
300 ml/h. Po zmniejszeniu tej szybkości do 120 ml/h i suszeniu w tej samej temperaturze
powietrza wlotowego zawartość produktów degradacji wzrosła do 2,36 %. Zmniejszenie
szybkości zasilania surowcem w podanym zakresie spowodowało wzrost temperatury
powietrza wylotowego z 137 do 141°C.
Niezaprzeczalnie, bardzo duży wpływ na zachowanie aktywności i stabilności enzymów,
w czasie procesów technologicznych oraz przechowywania, ma występująca w układzie
enzymatycznym woda. Jej zawartość i aktywność, a także interakcje jej cząsteczek z różnymi
związkami oraz wpływ wody na stan fizyczny materiałów, decydują o trwałości i aktywności
enzymów. Zależności te przedstawiono szczegółowo w kolejnym rozdziale.
2.4. ROLA WODY W PROCESACH FIZYCZNYCH I BIOCHEMICZNYCH
Woda jest jednym z głównych składników żywności, który w znaczący sposób wpływa na
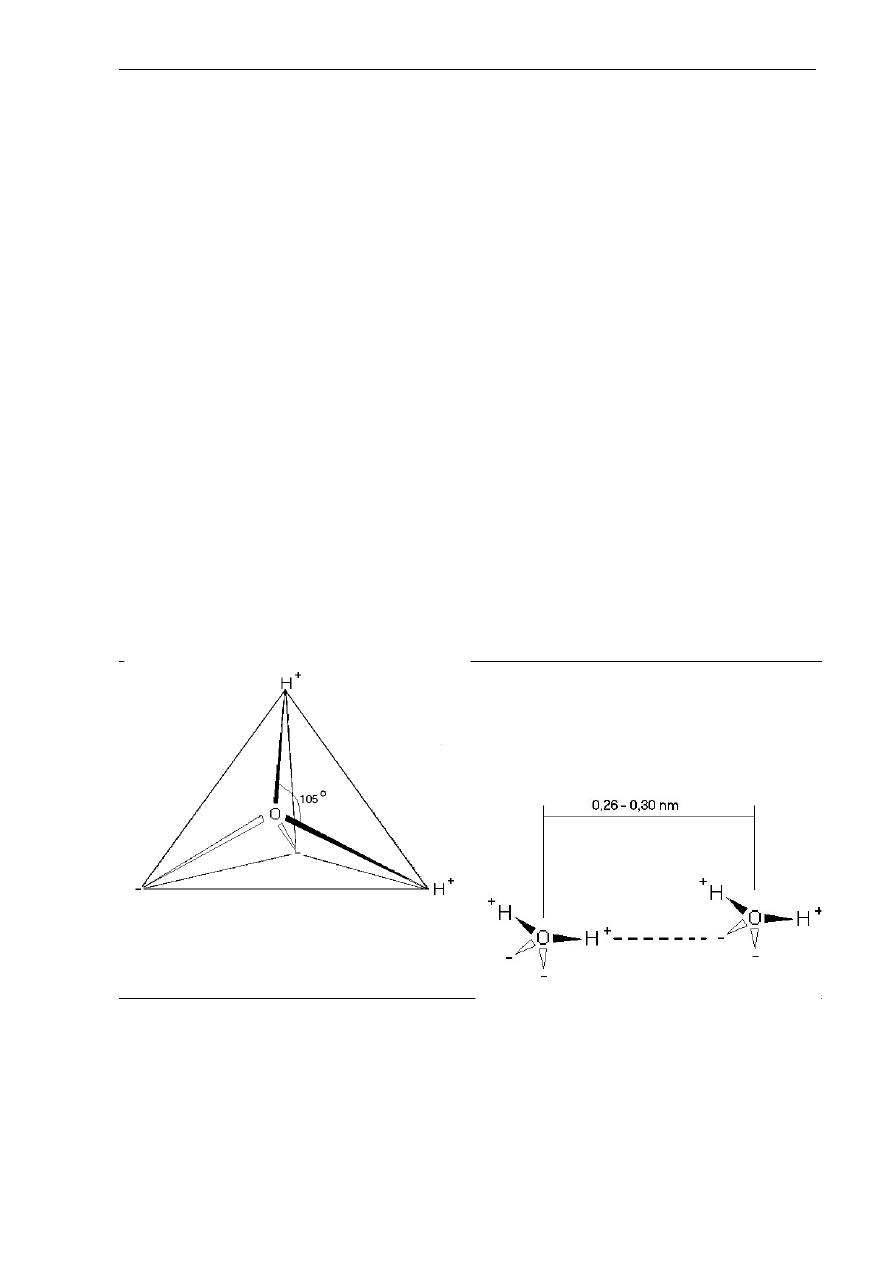
jej stabilność, jakość oraz właściwości fizyczne (Lewicki 2004). W skład cząsteczki wody
wchodzą dwa atomy wodoru ułożone względem siebie pod kątem 105° oraz jeden atom tlenu
umieszczony centralnie w tetragonalnej strukturze przestrzennej cząsteczki (Rys. 2.9).
Rys. 2.9. Struktura przestrzenna
cząsteczki wody
Rys. 2.10. Wiązanie wodorowe między
cząsteczkami wody
19

Przegląd literatury – Rola wody w procesach fizycznych i biochemicznych
Cząsteczka wody ma charakter dipolowy (polarny, biegunowy). W rogach struktury
tetragonalnej w miejscu atomów wodoru występują resztkowe ładunki dodatnie, a w dwóch
pozostałych rogach ładunki ujemne pochodzące od wolnych par elektronowych atomu tlenu.
Odległość między środkiem a rogiem tetraedru wynosi 0,099 nm (Lewicki 2004).
Występowanie cząstkowych ładunków w rogach przestrzennej tetragonalnej struktury
cząsteczki wody jest przyczyną powstawania interakcji między sąsiadującymi cząsteczkami
wody oraz z różnymi grupami i wiązaniami chemicznymi. Tworzą się słabe ukierunkowane
wiązania o długości 0,26 – 0,30 nm, nazywane wiązaniami wodorowymi (Rys. 2.10). Są
one słabsze niż wiązanie jonowe lub kowalencyjne, lecz silniejsze niż siły przyciągania
międzycząsteczkowego Van der Waalsa, a ich energia wynosi 21 kJ/mol. Tworzenie wiązania
wodorowego jest cechą charakterystyczną atomu wodoru wykazującego powinowactwo do
elektroujemnych atomów jak tlen czy azot, dzielących swe elektrony z wodorem. Ponieważ
w cząsteczce wody występują dwa atomy wodoru i dwie wolne pary elektronowe, jest ona
szczególnie podatna na tworzenie tego typu wiązań – jedna cząsteczka wody może tworzyć
cztery wiązania wodorowe (Pijanowski i wsp. 1996, Pierce 2003).
2.4.1. Aktywność wody
Zawartość wody w produktach spożywczych jest bardzo różna i może wynosić od
zaledwie kilku do blisko 100 %. Już człowiek pierwotny zauważył, że żywność o wysokiej
zawartości wody jest bardziej podatna na zachodzenie niekorzystnych zmian prowadzących do
obniżenia jej jakości i trwałości. Stąd wzięło się suszenie na słońcu. Nieco później zauważono,
że dodatek pewnych substancji, jak sól czy cukier, pomaga zwiększyć trwałość produktów
żywnościowych. Sól była jednym z najcenniejszych minerałów już w epoce neolitu. Praktyczne
zastosowanie takich metod utrwalania żywności jak suszenie i solenie wpłynęło na rozwój
żeglugi morskiej i pozwoliło dowieść ponad wszelką wątpliwość, że Ziemia jest okrągła, że
Pacyfik i Atlantyk to dwa odrębne oceany i że obie Ameryki leżą między nimi (Davies 2001).
Dzisiaj stwierdzenie, że zawartość wody jest głównym czynnikiem wpływającym na
trwałość żywności ma znaczenie jedynie historyczne. Wiadomo, że czynnikiem decydującym
o możliwości zachodzenia niekorzystnych reakcji prowadzących do „psucia” żywności jest
dostępność wody i sposób jej związania, a nie jej bezwzględna ilość (Acker 1969, Ross 2003).
Do określenia stopnia dostępności wody (lub jej powiązania ze składnikami żywności)
najczęściej stosuje się pojęcie aktywności wody, po raz pierwszy zaproponowane przez
Scotta w 1953 r. Aktywność wody
a
w
w żywności jest definiowana jako stosunek ciśnienia pary
wodnej nad żywnością
p
do ciśnienia pary wodnej nad czystą wodą
p
0
w tej samej
20
Przegląd literatury – Rola wody w procesach fizycznych i biochemicznych
temperaturze. Może być też definiowana jako równowagowa wilgotność względna
RWW
, przy
której produkt ani nie zyskuje ani nie traci wilgoci (Scott 1953, Pijanowski i wsp. 1996):
100
0
RWW
p
p
a
W
=
=
(2.3)
W produktach żywnościowych wodę wykazującą ciśnienie pary równe ciśnieniu czystej
wody nazywa się wodą wolną. Jej występowanie (jako rozpuszczalnik, środowisko reakcji lub
substrat) jest warunkiem koniecznym do zachodzenia reakcji chemicznych, enzymatycznych
oraz wzrostu drobnoustrojów. Część wody występuje w postaci tzw. wody związanej,
nazywanej też wodą strukturalną. Nie jest ona dostępna, tzn. nie stanowi środowiska dla
rozwoju mikroorganizmów ani substratu reakcji chemicznych i enzymatycznych. Woda
związana wykazuje mniejsze ciśnienie pary wodnej niż ciśnienie nad czystą wodą w tej samej
temperaturze (Brennan 2003).
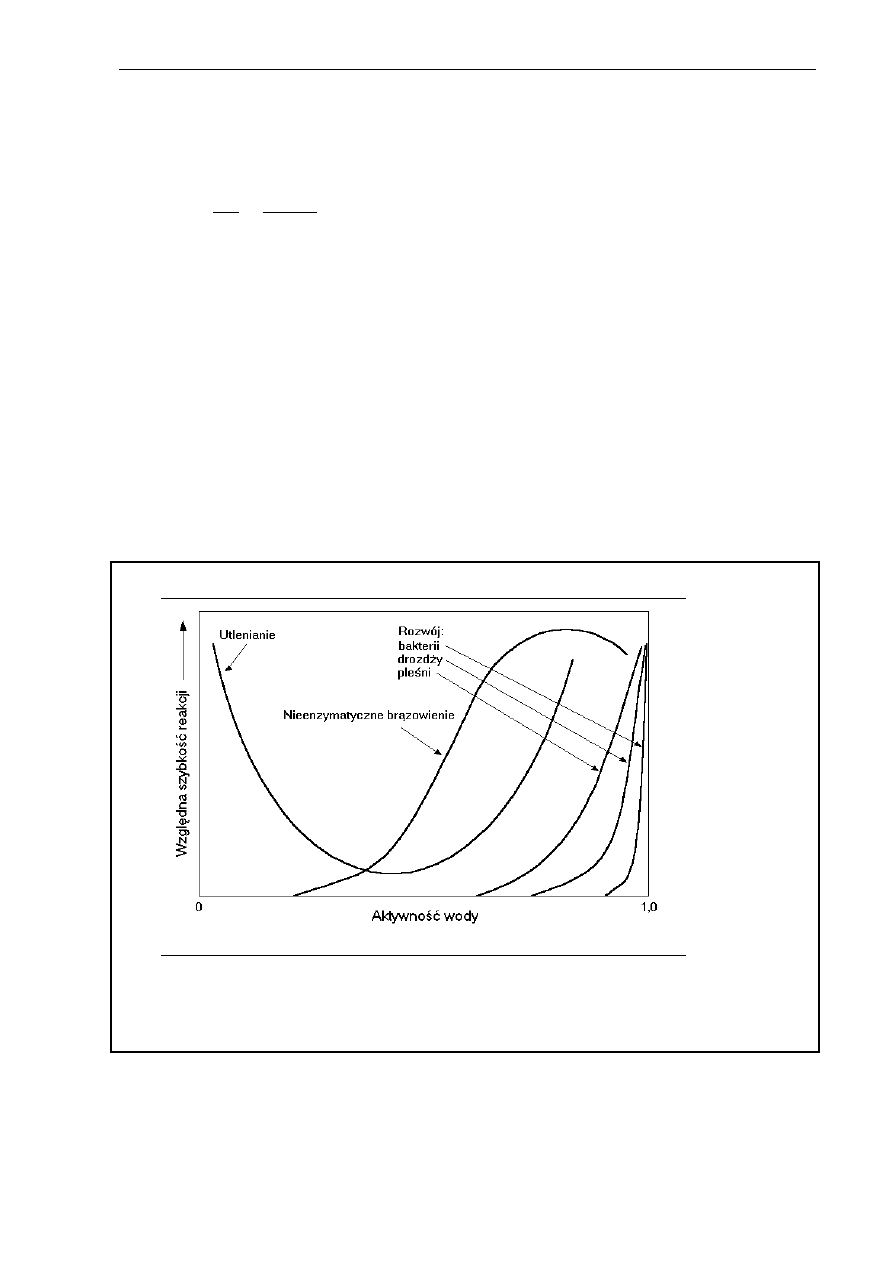
Wpływ aktywności wody na względną szybkość reakcji chemicznych i rozwój
drobnoustrojów przedstawiono na rysunku 2.11.
Rys. 2.11. Wpływ aktywności wody na względną szybkość reakcji
chemicznych i rozwój drobnoustrojów (Pierce 2003)
21

Przegląd literatury – Rola wody w procesach fizycznych i biochemicznych
2.4.2. Hydratacja i interakcje wody z innymi składnikami
Woda pod względem fizycznym nie stanowi jednorodnej substancji – jej właściwości
zmieniają się na skutek rozmaitych interakcji, zarówno między jej cząsteczkami jak i pomiędzy
cząsteczkami kontaktujących się z nią substancji (Pijanowski i wsp. 1996).
Zjawisko oddziaływania rozpuszczalnika z cząsteczkami substancji rozpuszczonej
nazywane jest solwatacją. Hydratacja jest szczególnym przypadkiem solwatacji,
gdy rozpuszczalnikiem jest woda. Gdy w substancji rozpuszczonej występują grupy polarne,
mechanizm hydratacji jest zdominowany przez tworzenie wiązań wodorowych. Wiązania
wodorowe występujące między cząsteczkami wody są słabsze niż między cząsteczkami wody
i innych substancji o charakterze polarnym lub jonowym (Pijanowski i wsp. 1996).
W roztworach substancji podlegających dysocjacji występują interakcje między jonami
a cząsteczkami wody. Cząsteczki wody, ze względu na swój charakter dipolowy, otaczają
dodatnie i ujemnie jony substancji rozpuszczonej, tworząc dookoła jonów warstwę
hydratacyjną. Silne oddziaływania pomiędzy jonami a cząsteczkami wody powodują, że
cząsteczki wody w tej warstwie są przestrzennie zorientowane. To prowadzi również do
przestrzennego uporządkowania sąsiadujących cząsteczek wody, w rezultacie czego jony są
otoczone przez kilka uporządkowanych warstw wody, nazywanych warstwami hydratacyjnymi.
Pierwsza warstwa hydratacyjna najsilniej związana przez grupy polarne i jonowe nazywana jest
warstwą monomolekularną. Dalsze warstwy są związane coraz słabszymi siłami (Barrow
1973, Pijanowski i wsp. 1996, Lewicki 2004).
Substancje odznaczające się znacznym powinowactwem do wody określane są jako
hydrofilowe. Związki niezawierające grup polarnych i zjonizowanych (jak np. tłuszcze),
a więc obojętne w stosunku do dipolowych cząsteczek wody, nie przyciągają cząsteczek wody –
są one nierozpuszczalne w wodzie i noszą nazwę hydrofobowych (Pijanowski i wsp. 1996).
Oddziaływanie między cząsteczkami wody a substancjami niepolarnymi (lub substancjami
polarnymi zawierającymi grupy niepolarne) ma szczególny charakter i prowadzi do nabycia
przez ciecz struktury podobnej do ciała stałego. Zjawisko to nosi nazwę hydratacji
hydrofobowej (Rys. 2.12) i może być określone jako próba odrzucenia substancji
rozpuszczanej przez rozpuszczalnik (wodę) (Lewicki 2004).
Szczególnie złożone interakcje z wodą wykazują biopolimery (białka, pektyny, skrobia),
które charakteryzują się skomplikowaną strukturą, olbrzymią powierzchnią i zawierają różne
grupy funkcyjne, zarówno hydrofilowe jak i hydrofobowe. Ze względu na małe rozmiary
cząsteczek wody wnikają one do wewnątrz cząsteczek biopolimerów (Pijanowski i wsp. 1996).
Są wbudowywane w ich strukturę za pomocą wiązań wodorowych oraz interakcji jonowych
w przypadku występowania grup dysocjujących. Ponadto, grupy polarne obecne
22

Przegląd literatury – Rola wody w procesach fizycznych i biochemicznych
w makrocząsteczce tworzą wiązania wodorowe z cząsteczkami wody, tworząc dookoła
warstwę hydratacyjną (Rys. 2.13). W wyniku tych interakcji woda występuje w dwóch stanach.
Woda unieruchomiona wewnątrz cząsteczek biopolimerów nazywana jest wodą strukturalną.
Woda zorganizowana w warstwie hydratacyjnej nazywana jest wodą hydratacyjną.
Ruchliwość cząsteczek w tej warstwie nie jest całkowicie ograniczona. Oddziaływania woda –
biopolimer określają konformację przestrzenną makrocząsteczki i jej ruchliwość w środowisku.
Pełna hydratacja makromolekuł białkowych jest osiągana przy zawartości wody
0,6-0,75 g/g białka (Lewicki 2004). Według Whitaker (2003) enzymy przy pełnej hydratacji
zawierają 170-220 moli wody na 10000 g białka. Lewicki (1999a) podaje, że pełna hydratacja
lizozymu wymaga 360-400 cząsteczek wody na jedną cząsteczkę enzymu.
Rys. 2.12. Interakcje hydrofobowe:
obszar zakreskowany – hydrofobowy
region substancji rozpuszczonej
w wodzie, elipsy – cząsteczki wody
Rys. 2.13. Hydratacja cząsteczki
biopolimeru: elipsy zakreskowane –
woda strukturalna, elipsy niezakres-
kowane – woda hydratacyjna
2.4.2.1. Interakcje w układach trójskładnikowych
Złożone interakcje biopolimerów z wodą stają się jeszcze bardziej skomplikowane, gdy do
układu zostaje wprowadzony jeszcze jeden dodatkowy składnik (ang. „co-solvent”). Dodatki
różnych substancji, jak np. alkoholi wielowodorotlenowych (najczęściej glicerolu i sorbitolu) czy
cukrów (najczęściej sacharozy) są często stosowane w celu zwiększenia stabilności cieplnej
enzymów.
23

Przegląd literatury – Rola wody w procesach fizycznych i biochemicznych
Timasheff i Arakawa (1989) oraz Timasheff (1993) podają, że substancje trzecie
wprowadzone do wodnego roztworu białka są wykluczane (eliminowane) z obszaru białka.
Dookoła makrocząsteczek białka tworzy się warstwa hydratacyjna uboga w trzecią substancję
rozpuszczoną, która jest wypychana do głównej objętości rozpuszczalnika (wody). Proces taki
nazywany jest
preferencyjną (uprzywilejowaną) hydratacją. Schematyczne
przedstawiono to na rysunku 2.14.
Chociaż występowanie preferencyjnej hydratacji cząsteczek białka i wykluczanie
„co-solwentu” z obszaru warstwy hydratacyjnej jest ogólną regułą występującą w czasie
rozpuszczania substancji trzeciej w wodnym roztworze białka, mechanizm tych procesów różni
się w zależności od charakteru substancji trzeciej.
W przypadku rozpuszczania cukrów i aminokwasów mechanizm ten związany jest
z zaburzeniami napięcia powierzchniowego wody. W miejscu kontaktu między białkiem a wodą
tworzy się powierzchnia międzyfazowa z określonym napięciem powierzchniowym. Substancje
zwiększające to napięcie powierzchniowe (np. cukry) będą wykluczane z obszaru białka zgodnie
z zasadą dążenia każdego układu do minimalnej energii.
Rys. 2.14. Preferencyjna
hydratacja białka w wodnym
roztworze zawierającym
substancje trzecią (alkohol
wielowodorotlenowy lub cukier)
Mechanizm preferencyjnej hydratacji białka w układach zawierających alkohole
wielowodorotlenowe związany jest z interakcjami o naturze chemicznej pomiędzy tymi
substancjami a cząsteczką białka. Interakcje pomiędzy niepolarnymi grupami w cząsteczce
białka a wodą, prowadzące do hydratacji hydrofobowej, są niekorzystne z termodynamicznego
punktu widzenia, gdyż prowadzą do zwiększenia potencjału chemicznego układu. Kontakt grup
niepolarnych białka z wprowadzonym do układu alkoholem wielowodorotlenowym jest jeszcze
bardziej niekorzystny niż kontakt z wodą, w rezultacie czego substancja ta migruje z dala od
24
Przegląd literatury – Rola wody w procesach fizycznych i biochemicznych
tych regionów, do głównej objętości rozpuszczalnika (wody), wokół cząsteczki białka
pozostawiając warstwę hydratacyjną (Timasheff i Arakawa 1989, Timasheff 1993).
Wpływ preferencyjnej hydratacji białka w roztworach wodnych zawierających substancje
trzecie (tzw. dodatki ochronne) na stabilność termiczną białka (enzymów) przedstawiono
w rozdziale 2.5.2.
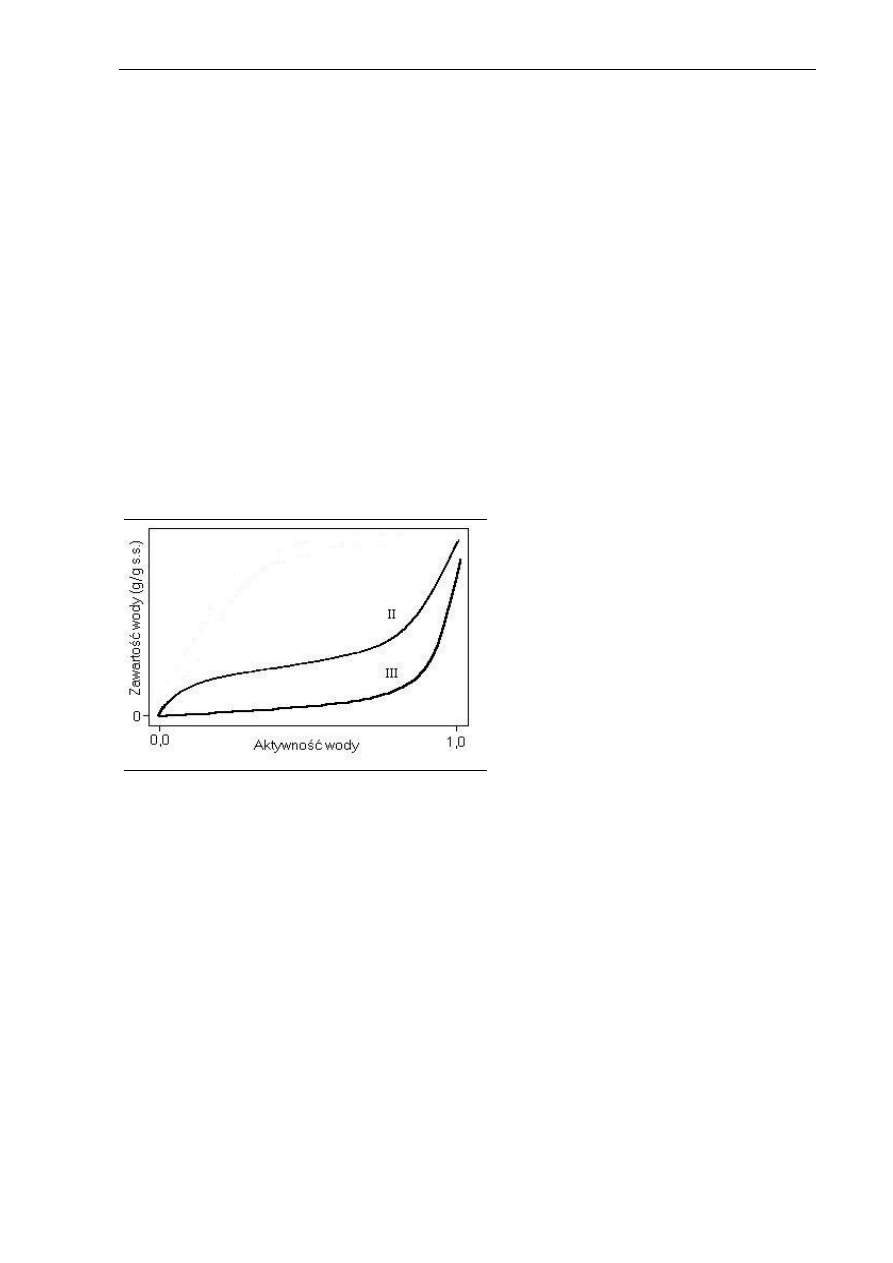
2.4.3. Izotermy sorpcji
Ze względu na różne mechanizmy powiązania wody w produktach żywnościowych,
materiały o takiej samej zawartości wody mogą wykazywać różną aktywność wody. Zależność
między zawartością wody a jej aktywnością w produkcie jest przedstawiana w postaci
izotermy sorpcji. Kształt krzywej zależy od właściwości sorpcyjnych produktu. Większość
produktów spożywczych wykazuje typ II izotermy według klasyfikacji Brunauera, o kształcie
sigmoidalnym (Rys. 2.15). Typ III jest charakterystyczny dla cukrów.
Rys. 2.15. Izotermy sorpcji
Przy analizie sorpcji wody za punkt wyjścia przyjmuje się stan zupełnego odwodnienia.
Początkowo woda jest adsorbowana w miejscach hydrofilowych powierzchni produktu. W miarę
wzrastania wilgotności względnej w otoczeniu zaadsorbowana woda może tworzyć teoretyczną
warstwę monomolekularną, gdy wszystkie dostępne miejsca hydrofilowe przyłączą
cząsteczki wody. Jest to model teoretyczny, ponieważ substancja adsorbująca wodę może
tworzyć wewnętrzne wiązania wodorowe i ilość przyłączonych cząsteczek wody w warstwie
monomolekularnej będzie mniejsza niż ilość miejsc hydrofilowych (Pijanowski i wsp. 1996).
Woda zaadsorbowana przy niskiej aktywności wody ma inne właściwości niż czysta woda.
W wyniku silnego związania z grupami hydrofilowymi charakteryzuje się wyższą wartością
ciepła parowania niż czysta woda, jest niedostępna jako rozpuszczalnik i, w większości
przypadków, nie zamarza (Lewicki 1997).
25

Przegląd literatury – Rola wody w procesach fizycznych i biochemicznych
2.4.4. Stan szklisty
Aktywność i zawartość wody wpływa na trwałość produktów spożywczych również ze
względu na jej uplastyczniający wpływ na składniki żywności znajdujące się w stanie szklistym.
Określenie „stanu szklistego” wywodzi się z nauki o polimerach, ale zastosowanie tej teorii
w naukach o żywności umożliwia wytłumaczenie pewnych zachodzących w niej zmian
fizykochemicznych (Slade i Levine 2002).
Występowanie w stanie szklistym jest cechą charakterystyczną dla pewnych składników
żywności – głównie dla występujących w niej amorficznych polisacharydów, lecz także dla
cukrów niskocząsteczkowych (Schebor i wsp. 1996). Stan szklisty jest osobliwym stanem
materii. Stanowi on substancję sztywną, kruchą i twardą, o lepkości tego samego rzędu co
lepkość ciał stałych (10
12
Pas). Z punktu widzenia podstawowych właściwości mechanicznych
należy zatem niewątpliwie do ciał stałych. Jednak przejście od stanu ciekłego do stanu stałego
w toku ochładzania lub suszenia nie odbywa się w tym przypadku poprzez proces krystalizacji,
lecz w sposób ciągły przy ciągłym wzroście lepkości (Goerlich 1975).
W temperaturze T
g
, nazywanej temperaturą przejścia szklistego, stan w jakim
występują składniki ulega zmianie – z twardego, kruchego materiału „szklistego” o bardzo
wysokiej lepkości, do miękkiego lepko-sprężystego „gumowatego” o lepkości około 10
3
Pas
(Williams i wsp. 1955). Temperatura, przy jakiej zachodzi ta przemiana, jest cechą
charakterystyczną każdej substancji i zależy w dużym stopniu od składu systemu, w jakim ta
substancja się znajduje. Bardzo istotny jest wpływ obecności wody, która uplastycznia stan
szklisty i powoduje znaczne zmniejszanie T
g
(Ross i Karel 1991, Ross 1995). Wpływ zawartości
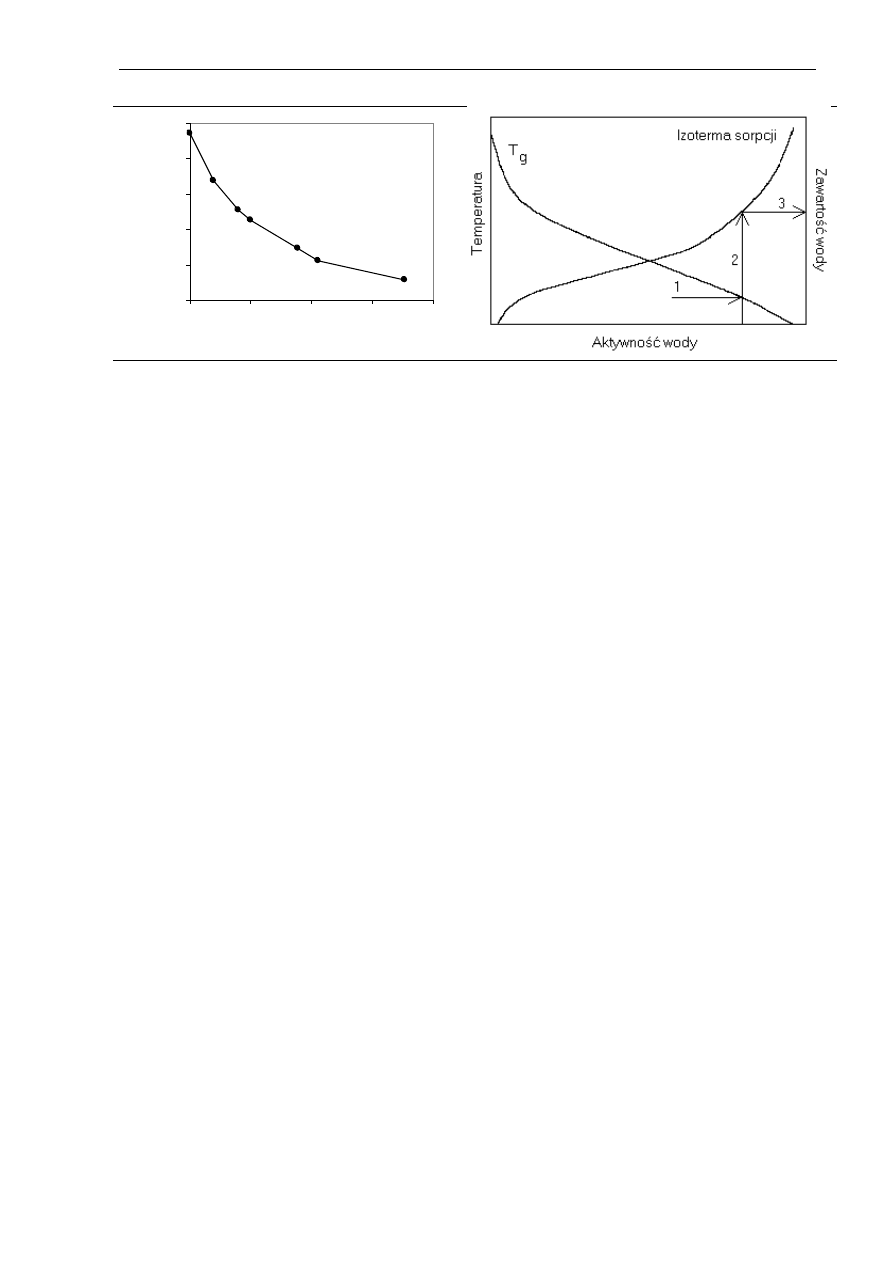
wody na temperaturę przemiany szklistej maltodekstryny przedstawia rysunek 2.16. Wartość T
g
maltodekstryny bezwodnej, wynosząca 188°C, zmniejsza się do 100°C, gdy zawartość wody
jest równa 4 g/100 g s.s. (3,8 % wody), a przy zawartości wody 10 g/100 g s.s. (9,1 % wody)
wynosi 50°C. Na rysunku 2.17. przedstawiono sposób wyznaczania krytycznej, maksymalnej
zawartości wody, powyżej której w określonej temperaturze przechowywania następuje
przemiana szklista prowadząca do niekorzystnych zmian w produkcie.
Właściwości materiału powyżej i poniżej temperatury przejścia szklistego różnią się
zasadniczo. Stan szklisty charakteryzuje się znacznie ograniczoną ruchliwością cząsteczek.
Substraty możliwych reakcji są unieruchomione w szklistej matrycy, więc możliwość
zachodzenia reakcji jest ograniczona. W stanie szklistym nie może zajść krystalizacja
składników amorficznych. Po wzroście temperatury powyżej T
g
, w wyniku zmniejszenia lepkości
materiału, zwiększa się ruchliwość cząstek i szybkość reakcji. Możliwa jest krystalizacja
składników amorficznych (Ross 1995).
26
Przegląd literatury – Rola wody w procesach fizycznych i biochemicznych
0
40
80
120
160
200
0
5
10
15
20
Zaw artoś ć w ody (g/100 g s .s .)
T
g
(
o
C
)
Rys. 2.16. Temperatura przemiany
szklistej maltodekstryny (DE = 5)
o różnej zawartości wody (Ross i Karel
1991)
Rys. 2.17. Sposób wyznaczania krytycznej
zawartości wody: temperatura przechowy-
wania (1), odpowiadająca tej temperaturze
aktywność wody, przy której zachodzi
przemiana szklista (2), odpowiadająca jej
zawartość wody (3)
Występowanie składników produktów żywnościowych w stanie szklistym oraz zmiany
właściwości związane z zachodzeniem przemiany szklistej są istotne z punktu widzenia jakości
i trwałości. W przypadku produktów, których ważną cechą jest chrupkość, dla utrzymania tej
cechy konieczne jest zapobieganie możliwości zajścia przemiany szklistej w kierunku materiału
lepko-sprężystego. Ponieważ woda obniża temperaturę przemiany szklistej i przy osiągnięciu
pewnej zawartości wody przemiana ta może nastąpić w temperaturze pokojowej, produkty te
powinny być chronione przed adsorbowaniem wilgoci. Podobnie jest w przypadku proszków,
występujących początkowo w stanie szklistym, w których następuje przemiana szklista
w wyniku chłonięcia wody i obniżania T
g
. Zajście przemiany szklistej jest niekorzystne,
ponieważ cukry w stanie amorficznym mają wtedy tendencję do krystalizacji prowadzącej do
wydzielania pewnej ilości wody i w efekcie do zbrylania. Możliwość zachodzenia reakcji
prowadzących do obniżenia jakości żywności (jak np. nieenzymatycane brązowienie, reakcje
enzymatyczne) jest znacznie ograniczona w stanie szklistym, ze względu na ograniczenie
ruchliwości cząsteczek (Buitink i wsp. 2000, Ross 1995).
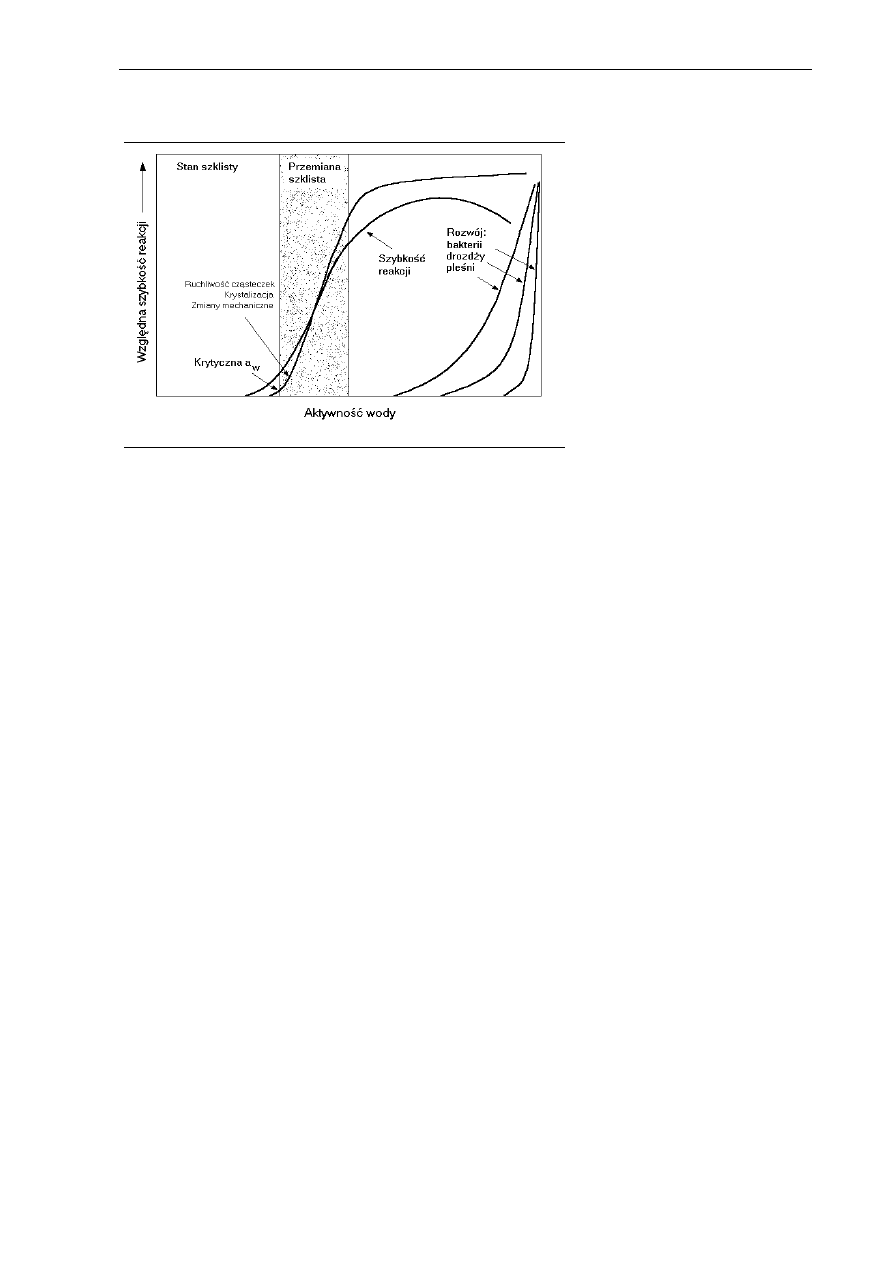
Na rysunku 2.18. przedstawiono wpływ aktywności wody na względną szybkość reakcji
oraz rozwój drobnoustrojów w powiązaniu z występowaniem stanu szklistego.
27
Przegląd literatury – Inaktywacja cieplna enzymów
Rys. 2.18. Diagram stabilnej
żywności
2.5. INAKTYWACJA CIEPLNA ENZYMÓW
W 1954 r. Lumry i Eyring po raz pierwszy przedstawili model inaktywacji cieplnej
enzymów jako procesu dwuetapowego. W pierwszym etapie następują odwracalne zmiany
w konformacji przestrzennej, prowadzące do nieodwracalnej inaktywacji w etapie drugim:
I
U
N
ir
k
K
→
→
←
(2.4)
gdzie:
N
- enzym w stanie natywnym
U
- enzym w stanie odwracalnie rozwiniętym (ang. „unfolded”)
I
- enzym nieodwracalnie zinaktywowany (zdenaturowany)
K
- stała równowagi reakcji
= [U]/[N]
k
ir
-
stała szybkości reakcji prowadzącej do nieodwracalnej inaktywacji
Termin „denaturacja” odnosi się zmian konformacyjnych natywnego białka (struktury
II-IV rzędowej) w wyniku zerwania wiązań wodorowych i mostków siarczkowych. Może być
wywołana przez różne oddziaływania (podwyższona temperatura, zmiana pH, detergenty),
które powodują rozpad wiązań wodorowych oraz zanik oddziaływań jonowych i hydrofobowych
stabilizujących strukturę białka (Weder i Belitz 2003). Denaturacja może być procesem
odwracalnym, gdy natywna konformacja łańcucha polipeptydowego jest przywracana po
ustaniu działania czynnika denaturującego. W przypadku, gdy rozwinięta forma łańcucha
polipeptydowego jest stabilizowana poprzez wchodzenie w interakcje z innymi łańcuchami,
28

Przegląd literatury – Inaktywacja cieplna enzymów
denaturacja jest nieodwracalna (Klibanov 1983). Denaturacja biologicznie aktywnych białek,
a więc i enzymów, jest związana z utratą ich aktywności. Ponieważ centrum aktywne enzymów
składa się z reszt aminokwasowych znajdujących się obok siebie tylko w natywnej
trójwymiarowej strukturze białka, każda ekspozycja na działanie czynników denaturujących,
powodująca rozwinięcie łańcucha polipeptydowego, wywołuje utratę aktywności centrum
aktywnego (Fágáin 1995, Fitter i wsp. 2001).
Najczęstszą przyczyną inaktywacji cieplnej enzymów jest utrata ich natywnej konformacji,
nazywana termodenaturacją. Zachodzi ona na skutek rozwijania aktywnej trzeciorzędowej
struktury białka enzymatycznego do postaci niezorganizowanych łańcuchów polipeptydowych,
w wyniku zwiększonej mobilności cząsteczek w podwyższonej temperaturze.
Przy stałej temperaturze kinetyka inaktywacji niektórych enzymów, w tym
α
-amylazy,
może być opisana równaniem reakcji pierwszego rzędu (Guiavarc’h i wsp. 2002, Terebiznik
i wsp. 1997):
kt
A
A
−
=
0
ln
(2.5)
gdzie:
A, A
0
- aktywność enzymu po i przed ekspozycją na podwyższoną
temperaturę
k
- stała szybkości reakcji inaktywacji zależna od temperatury (s
-1
)
t
- czas ekspozycji (s).
Stosując równanie (2.5) można oszacować stałą szybkości reakcji inaktywacji
w temperaturach zastosowanych doświadczalnie. Wartość bezwzględna współczynnika
nachylenia prostych, otrzymanych po opisaniu zależności ln(
A/A
0
) od czasu za pomocą regresji
prostej, jest równa stałej szybkości reakcji inaktywacji
k
. Typowy przykład inaktywacji cieplnej
enzymu wykazującej kinetykę reakcji pierwszego rzędu przedstawiono na rysunku 2.19.
29
Przegląd literatury – Inaktywacja cieplna enzymów
-3
-2
-1
0
0
5
10
15
20
Czas (min)
ln
A
/A
0
70
75
72.5
73.5
Temperatura [
0
C]
Rys. 2.19. Przykładowy wykres
ilustrujący inaktywację enzymu
pod wpływem temperatury
Wzrost temperatury powoduje również wzrost stałej szybkości reakcji inaktywacji
k
.
Zależność między tymi dwiema wartościami opisuje równanie Arrheniusa:
−
−
+
=
ref
a
ref
T
T
R
E
k
k
1
1
ln
ln
(2.6)
gdzie:
k
– stała szybkości reakcji inaktywacji (s
-1
)
E
a
– energia aktywacji reakcji inaktywacji (kJ/mol)
R
– stała gazowa (8,314 J/mol·K )
T
– temperatura (K)
T
ref
– temperatura porównawcza (K)
k
ref
– stała szybkości reakcji inaktywacji w
T
ref
(s
-1
)
Korzystając z zależności między ln(
k
) i temperaturą można wyznaczyć energię aktywacji
reakcji inaktywacji. Wykreślając zależność ln(
k
)
od 1/
T
i opisując ją równaniem za pomocą
regresji prostej, energia aktywacji jest równa wartości bezwzględnej iloczynu otrzymanego
współczynnika nachylenia prostej i stałej gazowej R. Typowy wykres Arrheniusa
przedstawiający zależność między temperaturą a stałą szybkości reakcji inaktywacji
k
przedstawiono na rysunku 2.20.
30

Przegląd literatury – Inaktywacja cieplna enzymów
-3,2
-2,7
-2,2
-1,7
-1,2
0,00292
0,00294
0,00296
0,00298
1/T
ln
k
Rys. 2.20. Przykładowy wykres
Arrheniusa przedstawiający
zależność między temperaturą
a stałą szybkości reakcji inaktywacji
cieplnej enzymu k
Kinetykę inaktywacji enzymów w czasie obróbki termicznej analizuje się także za pomocą
modelu „biphasic”, zakładającego istnienie dwóch frakcji enzymu – termolabilnej (a
l
)
i termostabilnej (a
s
). Obie frakcje podlegają inaktywacji zgodnie z modelem reakcji pierwszego
rzędu niezależnie od siebie (Saraiva i wsp. 1996, Ling i Lund 1978), co jest wyrażone
równaniem:
(
)
(
)
t
k
a
t
k
a
A
A
s
s
l
l
⋅
−
⋅
+
⋅
−
⋅
=
exp
exp
0
(2.7)
gdzie:
A, A
0
- aktywność enzymu po i przed ekspozycją na podwyższoną
temperaturę
k
- stała szybkości reakcji inaktywacji zależna od temperatury (s
-1
)
a
- zawartość frakcji enzymu wyrażona w ułamku
t
-
czas ekspozycji (s)
indeksy dolne:
l, s
-
labilna i stabilna frakcja enzymu.
Kinetyka inaktywacji cieplnej enzymów może być również opisana za pomocą klasycznego
modelu czasu śmierci cieplnej (Thermal Death Time), który pierwszy raz zaproponował
Bigelow (1921). Opiera się on na dwóch podstawowych wartościach
D
i
z
, używanych do opisu
wpływu temperatury i czasu działania podwyższonej temperatury na przeżywalność
mikroorganizmów lub inaktywację enzymów.
D
jest to czas dziesięciokrotnej redukcji, czyli
czas potrzebny, w danej temperaturze, do zmniejszenia ilości żywych mikroorganizmów (lub do
zmniejszenia aktywności enzymu) o 90 %.
31

Przegląd literatury – Inaktywacja cieplna enzymów
Zależność między wartością
D
i stałą szybkości inaktywacji
k
przedstawiana jest
równaniem:
k
D
303
,
2
=
(2.8)
Wartość
z
określa wrażliwość danego układu na zmiany temperatury i jest
definiowana jako wzrost (lub zmniejszenie) temperatury potrzebny do dziesięciokrotnego
zmniejszenia (lub zwiększenia) wartości
D
. Korzystając z równania (2.9) można obliczyć
wartość
D
dla dowolnej temperatury, jeżeli znana jest wartość
D
ref
w temperaturze
porównawczej
T
ref
oraz wartość
z
.
−
⋅
=
z
T
T
ref
ref
D
D
10
(2.9)
W celu wyznaczenia obu parametrów (
D
i
z
) stosuje się klasyczną metodę dwustopniową
(Van Loey i wsp., 1997a). Najpierw, dla danych eksperymentalnych uzyskanych w różnych
temperaturach, wykreśla się zależność log(
A
/
A
0
) w funkcji czasu. Wartość parametru
D
dla
każdej z zastosowanych temperatur jest równa wartości bezwzględnej współczynnika
nachylenia prostej na otrzymanym wykresie. Równania prostych są wyznaczane za pomocą
regresji prostej. W drugim kroku wartość
z
jest szacowana na podstawie zmian parametru
D
w zależności od temperatury. Wartość
z
jest równa wartości bezwzględnej odwrotności
współczynnika nachylenia prostej na wykresie log(
D
) w funkcji temperatury. Wykres ten
nazywany jest krzywą oporności cieplnej, a równanie prostej jest wyznaczane za pomocą
regresji prostej.
2.5.1. Wpływ aktywności wody na inaktywację cieplną enzymów
Obniżanie aktywności wody w systemie enzymatycznym jest jedną z metod stosowanych
do zwiększenia odporności enzymów na inaktywację cieplną.
Rola wody w strukturze biopolimerów, jakimi są też białka enzymatyczne, ma złożony
charakter. Z jednej strony występowanie tzw. wody strukturalnej jest konieczne i pomocne
w utrzymaniu natywnej aktywnej struktury makrocząsteczki. Z drugiej strony, oddziaływania
woda-biopolimer określają ruchliwość makrocząsteczki w środowisku. Przy wysokiej aktywności
wody zwiększona jest mobilność cząsteczek, prowadząca do zachodzenia zmian
konformacyjnych powodujących denaturację (inaktywację). Zawartość wody niższa niż przy
pełnej hydratacji powoduje, że cząsteczka jest bardziej odporna na zmiany wywołane
czynnikami fizycznymi. A zatem suszenie lub inne metody prowadzące do obniżania aktywności
32

Przegląd literatury – Inaktywacja cieplna enzymów
wody i zmniejszające mobilność cząsteczek sprawiają, że białko jest mniej podatne na
występowanie niekorzystnych zmian strukturalnych prowadzących do denaturacji. Jednakże,
cząsteczki wody strukturalnej, niezbędne do utrzymania natywnej struktury makrocząsteczki,
muszą być zastąpione cząsteczkami innych substancji (Terebiznik i wsp. 1997, Sun i wsp. 1998,
Lewicki 2004).
Obecność węglowodanów w czasie suszenia enzymów pomaga w utrzymaniu ich
natywnej uwodnionej struktury. Wielu badaczy sugeruje, że cukry i poliole, poprzez tworzenie
wiązań wodorowych, są w stanie zastąpić cząsteczki wody niezbędne do utrzymania struktury
białka. Dodatek cukrów wzmacnia też interakcje hydrofobowe między grupami niepolarnymi,
które są uważane za jedne z najistotniejszych czynników stabilizujących strukturę białka
(Klibanov 1983, Colaco i wsp. 1992).
Jedna z hipotez na temat mechanizmu działania ochronnego obniżonej aktywności wody
na stabilność białka jest związana z właściwościami szklisto-twórczymi węglowodanów
i polimerów w stanie amorficznym. Wiele cukrów (zarówno polisacharydów o długich
łańcuchach jak np. maltodekstryna, jak i niskocząsteczkowych, jak np. trehaloza) po suszeniu
występuje w stanie szklistym. Jak wcześniej wspomniano, stan ten charakteryzuje się bardzo
wysoką lepkością rzędu 10
12
Pa·s oraz, co za tym idzie, znacznie ograniczoną ruchliwością
cząsteczek (Noel i wsp. 1990). W wyniku zmniejszenia ruchliwości cząstek znacznemu
zmniejszeniu ulegają szybkości reakcji, w tym reakcji inaktywacji (Cardona i wsp. 1997).
Ponieważ denaturacja (inaktywacja) białka jest wynikiem zmian w konformacji przestrzennej,
stan szklisty, w którym możliwość zajścia tych zmian jest znacznie ograniczona, wpływa
korzystnie na stabilność enzymów (Mazzobre i wsp. 1997, Schebor i wsp. 1996).
Guiavarc’h i wsp. (2002), badając odporność cieplną
α
-amylazy z
Bacillus licheniformis
stwierdzili, że jest ona ściśle związana z aktywnością wody i jej zawartością w systemie
enzymatycznym. Czas potrzebny do obniżenia początkowej aktywności
α
-amylazy o 90 %
w systemie o równowagowej wilgotności względnej 78,57
±
0,52 % w temperaturze 116°C
wynosił 72,05
±
9,59 min. Po zwiększeniu równowagowej wilgotności względnej do
85,09
±
0,26 % czas ten zmniejszył się do 42,28
±
2,21 min. Podobną zależność przedstawili
Meeridnk i Van’t Riet (1991). Stała szybkości reakcji inaktywacji
k
α
-amylazy z
Bacillus
licheniformis
w temperaturze 105,5°C zmniejszyła się z 0,046 do 0,006 min
-1
po zmniejszeniu
zawartości wody z 1,86 do 0,09 g H
2
O/g s.s.
2.5.2. Wpływ dodatków stabilizujących na inaktywację cieplną enzymów
Substancje dodatkowe, takie jak cukry i alkohole wielowodorotlenowe, stosuje się w celu
zwiększenia stabilności cieplnej enzymów występujących w formie ciekłej. Według Klibanova
33

Przegląd literatury – Inaktywacja cieplna enzymów
(1983) dodatek tych substancji do wodnych roztworów enzymów wzmacnia hydrofobowe
interakcje pomiędzy niepolarnymi grupami aminokwasowymi, które, razem z wiązaniami
wodorowymi, interakcjami jonowymi i siłami van der Waalsa, odgrywają istotną rolę
w utrzymaniu natywnej, katalitycznie aktywnej struktury enzymów. Wzmacnianie tych
oddziaływań usztywnia makrocząsteczki białka i czyni je bardziej odpornymi na termiczną
denaturację.
Lee i Timasheff (1981) podają, że mechanizm stabilizacji enzymów w roztworach
wodnych w obecności cukrów i alkoholi wielowodorotlenowych jest działaniem
„niekierunkowym”, tzn. dodatki te nie zmieniają konformacji i struktury białka, lecz
fizykochemiczne właściwości całego systemu (np. strukturę rozpuszczalnika, czyli wody), które
to zmiany prowadzą do stabilizacji białka.
Jak przedstawiono w rozdziale 2.4.2.1., cząsteczki białka w roztworze wodnym po
wprowadzeniu do niego substancji trzeciej podlegają preferencyjnej hydratacji. Oznacza to, że
substancje trzecie wprowadzone do wodnego roztworu białka są wykluczone (eliminowane)
z obszaru białka, a dookoła makrocząsteczek białka tworzy się warstwa hydratacyjna uboga
w trzecią substancję rozpuszczoną, która jest wypychana do głównej objętości rozpuszczalnika
(wody).
Jak wcześniej wspomniano, tworzenie warstwy hydratacyjnej zwiększa potencjał
chemiczny i wolną energię układu, co jest niekorzystne z termodynamicznego punktu widzenia.
Zapobieganie układu dalszemu zwiększaniu, i tak już powiększonego, potencjału chemicznego
jest przyczyną działania ochronnego wyżej wymienionych dodatków na białka enzymatyczne.
Inaktywacja (denaturacja) enzymów wiąże się ze zmianą konformacji przestrzennej białka,
rozwinięciem natywnej struktury i zwiększeniem powierzchni makrocząsteczki. W przypadku
zaistnienia takich zmian konformacyjnych w układzie trójskładnikowym (woda, białko i cukier
lub alkohol wielowodorotlenowy) zwiększeniu ulega również warstwa hydratacyjna otaczająca
makrocząsteczkę białka (Rys. 2.21), co wiąże się również z dalszym zwiększeniem potencjału
chemicznego. Aby temu zapobiec równowaga reakcji
N
↔
I
(równanie 2.4) przesuwa się
w lewo, w stronę natywnej konformacji enzymu (Timashef 1993).
34

Przegląd literatury – Inaktywacja cieplna enzymów
Rys. 2.21. Hydratacja
preferencyjna białka w stanie
natywnym i zdenaturowanym,
w roztworze wodnym
zawierającym trzecią
substancję rozpuszczoną
Combes i wsp. (1992) oraz Graber i Combes (1989) przedstawiają odmienną teorię na
temat mechanizmu stabilizacji enzymów (
α
-amylazy) przez alkohole wielowodorotlenowe,
według której substancje te wchodzą w bezpośrednie interakcje z cząsteczką białka,
a w niewielkim stopniu wpływają na stopień organizacji wody. Graber i Combes (1989)
stwierdzili, że alkohole wielowodorotlenowe są inhibitorami współzawodniczącymi
α
-amylazy
i ich interakcje z centrum aktywnym enzymu odgrywają decydującą rolę w stabilizacji tego
enzymu. Ponadto, efekt stabilizacyjny jest związany z ilością grup wodorotlenowych
w cząsteczce substancji stabilizującej, jako że podobieństwo
α
-amylazy do alkoholi
wielowodorotlenowych wzrasta wraz ze wzrostem ilości tych grup w cząsteczce.
Timasheff i Arakawa (1989) sugerują, że całkowity efekt stabilizujący alkoholi
wielowodorotlenowych na aktywność enzymów ma mechanizm pośredni między dwoma wyżej
przedstawionymi, z przewagą mechanizmu preferencyjnej hydratacji.
Ludikhuyze i wsp. (1997), badając odporność cieplną
α
-amylazy z
Bacillus subtilis,
stwierdzili, że była ona znacznie zwiększona w wyniku dodatku glicerolu. Stała szybkości reakcji
inaktywacji
k
w temperaturze 80°C zmniejszyła się z 0,114 do 0,031 min
-1
po zastosowaniu
15 %-owego dodatku glicerolu. Ochronny wpływ glicerolu, innych alkoholi wielowodoro-
tlenowych oraz cukrów na stabilność cieplną pektynoesterazy (PME) wyekstrahowanej
z pomidorów odmiany
Lycopersicon esculentum
przedstawili Guiavarc’h i wsp. (2003). Dodatek
sacharozy (500 mg/ml) do buforowego roztworu enzymu spowodował zwiększenie czasu
dziesięciokrotnej redukcji PME w temperaturze 65°C z 39,5 minut (gdy enzym rozpuszczono
tylko w roztworze buforowym) do 232,5 minut. Taki sam dodatek trehalozy spowodował
zwiększenie czasu dziesięciokrotnej redukcji do 312,1 minut w tej samej temperaturze.
W dostępnej literaturze sugeruje się, że efekt stabilizujący alkoholi wielowodorotlenowych
i cukrów związany jest z liczbą grup OH w cząsteczce danej substancji (Busto i wsp. 1999,
35

Przegląd literatury – Inaktywacja cieplna enzymów
Graber i Combes 1989) lub z ogólną liczbą grup OH w danym roztworze (Noel i Combes 2003,
Guiavarc’h i wsp. 2003). W cytowanej powyżej pracy Guiavarc’h i wsp. (2003) stwierdzili, że
ogólna liczba grup OH w roztworach była związana z ich efektem ochronnym, bez względu na
rodzaj substancji zapewniającej źródło grup OH. Autorzy stwierdzili, że stabilność cieplna
pektynoesterazy może być przewidywana na podstawie znajomości liczby grup OH w danym
systemie.
2.6. PODSUMOWANIE
W powyższym rozdziale przedstawiono ogólną charakterystykę enzymów oraz ich
zastosowania w przetwórstwie żywności, ze szczególnym uwzględnieniem
α
-amylazy.
Przedstawiono proces suszenia, jako metodę utrwalania enzymów. Szczególnie zwrócono
uwagę na proces suszenia rozpyłowego, jako metodę charakteryzującą się cechami
wpływającymi na jej przydatność do suszenia enzymów.
Opisano wpływ interakcji wody i innych składników z cząsteczkami białka
enzymatycznego, jako wpływające na strukturę i aktywność enzymów. W sposób szczególny
zwrócono uwagę na wpływ aktywności i zawartości wody oraz dodatków stabilizujących na
stabilność enzymów. Przedstawiono mechanizmy stabilizacji enzymów w różnych środowiskach,
wskazując na wpływ obniżonej mobilności cząsteczek w warunkach niskiej zawartości wody,
możliwość wpływu stanu szklistego oraz wpływ liczby grup OH pochodzących z substancji
stabilizujących. Omówiono modele kinetyczne inaktywacji enzymów.
36

Cel i zakres pracy
3. CEL I ZAKRES PRACY
Celem pracy było zbadanie możliwości zastosowania suszenia rozpyłowego do suszenia
płynnego preparatu
α
-amylazy pochodzenia pleśniowego (
Aspergillus oryzae
). Cel ten
realizowano określając w części pierwszej:
̵
wpływ strumienia surowca oraz temperatury powietrza suszącego na przebieg
suszenia rozpyłowego,
̵
wpływ strumienia surowca oraz temperatury powietrza suszącego na końcową
aktywność otrzymanego preparatu enzymatycznego.
W celu wyjaśnienia otrzymanych w części pierwszej zależności, w drugiej części pracy
prowadzono eksperymenty mające na celu określenie:
̵
wpływu zawartości wody w roztworach zawierających badany enzym (systemy
o wysokiej zawartości wody) na kinetykę inaktywacji cieplnej preparatu
α
-amylazy,
̵
wpływu zawartości wody w proszkach zawierających badany enzym (systemy o
niskiej zawartości wody) na kinetykę inaktywacji cieplnej preparatu
α
-amylazy.
W części trzeciej pracy badano wpływ dodatków stabilizujących (alkoholi
wielowodorotlenowych i cukrów) na kinetykę inaktywacji cieplnej preparatu
α
-amylazy, testując
hipotezę zakładającą, że efekt stabilizujący zależy od liczby grup hydroksylowych w cząsteczce
zastosowanego dodatku lub od ogólnej liczby tych grup w roztworze.
37

Metodyka badań – Materiały
4. METODYKA BADAŃ
4.1 MATERIAŁY
4.1.1. Preparat
α
-amylazy Fungamyl 800L
Podstawowym materiałem do badań był płynny preparat enzymatyczny
α
-amylazy
(4-glukanohydrolazy-
α
-1,4-glukanu, EC 3.2.1.1.) o nazwie handlowej Fungamyl 800L,
produkowany przez firmę Novozymes A/S ze specjalnie wyselekcjonowanych szczepów
Aspergillus oryzae
(Sigma Aldrich, Niemcy).
Aktywność enzymu gwarantowana przez producenta wynosiła 800 FAU/g. 1 FAU (Fungal
α
-Amylase Unit) jest to ilość enzymu, która rozkłada 5,26 g suchej substancji skrobi w czasie
godziny w warunkach standardowych (pH 4,7; temperatura 37°C). Gęstość roztworu wynosiła
1,2 g/cm
3
. Po uwzględnieniu aktywności enzymu i gęstości preparatu obliczono, że
w 1
µ
l preparatu zawarta jest jedna jednostka aktywnego enzymu – 1 FAU.
Preparat enzymatyczny przechowywano w temperaturze 4°C.
4.1.1.1. Oznaczenie masy molowej białka enzymatycznego
Do oznaczenia masy molowej białka enzymatycznego stosowano elektroforezę płytową
w żelu poliakryloamidowym (polyacrylamide gel electrophoresis – PAGE) w obecności
dodecylo-siarczanu sodu (SDS). Zasada metody SDS PAGE po raz pierwszy została
przedstawiona przez Laemmliego w 1970 i od tamtego czasu jest to najpowszechniejsza
metoda do oznaczania masy molowej białek (Holme i Peck 1990).
Zasada metody
Elektroforeza jest zjawiskiem przesuwania się naładowanych cząstek w stosunku do
nieruchomego ośrodka pod działaniem pola elektrycznego. Białko poddawane jest działaniu
czynnika redukującego w celu usunięcia wiązań dwusiarczkowych. Następnie stosowany jest
silny detergent anionowy (SDS), który zrywa wiązania niekowalencyjne w białku, co prowadzi
do rozfałdowania łańcucha polipeptydowego. Cząsteczki SDS (1 cząsteczka SDS na
2 aminokwasy) wiążą się ze szkieletem polipeptydowym dzięki hydrofobowemu łańcuchowi
alkilowemu. Zdenaturowane białko wykazuje wypadkowy ładunek ujemny proporcjonalny do
jego masy cząsteczkowej. W czasie rozdziału elektroforetycznego jego ruchliwość zależy od
masy cząsteczkowej.
Materiały i aparatura
-
żel poliakryloamidowy PhastGel Homonegous 20,
-
roztwór buforowy SDS i
β
-merkaptoetanolu,
38

Metodyka badań – Materiały
-
wzorce masy cząsteczkowej – mieszanina białek standardowych 14-97 kDa
(Amersham Pharmacia Biosciences, Szwecja),
-
aparat do elektroforezy Phast System (Amersham Pharmacia Biosciences, Szwecja).
Wykonanie oznaczenia
Do odpowiednio rozcieńczonego (1:10) roztworu preparatu enzymatycznego (5
µ
l) oraz
białek standardowych (5
µ
l) dodawano roztwór buforowy (1,5
µ
l), zawierający SDS
i
β
-merkaptoetanol. Mieszano poprzez wirowanie w mikrowirówce (1000 rpm/min, 1 min.,
4°C). Ogrzewano w temperaturze 100°C przez 5 minut, mieszano i chłodzono w mikrowirówce
(1000 rpm/min, 1 min., 4°C). Próbki przenoszono na żel poliakryloamidowy i prowadzono
rozdział elektroforetyczny w aparacie do elektroforezy Phast System. Po zakończeniu rozdziału
żel wybarwiano barwnikiem srebrowym w celu uwidocznienia białek.
Interpretacja wyników oznaczenia
Bezpośrednio po zakończeniu oznaczenia obraz otrzymany na żelu skanowano. Masę
molową białka enzymatycznego zawartego w preparacie Fungamyl 800L określano na
podstawie porównania jego ruchliwości elektroforetycznej z ruchliwością wzorców masy
cząsteczkowej, przy użyciu programu komputerowego Amersham Pharmacia Biosciences.
4.1.1.2. Oznaczenie zawartości białka
Zawartość białka w preparacie enzymatycznym oznaczano zmodyfikowaną metodą
Lowry’ego i współpracowników (Smith i wsp. 1987).
Zasada metody
Pod wpływem działania białka jony miedzi Cu
2+
ulegają redukcji do jonów Cu
1+
, które
reagując z kwasem 2,2’-bichinidino-4,4’-dikarboksylowym tworzą barwne purpurowe
kompleksy. Intensywność koloru, mierzona przy długości fali 562 nm, zależy wprost
proporcjonalnie od ilości białka.
Odczynniki i aparatura
-
rozwór kwasu 2,2’-bichinidino-4,4’-dikarboksylowego (Sigma-Aldrich, Niemcy),
-
4 %-owy roztwór CuSO
4
·5H
2
O (Sigma-Aldrich, Niemcy),
-
standardowy roztwór albuminy bydlęcej (bovine serum albumin BSA, 1 mg/cm
3
,
Sigma-Aldrich, Niemcy),
-
rozcieńczony roztwór preparatu enzymatycznego Fungamyl 800 L (20
µ
l/10 cm
3
H
2
O),
-
cieplarka 60°C,
-
spektrofotometr Ultrospec 2100pro (Amerscham Biosciences).
39

Metodyka badań – Materiały
Wykonanie oznaczenia
W celu wyznaczenia krzywej wzorcowej – zależności między ilością białka a absorbancją
przygotowano po 50
µ
l pięciu roztworów białka wzorcowego o zawartości BSA: 0; 0,25; 0,5;
0,75 i 1 mg/cm
3
. Równocześnie przygotowano 50
µ
l roztworu enzymu Fungamyl w czterech
powtórzeniach (próby pełne). Do roztworów białka standardowego i białka oznaczanego
dodano równocześnie po 1 cm
3
reagentu (będącego mieszaniną 1 cm
3
4 %-owego roztworu
CuSO
4
·5H
2
O i 50 cm
3
kwasu 2,2’-bichindino-4,4’-dikarboksylowego). Mieszaniny białka
standardowego i preparatu Fungamyl 800 L z reagentem inkubowano 15 minut
w temperaturze 60°C, a następnie chłodzono 5 minut w temperaturze 4°C. Dokonywano
pomiaru absorbancji w temperaturze 25°C przy długości fali 562 nm w spektrofotometrze.
Wykonano również próbę ślepą, uwzględniającą absorbancję roztworu Fungamyl bez działania
reagentu. Do 50
µ
l roztworu preparatu enzymatycznego Fungamyl 800 L dodano 1 cm
3
wody
zamiast reagentu i inkubowano równocześnie z wykonaniem właściwego oznaczenia.
Interpretacja wyników oznaczenia
Na podstawie otrzymanych wyników wykreślano krzywą wzorcową i wyznaczano jej
równanie za pomocą regresji prostej. Obliczono średnią absorbancję z czterech powtórzeń prób
pełnych, odjęto absorbancję próby ślepej i obliczono zawartość białka w badanej próbce
z równania krzywej wzorcowej.
4.1.1.3. Oznaczenie zawartości suchej substancji
W naczynkach wagowych o znanej masie umieszczano próbki badanego materiału
i ważono. Pozostawiano w temperaturze 105°C na 4 godziny i ponownie ważono. Wszystkie
ważenia wykonywano z dokładnością do 0,00001 g. Zawartość suchej substancji
w badanej próbce obliczano ze wzoru:
%
100
0
1
0
2
⋅
−
−
=
m
m
m
m
u
(4.1)
gdzie:
u
- zawartość suchej substancji (%)
m
0
- masa pustego naczynka wagowego (g)
m
1
- masa naczynka wagowego z próbką przed suszeniem (g)
m
2
- masa naczynka wagowego z próbką po suszeniu (g)
40

Metodyka badań – Suszenie rozpyłowe
α
-amylazy
4.1.2. Maltodekstryna
W pierwszej części badań (eksperymenty suszarnicze) stosowano maltodekstrynę
o niskim stopniu scukrzenia, o zawartości grup redukujących odpowiadającej 9 % glukozy
(DE 9), produkowaną przez Szczecińskie Przedsiębiorstwo Przemysłu Ziemniaczanego
„Nowamyl” S.A. W drugiej części badań (badanie kinetyki inaktywacji cieplnej) stosowano
maltodekstrynę o zawartości grup redukujących odpowiadającej 4-7 % glukozy (DE 4-7),
produkowaną przez Sigma-Aldrich (Niemcy).
Zawartość suchej substancji w maltodekstrynie oznaczono zgodnie z PN-71/74700.
4.2. SUSZENIE ROZPYŁOWE PREPARATU
α
-AMYLAZY
Na podstawie dostępnej literatury (Meerdink i van’t Riet 1991 i 1995) określono, że jako
nośnik, który wykorzystywano do suszenia preparatu
α
-amylazy, zastosowano maltodekstrynę
(DE 9). Zawartość wody w roztworze poddawanym suszeniu wynosiła 3,5 g H
2
O/g s.s.
Stosowano dodatek 110 ppm CaCl
2
(110 mg CaCl
2
/kg s.s. maltodekstryny), jako substancji
stabilizującej. Ilość preparatu enzymatycznego w roztworze poddawanym suszeniu wynosiła
920 mg Fungamyl/kg s.s. maltodekstryny. Skład roztworu poddawanego suszeniu był
następujący: 200 cm
3
wody destylowanej; 66,5 g maltodekstryny; 0,055 g preparatu Fungamyl
oraz 0,14 cm
3
0,43 M roztworu CaCl
2
.
Do suszenia rozpyłowego stosowano laboratoryjną suszarkę Anhydro (Dania 1973).
Schemat urządzenia przedstawiono na rysunku 4.1.
Suszenie rozpyłowe przeprowadzano przy stałej prędkości dysku rozpylającego równej
39000 obr/min. Suszenie przeprowadzono w trzech powtórzeniach w każdej z czterech
temperatur powietrza wlotowego: 160, 180, 200 i 220°C i przy czterech strumieniach surowca:
0,4; 0,8; 1,3 i 1,7 cm
3
/s.
Po wyborze warunków suszenia sprawdzano właściwe połączenie wszystkich przewodów
i montowano pojemnik na proszek pod cyklonem. Włączano urządzenie głównym
przełącznikiem, co powodowało uruchomienie wentylatora. Włączano odpowiednią ilość grzałek
elektrycznych nagrzewających powietrze wlotowe. Po ustaleniu się temperatury powietrza
wlotowego na stałym, założonym poziomie, regulatorem obrotów włączano dysk rozpyłowy
i doprowadzano z zadaną prędkością wodę destylowaną w celu ustalenia równowagi
temperaturowej w komorze suszenia. W wyniku odparowania wody zmniejszała się
temperatura powietrza wylotowego. Po ustaleniu tej temperatury na stałym poziomie do dysku
rozpylającego doprowadzano właściwy roztwór przeznaczony do suszenia. Dozę preparatu
enzymatycznego dodawano do tego roztworu tuż przed rozpoczęciem suszenia. Mierzono czas
suszenia określonej objętości roztworu. W czasie trwania procesu nie dopuszczano do
41
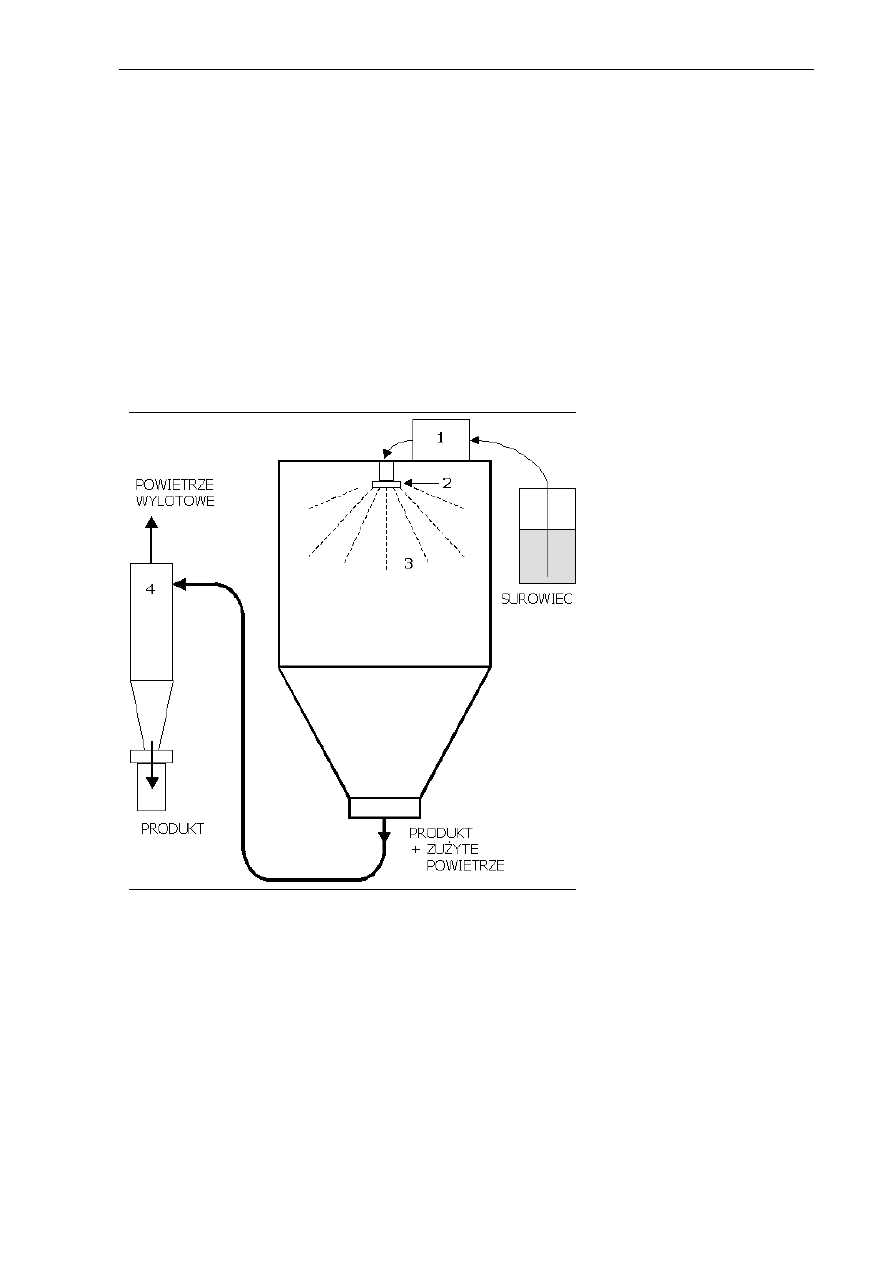
Metodyka badań – Suszenie rozpyłowe
α
-amylazy
zapowietrzenia przewodu dostarczającego surowiec do komory suszenia, co mogłoby zmienić
warunki temperaturowe procesu. Temperatura powietrza wlotowego i wylotowego utrzymywała
się na stałym poziomie. Po zakończeniu suszenia właściwego roztworu wyłączano grzałki
elektryczne, a do dysku rozpylającego ponownie doprowadzano wodę destylowaną w celu
oczyszczenia dysku i uniknięcia przegrzania urządzenia przy zatrzymywaniu. Po obniżeniu się
temperatury powietrza wlotowego do 130°C zatrzymywano dopływ wody a po obniżeniu do
80°C zmniejszono do zera obroty dysku i wyłączano suszarkę. Proszek odbierano z pojemnika
pod cyklonem. Podczas właściwego suszenia mierzono wilgotność powietrza otaczającego
i wylotowego za pomocą psychrometru Assmana.
Rys. 4.1. Schemat
suszarki rozpyłowej:
1 - Pompa perystaltyczna
2 - Dysk rozpylający
3 - Komora suszenia
4 - Cyklon
4.2.1. Charakterystyka otrzymanych suszy
4.2.1.1. Oznaczenie aktywności
α
-amylazy
Stosowano metodę będącą połączeniem znanej metody Sandstesta, Kneena, Blisha (SKB)
(Praca zbiorowa 2001) i metody przekazanej przez firmę Novozymes. Jako metodę nadrzędną
przyjęto metodę Novozymes, zgodnie z którą wykonywano odczynniki, ustalano standardowe
warunki reakcji oraz ilości substratów biorących w niej udział. Zmieniono sposób
przeprowadzania pomiarów. Zamiast zalecanego przez Novozymes wykonywania kolejnych
42

Metodyka badań – Suszenie rozpyłowe
α
-amylazy
pomiarów w czasie aż do osiągnięcia danego poziomu wyniku, przyjęto (zgodnie z metodą SKB)
czas reakcji, po którym dokonywano pomiaru.
Zasada metody
Aktywność
α
-amylazy określano na podstawie ilości skrobi rozłożonej w czasie reakcji
enzymatycznej w warunkach standardowych. Ilość rozłożonej skrobi mierzono na podstawie
zmiany intensywności zabarwienia mieszaniny reakcyjnej z jodem, po 15 minutach działania
enzymu w pH 4,7 i temperaturze 37°C, w obecności jonów wapnia. Jako substrat reakcji
stosowano maltodekstrynę niskoscukrzoną – tę samą, której używano do suszenia
rozpyłowego.
Odczynniki:
-
roztwór 0,43 M CaCl
2
pH 7,0 (1). Odważano 47,7 g CaCl
2
, dodawano około 900 cm
3
wody destylowanej, ustalano pH na 7,0 przy użyciu HCl, dopełniano do 1000 cm
3
wodą destylowaną
-
podstawowy roztwór jodu (2). 11 g jodu krystalicznego rozpuszczano w 60 cm
3
wody
destylowanej, dodawano 22 g KJ, dopełniano wodą do 500 cm
3
-
roboczy roztwór jodu (3). Do 1 cm
3
podstawowego roztworu jodu (2) dodawano 10 g
KJ, dopełniano wodą destylowaną do 250 cm
3
-
0,1 M HCl (4)
-
buforowy roztwór soli (5). Odważano 9,36 g NaCl; 69 g KH
2
PO
4
; 9,6 g
Na
2
HPO
4
·12H
2
O, dopełniano wodą do 1000 cm
3
, ustalano pH na 5,2 przy użyciu HCl
lub NaOH
-
roztwór substratu (6) – maltodekstryny. Odważano ilość maltodekstryny
odpowiadającą 6,95 g s.s., przenoszono ilościowo do kolby miarowej na 1000 cm
3
,
dodawano 100 cm
3
buforowego roztworu soli, dopełniano do 1000 cm
3
wodą,
ustalano pH na 4,7.
-
roztwór preparatu enzymatycznego (7). Aby otrzymać odpowiedni stosunek enzymu
do substratu enzym musiał być rozcieńczony do około 0,1 FAU/cm
3
. Jako
rozpuszczalnika stosowano roztwór CaCl
2
i wody w stosunku 1:100. Odmierzano
0,1 cm
3
enzymu, przenoszono do kolby miarowej na 100 cm
3
zawierającej 1 cm
3
roztworu CaCl
2
, dopełniano do kreski wodą i mieszano.
Dodatek enzymu do oznaczenia aktywności enzymu płynnego dobrano tak, aby
oznaczenie odbywało się w warunkach wysycenia enzymu substratem, co oznacza, że nawet
43
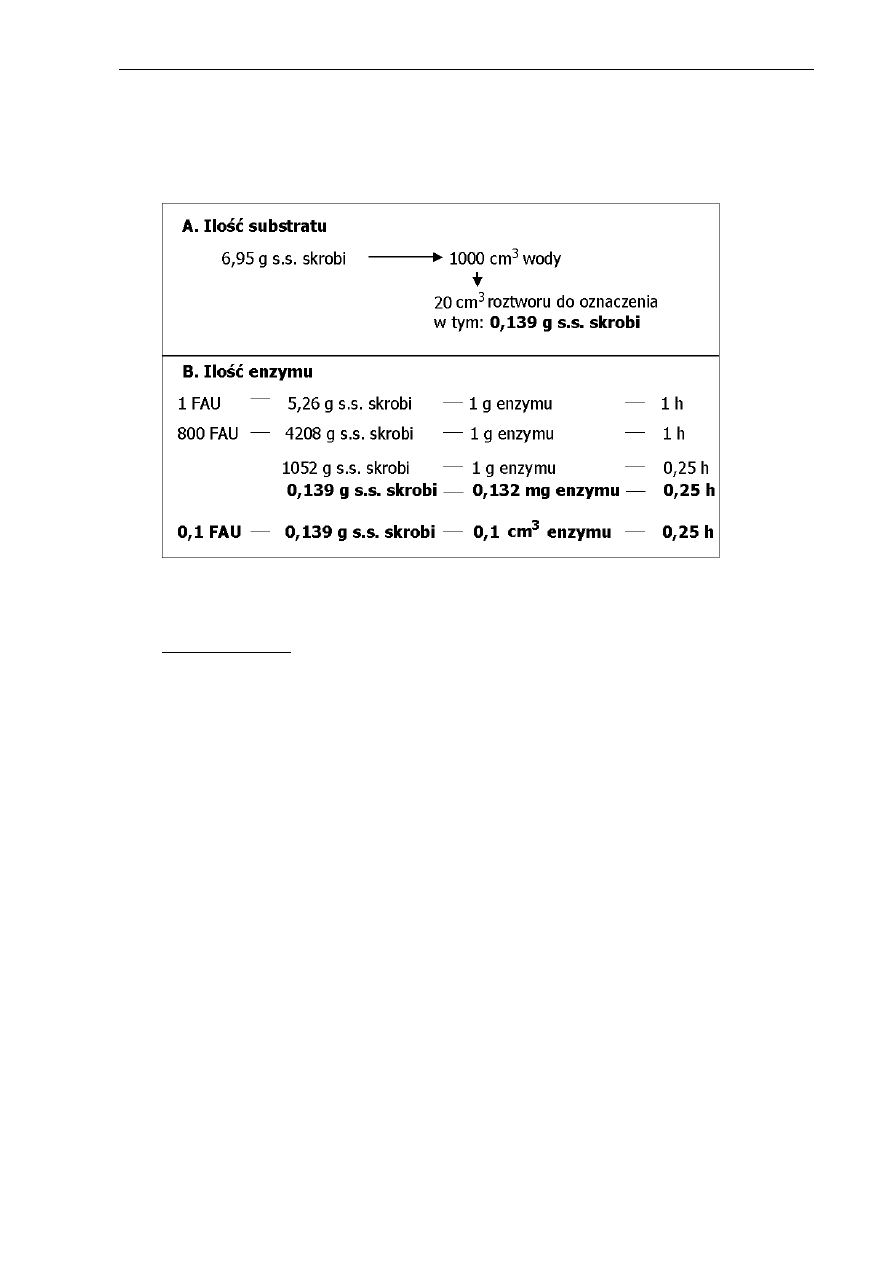
Metodyka badań – Suszenie rozpyłowe
α
-amylazy
przy maksymalnej aktywności enzymu w czasie 15 minut cały substrat nie zostanie rozłożony.
Sposób wyznaczenia ilości enzymu dodawanego do oznaczenia przedstawiono na rysunku 4.2.
Rys. 4.2. Schemat wyznaczenia dodatku enzymu do oznaczenia aktywności
α
-amylazy
Krzywa wzorcowa
Sporządzano 5 roztworów maltodekstryny o stężeniach: 0,3; 0,7; 1,3; 2,0
i 2,6 g s.s./dm
3
. Przenoszono po 1 cm
3
każdego z tych roztworów do kolb zawierających 5 cm
3
roboczego roztworu jodu (3). Wykonywano także próbę ślepą poprzez dodanie 1 cm
3
wody
destylowanej do 5 cm
3
roboczego roztworu jodu. Dokonywano odczytu w spektrofotometrze
przy długości fali 570 nm, nastawionym na zero wobec wody. Krzywą wzorcową przedstawiono
na rysunku 4.3.
44
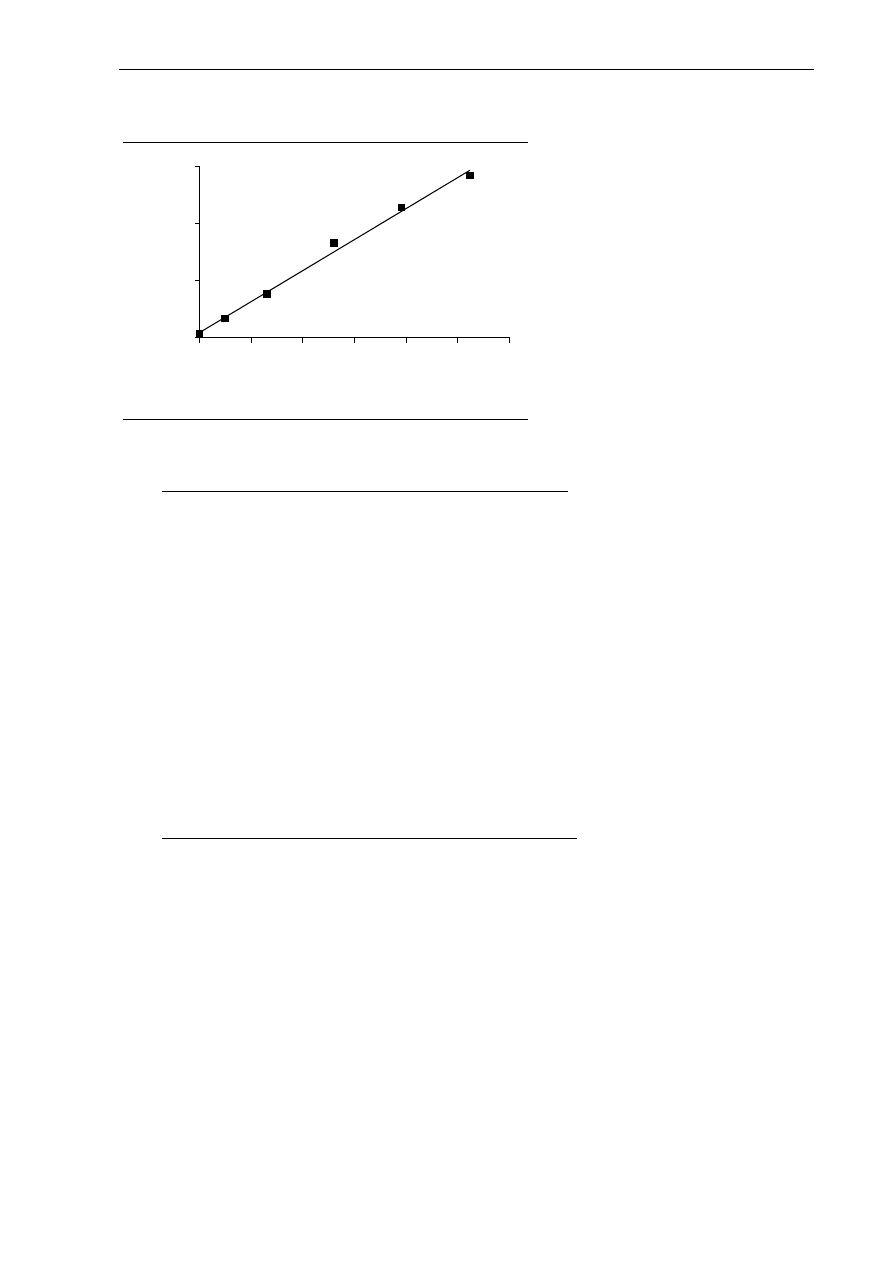
Metodyka badań – Suszenie rozpyłowe
α
-amylazy
R
2
= 0,9939
0,0
0,2
0,4
0,6
0,0
0,5
1,0
1,5
2,0
2,5
3,0
Zawartość skrobi (g s.s./dm
3
)
A
b
so
rb
an
cja
Rys. 4.3. Krzywa wzorcowa
ilustrująca zależność między
zawartością skrobi
a absorbancją
Wykonanie oznaczenia – płynny preparat enzymatyczny
Do trzech zlewek odmierzano po 20 cm
3
roztworu substratu (6) i po 8 cm
3
wody
destylowanej. Dwie z nich (próby pełne) wstawiano do łaźni wodnej o temperaturze 37°C na
15 minut w celu ustalenia się temperatury, po czym dodawano po 0,1 cm
3
roztworu preparatu
enzymatycznego (7), a do trzeciej (próba ślepa) taką samą ilość wody. Mieszano i inkubowano
15 minut. W czasie inkubacji odmierzano do dwóch kolb po 25 cm
3
0,1 M roztworu HCl (4),
a do trzech następnych po 5 cm
3
roboczego roztworu jodu (3). Po inkubacji całość mieszaniny
reakcyjnej prób pełnych przenoszono ilościowo do kolb zawierających HCl, a do próby ślepej
dodawano taką samą ilość wody. Mieszano, przenoszono po 1 cm
3
mieszaniny wszystkich
próbek do kolb zawierających roztwór jodu (3). Dokonywano odczytu w spektrofotometrze przy
długości fali 570 nm, nastawionym na zero wobec wody.
Wykonanie oznaczenia – suszony preparat enzymatyczny
Stosunek ilości suchej substancji maltodekstryny do ilości enzymu w suszach był taki sam
jak stosowany przy oznaczeniu płynnego preparatu enzymatycznego – tzn. uwzględniał
maksymalną ilość substratu, jaka może być rozłożona przez daną ilość enzymu w określonym
czasie. Dlatego do oznaczenia aktywności suszonego preparatu enzymatycznego wystarczyło
odważyć odpowiednią ilość proszku, aby otrzymać materiał do oznaczenia zawierający enzym
i substrat w odpowiednim stosunku wagowym.
Odważano ilości suszu odpowiadające 0,139 g s.s. w trzech powtórzeniach (dwa
powtórzenia próby pełnej i próba ślepa). Przygotowywano środowisko reakcji enzymatycznej,
czyli roztwór soli (5) z dodatkiem roztworu CaCl
2
(1) i ustalano pH na 4,7. Ponieważ
równocześnie oznaczano aktywność enzymu w kilku suszach, ilość przygotowywanej
45

Metodyka badań – Suszenie rozpyłowe
α
-amylazy
mieszaniny była iloczynem wartości potrzebnych do oznaczenia jednego suszu w jednym
powtórzeniu, czyli: 26 cm
3
wody destylowanej, 2 cm
3
roztworu soli (5), 0,001 cm
3
roztworu
CaCl
2
(1). Do oznaczenia aktywności
α
-amylazy w jednym suszu do dwóch zlewek odmierzano
po 28 cm
3
przygotowanej mieszaniny. Wstawiano do łaźni wodnej o temperaturze 37°C na
15 minut. Dodawano wcześniej odważone ilości suszu, dokładnie mieszano bagietką
i inkubowano przez 15 minut. W czasie inkubacji do dwóch kolb odmierzano po 25 cm
3
0,1 M
roztworu HCl (4), a do trzech następnych po 5 cm
3
roboczego roztworu jodu (3). Po inkubacji
całość mieszaniny reakcyjnej przenoszono ilościowo do kolb zawierających HCl, mieszano,
przenoszono 1 cm
3
roztworu do kolb zawierających roztwór jodu. Próbę ślepą wykonywano
poprzez wsypanie odważonej ilości suszu do 53 cm
3
wody destylowanej, dokładne wymieszanie
i natychmiastowe przeniesienie 1 cm
3
mieszaniny do trzeciej kolby z jodem.
Dokonywano odczytu w spektrofotometrze przy długości fali 570 nm, nastawionym na
zero wobec wody.
Interpretacja wyników oznaczenia
Korzystając z krzywej wzorcowej, na podstawie różnicy absorbancji między próbą ślepą
a średnią absorbancją prób pełnych, obliczano ilość skrobi rozłożonej w czasie oznaczenia.
Otrzymany wynik przeliczano na jednostki FAU/g, uwzględniając czas reakcji (15 min,
w stosunku do 60 min wg definicji jednostki FAU), ilość enzymu biorącą udział w reakcji
(0,132·10
-3
g) oraz ilość skrobi rozkładaną przez 1 g preparatu enzymatycznego według definicji
jednostki FAU (5,26 g s.s. skrobi):
26
,
5
10
132
,
0
4
3
⋅
⋅
⋅
=
−
s
A
s
(4.2)
gdzie:
A
s
- aktywność enzymu w suszu (FAU/g)
s
- ilość rozłożonej skrobi w czasie 15 min oznaczenia (g)
Aktywność enzymu w suszach wyrażano także jako aktywność względną w stosunku do
aktywności enzymu płynnego:
%
100
⋅
=
p
s
A
A
RA
(4.3)
gdzie:
RA
- aktywność względna enzymu w suszu (%)
A
p
- aktywność enzymu w preparacie płynnym (FAU/g)
46

Metodyka badań – Suszenie rozpyłowe
α
-amylazy
4.2.1.2. Oznaczenie zawartości suchej substancji
Zawartość suchej substancji oznaczono zgodnie z PN-71/74700.
4.2.1.3. Oznaczenie morfologii cząstek
W celu określenia wpływu parametrów suszenia na morfologię cząstek wykonywano
komputerową analizę obrazu zdjęć proszków za pomocą sterowanego komputerowo zestawu
zawierającego mikroskop i kamerę. Wykonywano przykładowe zdjęcia cząstek proszków
otrzymanych po suszeniu w różnych parametrach. Przed nałożeniem na szkiełko mikroskopowe
materiał rozprowadzano w izopropanolu.
4.2.1.4. Właściwości fizyczne proszków
W celu określenia właściwości fizycznych wybranych proszków oznaczano gęstość
nasypową luźną i utrzęsioną oraz rozpuszczalność.
Oznaczenie gęstości nasypowej wykonywano zgodnie z metodą podaną przez
Soerensen’a i wsp. (1978). 60 g proszku przenoszono do szklanego cylindra i odczytywano
objętość proszku. Gęstość nasypową luźną wyrażano w kg/m
3
. Następnie postukiwano
cylindrem 500 razy i odczytywano objętość proszku. Gęstość nasypową utrzęsioną wyrażano
w kg/m
3
.
Rozpuszczalność proszków oznaczano według PN-71/A-74700.
4.2.4.5. Oznaczenie zawartości sacharydów redukujących
W wybranych proszkach, otrzymanych po suszeniu przy minimalnym (0,4 cm
3
/s)
i maksymalnym (1,7 cm
3
/s) strumieniu surowca, oznaczono zawartość sacharydów
redukujących.
Oznaczenie wykonywano metodą kolorymetryczną, wykorzystującą właściwości
redukujące sacharydów, które w środowisku zasadowym redukują grupy nitrowe kwasu
3,5-dinitrosalicylowegodo grup aminowych, charakteryzujących się pomarańczowym
zabarwieniem. Intensywność zabarwienia, proporcjonalna do zawartości sacharydów
redukujących stanowi podstawę ich oznaczenia ilościowego (Praca zbiorowa 2001).
Zawartość sacharydów redukujących oznaczono również w maltodekstrynie przed
suszeniem.
4.2.2. Parametry opisujące przebieg suszenia rozpyłowego
Na podstawie wykonanych pomiarów zmian wilgotności i temperatury powietrza
wlotowego (oznaczenia z indeksem dolnym 1), wylotowego (oznaczenia z indeksem dolnym 2)
47
Metodyka badań – Suszenie rozpyłowe
α
-amylazy
i otaczającego (oznaczenia z indeksem dolnym 0) oraz zmian zawartości wody w suszonym
materiale obliczono:
-
bezwzględną zawartość wody w powietrzu otaczającym i wylotowym
x
(kg H
2
O/kg
p.s.):
t
t
i
x
⋅
+
−
=
93
,
1
2500
(4.4)
gdzie:
)
93
,
1
2500
(
m
m
m
t
x
t
i
⋅
+
+
=
)
(
)
(
622
,
0
m
n
m
n
m
p
p
p
x
−
=
i
- entalpia powietrza (kJ/kg p.s.)
t
- temperatura powietrza (°C)
t
m
- temperatura termometru mokrego (°C)
p
n(m)
- ciśnienie nasycenia w temperaturze termometru mokrego (Pa)
p
- ciśnienie atmosferyczne (Pa)
-
entalpię powietrza wlotowego, wylotowego i otaczającego
i
(kJ/kg p.s.)
:
)
93
,
1
2500
(
t
x
t
i
⋅
+
+
=
(4.5)
gdzie:
t
- temperatura (°C)
x
- bezwzględna zawartość wody (kg H
2
O/kg p.s.)
-
strumień wody odparowanej w czasie suszenia
W
(kg H
2
O/s):
k
k
p
p
u
u
u
G
W
−
−
=
100
(4.6)
gdzie:
G
p
- strumień masowy surowca (kg/s)
u
p
- początkowa zawartość H
2
O w materiale (%)
u
k
- końcowa zawartość wody w materiale (%)
-
właściwe zużycie powietrza
l
(kg p.s./kg H
2
O):
48

Metodyka badań – Suszenie rozpyłowe
α
-amylazy
0
2
1
x
x
l
−
=
(4.7)
gdzie:
x
0
- bezwzględna zawartość wody w powietrzu otaczającym (kg H
2
O/kg
p.s.)
x
2
- bezwzględna zawartość wody w powietrzu wylotowym (kg H
2
O/kg
p.s.)
-
zużycie powietrza
L
(kg p.s./s)
:
l
W
L
⋅
=
(4.8)
49

Metodyka badań – Kinetyka inaktywacji cieplnej
α
-amylazy
-
właściwe zużycie ciepła
q
(kJ/kg H
2
O):
0
2
0
2
x
x
i
i
q
−
−
=
(4.9)
gdzie:
i
0
- entalpia powietrza otaczającego (kJ/kg p.s.)
i
2
- entalpia powietrza wylotowego (kJ/kg p.s.)
4.3. KINETYKA INAKTYWACJI CIEPLNEJ
α
-AMYLAZY
4.3.1. Oznaczenie aktywności
α
-amylazy
Do oznaczenia aktywności enzymu w tej części pracy stosowano zestaw testowy
Amylase FL
produkowany przez Chema Diagnostica (Włochy).
Skład reagentu:
-
0,0023 M 2-chloro-4-nitrofenylo-
α
-
D
-maltotriozyd (CNPG3)
-
0,35 M NaCl
-
0,006 M (CH
3
COO)
2
Ca
-
0,6 M KSCN
-
0,1 M bufor Good’a pH 6.0
-
stabilizatory.
Zasada metody
α
-amylaza hydrolizuje 2-chloro-4-nitrofenylo-
α
-
D
-maltotriozyd (CNPG3) z uwolnieniem
2-chloro-4-nitrofenolu (CN), utworzeniem 2-chloro-4-nitrofenylo-
α
-
D
-maltozydu (CNPG2),
maltotriozy (G3) i glukozy (G). Miarą aktywności enzymu jest szybkość tworzenia
2-chloro-4-nitrofenolu, charakteryzującego się żółtą barwą, mierzona spektrofotometrycznie
przy
długości fali 405 nm w czasie 4 minut ciągłego pomiaru.
Wykonanie oznaczenia
Przed rozpoczęciem pomiarów reagent inkubowano przynajmniej 10 minut
w temperaturze 30°C. W celu wykonania oznaczenia 1 cm
3
reagentu przenoszono do
jednorazowej mikrokuwety, dodawano 25 µl próbki zawierającej enzym, mieszano.
Dokonywano ciągłego pomiaru absorbancji przy długości fali 405 nm. Schemat stanowiska do
oznaczenia aktywności enzymu przedstawiono na rysunku 4.4.
50
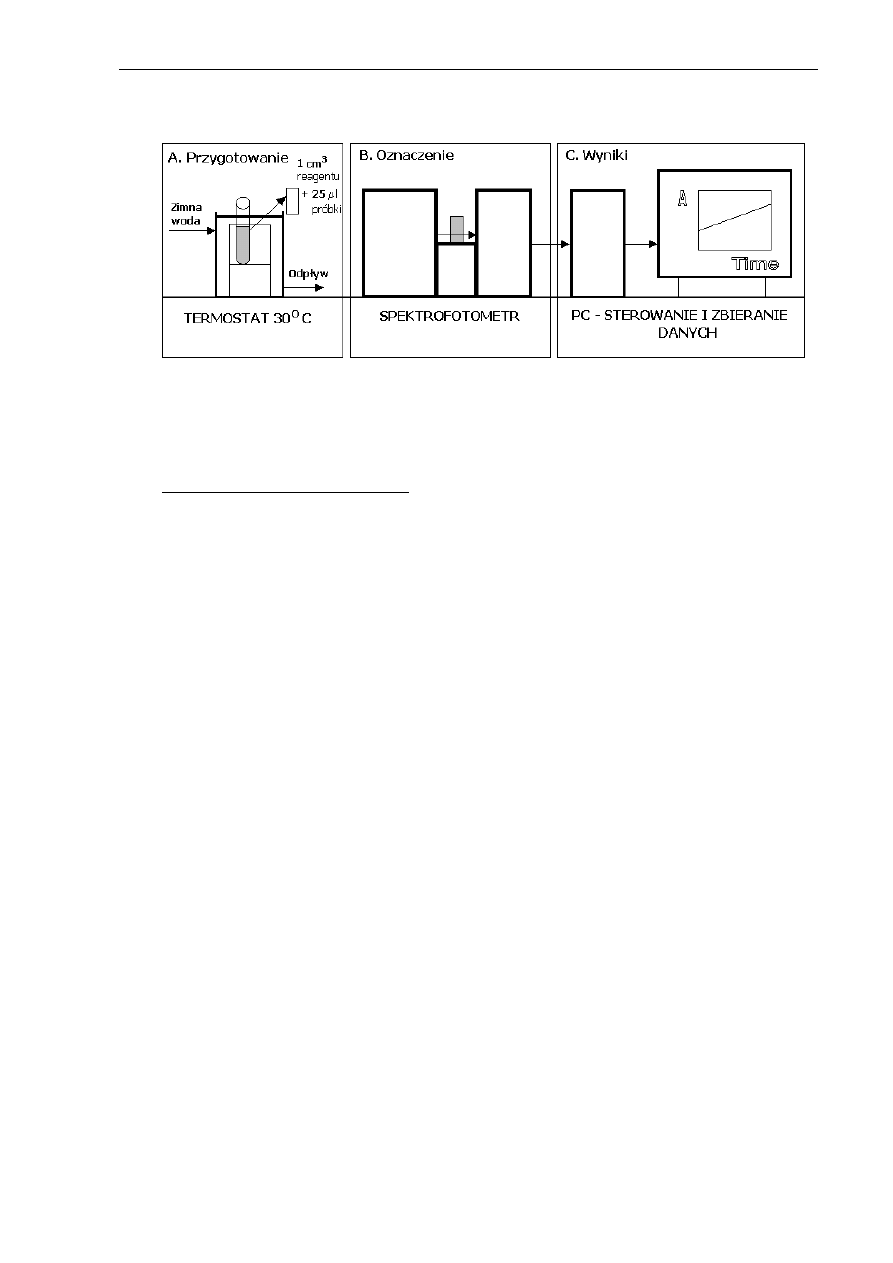
Metodyka badań – Kinetyka inaktywacji cieplnej
α
-amylazy
Rys. 4.4. Schemat stanowiska do oznaczania aktywności amylazy: przygoto-
wanie reagentu – inkubacja w temperaturze 30°C oraz dodanie badanej
próbki (A), ciągły pomiar absorbancji przez 4 minuty przy długości fali 405 nm
(B), PC - sterowanie i odczyt wyników (C)
Interpretacja wyników oznaczenia
Za aktywność enzymu przyjmowano wartość współczynnika nachylenia prostej na
wykresie absorbancji w funkcji czasu. Ze względu na konieczność ustabilizowania się
temperatury w kuwecie pomiarowej, pod uwagę brano wartość współczynnika nachylenia
w czasie od 2 do 4 minuty pomiaru. Przykładowe wykresy uzyskane w czasie oznaczenia
aktywności
α
-amylazy przedstawiono na rysunku 4.5.
4.3.1.1. Optymalizacja oznaczenia
Przed rozpoczęciem właściwych doświadczeń, dotyczących kinetyki inaktywacji cieplnej
α
-amylazy, konieczna była optymalizacja oznaczenia aktywności enzymu, tzn. dobór takiego
stężenia enzymu w badanych próbkach, aby możliwe było oznaczenie aktywności początkowej
oraz aktywności zmniejszonej po obróbce cieplnej. Początkowe stężenie enzymu nie mogło być
większe od pewnej granicznej wielkości, przy której następuje zużycie całości substratu przed
upływem całkowitego czasu oznaczenia. Przy zbyt dużym stężeniu enzymu substrat był
całkowicie rozkładany przed upływem całkowitego czasu oznaczenia. Objawiało się to
spłaszczeniem wykresu absorbancji w funkcji czasu (Rys. 5.17).
51
Metodyka badań – Kinetyka inaktywacji cieplnej
α
-amylazy
0,0
0,2
0,4
0,6
0,8
1,0
1,2
0
60
120
180
240
Czas (s)
A
b
so
rb
an
cja
1
2
Rys. 4.5. Przykładowe wykresy
uzyskane w czasie oznaczenia
aktywności
α
-amylazy: próbka
enzymu o wysokiej aktywności
(1), próbka enzymu o niskiej
aktywności (2)
W celu wyznaczenia granicznego stężenia enzymu, poniżej którego oznaczenie
aktywności odbywa się w warunkach wysycenia substratem w czasie całego oznaczenia,
oznaczono aktywność enzymu przy jego siedmiu różnych stężeniach: 0,0; 0,3; 0,6; 1,2; 1,8;
2,4 i 3,0 FAU/cm
3
. Wykres zależności aktywności enzymu od jego stężenia w warunkach
wysycenia enzymu substratem powinien przyjmować formę linii prostej.
4.3.2. Kinetyka inaktywacji cieplnej
α
-amylazy w systemach o wysokiej
zawartości wody.
4.3.2.1. Przygotowanie próbek
Kinetykę inaktywacji cieplnej
α
-amylazy badano w trzech systemach o wysokiej
zawartości wody:
-
roztworze wodnym, dodatek enzymu 1,8 FAU/cm
3
– w dalszej części pracy
nazywanym S1,
-
roztworze wodnym z dodatkiem maltodekstryny, dodatek enzymu 1,8 FAU/cm
3
,
zawartość wody 3,5 g H
2
O/g s.s. – w dalszej części pracy nazywanym S2,
-
roztworze wodnym z dodatkiem maltodekstryny, dodatek enzymu 1,8 FAU/cm
3
,
zawartość wody 1,8 g H
2
O /g s.s. – w dalszej części pracy nazywanym S3.
Po przygotowaniu roztworów napełniano nimi kapilary szklane (Hirschmann, Niemcy)
o długości 150 mm i średnicy 1,5 mm. Umieszczanie roztworów przeznaczonych do wykonania
doświadczeń inaktywacji cieplnej w kapilarach miało na celu zapewnienie ogrzewania
izotermicznego roztworów. Ilość roztworu zamkniętego w jednej kapilarze wynosiła około
60 - 80
µ
l i była wystarczająca do wykonania jednego punktu inaktywacji, tzn. jednej
kombinacji czasu i temperatury. Za pomocą aparatury przedstawionej na rysunku 4.6
52

Metodyka badań – Kinetyka inaktywacji cieplnej
α
-amylazy
napełniano równocześnie zestaw kapilar potrzebnych do wykonania pełnego doświadczenia
(np. 8 różnych czasów w 2-4 temperaturach). Próbkę roztworu umieszczano w naczynku
w eksykatorze (1), nad nią pionowo umieszczono zestaw kapilar związanych u góry gumką
i utwierdzonych na drucianej prowadnicy. Końce kapilar skierowane ku górze były zamknięte,
skierowane ku dołowi, w kierunku roztworów – otwarte. Eksykator szczelnie zamykano
i uruchamiano na 5 minut pompę próżniową (2) w celu usunięcia powietrza z eksykatora,
a zatem i z wnętrza kapilar. Następnie, za pomocą prowadnicy, zanurzano dolne końce kapilar
w roztworze i przy użyciu zaworu (3) powoli wprowadzano powietrze do wnętrza eksykatora.
Pod wpływem ciśnienia powietrza roztwór dostawał się do kapilar. Po napełnieniu do
2/3 wysokości wynurzano kapilary z roztworu i całkowicie otwierano zawór doprowadzający
powietrze. Końce kapilar zamykano nad płomieniem, osłaniając roztwór przed działaniem
ciepła. Przed przystąpieniem do dalszej części doświadczeń kapilary oznaczano numerami.
Przykład gotowych kapilar przedstawiono na rysunku 4.7.
4.3.2.2. Obróbka cieplna
Inaktywację cieplną
α
-amylazy przeprowadzano w łaźni wodnej o kontrolowanej
temperaturze. Kapilary zanurzano w łaźni wodnej na określony czas, po którym przenoszono je
do łaźni wodno-lodowej w celu przerwania inaktywacji cieplnej. Schemat doświadczenia
przedstawiono na rysunku 4.8. Po 10 minutach chłodzenia w łaźni wodno-lodowej otwierano
kapilary i dokonywano pomiaru aktywności enzymu.
Początkowo przeprowadzono doświadczenia wstępne w celu ustalenia zakresu
temperatury, w której będą wykonane właściwe doświadczenia kinetyki inaktywacji cieplnej
α
-amylazy w systemach o wysokiej zawartości wody S1 – S3. Zbadano inaktywację enzymu po
5 minutach w następujących temperaturach: 40, 55, 70, 85, 100°C. Z zakresu temperatury,
w którym zachodziła gwałtowna inaktywacja enzymu, wybrano po 4 temperatury dla każdego
systemu S1 – S3, w których przeprowadzono właściwe badania kinetyki inaktywacji cieplnej.
Temperatury te oraz czasy inaktywacji przedstawiono w tabeli 4.1.
53
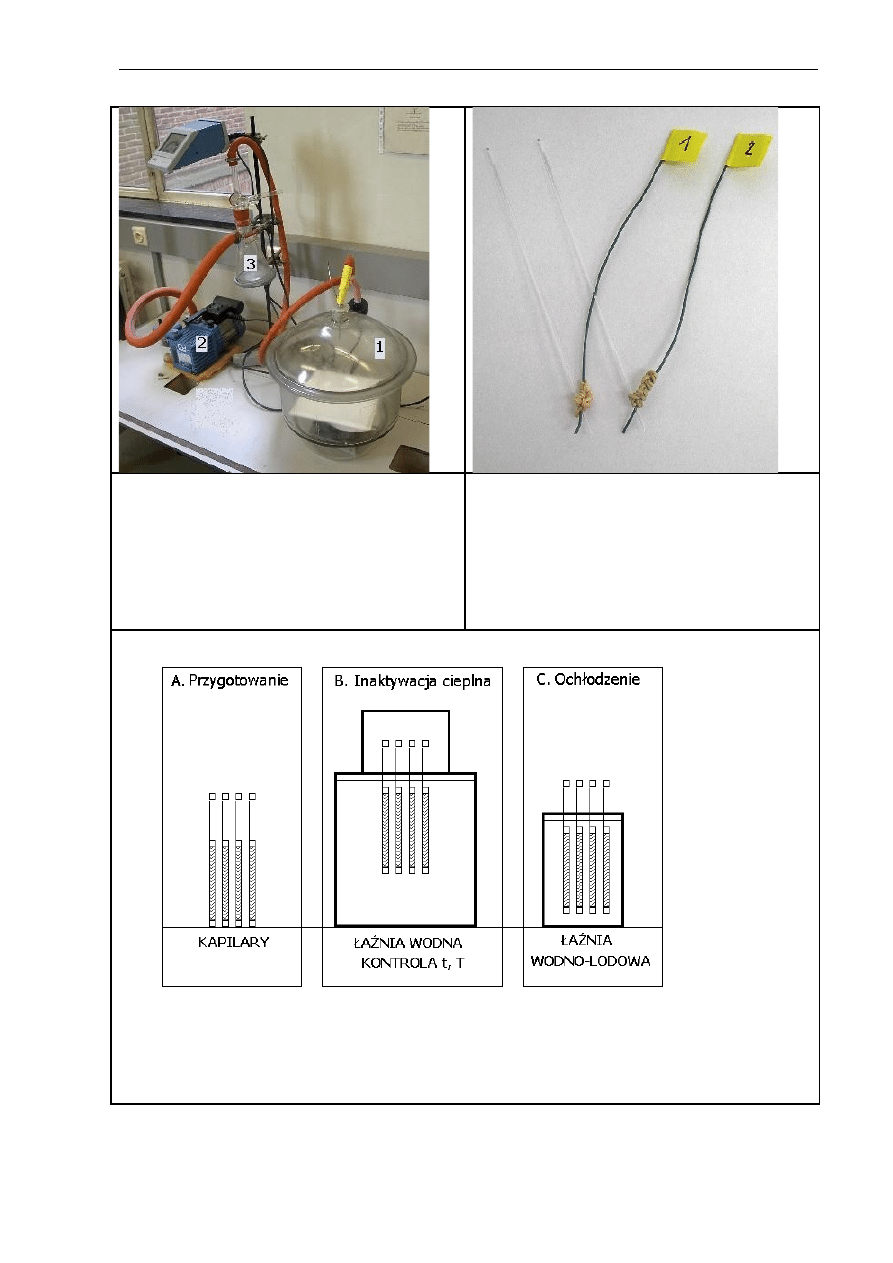
Metodyka badań – Kinetyka inaktywacji cieplnej
α
-amylazy
Rys. 4.6. Zestaw urządzeń do napełnia-
nia kapilar roztworami enzymu:
szczelnie zamykany eksykator – miejsce
umieszczenia roztworów i kapilar (1),
pompa próżniowa (2), zawór sterujący
przepływem powietrza (3)
Rys. 4.7. Kapilary szklane wypełnione
badanym roztworem enzymu przygoto-
wane do doświadczeń inaktywacji
cieplnej
α
-amylazy
Rys. 4.8. Schemat doświadczenia inaktywacji cieplnej
α
-amylazy. Roztwór
enzymu zamknięty w kapilarach (A), inaktywacja cieplna w łaźni wodnej (B),
przerwanie reakcji inaktywacji w łaźni wodno-lodowej (C)
54

Metodyka badań – Kinetyka inaktywacji cieplnej
α
-amylazy
Tabela 4.1. Parametry doświadczeń inaktywacji cieplnej
α
-amylazy
w systemach o wysokiej zawartości wody
S1
S2
S3
Temp. (
o
C)
62,5 65,0 67,5 70,0 70,0 72,5 73,5 75,0 73,5 75,0 76,5 78,5
Czas (min)
0,0
0,0
0,0
0,0
0,0
0,0
0,0
0,0
0,0
0,0
0,0
0,0
1,0
0,2
0,0
0,08
0,5
0,5
0,5
0,5
2,5
1,5
1,0
1,0
2,5
0,5
0,5
0,25
1,0
1,0
1,0
1,0
5,0
2,5
2,0
2,0
5,0
1,0
1,0
1,0
2,5
2,5
2,5
2,0
7,5
5,0
4,0
3,0
7,5
2,5
2,0
2,5
5,0
5,0
5,0
4,0
10,0
7,5
5,0
4,0
10,0
5,0
4,0
3,5
7,5
7,5
7,5
6,0
15,0 10,0
6,0
5,0
12,5
7,5
6,0
5,0
10,0 10,0 10,0
8,0
20,0 12,5
8,0
6,0
17,5 10,0
8,0
20,0 12,5 12,5
30,0 15,0 10,0
15,0 10,0
15,0
20,0 12,0
20,0
4.3.3. Kinetyka inaktywacji cieplnej
α
-amylazy w systemach o niskiej
zawartości wody.
Kinetykę inaktywacji cieplnej
α
-amylazy badano w trzech systemach o niskiej
zawartości wody:
-
proszku suszonym liofilizacyjnie o zawartości wody 0,163 g H
2
O/g s.s. – w dalszej
części pracy nazywanym S4,
-
proszku suszonym liofilizacyjnie o zawartości wody 0,060 g H
2
O/g s.s. – w dalszej
części pracy nazywanym S5,
-
proszku suszonym liofilizacyjnie o zawartości wody 0,029 g H
2
O/g s.s. – w dalszej
części pracy nazywanym S6.
Sposób otrzymania tych proszków, obejmujący suszenie liofilizacyjne, dosuszanie nad
P
2
O
5
oraz adsorpcję pary wodnej nad nasyconymi roztworami soli przedstawiono na rysunku
4.9 i opisano w kolejnych punktach.
4.3.3.1. Liofilizacja i dosuszanie
Liofilizacji poddawano enzym w wodnym roztworze maltodekstryny o zawartości wody
3,5 g H
2
O/g s.s. (taka sama zawartość wody jak w roztworze do suszenia rozpyłowego
i w systemie S2). Dodatek preparatu enzymatycznego wynosił 91,2 g Fungamyl/kg s.s.
maltodekstryny. Dawka enzymu w roztworze przeznaczonym do liofilizacji została ustalona na
podstawie wielkości pojedynczej próbki przeznaczonej do badania inaktywacji cieplnej.
Ponieważ wielkość tej próbki wynosiła około 15 mg, mogło się w niej znajdować maksymalnie
1,8 FAU enzymu, aby pomiar aktywności odbywał się w zakresie wysycenia enzymu
substratem.
55
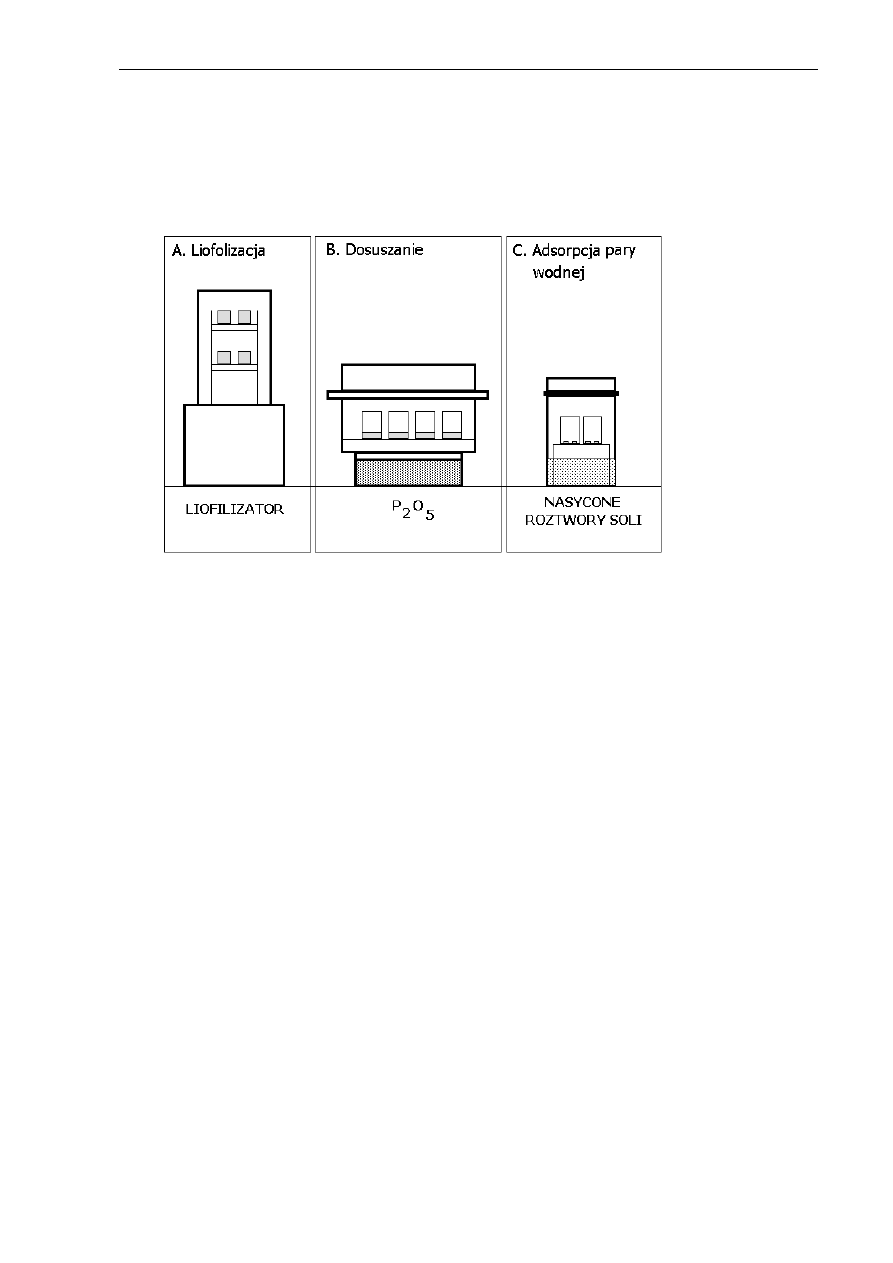
Metodyka badań – Kinetyka inaktywacji cieplnej
α
-amylazy
Roztwór przeznaczony do suszenia sublimacyjnego zamrażano w ciekłym azocie.
Liofilizację prowadzono w liofilizatorze Christ Alpha 4 przy ciśnieniu 10 Pa, w czasie
20 godzin w temperaturze półki 15°C.
Rys. 4.9. Schemat otrzymywania systemów
α
-amylazy o niskiej zawartości
wody
Po liofilizacji otrzymany proszek homogenizowano, umieszczano w cienkich warstwach
w pojemnikach plastikowych, ważono z dokładnością do 0,00001 g i przenoszono do
eksykatora zawierającego na dnie P
2
0
5
, w celu całkowitego dosuszenia. Szczelnie zamknięty
eksykator umieszczano w chłodni o kontrowanej temperaturze 4°C. Po 10 dniach próbki
ważono codziennie do uzyskania stałej masy.
4.3.3.2. Adsorpcja pary wodnej i izoterma sorpcji
Po dosuszeniu proszku nad P
2
0
5
do stałej masy próbki o średniej masie około 15 mg
przenoszono do kapsułek ze stali nierdzewnej (DSC pans, Perkin Elmer) o średnicy
wewnętrznej 7 mm. Kapsułki przed i po napełnieniu proszkiem ważono z dokładnością do
0,00001 g. Kapsułkę przedstawiono na rysunku 4.11. Próbki umieszczano w szczelnie
zamykanych słoikach zawierających nasycone roztwory soli, słoiki zamykano i umieszczano
w chłodni o kontrowanej temperaturze 4°C (Rys. 4.10).
W celu wyznaczenia izotermy sorpcji stosowano 7 nasyconych roztworów soli
wykazujących różne równowagowe wilgotności względne – wartości według Greenspan (1977)
nich przedstawiono w tabeli 4.2. W celu otrzymania próbek o trzech różnych zawartościach
wody, przeznaczonych do badań kinetyki inaktywacji
α
-amylazy (systemy S4 – S6), stosowano
nasycone roztwory następująych soli: NaBr, MgCl
2
, LiCl. Po osiągnięciu przez próbki
56

Metodyka badań – Kinetyka inaktywacji cieplnej
α
-amylazy
równowagowej wilgotności względnej oznaczano w nich początkową aktywność
α
-amylazy,
uprzednio ważąc je i rozpuszczając w 1 cm
3
roztworu buforowego.
Tabela 4.2. Równowagowe wilgotności względne nasyconych roztworów soli
RWW nasyconego
roztworu soli w 4°C (%)
LiCl
11,26 ± 0,47
CH
3
COOK
23,38 ± 0,53
MgCl
2
33,60 ± 0,28
K
2
CO
3
43,13 ± 0,30
NaBr
63,51 ± 0,72
NH
4
Cl
80,55 ± 0,96
K
2
SO
4
98,48 ± 0,91
4.3.3.3. Obróbka cieplna
Po osiągnięciu przez próbki równowagowej wilgotności względnej kapsułki zamykano,
umieszczano w siatkach z tworzywa sztucznego i oznaczano numerami (Rys. 4.12).
Inaktywację cieplną przeprowadzano w łaźni olejowej zgodnie z rysunkiem 4.8. Próbki
umieszczano na określony czas w łaźni olejowej o określonej temperaturze, a następnie
przenoszono do łaźni wodno-lodowej w celu przerwania inaktywacji. Po 10 minutach kapsułki
otwierano, ważono ilość proszku, rozpuszczano w 1 cm
3
roztworu buforowego i oznaczano
aktywność
α
-amylazy. W tabeli 4.3. przedstawiono temperatury i czasy, w jakich prowadzono
inaktywację
α
-amylazy w trzech systemach o niskiej zawartości wody.
Tabela 4.3. Parametry doświadczeń inaktywacji cieplnej
α
-amylazy
w systemach o niskiej zawartości wody
S4
S5
S6
Temp.(
o
C)
95,0 97,0 98,5 100,0 100,0 102,5 105,0 107,5 100,0 105,0 110,0 115,0
Czas (min)
0,0
0,0
0,0
0,0
0,0
0,0
0,0
0,0
0,0
0,0
0,0
0,0
5,0
1,0
1,0
1,0
3,5
1,0
1,0
1,0
2,5
2,5
1,0
1,0
7,5
2,5
2,0
2,5
6,0
5,0
2,5
1,5
5,0
5,0
2,0
2,0
10,0 5,0
3,0
5,0
7,5
5,0
4,0
2,0
10,0
7,5
3,5
4,0
15,0 7,5
4,0
7,5
10,0 10,0
6,0
2,5
15,0 10,0
6,5
5,0
20,0 10,0 6,0
10,0
12,5 20,0
7,5
3,0
20,0 15,0 10,0
7,0
25,0 15,0 8,0
15,0 15,0
8,0
3,5
25,0 20,0 15,0 10,0
20,0 12,0
17,5
10,0
30,0 30,0 20,0
57

Metodyka badań – Kinetyka inaktywacji cieplnej
α
-amylazy
Rys. 4.10. Próbki proszku zawierającego
enzym umieszczone w kapsułkach i szczelnie
zamykanym słoiku z nasyconym roztworem soli
Rys. 4.11. Kapsułki, w których
umieszczano próbki proszku
zawierającego enzym: przykry-
wka (1), napełniona (2)
i zamknięta (3)
Rys. 4.12. Kapsułki wypełnione
badanym proszkiem zawierają-
cym enzym, w siatkach
z tworzywa sztucznego,
przygotowane do badania
inaktywacji termicznej
α
-amylazy
4.3.4. Wpływ dodatków stabilizujących na kinetykę inaktywacji cieplnej
α
-amylazy
4.3.4.1. Przygotowanie próbek
Kinetykę inaktywacji cieplnej
α
-amylazy badano w obecności następujących substancji
dodatkowych: mannitol, laktitol, sorbitol, glicerol, trehaloza, sacharoza. Substancje stabilizujące
dodawane były do 20 mM roztworu buforowego Bis-Tris o pH równym 7,0. Ponieważ celem tej
części pracy była weryfikacja hipotezy o wpływie ilości grup OH w roztworach na efekt
stabilizujący zastosowanych substancji stabilizujących (Guiavarc’h i wsp. 2003), ilości
dodawanych substancji były dobrane tak, aby zapewnić tę samą liczbę grup OH, ale
pochodzących z różnych źródeł. Stosowane stężenia substancji stabilizujących i odpowiadające
im ilości grup OH w roztworach przedstawiono w tabeli 4.4. Do obliczenia ilości grup OH
korzystano z następującego wzoru:
58
Metodyka badań – Kinetyka inaktywacji cieplnej
α
-amylazy
M
N
A
c
n
OH
OH
⋅
⋅
=
(4.10)
gdzie:
n
OH
- liczba grup OH w jednostce badanego roztworu
(liczba grup/cm
3
)
c
- stężenie danej substancji dodatkowej (g/cm
3
)
A
- liczba Avogadro = 6,022·10
23
(liczba cząsteczek/mol)
N
OH
- liczba grup OH w cząsteczce danej substancji dodatkowej (liczba
grup/cząsteczka)
M
- masa molowa danej substancji dodatkowej (g/mol)
Dodatek enzymu do roztworów był we wszystkich przypadkach taki sam i wynosił
1,8 FAU/cm
3
. Po sporządzeniu roztworów i dodaniu enzymu były one zamykane w kapilarach –
procedurę przedstawiono w punkcie 4.3.2.1.
Tabela 4.4. Stężenia substancji stabilizujących i odpowiadające im liczby
grup OH w roztworach
Liczba grup
OH/cm
3
Mannitol
mg/cm
3
Laktitol
mg/cm
3
Sorbitol
mg/cm
3
Glicerol
% (v/v)
Trehaloza
mg/cm
3
Sacharoza
mg/cm
3
0,198 x 10
22
100
100
8,1
140
140
0,281 x 10
22
200
200
0,314 x 10
22
200
13,0
0,396 x 10
22
200
0,595 x 10
22
300
24,8
420
420
0,725 x 10
22
30,0
0,992 x 10
22
500
41,0
705
Pogrubienie – systemy, w których przeprowadzono szczegółową analizę kinetyki
inaktywacji cieplnej
α
-amylazy w temperaturach 62, 64, 66 i 68°C
4.3.4.2. Obróbka cieplna
Inaktywację cieplną
α
-amylazy badano w temperaturze 68°C w przypadku wszystkich
przedstawionych powyżej stężeń dodatków stabilizujących, a także w roztworze buforowym bez
żadnych dodatków. Przy wybranych stężeniach przeprowadzono szczegółową analizę kinetyki
inaktywacji w temperaturach 62, 64, 66, 68°C. Były to następujące stężenia: 100 mg/cm
3
mannitolu, 200 mg/cm
3
laktitolu, 300 mg/cm
3
sorbitolu, 30 % (v/v) glicerolu, 200 mg/cm
3
trehalozy, 200 mg/cm
3
sacharozy.
Sposób przeprowadzania doświadczeń – jak w punkcie 4.3.2.2.
59

Metodyka badań – Kinetyka inaktywacji cieplnej
α
-amylazy
4.3.5. Wyznaczanie parametrów kinetycznych inaktywacji cieplnej
α
-amylazy
Wyznaczenie parametrów kinetycznych inaktywacji enzymów na podstawie uzyskanych
danych eksperymentalnych wymaga postępowania dwustopniowego. Najpierw określa się, za
pomocą jakich wyrażeń matematycznych opisywać się będzie relacje między wartościami
zależnymi i niezależnymi. Następnie dobiera się odpowiednie metody regresji, jakie będą
stosowane w celu dopasowania dostępnych danych do wybranych równań z jak największą
dokładnością.
Termin „kinetyka” oznacza postęp badanej reakcji w czasie. To, w jaki sposób dana
reakcja przebiega (np. liniowo, nieliniowo) opisywane jest za pomocą modeli kinetycznych.
Przebieg reakcji w czasie opisywany jest za pomocą kinetycznego modelu pierwszorzędowego.
Model drugorzędowy określa wpływ określonego parametru (np. temperatury) na parametry
modelu pierwszorzędowego.
Przy wyznaczaniu parametrów kinetycznych reakcji najpierw określa się sposób
przebiegu badanej reakcji w czasie. W przypadku inaktywacji termicznej wielu enzymów,
w tym
α
-amylazy, często stosuje się opis za pomocą równania reakcji pierwszego rzędu
(Guiavarc’h i wsp. 2002, Terebiznik i wsp. 1997). W tym modelu podstawowym parametrem
kinetycznym jest stała szybkości reakcji
k
(równanie 4.11). Do opisu degradacji
mikroorganizmów lub inaktywacji enzymów często stosowany jest też model czasu śmierci
cieplnej (Thermal Death Time, Bigelow 1921), opierający się na parametrze kinetycznym
D
,
nazywanym czasem dziesięciokrotnej redukcji i definiowanym jako czas potrzebny,
w danej temperaturze, do zmniejszenia ilości żywych mikroorganizmów (lub do zmniejszenia
aktywności enzymu) o 90 % (równanie 4.13).
Do pełnego opisu modelu inaktywacji stosowane są równania opisujące wpływ
eksperymentalnie stosowanych parametrów (np. temperatury) na pierwszorzędowe parametry
kinetyczne. Najczęściej stosowanym równaniem opisującym wpływ temperatury na stałą
szybkości reakcji jest równanie Arrheniusa. Zależność między temperaturą a stałą szybkości
reakcji jest wyrażana za pomocą energii aktywacji
E
a
(równanie 4.12). W równolegle
stosowanym modelu czasu śmierci cieplnej zależność między temperaturą a wartością
D
opisywana jest za pomocą wartości
z
(równanie 4.14).
Po określeniu za pomocą jakich równań będą wyznaczane parametry kinetyczne
inaktywacji, można przejść do drugiego etapu, czyli praktycznego wyznaczania tych
parametrów na podstawie danych eksperymentalnych, za pomocą regresji metodą
najmniejszych kwadratów. Sposób przeprowadzania regresji również może być różny,
stosowane są metody jedno- i dwustopniowe.
60
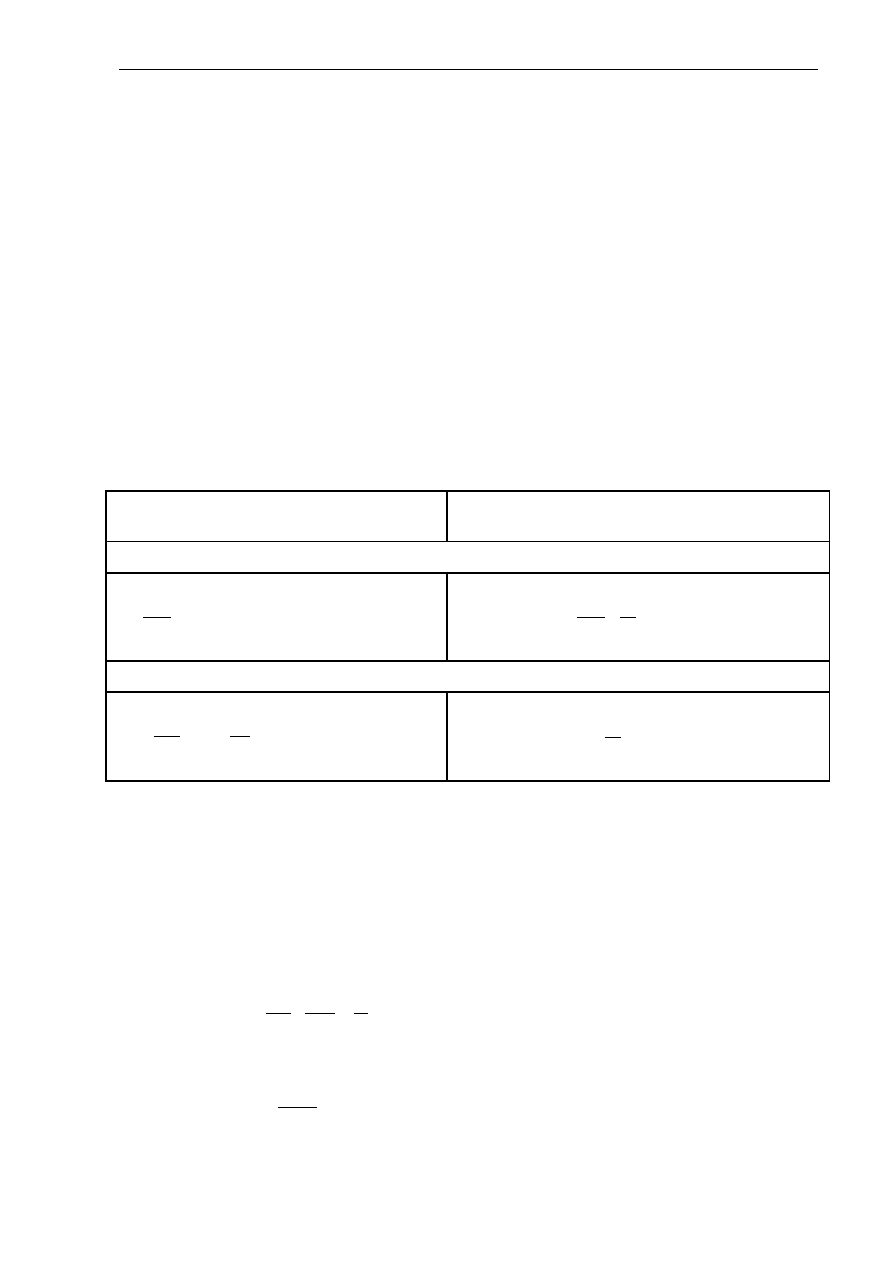
Metodyka badań – Kinetyka inaktywacji cieplnej
α
-amylazy
W metodzie dwustopniowej najpierw wyznacza się za pomocą liniowej regresji prostej
parametry pierwszorzędowe, czyli
k
i
D
. W drugim etapie za pomocą tej samej techniki
wyznacza się parametry drugorzędowe, czyli
E
a
i
z,
w oparciu o wcześniej wyznaczone
parametry pierwszorzędowe. Zaletą tej metody jest to, że ważność modelu może być oceniona
graficznie, a parametry obliczane są bezpośrednio z równania regresji. Wadą tej metody jest
to, że w rezultacie stosowania wyników pierwszej regresji jako danych do drugiej regresji, błąd
pierwszej regresji wpływa na dokładność szacowania parametrów drugorzędowych. Schemat
postępowania w dwustopniowym szacowaniu parametrów kinetycznych inaktywacji
α
-amylazy
przedstawiono w tabeli 4.5.
Tabela 4.5. Równania stosowane do dwustopniowego wyznaczania
parametrów kinetycznych inaktywacji
α
-amylazy, przebiegającej zgodnie
z równaniem reakcji pierwszego rzędu
1. Model pierwszorzędowy –
przebieg procesu w czasie
2. Model drugorzędowy – wpływ temperatury
M O D E L R E A K C J I I - g o R Z Ę D U + R Ó W N A N I E A R R H E N I U S A
kt
A
A
−
=
0
ln
k
(4.11)
−
=
T
R
E
k
k
a
A
1
ln
ln
a
E
(4.12)
M O D E L C Z A S U Ś M I E R C I C I E P L N E J
t
D
A
A
⋅
−
=
1
log
0
D
(4.13)
z
T
D
D
−
=
0
log
log
z
(4.14)
W jednostopniowej metodzie wyznaczania parametrów kinetycznych inaktywacji
α
-amylazy zestaw danych jest traktowany całościowo. Szacowane są tylko parametry
drugorzędowe (
E
a
, z
), symultanicznie za pomocą regresji nieliniowej metodą najmniejszych
kwadratów. Wartości te wyznaczane są z równań 4.17 i 4.18, które otrzymano poprzez
podstawienie wartości
k
i
D
w równaniach 4.11 i 4.13 zgodnie z równaniami 4.15 i 4.16.
−
=
T
T
R
E
k
k
ref
a
ref
1
1
exp
(4.15)
z
T
T
ref
ref
D
D
−
⋅
=
10
(4.16)
61

Metodyka badań – Kinetyka inaktywacji cieplnej
α
-amylazy
Schemat postępowania w jednostopniowym szacowaniu parametrów kinetycznych
inaktywacji
α
-amylazy przedstawiono w tabeli 4.6.
Tabela 4.6. Równania stosowane do jednostopniowego wyznaczania
parametrów kinetycznych inaktywacji
α
-amylazy, przebiegającej zgodnie
z równaniem reakcji pierwszego rzędu
M O D E L R E A K C J I I - g o R Z Ę D U + R Ó W N A N I E A R R H E N I U S A
t
T
T
R
E
k
A
A
ref
a
ref
⋅
−
−
=
1
1
exp
0
a
E
(4.17)
M O D E L C Z A S U Ś M I E R C I C I E P L N E J
z
T
T
ref
ref
D
t
A
A
−
⋅
−
=
10
0
z
(4.18)
Szacowanie parametrów kinetycznych inaktywacji cieplnej
α
-amylazy na podstawie
uzyskanych danych eksperymentalnych wykonywano za pomocą programu komputerowego
SAS.
4.4. METODY STATYSTYCZNE
4.4.1. Analiza wariancji
Za pomocą dwuczynnikowej analizy wariancji badano zróżnicowanie poziomu aktywności
względnej suszonej
α
-amylazy oraz parametrów opisujących przebieg procesu suszenia
rozpyłowego, ze względu na zastosowane parametry suszenia – temperaturę powietrza
wlotowego oraz strumień surowca. Testowano hipotezę o równości średnich oraz wykonano
analizę porównań wielokrotnych metodą Student-Newman-Keuls w celu podzielenia średnich na
grupy jednorodne, między składnikami których nie występują istotne statystycznie różnice.
Analizę wykonano przy użyciu programu Statgraphics 5.0.
4.4.2. Test t-Studenta
Za pomocą testu t-Studenta weryfikowano hipotezę o równości współczynników
kierunkowych prostych otrzymanych po wykreśleniu zależności między temperaturą powietrza
wylotowego a strumieniem surowca przy czterech temperaturach powietrza wlotowego podczas
62

Metodyka badań – Kinetyka inaktywacji cieplnej
α
-amylazy
suszenia rozpyłowego preparatu
α
-amylazy. W celu weryfikacji hipotezy o równości
współczynników kierunkowych porównywano te współczynniki parami na podstawie testu
istotności dla weryfikacji hipotez statystycznych:
2
2
2
1
1
2
SE
SE
x
x
t
emp
+
−
=
(4.19)
gdzie:
x
1
,
x
2
- wartości współczynników kierunkowych dwóch porównywanych
prostych wyznaczone za pomocą regresji prostej
SE
1
,
SE
2
- błąd standardowy szacowania wartości współczynników
kierunkowych dwóch porównywanych prostych za pomocą regresji
prostej
Obliczone
t
emp
porównywano z tablicową wartością
t
tab
, odczytaną dla poziomu istotności
α
=0,05 i liczby stopni swobody
n
=
n
1
+
n
2
-2
, gdzie
n
1
i
n
2
oznaczają liczbę punktów na podstawie
których szacowano wartość współczynników kierunkowych. Gdy
t
emp
<
t
tab
przyjmowano
hipotezę o równości współczynników kierunkowych (Łomnicki 1999).
63

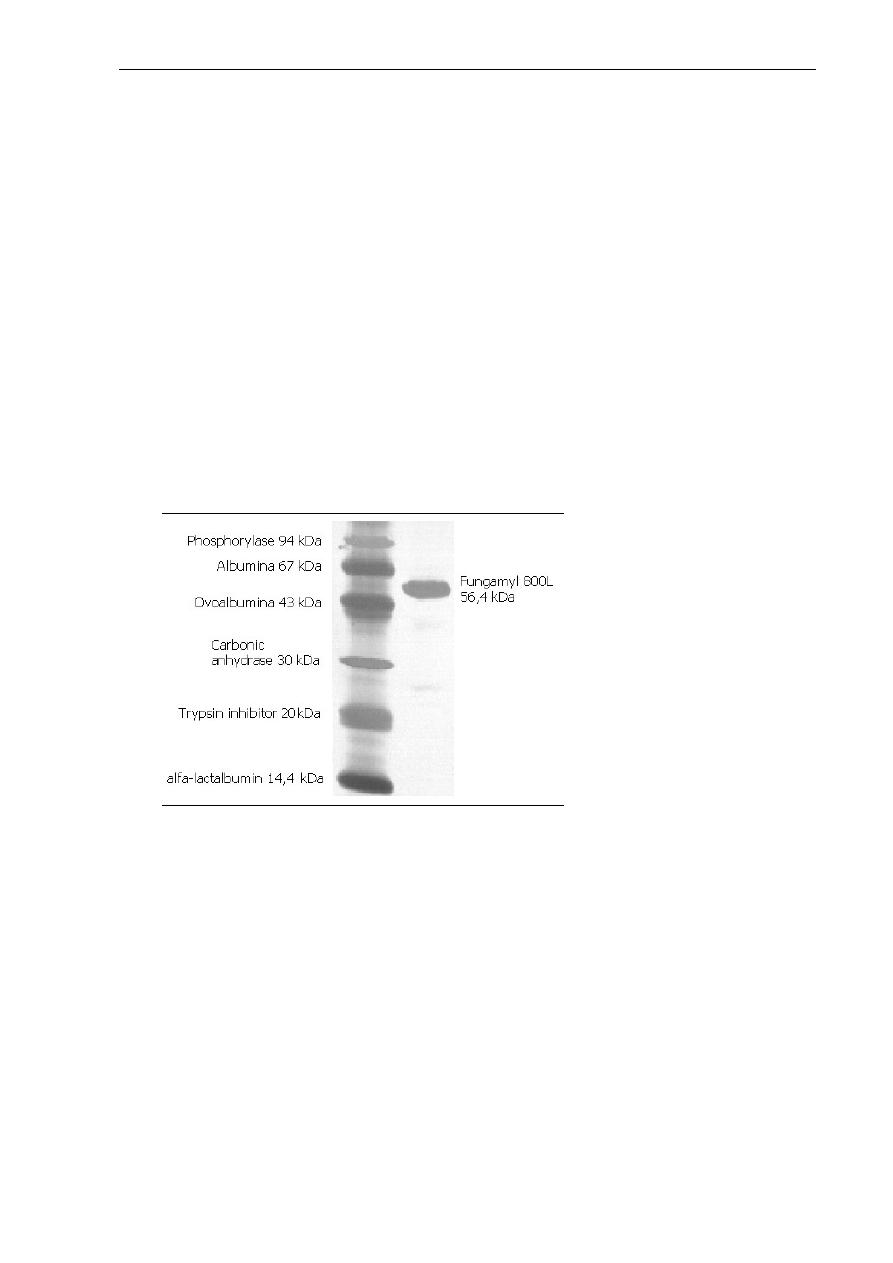
Omówienie i dyskusja wyników – Materiały
5. OMÓWIENIE I DYSKUSJA WYNIKÓW
5.1. CHARAKTERYSTYKA MATERIAŁÓW DO BADAŃ
5.1.1. Preparat
α
-amylazy Fungamyl 800L
5.1.1.1. Masa molowa białka
Bezpośrednio po zakończeniu oznaczenia obraz otrzymany na żelu skanowano,
a następnie analizowano za pomocą programu komputerowego Amersham Biosciences. Obraz
utrwalony na żelu poliakryloamidowym przedstawiono na rysunku 5.1. W lewej kolumnie
widoczne są pasma odpowiadające białkom standardowym o znanych masach molowych.
Pojedyncze pasmo w prawej kolumnie odpowiada badanemu białku. Występowanie tylko
jednego pasma w tej kolumnie świadczy o czystości preparatu enzymatycznego, tzn. braku
zanieczyszczeń innymi białkami oraz o braku izoenzymów o różnych masach molowych.
Rys. 5.1. Białka uwidocznione na żelu poliakryloamidowym po
przeprowadzeniu elektroforezy SDS PAGE
Położenie pasm białek standardowych o znanych masach molowych porównano
z położeniem pasma białka enzymatycznego zawartego w preparacie Fungamyl 800L i na tej
podstawie jego masę molową określono na 56,4 kDa.
Otrzymana wartość jest zgodna z wartościami masy cząsteczkowej
α
-amylaz, jakie są
podawane w literaturze. Janeček i Baláž (1992) podają, że masa molowa
α
-amylaz kształtuje
się na poziomie od 45,0 do 60,0 kDa. Według Repsa (2003) masa cząsteczkowa
α
-amylazy
syntetyzowanej przez
Aspergillus oryzae
wynosi 52,6 kDa. Achremowicz i Wójcik (2000) podają
zakres wartości od 49,0 do 52,6 kDa.
63

Omówienie i dyskusja wyników – Materiały
5.1.1.2. Zawartość białka
Wyniki oznaczenia przedstawiono w tabeli 5.1.
Tabela 5.1. Wyniki oznaczenia zawartości białka w preparacie Fungamyl 800L
Zawartość białka
[mg/cm
3
]
Absorban
cja
Krzywa
wzorcowa
0,00
0,145
0,25
0,461
0,50
0,740
0,75
1,002
1,00
1,236
Absorbancja Fungamyl 800L:
0,618; 0,624; 0,633; 0,635
Średnia: 0,628 ± 0,008
Na podstawnie wyników oznaczenia wykreślono krzywą wzorcową obrazującą zależność
między absorbancją a zawartością białka standardowego w próbce. Krzywą tę przedstawiono
na rysunku 5.2.
y = 1,0892x + 0,1722
R
2
= 0,9968
0,0
0,5
1,0
1,5
0,0
0,2
0,4
0,6
0,8
1,0
Zawartość białka (mg/cm
3
)
A
b
so
rb
an
cja
Rys. 5.2. Krzywa wzorcowa – zależność między absorbancją a zawartością
białka w próbce
64

Omówienie i dyskusja wyników – Materiały
Za pomocą regresji prostej wyznaczono równanie tej krzywej, z którego następnie
obliczono zawartość białka w preparacie Fungamyl 800L. Po uwzględnieniu rozcieńczenia
stosowanego w czasie oznaczenia otrzymano wynik: 183 mg białka/cm
3
Fungamyl 800L.
65
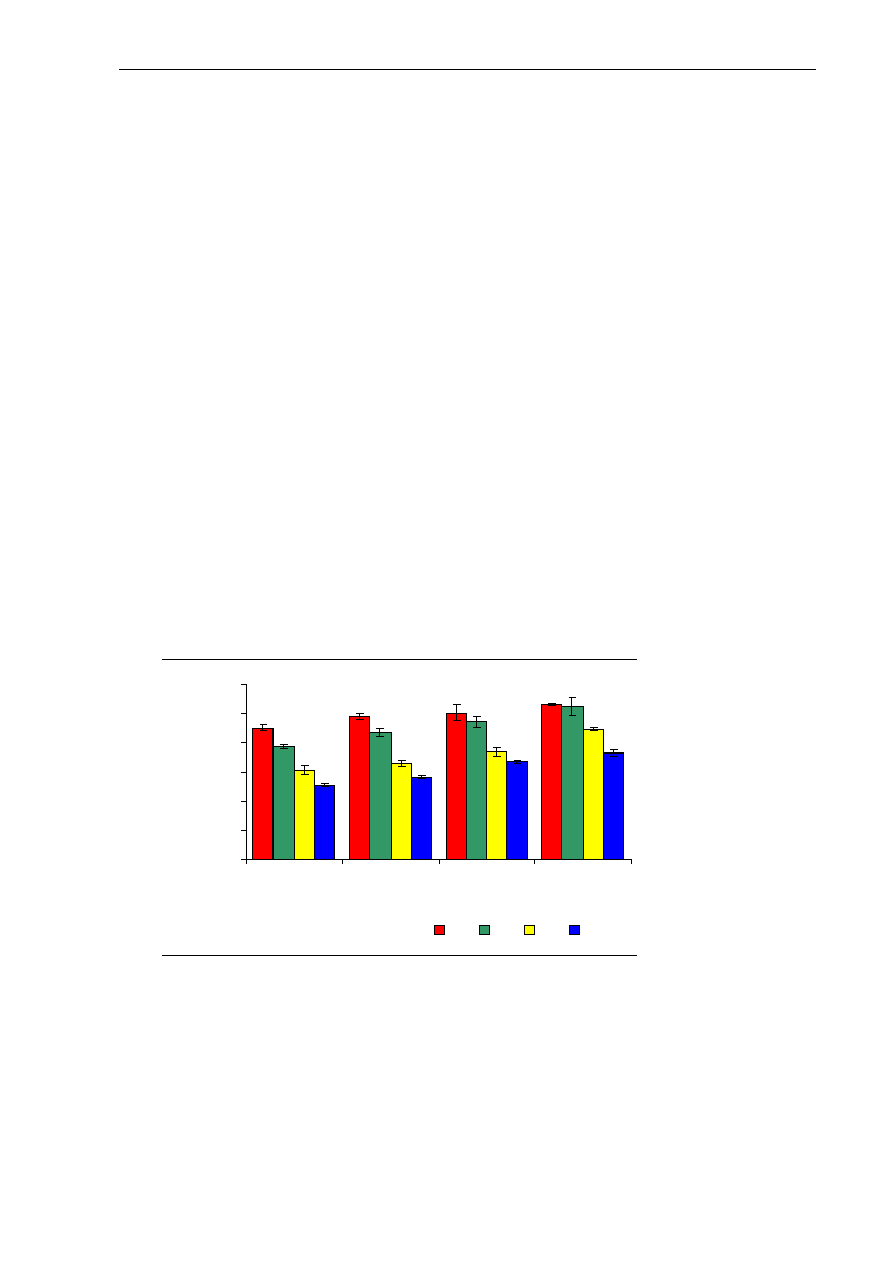
Omówienie i dyskusja wyników – Suszenie rozpyłowe
α
-amylazy
Podobną zawartość białka (225 mg/cm
3
) w tym samym preparacie Fungamyl 800L podają
Graber i Combes (1989).
5.1.1.3. Zawartość suchej substancji
Zawartość suchej substancji w preparacie enzymatycznym Fungamyl 800L wynosiła
57,0 % (zawartość wody 0,75 g H
2
O/g s.s.).
5.1.2. Maltodekstryna
Zawartość wody w maltodekstrynie produkowanej przez „Nowamyl” S.A. wynosiła
0,11 g H
2
O/g s.s., a w maltodekstrynie z Sigma-Aldrich 0,08 g H
2
O/g s.s.
5.2. SUSZENIE ROZPYŁOWE PREPARATU
α
-AMYLAZY
5.2.1. Parametry opisujące przebieg suszenia rozpyłowego
5.2.1.1. Temperatura powietrza wylotowego
Średnią temperaturę powietrza wylotowego w czasie suszenia rozpyłowego preparatu
α
-amylazy, w czterech różnych temperaturach powietrza wlotowego i przy czterech różnych
strumieniach surowca, przedstawiono na rysunku 5.3 i w tabeli 10.1.
0
20
40
60
80
100
120
160
180
200
220
0,4
0,8
1,2
1,7
Temperatura powietrza wlotowego (
o
C)
Strumień surowca (cm
3
/s):
T
em
pe
ra
tu
ra
po
w
ie
tr
za
w
yl
o
to
w
eg
o
(
o
C
)
Rys. 5.3. Średnia temperatura powietrza wylotowego (°C) w czasie suszenia
rozpyłowego preparatu
α
-amylazy w zależności od temperatury powietrza
wlotowego i strumienia surowca
Zmniejszanie temperatury powietrza wlotowego oraz zwiększanie strumienia surowca
powodowało obniżanie temperatury powietrza wylotowego. Na podstawie przeprowadzonej
analizy wariancji wpływ obu zmiennych parametrów suszenia (temperatury powietrza
66
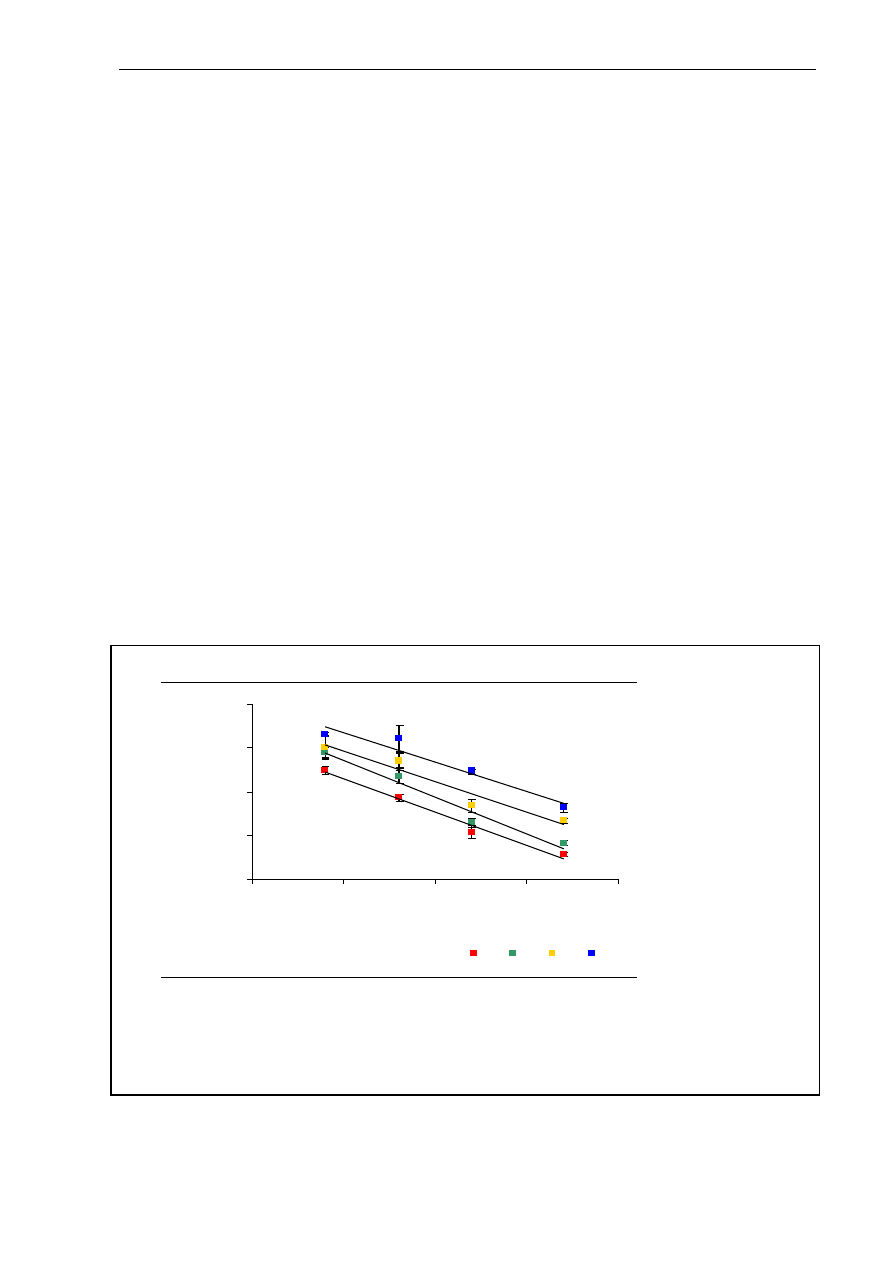
Omówienie i dyskusja wyników – Suszenie rozpyłowe
α
-amylazy
wlotowego i strumienia surowca) na wartość temperatury powietrza wylotowego został uznany
za istotny statystycznie (Tabela 10.2). Zależność między strumieniem surowca
a temperaturą wylotową, przy stałej temperaturze powietrza wlotowego, była prostoliniowa
(Rys. 5.4). Obniżanie temperatury powietrza wylotowego przy wyższych strumieniach surowca
było wynikiem zwiększonego odparowania wody i zwiększonego pobierania ciepła przemiany
fazowej przez parującą wodę. Przy strumieniu surowca równym 0,4 cm
3
/s strumień
odparowanej wody wynosił około 1 kg/h, a gdy strumień surowca zwiększono do
1,7 cm
3
/s w ciągu jednej godziny z materiału odparowało około 5 kg wody (Rys. 5.5). Podobne
wyniki prezentowali Ståhl i wsp. (2002) oraz Nath i Satpathy (1998). W pracy przedstawionej
przez Ståhl i wsp. (2002) temperatura powietrza wylotowego w czasie suszenia rozpyłowego
insuliny w temperaturze powietrza wlotowego 100°C przy strumieniu surowca 0,003 cm
3
/s
wynosiła 72°C, a po zwiększeniu strumienia do 0,083 cm
3
/s zmniejszyła się do 59°C (przy tej
samej temperaturze powietrza wlotowego). Nath i Satpathy (1998) podają, że przy stałej
temperaturze powietrza wlotowego 140°C, temperatura powietrza wylotowego zmniejszyła się
z 58 do 48°C, gdy strumień surowca zwiększono z 7,0 do 15,0 cm
3
/min. Ponadto, autorzy
stwierdzili, że zależność między czterema różnymi szybkościami zasilania a obserwowaną
temperaturą powietrza wylotowego przy stałej temperaturze powietrza wlotowego była
prostoliniowa.
40
60
80
100
120
0
0,5
1
1,5
2
Strumień surowca (cm
3
/s)
T
emp
er
at
u
ra p
o
w
iet
rz
a
w
ylo
to
w
eg
o
(
o
C
)
160
180
200
220
Temperatura powietrza wlotowego (
o
C):
Rys. 5.4. Zależność między strumieniem surowca a temperaturą powietrza
wylotowego przy temperaturach powietrza wlotowego: 160°C (
) R
2
=0,98;
180°C (
) R
2
=0,96; 200°C (
) R
2
=0,94; 220°C (
) R
2
=0,93
Za pomocą testu t-Studenta zweryfikowano hipotezę o równości współczynników
kierunkowych prostych otrzymanych po wykreśleniu zależności między temperaturą powietrza
67
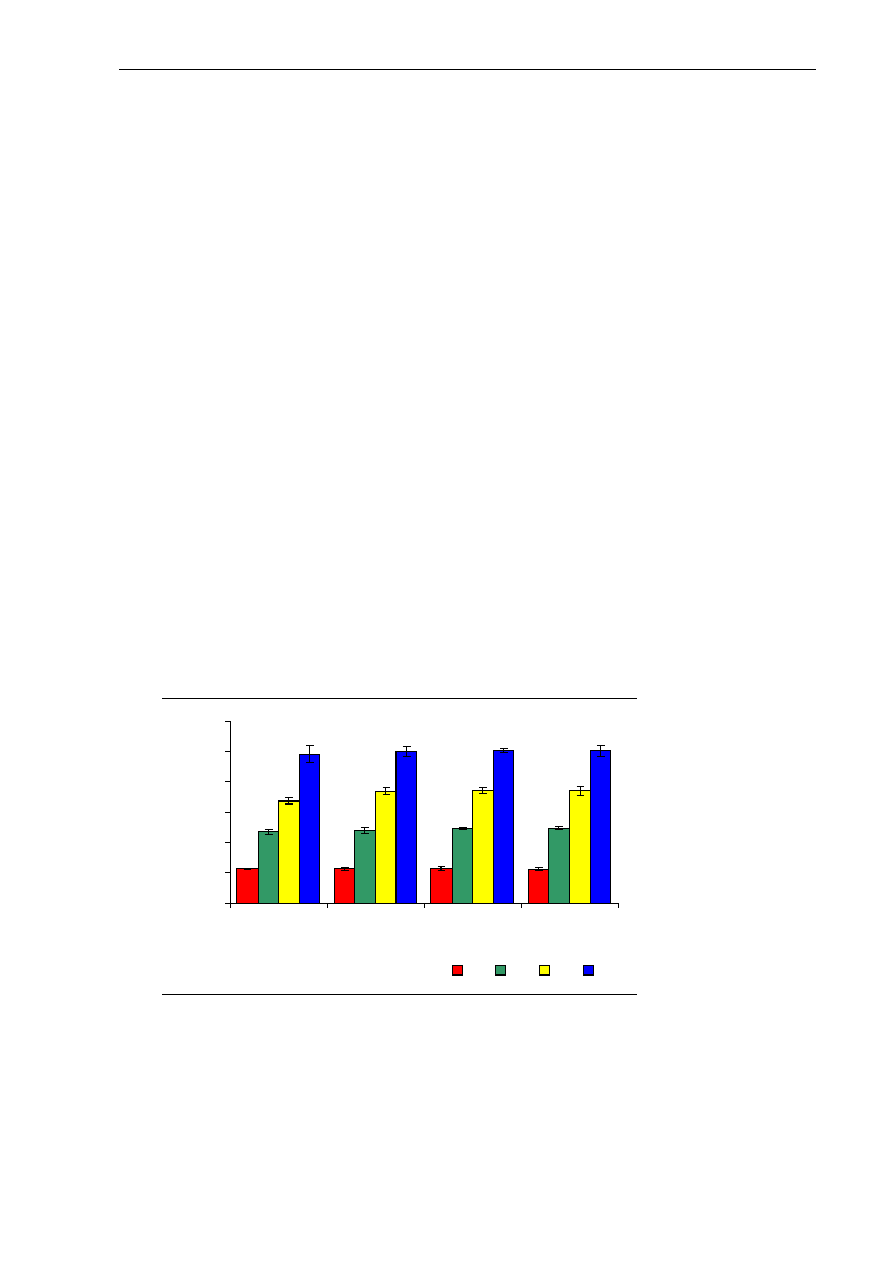
Omówienie i dyskusja wyników – Suszenie rozpyłowe
α
-amylazy
wylotowego a strumieniem surowca w czterech temperaturach powietrza wlotowego (Rys. 5.4).
Stwierdzono, że współczynniki te nie różnią się statystycznie istotnie (Tabela 10.3). Można
przyjąć, że średnia wartość współczynnika kierunkowego jest równa –29,8. Oznacza to, że
zwiększenie strumienia zasilającego o 1 cm
3
spowodowałoby zmniejszenie temperatury
powietrza opuszczającego suszarkę o około 30°C, niezależnie od temperatury powietrza
wlotowego.
5.2.1.2. Strumień odparowanej wody
Średni strumień wody odparowanej podczas suszenia rozpyłowego preparatu
α
-amylazy,
w czterech różnych temperaturach powietrza wlotowego i przy czterech różnych strumieniach
surowca, obliczono z równania 4.6 i przedstawiono na rysunku 5.5 oraz w tabeli 10.4.
Zwiększanie strumienia surowca wpływało na znaczne zwiększenie ilości wody
odparowywanej w jednostce czasu. Strumień odparowanej wody przy suszeniu przy strumieniu
surowca 0,4 cm
3
/s był około pięciokrotnie mniejszy niż przy suszeniu przy strumieniu surowca
1,7 cm
3
/s. W wyniku zwiększonego odparowywania wody i zwiększonego pobierania ciepła
przemiany fazowej, w czasie suszenia przy większych strumieniach surowca, obniżaniu ulegała
temperatura powietrza wylotowego (Rys. 5.4, Tabela 10.1). Na podstawie przeprowadzonej
analizy wariancji wpływ strumienia surowca na zmiany strumienia odparowanej wody uznano
za statystycznie istotny, a wpływ temperatury powietrza wlotowego za nieistotny (Tabela 10.5).
0,0
1,0
2,0
3,0
4,0
5,0
6,0
160
180
200
220
S
tr
u
mie
ń
o
d
p
ar
o
w
an
ej w
o
d
y (
kg
/h
)
0,4
0,8
1,2
1,7
Temperatura powietrza wlotowego (
o
C)
Strumień surowca (cm
3
/s):
Rys. 5.5. Średni strumień wody (kg/h) odparowywanej w czasie suszenia
rozpyłowego preparatu
α
-amylazy w zależności od temperatury powietrza
wlotowego i strumienia surowca
68
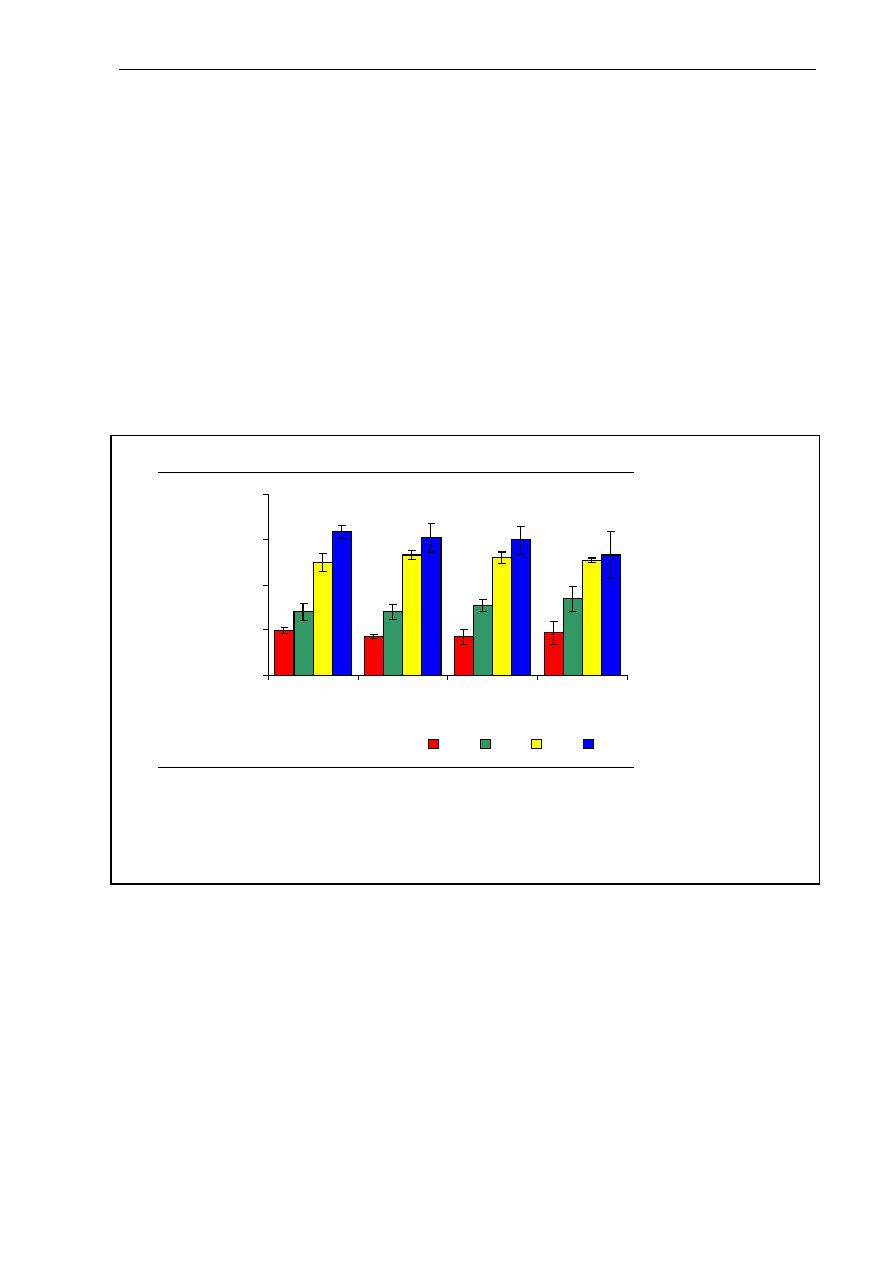
Omówienie i dyskusja wyników – Suszenie rozpyłowe
α
-amylazy
5.2.1.3. Wilgotność powietrza wylotowego
Na rysunku 5.6 i w tabeli 10.6 przedstawiono średnią wilgotność powietrza wylotowego
(obliczona na podstawie równania 4.4) w czasie suszenia rozpyłowego preparatu
α
-amylazy
w czterech różnych temperaturach powietrza wlotowego i przy czterech różnych strumieniach
surowca.
Zwiększanie strumienia surowca, a co za tym idzie strumienia wody usuwanej w czasie
suszenia, powodowało około trzykrotne zwiększenie wilgotności powietrza wylotowego
(porównując suszenie przy strumieniach zasilających 0,4 i 1,7 cm
3
/s). Na podstawie przeprowa-
dzonej analizy wariancji wpływ strumienia surowca na zmiany wilgotności powietrza
wylotowego uznano za statystycznie istotny, a wpływ temperatury powietrza wlotowego za
nieistotny (Tabela 10.7).
0,00
0,01
0,02
0,03
0,04
160
180
200
220
W
ilg
o
tn
o
ść
p
o
w
ie
tr
z
a w
ylo
to
w
eg
o
(k
g
H
2
O
/kg
p
.s.)
0,4
0,8
1,2
1,7
Temperatura powietrza wlotowego (
o
C)
Strumień surowca (cm
3
/s):
Rys 5.6. Średnia wilgotność powietrza wylotowego (kg H
2
O/kg p.s.) w czasie
suszenia rozpyłowego preparatu
α
-amylazy w zależności od temperatury
powietrza wlotowego i strumienia surowca
5.2.1.4. Właściwe zużycie powietrza
Średnie właściwe zużycie powietrza w czasie suszenia rozpyłowego preparatu
α
-amylazy
(obliczone z równania 4.7), w zależności od zastosowanej temperatury powietrza wlotowego
oraz strumienia surowca, przedstawiono na rysunku 5.7 i w tabeli 10.8.
Właściwe zużycie powietrza w czasie suszenia rozpyłowego przyjmowało wartości od
53,6 do 500,0 kg p.s./kg H
2
O. Najniższe wartości, na poziomie od 53,6 do 73,5 kg p.s./kg H
2
O,
zanotowano w przypadku suszenia przy największym strumieniu surowca równym 1,7 cm
3
/s.
Najwyższe wartości, na poziomie około dziesięciokrotnie wyższym (od 344,8 do
69
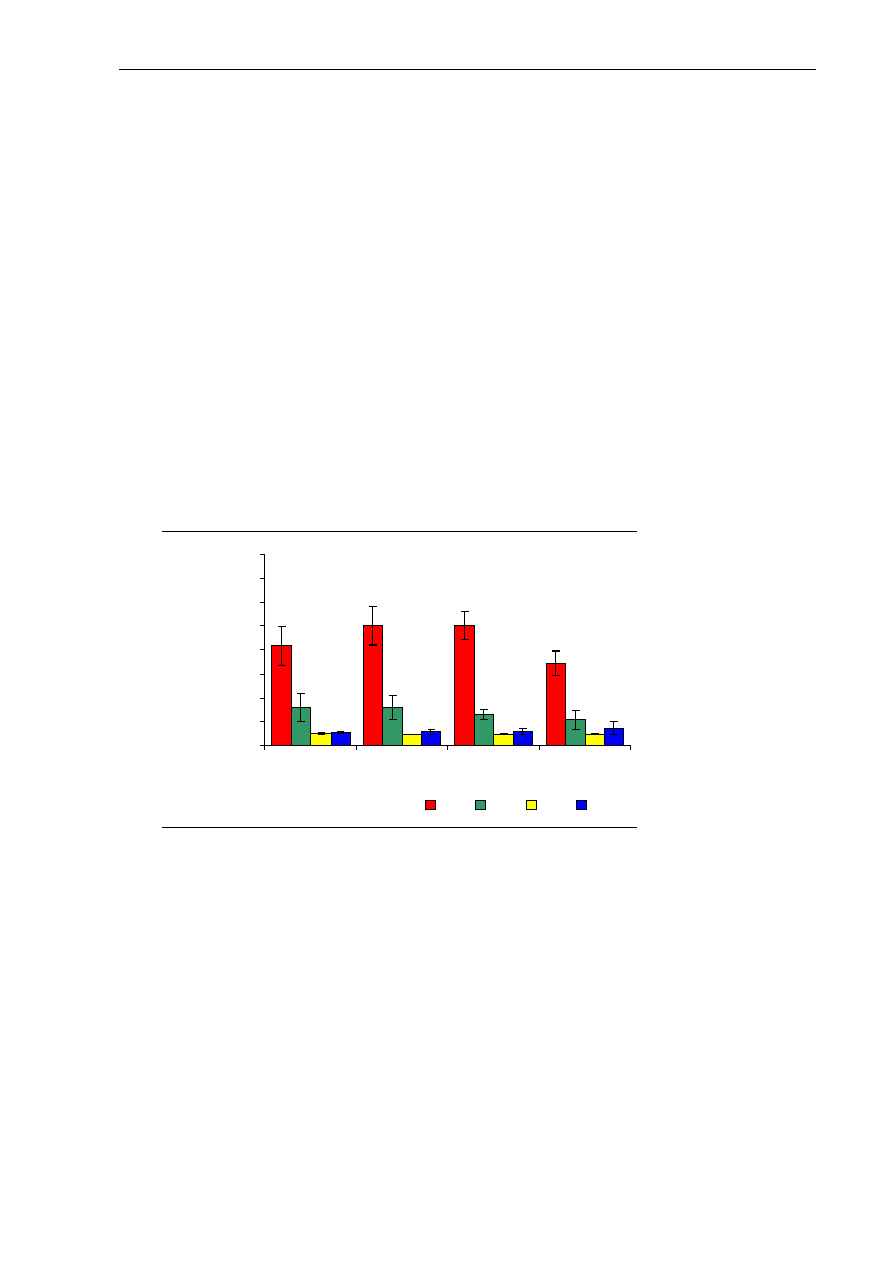
Omówienie i dyskusja wyników – Suszenie rozpyłowe
α
-amylazy
500,0 kg p.s./kg H
2
O) zanotowano podczas suszenia przy najmniejszym strumieniu surowca
równym 0,4 cm
3
/s. Porównując powyższe wartości można stwierdzić, że suszenie
z zastosowaniem wyższych strumieni surowca było bardziej korzystne z punktu widzenia
ekonomiczności przeprowadzanego procesu.
Na podstawie przeprowadzonej analizy wariancji wpływ zmian strumienia surowca na
zmiany właściwego zużycia powietrza uznano za statystycznie istotny (Tabela 10.9). Po
przeprowadzeniu porównań wielokrotnych stwierdzono występowanie trzech grup
jednorodnych (Tabela 10.10). Nie stwierdzono statystycznie istotnej różnicy między średnim
poziomem właściwego zużycia powietrza podczas suszenia przy strumieniu surowca
1,2 i 1,7 cm
3
/s. Obie wartości średnie należały do tej samej grupy jednorodnej. W pozostałych
dwu grupach jednorodnych znalazły się wartości właściwego zużycia powietrza zanotowane
podczas suszenia przy strumieniu surowca 0,4 i 0,8 cm
3
/s. Wpływ temperatury powietrza
wlotowego uznano za nieistotny.
0
100
200
300
400
500
600
700
800
160
180
200
220
W
łaś
ciw
e
z
u
ż
ycie
p
o
w
iet
rz
a
(k
g
p
.s./k
g
H
2
O
)
0,4
0,8
1,2
1,7
Temperatura powietrza wlotowego (
o
C)
Strumień surowca (cm
3
/s):
Tabela 5.7. Średnie właściwe zużycie powietrza (kg p.s./kg H
2
O) w czasie
suszenia rozpyłowego preparatu
α
-amylazy w zależności od temperatury
powietrza wlotowego i strumienia surowca
5.2.1.5. Właściwe zużycie ciepła
Średnie właściwe zużycie ciepła w czasie suszenia rozpyłowego preparatu
α
-amylazy,
w zależności od zastosowanej temperatury powietrza wlotowego oraz strumienia surowca,
obliczone na podstawie równania 4.9, przedstawiono na rysunku 5.8 i w tabeli 10.11.
Właściwe zużycie ciepła wahało się w granicach od 4112 kJ/kg H
2
O do 49550 kJ/kg H
2
O.
Najniższe wartości, na poziomie od 4000 do 6000 kJ/kg H
2
O, zanotowano w przypadku
70
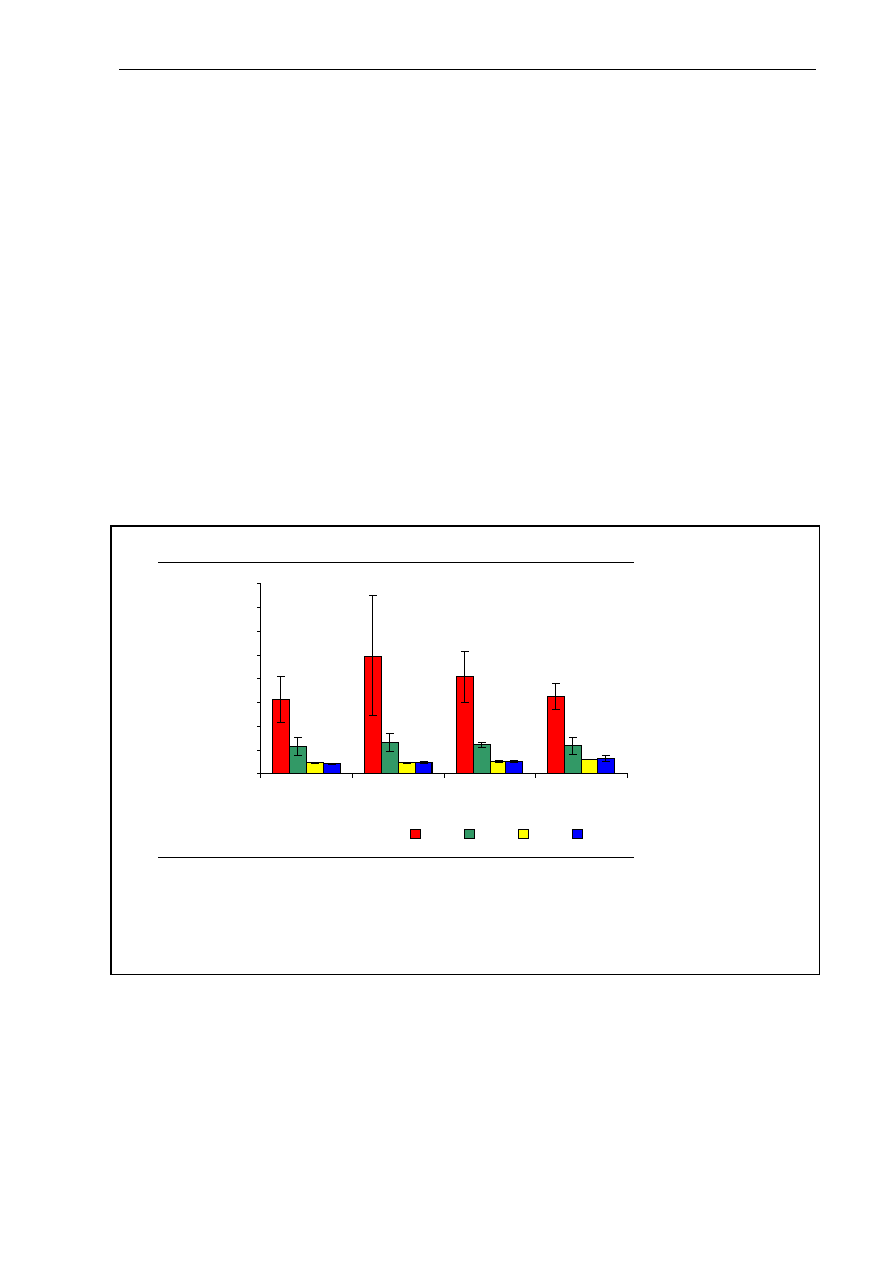
Omówienie i dyskusja wyników – Suszenie rozpyłowe
α
-amylazy
suszenia przy największym strumieniu surowca 1,7 cm
3
/s. Najwyższe wartości, na poziomie
około dziesięciokrotnie większym (od 30000 do 50000 kJ/kg H
2
O), zanotowano przy suszeniu
przy najmniejszym strumieniu surowca 0,4 cm
3
/s. Suszenie z zastosowaniem wyższych
strumieni surowca było bardziej korzystne z punktu widzenia ekonomiczności
przeprowadzanego procesu.
Na podstawie przeprowadzonej analizy wariancji wpływ zmian strumienia surowca na
poziom właściwego zużycia ciepła uznano za statystycznie istotny (Tabela 10.12). Podobnie jak
w przypadku właściwego zużycia powietrza, po przeprowadzeniu porównań wielokrotnych nie
stwierdzono jednak statystycznie istotnej różnicy między średnim poziomem właściwego
zużycia ciepła przy suszeniu przy strumieniu surowca 1,2 i 1,7 cm
3
/s (Tabela 10.13). Obie
wartości średnie należały do tej samej grupy jednorodnej. W pozostałych dwu grupach
jednorodnych znalazły się wartości właściwego zużycia ciepła przy suszeniu przy strumieniu
surowca 0,4 i 0,8 cm
3
/s. Wpływ temperatury powietrza wlotowego uznano za nieistotny.
0
10000
20000
30000
40000
50000
60000
70000
80000
160
180
200
220
W
łaś
ciw
e
z
u
ż
ycie
ciep
ła
(k
J/kg
H
2
O
)
0,4
0,8
1,2
1,7
Temperatura powietrza wlotowego (
o
C)
Strumień surowca: (cm
3
/s):
Rys. 5.8. Średnie właściwe zużycie ciepła (kJ/kg H
2
O) w czasie suszenia
rozpyłowego preparatu
α
-amylazy w zależności od temperatury powietrza
wlotowego i strumienia surowca
5.2.2. Charakterystyka otrzymanych proszków
5.2.2.1. Zawartość wody
Średnią zawartość wody w suszach po suszeniu rozpyłowym preparatu
α
-amylazy,
w zależności od temperatury powietrza wlotowego i strumienia surowca, przedstawiono na
rysunku 5.9 i w tabeli 10.14. Wartość ta wahała się w granicach od 0,029 do
71
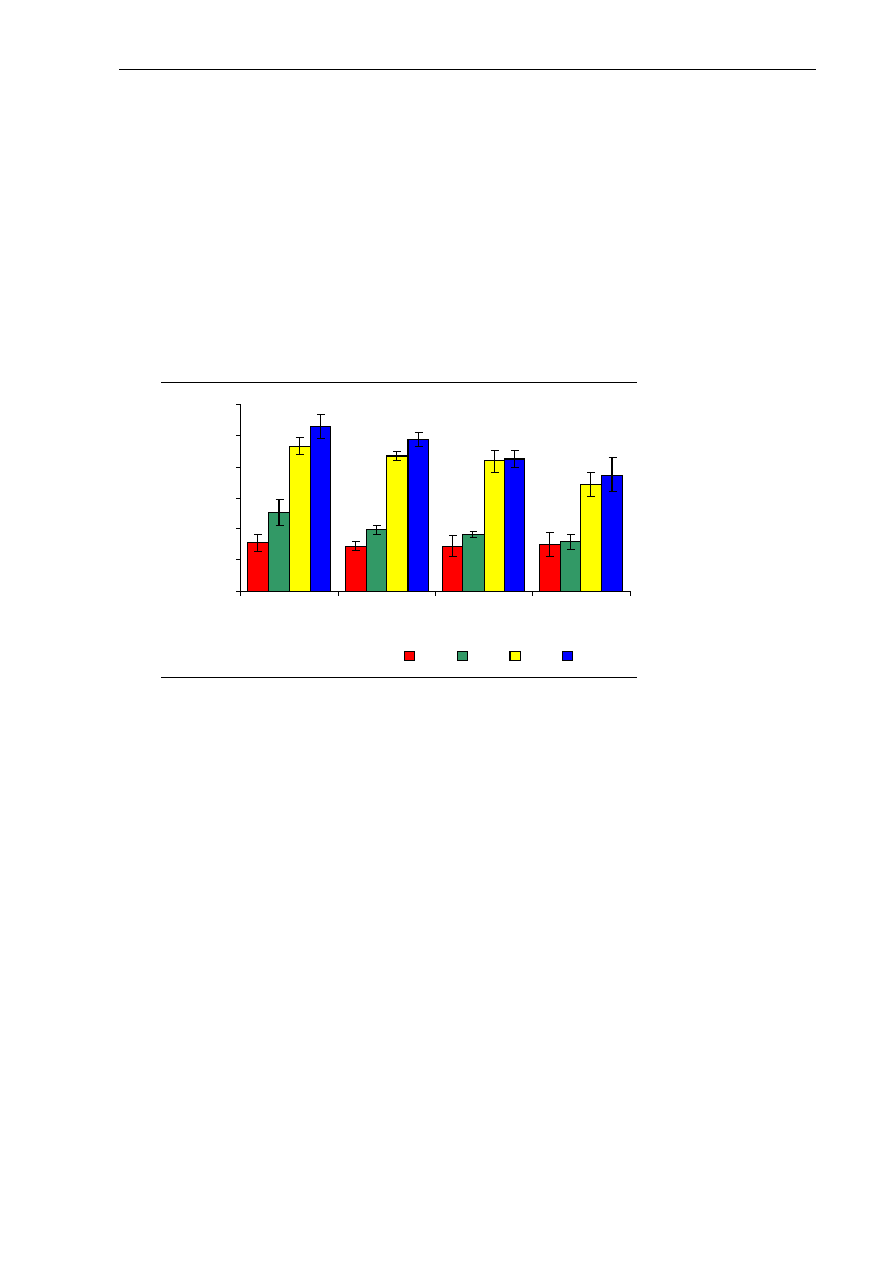
Omówienie i dyskusja wyników – Suszenie rozpyłowe
α
-amylazy
0,160 g H
2
O/g s.s, a na podstawie przeprowadzonej analizy wariancji wpływ obu zmiennych
parametrów suszenia (temperatury powietrza wlotowego i strumienia surowca) został uznany
za istotny statystycznie (Tabela 10.15).
Zawartość wody w suszach była zależna od temperatury powietrza wylotowego, a więc
tej, przy której zachodziło odparowanie wody. Kreśląc zależność u=f(t) (Rys. 5.10) można
zauważyć, że zależność ta jest liniowa. Jednocześnie otrzymane susze można podzielić na dwie
grupy – o niższej i wyższej zawartości wody – uzyskane odpowiednio podczas suszenia
w wyższych i niższych temperaturach powietrza wylotowego.
0,00
0,02
0,04
0,06
0,08
0,10
0,12
160
180
200
220
Z
aw
ar
to
ść w
o
d
y
w
su
sz
a
ch
(
g
/g
)
0,4
0,8
1,2
1,7
Temperatura powietrza wlotowego (
o
C)
Strumień surowca (cm
3
/s):
Rys. 5.9. Średnia zawartość wody w suszach (g H
2
O/g s.s.)
w zależności od temperatury powietrza wlotowego i strumienia surowca
72
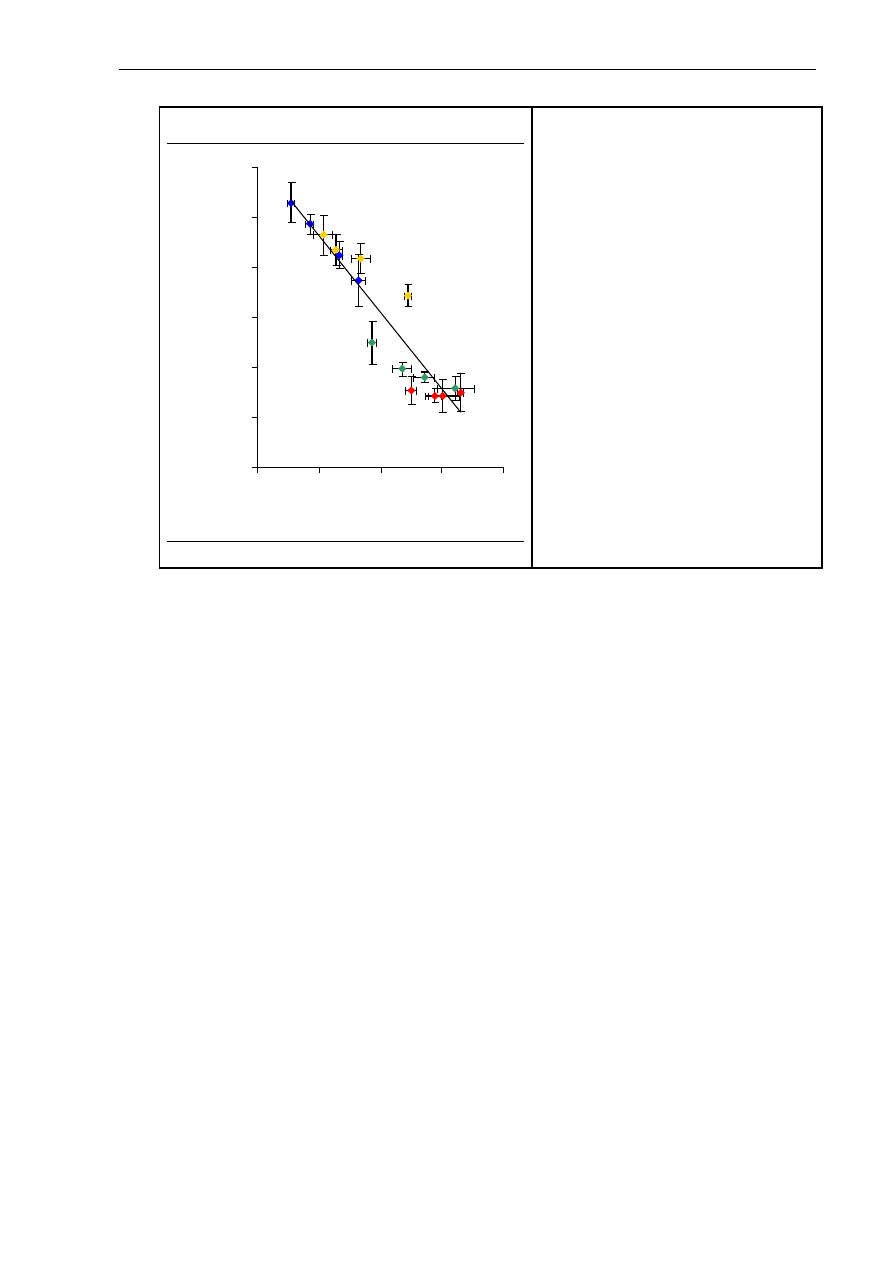
Omówienie i dyskusja wyników – Suszenie rozpyłowe
α
-amylazy
u = -0,0015*t + 0,1852
R
2
= 0,886
0,00
0,02
0,04
0,06
0,08
0,10
0,12
40
60
80
100
120
Za
w
ar
to
ść
w
o
dy
w
s
zu
sz
ac
h
(g/
g
)
Temperatura powietrza wylotowego
(
o
C)
Rys. 5.10. Zależność między
średnią zawartością wody
w suszach a temperaturą
powietrza wylotowego w czasie
suszenia rozpyłowego; dane
eksperymentalne: 0,4 cm
3
/s
(
), 0,8 cm
3
/s (
), 1,3 cm
3
/s
(
), 1,7 cm
3
/s (
); model
u= a·t+b dopasowany za
pomocą regresji prostej (—),
R
2
= 0,886
Susze z pierwszej grupy (o niższych zawartościach wody), otrzymane po suszeniu
w średniej temperaturze powietrza wylotowego od 104,3 do 77,3°C charakteryzowały się
zawartością wody od 0,03 do 0,05 g H
2
O/g s.s. Susze z drugiej grupy, o wyższej zawartości
wody – od 0,07 do 0,11 g H
2
O/g s.s., suszone były w temperaturze powietrza wylotowego od
72,7 do 51,0°C.
Ogólną zależność końcowej zawartości wody w suszu od temperatury powietrza
wylotowego w czasie suszenia rozpyłowego podaje Masters (1985), a potwierdzają min.
doświadczenia suszenia rozpyłowego fosfatazy alkalicznej przeprowadzone przez Etzel i wsp.
(1996). Zawartość wody w suszu otrzymanym po suszeniu przy temperaturze powietrza
wylotowego 80°C wynosiła 6,0 % (0,06 g H
2
O/g s.s.), 100°C – 4,2 % (0,04 g H
2
O/g s.s),
120°C – 2,4 % (0,02 g H
2
O/g s.s).
Jak wcześniej wspomniano, obniżanie temperatury powietrza wylotowego przy stałej
temperaturze powietrza wlotowego było wynikiem zwiększania strumienia surowca. Można więc
stwierdzić za Masters (1985), że zwiększanie strumienia zasilającego wpływa na zwiększanie
końcowej zawartości wody w suszu, poprzez obniżanie temperatury odparowania wody
(temperatury powietrza wylotowego). Zależność tę obserwowali również Zbiciński i wsp.
(2002). Zwiększenie szybkości zasilania suszarki rozpyłowej 10 %-owym roztworem
maltodekstryny z 5 do 10 kg/h powodowało około pięciokrotny wzrost zawartości wody.
5.2.2.2. Morfologia cząstek
73

Omówienie i dyskusja wyników – Suszenie rozpyłowe
α
-amylazy
Na rysunku 5.11 i 5.12 przedstawiono wybrane zdjęcia cząstek proszku suszonych
rozpyłowo przy dwóch strumieniach surowca: 0,4 i 1,7 cm
3
/s w temperaturze 160°C. Widoczne
są różnice w wielkości, kształcie i wyglądzie powierzchni cząstek. Cząstki uzyskane po suszeniu
przy niższym strumieniu surowca charakteryzowały się mniejszymi rozmiarami, a ich
powierzchnia była bardziej pofałdowana. Rozpylanie cieczy przy mniejszym strumieniu surowca
jest bardziej efektywne, tzn. powstające krople mają mniejsze rozmiary (Masters 1985).
Zmniejszenie rozmiarów kropel umożliwia ich dokładniejsze wysuszenie, w wyniku czego
uzyskane susze charakteryzowały się niższą końcową zawartością wody, a ich powierzchnia
była bardziej pofałdowana, prawdopodobnie ze względu na większy skurcz cząstek. Przy
większym strumieniu surowca otrzymane cząstki charakteryzowały się bardziej sferycznym
kształtem i większymi wymiarami.
Według Zbicińskiego i wsp. (2001) przy wyższych temperaturach powietrza suszącego
może następować częściowa destrukcja materiału prowadząca do powstawania szorstkich
i chropowatych cząstek. Maa i wsp. (1997) podają, że susząc rozpyłowo roztwór białka
w niższej temperaturze powietrza wylotowego (a więc, w przypadku regulacji tej wartości za
pomocą strumienia surowca, przy większym strumieniu surowca) uzyskiwano cząstki
o bardziej regularnym sferycznym kształcie. Odwrotną zależność podaje Etzel i wsp. (1997).
Proszek uzyskany po suszeniu rozpyłowym w najwyższej temperaturze powietrza wylotowego
wykazywał największy udział cząstek o regularnym sferycznym kształcie.
Rys. 5.11. Zdjęcia cząstek proszku po
suszeniu przy strumieniu surowca
Rys. 5.12. Zdjęcia cząstek proszku po
suszeniu przy strumieniu surowca
74

Omówienie i dyskusja wyników – Suszenie rozpyłowe
α
-amylazy
0,4 cm
3
/s (powiększenie 220x)
1,7 cm
3
/s (powiększenie 220x)
5.2.2.3. Właściwości fizyczne proszków
Określenie właściwości fizycznych proszków, takich jak gęstość nasypowa, zwilżalność
i rozpuszczalność jest istotne, gdyż właściwości te warunkują możliwość i łatwość ich
praktycznego wykorzystania materiału w procesie produkcyjnym. Do zbadania właściwości
fizycznych proszków wybrano materiał wysuszony w temperaturze 220°C przy zastosowaniu
dwóch skrajnych strumieni zasilających (czynnik mający większy wpływ na badane zmienne niż
temperatura powietrza wlotowego).
Gęstość nasypowa luźna proszków otrzymanych poprzez suszenie w temperaturze
powietrza wlotowego 220°C przy strumieniu surowca 0,4 i 1,7 cm
3
/s wynosiła odpowiednio
400 i 380 kg/m
3
. Gęstość nasypowa utrzęsiona wynosiła odpowiednio 580 i 600 kg/m
3
. Znaczne
zwiększenie gęstości nasypowej utrzęsionej w stosunku do gęstości luźnej jest cechą
charakterystyczną dla proszków o właściwościach kohezyjnych, do których jest zaliczana
maltodekstryna (Peleg 1977, Kwapińska 2002). Tego rodzaju proszki charakteryzują się
również słabą zwilżalnością i sypkością. W celu polepszenia tych właściwości i ułatwienia
stosowania proszku w procesie produkcyjnym stosowane jest aglomerowanie, czyli proces
powiększania rozmiarów cząstek poprzez łączenie ich w większe skupiska, w których tworzące
je cząstki są nadal rozpoznawalne (Domian 2002).
Otrzymane susze charakteryzowały się bardzo dobrą rozpuszczalnością na
poziomie 99 %.
5.2.2.4. Zawartość sacharydów redukujących
Celem oznaczeń sacharydów redukujących było zbadanie, czy wydłużony czas podawania
surowca do dysku rozpylającego, przy mniejszych strumieniach surowca, miał wpływ na zmianę
składu chemicznego (zawartość sacharydów redukujących) podawanego roztworu, co mogłoby
wpływać na zmianę oddziaływania tego roztworu na enzym w czasie suszenia. Ewentualny
wpływ wydłużonego czasu podawania surowca na zmianę składu chemicznego podawanego
roztworu mógłby być wynikiem oddziaływania enzymu na maltodekstrynę.
Zawartość sacharydów redukujących w proszkach otrzymanych poprzez suszenie
w temperaturze powietrza wlotowego 220°C przy strumieniu surowca 0,4 i 1,7 cm
3
/s wynosiła
odpowiednio 13,5 i 12,7 %. W maltodekstrynie stwierdzono zawartość sacharydów
redukujących na poziomie 9,6 %. Na podstawie wyników oznaczenia zawartości sacharydów
redukujących w proszkach, otrzymanych po suszeniu przy strumieniu surowca 0,4 i 1,7 cm
3
/s,
75

Omówienie i dyskusja wyników – Suszenie rozpyłowe
α
-amylazy
można stwierdzić, że wydłużony czas podawania surowca (z 4 do 10 minut) nie miał istotnego
wpływu na zawartość sacharydów redukujących w suszach. Zawartość ta była zwiększona
w stosunku do zawartości początkowej w maltodekstrynie, lecz różnica między zawartością
w proszkach otrzymanych po suszeniu przy strumieniu surowca 0,4 i 1,7 cm
3
/s była
w granicach błędu statystycznego. Surowiec podawany był do dysku rozpylającego
w temperaturze 20°C, podczas gdy temperatura optymalna działania enzymu wynosi 37°C.
Również pH roztworu nie było optymalne dla działania enzymu. Ponadto,
α
-amylaza nie jest
enzymem, w wyniku działania którego może dochodzić do rozkładu polisacharydu do cukrów
prostych, a obecności innych enzymów w preparacie nie stwierdzono. Tak więc zwiększona
zawartość sacharydów redukujących w suszach w stosunku do maltodekstryny przed
suszeniem była prawdopodobnie spowodowana działaniem destrukcyjnym procesu rozpylania.
Taki destrukcyjny wpływ rozpylania roztworu maltodekstryny niskoscukrzonej w dysku
rozpyłowym obserwował również Stolarek (2003).
5.2.3. Podsumowanie – przebieg suszenia
Reasumując, przebieg suszenia był ściśle uzależniony od zmian badanych parametrów:
temperatury powietrza wlotowego oraz strumienia surowca. Suszenie przy niższych
strumieniach surowca prowadziło do uzyskania proszków o niższej zawartości wody, co
wynikało z różnic w temperaturze wylotowej powietrza. Zmniejszanie strumienia surowca
powodowało zmniejszenie strumienia odparowywanej wody, w rezultacie czego temperatura
powietrza wylotowego była wyższa niż przy zastosowaniu wyższych strumieni surowca.
Zwiększenie temperatury powietrza wylotowego powodowało lepsze wysuszenie cząstek.
Ponadto, rozmiary kropel przy mniejszych strumieniach surowca są mniejsze (Masters 1985),
co również umożliwia ich lepsze wysuszenie. Podwyższanie temperatury powietrza wlotowego,
przy danym strumieniu surowca, powodowało zwiększenie temperatury powietrza wylotowego
oraz zmniejszenie zawartości wody w suszach.
Strumień surowca miał również wpływ na zużycie ciepła i powietrza podczas procesu
suszenia. Znacznie wydajniej, ze względu na ilość ciepła i powietrza zużytego na odparowanie
jednostki wody, przebiegało suszenie przy wyższych strumieniach surowca.
5.2.4. Aktywność
α
-amylazy w otrzymanych suszach
Średnią względną aktywność
α
-amylazy w otrzymanych suszach (obliczoną z równania
4.3), w zależności od temperatury powietrza wlotowego i strumienia surowca, przedstawiono
na rysunku 5.13 oraz w tabeli 10.16.
Aktywność względna
α
-amylazy w otrzymanych suszach wahała się od 56,7 do 90,1 %.
Zależała ona zarówno od zastosowanej temperatury suszenia, jak i strumienia surowca.
76
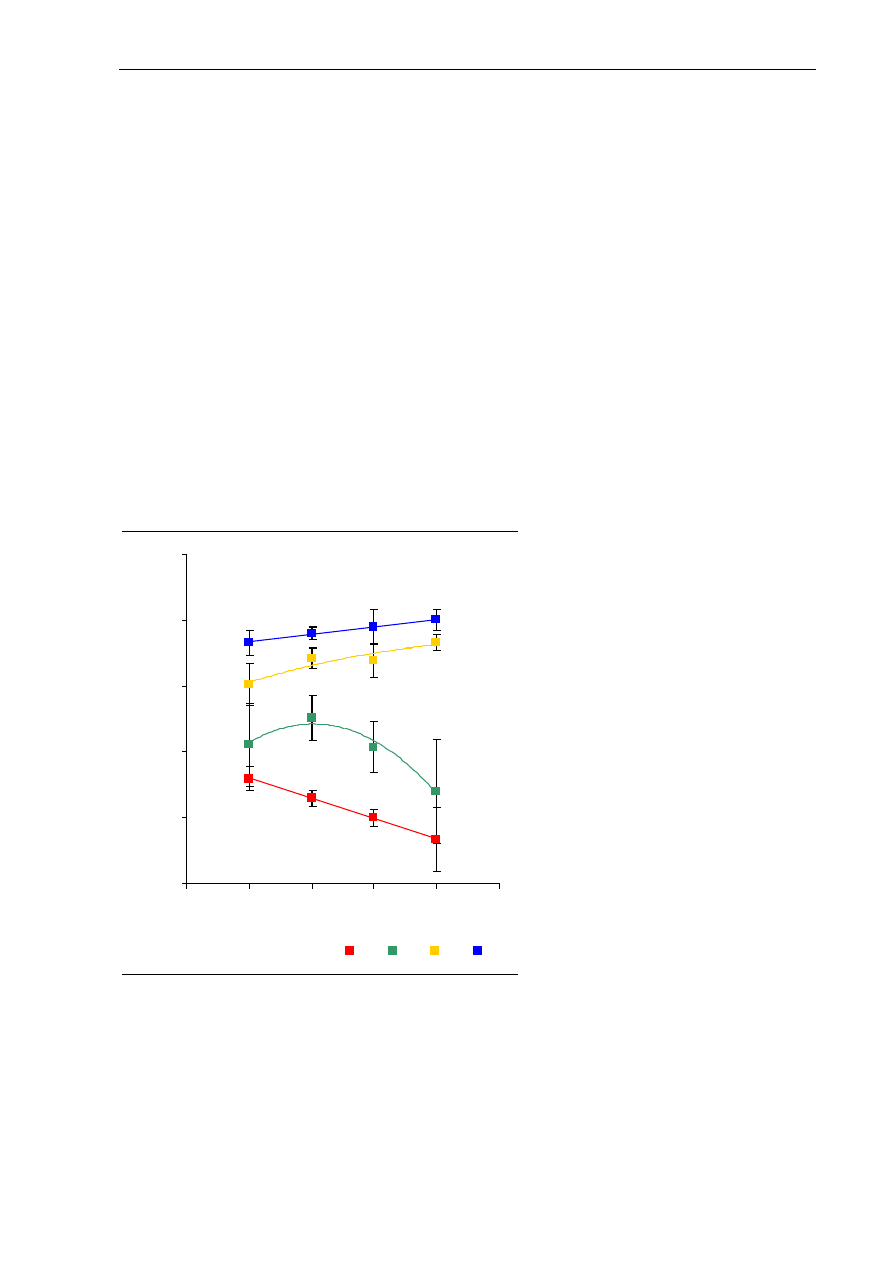
Omówienie i dyskusja wyników – Suszenie rozpyłowe
α
-amylazy
Najwyższą aktywność względną enzymu, od 86,6 do 90,1 %, zanotowano w suszach
otrzymanych poprzez suszenie przy strumieniu surowca 1,7 cm
3
/s. Susze otrzymane podczas
suszenia przy strumieniu surowca 0,4 cm
3
/s charakteryzowały się najniższą aktywnością
względną na poziomie od 56,7 do 66,0 %, w zależności od temperatury suszenia. Przy każdej
z zastosowanych temperatur powietrza wlotowego zwiększanie strumienia surowca wpływało
na zwiększenie aktywności enzymu w suszu. Przykładowo, średnia aktywność enzymu
suszonego w temperaturze powietrza wlotowego 160ºC przy czterech kolejnych strumieniach
surowca (0,4; 0,8; 1,2; 1,7 cm
3
/s) wynosiła kolejno: 66,0; 71,1; 80,2; 86,6 %. Wpływ
temperatury powietrza wlotowego na aktywność względną enzymu przy kolejnych strumieniach
surowca był różny. Przy zastosowaniu strumienia surowca 1,2 i 1,7 cm
3
/s obserwowano wzrost
aktywności względnej wraz ze wzrastającą temperaturą powietrza wlotowego. Przy strumieniu
surowca 0,4 cm
3
/s zależność ta była odwrotna, a przy strumieniu surowca 0,8 cm
3
/s
początkowo obserwowano wzrost (przy wzroście temperatury od 160 do 180ºC) a następnie
50
60
70
80
90
100
140
160
180
200
220
240
A
kt
yw
n
o
ść w
z
g
lęd
n
a
α
-amylaz
y
(
%
)
0.4
0.8
1.3
1.7
Strumień surowca (cm
3
/s):
Temperatura powietrza wlotowego (
o
C)
Rys. 5.13. Zależność między
średnią aktywnością względną
suszonej
α
-amylazy
a temperaturą powietrza
wlotowego i szybkością
zasilania; dane eksperymen-
talne: strumień surowca 0,4
cm
3
/s (
), 0,8 cm
3
/s (
), 1,2
cm
3
/s (
), 1,7 cm
3
/s (
);
model dopasowany za pomocą
regresji prostej przy szybkości
zasilania 0,4 cm
3
/s
(
—
) R
2
=0,99; 0,8 cm
3
/s (
—
)
R
2
=0,96; 1,2 cm
3
/s (
—
) R
2
=
0,86; 1,7 cm
3
/s (
—
) R
2
=0,99
zmniejszenie (przy wzroście temperatury od 180 do 200 i 220ºC) aktywności względnej
enzymu wraz ze wzrostem temperatury powietrza wlotowego.
Inaktywacja enzymów w czasie suszenia jest wywołana głównie działaniem podwyższonej
temperatury. Jednakże, jeśli przy bardzo intensywnych warunkach suszenia dochodzi do
usunięcia z układu również części wody strukturalnej stabilizującej strukturę białka, inaktywacja
77

Omówienie i dyskusja wyników – Suszenie rozpyłowe
α
-amylazy
może mieć również charakter ksero-inaktywacji (Strumiłło i wsp. 1991). Zależność między
końcową zawartością wody w suszu a aktywnością względną
α
-amylazy przedstawiono na
rysunku 5.14. Zgodnie z tym rysunkiem można stwierdzić, że aktywność enzymu w suszach
o niższej zawartości wody była niższa – w suszach o zawartości wody od 0,03 do
0,05 g H
2
O/g s.s. wynosiła od 56,7 do 75,3 %. W suszach o wyższej zawartości wody, od 0,07
do 0,11 g H
2
O/g s.s., aktywność enzymu kształtowała się na poziomie od 80,2 do 90,1 %.
Jednakże, na podstawie parabolicznego kształtu krzywej w zakresie wyższych zawartości wody,
można przypuszczać, że zależność między zwiększaniem zawartości wody w suszach
a zwiększaniem aktywności enzymu osiąga maksimum na pewnym poziomie zawartości wody.
Dalsze zwiększanie zawartości wody w suszu nie prowadzi do uzyskania większej aktywności
względnej
α
-amylazy po suszeniu rozpyłowym. Tę maksymalną wartość można nazwać
optymalną zawartością wody w suszu, ze względu na zachowanie aktywności
α
-amylazy.
Na podstawie danych eksperymentalnych wartość tę można oszacować na
0,07 – 0,09 g H
2
O/g s.s. Niemniej jednak, wartość ta odnosi się tylko do suszenia rozpyłowego
α
-amylazy w warunkach, jakie zastosowano w doświadczeniach.
Ponieważ, jak wcześniej wspomniano, zawartość wody w suszach jest ściśle związana
z temperaturą powietrza wylotowego w czasie suszenia, aktywność
α
-amylazy w suszach jest
również skorelowana z tą temperaturą (Rys. 5.15). Podobną zależność między aktywnością
względną enzymu (fosfataza alkaliczna) suszonego rozpyłowo a temperaturą powietrza
wylotowego w czasie suszenia podaje Etzel i wsp. (1997). Aktywność względna enzymu
suszonego w temperaturze powietrza wylotowego 80°C wynosiła 81 %, 100°C – 45 %,
120°C – 8,1 %.
Na podstawie danych eksperymentalnych można stwierdzić, że w celu otrzymania suszu
o wysokiej aktywności względnej
α
-amylazy, warunki suszenia należy dobrać tak, aby końcowa
zawartość wody kształtowała się na poziomie 0,07 – 0,09 g H
2
O/g s.s. Aby otrzymać susz o tej
zawartości wody temperatura powietrza wylotowego powinna wynosić 70 – 80°C.
78
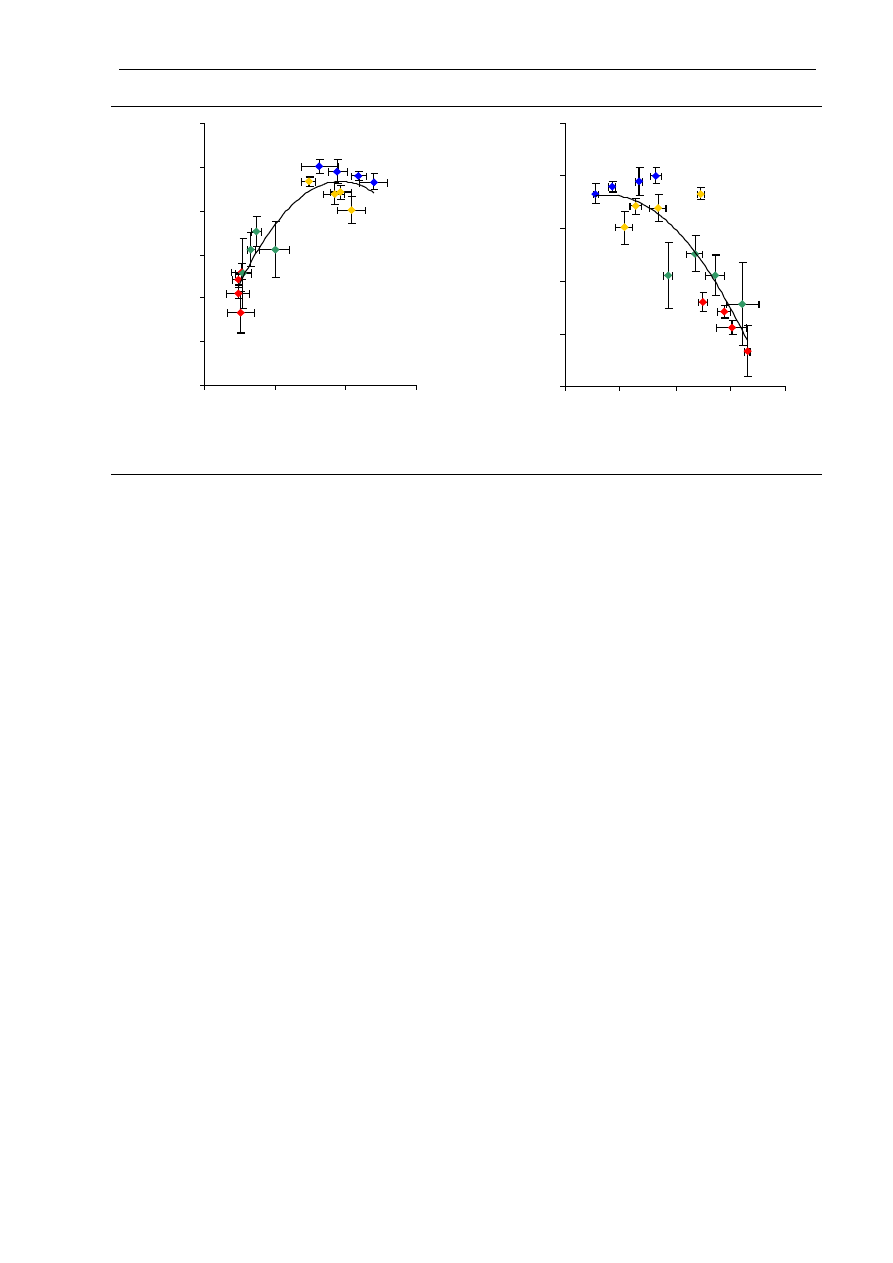
Omówienie i dyskusja wyników – Suszenie rozpyłowe
α
-amylazy
R
2
= 0,8866
40,0
50,0
60,0
70,0
80,0
90,0
100,0
0,01
0,05
0,09
0,13
A
kt
yw
n
o
ść w
z
g
lęd
n
a
α
-a
mylaz
y (
%)
Zawartość wody w suszu
(g H
2
O/g s.s.)
R
2
= 0,7497
50,0
60,0
70,0
80,0
90,0
100,0
40
60
80
100
120
A
kt
yw
n
o
ść w
z
g
lęd
n
a
α
-a
mylaz
y (
%)
Temperatura powietrza
wylotowego (
o
C)
Rys. 5.14. Zależność między średnią
aktywnością względną suszonej
α
-amylazy (%) a średnią zawartością
wody w suszach (g H
2
O/g s.s.); dane
eksperymentalne: 0,4 cm
3
/s (
) 0,8
cm
3
/s (
),1,3 cm
3
/s (
), 1,7 cm
3
/s (
);
model dopasowany za pomocą regresji
prostej (—) (R
2
= 0,89)
Rys. 5.15. Zależność między średnią
aktywnością względną suszonej
α
-amylazy (%) a średnią temperaturą
wylotową w czasie suszenia
rozpyłowego (°C); dane eksperymen-
talne: 0,4 cm
3
/s (
) 0,8 cm
3
/s (
),
1,3 cm
3
/s (
), 1,7 cm
3
/s (
); model
dopasowany za pomocą regresji
prostej (—) (R
2
= 0,75)
Na podstawie przeprowadzonej analizy wariancji (Tabela 10.17) wpływ strumienia
surowca na aktywność względną
α
-amylazy został uznany za istotny statystycznie. Wpływ
temperatury powietrza wlotowego na aktywność enzymu został uznany za nieistotny, jednak
wydaje się, że wynik ten należy traktować z pewną ostrożnością. Jak wcześniej przedstawiono,
najważniejszym czynnikiem wpływającym na końcową aktywność enzymu była zawartość wody
w suszu. Ponieważ wpływ obu zmiennych parametrów suszenia na zawartość wody był istotny
statystycznie, to nie można stwierdzić, że zmiany temperatury powietrza wlotowego nie miały
istotnego wpływu na aktywność enzymu (uzależnioną od zawartości wody w suszu), jak
wskazywałaby dwuczynnikowa analiza wariancji. W tym przypadku zastosowanie analizy
wariancji nie prowadzi do właściwych wniosków, ponieważ nie uwzględnia ona dodatkowych
zależności między zmiennymi.
Ogólnie stwierdza się, że suszenie rozpyłowe jest odpowiednią metodą suszenia
α
-amylazy, ponieważ enzym ten charakteryzuje się zwiększoną odpornością na podwyższoną
temperaturę w warunkach obniżonej zawartości wody (Meerdink i van’t Riet 1991 i 1995,
79

Omówienie i dyskusja wyników – Suszenie rozpyłowe
α
-amylazy
Samborska i Witrowa-Rajchert 2002). Szczegółową analizę kinetyki inaktywacji
α
-amylazy
w systemach o różnej zawartości wody przedstawiono w części drugiej pracy. Ze względu na tę
właściwość, po suszeniu rozpyłowym (przy zastosowaniu odpowiednich parametrów suszenia),
w czasie którego czas działania wysokiej temperatury na materiał o wysokiej i średniej
zawartości wody jest bardzo krótki, względna aktywność enzymu jest wysoka. W czasie
suszenia rozpyłowego następuje szybkie odparowanie wody, zwiększające odporność
α
-amylazy na wysokie temperatury. Jednakże, jak wcześniej wspomniano, wpływ procesu
suszenia na aktywność enzymu nie zależy tylko od szybkości suszenia, powodującej
zwiększenie odporności cieplnej
α
-amylazy, lecz zależy również od końcowej zawartości wody
w preparacie enzymatycznym. Ta ostatnia nie może być niższa od pewnej wartości granicznej,
zapewniającej zachowanie nienaruszonej struktury białka. Dalsze zwiększanie intensywności
procesu suszenia nie prowadzi do większego zachowania aktywności enzymu. Tak więc,
w zakresie stosowanych parametrów eksperymentalnych, zwiększanie efektywności suszenia
poprzez zmniejszanie strumienia surowca nie prowadziło do otrzymania preparatu o wyższej
aktywności, ponieważ zwiększanie intensywności odparowania prowadziło do otrzymania suszy
o zawartości wody poniżej zawartości granicznej, gwarantującej zachowanie nienaruszonej
struktury białka. Jedynie rozpatrując wyniki otrzymane przy suszeniu z zastosowaniem
strumienia surowca 1,7 cm
3
/s oraz 1,3 cm
3
/s zaobserwowano pozytywny wpływ suszenia w
bardziej intensywnych warunkach na zwiększanie się aktywności względnej enzymu po
suszeniu. Podwyższanie temperatury wlotowej powietrza w obu przypadkach powodowało
zwiększenie końcowej aktywności względnej
α
-amylazy, co jest potwierdzeniem stwierdzenia,
że im szybsze odparowanie i przejście przez zakres wysokich i średnich zawartości wody,
w którym
α
-amylaza jest mało odporna na wysoką temperaturę, tym mniejsza degradacja
enzymu. W przypadku obu tych strumieni surowca zwiększanie intensywności suszenia poprzez
zwiększanie temperatury powietrza wlotowego i wylotowego powodowało również zmniejszanie
się zawartości wody, czemu towarzyszyło zwiększanie aktywności względnej enzymu. Można
zatem stwierdzić, że poprzez zwiększanie intensywności odparowania wody przy strumieniu
surowca 1,7 i 1,3 cm
3
/s zawartość wody w suszach zmniejszała się w kierunku zawartości
optymalnej, ze względu na maksymalne zachowanie aktywności enzymu. Wartość optymalna
zawartości wody została osiągnięta przy suszeniu w temperaturze 200 i 220°C przy strumieniu
surowca 1,7 i 1,3 cm
3
/s i wynosiła 0,07 – 0,09 g H
2
O/g s.s. Aktywność względna
α
-amylazy
suszona z zastosowaniem powyżej wymienionych parametrów wahała się od 85 do 90 %.
Jednakże dalsze zwiększanie szybkości odparowania, poprzez zmniejszenie strumienia surowca
do 0,8 i 0,4 cm
3
/s, nie wpływało pozytywnie na końcową aktywność enzymu, ponieważ zbyt
intensywne warunki wymiany masy i ciepła mogły prowadzić do usuwania lub naruszenia tzw.
80

Omówienie i dyskusja wyników – Suszenie rozpyłowe
α
-amylazy
wody strukturalnej, stabilizującej natywną konformację białka. Zbyt szybkie suszenie mogło
również uniemożliwić zastępowanie cząsteczek wody stabilizujących strukturę białka
cząsteczkami węglowodanów (np. glukozy obecnej w maltodekstrynie), co jest również znaną
przyczyną stabilizacji cząsteczek białka w warunkach obniżonej zawartości wody (Sun i wsp.
1998). Zwiększenie intensywności odparowania, poprzez zmniejszenie strumienia surowca do
0,8 cm
3
/s, spowodowało obniżenie aktywności względnej enzymu do poziomu od 65,7 do
75,3 %, w zależności od zastosowanej temperatury suszenia. Zwiększanie temperatury
suszenia oraz zmniejszanie zawartości wody w suszach, otrzymywanych przy tym strumieniu
surowca, powodowało zmniejszenie aktywności względnej amylazy, co mogło być związane
z coraz bardziej intensywnym naruszaniem struktury białka wywołanym usuwaniem wody
strukturalnej. Najniższą aktywność
α
-amylazy suszonej przy strumieniu surowca 0,8 cm
3
/s,
wynoszącą 65,7 %, zanotowano po suszeniu w temperaturze powietrza wlotowego 220°C.
Średnia zawartość wody w suszu otrzymanym w tych warunkach wynosiła 0,03 g H
2
O/g s.s.
Niemal identyczne wartości aktywności enzymu i zawartości wody otrzymano po suszeniu
z zastosowaniem najniższego strumienia surowca 0,4 cm
3
/s w temperaturze 160°C. Dalsze
zwiększanie intensywności suszenia poprzez zwiększanie temperatury powietrza wlotowego nie
prowadziło jednak do zmniejszania zawartości wody w suszach. Można więc przyjąć, że
zawartość wody na poziomie około 0,03 g H
2
O/g s.s. jest wartością minimalną, jaką można
uzyskać w danych warunkach eksperymentalnych. Można przypuszczać, że cała ilość wody
możliwej do usunięcia została odparowana. Zwiększanie temperatury powietrza wlotowego
powodowało obniżanie aktywności względnej enzymu z poziomu od 64,3 do 56,7 %
81

Omówienie i dyskusja wyników – Kinetyka inaktywacji cieplnej
α
-amylazy
w temperaturach powietrza wlotowego odpowiednio 160 i 220°C. Jednakże, aktywność
względna enzymu suszonego przy najbardziej intensywnych warunkach procesu odparowania
(56 %, 0,4 cm
3
/s, 220°C) była również dość wysoka. Mimo znacznego wysuszenia i możliwego
naruszenia wody strukturalnej, podwyższenie termostabilności enzymu poprzez szybkie
odparowanie oraz krótki czas suszenia i działania podwyższonej temperatury na enzym
pozwoliły na zachowanie ponad 50 % aktywności początkowej enzymu.
5.2.5. Podsumowanie
Głównym parametrem decydującym o końcowej aktywności względnej suszonej
α
-amylazy jest końcowa zawartość wody w suszu. Szybkie odparowanie wody, jakie następuje
w czasie suszenia rozpyłowego, jest korzystne ze względu na zwiększanie się odporności
enzymu na podwyższoną temperaturę, jednak nie może ono prowadzić do zbyt dużego stopnia
wysuszenia prowadzącego do naruszenia struktury białka w wyniku usuwania wody
strukturalnej. Zawartość wody gwarantująca uzyskanie maksymalnej stabilności cieplnej
α
-amylazy, gdy nie występuje jeszcze niekorzystny wpływ dehydracji związany z niszczeniem
struktury białka, może być nazwana optymalną zawartością wody w preparacie
enzymatycznym, gwarantującą maksymalne zachowanie aktywności enzymu.
Zastosowane parametry suszenia, przy których osiągnięto optymalną zawartość wody,
gwarantujące maksymalne zachowanie aktywności enzymatycznej preparatu
α
-amylazy,
okazały się również korzystne z punktu widzenia ekonomiczności procesu suszenia (najmniejsze
wartości właściwego zużycia powietrza i ciepła).
5.3. KINETYKA INAKTYWACJI CIEPLNEJ
α
-AMYLAZY
5.3.1. Optymalizacja oznaczenia aktywności
α
-amylazy
Po wykonaniu oznaczenia aktywności
α
-amylazy przy siedmiu stężeniach enzymu
otrzymywano wykres jak na rysunku 5.16A. Powyżej stężenia 1,8 FAU/cm
3
wykres zaczął
przyjmować postać nieprostoliniową, wskazując na to, że enzym nie był już wysycany
substratem. W czasie oznaczenia aktywności objawiało się to również spłaszczeniem wykresu
absorbancji w funkcji czasu (Rys. 5.17).
Przyjęto, że maksymalne stężenie początkowe amylazy, zapewniające wykonywanie
oznaczenia w warunkach wysycenia enzymu substratem w czasie trwania całego oznaczenia
wynosi 1,8 FAU/cm
3
(Rys. 5.16B).
82
Omówienie i dyskusja wyników – Kinetyka inaktywacji cieplnej
α
-amylazy
0
0,1
0,2
0,3
0,4
0,5
0,6
0,0
1,0
2,0
3,0
4,0
Stężenie
α
-amylazy (FAU/ml)
Ab
so
rb
an
c
ja
A
B
Rys. 5.16. Zależność między
stężeniem
α
-amylazy
a oznaczoną aktywnością:
w warunkach wysycenia enzymu
substratem (
) R
2
=0,99;
w warunkach niedosytu
substratu (
)
0,0
0,2
0,4
0,6
0,8
1,0
0
60
120
180
240
Czas (s)
A
b
so
rb
a
n
cj
a
Rys 5.17. Przykładowy wykres
uzyskany w czasie oznaczenia
aktywności amylazy przy zbyt
dużym stężeniu enzymu. Po
180 s trwania oznaczenia cały
substrat został zużyty
5.3.2. Kinetyka inaktywacji cieplnej
α
-amylazy w systemach o różnej
zawartości wody
Badanie kinetyki inaktywacji cieplnej a-amylazy prowadzono w trzech systemach
o wysokiej zawartości wody (roztwory S1, S2 i S3) oraz w trzech systemach o niskiej
zawartości wody (suszone liofilizacyjnie proszki S4, S5 i S6).
5.3.2.1. Adsorpcja pary wodnej i izoterma sorpcji
Końcową zawartość wody w suszonych liofilizacyjnie próbkach, po adsorpcji wody do
stanu równowagi nad nasyconymi roztworami soli, przedstawiono w tabeli 5.2.
Tabela 5.2. Zawartość wody w próbkach po adsorpcji wody do stanu
równowagi przy aktywności wody od 0,11 do 0,98; systemy o niskiej
83
Omówienie i dyskusja wyników – Kinetyka inaktywacji cieplnej
α
-amylazy
zawartości
wody S4-S6
Równowagowa wilgotność
względna nasyconych roztworów
soli w temperaturze 4°C (%)
Zawartość wody w próbkach
(g H
2
O/g s.s.)
LiCl
11,26 ± 0,47
0,029 ± 0,001 (S6)
CH
3
COOK
23,38 ±0,53
0,048 ± 0,004
MgCl
2
33,60 ± 0,28
0,060 ± 0,003 (S5)
K
2
CO
3
43,13 ± 0,30
0,078 ± 0,001
NaBr
63,51 ± 0,72
0,163 ± 0,007 (S4)
NH
4
Cl
80,55 ± 0,96
0,381 ± 0,015
K
2
SO
4
98,48 ± 0,91
2,722 ± 0,131
Na podstawie otrzymanych wartości wykreślono izotermę sorpcji, którą przedstawiono na
rysunku 5.18. Do danych eksperymentalnych za pomocą regresji nieliniowej dopasowano
model opierający się na równaniu GAB. Na rysunku 5.19. przedstawiono porównanie danych
eksperymentalnych z danymi uzyskanymi po dopasowaniu modelu.
0,0
1,0
2,0
3,0
4,0
5,0
0
0,2
0,4
0,6
0,8
1
Aktywność wody
Z
aw
art
o
ść
w
o
d
y
(g
H2O
/g
s
.s
.)
0
0,5
1
1,5
2
2,5
0
0,5
1
1,5
2
2,5
Zawartość wody (exp)
Z
aw
ar
to
ść
w
o
d
y
(p
re
d
)
Rys. 5.18. Izoterma sorpcji
α
-amylazy
suszonej w obecności maltodekstryny: dane
eksperymentalne (), model dopasowany za
pomocą regresji nieliniowej na podstawie
równania GAB (
)
Rys. 5.19. Porównanie danych
eksperymentalnych (exp)
z wartościami uzyskanymi
poprzez dopasowanie modelu za
pomocą regresji nieliniowej
(pred)
Ponieważ zawartość białka enzymatycznego w materiale suszonym wynosiła zaledwie
1,4 g/100 g s.s. maltodekstryny, a więc 1,4 % materiału, kształt izotermy, który jest zależny od
składu chemicznego, był uwarunkowany głównie obecnością cukrów.
5.3.2.2. Parametry kinetyczne inaktywacji
α
-amylazy
84
Omówienie i dyskusja wyników – Kinetyka inaktywacji cieplnej
α
-amylazy
Na rysunku 5.20. przedstawiono wyniki inaktywacji cieplnej enzymu w systemach
S1 – S3 w czasie 5 minut w temperaturach 40, 55, 70, 85 i 100°C. Inaktywacja enzymu
w systemach o zmniejszającej się zawartości wody następowała przy wyższych temperaturach.
W systemie S1 (roztworze wodnym bez dodatku maltodekstryny) całkowita inaktywacja
enzymu w czasie 5 minut następowała już w temperaturze 70°C. Dodatek maltodekstryny do
roztworu wodnego wpłynął na podwyższenie temperatury, w której następowała całkowita
inaktywacja enzymu. W systemie S2 (3,5 g H
2
O/g s.s.) i S3 (1,8 g H
2
O/g s.s.) była to
temperatura 85°C. Jednakże, odporność enzymu na podwyższoną temperaturę w obu tych
systemach w temperaturze pomiędzy 55 a 85°C różniła się. Po 5 minutach inaktywacji
w temperaturze 70°C aktywność względna enzymu w systemie S2 wynosiła 63 %,
a w systemie S3 równa była 89 %. Na podstawie tych doświadczeń dokonano wyboru czterech
temperatur dla każdego systemu S1 – S3, przy których następnie badano dokładnie kinetykę
inaktywacji. Temperatury te oraz czasy inaktywacji przedstawiono wcześniej w tabeli 4.1.
0,0
0,2
0,4
0,6
0,8
1,0
20
30
40
50
60
70
80
90
100
Temperatura (
o
C)
A/
A
0
S1
S2
S3
Rys. 5.20. Inaktywacja cieplna
α
-amylazy w czasie 5 min:
system S1 (
),
S2 (
), S3 (
)
Kinetyka inaktywacji
α
-amylazy w systemach S1 – S5 mogła być ściśle opisana
równaniem reakcji pierwszego rzędu. Świadczy o tym linearność zależności log
A
/
A
0
od
czasu (wykresy prezentowane poniżej dla wszystkich systemów) oraz ln
A
/
A
0
od czasu (wykres
prezentowany poniżej dla systemu S1) oraz wysokie współczynniki determinacji R
2
, na
poziomie od 0,95 do 0,99, uzyskane po dopasowaniu modelu do danych eksperymentalnych za
pomocą regresji liniowej. Stałe szybkości reakcji inaktywacji
α
-amylazy
k
w systemach
o wysokiej i niskiej zawartości wody, wyznaczone po dopasowaniu danych eksperymentalnych
do modelu reakcji pierwszego rzędu w oparciu o równanie 4.11, przedstawiono w tabeli 5.3.
W tabeli 5.4. przedstawiono czasy dziesięciokrotnej redukcji aktywności enzymu
D
wyznaczone
na podstawie równania 4.13.
85

Omówienie i dyskusja wyników – Kinetyka inaktywacji cieplnej
α
-amylazy
Kinetykę inaktywacji
α
-amylazy w systemie S1 (roztwór wodny bez dodatku
maltodekstryny), opisaną modelem reakcji pierwszego rzędu, przedstawiono na rysunkach 5.21
i 5.22 oraz w tabeli 10.18. Czas dziesięciokrotnej redukcji
D
jest to czas, przy którym wartość
log
A
/
A
0
przy danej temperaturze osiąga wartość –1. Wartość ta zmniejsza się wraz ze
wzrostem temperatury, tzn. obniżenie aktywności początkowej enzymu o 90 % zachodzi
w krótszym czasie. W systemie S1 wartość
D
w temperaturach 62,5; 65,0; 67,5 i 70,0°C
wynosiła odpowiednio 17,4; 8,9; 7,0 i 2,7 min. Stała szybkości reakcji inaktywacji
k
jest
wartością bezwzględną współczynnika nachylenia prostej na wykresie zależności ln
A
/
A
0
od
czasu (Rys. 5.22). Ulega ona zwiększeniu wraz ze wzrostem temperatury, tzn., że reakcja
inaktywacji przebiega z większą szybkością. W systemie S1 wartość
k
w temperaturach 62,5;
65,0; 67,5 i 70,0°C wynosiła odpowiednio 0,132; 0,258; 0,330 i 0,826 min
-1
.
Wyznaczenie kinetycznych parametrów pierwszorzędowych
D
i
k
na podstawie zależności
log
A
/
A
0
od czasu oraz ln
A
/
A
0
od czasu było pierwszym etapem wyznaczania parametrów
kinetycznych w dwustopniowej metodzie regresji liniowej. Drugim etapem było wyznaczenie
parametrów drugorzędowych
z
i
E
a
za pomocą regresji liniowej na podstawie zależności log
D
od temperatury i ln
k
od odwrotności temperatury absolutnej zgodnie z równaniami 4.14 i 4.12.
Kinetyczne parametry drugorzędowe przedstawiono w dalszej części pracy.
Zależność między czasem inaktywacji a aktywnością
α
-amylazy w czterech różnych
temperaturach w systemie S1 przedstawiono na rysunku 5.23. Dane eksperymentalne
opisywano za pomocą regresji nieliniowej modelem równania reakcji pierwszego rzędu,
połączonym z równaniem Arrheniusa zgodnie z równaniem 4.17 lub na podstawie modelu
czasu śmierci cieplnej zgodnie z równaniem 4.18. Na rysunku 5.23 dane uzyskane na
podstawie modelu przedstawiono liniami ciągłymi o kolorach odpowiadających kolorom serii
danych eksperymentalnych otrzymanych w kolejnych temperaturach. Na rysunku 5.24
przedstawiono porównanie danych eksperymentalnych inaktywacji
α
-amylazy w systemie S1 z
wartościami uzyskanymi poprzez dopasowanie modelu za pomocą regresji nieliniowej.
Zgrupowanie punktów wokół prostej x=y świadczy o dobrym dopasowaniu zastosowanego
modelu.
86
Omówienie i dyskusja wyników – Kinetyka inaktywacji cieplnej
α
-amylazy
-2,5
-2
-1,5
-1
-0,5
0
0
5
10
15
20
Czas (min)
lo
g
A/
A
0
62,5
65,0
67,5
70,0
Temperatura (
o
C)
Rys. 5.21. Kinetyka
inaktywacji
α
-amylazy
w systemie S1: dane
eksperymentalne otrzymane
w temperaturze 62,5°C (
);
65,0°C (
); 67,5°C (
);
70,0°C (
), model dopaso-
wany za pomocą regresji
liniowej dla temperatury
62,5°C (
) R
2
=0,99; 65,0°C
(
) R
2
=0,99; 67,5°C (
)
R
2
=0,98; 70,0°C (
) R
2
=0,95
-5
-4
-3
-2
-1
0
0
5
10
15
20
Czas (min)
ln
A/
A
0
62,5
65,0
67,5
70,0
Temperatura (
o
C)
Rys. 5.22. Kinetyka
inaktywacji
α
-amylazy
w systemie S1: dane
eksperymentalne otrzymane
w temperaturze 62,5°C (
);
65,0°C (
); 67,5°C (
);
70,0°C (
), model dopaso-
wany za pomocą regresji
liniowej dla temperatury
62,5°C (
) R
2
=0,99; 65,0°C
(
) R
2
=0,99; 67,5°C (
)
R
2
=0,98; 70,0°C (
) R
2
=0,95
87
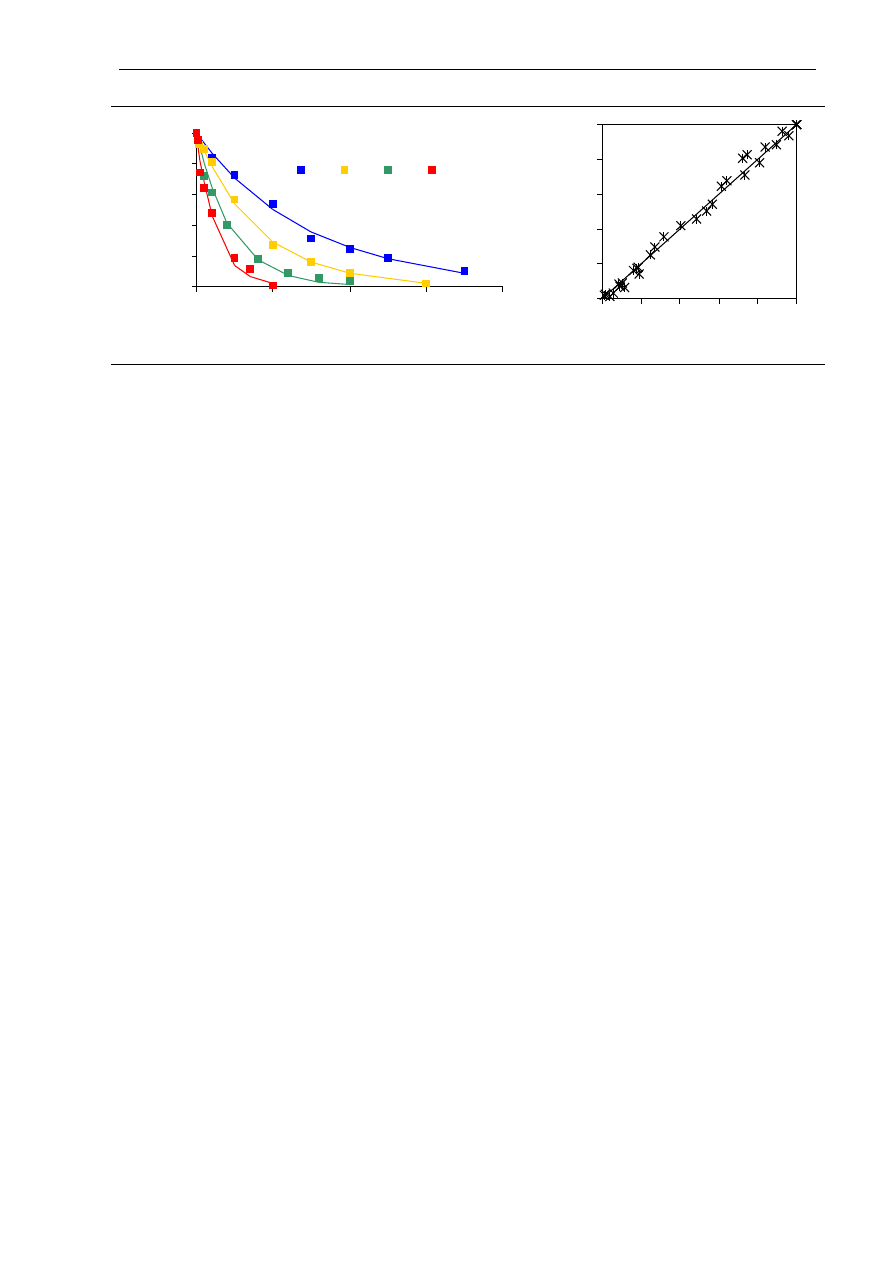
Omówienie i dyskusja wyników – Kinetyka inaktywacji cieplnej
α
-amylazy
0
0,2
0,4
0,6
0,8
1
0
5
10
15
20
Czas (min)
A
/A
0
62,5 65,0 67,5 70,0
Temperatura (
o
C)
0,0
0,2
0,4
0,6
0,8
1,0
0,0
0,2
0,4
0,6
0,8
1,0
A/A
0
(exp)
A/
A
0
(
p
re
d
)
Rys. 5.23. Zależność między czasem
inaktywacji a aktywnością względną
α
-amylazy
w systemie S1 (woda): dane eksperymentalne
otrzymane w temperaturze 62,5°C (
); 65,0°C
(
); 67,5°C (
); 70,0°C (
), model dopaso-
wany za pomocą regresji nieliniowej dla
temperatury 62,5°C (
); 65,0°C (
);
67,5°C (
)
; 70,0°C (
)
Rys. 5.24. Porównanie danych
eksperymentalnych (exp)
inaktywacji
α
-amylazy
w systemie S1 z wartościami
uzyskanymi poprzez dopaso-
wanie modelu za pomocą regresji
nieliniowej (pred)
Dla kolejnych systemów S2 – S5 o zmniejszającej się zawartości wody, w których
badano kinetykę inaktywacji
α
-amylazy, przedstawiono wykresy zależności log
A
/
A
0
od czasu
(regresja liniowa),
A
/
A
0
od czasu (regresja nieliniowa) oraz graficzne porównanie danych
eksperymentalnych inaktywacji z wartościami uzyskanymi poprzez dopasowanie modelu za
pomocą regresji nieliniowej. Wyniki przeprowadzonych eksperymentów przedstawiono
w tabelach 10.19 (system S2), 10.20 (system S3), 10.21 (system S4), 10.22 (system S5).
88
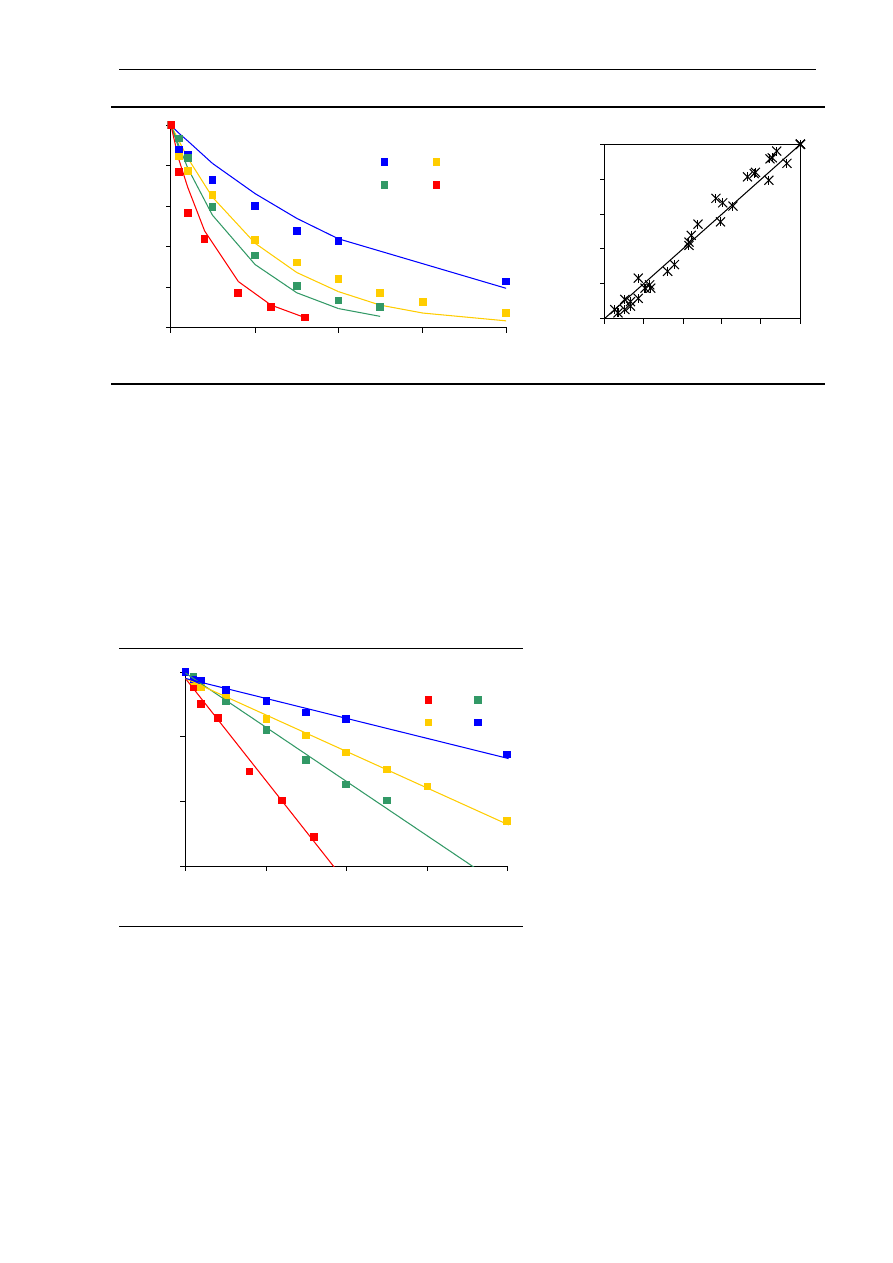
Omówienie i dyskusja wyników – Kinetyka inaktywacji cieplnej
α
-amylazy
0
0,2
0,4
0,6
0,8
1
0
5
10
15
20
Czas (min)
A/
A
0
70,0
72,5
73,5
75,0
Temperatura (
o
C)
0,0
0,2
0,4
0,6
0,8
1,0
0,0
0,2
0,4
0,6
0,8
1,0
A/A
0
(exp)
A
/A
0
(
p
re
d
)
Rys. 5.25. Zależność między czasem
inaktywacji a aktywnością względną
α
-amylazy
w systemie S2: dane eksperymentalne
otrzymane w temperaturze 70,0°C (
); 72,5°C
(
); 73,5°C (
); 75,0°C (
), model dopaso-
wany za pomocą regresji nieliniowej dla
temperatury 70,0°C (
); 72,5°C (
);
73,5°C (
)
; 75,0°C (
)
Rys. 5.26. Porównanie danych
eksperymentalnych (exp)
inaktywacji
α
-amylazy
w systemie S2 z wartościami
uzyskanymi poprzez dopaso-
wanie modelu za pomocą regresji
nieliniowej (pred)
-1,5
-1
-0,5
0
0
5
10
15
20
Czas (min)
lo
g
A/
A
0
75,0
73,5
72,5
70,0
Temperatura (
o
C)
Rys. 5.27. Kinetyka inaktywacji
α
-amylazy w systemie S2: dane
eksperymentalne w temperaturze
70,0°C (
); 72,5°C (
); 73,5°C
(
); 75,0°C (
), model
dopasowany za pomocą regresji
liniowej dla temperatury 70,0°C
(
) R
2
=0,98; 72,5°C (
)
R
2
=0,99; 73,5°C (
)
R
2
=0,99;
75,0°C (
) R
2
=0,99
89
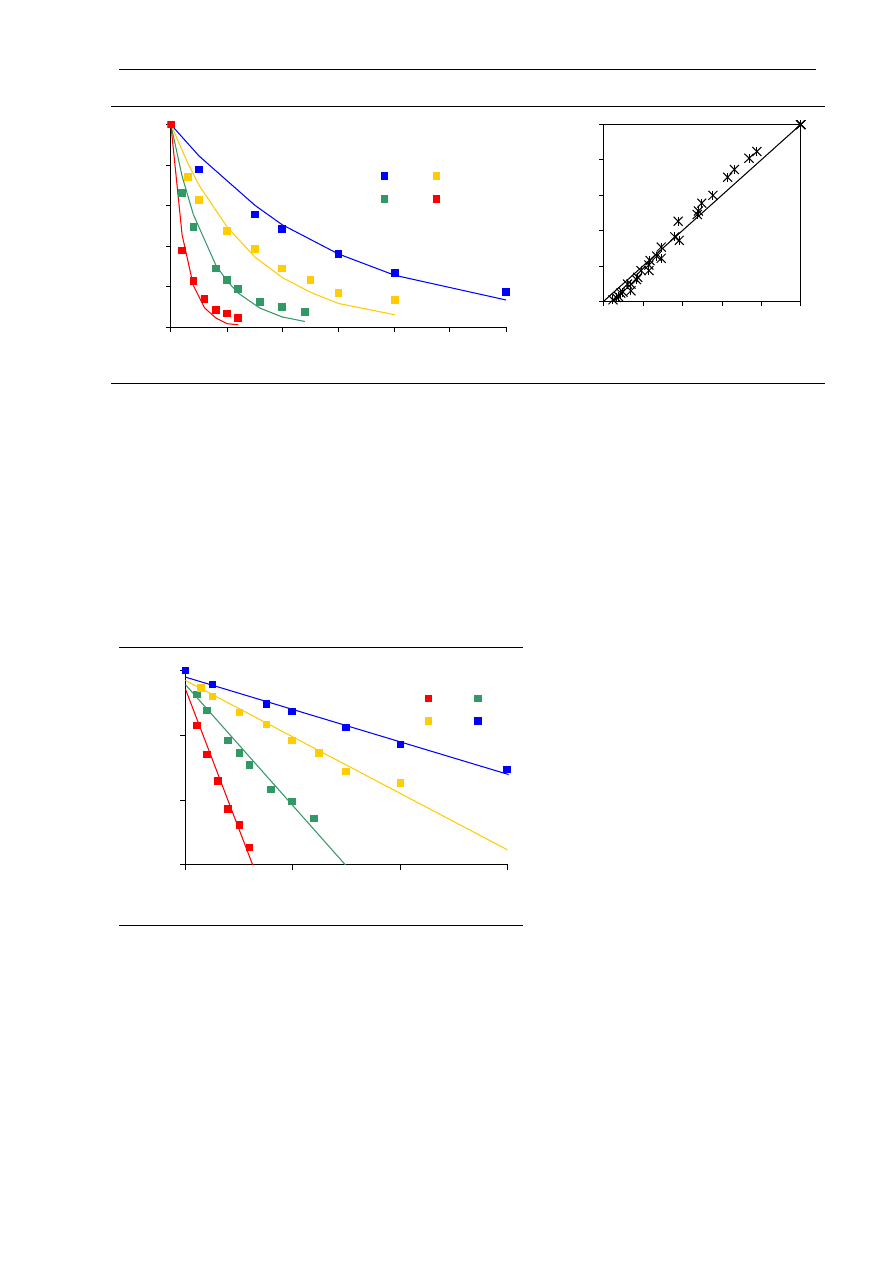
Omówienie i dyskusja wyników – Kinetyka inaktywacji cieplnej
α
-amylazy
0
0,2
0,4
0,6
0,8
1
0
5
10
15
20
25
30
Czas (min)
A/
A
0
73,5
75,0
76,5
78,5
Temperatura (
o
C)
0,0
0,2
0,4
0,6
0,8
1,0
0,0
0,2
0,4
0,6
0,8
1,0
A/A
0
(exp)
A/
A
0
(
p
re
d
)
Rys. 5.28. Zależność między czasem
inaktywacji a aktywnością względną
α
-amylazy
w systemie S3: dane eksperymentalne
otrzymane w temperaturze 73,5°C (
); 75,0°C
(
); 76,5°C (
); 78,5°C (
), model dopaso-
wany za pomocą regresji nieliniowej dla
temperatury 73,5°C (
); 75,0°C (
);
76,5°C (
)
; 75,8°C (
)
Rys. 5.29. Porównanie danych
eksperymentalnych (exp)
inaktywacji
α
-amylazy
w systemie S3 z wartościami
uzyskanymi poprzez dopaso-
wanie modelu za pomocą regresji
nieliniowej (pred)
-1,5
-1
-0,5
0
0
10
20
30
Czas (min)
lo
g
A/
A
0
78,5
76,5
75,0
73,5
Temperatura (
o
C)
Rys. 5.30. Kinetyka inaktywacji
α
-amylazy w systemie S3: dane
eksperymentalne w temperaturze
73,5°C (
); 75,0°C (
); 76,5°C
(
); 78,5°C (
), model
dopasowany za pomocą regresji
liniowej dla temperatury 73,5°C
(
) R
2
=0,99; 75,0°C (
)
R
2
=0,98; 76,5°C (
)
R
2
=0,97;
78,5°C (
) R
2
=0,97
90
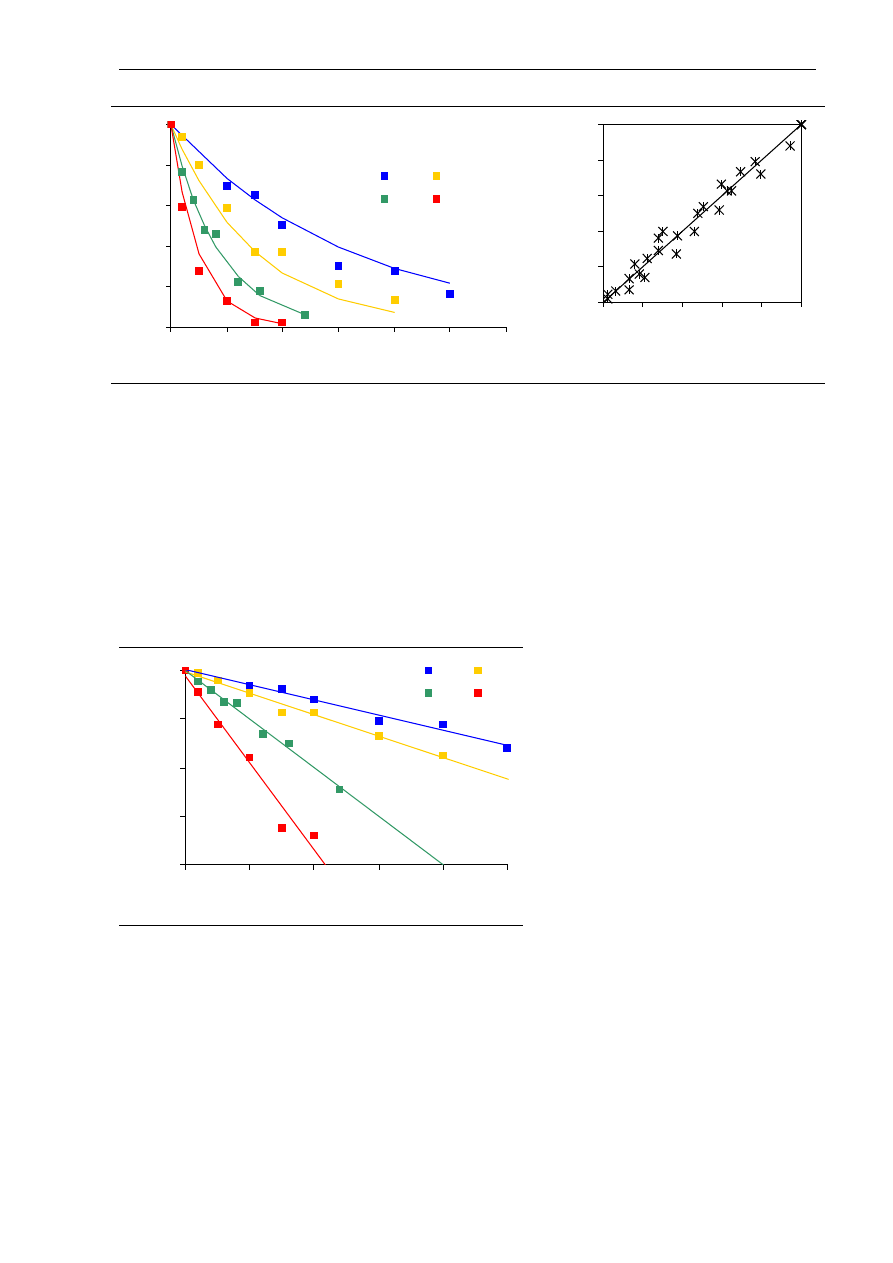
Omówienie i dyskusja wyników – Kinetyka inaktywacji cieplnej
α
-amylazy
0
0,2
0,4
0,6
0,8
1
0
5
10
15
20
25
30
Czas (min)
A/
A
0
95,0
97,0
98,5
100
Temperatura (
o
C)
0,0
0,2
0,4
0,6
0,8
1,0
0,0
0,2
0,4
0,6
0,8
1,0
A/A
0
(exp)
A/
A
0
(
p
re
d
)
Rys. 5.31. Zależność między czasem
inaktywacji a aktywnością względną
α
-amylazy
w systemie S4: dane eksperymentalne
otrzymane w temperaturze 95,0°C (
); 97,0°C
(
); 98,5°C (
); 100,0°C (
), model dopaso-
wany za pomocą regresji nieliniowej dla
temperatury 95,0°C (
); 97,0°C (
);
98,5°C (
)
; 100,0°C (
)
Rys. 5.32. Porównanie danych
eksperymentalnych (exp)
inaktywacji
α
-amylazy
w systemie S4 z wartościami
uzyskanymi poprzez dopaso-
wanie modelu za pomocą regresji
nieliniowej (pred)
-2
-1,5
-1
-0,5
0
0
5
10
15
20
25
Czas (min)
lo
g
A/
A
0
95,0
97,0
98,5
100
Temperatura (
o
C)
Rys. 5.33. Kinetyka inaktywacji
α
-amylazy w systemie S4: dane
eksperymentalne w temperaturze
95,0°C (
); 97,0°C (
); 98,5°C
(
); 100,0°C (
), model
dopasowany za pomocą regresji
liniowej dla temperatury 95,0°C
(
) R
2
=0,98; 97,0°C (
)
R
2
=0,99; 98,5°C (
)
R
2
=0,99;
100,0°C (
) R
2
=0,97
91
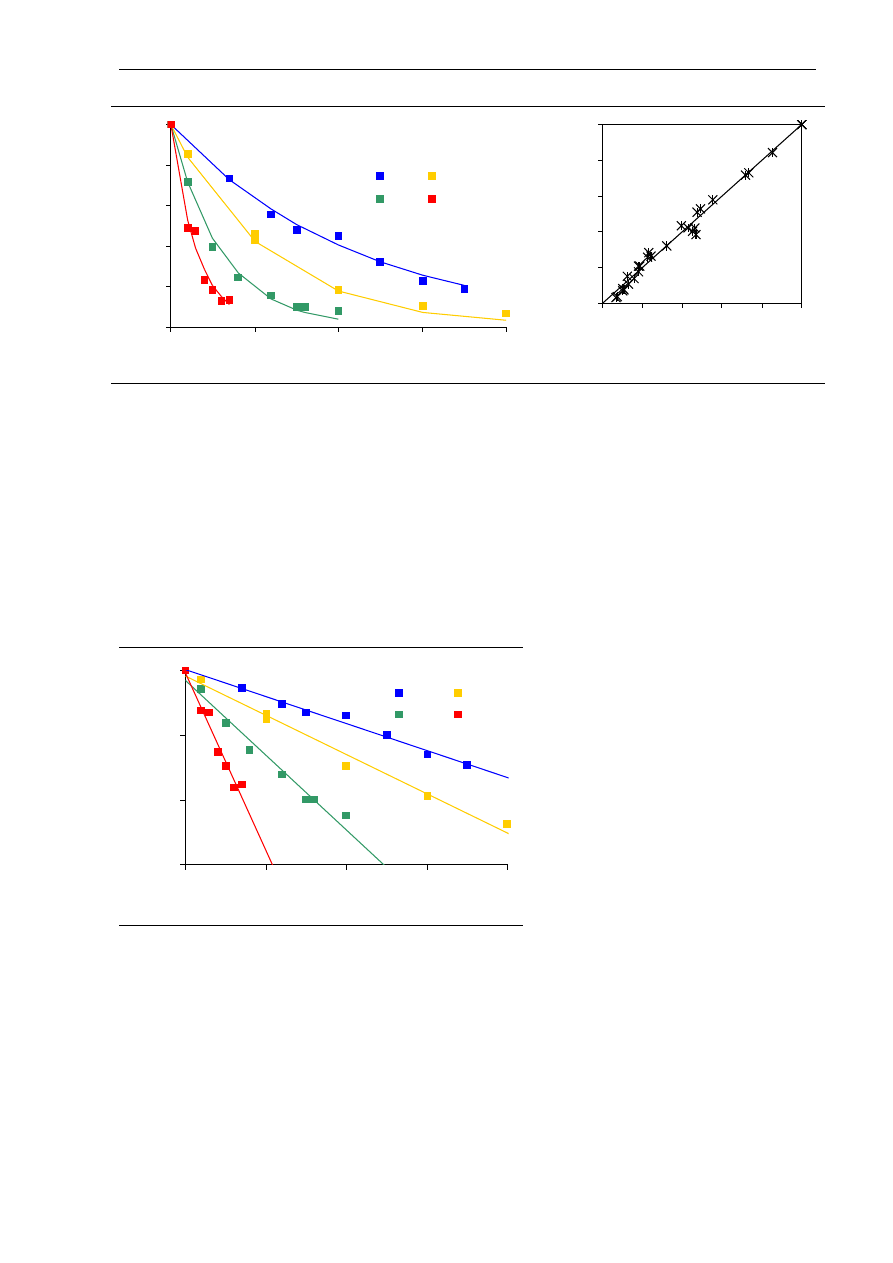
Omówienie i dyskusja wyników – Kinetyka inaktywacji cieplnej
α
-amylazy
0
0,2
0,4
0,6
0,8
1
0
5
10
15
20
Czas (min)
A/
A
0
100,0 102,5
105,0 107,5
Temperatura (
o
C)
0,0
0,2
0,4
0,6
0,8
1,0
0,0
0,2
0,4
0,6
0,8
1,0
A/A
0
(exp)
A/
A
0
(
p
re
d
)
Rys. 5.34. Zależność między czasem
inaktywacji a aktywnością względną
α
-amylazy
w systemie S5: dane eksperymentalne
otrzymane w temperaturze 100,0°C (
);
102,5°C (
); 105,0°C (
); 107,5°C (
),
model dopasowany za pomocą regresji
nieliniowej dla temperatury 100,0°C (
);
102,5°C (
); 105,0°C (
)
; 107,5°C (
)
Rys. 5.35. Porównanie danych
eksperymentalnych (exp)
inaktywacji
α
-amylazy
w systemie S5 z wartościami
uzyskanymi poprzez dopaso-
wanie modelu za pomocą regresji
nieliniowej (pred)
-1,5
-1
-0,5
0
0
5
10
15
20
Czas (min)
lo
g
A/
A
0
100,0
102,5
105,0
107,5
Temperatura (
o
C)
Rys. 5.36. Kinetyka inaktywacji
α
-amylazy w systemie S5: dane
eksperymentalne w temperaturze
100,0°C (
); 102,5°C (
);
105,0°C (
); 107,5°C (
),
model dopasowany za pomocą
regresji liniowej dla temperatury
100,0°C (
) R
2
=0,98; 102,5°C
(
) R
2
=0,98; 105,0°C (
)
R
2
=0,98; 107,5°C (
) R
2
=0,96
Kinetyka inaktywacji cieplnej
α
-amylazy w systemie S6 o najniższej zawartości wody
0,029 g H
2
O/g s.s. nie mogła być opisana modelem reakcji pierwszego rzędu, tak jak
w pozostałych systemach. Lepsze dopasowanie do danych eksperymentalnych wykazał model
„biphasic” (równanie 2.7), zakładający istnienie dwóch frakcji enzymu – termolabilnej (a
l
)
i termostabilnej (a
s
). W dalszej części pracy termolabilna frakcja enzymu w systemie S6 będzie
oznaczana jako S6l, a frakcja termostabilna jako S6s. Według modelu „biphasic” obie frakcje
92
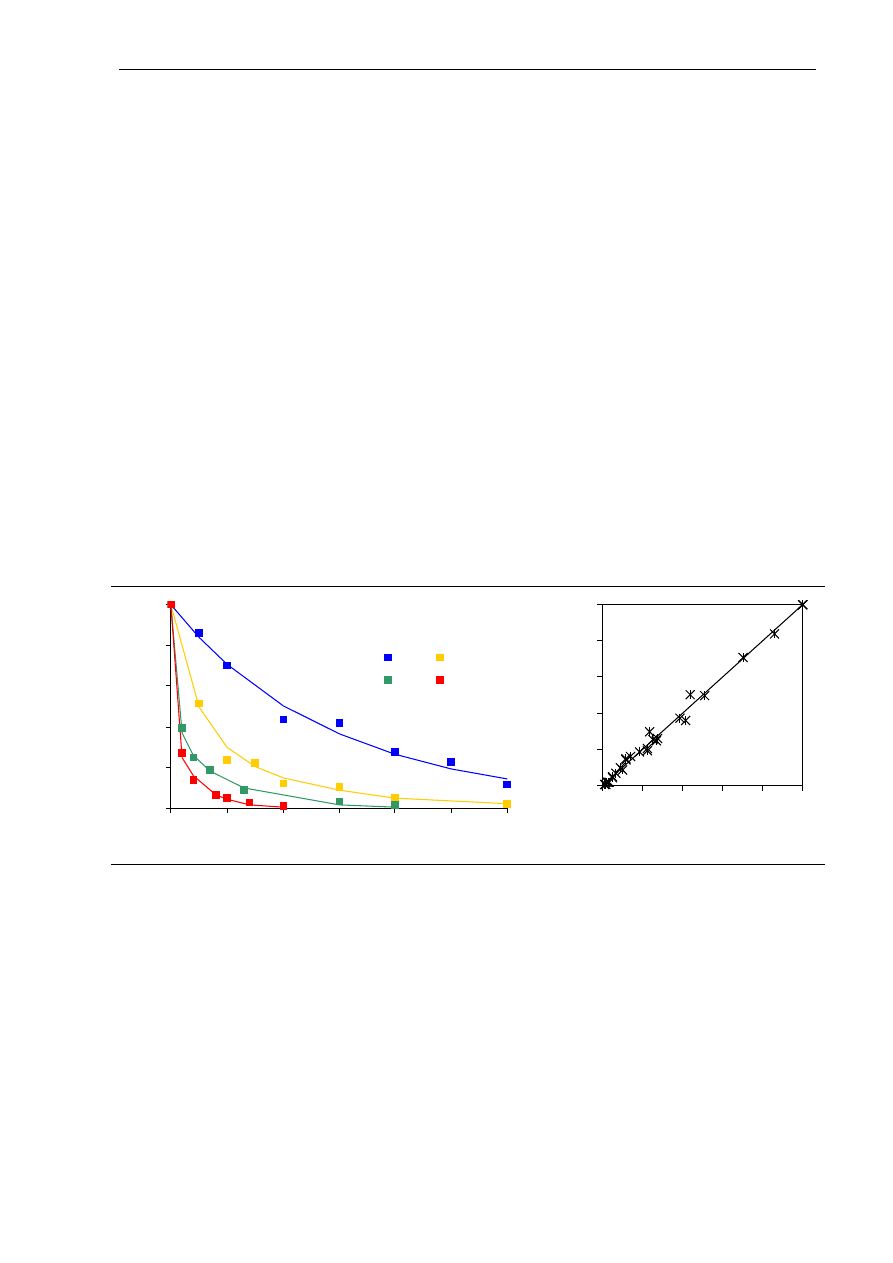
Omówienie i dyskusja wyników – Kinetyka inaktywacji cieplnej
α
-amylazy
enzymu niezależnie od siebie podlegają inaktywacji zgodnie z modelem reakcji pierwszego
rzędu. Frakcja labilna wykazuje większą wartość stałej inaktywacji
k
(Tabela 5.3) i mniejszą
wartość czasu dziesięciokrotnej redukcji
D
(Tabela 5.4). Wyniki eksperymentów mających na
celu zbadanie kinetyki inaktywacji
α
-amylazy w systemie S6 przedstawiono tabeli 10.23.
Zależność między czasem inaktywacji a aktywnością
α
-amylazy w czterech różnych
temperaturach w systemie S6 przedstawiono na rysunku 5.37. Dane eksperymentalne
opisywano za pomocą regresji nieliniowej modelem „biphasic”, czyli niezależnie dla obu
frakcji enzymu równaniem reakcji pierwszego rzędu połączonym z równaniem Arrheniusa
zgodnie z równaniem 4.17 lub na podstawie modelu czasu śmierci cieplnej zgodnie
z równaniem 4.18. Na rysunku 5.37 dane uzyskane na podstawie modelu przedstawiono liniami
ciągłymi o kolorach odpowiadających kolorom serii danych eksperymentalnych otrzymanych w
kolejnych temperaturach. Na rysunku 5.38. przedstawiono porównanie danych
eksperymentalnych inaktywacji
α
-amylazy w systemie S6 z wartościami uzyskanymi poprzez
dopasowanie modelu za pomocą regresji nieliniowej. Zgrupowanie punktów wokół prostej x=y
świadczy o dobrym dopasowaniu zastosowanego modelu.
0
0,2
0,4
0,6
0,8
1
0
5
10
15
20
25
30
Czas (min)
A/
A
0
100
105
110
115
Temperatura (
o
C)
0,0
0,2
0,4
0,6
0,8
1,0
0,0
0,2
0,4
0,6
0,8
1,0
A/A
0
(exp)
A/
A
0
(
p
re
d
)
Rys. 5.37. Zależność między czasem
inaktywacji a aktywnością względną
α
-amylazy
w systemie S6: dane eksperymentalne
otrzymane w temperaturze 100,0°C (
);
105,0°C (
); 110,0°C (
); 115,0°C (
),
model dopasowany za pomocą regresji
nieliniowej dla temperatury 100,0°C (
);
105,0°C (
); 110,0°C (
)
; 115,0°C (
)
Rys. 5.38. Porównanie danych
eksperymentalnych (exp)
inaktywacji
α
-amylazy
w systemie S6 z wartościami
uzyskanymi poprzez dopaso-
wanie modelu za pomocą regresji
nieliniowej (pred)
W tabeli 5.3 przedstawiono stałe szybkości reakcji inaktywacji
α
-amylazy
k
, a w tabeli 5.4
czas dziesięciokrotnej redukcji aktywności
α
-amylazy w systemach o wysokiej i niskiej
93

Omówienie i dyskusja wyników – Kinetyka inaktywacji cieplnej
α
-amylazy
zawartości wody. Obserwowano znaczne zwiększanie stabilności cieplnej
α
-amylazy wraz
z obniżaniem zawartości wody. Na podstawie przedstawionych tabel oraz wykresów można
zaobserwować, że wraz ze zmniejszaniem się zawartości wody zakres temperatur, w których
następowała inaktywacja cieplna
α
-amylazy, przesuwał się w kierunku wyższych temperatur.
Enzym w roztworze wodnym (S1) ulegał inaktywacji cieplnej w zakresie temperatury od 62,5
do 70,0°C. Po zmniejszeniu zawartości wody do 0,029 g H
2
O/g s.s. (S6) temperaturę, w której
badano kinetykę inaktywacji cieplnej enzymu, zwiększono do 100 – 115°C w celu uzyskania
mierzalnych wartości
D
i
k
. W przypadku zastosowania tej samej temperatury w systemach
o różnej zawartości wody obserwowano mniejszą wartość stałej szybkości reakcji inaktywacji
oraz większy czas dziesięciokrotnej redukcji w systemie o niższej zawartości wody.
Przykładowo, w temperaturze 75°C stała szybkości inaktywacji
k
wynosząca
0,100
±
0,006 min
-1
w systemie S3 o zawartości wody 1,8 g H
2
O/g s.s. uległa zwiększeniu do
0,365
±
0,016 min
-1
, gdy zawartość wody wzrosła do 3,5 g H
2
O/g s.s. (S2). Równocześnie czas
dziesięciokrotnej redukcji
D
zmniejszył się z 22,9
±
1,3 do 6,3
±
0,3 min.
Podobny ochronny wpływ niskiej zawartości wody na stabilność cieplną
α
-amylazy był
obserwowany wcześniej przez Terebiznik i wsp. (1997) (
α
-amylaza z
Aspergillus oryzae
) oraz
Saraiva i wsp. (1992 i 1996) i Haentjens i wsp. (1998) (
α
-amylaza pochodzenia bakteryjnego
z gatunku
Bacillus
).
W pracy przedstawionej przez Terebiznik i wsp. (1997) badano stabilność
cieplną
α
-amylazy z
Aspergillus oryzae
w roztworze wodnym oraz w systemie o niskiej
zawartości wody otrzymanym poprzez liofilizację i adsorpcję wody do stanu równowagi nad
nasyconym roztworem CH
3
COOK. Usuwanie wody wpłynęło na znaczne zwiększenie stabilności
cieplnej enzymu. Czas potrzebny do obniżenia aktywności enzymu o połowę, w czasie obróbki
cieplnej w 60°C, wynoszący 6 min w przypadku badania kinetyki inaktywacji w roztworze
wodnym, wzrósł do 100 min, gdy kinetykę badano w systemie o niskiej zawartości wody. Ze
względu na niepodawanie przez autorów wyżej cytowanej publikacji czasów dziesięciokrotnej
redukcji
D
i stałych szybkości reakcji
k
, trudne jest bezpośrednie porównanie wyników
otrzymanych w bieżącej pracy, poza stwierdzeniem, że obserwowano podobny wpływ
stabilizujący niskiej zawartości wody.
W systemie S6 o zawartości wody 0,029 g H
2
O/g s.s. kinetyka inaktywacji stabilnej frakcji
α
-amylazy (S6s) charakteryzowała się zacznie niższymi wartościami stałej szybkości
inaktywacji
k
oraz wyższymi wartościami czasu dziesięciokrotnej redukcji
D
w porównaniu
z frakcja labilną (S6l). Przykładowo, w temperaturze 105°C stała szybkości inaktywacji frakcji
labilnej enzymu wynosiła 0,386 ± 0,112 min
-1
, podczas gdy dla frakcji stabilnej wartość ta
wynosiła 0,070 ± 0,049 min
-1
.
94

Omówienie i dyskusja wyników – Kinetyka inaktywacji cieplnej
α
-amylazy
Istnienie dwóch frakcji enzymu o różnej stabilności cieplnej w systemie o najniższej
zawartości wody S6, może być związane z podatnością maltodekstryny na tworzenie stanu
szklistego w czasie suszenia oraz z teorią przemiany szklistej (Samborska i wsp. 2004). Ross
i Karel (1991) podają temperaturę przemiany szklistej maltodekstryny (DE 5) o różnej
zawartości wody (Rys. 2.16.). Jeśli porówna się przedstawione wartości z temperaturą, w której
prowadzono badanie kinetyki inaktywacji
α
-amylazy w systemach o różnej zawartości wody,
można zauważyć, że jedynie w przypadku systemu S6 badanie kinetyki prowadzono
w temperaturze poniżej temperatury przemiany szklistej. W przypadku systemu S4 wartość T
g
oszacowana na podstawie rysunku 2.15 wynosi około 25°C, podczas gdy badanie kinetyki
inaktywacji prowadzono w temperaturach od 95 – 100°C. Podobnie w przypadku systemu S5,
w którym wartość T
g
wynosząca 87°C również była niższa od temperatury stosowanej w czasie
badania kinetyki inaktywacji cieplnej. Wynika z tego, że stan szklisty wytworzony w czasie
liofilizacji ulegał uplastycznieniu w czasie obróbki cieplnej. Jedynie w przypadku systemu S6,
o najniższej zawartości wody, temperatura przemiany szklistej wynosząca około 120°C była
wyższa niż temperatura stosowana w czasie obróbki cieplnej (100 – 115°C). Można więc
przypuszczać, że maltodekstryna w tym systemie, w czasie badania kinetyki inaktywacji
cieplnej, występowała w stanie szklistym. Jednakże, ponieważ przemiana szklista nie jest
przemianą zachodzącą „nagle” w temperaturze T
g
, lecz stopniowo w pewnym zakresie
temperatur zbliżonych do T
g
, można przypuszczać, że niewielka różnica temperatur pomiędzy
temperaturą przemiany szklistej a temperaturą obróbki cieplnej mogła spowodować tylko
częściowe występowanie maltodekstryny w systemie S6 w stanie szklistym, co z kolei mogło
być przyczyną występowania dwóch frakcji enzymu o różnej stabilności cieplnej. Stabilna
frakcja enzymu, unieruchomiona w stanie szklistym, charakteryzowała się mniejszą stałą
szybkości reakcji inaktywacji niż frakcja labilna, znajdująca się w częściowo uplastycznionych
regionach polimeru. Wartość stałej szybkości reakcji inaktywacji frakcji labilnej enzymu
w systemie S6 była zbliżona do wartości w systemie S5, co potwierdza powyższe rozważania.
Wysoka lepkość składników występujących w stanie szklistym oraz znacznie ograniczona
ruchliwość cząsteczek są znanymi przyczynami stabilizacji struktury białek w wyniku
uniemożliwiania zachodzenia zmian konformacyjnych prowadzących do denaturacji (Buitink
i wsp. 2000).
Obecność dwóch frakcji enzymu w systemie S6 można również wyjaśnić faktem, że stan
szklisty może być złożony z bardziej i mniej zagęszczonych regionów. Te drugie, nazywane np.
„niejednorodnościami” (ang. „heterogenities”) lub „fluktuacjami gęstości” (ang. „density
95
Tabela 5.3. Stała szybkości reakcji inaktywacji cieplnej
α
-amylazy w systemach o wysokiej i niskiej zawartości
wody
S6l
S6s
S5
S4
S3
S2
S1
0,029 g H
2
O/g s.s.
Frakcja labilna
Frakcja stabilna
0,060 g H
2
O/g s.s. 0,163 g H
2
O/g s.s.
1,8 g H
2
O/g s.s.
3,5 g H
2
O/g s.s.
Roztwór wodny
enzymu bez
dodatku
maltodekstryny
Temp. (
o
C)
k (min
-1
)
62,5
0,132 (± 0,005)
65,0
0,258 (± 0,005)
67,5
0,330 (± 0,018)
70,0
0,071 (± 0,004)
0,826 (± 0,080)
72,5
0,130 (± 0,003)
73,5
0,058 (± 0,003)
0,192 (± 0,007)
75,0
0,100 (± 0,006)
0,364 (± 0,016)
76,5
0,216 (± 0,014)
78,5
0,497 (± 0,041)
95,0
0,072 (± 0,033)
97,0
0,103 (± 0,009)
98,5
0,232 (± 0,005)
100,0
0,066 (± 0,004)
0,095 (± 0,004)
0,411 (± 0,005)
102,5
0,140 (± 0,008)
105,0
0,386 (± 0,112)
0,070 (± 0,049)
0,268 (± 0,017)
107,5
0,638 (± 0,060)
110,0
1,828 (± 0,247)
0,188 (± 0,029)
115,0
2,028 (± 0,027)
0,300 (± 0,006)
96
Tabela 5.4. Czas dziesięciokrotnej redukcji aktywności
α
-amylazy w systemach o wysokiej i niskiej zawartości wody
S6l
S6s
S5
S4
S3
S2
S1
0,029 g H
2
O/g s.s.
Frakcja labilna
Frakcja stabilna
0,060 g H
2
O/g s.s. 0,163 g H
2
O/g s.s.
1,8 g H
2
O/g s.s.
3,5 g H
2
O/g s.s.
Roztwór wodny
enzymu bez
dodatku
maltodekstryny.
Temp. (
o
C)
D (min)
62,5
17,4 ± 0,6
65,0
8,9 ± 0,2
67,5
7,0 ± 0,4
70,0
32,3 ± 1,7
2,7 ± 0,3
72,5
17,7 ± 0,4
73,5
40,0 ± 2,1
12,0 ± 0,4
75,0
22,9 ± 1,3
6,3 ± 0,3
76,5
10,7 ± 0,7
78,5
4,6 ± 0,4
95,0
31,9 ± 2,1
97,0
22,4 ± 1,1
98,5
9,9 ± 0,4
100,0
34,8 ± 2,4
24,2 ± 1,1
5,6 ± 0,5
102,5
16,5 ± 0,9
105,0
5,9 ± 1,7
32,8 ± 23,0
8,6 ± 0,5
107,5
3,6 ± 0,3
110,0
1,3 ± 0,2
12,3 ± 1,8
115,0
1,1 ± 0,01
7,6 ± 0,1
fluctuations”), są obszarami mobilnymi, w których mogą występować ruchy polimerów lub ruchy uwięzionego wewnątrz gazu i małych cząsteczek
(Rounant i wsp. 2004, Chan i wsp. 1984, Stillinger i Hodgon 1994). Enzym znajdujący się w takim regionie polimeru o zwiększonej możliwości
97

występowania ruchów cząsteczek, może charakteryzować się mniejszą stabilnością cieplną niż enzym znajdujący się w bardziej „unieruchomionej”
frakcji stanu szklistego.
Występowanie dwóch frakcji enzymu o różnej stabilności cieplnej zaobserwowali również De Cordt i wsp. (1994), badając kinetykę
inaktywacji cieplnej
α
-amylazy z
Bacillus licheniformis
unieruchomionej na złożu koralików krzemionkowych pokrytych warstwą silikonu.
Należy jednak zauważyć, że
α
-amylaza w systemach, które powyżej uznano za występujące w czasie obróbki cieplnej w stanie lepko-
sprężystym, również wykazuje zwiększającą się stabilność cieplną wraz ze zmniejszaniem zawartości wody. Oznacza to, że występowanie
maltodekstryny w stanie szklistym nie jest głównym czynnikiem wpływającym na odporność cieplną enzymu. Jak wcześniej wspominano, istotne
jest ograniczenie ruchliwości cząsteczek w warunkach niskiej zawartości wody, uniemożliwiające zachodzenie zmian strukturalnych prowadzących
do denaturacji białka. Istotną rolę w procesie stabilizacji pełni również zastępowanie cząsteczek wody niezbędnych do utrzymania natywnej
struktury białka przez cząsteczki cukru, w wyniku tworzenia wiązań wodorowych (Terebiznik i wsp. 1998). Przy zmniejszającej się zawartości
wody a zwiększającej względnej zawartości cukrów, wymiana ta staje się coraz bardziej efektywna, co razem ze zmniejszającą się ruchliwością
cząsteczek przyczynia się do stabilizacji struktury białka, nawet gdy kinetyka inaktywacji badana jest
w temperaturach powyżej temperatury przemiany szklistej. Ponadto, pewną rolę w stabilizacji
α
-amylazy mogą odgrywać bezpośrednie oddziaływania maltodekstryny jako substratu tego enzymu, z jego centrum aktywnym, powodujące
usztywnianie
cząsteczki
białka
(De
Cordt
i wsp. 1994).
Wyniki
otrzymane
w
tej
części
pracy,
stwierdzające
wzrost
odporności
cieplnej
α
-amylazy w systemach o niskiej zawartości wody, są pomocne w wytłumaczeniu korzystnego wpływu suszenia rozpyłowego na zachowanie
aktywności enzymu. Ponieważ w czasie tego rodzaju suszenia następuje szybkie odparowanie wody, to równocześnie następuje szybki wzrost
odporności
α
-amylazy na działanie podwyższonej temperatury, a czas przebywania enzymu o niskiej odporności cieplnej (w środowisku o wysokiej
zawartości wody) w środowisku o podwyższonej temperaturze jest bardzo krótki. To pozwala na otrzymanie preparatu enzymatycznego o
wysokiej aktywności. Jednakże, pomimo tego, że w obu częściach pracy zmiany zawartości wody były w tym samym zakresie – od 3,5 do 0,03
g H
2
O/g s.s, to wyników otrzymanych w obu częściach pracy nie można porównywać bezpośrednio. W dyskusji wyników
98

dotyczących suszenia rozpyłowego zwrócono uwagę, że susze o najniższej zawartości wody (około 0,03 g H
2
O/g s.s.) wykazywały najniższą
aktywność względną, mimo, że w drugiej części pracy wykazano, że przy tej zawartości wody
α
-amylaza charakteryzowała się największą
odpornością na podwyższona temperaturę. Jednakże, badanie kinetyki inaktywacji cieplnej prowadzono w zupełnie innych warunkach – tzn.
proszek o tej samej zawartości wody otrzymano w wyniku liofilizacji i powolnego dosuszania. Takie łagodne warunki usuwania wody nie
prowadziły prawdopodobnie do zniszczenia struktury enzymu, lecz jedynie do takich zmian konformacyjnych, które powodowały zwiększenie
stabilności cieplnej. W czasie suszenia rozpyłowego drastyczne warunki wymiany ciepła i masy, prowadzące do otrzymania suszu o tej samej
zawartości wody, powodowały prawdopodobnie zniszczenie struktury białka. Tak więc, pojawiające się w literaturze stwierdzenie, że im szybciej i
bardziej intensywnie będzie prowadzony proces suszenia, tym lepsze zachowanie aktywności enzymu, jest prawdziwe tylko, jeśli proces suszenia
jest prowadzony do osiągnięcia pewnej granicznej zawartości wody. Zwiększanie intensywności procesu, prowadzące do dalszego obniżania
zawartości wody, nie wpływa korzystnie na zachowanie aktywności enzymu. Zwiększona degradacja enzymu przy zawartości wody niższej od
optymalnej mogła być spowodowana występowaniem frakcji enzymu o obniżonej stabilności cieplnej (frakcji labilnej). Prawdopodobne istnienie
tej frakcji enzymu obserwowano w przypadku proszku otrzymanego za pomocą liofilizacji (system S6), lecz nie można wykluczyć, że podczas
suszenia rozpyłowego również następuje tworzenie stanu szklistego maltodekstryny, prawdopodobnie odpowiedzialnego za istnienie dwóch frakcji
enzymu o różnej odporności cieplnej.
Na rysunku 5.39. przedstawiono logarytmiczną zależność czasu dziesięciokrotnej redukcji
D
aktywności
α
-amylazy od temperatury we
wszystkich
sześciu
systemach
o
wysokiej
i niskiej zawartości wody, z uwzględnieniem labilnej i stabilnej frakcji enzymu w systemie
o zawartości wody 0,029 g H
2
O/g s.s. (S6). Model dopasowany za pomocą regresji liniowej na podstawie równania 4.14 przedstawiono na tym
samym
wykresie
za
pomocą
linii
prostych
o kolorach takich samych jak dane eksperymentalne dla odpoowiedniego systemu. Wykres ten jest graficznym przedstawieniem drugiego etapu
w dwustopniowym wyznaczaniu drugorzędowych parametrów kinetycznych inaktywacji enzymu (wartość
z
), na podstawie modelu czasu śmierci
cieplnej, za pomocą regresji liniowej. Zgodnie z równaniem 4.14 odwrotność wartości bezwzględnej współczynnika nachylenia prostej na
wykresie
99
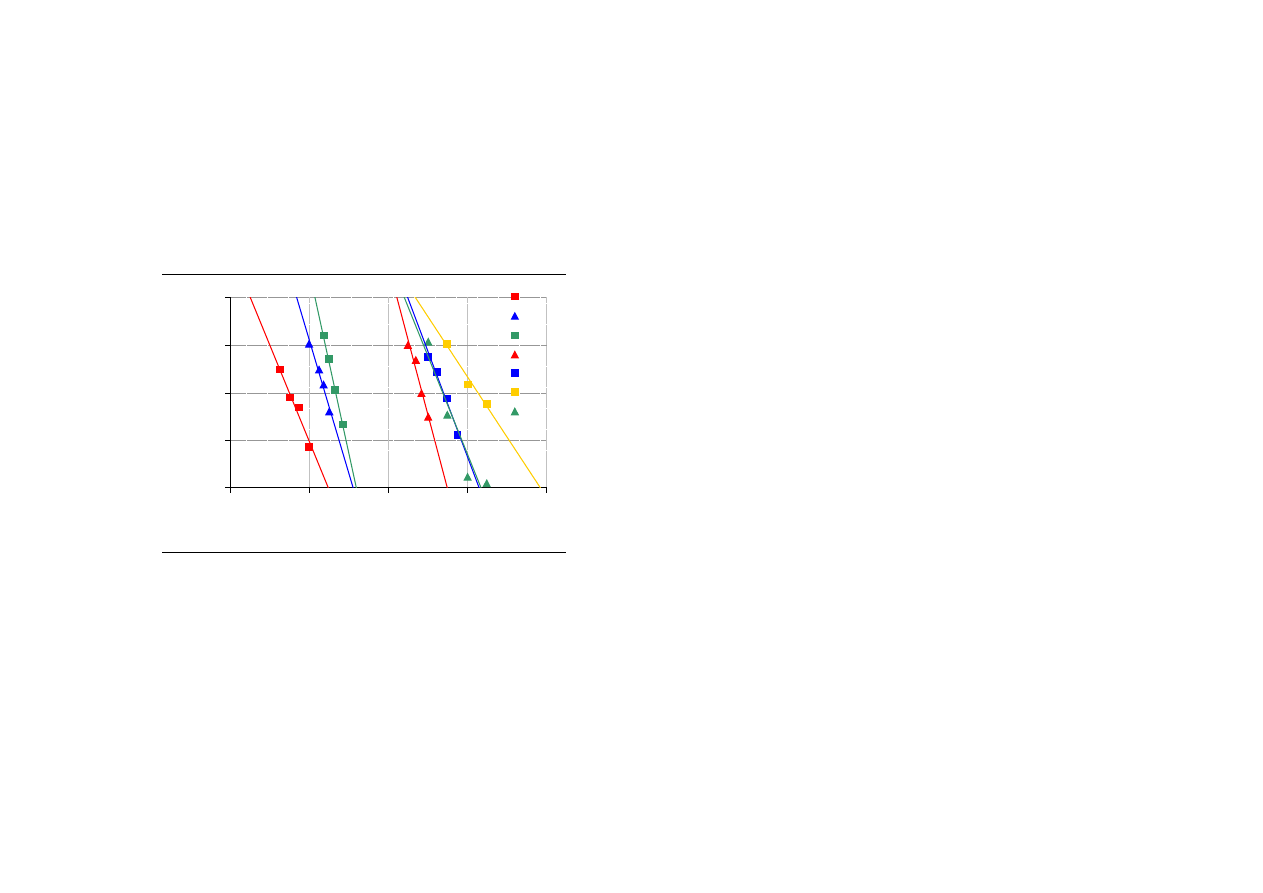
log
D
w funkcji temperatury jest równa wartości
z
. Wartość ta jest określana jako wzrost (lub obniżenie) temperatury, powodujący
dziesięciokrotne zmniejszenie (lub zwiększenie) czasu dziesięciokrotnej redukcji
D
. Na wykresie log
D
w funkcji temperatury wartość ta może być
odczytana jako różnica temperatury odpowiadająca zmianie
D
o jeden cykl logarytmiczny
(np. z log
D
=1 do log
D
=0). Wartość
z
jest zatem miarą wrażliwości czasu dziesięciokrotnej redukcji
D
na zmiany temperatury, a miarą wartości
z
jest współczynnik nachylenia prostej na wykresie log
D
w funkcji temperatury. Im większa wartość bezwzględna tego współczynnika tym większa
wartość
z
. Wszystkie wartości
z
przedstawiono w tabeli 5.5.
0,0
0,5
1,0
1,5
2,0
50
70
90
110
130
Temperatura (
o
C)
lo
g
D
S1
S2
S3
S4
S5
S6s
S6l
Rys. 5.39. Zależność
między czasem
dziesięciokrotnej redukcji D
a temperaturą inaktywacji
cieplnej
α
-amylazy w systemie
S1 (
), S2 (
), S3 (
),
S4 (
), S5 (
), S6s (
),
S6l (
)
Ze względu na mniejsze błędy szacowania wartości
z
i
E
a
występujące w metodzie regresji nieliniowej (z wyjątkiem systemu S3 i S6l) w
dalszej części omówienia i dyskusji wyników podawane będą tylko wartości otrzymane za pomocą tej metody szacowania.
Wartości
z
inaktywacji cieplnej
α
-amylazy
w badanych systemach znajdowały się
w przedziale od 4,7 ± 0,2 do 15,6 ± 1,6°C (Tabela 5.12). Wśród wszystkich badanych systemów największą wartość
z
oszacowano w przypadku
frakcji
stabilnej
enzymu
w
systemie
o zawartości wody 0,029 g H
2
O/g s.s. (S6s). Jednocześnie, jest to wartość najbardziej odbiegająca od wartości oszacowanych w pozostałych
100

systemach. Wartości
z
w systemach od S1 do S5 oraz S6l wykazują nieznaczne zróżnicowanie, bez wyraźnego wpływu zawartości wody na tę
wartość.
Na
podstawie
zwiększonej
wartości
z
we
frakcji
stabilnej
enzymu
w systemie S6 można stwierdzić, że enzym w tej frakcji jest znacznie mniej wrażliwy na zmiany temperatury, tzn. aby dziesięciokrotnie zmniejszyć
czas dziesięciokrotnej redukcji
D,
należy zwiększyć temperaturę o 15,6 ± 1,6°C. Aby taki sam efekt osiągnąć w pozostałych systemach potrzebne
jest trzykrotnie (np. system S3,
z
=4,7 ± 0,2°C) lub dwukrotnie mniejsze podwyższenie temperatury (np. system S5,
z
=8,8 ± 0,2°C).
Zwiększona wartość
z
we frakcji stabilnej enzymu w systemie S6, wskazująca na mniejszą wrażliwość na zmiany temperatury, może być
związana z unieruchomieniem tej frakcji enzymu w stanie szklistym utworzonym przez maltodekstrynę w czasie liofilizacji. Wpływ występowania
tego stanu materii na właściwości materiału był opisany we wcześniejszej części pracy. De Cordt i wsp. (1994), badając kinetykę inaktywacji
α
-
amylazy z
Bacillus licheniformis
,
oszacowali wartość
z
inaktywacji tego enzymu we frakcji stabilnej i labilnej, których występowanie było związane
z unieruchomieniem enzymu na złożu koralików silikonowych pokrytych warstwą silikonu. Nie stwierdzono znacznych różnic w wartości
z
w obu
frakcjach enzymu (
z
l
= 11,2°C;
z
s
= 10,0°C). Jednakże, możliwość porównania wyników obu prac jest ograniczona ze względu na inne źródło
enzymu oraz inny charakter unieruchomienia frakcji stabilnej enzymu.
Saraiva i wsp. (1992) podają wartości
z
inaktywacji cieplnej
α
-amylazy z
Bacillus amyloliquefaciens
w systemach o różnej zawartości wody
(adsorpcja wody przy aktywności wody a
w
od 0,11 do 0,88). Autorzy prezentują wartości w przedziale od 18,7 do 30,7°C i nie stwierdzają
występowania
korelacji
między
tymi
dwoma
zmiennymi
(zawartość
wody
i wartość z).
Na rysunku 5.40 przedstawiono logarytmiczną zależność stałej szybkości reakcji inaktywacji
α
-amylazy
k
od odwrotności temperatury
absolutnej we wszystkich sześciu systemach o wysokiej i niskiej zawartości wody, z uwzględnieniem labilnej i stabilnej frakcji enzymu w systemie
o zawartości wody 0,029 g H
2
O/g s.s. (S6). Wykres ten, nazywany wykresem Arrheniusa, jest graficznym przedstawieniem drugiego etapu
w dwustopniowym wyznaczaniu drugorzędowych parametrów kinetycznych inaktywacji enzymu (
E
a
) za pomocą regresji liniowej na podstawie
równania 4.12. Zgodnie z tym równaniem, wartość bezwzględna współczynnika nachylenia prostej na wykresie ln
k
w funkcji odwrotności
temperatury absolutnej, pomnożona przez stałą gazową R, jest równa energii aktywacji reakcji inaktywacji enzymu
E
a
. Wśród wszystkich
badanych
systemów
najmniejszą
wartość
101
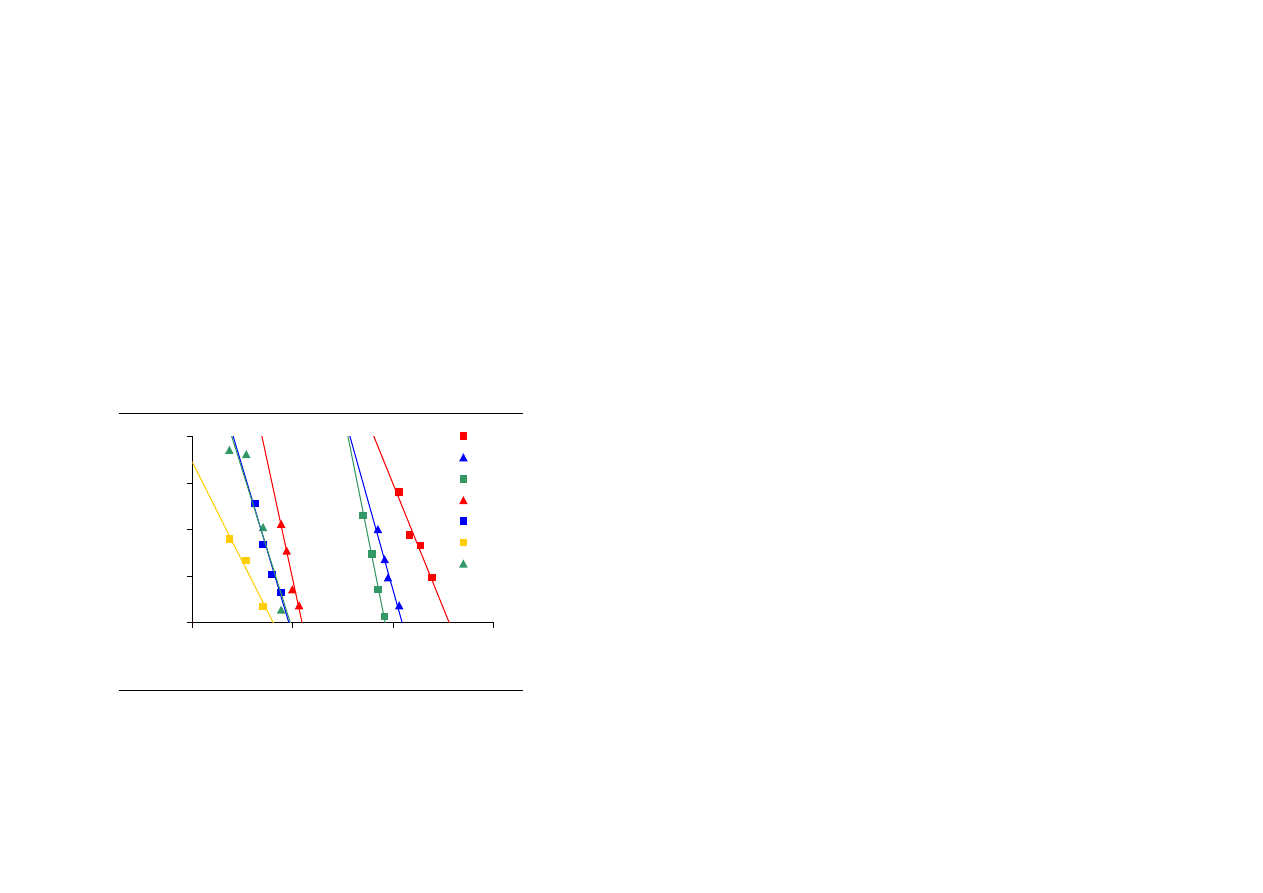
E
a
oszacowano w przypadku frakcji stabilnej enzymu w systemie o zawartości wody 0,029 g H
2
O/g s.s. (S6s). Dwustopniowe szacowanie za
pomocą regresji liniowej dało wynik 178,3 ± 34,9 kJ/mol, a jednostopniowe szacowanie za pomocą regresji nieliniowej – 179,4 ± 18,4 kJ/mol.
Wszystkie wartości energii aktywacji przedstawiono w tabeli 5.5.
Energia aktywacji reakcji inaktywacji cieplnej
α
-amylazy
E
a
w badanych systemach znajdowała się w przedziale od 179,4 ± 18,4 do
497,1 ± 19,6 kJ/mol. Wartość energii aktywacji reakcji inaktywacji jest uzależniona od mechanizmu tego procesu. Otrzymane wartości są
charakterystyczne
dla
energii
aktywacji
denaturacji
białka,
która
znajduje
się
w przedziale 225-500 kJ/mol (Strumiłło i wsp. 1991). Można więc stwierdzić, że inaktywacja enzymu jest skutkiem denaturacji białka
enzymatycznego.
Podobne wartości
E
a
reakcji inaktywacji cieplnej trzech
α
-amylaz pochodzenia bakteryjnego w roztworze wodnym podają Weemaes i wsp.
(1996). Energia aktywacji reakcji
-3,0
-2,0
-1,0
0,0
1,0
0,0025
0,0027
0,0029
0,0031
1/T
ln
k
S1
S2
S3
S4
S5
S6s
S6l
Rys. 5.40. Wykres Arrheniusa –
zależność między stałą szybkości
reakcji inaktywacji k
a temperaturą inaktywacji
α
-amylazy w systemie
S1 (
), S2 (
), S3 (
), S4 (
),
S5 (
), S6s (
), S6l (
)
102

Tabela 5.5. Drugorzędowe parametry kinetyczne inaktywacji
α
-amylazy
w systemach S1 - S6: energia aktywacji reakcji inaktywacji E
a
oraz wartość z, szacowane dwustopniową metodą regresji
liniowej (L) lub jednostopniową metodą regresji nieliniowej (NL)
Energia aktywacji (kJ/mol)
z (
o
C)
L*
NL*
L
NL
S6l
S6s
0,029 g H
2
O/g s.s.
Frakcja
labilna
395,6 (± 11,4)
390,2 (± 29,5)
7,0 (± 0,3)
6.9 (± 0.5)
Frakcja
stabilna 178,3 (± 34,9)
179,4 (± 18,4)
15,7 (± 3,1)
15.6 (± 1.6)
S5
0,060 g H
2
O/g s.s.
300,6 (± 37,6)
306,3 (± 8,2)
9,1 (± 1,1)
8,8 (± 0,2)
S4
0,163 g H
2
O/g s.s.
413,1 (± 62,6)
430,2 (± 22,7)
6,4 (± 1,0)
6,1 (± 0,3)
S3
1,8 g H
2
O/g s.s.
445,4 (± 16,9)
497,1 (± 19,6)
5,3 (± 0,2)
4,7 (± 0,2)
S2
3,5 g H
2
O/g s.s.
319,8 (± 37,4)
296,2 (± 22,3)
7,2 (± 0,8)
7,7 (± 0,6)
S1
Roztwór wodny enzymu bez
dodatku maltodekstryny
220,9 (± 33,7)
221,3 (± 8,0)
10,0 (± 1,5)
9,9 (± 0,3)
* L – regresja liniowa, NL – regresja nieliniowa
inaktywacji
α
-amylazy z
Bacillus subtilis
była równa 234,5 kJ/mol, z
Bacillus amyloliquefaciens
274,1 kJ/mol, a z
Bacillus licheniformis
361,3
kJ/mol.
Wśród wszystkich badanych systemów najmniejszą wartość
E
a
oszacowano w przypadku frakcji stabilnej enzymu w systemie o zawartości
wody 0,029 g H
2
O/g s.s. (S6s). Jednocześnie jest to wartość najbardziej odbiegająca od wartości oszacowanych w pozostałych systemach.
Energia aktywacji w systemach od S1 do S5 oraz S6l wykazuje pewne zróżnicowanie, jednak brak widocznego wyraźnego wpływu zawartości
wody
na
tę
wartość.
Podobną
wartość
E
a
(199,0 ± 6,5) inaktywacji cieplnej
α
-amylazy w systemie o podobnej zawartości wody (0,02 g H
2
O/g s.s.) podaje Sadykow i wsp. (1997).
103

Terebiznik i wsp. (1997), badając stabilność cieplną
α
-amylazy z
Aspergillus oryzae
w roztworze wodnym oraz w systemie o niskiej zawartości wody, również nie stwierdzili istotnego wpływu zawartości wody na energię aktywacji
reakcji inaktywacji. Wartość
E
a
inaktywacji
α
-amylazy w systemie o niskiej zawartości wody równa była 212
±
23 kJ/mol. Według tych autorów,
mimo że usunięcie wody miało znaczący wpływ na zwiększenie stabilności cieplnej enzymu, wartość
E
a
niezależna od zawartości wody wskazuje
na niezmieniony mechanizm inaktywacji. Jednakże autorzy nie podają, jaka była zawartość wody w otrzymanym przez nich systemie ani wartości
E
a
w roztworze wodnym, a więc trudne jest porównanie tych wyników z wynikami prezentowanymi w bieżącej pracy. Jednak, jeśli stwierdzili, że
nie
było
istotnej
różnicy
w
wartości
E
a
oszacowanej
dla
inaktywacji
α
-amylazy
w systemie o niskiej zawartości wody oraz w roztworze wodnym to można przyjąć, że ta ostatnia była zbliżona do wartości 212
±
23 kJ/mol.
Wartość
E
a
reakcji
inaktywacji
α
-amylazy
w roztworze wodnym, jaką oszacowano w bieżącej pracy, była bardzo zbliżona i wynosiła 221,3
±
8,0 kJ/mol.
Wartości energii aktywacji reakcji inaktywacji
α
-amylazy
E
a
, przedstawione w tabeli 5.5, są częściowo zgodne z wartościami
przedstawionymi przez Meerdink i van’t Riet (1991), którzy prezentują energię aktywacji reakcji inaktywacji
α
-amylazy z
Bacillus
licheniformis
.
Przy zawartości wody 1,8 g H
2
O/g s.s. wartość
E
a
,
podawana w cytowanej pracy, wynosi 350 kJ/mol, a przy zawartości wody 0,09 g H
2
O/g s.s.
zmniejsza się do 120 kJ/mol. W bieżącej pracy obserwowano podobny trend obniżenia
E
a
wraz o obniżeniem zawartości wody od 1,8 g H
2
O/g s.s.
Wartość
E
a
oszacowana przy tej zawartości wody, wynosząca 497,1 ± 19,6 kJ/mol zmniejsza się do 179,4 ± 18,4 kJ/mol, lecz zawartość wody,
przy której to następuje, równa 0,029 g H
2
O/g s.s., jest inna niż w pracy cytowanej powyżej. Dodatkowo, obniżenie to zanotowano tylko dla
frakcji stabilnej enzymu.
Adamiec i wsp. (1995), Sadykov i wsp. (1997) oraz Meerdink i vant’Riet (1991) przedstawiają wyniki badań, z których wynika, że istnieje
zależność
między
zawartością
wody
a energią aktywacji reakcji inaktywacji enzymów, jednak podawane zależności są ze sobą sprzeczne. Według Sadykov’a i wsp. (1997)
E
a
reakcji
inaktywacji
α
-amylazy zmniejsza się od 200 kJ/mol do 110 kJ/mol przy zwiększeniu zawartości wody od 0,01 g H
2
O/g s.s. do 3,0 g H
2
O/g s.s.
Według Meerdink i vant’Riet (1991), w podobnym zakresie zawartości wody wartość ta ulega zwiększeniu od 100 do 350 kJ/mol. Adamiec i wsp.
(1995) z kolei podają, że kierunek tej zależności zależy od właściwości enzymu, mając charakter wzrostowy w przypadku fosfatazy alkalicznej, a
104

odwrotny w przypadku lipazy. Niemniej jednak, we wszystkich przypadkach same wartości energii aktywacji reakcji inaktywacji są podobne i w
tym samym przedziale co prezentowane w bieżącej pracy.
5.3.3. Wpływ dodatków stabilizujących na kinetykę inaktywacji cieplnej
α
-amylazy
Substancje dodatkowe, takie jak cukry i alkohole wielowodorotlenowe, stosuje się w celu zwiększenia stabilności cieplnej enzymów
występujących w formie ciekłej. W ostatniej części pracy przeprowadzono badania mające na celu stwierdzenie, czy efekt stabilizujący tych
związków, w przypadku
α
-amylazy, związany jest z liczbą grup hydroksylowych występujących w ich cząsteczkach lub z ogólną liczbą tych grup w
roztworze.
Kinetyka inaktywacji
α
-amylazy w 20 mM roztworze buforowym Bis-Tris oraz w tym roztworze z dodatkami alkoholi wielowodorotlenowych i
cukrów mogła być ściśle opisana modelem czasu śmierci cieplnej. Świadczy o tym linearność zależności log
A
/
A
0
od czasu (na rysunku 5.42
przedstawiono
przykładowy
wykres
kinetyki
inaktywacji
α
-amylazy
w
systemie
z dodatkiem 30 % glicerolu) oraz wysokie współczynniki determinacji R
2
, na poziomie od 0,94 do 0,99, uzyskane po dopasowaniu modelu do
danych eksperymentalnych za pomocą regresji liniowej. Przykładową zależność między czasem inaktywacji a aktywnością
α
-amylazy
w czterech różnych temperaturach w systemie z dodatkiem 30 % glicerolu przedstawiono na rysunku 5.41. Dane eksperymentalne opisywano za
pomocą regresji nieliniowej na podstawie modelu czasu śmierci cieplnej zgodnie z równaniem 4.18. Porównanie danych eksperymentalnych
wszystkich doświadczeń z tej części pracy z wartościami uzyskanymi poprzez dopasowanie modelu za pomocą regresji nieliniowej przedstawiono
na rysunku 5.43. Zgrupowanie punktów wokół linii x=y świadczy o dobrym dopasowaniu zastosowanego modelu.
Czas dziesięciokrotnej redukcji aktywności
α
-amylazy
D
w temperaturze 68°C we wszystkich systemach o różnych zawartościach dodatków
stabilizujących
przedstawiono
w tabeli 5.6. Wyniki wszystkich przeprowadzonych eksperymentów przedstawiono w tabelach 10.24 - 10.34. Zastosowane dodatki we wszystkich
stężeniach spowodowały wydłużenie czasu dziesięciokrotnej redukcji, co świadczy o ich działaniu stabilizującym na enzym. Zauważalne są różnice
w
efektywności
stabilizacji
w
zależności
od
rodzaju
substancji
oraz
jej
stężenia.
W przypadku mannitolu i laktitolu wzrost wartości
D
w stosunku do roztworu buforowego jest niewielki. Zastosowanie sorbitolu, glicerolu i
105
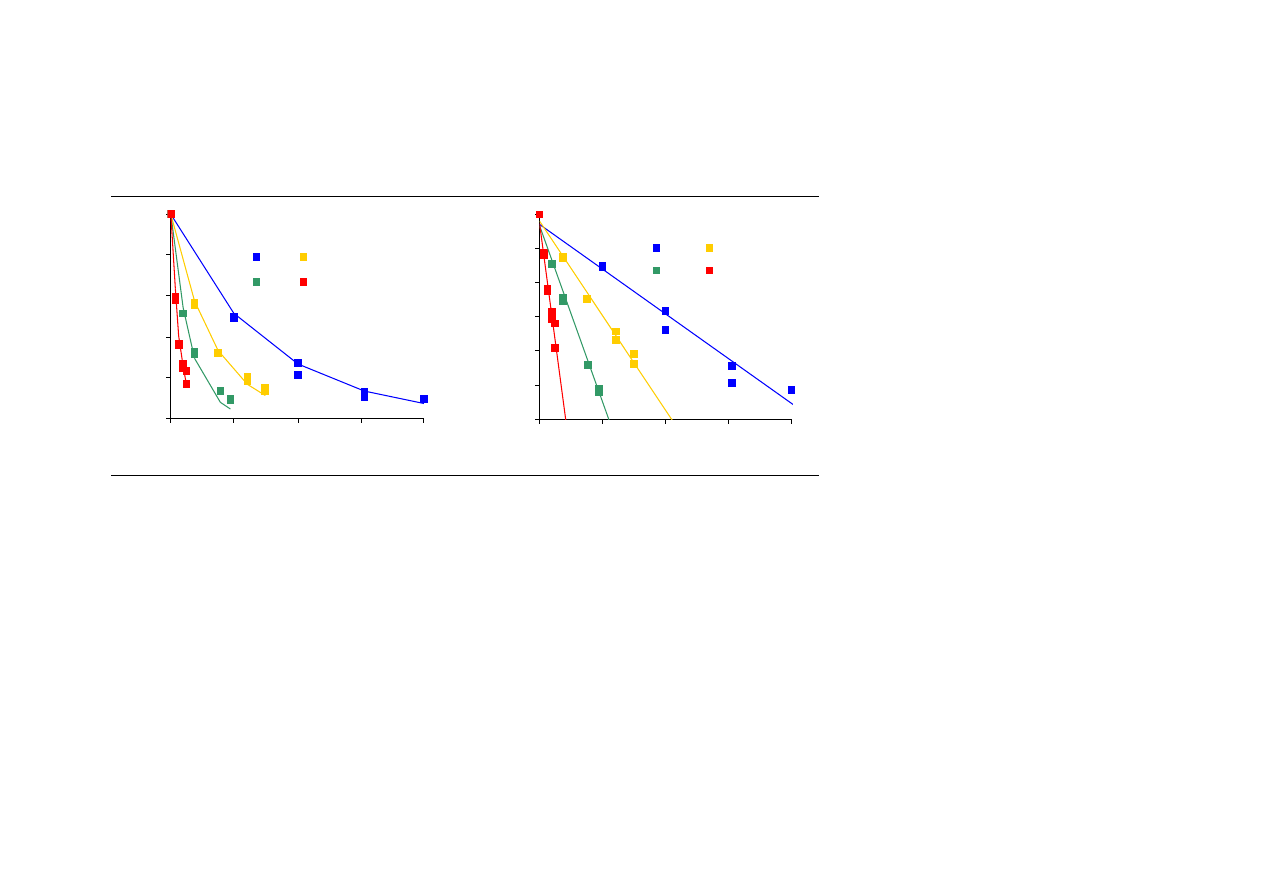
trehalozy, zawłaszcza w wyższych stężeniach, spowodowało większy wzrost stabilności enzymu. Najbardziej skutecznym dodatkiem stabilizującym
okazała się być sacharoza. Zastosowanie 1,2 M roztworu (705 mg/cm
3
) pozwoliło na uzyskanie ponad trzydziestokrotnego wzrostu czasu
dziesięciokrotnej redukcji
0
0,2
0,4
0,6
0,8
1
0
40
80
120
160
Czas (min)
A/
A
0
62,0
64,0
66,0
68,0
Temperatura (
o
C)
-1,2
-1
-0,8
-0,6
-0,4
-0,2
0
0
40
80
120
160
Czas (min)
lo
g
A/
A
0
62,0
64,0
66,0
68,0
Temperatura (
o
C)
Rys. 5.41. Zależność między czasem
inaktywacji a aktywnością względną
α
-amylazy w roztworze buforowym
20 mM Bis-Tris z dodatkiem 30 % (v/v)
glicerolu: dane eksperymentalne
otrzymane w temperaturze 62,0°C (
);
64,0°C (
); 66,0°C (
); 68,0°C (
),
model dopasowany za pomocą regresji
nieliniowej dla temperatury 62,0°C (
);
64,0°C (
); 66,0°C (
)
; 68,0°C (
).
Rys. 5.42. Kinetyka inaktywacji
α
-amylazy w roztworze buforowym
20 mM Bis-Tris z dodatkiem 30 % (v/v)
glicerolu: dane eksperymentalne
otrzymane w temperaturze 62,0°C (
);
64,0°C (
); 66,0°C (
); 68,0°C (
),
model dopasowany za pomocą regresji
liniowej dla temperatury 62,0°C (
)
R
2
=0,96; 64,0°C (
) R
2
=0,99; 66,0°C
(
)
R
2
=0,99; 68,0°C (
) R
2
=0,96.
106
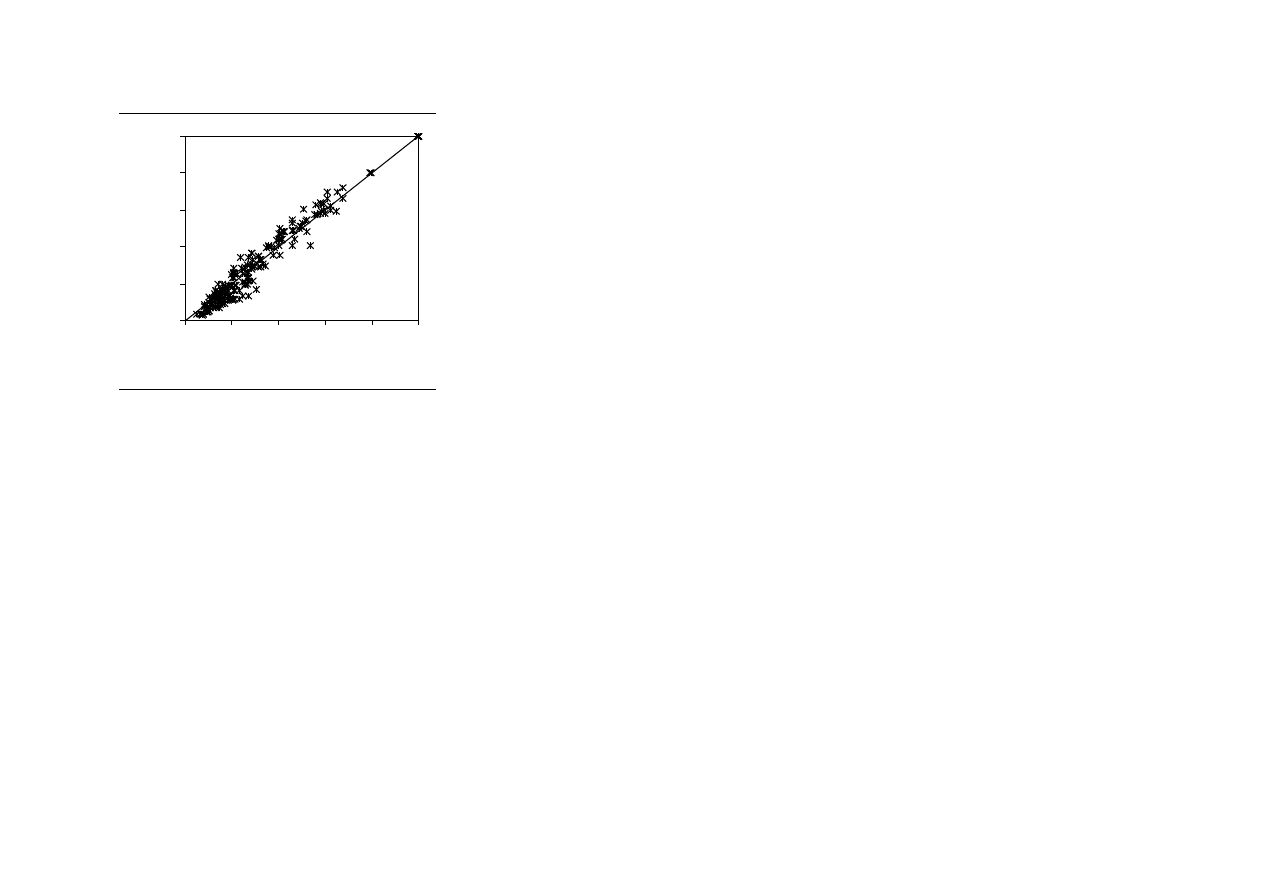
0
0,2
0,4
0,6
0,8
1
0
0,2
0,4
0,6
0,8
1
A/A
0
(exp)
A/
A
0
(
p
re
d
)
5.43. Porównanie danych
eksperymentalnych inaktywacji
α
-amylazy we wszystkich systemach
z dodatkami stabilizującymi (exp)
z wartościami uzyskanymi poprzez
dopasowanie modelu za pomocą regresji
nieliniowej (pred).
w porównaniu z roztworem buforowym bez żadnych dodatków. Na podstawie uzyskanych wyników można następująco uszeregować zastosowane
substancje na podstawie ich wzrastających właściwości ochronnych: mannitol < laktitol < sorbitol< glicerol < trehaloza < sacharoza.
Zastosowane cukrów było bardziej korzystne niż alkoholi wielowodorotlenowych.
Tabela 5.6. Czas dziesięciokrotnej redukcji D inaktywacji cieplnej
α
-amylazy
w temperaturze 68°C w 20 mM roztworze buforowym Bis-Tris oraz z dodatkiem substancji stabilizujących.
107

Liczba
grup
OH/cm
3
*
Roztwór
buforowy
20 mM Bis-
Tris, pH 7,0
Roztwór buforowy 20 mM Bis-Tris, pH 7,0 z dodatkiem:
mannitolu laktitolu
sorbitolu
glicerolu
trehalozy sacharozy
D (min) w temperaturze
68°C
0
2,4 ± 0,2
0,198 x 10
22
3,1 ± 0,2
3,8 ± 0,2
5,3 ± 0,5
5,4 ± 0,7 10,2 ± 0,4
0,281 x 10
22
7,5 ± 0,5 14,2 ± 0,4
0,314 x 10
22
4,2 ± 0,3
6,9 ± 0,4
0,396 x 10
22
4,5 ± 0,2
0,595 x 10
22
7,9 ± 0,4
11,4 ± 1,0 15,4 ± 0,9 81,3 ± 1,5
0,725 x 10
22
14,5 ± 1,2
0,992 x 10
22
13,2 ± 0,7 33,7 ± 1,8 47,4 ± 4,1
* Stężenia roztworów o różnych zawartościach grup OH podano w tabeli 4.4
Sacharoza wykazała również najlepsze właściwości ochronne w pracy przedstawionej przez Busto i wsp. (1999). Zastosowanie od 1 do 2 M
roztworu zwiększyło stabilność lipoksygenazy w temperaturze 70°C o 400-600 %. Dodatek alkoholi wielowodorotlenowych jak mannitol, sorbitol i
glicerol był mniej korzystny lub wcale nie miał wpływu na stabilność cieplną enzymu.
Pozytywny wpływ zastosowanych dodatków na odporność cieplną
α
-amylazy zwiększał się wraz ze wzrostem ich stężenia. Zwiększenie to, w
badanym zakresie stężeń, miało charakter wykładniczy o współczynniku korelacji R
2
od 0,97 do 0,99. Wpływ stężenia dodatków stabilizujących na
czas dziesięciokrotnej redukcji
D
w temperaturze 68°C przedstawiono na rysunku 5.44. Podobną zależność, między stężeniem sorbitolu a
„efektem ochronnym” wywieranym na
α
-amylazę z
Aspergillus oryzae
, podali wcześniej Graber i Combes (1989). „Efekt ochronny” definiowano
jako stosunek czasu potrzebnego do zmniejszenia aktywności enzymu o połowę w obecności dodatku stabilizującego i czasu potrzebnego do
zmniejszenia aktywności enzymu o połowę bez obecności tego dodatku w roztworze buforowym. Wielkość ta, wynosząca 200 w 2,5 M roztworze
sorbitolu, uległa zwiększeniu nawet do 2000, gdy stężenie sorbitolu zwiększono do 4 M.
108
Jeśli przyjąć, że mechanizm stabilizacji enzymu w obecności alkoholi wielowodorotlenowych i cukrów związany jest z hydratacją
preferencyjną białka, jak opisano
0
20
40
60
80
0
1
2
3
4
5
6
Stężenie substancji dodatkowej (M)
D
6
8
°C
(
m
in
)
Sorbitol
Glicerol
Trehaloza
Sacharoza
Rys. 5.44. Wpływ stężenia (M)
sorbitolu (
) R
2
=0,97, glicerolu
(
) R
2
=0,98; trehalozy (
)
R
2
=0,99 i sacharozy (
) R
2
=0,99
na czas dziesięciokrotnej redukcji
D (min) w temperaturze 68°C.
w rozdziale 2.4.2.1, to można zauważyć, że cukry, dla których źródłem wykluczenia z obszaru białka jest wzrost napięcia powierzchniowego,
wykazywały lepsze właściwości ochronne niż alkohole wielowodorotlenowe, których wykluczanie związane jest z interakcjami o naturze
chemicznej. Poza wpływem na budowę całego systemu, w którym rozpuszczone jest białko
i substancja dodatkowa, źródłem działania ochronnego zastosowanych dodatków mogą być ich potencjalne oddziaływania z samą cząsteczką
białka. Wykazano, że alkohole wielowodorotlenowe mają podobieństwo do grup polarnych białka i są nawet opisane jako inhibitory
współzawodniczące
α
-amylazy,
mogą
więc
wchodzić
w
bezpośrednie
interakcje
z centrum aktywnym enzymu (Timasheff 1993, Timasheff i Arakawa 1989, Graber i Combes 1989). Oddziaływania te, zwiększając „sztywność”
cząsteczki enzymu, powodują zwiększenie jej odporności na zmiany strukturalne prowadzące do denaturacji i inaktywacji. Jednakże bezpośrednie
oddziaływania z łańcuchami polipeptydowymi mogą być też niekorzystne, ponieważ mogą prowadzić do stabilizacji nieaktywnej enzymatycznie
struktury rozwiniętej białka. Mimo, że „co-solvent” jest wykluczony z bezpośredniego sąsiedztwa cząsteczki białka, nieliczne cząsteczki mogą
109

migrować poprzez warstwę hydratacyjną w okolice rozwiniętych łańcuchów polipeptydowych i, poprzez oddziaływania z wyeksponowanymi
regionami niepolarnymi białka, wpływać na zwiększenie stabilności rozwiniętej struktury oraz uniemożliwiać jej ewentualny powrót do aktywnej
struktury natywnej (Timasheff 1993).
Wielu autorów rozważa wpływ ilości grup OH na stabilność cieplną enzymów. Sugeruje się, że efekt stabilizujący alkoholi
wielowodorotlenowych i cukrów związany jest z liczbą grup OH w cząsteczce danej substancji (Busto i wsp. 1999, Graber i Combes 1989) lub z
ogólną liczbą grup OH w danym roztworze (Noel i Combes 2003, Guiavarc’h i wsp. 2003).
Na podstawie pierwszej z cytowanych hipotez (liczba grup OH w cząsteczce substancji stabilizującej) należałoby spodziewać się następującego
uszeregowania substancji zastosowanych w bieżącej pracy pod względem ich wzrastającego wpływu ochronnego: glicerol (3*OH) < mannitol,
sorbitol, (6*OH) < trehaloza, sacharoza (8*OH) < laktitol (9*OH). Jednakże, otrzymane wyniki nie potwierdzają powyższej hipotezy. Laktitol,
który ma największą liczbę grup OH w cząsteczce spośród zastosowanych substancji, wykazał mniejszy wpływ na czas dziesięciokrotnej redukcji
D
niż inne związki. Również efekt ochronny substancji o tej samej liczbie grup OH w cząsteczce (sacharoza, trehaloza) był zróżnicowany.
Jeżeli chodzi o drugą z cytowanych hipotez (wpływ ogólnej liczby grup OH w danym roztworze), to w tabeli 5.6 przedstawiono czas
dziesięciokrotnej redukcji
D
uzyskany po zastosowaniu różnych stężeń dodatków, w odniesieniu do ogólnej liczby grup OH w danym roztworze.
Można zauważyć, że w systemach o tej samej zawartości grup OH wartość
D
różniła się w zależności od źródła tych grup. Przykładowo, przy
zawartości
grup
OH
w
1 cm
3
równej
0,595·10
22
wartość
D
wynosiła 7,9 ± 0,4 min, gdy dodatkiem stabilizującym był sorbitol, 11,4 ± 1,0 min w obecności glicerolu, 15,4 ± 0,9 min w
przypadku trehalozy, a po zastosowaniu sacharozy wartość ta wyniosła nawet 81,3 ± 1,5 min. Zależność między liczbą grup OH w danym
roztworze a otrzymaną wartością
D
w temperaturze 68°C przedstawiono na rysunku 5.45.
110
0
20
40
60
80
0
0,2
0,4
0,6
0,8
1
Liczba grup OH * 10
22
D
6
8
°C
(
m
in
)
Sorbitol
Glicerol
Trehaloza
Sacharoza
Rys. 5.45. Wpływ liczby grup OH
zapewnionych przez sorbitol (
)
R
2
=0,98, glicerol (
) R
2
=0,98;
trehalozę (
) R
2
=0,99
i sacharozę (
) R
2
=0,99 na czas
dziesięciokrotnej redukcji D (min)
w temperaturze 68°C
Jego analiza potwierdza, że ogólna liczba grup OH w danym roztworze nie jest czynnikiem decydującym o stabilności cieplnej
α
-amylazy.
Bardziej istotny jest rodzaj zastosowanej substancji. Dla każdej substancji rozpatrywanej oddzielnie istnieje ścisła zależność między liczbą grup OH
a efektem ochronnym, lecz ma to związek ze zwiększeniem stężenia roztworów. Istnienie zależności między ogólną liczbą grup OH w roztworze
a otrzymaną wartością
D
podczas badania wpływu substancji dodatkowych (takich samych jak w bieżącej pracy) na kinetykę inaktywacji cieplnej
pektynoesterazy
(PME)
wyekstrahowanej
z pomidorów, stwierdzili Guiavarc’h i wsp. (2003). Ogólna liczba grup OH w roztworach była związana z ich efektem ochronnym, bez względu na
rodzaj substancji zapewniającej źródło grup OH. Autorzy stwierdzili, że stabilność cieplna PME może być przewidywana na podstawie znajomości
liczby grup OH w danym systemie
W tabeli 5.7 przedstawiono drugorzędowe parametry kinetyczne inaktywacji
α
-amylazy (wartość
z
i
E
a
) w 20 mM roztworze buforowym Bis-
Tris oraz z dodatkami substancji stabilizujących. Wartości
z
znajdują się w przedziale wielkości charakterystycznych dla inaktywacji
α
-amylazy.
Energia aktywacji reakcji inaktywacji przyjmuje wartości charakterystyczne dla energii aktywacji denaturacji białka. Zarówno wartość
z
jak
E
a
111
wykazują pewne zróżnicowanie w zależności od zastosowanych dodatków, brak jednak zależności między tymi wartościami a liczbą grup OH w
roztworach.
De Cordt i wsp. (1994), badając kinetykę inaktywacji
α
-amylazy z
Bacillus amyloliquefaciens
w roztworze buforowym oraz z dodatkiem
glicerolu (35,1 %), zaobserwowali zmniejszenie wartości z z 7,36°C do 6,46°C po zastosowaniu dodatku glicerolu. Gdy porówna się wartości
uzyskane w bieżącej pracy, również widoczne jest zmniejszenie tej wartości po zastosowaniu glicerolu (5,8 ± 0,1°C) w stosunku do roztworu
buforowego (7,8 ± 0,4°C).
Tabela 5.7. Drugorzędowe parametry kinetyczne inaktywacji
α
-amylazy
w 20 mM roztworze buforowym Bis-Tris oraz z dodatkami substancji stabilizują-cych: energia aktywacji reakcji inaktywacji
E
a
oraz wartość z, szacowane dwustopniową metodą regresji liniowej (L) lub jednostopniową metodą regresji nieliniowej
(NL).
Roztwór
buforowy
20 mM Bis-
Tris, pH 7,0
Roztwór buforowy 20 mM Bis-Tris, pH 7,0 z dodatkiem:
100 mg/cm
3
mannitolu
200 mg/cm
3
laktitolu
300 mg/cm
3
sorbitolu
30 % (v/v)
glicerolu
200 mg/cm
3
trehalozy
200 mg/cm
3
sacharozy
z (°C)
L*
8,1 ± 0,9
7,5 ± 0,9
5,4 ± 0,3
6,0 ± 0,4
6,1 ± 0,5
8,1 ± 1,0
5,7 ± 0,7
NL*
7,8 ± 0,4
7,6 ± 0,3
4,9 ± 0,1
6,3 ± 0,2
5,8 ± 0,1
7,9 ± 0,3
5,4 ± 0,2
E
a
(kJ/mol)
L
245,1 ± 26,5 289,7 ± 41,2 407,2 ± 26,4 369,7 ± 26,8 364,3 ± 25,8 277,4 ± 15,9 386,2 ± 44,9
NL
280,7 ± 13,8 277,0 ± 11,8 446,3 ±12,2 349,2 ± 9,8
378,9 ± 8,1 277,0 ± 11,8 401,5 ± 12,5
* L – regresja liniowa, NL – regresja nieliniowa
5.3.4. Podsumowanie
Kinetyka inaktywacji cieplnej preparatu
α
-amylazy z
Aspergillus oryzae
w prawie wszystkich środowiskach, w których badano przebieg tego
procesu (o różnej zawartości wody oraz w obecności dodatków stabilizujących) mogła być ściśle opisana równaniem reakcji pierwszego rzędu oraz
112

za pomocą modelu czasu śmierci cieplnej. Wyjątkiem była kinetyka inaktywacji
α
-amylazy w systemie o najniższej z zastosowanych zawartości
wody równej 0,029 g H
2
O/g s.s., kiedy to stosowano model „biphasic”. Model ten zakłada istnienie dwóch frakcji enzymu o różnej stabilności
cieplnej. Wpływ temperatury na stałą szybkości reakcji inaktywacji cieplnej enzymu, we wszystkich zastosowanych systemach, był opisywany
równaniem Arrheniusa.
Stwierdzono, że zarówno obniżanie zawartości wody jak i zastosowanie substancji dodatkowych, takich jak alkohole wielowodorotlenowe i
dwucukry, wpłynęło na zwiększenie stabilności cieplnej
α
-amylazy. Temperaturę, w której badano kinetykę inaktywacji cieplnej zwiększono około
dwukrotnie (z 60 do 115°C) po zmniejszeniu zawartości wody z systemu stanowiącego roztwór wodny enzymu do systemu o zawartości wody
0,029 g H
2
O/g s.s. Zwiększanie stabilności enzymów w środowisku o niskiej zawartości wody jest spowodowane głównie ograniczoną ruchliwością
cząstek i niemożliwością zachodzenia niekorzystnych zmian strukturalnych prowadzących do denaturacji. W przypadku obecności maltodekstryny
możliwe jest także bezpośrednie oddziaływanie tego związku z centrum aktywnym enzymu, wpływające na usztywnienie jego struktury. Istnienie
dwóch
frakcji
enzymu
o
różnej
stabilności
cieplnej,
w systemie o najniższej zawartości wody, może być związane z występowaniem maltodekstryny w stanie szklistym i częściowym
unieruchomieniem enzymu w materii o wysokiej lepkości.
Wszystkie zastosowane alkohole wielowodorotlenowe oraz dwucukry wpływały na zwiększenie stabilności cieplnej
α
-amylazy. Najbardziej
korzystnie wpływała sacharoza, której dodatek w stężeniu 1,2 M zwiększył czas dziesięciokrotnej redukcji
D
ponad trzydziestokrotnie
w stosunku do wartości
D
w roztworze buforowym.
Zastosowanie substancji dodatkowych, w celu obniżenia degradacji materiałów w czasie suszenia, jest często stosowane w przypadku
liofilizacji. Związki te, nazywane w tym przypadku substancjami ochronnymi, zmniejszają występowanie niekorzystnych przemian (podczas
zamrażania i suszenia) obniżających jakość suszonych preparatów. Mogą być dodawane zarówno do podłoża hodowlanego jak i bezpośrednio
przed procesem zamrażania. Do najczęściej stosowanych substancji ochronnych należą: sacharoza, trehaloza, glicerol, związki zawierające jony
wapnia, NH
4
Cl (Witrowa-Rajchert i Samborska 2002). Pozytywny wpływ zastosowanych w niniejszej pracy dodatków na stabilność cieplną
α
-
amylazy wskazuje na potencjalną możliwość zastosowania tych substancji jako dodatków ochronnych również
113

w czasie suszenia rozpyłowego. Wstępne wyniki przeprowadzonych badań (wyniki dotychczas niepublikowane i niebędące częścią poniższej pracy)
potwierdzają tę hipotezę.
114

Wnioski
6. WNIOSKI
1. Suszenie rozpyłowe jest odpowiednią metodą suszenia preparatu
α
-amylazy z
Aspergillus
oryzae
, za pomocą której, pod warunkiem zastosowania odpowiednich parametrów
procesu, możliwe jest otrzymanie preparatu enzymatycznego o wysokiej aktywności.
2. Głównym czynnikiem wpływającym na końcową aktywność
α
-amylazy po suszeniu
rozpyłowym, w badanym zakresie parametrów procesu, jest zawartość wody w suszu.
W celu maksymalnego zachowania aktywności tego enzymu po suszeniu wartość ta
powinna być jak najbardziej zbliżona do tzw. optymalnej zawartości wody. Zarówno
zmniejszanie jak i zwiększanie zawartości wody w suszu poniżej lub powyżej optymalnej
zawartości wody prowadzi do obniżenia aktywności
α
-amylazy. Optymalna zawartość
wody po suszeniu dla badanego preparatu
α
-amylazy i badanego zakresu parametrów
procesu znajduje się w przedziale 0,07 – 0,09 g H
2
O/g s.s.
3. Zastosowanie parametrów suszenia prowadzących do otrzymania suszu o optymalnej
zawartości wody jest również korzystne ze względu na ekonomiczność prowadzonego
procesu suszenia. Właściwe zużycie powietrza i właściwe zużycie ciepła zanotowane
w czasie suszenia z zastosowaniem tych parametrów charakteryzowało się najmniejszymi
wartościami.
4. Głównym parametrem wpływającym na końcową zawartość wody w suszu, a więc
i na aktywność
α
-amylazy, jest temperatura powietrza wylotowego w czasie suszenia.
Wartość ta może być regulowana poprzez zmianę temperatury powietrza wlotowego
i strumienia surowca. Im większy strumień surowca, przy stałej temperaturze powietrza
wlotowego, tym niższa temperatura powietrza wylotowego i tym wyższa zawartość wody
w suszach.
5. Zbyt intensywne suszenie, np. prowadzone przy niskiej wartości strumienia surowca
(rozpylenie roztworu na mniejsze kropelki), powoduje zwiększoną degradację enzymu,
wynikającą prawdopodobnie z naruszania wody strukturalnej stabilizującej cząsteczkę
białka lub z destrukcji termicznej materiału.
6. Kinetyka inaktywacji cieplnej
α
-amylazy w systemach o różnej zawartości wody oraz
z dodatkami substancji stabilizujących może być opisana równaniem reakcji pierwszego
rzędu i modelem czasu śmierci cieplnej. Wyjątkiem jest system o najniższej zawartości
wody 0,029 g H
2
O/g s.s., w którym enzym podlega inaktywacji zgodnie z modelem
109

Wnioski
„biphasic”, zakładającym istnienie dwóch frakcji enzymu o różnej stabilności cieplnej.
Powodem występowania dwóch frakcji enzymu może być unieruchomienie części enzymu
w stanie szklistym utworzonym przez maltodekstrynę.
7. Wpływ temperatury na kinetykę inaktywacji cieplnej
α
-amylazy może być opisywany
równaniem Arrheniusa. Otrzymane wartości energii aktywacji reakcji inaktywacji wskazują
na to, że inaktywacja cieplna
α
-amylazy w systemach o różnej zawartości wody oraz
z dodatkami substancji stabilizujących jest spowodowana denaturacją białka
enzymatycznego.
8. Enzym
α
-amylaza charakteryzuje się zwiększającą się stabilnością cieplną w
warunkach
o zmniejszającej się zawartości wody. Może być to związane z ograniczaniem
ruchliwości cząstek redukującym możliwość zachodzenia zmian strukturalnych
prowadzących do denaturacji, substytuowaniem cząsteczek wody niezbędnych do
utrzymania natywnej struktury białka przez sacharydy pochodzące z
maltodekstryny lub bezpośrednim oddziaływaniem maltodekstryny jako substratu
α
-amylazy z centrum aktywnym enzymu, co prowadzi do zwiększenia sztywności
cząsteczki białka.
9. Stabilność cieplna
α
-amylazy zwiększa się w obecności zastosowanych dodatków
stabilizujących. Efekt stabilizujący nie zależy od liczby grup hydroksylowych w
cząsteczce zastosowanego związku ani od ogólnej ilości tych grup w roztworze,
lecz
od
rodzaju
i stężenia substancji dodatkowej, wykazując znacznie większy wpływ na stabilność
α
-amylazy w przypadku dwucukrów niż w przypadku alkoholi
wielowodorotlenowych. Najlepszymi właściwościami ochronnymi charakteryzuje się
sacharoza.
110

Streszczenie
7. STRESZCZENIE
Celem pracy było określenie możliwości zastosowania suszenia rozpyłowego do suszenia
płynnego preparatu
α
-amylazy pochodzenia pleśniowego (
Aspergillus oryzae
) oraz zbadanie
wpływu takich parametrów suszenia rozpyłowego jak strumień surowca oraz temperatura
powietrza suszącego na przebieg tego procesu oraz końcową aktywność enzymu. Ponadto
zakres pracy obejmował wykonanie badań mających na celu określenie wpływu zawartości
wody oraz obecności dodatków stabilizujących (alkoholi wielowodorotlenowych i dwucukrów)
na kinetykę inaktywacji cieplnej
α
-amylazy.
Przebieg suszenia był ściśle uzależniony od zmian badanych parametrów: temperatury
powietrza wlotowego oraz strumienia surowca. Suszenie przy niższych strumieniach surowca
prowadziło do uzyskania proszków o niższej zawartości wody, co wynikało z różnic
w temperaturze wylotowej powietrza. Zmniejszanie strumienia surowca powodowało
zmniejszenie ilości wody odparowywanej w jednostce czasu, w rezultacie czego temperatura
powietrza wylotowego była wyższa niż przy zastosowaniu wyższych strumieni surowca.
Zwiększenie temperatury powietrza wylotowego powodowało lepsze wysuszenie cząstek.
Podwyższanie temperatury powietrza wlotowego, przy danym strumieniu surowca,
powodowało zwiększenie temperatury powietrza wylotowego oraz zmniejszenie zawartości
wody w suszach.
Aktywność względna
α
-amylazy w otrzymanych suszach wahała się od 56,7 do 90,1 %.
Stwierdzono, że głównym parametrem decydującym o końcowej aktywności względnej
suszonej
α
-amylazy jest końcowa zawartość wody w suszu. Szybkie odparowanie wody, jakie
następuje w czasie suszenia rozpyłowego, jest korzystne ze względu na zwiększanie się
odporności enzymu na podwyższona temperaturę, jednak nie może ono prowadzić do zbyt
dużego stopnia wysuszenia, prowadzącego prawdopodobnie naruszenie struktury białka
w wyniku usuwania wody strukturalnej. Zawartość wody gwarantująca uzyskanie maksymalnej
aktywności względnej
α
-amylazy w suszu, gdy nie występuje jeszcze niekorzystny wpływ
dehydracji związany z niszczeniem struktury białka, nazwana została optymalną zawartością
wody w preparacie enzymatycznym. Stwierdzono, że w celu otrzymania suszu o wysokiej
aktywności względnej
α
-amylazy, warunki suszenia należy dobrać tak, aby końcowa zawartość
wody kształtowała się na poziomie wartości optymalnej 0,07 – 0,09 g H
2
O/g s.s. Aby otrzymać
susz o tej zawartości wody temperatura powietrza wylotowego powinna wynosić 70-80
°
C.
Zastosowanie parametrów suszenia prowadzących do otrzymania suszu o optymalnej
zawartości wody jest również korzystne ze względu na ekonomiczność prowadzonego procesu
111

Streszczenie
suszenia. Właściwe zużycie powietrza i ciepła zanotowane w czasie suszenia z zastosowaniem
tych parametrów charakteryzowało się najmniejszymi wartościami.
Kinetykę inaktywacji
α
-amylazy w systemach o zmniejszającej się zawartości wody oraz
zawierających substancje stabilizujące opisywano równaniem reakcji pierwszego rzędu
i modelem czasu śmierci cieplnej. Jedynie kinetyka inaktywacji w systemie o najniższej
zawartości wody 0,029 g H
2
O/g s.s. opisywana była modelem „biphasic”, zakładającym
istnienie dwóch frakcji enzymu o różnej stabilności cieplnej.
Stwierdzono znaczne zwiększanie stabilności cieplnej
α
-amylazy wraz z obniżaniem
zawartości wody, co prawdopodobnie było wynikiem zmniejszenia możliwości zachodzenia
zmian konformacyjnych prowadzących do denaturacji w rezultacie ograniczania ruchliwości
cząsteczek. Inną możliwą przyczyną stabilizacji enzymu mógł być wpływ węglowodanów
polegający na zastępowaniu w cząsteczce białka enzymatycznego cząsteczek wody
niezbędnych do utrzymania natywnej struktury białka.
Istnienie dwóch frakcji enzymu o różnej stabilności cieplnej w systemie o najniższej
zawartości wody powiązano z możliwością występowania maltodekstryny w stanie szklistym,
ponieważ zakres temperatur stosowanych podczas badania kinetyki inaktywacji cieplnej był
niższy od temperatury przemiany szklistej maltodekstryny przy tej zawartości wody. Stabilna
frakcja enzymu unieruchomiona prawdopodobnie w stanie szklistym charakteryzowała się
mniejszą stałą szybkości reakcji inaktywacji niż frakcja labilna znajdująca się w częściowo
uplastycznionych regionach polimeru (lub w regionach stanu szklistego charakteryzujących się
większą mobilnością cząsteczek).
Wyniki drugiej części pracy, dotyczącej kinetyki inaktywacji
α
-amylazy w systemach
o różnej zawartości wody, były pomocne w wytłumaczeniu korzystnego wpływu suszenia
rozpyłowego na zachowanie aktywności enzymu. Ten rodzaj suszenia pozwala na otrzymanie
preparatu enzymatycznego o wysokiej aktywności, ponieważ w czasie szybkiego odparowania
wody następuje równocześnie szybki wzrost odporności
α
-amylazy na podwyższoną
temperaturę, a czas działania podwyższonej temperatury na enzym o niskiej odporności
cieplnej (w środowisku o wysokiej zawartości wody) jest bardzo krótki. Jednocześnie
stwierdzono, że intensyfikacja procesu suszenia pozwala na zwiększenie aktywności względnej
enzymu, tylko jeśli proces jest prowadzony do otrzymania pewnej granicznej zawartości wody.
Dalsze zwiększanie intensywności procesu, prowadzące do dalszego obniżania zawartości
wody, nie wpływa korzystnie na zachowanie aktywności enzymu.
Zastosowanie substancji dodatkowych, takich jak alkohole wielowodorotlenowe
i dwucukry, wpłynęło na zwiększenie stabilności cieplnej
α
-amylazy. Pozytywny wpływ
zastosowanych dodatków na odporność cieplną
α
-amylazy zwiększał się wraz ze wzrostem ich
112

Streszczenie
stężenia, a zwiększenie to miało charakter wykładniczy. Otrzymane wyniki nie potwierdziły
hipotez o wpływie ilości grup OH w cząsteczce substancji dodatkowej (lub całkowitej liczbie
grup OH w jednostce roztworu) na stabilność cieplną
α
-amylazy. Wykazano, że większy wpływ
miało stężenie i rodzaj zastosowanej substancji. W przypadku mannitolu i laktitolu wzrost
wartości
D
w stosunku do roztworu buforowego był niewielki. Zastosowanie sorbitolu, glicerolu
i trehalozy, zawłaszcza w wyższych stężeniach, spowodowało większy wzrost stabilności
enzymu, a najbardziej skutecznym dodatkiem stabilizującym okazała się być sacharoza.
Pozytywny wpływ zastosowanych dodatków na stabilność cieplną
α
-amylazy wskazuje na
potencjalną możliwość zastosowania tych substancji jako dodatków ochronnych w czasie
suszenia rozpyłowego. Wstępne wyniki przeprowadzonych badań (wyniki dotychczas
niepublikowane i niebędące częścią pracy) potwierdzają tę hipotezę.
113


Abstract
8. ABSTRACT
Dry solid formulations are often developed to provide an acceptable protein and enzymes
shelf life. Spray-drying is the most common method for drying of liquids. It is widely used in
a dairy and pharmaceutical industry for dehydration of various substances, such as: milk,
whey, antibiotics, vitamins, enzymes. The main advantage of this method is the fact that it
enables to transfer a solution, suspension or emulsion into a powder in one-step process. The
drying performs with a high efficiency and is far less expensive than freeze drying. During
drying droplets come immediately in a contact with a flow of hot drying medium, usually air.
Because of the rapid water evaporation the temperature of droplets is maintained low. The
cooling effect of evaporation on the droplets is observed. Due to a short drying time and
a relatively low product temperature, spray-drying can be successfully used for drying of
extremely heat-sensitive materials.
The objective of this work was to investigate the effect of spray drying conditions on the
activity of
Aspergillus oryzae
α
-amylase and the process development. Several experiments
were performed to determine the influence of following variables: feed ratio speed, inlet and
outlet drying air temperature. Fungal
α
-amylase was dissolved in a maltodextrin solution and
spray-dried in a laboratory drier. Water concentration and residual enzyme activity were
determined in obtained powders as a function of the drying conditions. It was found that both
temperature and feed ratio speed affected the retention of the enzyme activity after drying.
The relative enzyme activity in obtained powders ranged from 56.7 to 90.1 %, depending on
process parameters. Water content was the main factor which affected the final relative
enzyme activity. Fast evaporation during spray drying allows to obtain an active dry enzyme
preparation, cause
α
-amylase is characterised by an increased thermal stability at low moisture
content conditions. However, rapid drying should not lead to protein damage, which can occur
as a result of evaporation of water essential for protein stability maintenance. The final water
content which ensures to obtain maximum relative activity of the enzyme in dry state, when
the protein destruction due to water evaporation is not observed, can be called optimum water
content in dry
α
-amylase preparation. It was found that this optimum water content ranged
from 0.07 – 0.09 g H
2
O/g db. In order to obtain powders of this water content higher value of
feed ratio speed (1.3 or 1.7 cm
3
/s) should be used, and low outlet air temperature
(70 – 80
°
C) should be kept during spray drying.
The thermal stability of
α
-amylase in systems of different moisture content was also
investigated. To obtain systems of reduced moisture content the enzyme was freeze-dried with
111

Abstract
addition of maltodextrin and equilibrated above saturated salt solutions. Other systems applied
were aqueous solutions of maltodextrin.
The thermal inactivation kinetics could be accurately described by a first order model in
all systems studied except the system of moisture content of 0.029 g H
2
O/g db, which showed
a biphasic inactivation pattern. Heat stability of the enzyme significantly increased in systems
at reduced moisture content. In all subsequent systems of reduced moisture content the heat
stability of the enzyme was increased, and reached maximum stability at the lowest moisture
content of 0.029 g H
2
O/g db. At this moisture content the existence of two enzyme fractions
was suggested, a heat labile and a heat stable fraction. A possible explanation for this
observation is glass forming properties of maltodextrin and its influence on enzyme stability.
The results of this part of work, dealing with
α
-amylase heat stability at different water
content conditions, were useful while explaining the enzyme behaviour during spray drying
process. This drying method allows to obtain highly active enzyme preparation cause during
rapid drying the heat stability of
α
-amylase increases as a result of rapid water content
reduction. Moreover, the contact time of dried enzyme material of low heat stability (material
of high water content) with hot drying medium is very short. Although fast drying leads to high
active enzymatic material, the drying ratio can not be too high. If the drying ratio is too high
and the final water content is lower than optimal, the protein degradation and enzyme activity
deterioration is observed.
The effect of sugars (disaccharides) and polyols on
α
-amylase thermal stability was
investigated. The largest protective effect was obtained with addition of sucrose. The influence
of trehalose and polyols on the enzyme heat stability was also positive, but less pronounced
than with sucrose. The protective effect was strongly related to the concentration of the
protective compound, following an exponential function. The number of hydroxyl groups per
molecule and the total amount of hydroxyl groups provided by additives to the system (
n
OH),
were not correlated with the heat stability of
α
-amylase. The source of OH groups was found
to be more important, sugars (especially sucrose) being more effective than polyols for similar
number of
n
OH values. The positive effect of applied substances on
α
-amylase heat stability
indicates that they could be used as protective additions during spray drying. The results of
carried research (not published yet, and not being a part of the current work) confirm this
hypothesis.
112


Spis literatury
9. SPIS LITERATURY
10. Achremowicz B, Wójcik W. 2000. Enzymy amylolityczne i inne hydrolazy O-glikozydowe.
Wydawnictwo Akademii Rolniczej w Lublinie, Lublin.
11. Acker LW. 1969. The practical approach to better low-moisture foods – water activity and
enzyme activity. Food Technol., 23, 1257-1270.
12. Adamiec J, Kamiński W, Markowski AS, Strumiłło C. 1995. Drying of biotechnological
products. In: Handbook of Industrial Drying (ed. AS Mujumdar). Marcel Deker Inc., New
York, vol. 2, 775-808.
13. Barrow GM. 1973. Chemia fizyczna. Państwowe Wydawnictwo Naukowe, Warszawa.
14. Bednarski W. 1997. Stan obecny i perspektywy biotechnologii żywności. Przem. Spoż.,
51(2), 29-32.
15. Belghith H, Chaabouni SE, Gargouri CA. 2001. Stabilisation of
Penicilium occitanis
cellulases by spray drying in presence of maltodextrin. Enzyme Microb. Technol., 28, 253-
258.
16. Bigelow WD. 1921. The logarithmic nature of thermal death time curves. J. Infect. Dis.,
29(5), 528-536.
17. Brennan JG. 2003. Spray drying. In: Encyclopedia of Food Sciences and Nutrition (eds.
B Caballero, LC Trugo, PM Finglas). Academic Press Elsevier Science Ltd., Oxford, UK.
18. Buitink J, Van den Dries IJ, Hoekstra FA, Alberda M, Hemminga MA. 2000. High critical
temperature above T
g
may contribute to the stability of biological systems. Biophys. J.,
79, 1119-1128.
19. Busto MD, Apenten RK, Robinson DS, Wu Z. 1999. Kinetics of thermal inactivation of pea
seed lipoxygenases and the effect of additives on their thermostability. Food Chem., 65,
323-329.
20. Cardona S, Schebor C, Buera MP, Karel M, Chirife J. 1997. The thermal stability of
invertase in reduced-moisture amorphous matrices in relation to glassy state of trehalose.
J. Food Sci., 62, 105-112.
21. Chan RK, Pathmanthan K, Johari GP. 1986. Dieletric relaxations in the liquid and glassy
states of glucose and its water mixtures. J. Phys. Chem., 90(63), 6358-6362.
22. Colaco C, Sen S, Thangavelu M, Pinder S, Roser B. 1992. Extraordinary stability of
enzymes dried in trehalose: simplified molecular biology. Biotechnol., 10, 1007-1011.
116

Spis literatury
23. Combes D, Auzanneau I, Zwick A. 1992. Thermal stability of enzymes: influence of
solvation medium (a Raman spectroscopy study). In: Stability and stabilisation of enzymes
(eds. WJJ Van den Tweel, A Harder, RM Buitelaar). Elsevier, Maastricht, 29-36.
24. Czapski J. 2001. Wybrane kierunki rozwoju dodatków do żywności. Przem. Ferm. i Owoc.-
Warz., 45(2), 7-9.
25. Dajnowiec F, Reps, Jarmul I, Wasilewski R. 1997. Substytuty podpuszczki otrzymane przy
użyciu drobnoustrojów modyfikowanych metodą inżynierii genetycznej. Przem. Spoż.,
51(12), 39-42.
26. Davies N. 2001. Europa – rozprawa historyka z historią. Wydawnictwo Znak, Kraków.
27. De Cordt S, Avila I, Hendrickx M, Tobback P. 1994. DSC and protein-based time-
temperature integrators: case study of
α
-amylase stabilized by polyols and/or sugar.
Biotechnol. Bioeng., 44, 859-865.
28. De Cordt S., Hendrickx M., Maesmans G., Tobback P. 1994. The influence of polyalcohols
and carbohydrates on the thermostability of
α
- amylase. Biotechnol. Bioeng., 43, 107-
114.
29. Domian E. 2002. Aglomeracja w przemyśle spożywczym. Przem. Spoż., 56(8), 80-88.
30. Etzel MR, Suen SY, Halverson SL, Budijono S. 1996. Enzyme inactivation in a droplet
forming a bubble during drying. J. Food Eng, 27, 17-34.
31. Fágáin CÓ. 1995. Understanding and increasing protein stability. Biochim. Biophys. Acta,
1252, 1-14.
32. Finney J, Buffo R, Reineccius GA. 2002. Effects of type of atomisation and processing
temperatures on the physical properties and stability of spray dried flavours. J. Food Sci.,
67(3), 1108-1114.
33. Fitter J, Herrmann R, Hauß T, Lechner RE, Dencher NA. 2001. Dynamical properties of
α
-amylase in the folded and unfolded state: the role of thermal equilibrium fluctuations for
conformational entropy and protein stabilisation. Physica B., 301, 1-7.
34. Fu WY, Suen S, Etzel MR. 1995. Inactivation
of Lactococcus ssp. Lactis C2
and alkaline
phosphatase during spray drying. Drying Technol., 13 (5-7), 1463-1476.
35. Geeraerd AH, Herremans CH, Ludikhuyze LR, Hendrickx ME, Van Impe JF. 1998.
Evaluation of model parameter accuracy by using joint confidence regions: application to
117

Spis literatury
low complexity neural networks to describe enzyme inactivation. Math. Comput. Simul.,
48, 53-64.
36. Goerlich E. 1975. Stan szklisty. W: Chemia ciała stałego (red. J Dereń, J Haber,
R Pampuch). Państwowe Wydawnictwa Naukowe, Warszawa.
37. Graber M, Combes D. 1989. Effect of polyols on fungal alpha-amylase thermostability.
Enzyme Microb. Technol., 11, 673-677.
38. Grabowski S, Mujumdar AS, Ramaswamy HS, Strumiło C. 1997. Evaluation of fluidized
versus spouted bed drying of baker’s yeast. Drying Technol., 15 (2), 625-634.
39. Grajek W. 1999. Biotechnologiczne metody kształtowania jakości żywności – produkcja
dodatków do żywności oraz rośliny transgeniczne. W: Surowce, technologia i dodatki
a jakość żywności (red. J Czapski, W Grajek, E Pospiech). Wydawnictwo AR im. Augusta
Cieszkowskiego w Poznaniu, Poznań, 299-341.
40. Greenspan L. 1977. Humidity fixed points of binary saturated aqueous solutions. J. Res.
Nat. Bur. Stand. (US) – Physics Chem., 81A (1), 89-96.
41. Guiavarc’h YP, Deli V, Van Loey AM, Hendrickx ME. 2002. Development of an enzymic
time temperature integrator for sterilization processes based on
Bacillus licheniformis
α
-amylase at reduced water content. J. Food Sci., 67(1), 285-291.
42. Guiavarc’h YP, Sila D, Duvetter T, Van Loey A, Hendrickx. 2003. Influence of sugars and
polyols on the thermal stability of purified tomato and cucumber pectinmethylesterases:
a basis for TTI development. Enzyme Microb. Technol., 33, 544-555.
43. Haentjens TH, Van Loey AM, Hendrickx ME, Tobback PP. 1998. The use of
α
-amylase at
reduced moisture content to develop time temperature integrators for sterilization
processes. Lebensm.- Wiss. u.-Technol., 31, 467-472.
44. Holme DJ, Peck H. 1993. Proteins. In: Analytical biochemistry. Longman Scientific
& Technical, Harlow, UK, 399-421.
45. Janeček Š, Baláž S. 1992.
α
-Amylases and approaches leading to their enhanced stability.
FEBS Lett., 304(1), 1-3.
46. Johnson JAC, Etzel MR. 1993. Inactivation of lactic acid bacteria during spray drying.
AICHe Symposium Series, 89(297), 98-107.
47. Johnson ML. 1992. Why, when, and how biochemists should use least squares. Anal.
Biochem., 206, 215-225.
118

Spis literatury
48. Kalinowska H, Turkiewicz M, Bielecki S. 2000. Enzymy nowej generacji w produkcji
żywności. Przem. Spoż., 54(10), 3-5.
49. Kączkowski J. 1999. Podstawy biochemii. Wydawnictwa Naukowo-Techniczne, Warszawa.
50. Klibanov AM. 1983. Thermostabilisation of enzymes. Adv. App. Microbiol., 29, 1-29.
51. Kuriki T, Imanaka T. 1999. The concept of the
α
-amylase family: structural similarity and
common catalytic mechanism. J. Biosci. Bioeng., 87(5), 557-565.
52. Kwapińska M. 2002. Wpływ parametrów suszenia i rozpylania na własności fizyczne
produktów. Rozprawa doktorska, Wydział Inżynierii Procesowej i Ochrony Środowiska,
Politechnika Łódzka.
53. Lee BH. 1996. Other microorganism-based processes and products. In: Fundamentals of
Food Biotechnology (ed. YH Hui). VCH Publishers, Inc., New York.
54. Lee BH. 1996. Principles of biochemistry. In: Fundamentals of Food Biotechnology (ed.
YH Hui). VCH Publishers, Inc., New York.
55. Lee JC, Timasheff SN. 1981. The stabilisation of proteins by sucrose. J Biol. Chem.,
256(14), 7193-7201.
56. Lévêque E, Janeček Š, Haye B, Belarbi A. 2000. Thermophilic archaeal amylolytic enzymes.
Enzyme Microb. Technol., 26, 3-14.
57. Lewicki PP. 1997. Water sorption isotherms and their estimation in food model mechanical
mixtures. J. Food Eng., 32, 47-68.
58. Lewicki PP. 1999. Właściwości wody w produktach spożywczych. Zeszyty Naukowe
Politechniki Łódzkiej. Inżynieria Chemiczna i Procesowa. 811(24), 29-46.
59. Lewicki PP. 1999. Suszenie. W: Inżynieria procesowa i aparatura przemysłu spożywczego
(red. PP Lewicki). Wydawnictwa Naukowo-Techniczne, Warszawa, 359-392.
60. Lewicki PP. 2004. Water as a determinant of food engineering properties. A review.
J. Food Eng., 61(4), 483-495.
61. Ling AC, Lund DB. 1978. Determining kinetic parameters for isothermal inactivation of
heat resistant and heat labile isozymes from thermal destruction curves. J. Food Sci., 43,
1307-1310.
62. Ludikhuyze LR, Van den Broeck I, Weemaes CA, Herremans CH, Van Impe JF, Hendrickx
ME, Tobback PP. 1997. Kinetics for isobaric-isothermal inactivation of
Bacillus subtilis
α
-amylase. Biotechnol. Progr., 13, 532-538.
119

Spis literatury
63. Lumry R, Eyring H. 1954. Conformation changes of proteins. J Phys. Chem., 58, 110-120.
64. Łomnicki A. 1999. Wprowadzenie do statystyki dla przyrodników. Wydawnictwo Naukowe
PWN, Warszawa.
65. Maa Y, Costantino HR, Nguyen P, Hsu CC. 1997. The effect of operating and formulation
variables on the morphology of spray-dried protein particles. Pharm. Dev. Technol., 2(3),
213-223.
66. Marangoni AG. 2003. How do enzymes work? In: Enzyme kinetics – a modern approach.
Wiley Interscience, Hoboken, New Jersey, 41-43.
67. Masters K. 1985. Spray drying - Handbook. George Godwin, London, UK.
68. Mazzobre MF, Buera MP, Chirife J.1997. Protective role of trehalose on thermal stability of
lactase in relation to its glass and crystal forming properties and effect of delaying
crystallization. Lebensm.- Wiss. u.-Technol., 30, 324-329.
69. Meerdink G, Van’t Riet K. 1991. Inactivation of a thermostable
α
-amylase during drying.
J. Food Eng., 14, 83-102.
70. Meerdink G, van’t Riet K. 1995. Prediction of product quality during spray drying. Food
Bioprod. Proc., 73C, 165-170.
71. Mellor JD, Bell GA. 2003. Freeze-drying. In: Encyclopedia of Food Sciences and Nutrition
(eds. B Caballero, LC Trugo, PM Finglas). Academic Press Elsevier Science Ltd., Oxford,
UK.
72. Mitura E, Kamiński W. 1994. Suszenie na nośnikach porowatych drożdży piekarskich
Saccharomyces cerevisiae. Biotechnologia, 26(3), 54-59.
73. Matsuura Y, Kusunoki M, Harada W, Kakudo M. 1984. Structure and possible catalytic
residues of Taka-amylase A. J. Biochem., 95, 697-705.
74. Nath S, Satpathy GR. 1998. A systematic approach for investigation of spray drying
prosesses. Drying Technol., 16(6), 1173-1193.
75. Nielsen JE, Borchert TV. 2000. Protein engineering of bacterial
α
-amylases. Biochim.
Biophys. Acta, 1543, 253-274.
76. Ninomiya K, Yamamoto T, Oheda T, Sato K, Sazaki G. 2001. Morphology and solubility of
multiple crystal forms of Taka-amylase A. J. Cryst. Growth, 222, 311-316.
120

Spis literatury
77. Noel M, Combes D. 2003.
Rhizomucor miehei
lipase: differential scanning calorimetry and
pressure/temperature stability studies in presence of soluble additives. Enzyme Microb.
Technol., 33, 299-308.
78. Noel TR, Ring SG, Whittam PA. 1990. Glass transition in low moisture food. Trends Food
Sci. Technol., 1, 62-67.
79. Obon JM, Manjon A, Iborra JL. 1996. Comparative thermostability of glucose
dehydrogenase from
Haloferax mediterranei
. Effects of salts and polyols. Enzyme Microb.
Technol., 19, 352-360.
80. Okello HO, Brennan JG, Lewis MJ, Gilmour S. 1998. Optimisation of the spray drying of the
enzyme polyphenol oxidase by response surface methodology. Proceedings of the 11
th
International Drying Symposium. Drying’98 (eds. A.S. Mujumdar, C.B. Akritidis,
D. Marinos-Kouris, G.D. Saravacos), Ziti Editions, Thessaloniki, vol. C, 1713-1722.
81. Peleg M. 1977. Flowability of foods and methods for its evaluation. J Food Proc. Eng.,
1, 303-328.
82. Pierce M M. 2003. Water – structures, properties and determination. In: Encyclopedia of
Food Sciences and Nutrition (eds. B Caballero, LC Trugo, PM Fingals). Academic Press
Elsevier Science Ltd, Oxford, UK.
83. Pijanowski E, Dłużewski M, Dłużewska A, Jarczyk A. 1996. Ogólna technologia żywności.
Wydawnictwa Naukowo-Techniczne, Warszawa.
84. Polska Norma PN-71/74700. Przetwory skrobiowe. Metody badań dekstryn.
85. Praca zbiorowa. 2001. Materiały do ćwiczeń z biochemii (red. M Toczko, A Grzelińska).
Wydawnictwo SGGW, Warszawa.
86. Reps A. 2003. Biotechnologia składników żywności. W: Biotechnologia żywności (red.
W Bednarski, A Reps). Wydawnictwa Naukowo-Techniczne, Warszawa, 257-321.
87. Rodwell VW. 1995. Enzymy: właściwości ogólne. W: Biochemia Harpera, (red. RK Murray,
DK Granner, P Mayes), Wydawnictwo Lekarskie PZWL, Warszawa.
88. Ross Y. 1995. Glass transition-related physicochemical changes in foods. Food Technol.
49(10), 97-102.
89. Ross YH. 2003. Water activity – principles and measurement. In: Encyclopedia of Food
Sciences and Nutrition (eds. BCaballero, LC Trugo, PM Fingals). Academic Press Elsevier
Science Ltd, Oxford, UK.
121

Spis literatury
90. Ross Y, Karel M. 1991. Phase transitions of mixtures of amorphous polysaccharides and
sugars. Biotechnol. Progr., 7, 49-53.
91. Roudant G, Simatos D, Champion E, Contreras-Lopez M, Le Meste M. 2004. Molecular
mobility atound the glass transition temperature: a mini review. Inn. Food Sci. Emerging
Technol., 5, 127-134.
92. Rutkowski A, Sawicka-Żukowska R. 2002. Preparaty enzymatyczne a substancje
dodatkowe do żywności. Przem. Spoż., 56(8), 50-54.
93. Rutkowski A., Gwiazda S., Dąbrowski K. 1993. Dodatki funkcjonalne do żywności. Agro
& Food Technology, Katowice, 223-224.
94. Sadykov R.A., Pobedimsky D.G., Bakhtiyarov F.R. 1997. Drying of bioactive products:
inactivation kinetics. Drying Technol., 15(10), 2401-2420.
95. Samborska K, Guiavar’h Y, Van Loey A, Hendrickx M. 2004. The influence of moisture
content on the thermostability of
Aspergillus oryzae
α
-amylase. Przyjęto do druku
w Enzyme Microb. Technol.
96. Samborska K, Witrowa-Rajchert D. 2002. Ocena procesu suszenia rozpyłowego
handlowego płynnego preparatu
α
-amylazy. Żywność. Nauka. Technologia. Jakość., 2(32),
170-178.
97. Saraiva J, De Cordt S, Hendrickx M, Oliveira J, Tobback P. 1992. Inactivation of
α
-amylase from Bacillus amyloliquefaciens at low moisture contents. In: Stability and
stabilisation of enzymes (eds. WJJ Van den Tweel, A Harder, RM Buitelaar) Proc.
International Symposium, Maastricht, The Nederlands, 459-466.
98. Saraiva J, Oliveira J, Lemos A, Hendrickx M. 1996. Analysis of the kinetic patterns of
horseradish peroxidase thermal inactivation in sodium phosphate buffer solutions of
different ionic strength. Int. J. Food Sci. Technol., 31, 223-231.
99. Saraiva J, Oliveira JC, Hendrickx M, Oliveira FAR., and Tobback P. 1996a. Analysis of the
inactivation kinetics of freeze dried α-amylase form
Bacillus amyloliquefaciens
at different
moisture contents. Lebensm.- Wiss. u.-Technol., 29, 260-266.
100.Schebor C, Buera M P, Chirife J. 1996. Glassy state in relation to the thermal inactivation
of the enzyme invertase in amorphous dried matrices of trehalose, maltodextrin and PVP.
J. Food Eng, 30, 269-282.
101.Scott WJ. 1953. Water relations of
Staphylococus aureus
at 30
°
C. Aust. J. Biol. Sci.,
6, 549-564.
122

Spis literatury
102.Slade L, Levine H. 2002. Progress in food processing and storage, based on amorphous
product technology. In: Amorphous food and pharmaceutical systems – the proceedings
of conference: The amorphous state – a critical review (ed. H Levine), The Royal Society
of Chemistry, Cambridge.
103.Smith PK, Krohn RI, Hermansin GT, Mallia AK, Gartner FH, Provenzano MD, Fujimoto EK,
Goeke NM, Olson BJ, Klenk DC. 1987. Measurement of protein using bicinchoninic acid.
Anal Biochem., 163, (1), 279.
104.Soerensen HH, Kragg I, Pisecky J, Westergaard V. 1978. Analytical methods for dry milk
production. Niro Atomizer Diary Research Group. De Forenade Trykkerier, Copenhagen,
Denmark.
105.Ståhl K, Claesson M, Lilliehorn P, Lindén H, Bäckström K. 2002. The effect of process
variables on the degradation and physical properties of spray dried insulin intended for
inhalation. Int. J. Pharm., 233, 227-237.
106.Stillinger FH, Hodgdon JA. 1994. Translation-rotation paradox for diffusion in glass-
forming liquids. Phys. Rev., E 50(3), 2064-2068.
107.Stolarek K. 2003. Badanie procesu degradacji amylolitycznego preparatu enzymatycznego
podczas suszenia rozpyłowego. Praca magisterska, Wydział Technologii Żywności, Szkoła
Główna Gospodarstwa Wiejskiego w Warszawie.
108.Strumiłło C., Markowski A., Adamiec J. 1991. Selected aspects of drying of
biotechnological products. Drying’91 (eds. AS Mujumdar, J Filkowa), Elsevier Science
Publishers, Amsterdam, 36-55.
109.Sun WQ, Davidson P, Chan HSO. 1998. Protein stability in the amorphous carbohydrate
matrix: relevance to anhydrobiosis. Biochim. Biophys. Acta, 1425, 245-254.
110.Terebiznik MR, Buera MP, and Pilosof AMR. 1997. Thermal stability of dehydrated
α
-amylase in trehalose matrices in relation to its phase transitions. Lebensm.- Wiss.
u.-Technol., 30, 513–518.
111.Timasheff SN, Arakawa T. 1989. Stabilisation of protein structure by solvents. In: Protein
structure, a practical approach (ed. TE Creighton). IRL Press, New York, 331-344.
112.Timasheff SN. 1993. The control of protein stability and association by week interactions
with water: How do solvents affect these processes? Annu. Rev. Biophys. Biomol. Struct.,
22, 67-97.
123

Spis literatury
113.Tomazic SJ, Klibanow AM. 1988. Mechanisms of irreversible thermal inactivation of Bacillus
α
-amylases. J. Biol. Chem., 263 (7), 3086-3091.
114.Van Arsdel WB. 1963. Properties of water, water vapor and air. In: Food Dehydration (eds.
WB Van Arsdel, MJ Copley), The Avi Publishing Company, Westport.
115.Van Loey A, Arthawan A, Hendrickx M, Haentjens T, Tobback P. 1997. The development
and use of an
α
-amylase-based time-temperature integrator to evaluate in-pack
pasteurisation processes. Lebensm.- Wiss. u.-Technol., 1997, 30, 94-100.
116.Van Loey A, Haentjens TH, Hendrickx ME, Tobback PP. 1997. The development of an
enzymic time temperature integrator to assess thermal efficacy of sterilisation of low-acid
canned foods. Food Biotechnol., 11(2), 147-168.
117.Warchalewski JR. 2001. Zastosowanie enzymów w produkcji żywności na przełomie
wieków. Przem. Spoż., 55(8), 40-44.
118.Weder JKP, Belitz HD. 2003. Protein – chemistry. In: Encyclopedia of Food Sciences and
Nutrition (eds. B Caballero, LC Trugo, PM Finglas). Academic Press Elsevier Science Ltd.,
Oxford.
119.Weemaes C, De Cordt S, Goossens K, Ludikhuyze L, Hendrickx M, Heremans K, Tobback P.
High pressure, thermal and combined pressure-temperature stabilities of
α
-amylase from
Bacillus
species. Biotechnol. Bioeng., 1993, 50(1), 49-56.
120.Williams ML, Landel RF, Ferry JD. 1955. The temperature dependence of relaxation
mechanisms in amorphous polymers and other glass-forming liquids. J. Chem. Eng., 77,
3701-3707.
121.Witrowa-Rajchert D, Samborska K. 2002. Metody suszenia mikroorganizmów i produktów
syntezy mikrobiologicznej. Żywność. Nauka. Technologia. Jakość., 2 (31), 5-15.
122.Whitaker JR. 2003. Enzymes – functions and characteristics. In: Encyclopedia of Food
Sciences and Nutrition (eds. B Caballero, LC Trugo, PM Finglas). Academic Press Elsevier
Science Ltd., Oxford, UK.
123.Zbiciński I, Strumiłło Cz, Kwapińska M, Piątkowski M. 2001. Wpływ parametrów suszenia
i atomizacji na wybrane własności produktu końcowego. Inżynieria Chemiczna
i Procesowa, 22(3E), 1549-1554.
124.Zbiciński I, Strumiłło Cz, Deląg A. 2002. Drying kinetics and particle residence time in
spray drying. Drying Technol., 20(9), 1751-1768.
124

Spis literatury
125.Zgirski A. 1999. Enzymy. W: Ćwiczenia z biochemii (red. L Kłyszajko-Stefanowicz).
Wydawnictwo Naukowe PWN, Warszawa, 471-573.
125
Aneks
10. ANEKS
Tabela 10.1. Średnia temperatura powietrza wylotowego (°C) w czasie
suszenia rozpyłowego preparatu
α
-amylazy w zależności od temperatury
powietrza wlotowego i strumienia surowca
Temperatura
powietrza
wlotowego
(°C)
Strumień surowca (cm
3
/s)
0,4
0,8
1,2
1,7
Temperatura powietrza wylotowego (
o
C)
160
90,0 ± 1,7
77,3 ± 1,5
61,3 ± 3,1
51,0 ± 1,0
180
97,7 ± 2,3
87,0 ± 3,0
65,7 ± 2,1
56,3 ± 1,2
200
100,3 ± 5,5
94,3 ± 3,5
73,7 ± 3,1
66,7 ± 1,2
220
106,0 ± 1,0
104,3 ± 6,0
89,3 ± 1,2
72,7 ± 2,1
Tabela 10.2. Dwuczynnikowa analiza wariancji – wpływ temperatury
powietrza wlotowego i strumienia surowca na temperaturę powietrza
wylotowego
w czasie suszenia rozpyłowego preparatu
α
-amylazy
Źródło zróżnicowania
p-value
Temperatura (
o
C)
0,0000
Strumień surowca (cm
3
/s)
0,0000
Tabela 10.3. Test t-Studenta – weryfikacja hipotezy o równości
współczynników kierunkowych prostych otrzymanych po wykreśleniu
zależności między temperaturą powietrza wylotowego a strumieniem surowca
przy czterech temperaturach powietrza wlotowego podczas suszenia
rozpyłowego preparatu
α
-amylazy
Temperatura powietrza
wlotowego (
o
C)
Współczynnik
kierunkowy
a
Błąd standardowy
160
-30,7
2,8
180
-33,6
4,6
200
-28,1
5,2
220
-27,0
5,1
Porównanie
Różnica
t empiryczne
t tablicowe
160-180
2,8
0,526
2,447
160-200
2,7
0,453
2,447
160-220
3,7
0,644
2,447
180-200
5,5
0,796
2,447
180-220
6,6
0,959
2,447
126
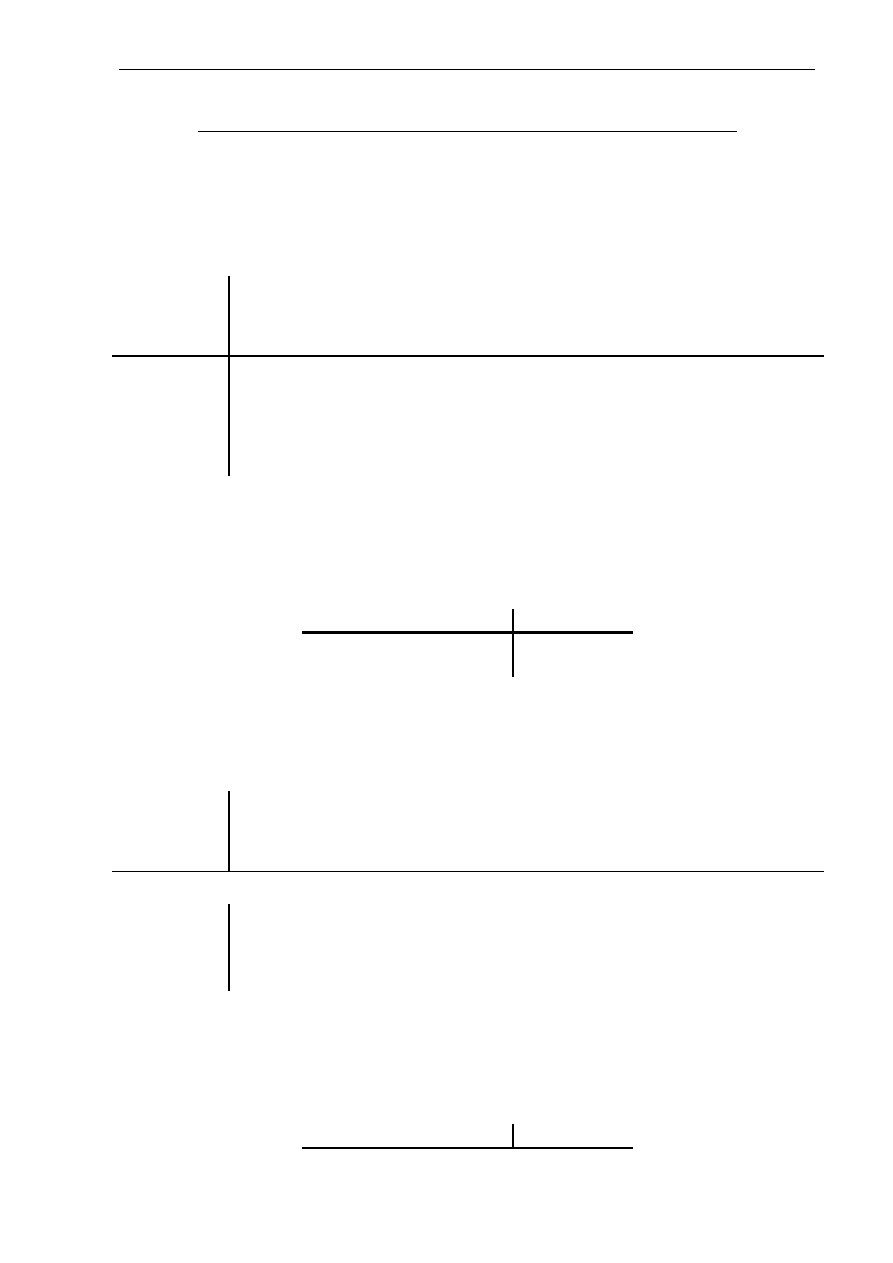
Aneks
200-220
1,1
0,149
2,447
Tabela 10.4. Średni strumień wody (kg/h) odparowywanej w czasie
suszenia rozpyłowego preparatu
α
-amylazy w zależności od temperatury
powietrza wlotowego i strumienia surowca
Temperatura
powietrza
wlotowego
(
o
C)
Strumień surowca (cm
3
/s)
0,4
0,8
1,2
1,7
Strumień odparowanej wody (kg/h)
160
1,12 ± 0,02
2,35 ± 0,07
3,36 ± 0,10
4,91 ± 0,28
180
1,13 ± 0,05
2,40 ± 0,10
3,67 ± 0,12
5,01 ± 0,17
200
1,13 ± 0,06
2,46 ± 0,04
3,71 ± 0,10
5,03 ± 0,06
220
1,11 ± 0,05
2,47 ± 0,04
3,70 ± 0,15
5,02 ± 0,18
Tabela 10.5. Dwuczynnikowa analiza wariancji – wpływ temperatury
powietrza wlotowego i strumienia surowca na strumień wody odparowywanej
w czasie suszenia rozpyłowego preparatu
α
-amylazy
Źródło zróżnicowania
p-value
Temperatura (
o
C)
0,5866
Strumień surowca (cm
3
/s)
0,0000
Tabela 10.6. Średnia wilgotność powietrza wylotowego (kg H
2
O/kg p.s.)
w czasie suszenia rozpyłowego
α
-amylazy w zależności od temperatury
powietrza wlotowego i strumienia surowca
Temperatura
powietrza
wlotowego
(
o
C)
Strumień surowca (cm
3
/s)
0,4
0,8
1,2
1,7
Wilgotność powietrza wylotowego (kg H
2
O/kg p.s.)
160
0,0098 ± 0,0006
0,0140 ± 0,0018
0,0250 ± 0,0020
0,0317 ± 0,0015
180
0,0084 ± 0,0005
0,0140 ± 0,0016
0,0266 ± 0,0008
0,0304 ± 0,0030
200
0,0084 ± 0,0017
0,0154 ± 0,0013
0,0261 ± 0,0012
0,0298 ± 0,0029
220
0,0093 ± 0,0025
0,0169 ± 0,0027
0,0256 ± 0,0005
0,0266 ± 0,0051
Tabela 10.7. Dwuczynnikowa analiza wariancji – wpływ temperatury
powietrza wlotowego i strumienia surowca na wilgotność powietrza
wylotowego
w czasie suszenia rozpyłowego preparatu
α
-amylazy
Źródło zróżnicowania
p-value
127
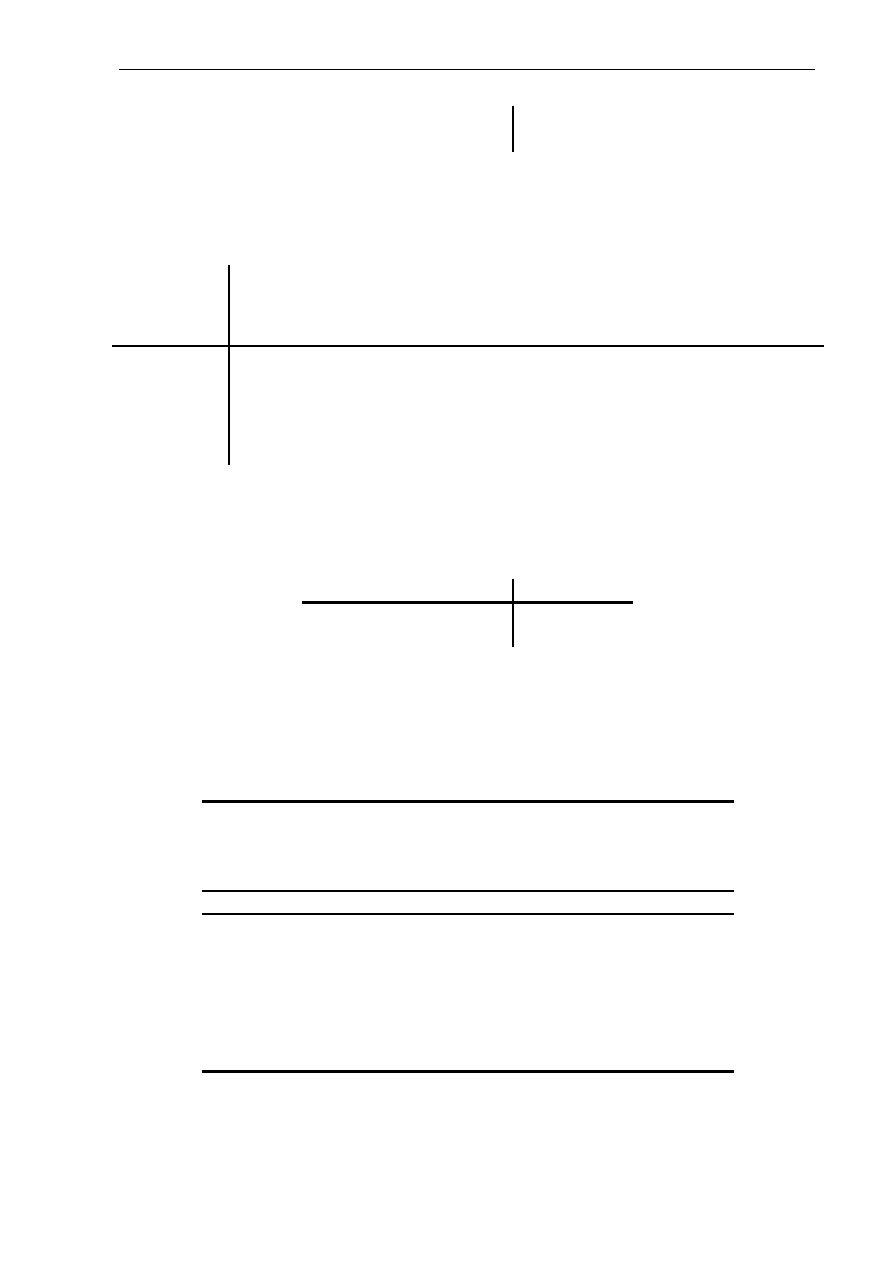
Aneks
Temperatura (
o
C)
0,9555
Strumień surowca (cm
3
/s)
0,0000
Tabela 10.8. Średnie właściwe zużycie powietrza (kg p.s./kg H
2
O)
w czasie
suszenia rozpyłowego preparatu
α
-amylazy w zależności od temperatury
powietrza wlotowego i strumienia surowca
Temperatura
powietrza
wlotowego
(
o
C)
Strumień surowca (cm
3
/s)
0,4
0,8
1,2
1,7
Właściwe zużycie powietrza (kg p.s./kg H
2
O)
160
416,7 ± 80,0
159,4 ± 60,3
49,8 ± 5,0
53,6 ± 4,5
180
500,0 ± 80,0
158,7 ± 50,3
46,0 ± 1,8
57,5 ± 10,2
200
500,0 ± 58,3
129,9 ± 22,2
47,1 ± 2,7
59,4 ± 11,7
220
344,8 ± 50,0
108,7 ± 39,6
48,4 ± 1,0
73,5 ± 25,9
Tabela 10.9. Dwuczynnikowa analiza wariancji – wpływ temperatury
powietrza wlotowego i strumienia surowca na właściwe zużycie powietrza w
czasie suszenia rozpyłowego preparatu
α
-amylazy
Źródło zróżnicowania
p-value
Temperatura (
o
C)
0,3128
Strumień surowca (cm
3
/s)
0,0000
Tabela 10.10. Porównania wielokrotne – wpływ strumienia surowca na
właściwe zużycie powietrza w czasie suszenia rozpyłowego preparatu
α
-
amylazy
Strumień surowca (cm
3
/s) Liczebność Średnia
Grupy
homogeniczne
1,2
12
47,9
x
1,7
12
63,3
x
0,8
12
147,0
x
0,4
12
472,3
x
Porównanie
Różnica
0,4-0,8
325,2
*
0,4-1,2
424,3
*
0,4-1,7
408,9
*
0,8-1,2
99,1
*
0,8-1,7
83,7
*
1,2-1,7
-15,4
* zanotowano statystycznie istotną różnicę
128

Aneks
Tabela 10.11. Średnie właściwe zużycie ciepła (kJ/kg H
2
O) w czasie
suszenia rozpyłowego preparatu
α
-amylazy w zależności od temperatury
powietrza wlotowego i strumienia surowca
Temperatura
powietrza
wlotowego
(
o
C)
Strumień surowca (cm
3
/s)
0,4
0,8
1,2
1,7
Właściwe zużycie ciepła (kJ/kg H
2
O)
160
31086,8 ± 9553,0
11530,6 ± 3659,3
4557,6 ± 314,8
4112,0 ± 148,1
180
49549,6 ± 25167,7
13100,5 ± 3750,6
4618,5 ± 179,8
4545,9 ± 400,0
200
40777,7 ± 10841,0
12160,1 ± 1158,5
5061,9 ± 293,0
5256,5 ± 483,4
220
32329,5 ± 5517,5
11746,3 ± 3496,4
5924,8 ± 128,6
6345,5 ± 1427,0
Tabela 10.12. Dwuczynnikowa analiza wariancji – wpływ temperatury
powietrza wlotowego i strumienia surowca na właściwe zużycie ciepła w
czasie suszenia rozpyłowego preparatu
α
-amylazy
Źródło zróżnicowania
p-value
Temperatura (
o
C)
0,3917
Strumień surowca (cm
3
/s)
0,0000
Tabela 10.13. Porównania wielokrotne – wpływ strumienia surowca na
właściwe zużycie ciepła w czasie suszenia rozpyłowego preparatu
α
-
amylazy
Strumień surowca (cm
3
/s) Liczebność Średnia
Grupy
homogeniczne
1,2
12
5050,17
x
1,7
12
5184,33
x
0,8
12
12693,6
x
0,4
12
38435,8
x
Porównanie
Różnica
0,4-0,8
25742,2
*
0,4-1,2
33385,7
*
0,4-1,7
33251,5
*
0,8-1,2
7643,4
*
0,8-1,7
7509,2
*
1,2-1,7
-134,1
* zanotowano statystycznie istotną różnicę
129
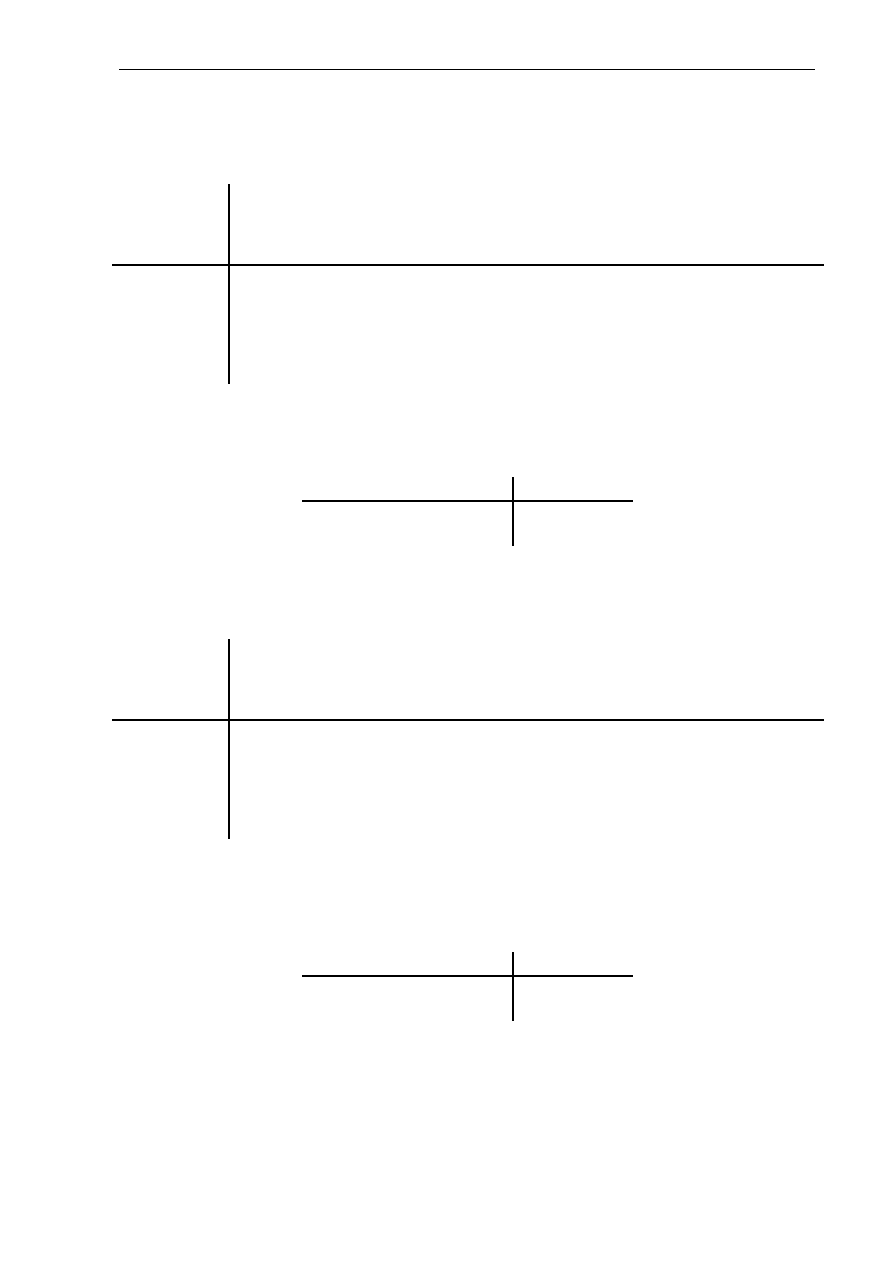
Aneks
Tabela 10.14. Średnia zawartość wody w suszach (g H
2
O/g s.s.)
w
zależności od temperatury powietrza wlotowego i strumienia surowca w czasie
suszenia rozpyłowego preparatu
α
-amylazy
Temperatura
powietrza
wlotowego
(
o
C)
Strumień surowca (cm
3
/s)
0,4
0,8
1,2
1,7
Zawartość wody w suszach (g H
2
O/g s.s.)
160
0,031 ± 0,006
0,051 ± 0,008
0,093 ± 0,024
0,106 ± 0,008
180
0,029 ± 0,003
0,040 ± 0,003
0,087 ± 0,050
0,097 ± 0,004
200
0,029 ± 0,007
0,036 ± 0,002
0,083 ± 0,048
0,085 ± 0,005
220
0,030 ± 0,008
0,032 ± 0,005
0,069 ± 0,004
0,075 ± 0,010
Tabela 10.15. Dwuczynnikowa analiza wariancji – wpływ temperatury
powietrza wlotowego i strumienia surowca na zawartość wody w suszach
Źródło zróżnicowania
p-value
Temperatura (
o
C)
0,0001
Strumień surowca (cm
3
/s)
0,0000
Tabela 10.16. Średnia aktywność względna (%) suszonej
α
-amylazy
w zależności od temperatury powietrza wlotowego i strumienia surowca
Temperatura
powietrza
wlotowego
(
o
C)
Strumień surowca (cm
3
/s)
0,4
0,8
1,2
1,7
Aktywność względna
α−
amylazy (%)
160
66,0 ± 1,8
71,1 ± 6,4
80,2 ± 3,2
86,6 ± 1,9
180
64,3 ± 1,2
75,3 ± 3,4
84,3 ± 1,6
88,0 ± 1,0
200
61,2 ± 1,3
71,2 ± 3,9
83,9 ± 2,6
89,0 ± 2,7
220
56,7 ± 4,9
65,7 ± 8,0
86,7 ± 1,2
90,1 ± 1,5
Tabela 10.17. Dwuczynnikowa analiza wariancji – wpływ temperatury
powietrza wlotowego i strumienia surowca na aktywność względną
suszonej
α
-amylazy
Źródło zróżnicowania
p-value
Temperatura (
o
C)
0,3285
Strumień surowca (cm
3
/s)
0,0000
130

Aneks
Tabela 10.18. Kinetyka inaktywacji cieplnej
α
-amylazy w roztworze wodnym
S1
Czas (min)
A
A
/
A
0
log (
A
/
A
0
)
ln (
A
/
A
0
)
Temperatura 62,5°C
0,0
0,485
1,000
0,000
0,000
1,0
0,406
0,837
-0,077
-0,178
2,5
0,355
0,732
-0,136
-0,312
5,0
0,261
0,538
-0,269
-0,620
7,5
0,153
0,315
-0,501
-1,154
10,0
0,121
0,249
-0,603
-1,388
12,5
0,091
0,188
-0,727
-1,673
17,5
0,050
0,103
-0,987
-2,272
Temperatura 65,0°C
0,0
0,420
1,000
0,000
0,000
0,2
0,389
0,926
-0,033
-0,077
0,5
0,376
0,895
-0,048
-0,111
1,0
0,341
0,812
-0,090
-0,208
2,5
0,239
0,569
-0,245
-0,564
5,0
0,113
0,269
-0,570
-1,313
7,5
0,068
0,162
-0,791
-1,821
10,0
0,037
0,088
-1,055
-2,429
15,0
0,008
0,019
-1,720
-3,961
Temperatura 67,5°C
0,0
0,485
1,000
0,000
0,000
0,5
0,351
0,724
-0,140
-0,323
1,0
0,297
0,612
-0,213
-0,490
2,0
0,196
0,404
-0,393
-0,906
4,0
0,088
0,181
-0,741
-1,707
6,0
0,044
0,091
-1,042
-2,400
8,0
0,027
0,056
-1,254
-2,888
10,0
0,019
0,039
-1,407
-3,240
Temperatura 70,0°C
0,0
0,420
1,000
0,000
0,000
0,1
0,402
0,957
-0,019
-0,044
0,3
0,314
0,748
-0,126
-0,291
0,5
0,270
0,643
-0,192
-0,442
1,0
0,203
0,483
-0,316
-0,727
2,5
0,080
0,190
-0,720
-1,658
3,5
0,048
0,114
-0,942
-2,169
5,0
0,004
0,010
-2,021
-4,654
131

Aneks
Tabela 10.19. Kinetyka inaktywacji cieplnej
α
-amylazy w systemie S2
o zawartości wody 3,5 g H
2
O/g s.s.
Czas (min)
A
A
/
A
0
log (
A
/
A
0
)
ln (
A
/
A
0
)
Temperatura 70,0°C
0,0
0,296
0,296
-0,529
0,000
0,5
0,260
0,260
-0,585
-0,130
1,0
0,253
0,253
-0,597
-0,157
2,5
0,216
0,216
-0,666
-0,315
5,0
0,178
0,178
-0,750
-0,509
7,5
0,142
0,142
-0,848
-0,735
10,0
0,127
0,127
-0,896
-0,846
20,0
0,068
0,068
-1,167
-1,471
Temperatura 72,5°C
0,0
0,286
1,788
0,252
0,000
0,5
0,242
1,513
0,180
-0,167
1,0
0,221
1,381
0,140
-0,258
2,5
0,187
1,169
0,068
-0,425
5,0
0,124
0,775
-0,111
-0,836
7,5
0,092
0,575
-0,240
-1,134
10,0
0,068
0,425
-0,372
-1,436
12,5
0,050
0,313
-0,505
-1,744
15,0
0,037
0,231
-0,636
-2,045
20,0
0,020
0,125
-0,903
-2,660
Temperatura 73,5°C
0,0
0,246
0,246
-0,609
0,000
0,5
0,229
0,229
-0,640
-0,072
1,0
0,207
0,207
-0,684
-0,173
2,5
0,146
0,146
-0,836
-0,522
5,0
0,087
0,087
-1,060
-1,039
7,5
0,051
0,051
-1,292
-1,574
10,0
0,033
0,033
-1,481
-2,009
12,5
0,025
0,025
-1,602
-2,286
Temperatura 75,0°C
0,0
0,247
0,988
-0,005
0,000
0,5
0,189
0,756
-0,121
-0,268
1,0
0,140
0,560
-0,252
-0,5677459
2,0
0,109
0,436
-0,361
-0,8180405
4,0
0,042
0,168
-0,775
-1,7717187
6,0
0,025
0,100
-1,000
-2,2905125
8,0
0,013
0,052
-1,284
-2,944439
132

Aneks
Tabela 10.20. Kinetyka inaktywacji cieplnej
α
-amylazy w systemie S3
o zawartości wody 1,8 g H
2
O/g s.s.
Czas (min)
A
A
/
A
0
log (
A
/
A
0
)
ln (
A
/
A
0
)
Temperatura 73,5°C
0,0
0,224
0,000
0,000
0,000
2,5
0,174
0,777
-0,110
-0,253
5,0
0,127
0,567
-0,246
-0,567
7,5
0,124
0,554
-0,257
-0,591
10,0
0,108
0,482
-0,317
-0,730
15,0
0,081
0,362
-0,442
-1,017
20,0
0,060
0,268
-0,572
-1,317
30,0
0,039
0,174
-0,759
-1,748
Temperatura 75,0°C
0,0
0,186
1,000
0,000
0,000
1,5
0,137
0,737
-0,133
-0,306
2,5
0,117
0,629
-0,201
-0,464
5,0
0,088
0,473
-0,325
-0,748
7,5
0,071
0,382
-0,418
-0,963
10,0
0,054
0,290
-0,537
-1,237
12,5
0,043
0,231
-0,636
-1,465
15,0
0,031
0,167
-0,778
-1,792
20,0
0,025
0,134
-0,872
-2,007
Temperatura 76,5°C
0,0
0,224
0,000
0,000
0,000
1,0
0,148
0,661
-0,180
-0,414
2,0
0,111
0,496
-0,305
-0,702
4,0
0,065
0,290
-0,537
-1,237
5,0
0,052
0,232
-0,634
-1,460
6,0
0,042
0,188
-0,727
-1,674
8,0
0,027
0,121
-0,919
-2,116
10,0
0,022
0,098
-1,008
-2,321
12,0
0,016
0,071
-1,146
-2,639
Temperatura 78,5°C
0,0
0,186
1,000
0,000
0,000
1,0
0,070
0,376
-0,424
-0,977
2,0
0,042
0,226
-0,646
-1,488
3,0
0,026
0,140
-0,855
-1,968
4,0
0,016
0,086
-1,065
-2,453
5,0
0,012
0,065
-1,190
-2,741
6,0
0,008
0,043
-1,366
-3,146
133

Aneks
Tabela 10.21. Kinetyka inaktywacji cieplnej
α
-amylazy w systemie S4
o zawartości wody 0,163 g H
2
O/g s.s.
Czas (min)
A
A
/
A
0
log (
A
/
A
0
)
ln (
A
/
A
0
)
Temperatura 95,0°C
0,0
0,250
1,000
0,000
0,000
5,0
0,174
0,697
-0,157
-0,361
7,5
0,132
0,648
-0,188
-0,434
10,0
0,126
0,503
-0,299
-0,688
15,0
0,075
0,298
-0,526
-1,211
20,0
0,070
0,278
-0,555
-1,279
25,0
0,040
0,160
-0,795
-1,830
Temperatura 97,0°C
0,0
0,203
1,000
0,000
0,000
1,0
0,191
0,938
-0,028
-0,064
2,5
0,162
0,798
-0,098
-0,226
5,0
0,119
0,584
-0,234
-0,538
7,5
0,076
0,374
-0,428
-0,984
10,0
0,075
0,368
-0,435
-1,001
15,0
0,043
0,213
-0,672
-1,547
20,0
0,027
0,132
-0,880
-2,027
Temperatura 98,5°C
0,0
0,134
1,000
0,000
0,000
1,0
0,103
0,770
-0,113
-0,261
2,0
0,084
0,627
-0,203
-0,467
3,0
0,064
0,477
-0,321
-0,739
4,0
0,062
0,465
-0,333
-0,766
6,0
0,030
0,227
-0,645
-1,484
8,0
0,024
0,180
-0,744
-1,713
12,0
0,008
0,058
-1,236
-2,846
Temperatura 100,0°C
0,0
0,250
1,000
0,000
0,000
1,0
0,149
0,597
-0,224
-0,515
2,5
0,070
0,282
-0,550
-1,267
5,0
0,032
0,130
-0,887
-2,043
7,5
0,006
0,026
-1,587
-3,653
10,0
0,005
0,019
-1,710
-3,938
134

Aneks
Tabela 10.22. Kinetyka inaktywacji cieplnej
α
-amylazy w systemie S5
o zawartości wody 0,060 g H
2
O/g s.s.
Czas (min)
A
A
/
A
0
log (
A
/
A
0
)
ln (
A
/
A
0
)
Temperatura 100,0°C
0,0
0,229
1,000
0,000
0,000
3,5
0,168
0,732
-0,136
-0,312
6,0
0,088
0,553
-0,257
-0,593
7,5
0,109
0,478
-0,321
-0,738
10,0
0,103
0,452
-0,345
-0,794
12,5
0,051
0,319
-0,496
-1,142
15,0
0,052
0,229
-0,640
-1,475
17,5
0,043
0,188
-0,726
-1,672
Temperatura 102,5°C
0,0
0,159
1,000
0,000
0,000
1,0
0,136
0,854
-0,069
-0,158
5,0
0,068
0,425
-0,371
-0,855
5,0
0,106
0,463
-0,335
-0,770
10,0
0,029
0,180
-0,745
-1,716
20,0
0,015
0,065
-1,187
-2,734
15,0
0,017
0,108
-0,966
-2,225
Temperatura 105,0°C
0,0
0,159
1,000
0,000
0,000
1,0
0,114
0,716
-0,145
-0,335
2,5
0,090
0,394
-0,405
-0,932
4,0
0,039
0,248
-0,605
-1,394
6,0
0,025
0,157
-0,803
-1,849
7,5
0,023
0,101
-0,998
-2,297
8,0
0,016
0,098
-1,010
-2,326
10,0
0,012
0,075
-1,126
-2,593
Temperatura 107,5°C
0,0
0,159
1,000
0,000
0,000
1,0
0,078
0,490
-0,310
-0,713
1,5
0,075
0,472
-0,326
-0,751
2,0
0,037
0,234
-0,631
-1,453
2,5
0,029
0,181
-0,742
-1,708
3,0
0,020
0,123
-0,910
-2,096
3,5
0,021
0,129
-0,889
-2,048
135

Aneks
Tabela 10.23. Kinetyka inaktywacji cieplnej
α
-amylazy w systemie S6
o zawartości wody 0,029 g H
2
O/g s.s.
Czas (min)
A
A
/
A
0
log (
A
/
A
0
)
ln (
A
/
A
0
)
Temperatura 100,0°C
0
0,251
1,000
0,000
0,000
2,5
0,216
0,861
-0,065
-0,150
5,0
0,176
0,703
-0,153
-0,353
10,0
0,110
0,439
-0,357
-0,822
15,0
0,105
0,417
-0,380
-0,874
20,0
0,069
0,276
-0,560
-1,289
25,0
0,057
0,227
-0,644
-1,483
30,0
0,029
0,116
-0,937
-2,158
Temperatura 105,0°C
0,0
0,251
1,000
0,000
0,000
2,5
0,129
0,514
-0,289
-0,666
5,0
0,059
0,237
-0,625
-1,440
7,5
0,056
0,222
-0,654
-1,506
10,0
0,030
0,121
-0,918
-2,113
15,0
0,026
0,104
-0,982
-2,260
20,0
0,013
0,053
-1,272
-2,930
30,0
0,006
0,024
-1,612
-3,711
Temperatura 110,0°C
0,0
0,251
1,000
0,000
0,000
1,0
0,098
0,392
-0,406
-0,936
2,0
0,063
0,252
-0,598
-1,378
3,5
0,047
0,186
-0,730
-1,681
6,5
0,022
0,087
-1,061
-2,443
10,0
0,012
0,048
-1,320
-3,041
15,0
0,008
0,031
-1,504
-3,463
20,0
0,004
0,015
-1,815
-4,178
Temperatura 115,0°C
0,0
0,251
1,000
0,000
0,000
1,0
0,068
0,269
-0,570
-1,313
2,0
0,035
0,138
-0,860
-1,980
4,0
0,017
0,066
-1,178
-2,712
5,0
0,013
0,053
-1,277
-2,941
7,0
0,007
0,027
-1,571
-3,617
10,0
0,003
0,012
-1,917
-4,413
136

Aneks
Tabela 10.24. Kinetyka inaktywacji cieplnej
α
-amylazy w roztworze
buforowym 20 mM Bis-Tris w temperaturach 62-68°C
Temperatura 62,0°C
Temperatura 64,0°C
Czas (min)
A
A
/
A
0
log (
A
/
A
0
)
Czas (min)
A
A
/
A
0
log (
A
/
A
0
)
0,0
0,221
1,000
0,000
0,0
0,228
1,000
0,000
3,5
0,101
0,457
-0,340
2,5
0,089
0,390
-0,409
3,5
0,111
0,502
-0,299
2,5
0,094
0,412
-0,385
7,0
0,055
0,249
-0,604
5,0
0,042
0,184
-0,735
7,0
0,063
0,285
-0,545
5,0
0,048
0,211
-0,677
10,5
0,028
0,127
-0,897
7,5
0,020
0,088
-1,057
10,5
0,033
0,149
-0,826
7,5
0,026
0,114
-0,943
14,0
0,018
0,081
-1,089
10,0
0,015
0,066
-1,182
14,0
0,021
0,095
-1,022
10,0
0,018
0,079
-1,103
Temperatura 66,0°C
Temperatura 68,0°C
Czas (min)
A
A
/
A
0
log (
A
/
A
0
)
Czas (min)
A
A
/
A
0
log (
A
/
A
0
)
0,0
0,245
1,000
0,000
0,0
0,231
1,000
0,000
1,5
0,112
0,457
-0,340
1,0
0,063
0,257
-0,590
1,5
0,131
0,535
-0,272
1,0
0,055
0,224
-0,649
3,0
0,075
0,306
-0,514
1,5
0,037
0,151
-0,821
4,5
0,035
0,143
-0,845
1,5
0,032
0,131
-0,884
4,5
0,032
0,131
-0,884
2,0
0,025
0,102
-0,991
6,0
0,018
0,073
-1,134
2,0
0,030
0,122
-0,912
2,5
0,021
0,086
-1,067
137

Aneks
Tabela 10.25. Kinetyka inaktywacji cieplnej
α
-amylazy w roztworze
buforowym
20 mM Bis-Tris z dodatkiem 100 mg/cm
3
mannitolu w temperaturach 62-
68°C
Temperatura 62,0°C
Temperatura 68,0°C
Czas (min)
A
A
/
A
0
log (
A
/
A
0
)
Czas (min)
A
A
/
A
0
log (
A
/
A
0
)
0,0
0,226
1,000
0,000
0,0
0,230
1,000
0,000
3,0
0,138
0,611
-0,214
1,0
0,097
0,422
-0,375
3,0
0,147
0,650
-0,187
1,0
0,098
0,426
-0,371
6,0
0,104
0,460
-0,337
1,5
0,067
0,291
-0,536
6,0
0,105
0,465
-0,333
1,5
0,074
0,322
-0,492
10,0
0,060
0,265
-0,576
2,0
0,048
0,209
-0,680
10,0
0,065
0,288
-0,541
2,0
0,047
0,204
-0,690
14,0
0,039
0,173
-0,763
2,5
0,030
0,130
-0,885
14,0
0,044
0,195
-0,711
2,5
0,040
0,174
-0,760
Temperatura 64,0°C
Temperatura 66,0°C
Czas (min)
A
A
/
A
0
log (
A
/
A
0
)
Czas (min)
A
A
/
A
0
log (
A
/
A
0
)
0,0
0,230
1,000
0,000
0,0
0,232
1,000
0,000
10,0
0,034
0,148
-0,829
5,0
0,039
0,168
-0,774
10,0
0,039
0,170
-0,770
5,0
0,044
0,190
-0,722
10,0
0,043
0,187
-0,727
5,0
0,057
0,246
-0,610
10,0
0,047
0,205
-0,689
5,0
0,063
0,272
-0,566
138

Aneks
Tabela 10.26. Kinetyka inaktywacji cieplnej
α
-amylazy w roztworze
buforowym
20 mM Bis-Tris z dodatkiem 200 mg/cm
3
laktitolu w temperaturach 62-68°C
Temperatura 62,0°C
Temperatura 68,0°C
Czas (min)
A
A
/
A
0
log (
A
/
A
0
)
Czas (min)
A
A
/
A
0
log (
A
/
A
0
)
0,0
0,216
1,000
0,000
0,0
0,235
1,000
0,000
10,0
0,146
0,676
-0,170
1,0
0,095
0,405
-0,392
10,0
0,132
0,611
-0,214
1,0
0,115
0,490
-0,309
20,0
0,087
0,403
-0,395
2,0
0,046
0,196
-0,707
20,0
0,090
0,417
-0,380
2,0
0,052
0,222
-0,654
30,0
0,055
0,255
-0,594
2,5
0,041
0,175
-0,757
30,0
0,062
0,287
-0,542
2,5
0,041
0,175
-0,757
40,0
0,043
0,199
-0,701
5,0
0,015
0,064
-1,194
40,0
0,047
0,218
-0,662
5,0
0,011
0,047
-1,329
Temperatura 64,0°C
Temperatura 66,0°C
Czas (min)
A
A
/
A
0
log (
A
/
A
0
)
Czas (min)
A
A
/
A
0
log (
A
/
A
0
)
0,0
0,229
1,000
0,000
0,0
0,229
1,000
0,000
20,0
0,027
0,118
-0,928
8,0
0,044
0,192
-0,716
20,0
0,029
0,127
-0,897
8,0
0,047
0,205
-0,688
20,0
0,033
0,144
-0,841
8,0
0,049
0,214
-0,670
20,0
0,035
0,153
-0,816
8,0
0,053
0,231
-0,636
139

Aneks
Tabela 10.27. Kinetyka inaktywacji cieplnej
α
-amylazy w roztworze
buforowym
20 mM Bis-Tris z dodatkiem czterech różnych stężeń sorbitolu w
temperaturze 68°C
100 mg/cm
3
200 mg/cm
3
Czas (min)
A
A
/
A
0
log (
A
/
A
0
)
Czas (min)
A
A
/
A
0
log (
A
/
A
0
)
0,0
0,165
1,000
0,000
0,0
0,222
1,000
0,000
1,0
0,075
0,456
-0,341
1,0
0,112
0,506
-0,296
1,0
0,087
0,529
-0,277
1,0
0,116
0,524
-0,281
2,0
0,042
0,255
-0,593
2,5
0,050
0,226
-0,646
3,0
0,025
0,152
-0,818
2,5
0,053
0,239
-0,621
3,0
0,022
0,134
-0,874
4,0
0,026
0,117
-0,930
4,0
0,015
0,091
-1,040
4,0
0,030
0,135
-0,868
5,0
0,015
0,068
-1,169
300 mg/cm
3
500 mg/cm
3
Czas (min)
A
A
/
A
0
log (
A
/
A
0
)
Czas (min)
A
A
/
A
0
log (
A
/
A
0
)
0,0
0,198
0,000
0,000
0,0
0,229
0,000
0,000
1,0
0,134
0,677
-0,170
7,5
0,049
0,214
-0,670
2,5
0,093
0,470
-0,328
7,5
0,049
0,214
-0,670
2,5
0,080
0,404
-0,394
15,0
0,014
0,061
-1,214
5,0
0,051
0,258
-0,589
3,0
0,116
0,507
-0,295
5,0
0,039
0,197
-0,706
3,0
0,130
0,568
-0,246
7,5
0,021
0,106
-0,974
15,0
0,018
0,079
-1,105
7,5
0,021
0,106
-0,974
140

Aneks
Tabela 10.28. Kinetyka inaktywacji cieplnej
α
-amylazy w roztworze
buforowym 20 mM Bis-Tris z dodatkiem pięciu różnych stężeń glicerolu w
temperaturze 68°C
8,3 % v/v
13,0 % v/v
Czas
(min)
A
A
/
A
0
log (
A
/
A
0
)
Czas (min)
A
A
/
A
0
log (
A
/
A
0
)
0,0
0,221
1,000
0,000
0,0
0,159
1,000
0,000
2,0
0,053
0,240
-0,619
1,5
0,096
0,604
-0,219
2,0
0,064
0,290
-0,537
1,5
0,093
0,585
-0,233
3,0
0,044
0,200
-0,700
3,0
0,071
0,447
-0,350
3,0
0,050
0,227
-0,644
3,0
0,052
0,327
-0,485
4,0
0,024
0,109
-0,963
4,5
0,032
0,201
-0,696
4,0
0,029
0,132
-0,881
4,5
0,039
0,245
-0,610
5,0
0,023
0,104
-0,982
6,0
0,020
0,126
-0,900
5,0
0,022
0,100
-1,001
6,0
0,023
0,145
-0,840
24,8 % v/v
30,0 % v/v
Czas
(min)
A
A
/
A
0
log (
A
/
A
0
)
Czas (min)
A
A
/
A
0
log (
A
/
A
0
)
0,0
0,194
1,000
0,000
0,0
0,213
1,000
0,000
6,0
0,066
0,340
-0,468
2,5
0,127
0,596
-0,225
6,0
0,068
0,351
-0,455
2,5
0,124
0,582
-0,235
4,0
0,075
0,387
-0,413
5,0
0,076
0,357
-0,448
4,0
0,077
0,397
-0,401
5,0
0,078
0,366
-0,436
9,0
0,027
0,139
-0,856
7,5
0,052
0,244
-0,612
9,0
0,032
0,165
-0,783
7,5
0,057
0,268
-0,573
10,0
0,035
0,164
-0,784
10,0
0,049
0,230
-0,638
41,0 % v/v
Czas
(min)
A
A
/
A
0
log (
A
/
A
0
)
0,0
0,163
1,000
0,000
10,0
0,063
0,387
-0,413
10,0
0,065
0,399
-0,399
20,0
0,032
0,196
-0,707
20,0
0,032
0,196
-0,707
30,0
0,017
0,104
-0,982
40,0
0,010
0,061
-1,212
141

Aneks
Tabela 10.29. Kinetyka inaktywacji cieplnej
α
-amylazy w roztworze
buforowym 20 mM Bis-Tris z dodatkiem czterech różnych stężeń trehalozy w
temperaturze 68°C
140 mg/cm
3
200 mg/cm
3
Czas (min)
A
A
/
A
0
log (
A
/
A
0
)
Czas (min)
A
A
/
A
0
log (
A
/
A
0
)
0,0
0,218
1,000
0,000
0,0
0,226
1,000
0,000
1,5
0,092
0,414
-0,383
1,5
0,118
0,522
-0,282
2,0
0,075
0,338
-0,471
3,0
0,067
0,296
-0,528
2,0
0,089
0,401
-0,397
3,0
0,077
0,341
-0,468
3,0
0,038
0,171
-0,767
4,5
0,048
0,212
-0,673
3,0
0,049
0,221
-0,656
6,0
0,032
0,142
-0,849
4,0
0,039
0,176
-0,755
6,0
0,034
0,150
-0,823
4,0
0,044
0,198
-0,703
420 mg/cm
3
705 mg/cm
3
Czas (min)
A
A
/
A
0
log (
A
/
A
0
)
Czas (min)
A
A
/
A
0
log (
A
/
A
0
)
0,0
0,215
1,000
0,000
0,0
0,220
1,000
0,000
4,0
0,104
0,484
-0,315
10,0
0,114
0,504
-0,297
8,0
0,053
0,247
-0,608
20,0
0,066
0,292
-0,535
8,0
0,055
0,256
-0,592
30,0
0,037
0,164
-0,786
10,1
0,040
0,186
-0,730
30,0
0,040
0,177
-0,752
10,1
0,045
0,209
-0,679
45,0
0,028
0,124
-0,907
12,0
0,036
0,167
-0,776
45,0
0,021
0,093
-1,032
12,0
0,035
0,163
-0,788
142
Aneks
Tabela 10.30. Kinetyka inaktywacji cieplnej
α
-amylazy w roztworze
buforowym 20 mM Bis-Tris z dodatkiem trzech różnych stężeń sacharozy w
temperaturze 68°C
140 mg/cm
3
200 mg/cm
3
Czas (min)
A
A
/
A
0
log (
A
/
A
0
)
Czas (min)
A
A
/
A
0
log (
A
/
A
0
)
0,0
0,197
1,000
0,000
0,0
0,210
1,000
0,000
2,5
0,093
0,472
-0,326
1,0
0,167
0,795
-0,100
2,5
0,105
0,533
-0,273
1,0
0,166
0,790
-0,102
5,0
0,052
0,264
-0,578
2,5
0,122
0,581
-0,236
5,0
0,058
0,294
-0,531
2,5
0,126
0,600
-0,222
7,5
0,030
0,152
-0,817
7,5
0,054
0,257
-0,590
7,5
0,035
0,178
-0,750
7,5
0,056
0,267
-0,574
10,0
0,018
0,091
-1,039
11,0
0,033
0,157
-0,804
10,0
0,021
0,107
-0,972
11,0
0,035
0,167
-0,778
420 mg/cm
3
Czas (min)
A
A
/
A
0
log (
A
/
A
0
)
0,0
0,181
1,000
0,000
10,0
0,127
0,702
-0,154
10,0
0,130
0,718
-0,144
15,0
0,109
0,602
-0,220
15,0
0,111
0,613
-0,212
30,5
0,067
0,370
-0,432
30,5
0,071
0,392
-0,406
70,0
0,024
0,133
-0,877
70,0
0,024
0,133
-0,877
143

Aneks
Tabela 10.31. Kinetyka inaktywacji cieplnej
α
-amylazy w roztworze
buforowym
20 mM Bis-Tris z dodatkiem 300 mg/cm
3
sorbitolu w temperaturach 62-
68°C
Temperatura 62,0°C
Temperatura 64,0°C
Czas (min)
A
A
/
A
0
log (
A
/
A
0
)
Czas (min)
A
A
/
A
0
log (
A
/
A
0
)
0,0
0,218
1,000
0,000
0,0
0,214
1,000
0,000
20,0
0,092
0,422
-0,375
10,0
0,086
0,409
-0,389
20,0
0,114
0,523
-0,282
10,0
0,088
0,418
-0,379
40,0
0,058
0,266
-0,575
25,0
0,029
0,138
-0,861
40,0
0,059
0,271
-0,568
25,0
0,031
0,147
-0,832
60,3
0,037
0,170
-0,770
18,0
0,045
0,214
-0,670
80,0
0,022
0,101
-0,996
32,0
0,018
0,086
-1,068
80,0
0,022
0,101
-0,996
Temperatura 66,0°C
Temperatura 68,0°C
Czas (min)
A
A
/
A
0
log (
A
/
A
0
)
Czas (min)
A
A
/
A
0
log (
A
/
A
0
)
0,0
0,211
1,000
0,000
0,0
0,198
1,000
0,000
7,5
0,059
0,280
-0,552
1,0
0,134
0,677
-0,170
7,5
0,070
0,333
-0,478
2,5
0,093
0,470
-0,328
15,0
0,023
0,109
-0,962
2,5
0,080
0,404
-0,394
15,0
0,024
0,114
-0,943
5,0
0,051
0,258
-0,589
3,0
0,132
0,627
-0,203
5,0
0,039
0,197
-0,706
11,0
0,037
0,176
-0,755
7,5
0,021
0,106
-0,974
7,5
0,021
0,106
-0,974
144

Aneks
Tabela 10.32. Kinetyka inaktywacji cieplnej
α
-amylazy w roztworze
buforowym
20 mM Bis-Tris z dodatkiem 30 %(v/v) glicerolu w temperaturach 62-68°C
Temperatura 62,0°C
Temperatura 64,0°C
Czas (min)
A
A
/
A
0
log (
A
/
A
0
)
Czas (min)
A
A
/
A
0
log (
A
/
A
0
)
0,0
0,225
1,000
0,000
0,0
0,218
1,000
0,000
40,0
0,111
0,493
-0,307
30,0
0,070
0,322
-0,492
40,0
0,112
0,498
-0,303
60,0
0,033
0,152
-0,819
80,0
0,061
0,271
-0,567
60,0
0,029
0,133
-0,875
80,0
0,047
0,209
-0,680
48,5
0,040
0,184
-0,735
122,0
0,023
0,102
-0,990
48,5
0,045
0,207
-0,684
122,0
0,029
0,129
-0,890
15,0
0,123
0,566
-0,248
160,0
0,021
0,093
-1,030
15,0
0,121
0,556
-0,255
160,0
0,021
0,093
-1,030
Temperatura 66,0°C
Temperatura 68,0°C
Czas (min)
A
A
/
A
0
log (
A
/
A
0
)
Czas (min)
A
A
/
A
0
log (
A
/
A
0
)
0,0
0,221
1,000
0,000
0,0
0,213
1,000
0,000
15,0
0,069
0,312
-0,506
2,5
0,127
0,596
-0,225
15,0
0,072
0,326
-0,487
2,5
0,124
0,582
-0,235
31,0
0,029
0,131
-0,882
5,0
0,076
0,357
-0,448
7,5
0,114
0,516
-0,287
5,0
0,078
0,366
-0,436
38,0
0,020
0,090
-1,043
7,5
0,052
0,244
-0,612
38,0
0,021
0,095
-1,022
7,5
0,057
0,268
-0,573
10,0
0,035
0,164
-0,784
10,0
0,049
0,230
-0,638
145

Aneks
Tabela 10.33. Kinetyka inaktywacji cieplnej
α
-amylazy w roztworze
buforowym
20 mM Bis-Tris z dodatkiem 200 mg/cm
3
trehalozy w temperaturach 62-
68°C
Temperatura 62,0°C
Temperatura 64,0°C
Czas (min)
A
A
/
A
0
log (
A
/
A
0
)
Czas (min)
A
A
/
A
0
log (
A
/
A
0
)
0,0
0,215
1,000
0,000
0,0
0,249
1,000
0,000
7,5
0,126
0,586
-0,232
4,0
0,126
0,506
-0,296
7,5
0,139
0,647
-0,189
10,0
0,052
0,209
-0,680
15,0
0,068
0,316
-0,500
10,0
0,060
0,241
-0,618
15,0
0,068
0,316
-0,500
16,0
0,032
0,129
-0,891
22,5
0,055
0,256
-0,592
16,0
0,032
0,129
-0,891
22,5
0,053
0,247
-0,608
22,0
0,024
0,096
-1,016
30,0
0,042
0,195
-0,709
30,0
0,042
0,195
-0,709
Temperatura 66,0°C
Temperatura 68,0°C
Czas (min)
A
A
/
A
0
log (
A
/
A
0
)
Czas (min)
A
A
/
A
0
log (
A
/
A
0
)
0,0
0,249
1,000
0,000
0,0
0,226
1,000
0,000
2,0
0,144
0,578
-0,238
1,5
0,118
0,522
-0,282
4,0
0,089
0,357
-0,447
3,0
0,067
0,296
-0,528
4,0
0,100
0,402
-0,396
3,0
0,077
0,341
-0,468
8,0
0,038
0,153
-0,816
4,5
0,048
0,212
-0,673
8,0
0,040
0,161
-0,794
6,0
0,032
0,142
-0,849
12,0
0,027
0,108
-0,965
6,0
0,034
0,150
-0,823
146
Aneks
Tabela 10.34. Kinetyka inaktywacji cieplnej
α
-amylazy w roztworze
buforowym
20 mM Bis-Tris z dodatkiem 200 mg/cm
3
sacharozy w temperaturach 62-
68°C
Temperatura 62,0°C
Temperatura 64,0°C
Czas (min)
A
A
/
A
0
log (
A
/
A
0
)
Czas (min)
A
A
/
A
0
log (
A
/
A
0
)
0,0
0,198
1,000
0,000
0,0
0,222
1,000
0,000
30,0
0,118
0,596
-0,225
15,0
0,102
0,460
-0,337
30,0
0,123
0,621
-0,207
34,0
0,046
0,208
-0,683
60,0
0,075
0,379
-0,422
34,0
0,046
0,208
-0,683
60,0
0,080
0,404
-0,394
45,0
0,029
0,131
-0,883
90,0
0,054
0,273
-0,564
25,0
0,063
0,284
-0,546
90,0
0,057
0,288
-0,541
25,0
0,063
0,284
-0,546
120,0
0,036
0,182
-0,740
120,0
0,036
0,182
-0,740
Temperatura 66,0°C
Temperatura 68,0°C
Czas (min)
A
A
/
A
0
log (
A
/
A
0
)
Czas (min)
A
A
/
A
0
log (
A
/
A
0
)
0,0
0,222
1,000
0,000
0,0
0,210
1,000
0,000
10,0
0,077
0,348
-0,459
1,0
0,167
0,795
-0,100
10,0
0,085
0,384
-0,416
1,0
0,166
0,790
-0,102
20,0
0,032
0,144
-0,840
2,5
0,122
0,581
-0,236
20,0
0,035
0,158
-0,801
2,5
0,126
0,600
-0,222
25,0
0,023
0,104
-0,984
7,5
0,054
0,257
-0,590
5,0
0,124
0,560
-0,252
7,5
0,056
0,267
-0,574
11,0
0,033
0,157
-0,804
11,0
0,035
0,167
-0,778
147
Document Outline
- D (min) w temperaturze 68°C
- KATEDRA INŻYNIERII ŻYWNOŚCI I ORGANIZACJI PRODUKCJI
- Praca doktorska
- 1. WSTĘP 1
- 2. PRZEGLĄD LITERATURY 2
- 3. CEL I ZAKRES PRACY 37
- 4. METODYKA BADAŃ 38
- 5. OMÓWIENIE I DYSKUSJA WYNIKÓW 63
- 6. WNIOSKI 109
- 7. STRESZCZENIE 111
- 8. ABSTRACT 114
- 9. SPIS LITERATURY 116
- 10. ANEKS 126
Wyszukiwarka
Podobne podstrony:
Wpływ procesów wytwarzania energii na środowisko przyrodnicze
Wpływ procesu wytwarzania energii na środowisko naturalne, NAUKA, geografia, Geografia(1)
ZAŁĄCZNIKI Wpływ ludzi, sprzętu i techniki na degradacje środowiska naturalnego człowieka ppt
Wpływ procesów wytwarzania energii na środowisko przyrodnicze
31 05 2012 Ochrona środowiska Temat 2 Wpływ ludzi, sprzętu i techniki na degradacje środowiska na
Wpływ parametrów mikrofalowo próżniowego suszenia truskawek na przebieg procesu i skurcz suszarniczy
Wpływ procesu na właściwości kawy zbożowej i jej komponentów 16
wyk, monograficzny10, Wpływ procesów technologicznych i obróbki kulinarnej na jakość oraz wartość bi
WPŁYW PROCESÓW EMOCJONALNYCH NA SPOSTRZEGANIE
Wplyw procesu prazenia na wlasciwosci kawy zbozowej i jej komponentow
Wpływ procesów starzenia na organizm człowieka
Praca wpływ czynników meteorologicznych na organizm
PROCES DOBORU PRACOWNIKÓW NA WYBRANE STANOWISKA, PRACA MAGISTERSKA INŻYNIERSKA DYPLOMOWA !!! PRACE !
wpływ hormonów i gruczołów dokrewnych na skórę- praca kontrolna, kosmetologia
Wyklad tłuszcze jadalne - z podkresleniami, Wpływ procesów technologicznych i obróbki kulinarnej na
Joanna Mazur Łuczak, Mikołaj Jacek Łuczak Wpływ procesu kształcenia japońskich kobiet na ich życie
Socjalizacja w rodzinie procesem formowania dorosłego członka grupy społecznej Jaki wpływ ma wychowa
więcej podobnych podstron