
Ilościowe oznaczenie glikogenu oraz badanie niektórych jego
właściwości
Cel ćwiczenia
Celem ćwiczenia jest zapoznanie się z podstawową wiedzą dotyczącą budowy,
funkcji i właściwości glikogenu jak również poznanie zasad najczęściej stosowanych
metod ilościowego oznaczania zawartości tego polisacharydu.
Wprowadzenie
Budowa glikogenu. Jest to silnie rozgałęziony polisacharyd zwierzęcy,
homopolimer zbudowany z reszt α-D-glukozy połączonych ze sobą wiązaniami α-1,4-
glikozydowymi, a w miejscach rozgałęzień α-1,6-glikozydowymi. Glikogen ma budowę
zbliżoną do składnika skrobi – amylopektyny, ale rozgałęzienia w jego cząsteczce są
liczniejsze i krótsze. Jedno rozgałęzienie przypada zwykle na 10-12 reszt glukozy.
Taka budowa cząsteczki glikogenu sprawia, że rozpuszcza się on lepiej w wodzie niż
amylopektyna. Wielkość cząsteczek glikogenu, jak też liczba i stopień rozgałęzień tego
wielocukru zależą od źródła, z którego został wyizolowany. Masa cząsteczkowa glikogenu
jest różna i waha się w granicach od kilkuset tysięcy do kilku milionów Da (masa
cząsteczkowa glikogenu w mięśniach ok. 1 000 000, a w wątrobie ok. 5 000 000 Da).
Występowanie i funkcje glikogenu
.
Jest to zapasowy polisacharyd odkładany w wątrobie
i w mniejszych ilościach w mięśniach. Zawartość glikogenu jest zależna od stanu
fizjologicznego organizmu, w wątrobie wynosi od 2 do 10%, a w mięśniach od 0,5 do
1,5% tkanki. Ze względu na dużą masę mięśni w porównaniu z masą wątroby w
organizmie przeważa jednak forma mięśniowa tego polisacharydu. Organizm ludzki może
zmagazynować nawet do 450 g glikogenu, z czego jedynie ok. 30 % znajduje się w
wątrobie. W komórce glikogen wraz z większością enzymów niezbędnych do jego syntezy
i degradacji jest zlokalizowany w postaci ziarnistości w cytoplazmie.
Glikogen w wątrobie służy przede wszystkim do utrzymania odpowiedniego poziomu
glukozy we krwi w przerwach pomiędzy posiłkami.
Glikogen w mięśniach stanowi
natomiast rezerwę glukozy wykorzystywanej do syntezy ATP podczas intensywnych
skurczów mięśni i nie bierze udziału w regulacji stężenia cukru we krwi.
Aktywność enzymów uczestniczących w syntezie i rozkładzie glikogenu podlega złożonej
regulacji przez hormony i inne czynniki.
Właściwości fizykochemiczne glikogenu. Podobnie jak pozostałe polisacharydy glikogen
należy do grupy nie zjonizowanych związków polarnych. Jako koloid hydrofilowy
rozpuszcza się w wodzie na zimno dając opalizujący roztwór. Możliwe jest to dzięki
występowaniu w jego cząsteczce licznych grup hydroksylowych, mogących łatwo tworzyć
wiązania wodorowe z cząsteczkami wody. W obecności soli nieorganicznych o znacznych
stężeniach oraz pod wpływem cieczy organicznych mieszających się z wodą glikogen
łatwo ulega wytrąceniu z roztworu. Dodanie do roztworu glikogenu soli obojętnej dobrze
zdysocjowanej, np. siarczanu amonowego lub chlorku sodowego, powoduje rozerwanie
wiązań wodorowych między grupami –OH polisacharydu a cząsteczkami wody
(dehydratacja), a samorzutnie tworzące się wewnątrz- i międzycząsteczkowe wiązania
doprowadzają do agregacji cząsteczek glikogenu i wytrącenia asocjatów z roztworu. Pod
wpływem rozpuszczalników organicznych, takich jak aceton czy alkohol, następuje
znaczne zmniejszenie stałej dielektrycznej roztworu (woda – 80, etanol – 24), co w
konsekwencji
również
prowadzi
do
zmniejszenia
stopnia
uwodnienia
grup
hydroksylowych glikogenu i powoduje jego wytrącenie z roztworu. Glikogen z jodem
tworzy kompleks o barwie czerwonobrunatnej. Pozwala to na odróżnienie niektórych
polisacharydów (glikogen, skrobia) od innych, gdyż kompleksy takie mogą być
wytwarzane tylko przez cząsteczki o odpowiednio dużych wymiarach i uporządkowanej
strukturze. Boczne łańcuchy rozgałęzionej cząsteczki glikogenu tworzą układy spiralne, w
których środku występują wolne przestrzenie umożliwiające pomieszczenie cząsteczek
jodu. Charakterystyczna absorpcja jodu występuje jedynie w przypadku łańcuchów
zawierających, co najmniej 6 reszt polisacharydowych (jeden skręt spirali). Barwny efekt
jest tym silniejszy, im większe są cząsteczki polisacharydu, a więc im większa jest liczba
cząsteczek jodu związanego w kompleksie. Glikogen, jako polisacharyd nie wykazuje
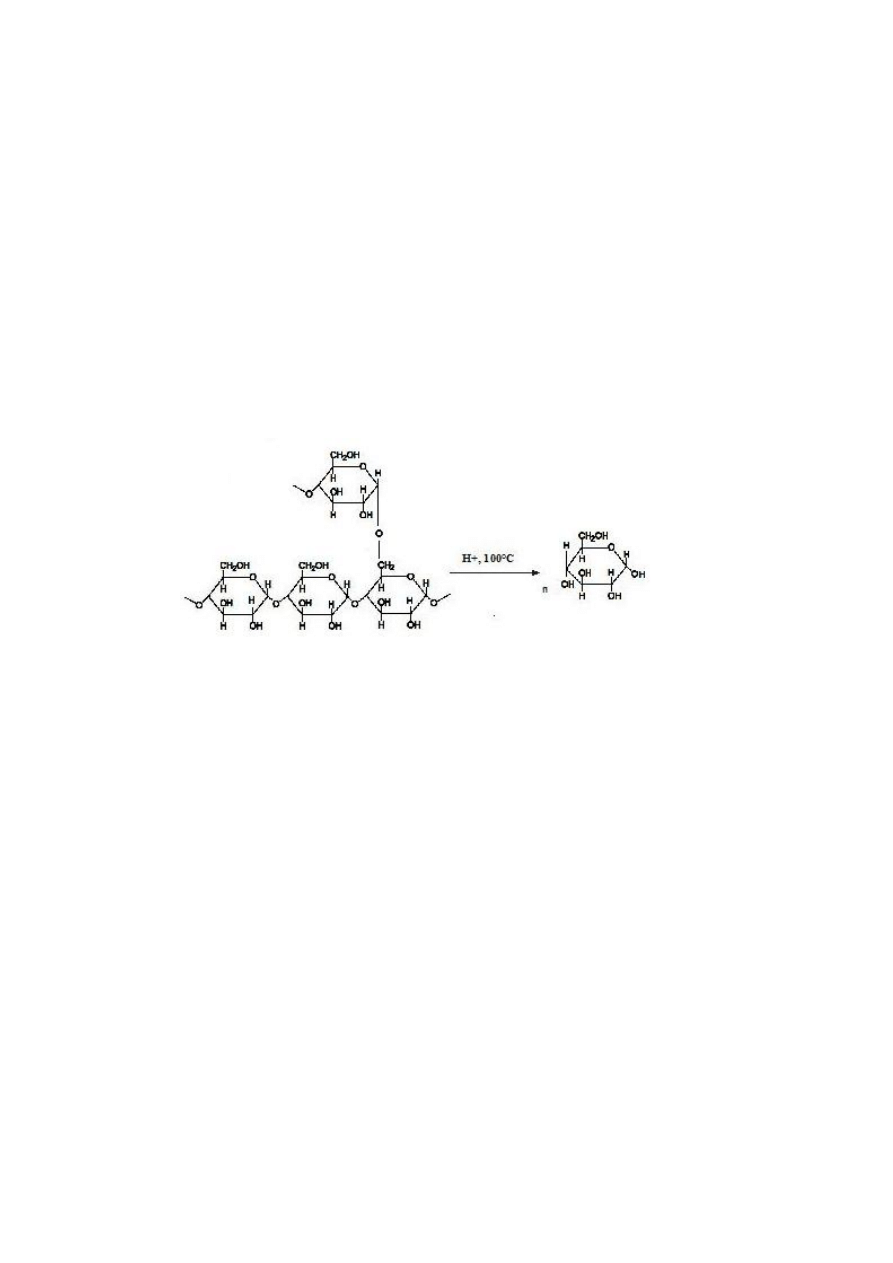
właściwości redukujących. Stosunkowo łatwo ulega on hydrolizie kwasowej oraz
enzymatycznej z udziałem amylaz. Obecność uwolnionych w wyniku hydrolizy cukrów
redukujących stanowi podstawę najczęściej stosowanych metod oznaczeń ilościowych i
jakościowych tego polisacharydu.
Rys. 1. Hydroliza kwasowa glikogenu
Zasada metody Somogyi i Nelsona (punkt A wykonania ćwiczenia).
G
lukoza redukuje w środowisku alkalicznym w obecności winianu sodowopotasowego
jony Cu
2+
do Cu
+
. Ilość powstałego w reakcji tlenku miedzi (I) oznacza się przy użyciu
kwasu arsenomolibdenowego, który ulega redukcji do błękitu molibdenowego. Natężenie
powstałej niebieskiej barwy produktu jest proporcjonalne do ilości wytworzonego Cu
2
O a
tym samym do ilości powstałej podczas hydrolizy glikogenu glukozy.
Zasada metody Benedicta (punkt B wykonania ćwiczenia). W środowisku alkalicznym
pod wpływem glukozy jony miedzi (II) ulegają redukcji do Cu(I) i z roztworu wypada
żółty, pomarańczowy lub ceglastoczerwony osad tlenku miedzi(I). Z barwy i ilości osadu
można w przybliżeniu ocenić stężenie sacharydu w badanym roztworze.
Odczynniki
1. Roztwór glikogenu o stężeniu 2 mg/1 ml.
2. Roztwór glikogenu o stężeniu 5 mg/1 ml.
3. Jod w jodku potasowym (10 g KI + 2,5 g I
2
w 1 l).
4. 2-molowy kwas solny.
5. 1-molowy wodorotlenek sodowy.
6. 2-molowy wodorotlenek sodowy.

7. Odczynnik Benedicta: 173 g cytrynianu sodowego i 100 g węglanu sodowego
rozpuścić w 800 ml ciepłej wody , uzupełnić wodą do 850 ml. 17,3 g siarczanu
miedziowego rozpuścić w 100 ml wody do uprzednio przygotowanego roztworu, całość
uzupełnić wodą do 1000 ml.
8. Roztwór glukoamylazy (stężenie preparatu enzymatycznego jest dobrane do
warunków ćwiczenia)
9. Winian sodowopotasowy, roztwór alkaliczny: W kolbie miarowej na 1 l
rozpuścić w wodzie destylowanej 25 g bezwodnego węglanu sodowego, 25 g winianu
sodowopotasowego, 20 g kwaśnego węglanu sodowego i 200 g bezwodnego siarczanu
sodowego. Uzupełnić kolbę wodą destylowaną do kreski.
10. Siarczan miedziowy (CuSO
4
5 H
2
O) roztwór o stężeniu: 15 g/100 ml, na każde 100 ml
tego roztworu dodać 1 kroplę stężonego H
2
SO
4
.
11. Odczynnik miedziowy. Zmieszać 25 ml odczynnika nr 9 z 1 ml odczynnika nr 10.
12. Odczynnik arsenomolibdenowy: 25 g czterowodnego molibdenianu amonowego
rozpuścić w 450 ml wody destylowanej i ostrożnie dodać 21 ml stężonego H
2
SO
4
.
Oddzielnie rozpuścić 3 g kwaśnego arsenianu sodowego siedmiowodnego (Na
2
HAsO
4
7H
2
O) w 25 ml wody destylowanej i przelać oba roztwory do kolby miarowej na 500 ml.
Uzupełniać do kreski wodą destylowaną.
Wykonanie
A) Oznaczanie stężenia glikogenu metodą Somogyi i Nelsona
Otrzymany w kolbie miarowej na 10 ml roztwór glikogenu (1) dopełnić wodą
destylowaną do kreski i wymieszać. Pobrać z kolby 2 ml roztworu do probówki, dodać 5
ml 2-molowego kwasu solnego (4), wymieszać i prowadzić hydrolizę glikogenu we
wrzącej łaźni wodnej przez 30 minut. Następnie próbę ochłodzić (np. wstawić probówkę
do zimnej wody), zobojętnić hydrolizat przez dodanie 5 ml 2-molowego wodorotlenku
sodowego (6) i wymieszać. Do 2 probówek pobrać po 1 ml uzyskanego hydrolizatu.
Przygotować także próbę kontrolną, w której należy zmieszać 0,5 ml 2-molowego kwasu
solnego (4) i 0,5 ml 2-molowego wodorotlenku sodowego (6). Do wszystkich trzech
probówek odmierzyć po 1 ml odczynnika Nelsona (11), zamieszać i wstawić do wrzącej
łaźni wodnej dokładnie na 10 minut. Próby ochłodzić i odmierzyć do nich po 1 ml
odczynnika arsenomolibdenowego (12), dokładnie wymieszać aż do rozpuszczenia osadu
tlenku miedzi (I) i ustania wydzielania pęcherzyków gazu (CO
2
). Próby rozcieńczyć
dodając po 7 ml wody destylowanej, wymieszać i po 10 minutach zmierzyć w fotometrze
absorbancję przy długości fali 520 nm wobec próby kontrolnej. Odczyty z aparatu uśrednić
a następnie odczytać z wcześniej przygotowanej krzywej wzorcowej odpowiadające im
stężenie glukozy.
B) Badanie wybranych właściwości glikogenu
1. Stopniowa hydroliza kwasowa glikogenu.
Przygotować 8 ponumerowanych probówek. Do 4 z nich odmierzyć po 1 ml 1-molowego
wodorotlenku sodowego (5), a do 4 pozostałych po 1 ml wody. Ponadto przygotować
próbę do hydrolizy glikogenu: do kolejnej probówki odmierzyć 10 ml roztworu glikogenu
(2) i 5 ml 2-molowego kwasu solnego (4), wymieszać i pobrać natychmiast po 1 ml
mieszaniny do pierwszej probówki serii z 1-molowym wodorotlenkiem sodowym i z wodą
(próba w czasie zerowym). Pozostałą część próby do hydrolizy umieścić we wrzącej łaźni
wodnej i po 5, 10 i 15 minutach pobierać po 1 ml mieszaniny do kolejnych probówek serii
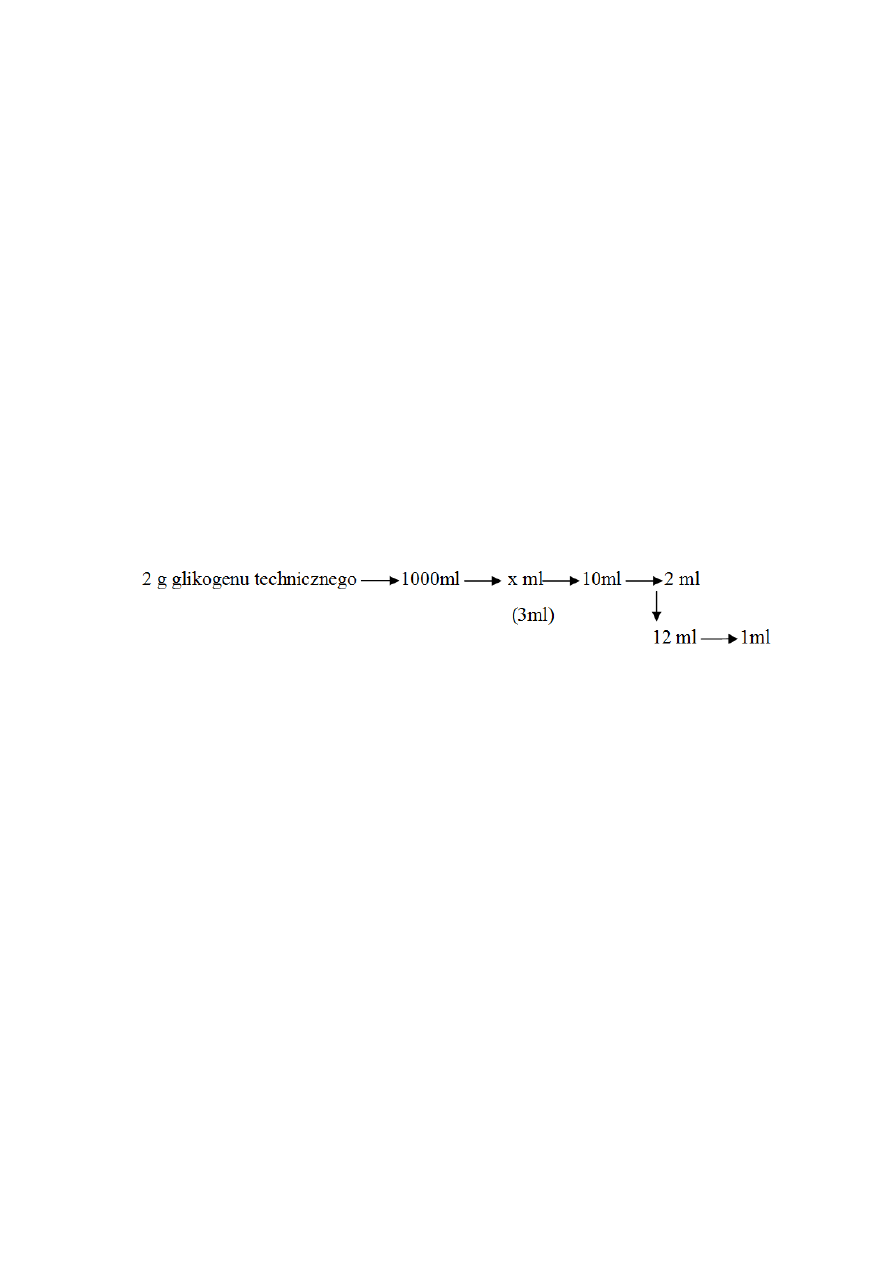
z wodorotlenkiem sodowym i z wodą. Po zakończeniu doświadczenia do probówek
zawierających wodorotlenek sodowy odmierzyć po 1 ml odczynnika Benedicta (7),
wymieszać i wstawić na 2 min do wrzącej łaźni wodnej. Roztwory w probówkach serii z
wodą natychmiast po pobraniu próby potraktować 2 kroplami roztworu jodu w jodku
potasowym (3).
2. Hydroliza enzymatyczna glikogenu. Do probówki odmierzyć 2 ml glikogenu (2) i 1 ml
glukoamylazy (8), wymieszać i wstawić do łaźni wodnej o temp. 40°C na 10 minut.
Reakcję przerwać przez zakwaszenie 0,2 ml 2 M kwasem solnym (4), wymieszać.
Przygotować dwie probówki , do jednej z nich pobrać 1 ml tej mieszaniny, do drugiej 1 ml
glikogenu (2), do obu dodać po 1 ml odczynnika Benedicta (7), wymieszać i ogrzewać we
wrzącej łaźni wodnej przez 2 minuty.
Opracowanie wyników
A. W celu obliczenia czystości otrzymanego roztworu glikogenu należy na
podstawie średniej wartości absorbancji prób pełnych dokonać odczytu stężenia glukozy z
krzywej wzorcowej i uwzględnić podany podczas zajęć sposób rozcieńczenia preparatu
glikogenu. W obliczeniach należy także uwzględnić współczynnik 0,9 pozwalający na
przeliczenie stężenie glukozy na stężenie glikogenu.
Przykładowe obliczenia na podstawie przedstawionego poniżej schematu rozcieńczenia
zadania kontrolnego:
2 g glikogenu technicznego (zawierającego zanieczyszczenia niecukrowe) rozpuszczono
w 1000 ml wody destylowanej; z tak przygotowanego roztworu studenci otrzymali w
formie zadania kontrolnego różne jego objętości (objętość podaje prowadzący ćwiczenia
po przyjęciu wyników absorbancji, w przedstawionym przykładzie 3ml) w kolbce
miarowej na 10ml, uzupełnionej do kreski wodą destylowaną.
Do hydrolizy pobrano 2 ml z kolby na 10 ml, po neutralizacji pH otrzymano mieszaninę o
objętości 12 ml, z której pobrano 1 ml do oznaczenia zawartości glukozy.
Przyjmijmy, ze średnia wartość absorbancji dla prób pełnych wyniosła 0,240 a odczytana
wartość z krzywej wzorcowej 90 μg glukozy, co po uwzględnieniu współczynnika 0,9 daje
nam 81 μg.
Z analizy schematu rozcieńczenia otrzymanej próby wynika, skoro ze w 1 ml roztworu
pobranego do oznaczenia jest 81 μg glukozy to w 12 ml 960 μg, tyle samo glukozy jest w 2
ml pobranego z kolby na 10 ml roztworu. W kolbie miarowej (10 ml) jest 4,8 mg glukozy i
tyle samo w 3 ml wydanego zadania kontrolnego, zatem w 1000 ml:
3 ml –4,8 mg
1000 ml –x mg ; x = 1800 mg =1,6 g, co odpowiada zawartości glikogenu w roztworze
glikogenu technicznego. W 1000 ml rozpuszczono 2 g glikogenu technicznego, więc:
2,0 g– 100%
1,6 g – x%
Obliczony procent czystości glikogenu w jego preparacie handlowym wynosi 80%.
B. 1. Należy dokonać obserwacji powstałego osadu tlenku miedzi (I) w próbach, w których
przeprowadzono reakcję z odczynnikiem Benedicta. W próbach z wodą obserwować

stopniowy zanik barwy kompleksu glikogenu z jodem. Dla ułatwienia opisu wyników
można przyjąć kilkustopniową skalę barwy i względem niej odpowiednio uszeregować
próby.
B. 2. Dokonać obserwacji prób po reakcji z odczynnikiem Benedicta. Zapisać i wyjaśnić
potencjalne różnice między nimi.
Pytania
1. Do jakiej grupy związków należy glikogen? Omów występowanie i funkcje glikogenu.
2. Napisz fragment cząsteczki glikogenu. Wskaż i nazwij występujące tam wiązania.
3. W jaki sposób można dokonać hydrolizy glikogenu?
4. W jaki sposób można ilościowo oznaczyć glikogen? Podaj zasadę stosowanej na
ćwiczeniach metody.
5. Omów sposoby wytrącania glikogenu z roztworu.
6. Czy jod w kompleksie z glikogenem zmienia swoją wartościowość? Uzasadnij
odpowiedź.
7. Uzasadnij stopniową zmianę barwy roztworu glikogenu z odczynnikiem Benedicta i z
jodem w miarę reakcji: a) z kwasem solnym, b) z preparatem glukoamylazy.
Literatura:
M. Somogyi. Notes on sugar determination. The Journal of Biological Chemistry,
Baltimore, 195: 19-23 (1952)
N. Nelson. A photometric adaptation of the Somogyi method for the determination of
glucose. The Journal of Biological Chemistry, Baltimore, 153: 375-381 (1944)
Krishnaveni, S., Theymoli Balasubramanian and Sadasivam, S. Sugar distribution in sweet
stalk Sorghum. Food Chemistry 15: 229-232 (1984).

Wyszukiwarka
Podobne podstrony:
Ilościowe oznaczenie glikogenu oraz badanie niektórych jego właściwości
2012 10 21 Za kradzież w hotelu konsekwencje ponosi jego właściciel
pyt, ZM 10. Omowic zrodla informacji wykorzystywane w badaniach marketingowych, Omówić źródła inform
Witaminy. hormony, barwniki, ILOŚCIOWE OZNACZANIE CHLOROFILI I KAROTENOIDÓW
Pracodawcy należy wskazać uchybienia oraz sposób realizaji jego obowiazków
Zaklad pracy oraz jego właściciele i pracownicy, Zarządzanie, poczta itp
10 Klasyfikacja osnów realizacyjnych oraz osnów budowlano montażowych
Skalowanie termopary, oraz badanie temperatury krzepnięcia stopu2, Marcin Meller
Dz U 96 60 282 szczegółowa treść świadectwa pracy oraz sposobu i trybu jego wydawania
Metody ilościowego oznaczania drobnoustrojów, Studia - materiały, semestr 4, Mikrobiologia żywności
budowa roślin okrytonasiennych oraz funkcja niektórych organów, biologia, Biologia roślin
Diagnoza SNS oraz badanie gotow Nieznany
25 Wykonawstwo budowli ziemnych oraz badania odbiorowe
Ilościowe oznaczanie miedzi metodą jodometryczną
Instrukcja F, Poniedziałek - Materiały wiążące i betony, 10. (08.12.2011) Ćw F - Badanie właściwości
ILOŚCIOWE OZNACZENIE ZAWARTOŚCI WITAMINY C METODĄ WOLTAMPEROMETRII CYKLICZNEJ
10.6 inne, 10.6, WYZNACZANIE ΔG, ΔH ORAZ ΔS REAKCJI CHEMICZNEJ
więcej podobnych podstron