KOD ZDAJĄCEGO
MCH-W2D1P-021
EGZAMIN MATURALNY
Z CHEMII
Arkusz II
Czas pracy 120 minut
Instrukcja dla zdającego
1. Proszę sprawdzić, czy arkusz egzaminacyjny zawiera 12 stron.
Ewentualny brak należy zgłosić przewodniczącemu zespołu
nadzorującego egzamin.
2. Proszę uważnie czytać wszystkie polecenia i informacje do
zadań.
3. Rozwiązania i odpowiedzi należy zapisać czytelnie w miejscu
na to przeznaczonym przy każdym zadaniu.
4. W rozwiązaniach zadań rachunkowych trzeba przedstawić tok
rozumowania prowadzący do ostatecznego wyniku oraz
pamiętać o jednostkach.
5. W trakcie obliczeń można korzystać z kalkulatora.
6. Proszę pisać tylko w kolorze niebieskim lub czarnym; nie pisać
ołówkiem.
7. Nie wolno używać korektora.
8. Błędne zapisy trzeba wyraźnie przekreślić.
9. Brudnopis nie będzie oceniany.
10. Obok każdego zadania podana jest maksymalna liczba
punktów, którą można uzyskać za jego poprawne rozwiązanie.
11. Do ostatniej kartki arkusza dołączona jest karta odpowiedzi,
którą wypełnia egzaminator.
Życzymy powodzenia !
ARKUSZ II
STYCZEŃ
ROK 2003
Za rozwiązanie
wszystkich zadań
można otrzymać
łącznie 60 punktów
(Wpisuje zdający przed rozpoczęciem pracy)
PESEL ZDAJĄCEGO
Miejsce
na naklejkę
z kodem
(Wpisuje zdający przed
rozpoczęciem pracy)
2
Egzamin maturalny z chemii
Arkusz II
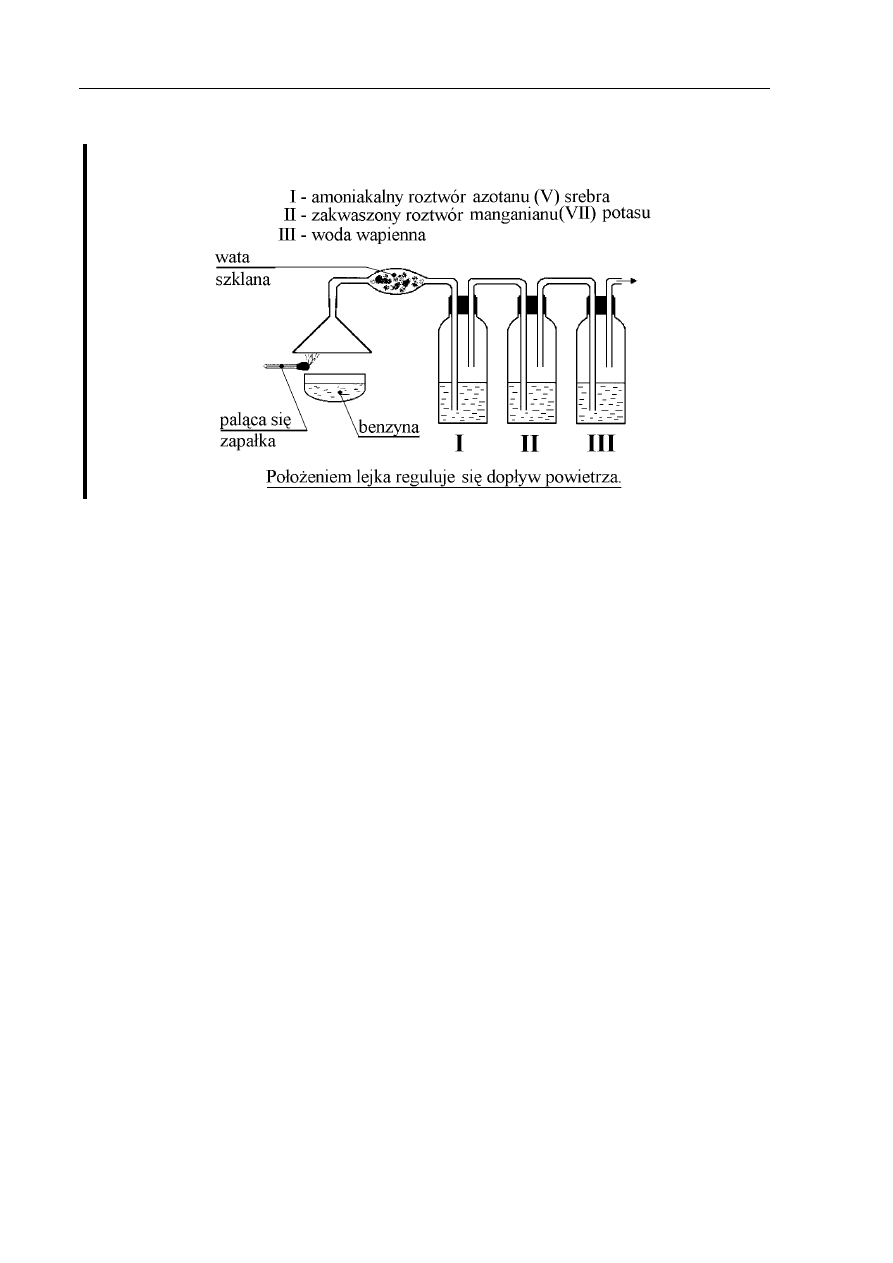
Informacje do zadań 22., 23., 24., 25.
Przeprowadzono następujące doświadczenie:
Zadanie 22. (3 pkt)
Napisz równania reakcji spalania jednego, dowolnego składnika benzyny przy różnym
dopływie powietrza.
.......................................................................................................................................................
.......................................................................................................................................................
.......................................................................................................................................................
Zadanie 23. (1 pkt)
Który z produktów spalania benzyny przereaguje z wodą wapienną? Odpowiedź uzasadnij
odpowiednim równaniem reakcji chemicznej.
.......................................................................................................................................................
Zadanie 24. (2 pkt)
Który z produktów spalania benzyny ma właściwości trujące i dlaczego?
.......................................................................................................................................................
.......................................................................................................................................................
.......................................................................................................................................................

Egzamin maturalny z chemii
Arkusz II
3
Zadanie 25. (1 pkt)
Jaką rolę w opisywanym doświadczeniu pełnią amoniakalny roztwór azotanu(V) srebra
i roztwór manganianu(VII) potasu?
.......................................................................................................................................................
.......................................................................................................................................................
.......................................................................................................................................................
Zadanie 26. (5 pkt)
Oblicz rzeczywisty wzór węglowodoru, który w warunkach normalnych jest gazem o gęstości
2,59 g/dm
3
i zawiera 82,8% węgla.
.......................................................................................................................................................
.......................................................................................................................................................
.......................................................................................................................................................
.......................................................................................................................................................
.......................................................................................................................................................
.......................................................................................................................................................
.......................................................................................................................................................
Zadanie 27. (1 pkt)
Wyjaśnij, dlaczego wodą nie wolno gasić palącej się benzyny.
.......................................................................................................................................................
.......................................................................................................................................................
.......................................................................................................................................................
.......................................................................................................................................................

4
Egzamin maturalny z chemii
Arkusz II
Zadanie 28. (2 pkt)
Zmieszano roztwory zawierające jednakowe ilości moli siarczanu(VI) potasu i azotanu(V)
ołowiu(II). Uzupełnij tekst, który opisuje to doświadczenie.
a) Po reakcji w układzie znajdowały się jony:
.......................................................................................................................................................
.......................................................................................................................................................
b) Odczyn roztworu był:
.......................................................................................................................................................
Zadanie 29. (4 pkt)
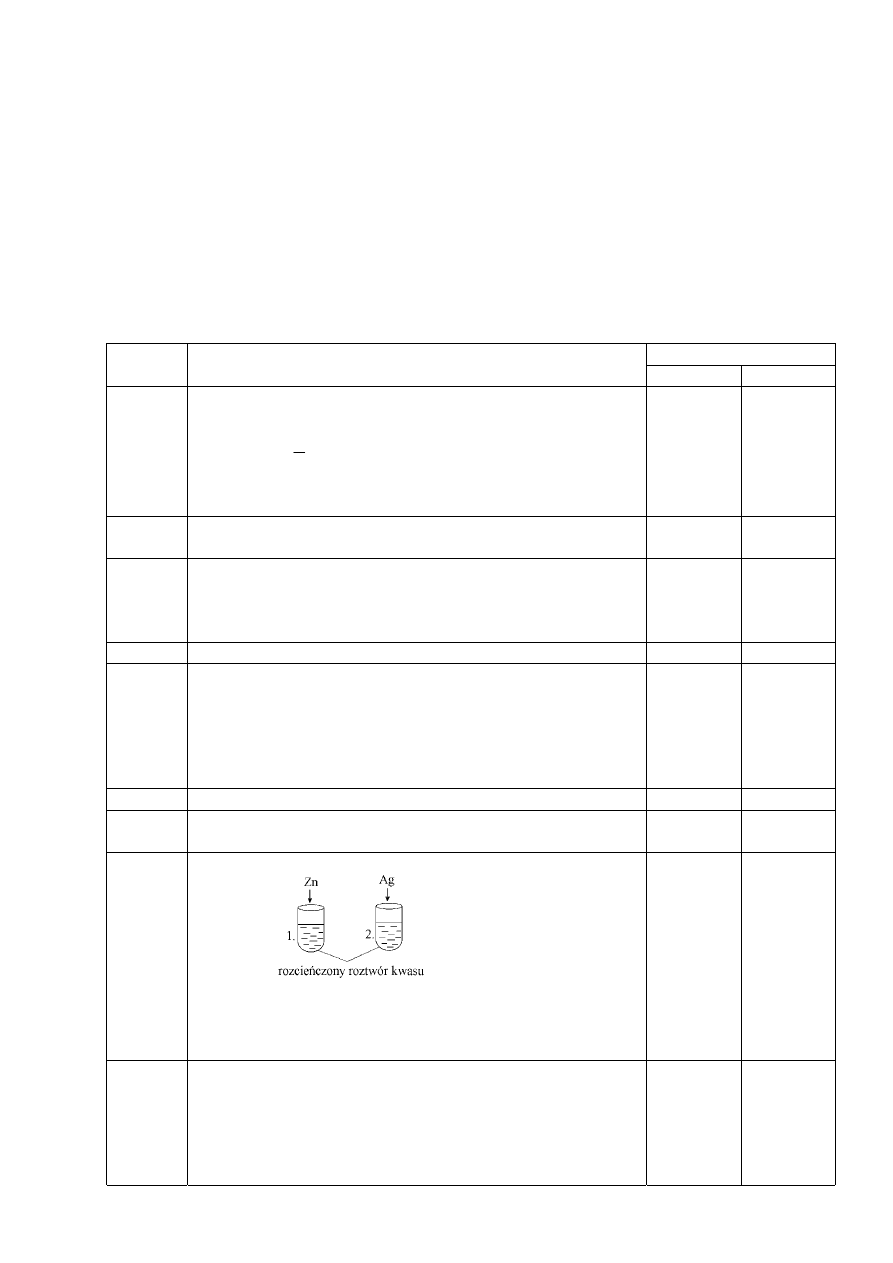
Zaprojektuj doświadczenie, aby wykazać, że cynk jest bardziej aktywny od wodoru, a srebro
mniej aktywne od wodoru.
a) Narysuj schemat doświadczenia lub podaj słowny opis.
.......................................................................................................................................................
b) Zapisz
obserwacje.
.......................................................................................................................................................
.......................................................................................................................................................
.......................................................................................................................................................
.......................................................................................................................................................

Egzamin maturalny z chemii
Arkusz II
5
Zadanie 30. (4 pkt)
Związek o wzorze sumarycznym C
3
H
6
O ma dwa izomery.
Jeden z nich łatwo się utlenia, natomiast obydwa ulegają redukcji.
a) Napisz równania redukcji tych związków za pomocą wodoru.
I ……………………………………………………………………………………………….
II ……………………………………………………………………………………………….
b) Podaj nazwy systematyczne powstałych produktów reakcji redukcji:
I ……………………………………………………………………………………………….
II ……………………………………………………………………………………………….
Zadanie 31. (4 pkt)
Przeprowadzono hydrolizę tristearynianu gliceryny w środowisku zasadowym.
a) Napisz równanie hydrolizy tego tłuszczu.
b) Zaproponuj doświadczenie, jakie wykonasz, aby wykryć jeden, wybrany przez Ciebie
produkt hydrolizy.
…………………………………………………………………………………………………...
…………………………………………………………………………………………………...
…………………………………………………………………………………………………...
c) Jaki będzie wynik Twojego doświadczenia ?
…………………………………………………………………………………………………...
………………………………………………………………………………………………..

6
Egzamin maturalny z chemii
Arkusz II
Zadanie 32. (3 pkt)
Podczas produkcji miedzi metodą hutniczą emitowane są do atmosfery gazy spalinowe,
w skład których wchodzą najczęściej CO
2
i SO
2
.
a) Zaproponuj odpowiedni tlenek, który zastosowany w filtrze pochłonie CO
2
i SO
2
. Podaj
wzór tego tlenku.
…………………………………………………………………………………………………...
b) Napisz równanie reakcji zachodzących podczas procesu pochłaniania tlenków:
- węgla(IV) ………………………………………………………………………………….
-
siarki(IV) ………………………………………………………………………………….
Zadanie 33. (6 pkt)
Podczas reakcji mieszaniny sproszkowanej miedzi i żelaza ze stężonym kwasem
azotowym(V) wydzieliło się 4,48 dm
3
gazu, a podczas reakcji tej mieszaniny z kwasem
solnym otrzymano 2,24 dm
3
gazu (objętości mierzono w warunkach normalnych).
a) Podaj, które reakcje nie zachodzą.
…………………………………………………………………………………………………...
…………………………………………………………………………………………………...
b) Podaj równania zachodzących reakcji w interpretacji jonowej.
…………………………………………………………………………………………………...
…………………………………………………………………………………………………...
c) Oblicz masę miedzi i masę żelaza w mieszaninie.
…………………………………………………………………………………………………...
…………………………………………………………………………………………………...
…………………………………………………………………………………………………...
…………………………………………………………………………………………………...
Zadanie 34. (1 pkt)
Amoniak wg teorii dysocjacji Bröensteda jest zasadą, bo przyjmuje proton zgodnie z reakcją:
NH
3
+ H
2
O → NH
4
+
+ OH¯
Wyjaśnij, dlaczego amoniak może przyjąć proton?
………………………………………………………………………………………………..
Egzamin maturalny z chemii
Arkusz II
7
Zadanie 35. (1 pkt)
Wiązanie wodorowe występujące między cząsteczkami alkoholi jest odpowiedzialne za:
A. ich niską temperaturę topnienia,
B. ich wysoką temperaturę wrzenia,
C. ich słabą rozpuszczalność w wodzie,
D. ich dużą aktywność chemiczną.
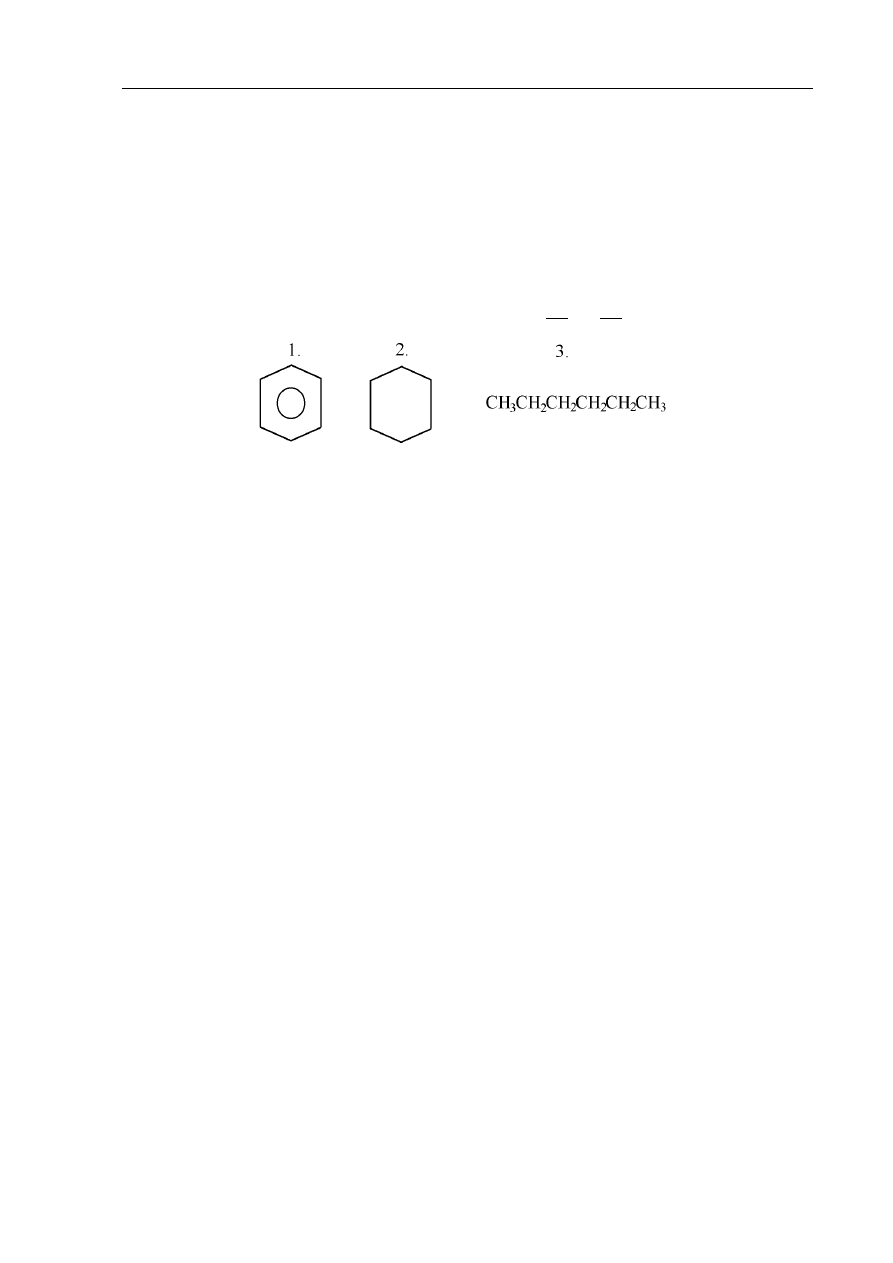
Zadanie 36. (3 pkt)
Skomentuj zdania dotyczące związków 1, 2 i 3 wyrazami tak lub nie.
a) Związki te są izomerami ……………...
b) Tylko związek oznaczony numerem 1 odbarwia wodę bromową ……………..
c) Każdy z nich można spalić całkowicie, a w wyniku spalania 1 mola każdego z nich
otrzymamy
taką samą liczbę gramów wody ……………..
Zadanie 37. (3 pkt)
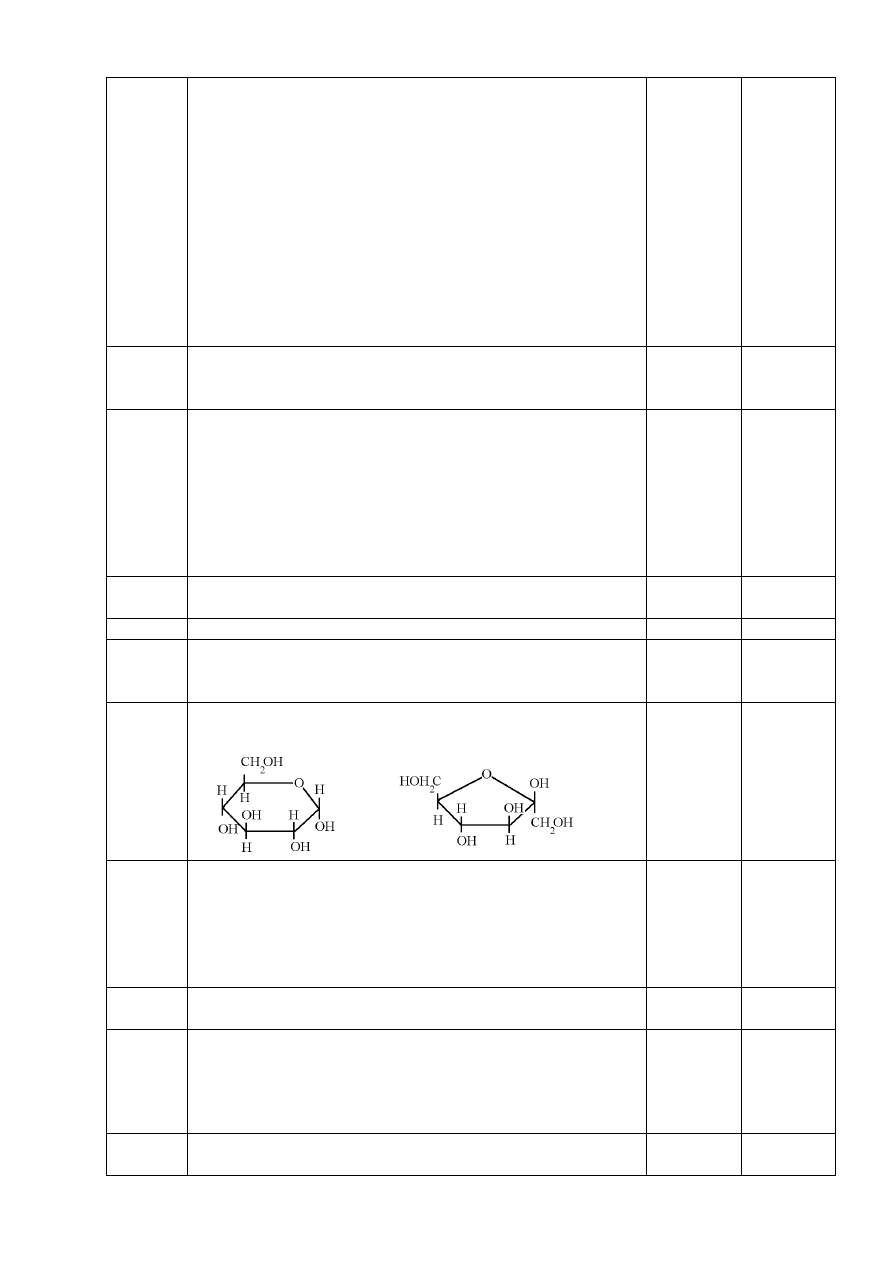
Pewien związek organiczny:
-
nie daje próby Tollensa,
- ulega
hydrolizie,
- powstały w wyniku hydrolizy produkt daje pozytywny wynik próby Tollensa,
-
przed i po hydrolizie związek ten ma słodki smak.
a) Napisz wzór sumaryczny tego związku.
…………………………………………………………………………………………………...
b) Napisz wzory taflowe (w projekcji Hawortha) produktów hydrolizy tego związku.

8
Egzamin maturalny z chemii
Arkusz II
Zadanie 38. (5 pkt)
Badany pierwiastek jest mieszaniną dwóch izotopów. Jądro lżejszego izotopu składa się ze
154 cząstek elementarnych, w tym z 90 neutronów, i jego zawartość w mieszaninie wynosi
51,35% wszystkich atomów. Natomiast jądro drugiego izotopu zbudowane jest ze 156 cząstek
elementarnych.
a) Oblicz
masę atomową badanego pierwiastka.
b) Podaj
liczbę atomową oraz liczby masowe obu izotopów.
…………………………………………………………………………………………………...
…………………………………………………………………………………………………...
…………………………………………………………………………………………………...
c) Jaki to pierwiastek?
…………………………………………………………………………………………………...
Zadanie 39. (1 pkt)
Wodorotlenek żelaza (III) można otrzymać w reakcji:
A. żelaza z zasadą sodową,
B. chlorku żelaza (II) z zasadą sodową,
C. chlorku żelaza (III) z zasadą sodową,
D. wodorotlenku żelaza (II) z zasadą sodową.
Zadanie 40. (4 pkt)
W wyniku elektrolizy wodnego roztworu substancji X na katodzie i anodzie wydzieliły się
gazy w stosunku objętościowym 1 : 1, pH przed elektrolizą wynosiło 7, a po elektrolizie
pH > 7.
a) Substancją X może być:
…………………………………………………………………………………………………...
Egzamin maturalny z chemii
Arkusz II
9
b) Jaki
ładunek przepłynął przez elektrolizer, jeżeli wydzieliło się łącznie 448 cm
3
gazów
odmierzonych w warunkach normalnych ? (F = 96500 C)
…………………………………………………………………………………………………...
…………………………………………………………………………………………………...
…………………………………………………………………………………………………...
c) Wyjaśnij zmianę pH po elektrolizie.
…………………………………………………………………………………………………...
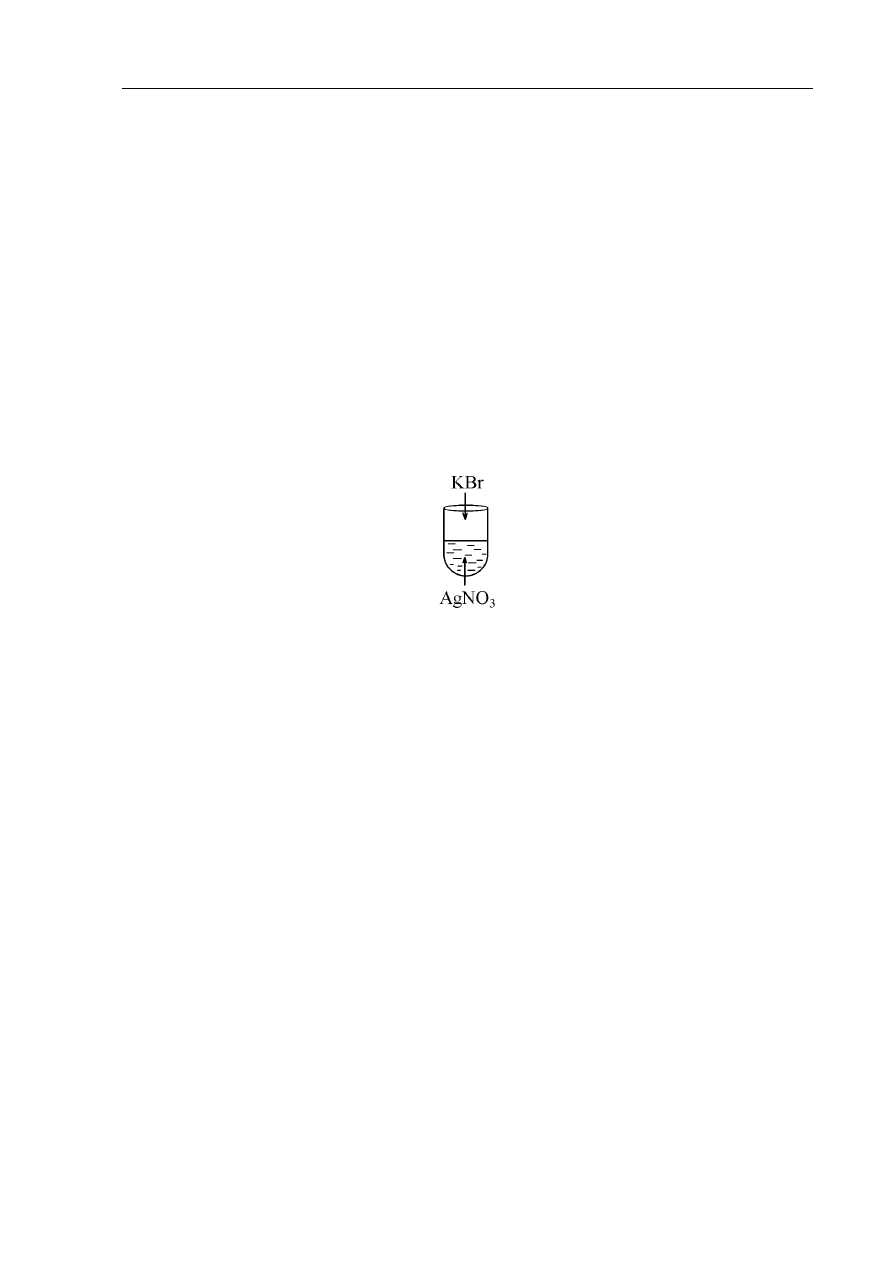
Zadanie 41. (3 pkt)
Przeprowadzono następujące doświadczenie:
W wyniku doświadczenia w probówce wytrącił się kremowy osad.
a) Podaj, w formie skróconej, jonowe równanie reakcji, która zaszła.
…………………………………………………………………………………………………...
b) Oblicz % wydajność tej reakcji, jeżeli roztwór zawierał 42,5g azotanu(V)srebra
a wytrącony osad ważył 38g.
Obliczenia:
…………………………………………………………………………………………………...
…………………………………………………………………………………………………...
…………………………………………………………………………………………………...

10
Egzamin maturalny z chemii
Arkusz II
Zadanie 42. (2 pkt)
Oblicz rozpuszczalność substancji w temperaturze 20
0
C, jeżeli stężenie procentowe
nasyconego roztworu w tej temperaturze wynosi 20%.
.......................................................................................................................................................
.......................................................................................................................................................
.......................................................................................................................................................
.......................................................................................................................................................
.......................................................................................................................................................
Zadanie 43. (1 pkt)
Z podanych niżej opisów właściwości wybierz ten, który najlepiej uzasadnia różnice gęstości
wody i tlenu w tych samych warunkach ciśnienia i temperatury.
A. Masy cząsteczkowe obu substancji są różne.
B. W cząsteczkach wody występują wiązania kowalencyjne spolaryzowane,
a w cząsteczkach tlenu wiązania kowalencyjne.
C. Cząsteczki tlenu nie wykazują momentu dipolowego, a między cząsteczkami wody
możliwe jest utworzenie wiązań wodorowych.
D. Za gęstości obu substancji odpowiedzialne są podwójne wiązania tlen–tlen
w cząsteczkach tlenu i spolaryzowane wiązania wodór–tlen w cząsteczkach wody.
Egzamin maturalny z chemii – styczeń 2003 r.
ARKUSZ II
MODEL ODPOWIEDZI I SCHEMAT OCENIANIA
• Zdający otrzymuje punkty za całkowicie prawidłową odpowiedź.
• Gdy do jednego polecenia są dwie odpowiedzi (jedna prawidłowa, druga
nieprawidłowa) to zdający nie otrzymuje punktów.
• Jeżeli polecenie brzmi: Napisz równanie reakcji..., to w odpowiedzi zdający
powinien napisać równanie reakcji chemicznej, a nie jej schemat.
• Brak współczynników w równaniu reakcji chemicznej obniża punktację o 1 punkt,
jeżeli punktacja za równanie jest równa 2 pkt.
• Brak jednostek przy rozwiązaniu zadań rachunkowych obniża punktację o 1 punkt.
• Całkowicie poprawne rozwiązanie zadań rachunkowych, uwzględniające inny tok
rozumowania niż w podanym opisie, należy ocenić pełną liczbą punktów.
Punktacja
Nr
zadania
Przewidywana odpowiedź
za czynność sumarycznie
22. Benzyna - mieszanina alkanów od 5 do 12 atomów węgla,
np. C
5
H
12
+ 8 O
2
→ 5 CO
2
+ 6 H
2
O,
C
5
H
12
+ 5
2
1
O
2
→ 5 CO + 6 H
2
O,
C
5
H
12
+ 3 O
2
→ 5 C + 6 H
2
O.
(za każdą prawidłowo zapisaną reakcję spalania 1 p.)
1
1
1
3
23. CO
2
+ Ca(OH)
2
→ ↓CaCO
3
+ H
2
O
lub 2CO
2
+ Ca(OH)
2
→ Ca(HCO
3
)
2
1
1
24. CO
uniemożliwia przenoszenie tlenu, lub ma wolną parę
elektronową na atomie węgla, lub łączy się z hemoglobiną
krwi lub tworzy methemoglobinę.
1
1
2
25. są utleniaczami (utleniają różne produkty spalania benzyny).
1
1
26. - obliczenie masy 1 mola badanego gazu: 58 g
- obliczenie masy węgla w 1 molu związku: 48 g
- obliczenie liczby moli węgla: 4
- obliczenie liczby moli wodoru: 10
- wyznaczenie wzoru: C
4
H
10
lub inne poprawne rozwiązanie
1
1
1
1
1
5
27. benzyna jest lżejsza od wody
1
1
28. a) K
+
, NO
3
–
,
b) obojętny.
1
1
2
29. a) np.:
lub opis słowny:
b) w probówce I wydziela się gaz, w probówce II brak
objawów reakcji.
1
1
1
1
4
30. wzory dwóch izomerów
zapis równań reakcji:
I: CH
3
CH
2
CHO + H
2
→ CH
3
CH
2
CH
2
OH,
II: CH
3
COCH
3
+ H
2
→ CH
3
CHOHCH
3
.
podanie obu nazw:
I: propan –1–ol (1-propanol), II: propan –2–ol (2-propanol)
1
1
1
1
4
Strona 1 z 3
Egzamin maturalny z chemii – styczeń 2003 r.
31. a) CH
2
OCOC
17
H
35
CH
2
OH
│ │
CHOCOC
17
H
35
+ 3 NaOH → CHOH + 3 C
17
H
35
COONa,
│ │
CH
2
OCOC
17
H
35
CH
2
OH
- prawidłowe wzory substratów
- prawidłowe wzory produktów
b) projekt doświadczenia uwzględniający np.: reakcję
gliceryny z wodorotlenkiem miedzi(II),
- badanie zachowania mydła w wodzie,
- badanie odczynu wodnego roztworu mydła lub gliceryny.
c) poprawne obserwacje lub wnioski odpowiednie do projektu
doświadczenia
1
1
1
1
4
32. a) np. CaO
b) CaO + CO
2
→ CaCO
3,
CaO + SO
2
→ CaSO
3
1
1
1
3
33. a) Fe + HNO
3
→ na zimno nie zachodzi (pasywacja)
Cu + HCl → z rozcieńczonym kwasem nie zachodzi,
b) Fe + 2H
+
→ Fe
2+
+ H
2,
Cu + 4H
+
+2NO
3
–
→ Cu
2+
+ 2NO
2
+ 2H
2
O lub pełny zapis
jonowy
c) masa miedzi obliczona zgodnie z przebiegiem reakcji 6,4g,
masa żelaza 5,6g.
1
1
1
1
1
1
6
34. atom azotu posiada wolną parę elektronową (może utworzyć
wiązanie donorowo-akceptorowe)
1
1
35. B
1
1
36. a) nie
b) nie
c) nie
1
1
1
3
37. a) C
12
H
22
O
11
b)
1
1
1
3
38. a) (51,35% x 154+ 48,65% x 156): 100%
≈ 155 u,
b) liczba atomowa – 64,
izotop X
1
liczba masowa – 154,
izotop X
2
liczba masowa - 156,
c) gadolin
1
1
1
1
1
5
39. C
1
1
40. a) np. chlorek sodu NaCl,
b) obliczenie liczby moli lub objętości gazu wydzielonego
na jednej elektrodzie (224 cm
3
)
obliczenie przepływającego ładunku (1930 C)
c) powstają jony OH
-
.
1
1
1
1
4
41. a) Ag
+
+ Br
-
→↓ AgBr,
b) Obliczenie teoretycznej masy bromku srebra = 47g,
1
1
3
Strona 2 z 3

Egzamin maturalny z chemii – styczeń 2003 r.
Obliczenie wydajności – 80,8%.
1
42. -
określenie masy substancji i masy rozpuszczalnika: 20g,
80g,
- obliczanie rozpuszczalności: 25g/100g wody.
1
1
2
43. C
1
1
Razem 60
Strona 3 z 3
Wyszukiwarka
Podobne podstrony:
chemia matura styczen 2003 arkusz 1 7NL7HMDRBPQUD5O26HUGWX
chemia matura styczen 2003 arkusz 1 7NL7HMDRBPQUD5O26HUGWX
fizyka matura styczen 2003 arkusz 1 YNEIP4Z27B573GY22RTYTQ
chemia-matura-styczeń 2001, arkusz 2
chemia matura styczen 2005 arkusz 1 Q3GMLEHQH36EPLCUOQ7DNK
Fizyka Matura Styczen 2003 Arkusz 2 (2)
fizyka matura styczen 2003 arkusz 1 YNEIP4Z27B573GY22RTYTQ
2003 probna matura styczen 2003 Chemia podstawowa arkusz1 id 60 (2)
2003 probna matura styczen 2003 Chemia rozszerzona arkusz2 id 6 (2)
2003 próbna matura styczeń 2003, Chemia podstawowa arkusz1-odpowiedzi
2003, próbna matura styczeń 2003 Chemia rozszerzona arkusz2 odpowiedzi
2003, próbna matura styczeń 2003 Chemia podstawowa arkusz1 odpowiedzi
Matematyka Matura Styczen 2003 poziom rozszerzony
Matematyka Matura Maj 2003 Arkusz 2
chemia matura maj 2005 arkusz 2 56UX3BDIJHTIJZIJ3U3GBS
Matematyka Matura Maj 2003 Arkusz 1
chemia matura maj 2005 arkusz 1 AHSWEJB3G5ZHA6H3ADSLFU
chemia matura maj 2002 arkusz 1 JNTVZRPRJT5DAR7ZHGMSF5
Matematyka Matura Styczen 2003 poziom podstawowy(1)
więcej podobnych podstron