
Równowaga chemiczna
1. Reakcje w układach jednofazowych
2. Obliczanie liczby moli i stężeń reagentow z uwzględnieniem przebiegu reakcji chemicznej
3. Reakcje w układach heterofazowych – przykłady obliczeń.
Reakcje chemiczne mogą biec aż do całkowitego zużycia substratow, lub też osiagać stan, w
którym substraty współistnieją z produktami. Przykładami reakcji, w których zużycie substratów jest
całkowite są eksplozje materiałow wybuchowych lub reakcje denaturacji białek - zachodzą one
nieodwracalnie i nie ma możliwości ponownego odzyskania substratow. Jeżeli jednak istnieje
możliwość przemiany substratów w produkty i odwrotnie - produktow w substraty, to nawet po
dłuższym czasie prowadzenia reakcji układ może zawierać znaczne ilości substratow. Takie zachowanie
układu wynika z ustalenia się stanu rownowagi, w którym stopień przereagowania substratow nie jest
całkowity, ale zatrzymuje się na pewnej wartości, w miejscu określonym przez tzw. stałą rownowagi.
Przykładem reakcji równowagowych mogą być reakcje estryfikacji, w których z alkoholu i kwasu
otrzymujemy ester i wodę. Reakcją odwrotną w tym przypadku jest hydroliza estru z powrotem do
kwasu i alkoholu.
1.
Reakcje w układach jednofazowych (reakcje homogeniczne)
1.1. Wszystkie substancje (substraty i produkty) znajdują się w jednej fazie, np. wszystkie są gazami lub
wszystkie tworzą jednorodną fazę ciekłą. W stanie równowagi stężenia substancji nie zmieniają się w
czasie ponieważ szybkość powstawania produktów jest równa szybkości ich zużywania w procesie
odwrotnym . Osiągnięcie stanu równowagi nie oznacza więc, że ustały wszelkie reakcje chemiczne,
oznacza jednak że szybkości obu reakcji (powstawania produktów i ich przekształcania w substraty) są
sobie równe.
Przykład: reakcja otrzymywania octanu etylu z alkoholu etylowego i kwasu octowego (r.estryfikacji).
C
2
H
5
OH + CH
3
COOH
→ CH
3
COOC
2
H
5
+ H
2
O
Załóżmy, że początkowo zmieszano ze sobą tylko kwas octowy i etanol. Na podstawie ogólnej teorii
kinetyki chemicznej możemy założyć, że szybkość powstawania octanu etylu i wody (szybkość
estryfikacji - v
e
) będzie proporcjonalna do iloczynu stężeń molowych substratow – alkoholu i kwasu:
v
e
= k
e
[C
2
H
5
OH][CH
3
COOH]
Wspołczynnik k
e
nazywany jest stałą szybkości reakcji.
Z kolei szybkość reakcji odwrotnej – reakcji hydrolizy estru (szybkość hydrolizy – v
h
) będzie
zależna od stężeń octanu etylu i wody:
v
h
= k
h
[CH
3
COOC
2
H
5
][H
2
O]
Na początku szybkość reakcji estryfikacji, v
e,
ma dużą wartość, bo stężenia substratow są duże, zaś
szybkość reakcji hydrolizy, v
h,
jest mała, gdyż ww wczesnych etapach reakcji stężenia produktow są
bliskie zeru. Z upływem czasu osiągany jest stan, w którym w jednostce czasu powstaje dokładnie tyle
samo moli estru, ile rozkłada się do alkoholu i kwasu. Wowczas stężenia składników mieszaniny
reakcyjnej nie zmieniają się już w czasie. Mówimy wówczas, że osiągnięty został stan równowagi
dynamicznej.
Z warunku na jednakową szybkość reakcji w obie strony (v
e
= v
h
) otrzymujemy:
k
e
[C
2
H
5
OH][CH
3
COOH] = k
h
[CH
3
COOC
2
H
5
][H
2
O]
czyli:
K
c
=
k
e
k
h
=
[
CH
3
COOC
2
H
5
]∗[
H
2
O]
[
CH
3
COOH ]∗[C
2
H
5
OH ]

Iloraz stałych szybkości k
e
/k
h
oznaczony K
c
nazywamy stężeniową stałą rownowagi.
Wartość stałej równowagi dla danej reakcji obliczonej z powyższego równania jest zależna jedynie od
temperatury (dla gazow rownież od ciśnienia i objętości). Zależność stałej równowagi od temperatury
wynika z wpływu temperatury na stałe szybkości reakcji k
e
i k
h
(jakościowo wpływ temperatury na
szybkość reakcji chemicznych opisuje reguła van't Hoffa, a ilościowo równanie Arrheniusa).
Uogólnieniem podanej wyżej zależności jest jest prawo działania mas, sformułowane przez
Guldberga i Waagego:
W danej temperaturze w stanie równowagi iloczyn ułamków molowych produktów reakcji
podniesionych do odpowiednich potęg podzielony przez iloczyn ułamków molowych substratów
podniesionych do odpowiednich potęg ma wartość stałą.
Wykładnikami potęgowymi w prawie działania mas są wspołczynniki występujące w
zbilansowanym rownaniu reakcji chemicznej.
Zatem dla reakcji danej równaniem: aA + bB
↔ cC + dD
wyrażenie na stałą rownowagi K
X
będzie miało postać:
K
x
=
x
C
c
∗
x
D
d
x
A
a
∗
x
B
b
Tak zdefiniowana stała rownowagi zdefiniowana dobrze opisuje układy znajdujące się w stałej
temperaturze oraz przy stałym całkowitym ciśnieniu gazow (jeśli faza gazowa nie jest obecna, to
ciśnienie nie ma dużego wpływu na wartość stałej). Przyjmując, że dla niezbyt stężonych roztworów
ułamek molowy jest proporcjonalny do stężenia molowego możemy w wyrażeniu na stałą K
x
zastąpić
ułamki molowe równowagowymi stężeniami molowymi reagentów. Otrzymujemy wówczas wyrażenie
na stężeniową stałą równowagi K
c
(nawiasy kwadratowe oznaczają stężenie molowe reagenta):
K
c
=
[
C ]
c
∗[
D]
d
[
A]
a
∗[
B]
b
Stała stężeniowa obowiązuje wyłącznie dla układow spełniających warunek stałości temperatury,
ciśnienia i objętości układu. Jest ona najczęściej stosowana do opisu równowag zachodzących w
rozcieńczonych roztworach wodnych, co przy nieznacznej zmianie gęstości, a tym samym i objętości
mieszaniny reakcyjnej powoduje, że stężenia molowe dla takiej mieszany są dość dobrym
przybliżeniem ułamkow molowych, a tak otrzymana stała stężeniowa K
c
jest w przybliżeniu
równa K
x
.
Przez podstawienie ciśnień cząstkowych p
x
w miejsce stężeń, uzyskujemy ciśnieniową stałą
rownowagi K
p
, ktora zależy tylko od temperatury i rodzaju układu:
K
p
=
p
C
c
∗
p
D
d
p
A
a
∗
p
B
b
Reakcje przebiegające w fazie gazowej można opisywać stałymi ciśnieniowymi lub
stężeniowymi, ktorych wartości zazwyczaj się różnią. W razie potrzeby stałe te można między soba
wzajemnie przeliczać w oparciu o stechiometrię zbilansowanej reakcji chemicznej oraz równanie
Clapeyrona. Ze stechiometrii reakcji wyznacza się różnicę liczby moli produktów i substratów reakcji
Δn. Przykładowo dla reakcji:
aA +bB → cC + dD
Δn = (c + d) – (a + b)
Następnie, po podstawieniu p
i
= n
i
RT/V = (n
i
/V)RT = c
i
RT w wyrażeniu na ciśnieniową stałą
równowagi K
p
otrzymujemy:
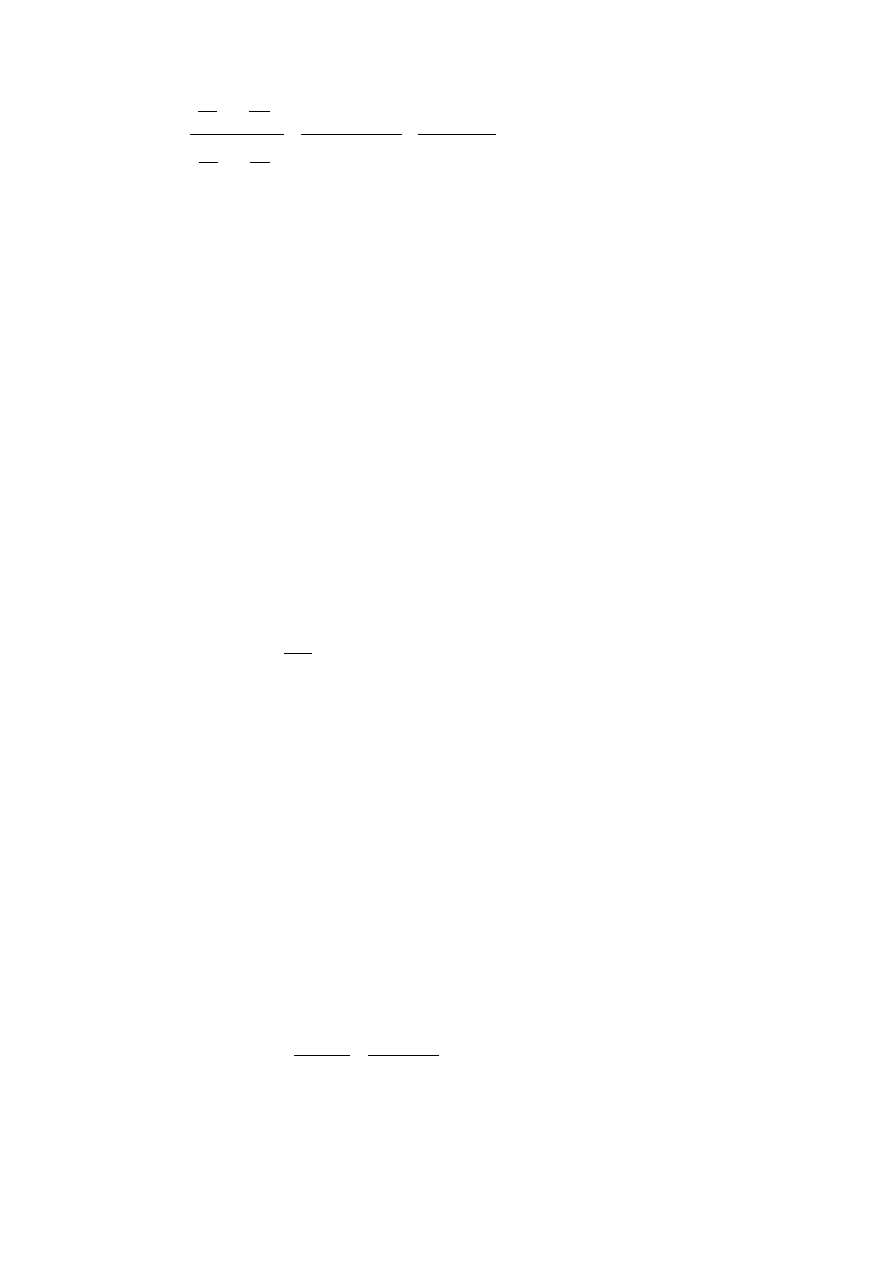
K
p
=
(
n
C
V
)
c
∗(
n
D
V
)
d
(
n
A
V
)
a
∗(
n
B
V
)
b
−
(
RT )
c
∗(
RT )
d
(
RT )
a
∗(
RT )
b
=
[
C ]
c
∗[
D]
d
[
A]
a
∗[
B]
b
−(
RT )
Δ
n
=
K
c
∗(
RT )
Δ
n
Otrzymuje się w ten sposób wyrażenie pozwalające na wzajemne przeliczanie stałych
stężeniowych:
K
p
=
K
c
∗(
RT )
Δ
n
Dla reakcji, w których sumy moli reagentów są stałe (liczby moli substratów są równe liczbie
moli produktów)
Δn = 0, przy założeniu że pomijamy aktywności bądź lotności reagentów, można
przyjąć, że odpowiednie stałe równowagi są sobie równe, czyli: K
x
= K
c
= K
p
.
Ponadto w tych przypadkach do obliczenia stałej równowagi zamiast ułamków molowych, ciśnień
cząstkowych lub stężeń, można użyć liczby moli reagentow w stanie rownowagi.
W razie potrzeby jakościowego określenia kierunku przebiegu reakcji chemicznej przy znanych
początkowych „ilościach” wszystkich reagentow (wyrażonych w molach, jednostkach stężenia
molowego, ułamkach molowych) lub po zaburzeniu stanu równowagi w układzie przez dodanie (lub
usunięcie) jednego lub więcej reagentow wykorzystuje się zwykle tzw. ilorazu reakcyjnego Q,
analogicznego do wyrażenia na stałą rownowagi, z tym, że ilości reagentów dotyczą określonego
momentu reakcji i porównuje się wartość Q z wartością odpowiedniej stałej równowagi.
Zatem jeśli Q > K to mamy nadmiar produktow reakcji, czyli reakcja będzie przebiegała w lewo,
natomiast jeśli Q < K to mamy nadmiar substratow, czyli reakcja będzie przebiegała w prawo.
Ten sam efekt uzyskamy obliczając tzw. postęp reakcji chemicznej x, kierunek przebiegu reakcji
wynika wówczas ze znaku postępu reakcji.
Postęp reakcji chemicznej x jest równy stosunkowi zmiany (przyrostu lub ubytku) liczby moli
danego reagenta n
i
do jego współczynnika stechiometrycznego v
i
w zbilansowanym równaniu reakcji
przedstawionej zapisem standardowym.
x=
Δ
n
i
v
i
Jednostką postępu reakcji jest mol. W procesie, w którym przybywa substratów, a maleje ilość
produktów, postęp reakcji ma znak ujemny.
Liczba moli
n
i
dowolnego reagenta, po zajściu reakcji chemicznej w stopniu określonym
postępem x jest określona zależnością:
n
i
=
n
i
o
+
x v
i
2. Przykłady obliczeń w reakcjach homogenicznych:
Przykład 1.
W naczyniu o pojemności 2 dm
3
umieszczono po 0,02 mola N
2
O
4
i NO
2
. Czy należy oczekiwać
dysocjacji N
2
O
4
czy asocjacji NO
2
, jeżeli stała K
c
dla reakcji
N
2
O
4
(g)
↔ 2NO
2
(g)
wynosi dla tych warunkow 4,6?
Rozwiązanie. Obliczamy iloraz reakcyjny Q i porównujemy go z podaną stałą K
c
.
Wyrażenie na stałą równowagi dla podanej reakcji jest następujące:
K
c
=
[
NO
2
]
2
[
N
2
O
4
]
=
(
n
NO
2
/
V )
2
n
N
2
O
4
/
V
Wykorzystując dane z zadania i stechiometrię reakcji obliczamy stężenia reagentów i iloraz reakcyjny:
[N
2
O
4
] = [NO
2
] = 0,02 mol / 2dm
3
= 0,01 mol/dm
3
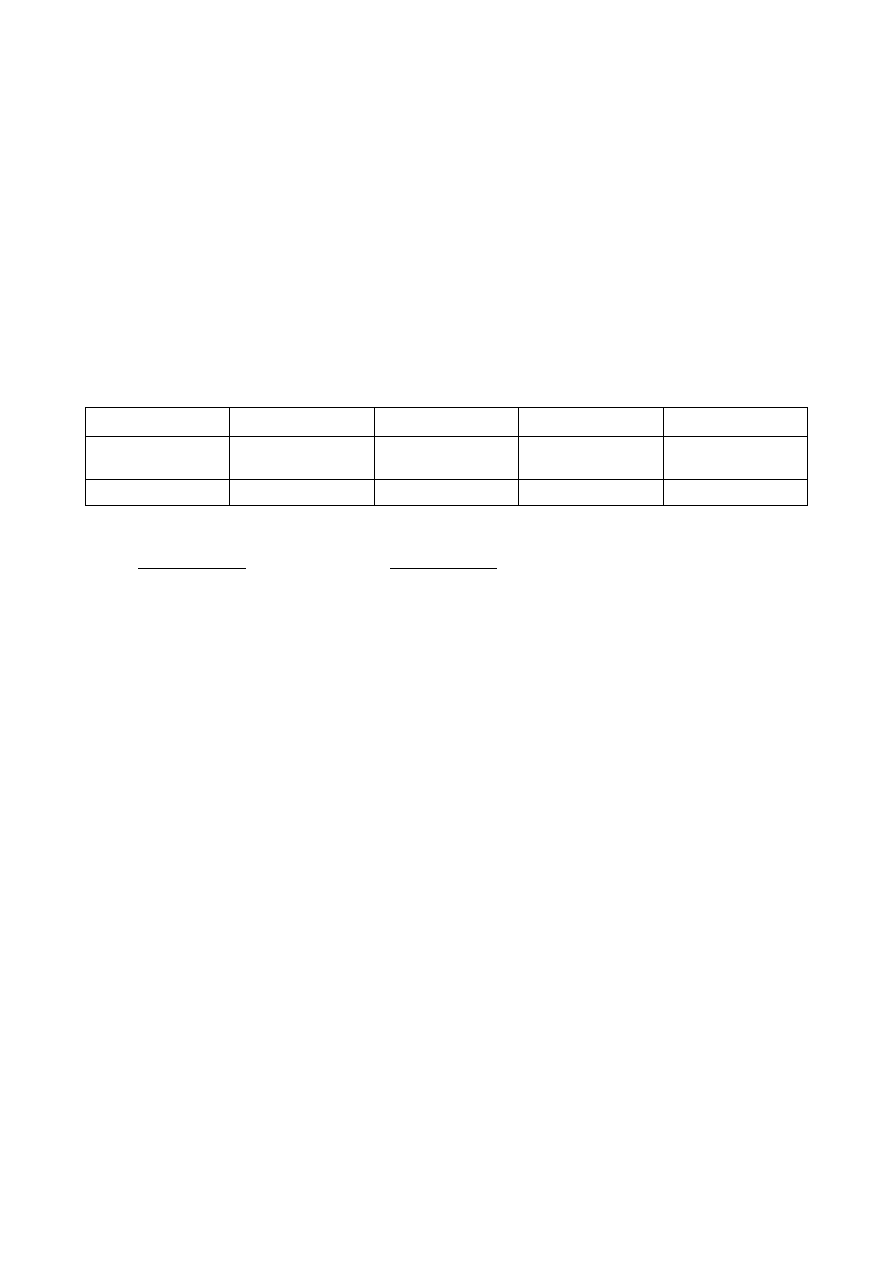
Q = (0,01)
2
/(0,01) = 0,01
Z uwagi na to, że Q < K, to dla osiągnięcia równowagi należy zwiększyć stężenie NO
2
(licznik)
wówczas zmniejszy się stężenie N
2
O
4
(mianownik). Reakcja będzie biec w prawo w i powstanie więcej
produktu czyli
,
czyli nastąpi dysocjacja części N
2
O
4
do NO
2
.
Przykład 2.
Zmieszano 5,0 moli etanolu z 8,0 mola kwasu octowego. Jakie będą liczby moli poszczególnych
reagentow w stanie rownowagi jeżeli stała stężeniowa reakcji estryfikacji K
C
=4,0?
Rozwiązanie:
CH
3
COOH(c) + C
2
H
5
OH(c) = CH
3
COOC
2
H
5
(c) + H
2
O(c)
Bilans moli – zakładamy, że powstanie x moli produktu:
Równanie reakcji
CH
3
COOH
C
2
H
5
OH
CH
3
COOC
2
H
5
H
2
O
Początkowa liczba
moli
8
5
0
0
Liczba moli po reakcji
8-x
5-x
x
x
Korzystając z wyrażenia na stałą równowagi reakcji estryfikacji mamy:
K
c
=
x
2
(
8−x )∗(5−x )
, czyli
4=
x
2
(
8− x)∗(5− x)
rozwiązujemy równanie kwadratowei obliczamy wartość x = 4.
W stanie równowagi będzie więc po 4 mole octanu etylu i wody. Ilości kwasu octowego i etanolu
obliczamy z bilansu:
(8-x) = 4,0 mole CH
3
COOH i (5-x) = 1 mol etanolu.
Przykład 3.
Określ postęp reakcji estryfikacji kwasu mrówkowego metanolem, jeśli: a) w reakcji powstało 0,1 mola
mrówczanu metylu; b) w reakcji ubyło 0,2 mola mrówczanu metylu.
Rozwiązanie. Zapis reakcji estryfikacji:
HCOOH + CH
3
OH
↔ HCOOCH
3
+ H
2
O
a) Jeżeli w reakcji kwasu mrówkowego z metanolem powstało 0,1 mola estru i współczynnik
stechiometryczny przy mrowczanie metylu jest 1 (ubyło jednocześnie po tyle samo moli kwasu i
metanolu) to postęp reakcji wynosi:
x
i
=
n
i
/v
= 0,1/1 = 0,1 mola
b) Jeżeli w reakcji kwasu HCOOH z metanolem ubyło 0,2 mola estru (przybyło jednocześnie po tyle
samo moli kwasu i metanolu) to postęp reakcji wynosi:
x
i
=
n
i
/v
= -0,2/1 = -0,2 mola
Odpowiedź. Postęp reakcji estryfikacji wynosi: a) 0,1 mola; b) –0,2 mola
Przykład 4.
Oblicz postęp reakcji oraz liczbę moli wszystkich reagentow na podstawie reakcji syntezy amoniaku
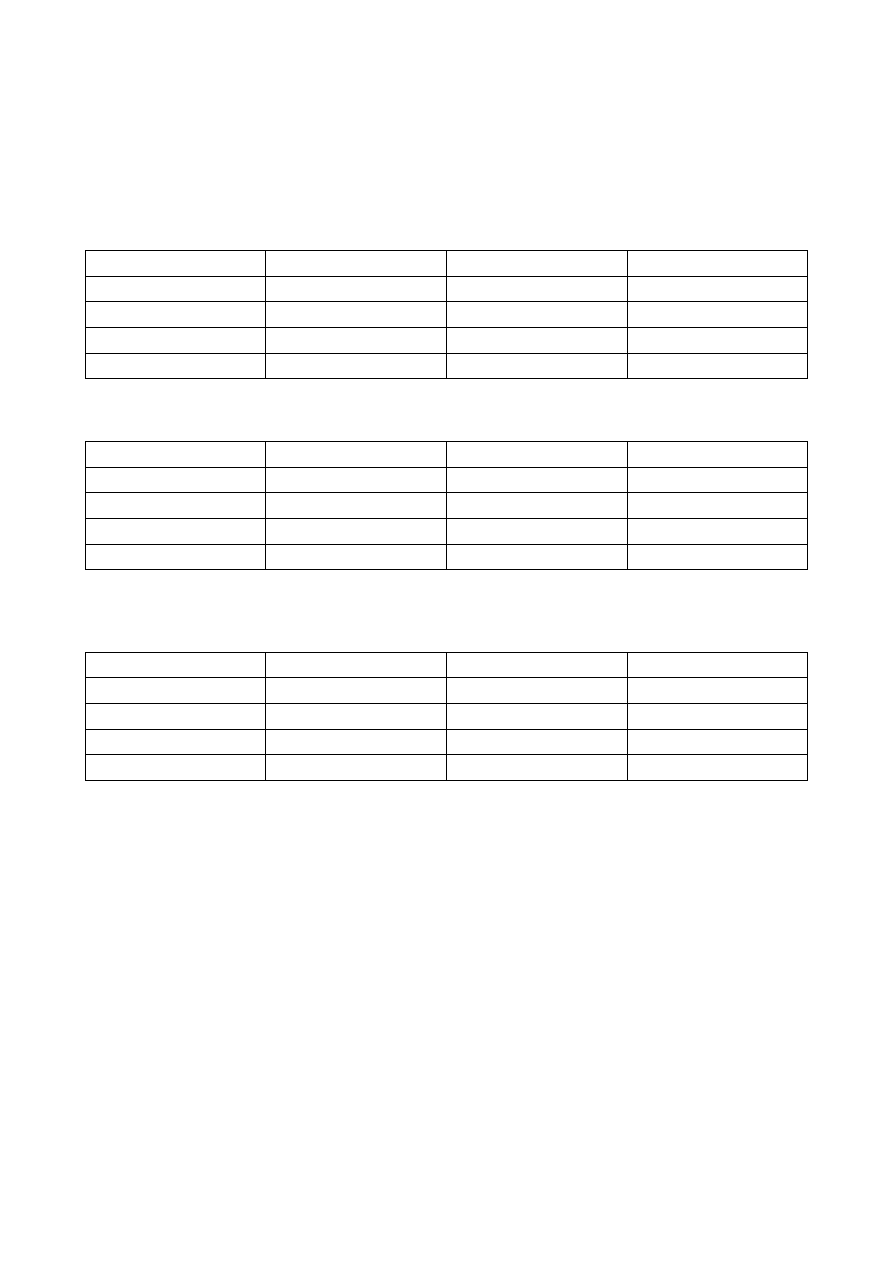
opisanej równaniem: 3H
2
+
N
2
= 2NH
3
oraz zawartość wszystkich reagentów w mieszaninie
poreakcyjnej, jeżeli dla trzech oddzielnych eksperymentow w mieszaninie po reakcji stwierdzono
obecność: a) 1,5 mola NH
3
; b) 0,7 mola NH
3
oraz c) 2 moli H
2
, a mieszanina początkowa zawierała po
1,00 molu wszystkich gazow: H
2
, N
2
oraz NH
3
.
Rozwiązanie:
a)
z bilansu amoniaku NH
3
mamy: 1,50 = 1,0 + x・2 czyli
x = 0,250
Równanie reakcji
3 H
2
+ N
2
2NH
3
Stan początkowy
1 mol
1mol
1 mol
zmiana
-3x
-x
+2x
równowaga
1-3x
1-x
1+2x
Po reakcji
0,25
0,75
1,50
b) z bilansu amoniaku
0,700 = 1 + x・2 czyli:
x = –0,150
Równanie reakcji
3 H
2
+ N
2
2NH
3
Stan początkowy
1 mol
1mol
1 mol
zmiana
-3x
-x
+2x
równowaga
1-3x
1-x
1+2x
Po reakcji
1,45
1,15
0,70
c) z bilansu wodoru H
2
mamy: 2,00 = 1,00 – x・3 czyli:
x = –0,333
Równanie reakcji
3 H
2
+ N
2
2NH
3
Stan początkowy
1 mol
1mol
1 mol
zmiana
-3x
-x
+2x
równowaga
1-3x
1-x
1+2x
Po reakcji
2
1,333
0,334
Odpowiedź. Postępy reakcji i liczby moli reagentów wynoszą odpowiednio:
a) x = 0,250, n(H
2
) = 0,250 mola, n(N
2
) = 0,750 mola;
b) x = –0,150, n(H
2
) = 1,45 mola, n(N
2
) = 1,15 mola;
c) x = –0,333, n(N
2
)= 1,333 mola, n(NH
3
) = 0,333 mola.
Przykład 5.
Mieszanina zawierająca 4 mole octanu etylu, 1 mol wody, 1 mol etanolu i 1 mol kwasu octowego
znajduje się w stanie rownowagi. Do układu dodano 36 gramow wody, wymieszano całość i
pozostawiono do przereagowania aż do ustalenia się nowego stanu równowagi. Oblicz ilości moli
poszczególnych substancji w nowym stanie rownowagi.
C
2
H
5
OH + CH
3
COOH ↔CH
3
COOC
2
H
5
+ H
2
O
Z warunków początkowych obliczamy stałą równowagi: Kc = 4
Konstruujemy tabelę, wstawiając sumaryczną liczbę moli wody w układzie (1 mol + 36g wody czyli
dodatkowe 2 mole, M(H
2
O)=18 g/mol):

Równanie reakcji
CH
3
COOH
C
2
H
5
OH
CH
3
COOC
2
H
5
H
2
O
Początkowa liczba
moli
1
1
4
(1+2)=3
Liczba moli po reakcji
1-x
1-x
4+x
3+x
Po podstawieniu wartości z tabeli do wyrażenia na stałą równowagi obliczamy wartość x:
K
c
=
4=
(
4+ x)∗(3+ x)
(
1−x )
2
otrzymujemy rownanie kwadratowe, 3x
2
-15x -8 = 0, z którego wyliczamy wartość postępu reakcji x. Z
dwóch pierwiastkow rownania, x
1
= 5,486 i x
2
= -0,486, wybieramy x
2
, ponieważ x
1
prowadzi do
ujemnych stężeń etanolu i kwasu. Postęp reakcji jest ujemny, co oznacza że po dodaniu wody reakcja
pobiegnie w kierunku odtworzenia substratów.
Liczby moli w nowym stanie równowagi oliczamy korzystając z x= -0,486.
n(C
2
H
5
OH) = 1,0–x = 1,0–(–0,4861) = 1,486
n(CH
3
COOH) = 1,0–x = 1,486
n(CH
3
COOC
2
H
5
) = 4,0+x = 4,0+(–0,4861) = 3,514
n(H
2
O) = 3,0+x = 2,514
Odpowiedź: W nowym stanie równowagi mamy po 1,486 mola etanolu i kwasu octowego, 3,514 mola
octanu etylu i 2,514 mola wody.
3. Reakcje zachodzące w układach heterofazowych
Dla układow, w których w równowadze wspołistnieje kilka faz, reakcje chemiczne zachodzą tak
długo aż wyrównają się potencjały chemiczne. Z warunku na równość potencjału chemicznego faz
wynika, że do wyrażenia na stałą równowagi nalezy wstawić ułamki molowe (ciśnienia cząstkowe,
stężenia) substancji w obrębie fazy, w której ona występuje. Przykładowo w przypadku reakcji między
fazą stałą i roztworami wyrażenie na stałą równowagi zawiera jedynie stężenia (ułamki molowe)
substancji obecnych w fazie ciekłej (roztworze), a pomijamy ciała stałe ponieważ ułamek molowy
substancji w ciele stałym nie ulega zmianie i wynosi 1. Do opisu tej równowagi wystarczy podanie
stężenia substancji w roztworze nasyconym (co oczywiście zależy od temperatury).
Podobnie, w reakcji wspołistnienia ze sobą gazów i ciał stałych w wyrażeniu na stałą rownowagi
pomija się człony dotyczące fazy stałej. Tak więc niektóre reakcje równowagi rozkładu ciał stałych daje
się opisać za pomocą stałych ciśnieniowych z pominięciem substancji stałych, podając równowagową
prężność gazów powstających w danej reakcji w określonej temperaturze. W taki sposób opisuje się
często np. reakcje rozkładu węglanow metali do tlenku metalu i dwutlenku węgla:
CaCO
3
(s)
↔ CaO(s) + CO
2
(g) lub reakcje odwodnienia hydratów: CaSO
4
・
2H
2
O(s)
↔ CaSO
4
・
0,5H
2
O(s) + 1,5H
2
O(g). W takich przypadkach podaje się równowagową prężność CO
2
w danej
temperaturze w przypadku rozkładu węglanu lub prężność pary wodnej w danej temperaturze dla
reakcji odwodnienia hydratu. Niezwykle ważne jest podawanie stanu skupienia dla wszystkich
reagentow.
Przykład 6
Podaj wyrażenia na stałe równowagi reakcji syntezy siarkowodoru z pierwiastków w temperaturze a)
1000°C, b) 200°C, c) -100°C.
Rozwiązanie:
a)W temperaturze 1000°C wszystkie reagenty są gazowe, siarka w tej temperaturze występuje głównie
jako cząsteczka dwuatomowa, a więc tę reakcję można przedstawić rownaniem:
2H
2
(g) + S
2
(g)
↔ 2H
2
S(g)

K
p
=
p
H
2
S
2
p
H
2
2
∗
p
S
2
b)
W temperaturze 200°C równanie syntezy siarkowodoru będzie miało postać:
8H
2
(g) + S
8
(c)
↔ 8H
2
S(g)
K
p
=
p
H
2
S
8
p
H
2
8
c)
W temperaturze –100°C tylko wodor będzie gazem, a pozostałe reagenty ciałami stałymi.
Wowczas reakcję można zapisać następująco:
8H
2
(g) + S
8
(s)
↔ 8H
2
S(s)
K
p
=
1
p
H
2
8
Wynika stąd, ze niezwykle istotne jest podanie stechiometrii i stanu skupienia reagentów ponieważ
wartości stałych znacznie różnia się od siebie.
Przykład 7.
Podaj rownanie na stałą równowagi dla następujących reakcji chemicznych w układow dwu- lub
wielofazowych:
1) MgCO
3
(s)
↔ MgO (s) + CO
2
(g)
2 ) 2NaHCO
3
(s)
↔ Na
2
CO
3
(s) + H
2
O(g) + CO
2
(g)
3) 2CaSO
4
・
2H
2
O(s)
↔ 2CaSO
4
・
H
2
O(s) + 2H
2
O(g)
4) C(grafit) + O
2
(g)
↔ CO
2
(g)
5) PbI
2
(s)
↔ Pb
2+
(aq) + 2 I
–
(aq)
6) 2NaHCO
3
(aq)
↔ Na
2
CO
3
(aq) + CO
2
(g) + H
2
O(c)
Rozwiązanie:
1) K
p
= p(CO
2
)
2) K
p
= p(H
2
O) p(CO
2
)
3) K
p
= p(H
2
O)
4 ) K
p
= p(CO
2
)/p(O
2
)
5) K
c
= [Pb
2+
(aq)
][I
–
(aq)
]
2
6)
K
p
= p(CO
2
)
Równowagi w roztworach elektrolitów.
[zagadnienia do samodzielnego przygotowania: elektrolity mocne i słabe, teorie kwasów i zasad,
dysocjacja elektrolityczna, prawo działania mas]
W roztworze doskonałym wszystkie jego właściwości fizyczne zależą liniowo od składu i
właściwości fizycznych składników tego roztworu. Prawa równowag chemicznych są ściśle
spełniane tylko przez roztwory doskonałe. Z dobrym przybliżeniem możemy je również stosować
do roztworów bardzo rozcieńczonych.
W przypadku roztworów rzeczywistych, w prawie działania mas zamiast stężeń używa się
aktywności reagentów (czyli efektywnych stężeń). Równowagę w takim układzie można zapisać
następująco:
mA + nB
↔ pC + qD
a ilościową zależność między aktywnościami a
i
reagentów takiej reakcji równowagowej

przedstawić jako:
K =
a
C
p
∗
a
D
q
a
A
m
∗
a
B
n
gdzie K jest termodynamiczną stałą równowagi w danej temperaturze i przy danym ciśnieniu (czyli
stałą równowagi dla roztworu doskonałego), a współczynniki stechiometryczne reakcji we wzorach
na stałą równowagi są potęgami aktywności reagentów (w liczniku wyrażenia występują produkty
reakcji, a w mianowniku – substraty).
Aktywności poszczególnych składników wiąże ze stężeniami następująca zależność:
a
i
=
f
i
∗
c
i
gdzie fi oznacza współczynnik aktywności a ci – oczekiwane lub teoretyczne równowagowe
stężenie danego reagenta. Aktywność posiada jednostkę taką samą jak stężenie molowe a
współczynnik aktywności jest bezwymiarowy. Do zapisu stężeń reagentów w stanie równowagi
używa się nawiasów kwadratowych, zatem wyrażenie na termodynamiczną stałą równowagi można
zapisać w postaci:
K =
f
C
p
∗
f
D
q
f
A
m
∗
f
B
n
∗
[
C ]
p
∗[
D]
q
[
A]
m
∗[
B]
n
Przenosząc współczynniki aktywności na stronę stałej termodynamicznej otrzymamy:
K '= K
f
A
m
∗
f
B
n
f
C
p
∗
f
D
q
=
[
C ]
p
∗[
D]
q
[
A]
m
∗[
B]
n
gdzie K' jest warunkową stałą równowagi wyrażoną w stężeniach równowagowych dla danej siły
jonowej I roztworu w danej temperaturze. Siła jonowa jest miarą oddziaływań międzyjonowych
wystepujacych w roztworze i definiujemy ją (wg. Lewisa i Randalla, 1921) jako:
I =
1
2
Σ
z
i
2
∗
c
i
gdzie zi oznacza liczbę ładunków elementarnych i-tego jonu o stężeniu molowm ci
znajdującego się w roztworze.
Jednostką siły jonowej jest mol/dm
3
.
Jeśli w roztworze istnieją również elektrolity słabe, wstępne wartości siły jonowej oblicza się
tylko dla elektrolitów mocnych uwzględniając stechiometrię reakcji. W przypadku konieczności
bardzo dokładnych obliczeń, siłę jonową z uwzględnieniem elektrolitów słabych koryguje się
później metodami iteracyjnymi.
Współczynniki aktywności można wyznaczać dla związków chemicznych z właściwości
koligatywnych roztworów (ciśnienie osmotyczne, obniżenie temperatury krzepnięcia lub
podwyższenie temperatury wrzenia roztworu, obniżenie prężności pary nasyconej rozpuszczalnika
nad roztworem), albo poprzez pomiary sił elektromotorycznych odpowiednio skonstruowanych
ogniw. Są to wówczas tak zwane średnie współczynniki aktywności będące średnią geometryczną
współczynników aktywności wszystkich jonów danego związku. Takie uśrednienie
współczynników aktywności powoduje, że za odstępstwa od idealnego roztworu w równym stopniu
odpowiadają wszystkie rodzaje jonów tego zwiazku. Niestety jest to tylko grube przybliżenie w
miarę dobrze spełniane dla bardzo rozcieńczonych roztworów elektrolitów złożonych z jonów o
takiej samej liczbie ładunków.
Alternatywną metodą jest obliczanie współczynników aktywności indywidualnych jonów na
podstawie odpowiednich zależności, do których potrzebna jest znajomość siły jonowej roztworu.
Poprawne obliczenia dla stężonych roztworów elektrolitów mocnych wymagają znajomości
współczynników aktywności, które wyznacza się zwykle z granicznego prawa Debye'a-Hückla

−
logf
i
=
Az
i
2
∗
√
I
1+
√
I
gdzie z
i
jest ładunkiem jonu i, A - stała, której wartość zależy od temperatury i właściwości
rozpuszczalnika, dla roztworu wodnego w temperaturze 25°C wynosi ona około 0,5.
Graniczne prawo Debye'a-Hückla jest adekwatne w przypadku jonów jednowartościowych gdy siła
jonowa I ≤ 0,05; dla jonów dwuwartościowych gdy I ≤ 0,014 i trójwartościowych gdy I ≤ 0,005.
Dla roztworów bardziej rozcieńczonych, gdy I ≤ 0,01 można obliczać współczynniki aktywności
jonów z uproszczonej zależności: −logf
i
=
Az
i
2
∗
√
I
Wartości współczynników aktywności w roztworach stężonych wyznacza się korzystając z
zależności logarytmu f od siły jonowej (Z.Galus, Ćwiczenia z Chemii analitycznej, str. 338).
Przykłady obliczeń:
Przykład 1
Obliczyć siłę jonową wodnego roztworu Na
2
SO
4
o stężeniu 0,2 mol/dm
3
.
Rozwiązanie:
W oparciu o reakcję dysocjacji soli:
Na
2
SO
4
→ 2 Na
+
+ SO
4
2-
obliczamy stężenia molowe poszczególnych jonów.
Stężenie jonów sodowych wynosi 0.4 mol/dm
3
, a jonów siarczanowych 0.2 mol/dm
3
. Podstawiając
te wartości do wzoru na siłę jonowa uzyskujemy wartość:
I =
1
2
∗(
0.4
mol
dm
3
∗
1+0.2
mol
dm
3
∗
4)=0.6
mol
dm
3
Przykład 2
Jakie jest stężenie jonów chlorkowych w roztworze CaCl
2
o sile jonowej 0,21 mol/dm
3
?
Rozwiązanie: Stężenie CaCl
2
oznaczamy jako C. W wyniku dysocjacji soli
CaCl
2
→ Ca
2+
+ 2Cl‾
stężenie jonów wapniowych w roztworze wynosi C, a jonów chlorkowych 2C Siła jonowa I = 0.21
mol/dm
3
= 1/2(4C + 2C) Stąd C = 0,07 mol/dm
3
(stężenie jonów wapniowych). Stężenie jonów
chlorkowych wynosi 0,14 mol/dm
3
.
Iloczyn jonowy wody i pH
[przypomnieć: iloczyn jonowy wody, definicję pH]

Zadania:
1.
Do naczynia wprowadzono gazowy azot i wodór w proporcji stechiometrycznej (1:3). Układ
wygrzewano w temperaturze 900K pod stałym ciśnieniem, wynoszącym 30398hPa. Analiza
wykazała, że azot N2 wywiera w stanie rownowagi ciśnienie cząstkowe 4053 hPa. Oblicz
ciśnieniową stałą równowagi K
P
. [Odp: 0.0276]
2.
W zbiorniku o objętości 1 dm3 i w temperaturze 740K badano równowagę reakcji:
2 NOCl(g) 2NO(g) + Cl2(g)
Wprowadzono 2 mole NOCl do pustego zbiornika i po osiągnięciu stanu równowagi stwierdzono, że
stopień dysocjacji tego związku wynosi 33%. Oblicz stałą równowagi reakcji. [odp: 0,080]
3.
Zmieszano 1,0 mola kwasu octowego ze 100 gramami wodnego roztworu alkoholu
etylowego o zawartości 30% wagowych etanolu. Oblicz, ile moli octanu etylu powstanie w stanie
rownowagi, jeśli stała równowagi reakcji estryfikacji K
c
wynosi 4,0. [odp: 0,269 mola (uwzględnić
obecność wody w roztworze etanolu!]
4.
W naczyniu o pojemności 2,0 dm
3
umieszczono 4,0 mola SO
2
i 3,0 mola NO
2
. Ile gramów SO
3
powstanie w stanie równowagi, jeśli stała stężeniowa dla tej temperatury wynosi 1,0. Równanie
reakcji: SO
2
(g) + NO
2
(g) = SO
3
(g) + NO(g). [odp: 137g SO
3
]
5.
Reakcja metalicznego żelaza z wodą zachodzi wg równania 3Fe(s) + 4H2O(g)
= Fe3O4(s) +
4H2(g). Jakie będzie stężenie pary wodnej w stanie równowagi w temperaturze 850°C, jeżeli reakcja
została zapoczątkowana w naczyniu o pojemności 16,0 dm
3
napełnionym 10,0 g H2 i odpowiednim
nadmiarem Fe3O4, a stężeniowa stała równowagi Kc wynosi 4,60? [odp: 0,127M]
6.
W temperaturze 125
o
C dla następującej reakcji 2NaHCO3(s)
↔Na2CO3(s) + CO2(g) + H2O(g) stała
równowagi Kp wynosi 0,25. Do opróżnionego naczynia o pojemności 1,00 dm
3
wprowadzono 11,9 g
NaHCO3 i naczynie ogrzewano w tej temperaturze do ustalenia się stanu równowagi. Obliczyć: a)
ciśnienia cząstkowe CO2 i H2O w stanie równowagi; b) masy NaHCO3 i Na2CO3 znajdujące się w
naczyniu po ustaleniu się stanu równowagi; c) minimalną objętość naczynia, przy ktorej cały
NaHCO3 ulegnie rozkładowi. [odp: a) pCO2=pH2O=50kPa, b) mNaHCO3=9,3627g;
mNa2CO3=1,601g, c) V=4,689 dm
3
]
7.
Zmieszano 150ml 0.01M roztworu HCl i 150ml 0.007M roztworu HNO
3
. Jaka jest aktywność
poszczególnych jonów w roztworze? [odp: a
Cl-
=0.0043, a
NO3
-
=0.00315, a
H+
=0.00764]
8.
Jaka jest aktywność jonów potasowych w 1 litrze roztworu zawierajacym 0,101 g saletry potasowej
oraz 0,085g saletry sodowej? [odp: 0.00095]
9.
Ile g NaOH musi zawierać 1 dm
3
roztworu aby jego pH wynosiło 12?
10.
Jaką objętość wodnego roztworu zasady sodowej o pH=10 należy użyć do zobojętnienia 25 cm
3
kwasu siarkowego(VI) o stężeniu 0.075M?
11.
Oblicz pH roztworu kwasu solnego o stężeniu 10
-8
mol/dm
3
.
12.
2g metalicznego wapnia dodano do 200ml kwasu solnego o pH=0,22. Obliczyć pH i pCl
otrzymanego roztworu. [pH=1, pCl=0,22]
13.
Wykładnik stężenia jonów wodorowych w 0,15M roztworze kwasu octowego wynosi 2,79. Obliczyć
wartość stałej dysocjacji kwasu octowego.
14.
Stężenia molowe jonów wodorotlenkowych w dwóch roztworach są następujące:
a)[OH
-
]=10
-4
, b)[OH
-
]=10
-6
. W którym roztworze jest większe stężenie jonów H
+
, a w którym
wyższe pH roztworu?
Document Outline
Wyszukiwarka
Podobne podstrony:
Moduł III cz 1 Równowaga, Kw, pH rozwiazania zadań
Moduł III cz 2 stała i stopien dysocjacji, zobojetnianie
Moduł III-cz.2 -stała i stopien dysocjacji, zobojetnianie
Bufory Moduł III, cz 2 uzupełnienie
Moduł III cz 2 stała i stopien dysocjacji, zobojetnianie
Modul III 2 id 305653 Nieznany
Modul III id 305652 Nieznany
glosa Pyziak Szafnickiej III CZ Nieznany
Modul III 2 id 305653 Nieznany
miedziowanie cz 2 id 113259 Nieznany
Analiza III semestr lista nr 3 Nieznany (2)
MATERIALY DO WYKLADU CZ IV id Nieznany
opracowane pytania metodologia III cz
F Cwiczenia, cz 3 id 167023 Nieznany
cz 9 id 127095 Nieznany
więcej podobnych podstron