1
Caserio, Roberts
CHEMIA ORGANICZNA
Morrison, Boyd
CHEMIA ORGANICZNA
McMurry
CHEMIA ORGANICZNA
KOLOKWIUM
06.11.2007
11.12.2007
22.01.2008
obejmuje materiał wykładowy przedstawiony odpowiednio do dnia
30.10.07; 6.12.07 oraz 17.01.08
Zaliczenie przedmiotu:
-
ocena z ćwiczeń wynika z sumy
punktów uzyskanych na kolokwiach
wykładowych i sprawdzianach
ćwiczeniowych – na ocenę pozytywną
niezbędne jest zgromadzenie co najmniej
60% punktów
-
ocena pozytywna z ćwiczeń jest
warunkiem koniecznym przystąpienia do
egzaminu
ĆWICZENIA Z CHEMII ORGANICZNEJ
Poniedziałek godz. 8.15 s. 11D
I gr. II rok
Wtorek
8.15 s. 11D
II gr. II rok
9.15 s. 222A
III rok
Środa
8.15 s. 410GG
III gr. II rok
Piątek
9.15 s. 222A
IV+V rok
WYKŁADY Z CHEMII ORGANICZNE
Wtorek
7.15 Audytorium Novum
Czwartek
7.25 Audytorium Chemiczne
STRUKTURA I WIĄZANIA W ZWIĄZKACH ORGANICZNYCH
1. Atomy pierwiastków występujących w związkach
organicznych biorą udział w określonej liczbie wiązań, np.
2. Atomy węgla są zdolne do tworzenia wiązań pomiędzy sobą
atomy węgla – czterowiązalne
C
atomy tlenu – dwuwiązalne
O
WIĄZANIA C – C
C C
pojedyncze
C C
podwójne
C C
potrójne
atomy wodoru i halogenów – jednowiązalne
Cl
H
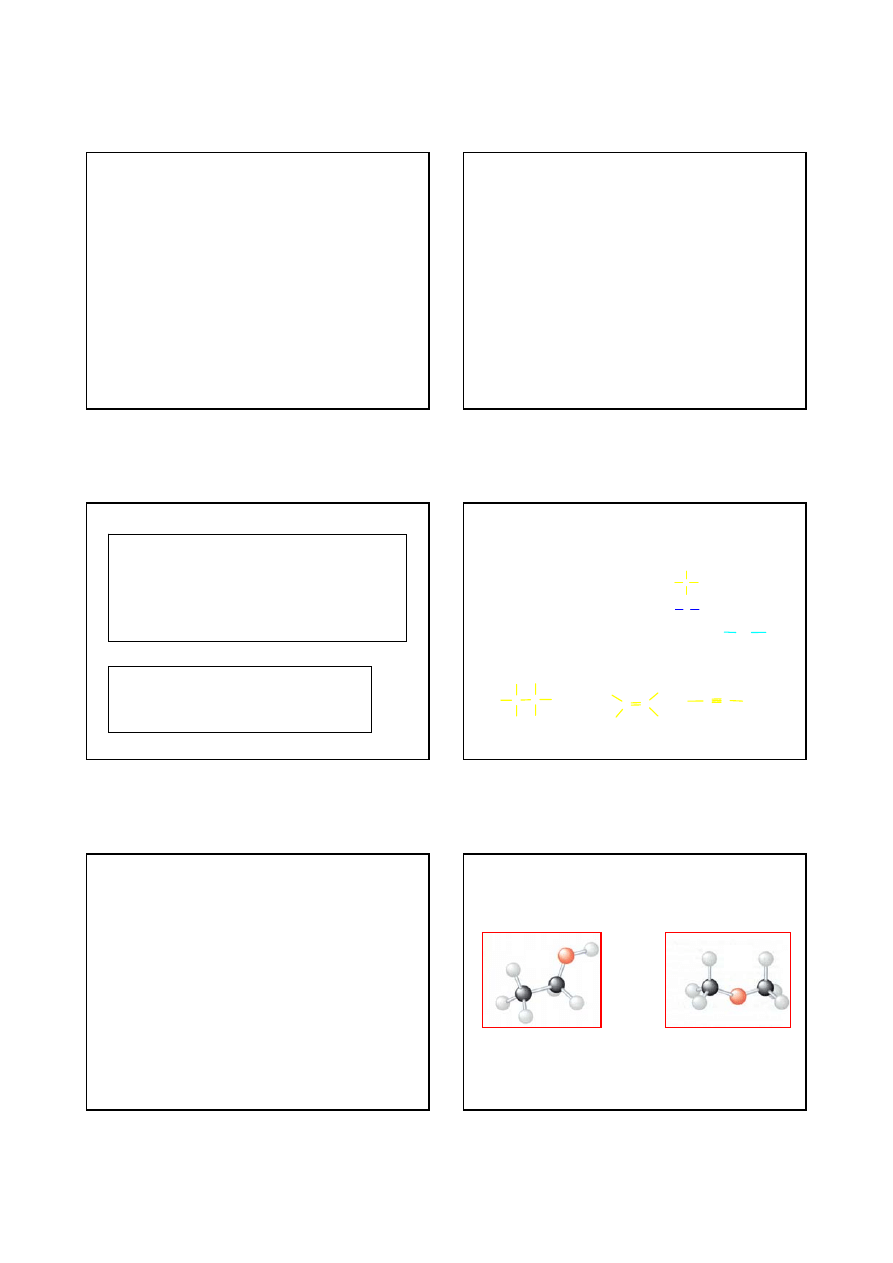
IZOMERIA
IZOMERY – różne związki chemiczne o takim
samym wzorze sumarycznym
C
2
H
6
O
CH
3
CH
2
OH
etanol
CH
3
OCH
3
eter dimetylowy
temp. wrzenia [°C]
78.5
- 24.9
temp. topnienia [°C]
- 117.3
- 138
reakcja z Na
wydziela się H
2
brak reakcji
IZOMERIA
IZOMERY KONSTYTUCYJNE –
różne związki
chemiczne o takim samym wzorze sumarycznym, ale
różniące się konstytucją (sposobem połączenia
atomów ze sobą)
CH
3
CH
2
OH
etanol
CH
3
OCH
3
eter dimetylowy
2
STRUKTURA I WIĄZANIA W ZWIĄZKACH ORGANICZNYCH
SYNTETYCZNE
ZWIĄZKI
ORGANICZNE
SYNTETYCZNE GUMY
SYNTETYCZNY JEDWAB
nylon, rayon
DODATKI DO ŻYWNOŚCI
barwniki
sztuczne słodziki
konserwanty
sztuczne środki zapachowe
TWORZYWA SZTUCZNE
teflony
polistyren
poliuretany
polipropylen
PALIWA
LEKI
WIĄZANIA CHEMICZNE
oddziaływanie pomiędzy atomami warunkujące powstanie
trwałych pod względem chemicznym cząsteczek
1916 r.
G. N. LEWIS (University of California, Berkeley)
W. KÖSSEL (Uniwersität München)
WIĄZANIE JONOWE – elektrostatyczne przyciąganie przeciwnie
naładowanych ładunków elektrycznych
WIĄZANIE KOWALENCYJNE – tworzy się przez ‘uwspólnienie’
elektronów obu atomów biorących udział w wiązaniu
WIĄZANIA JONOWE
występuje pomiędzy atomem metalu o małej wartości energii
jonizacji, a atomem niemetalu o dużej ujemnej wartości
powinowactwa elektronowego
11
Na 1s
2
2s
2
2p
6
3s
1
Na
+
: 1s
2
2s
2
2p
6
[Ne]
-1e
-
KATION
ANION
17
Cl 1s
2
2s
2
2p
6
3s
2
3p
5
Cl
-
: 1s
2
2s
2
2p
6
3s
2
3p
6
[Ar]
+1e
-
WIĄZANIA JONOWE
występuje pomiędzy dwoma atomami: jednym o niskim potencjale
jonizacyjnym oraz drugim – o dużym powinowactwie elektronowym
ELEKTROUJEMNOŚĆ KILKU WYBRANYCH PIERWIASTKÓW
Li
Be
B
C
N
O
F
1.0
1.5
2.0
2.5
3.0
3.5
4.0
Na
Mg
Al.
Si
P
S
Cl
0.9
1.2
1.5
1.8
2.1
2.5
3.0
K
Br
0.8
2.8
WZROST ELEKTROUJEMNOŚCI
W
Z
R
O
S
T
EL
EK
T
R
OU
J
E
MN
O
Ś
CI
WIĄZANIA JONOWE
NaCl
MgSO
4
NaHCO
3
NH
4
Cl
NaF
związki krystaliczne o wysokich temp. topnienia i wrzenia
dla NaCl tt. 801°C i tw. 1413°C
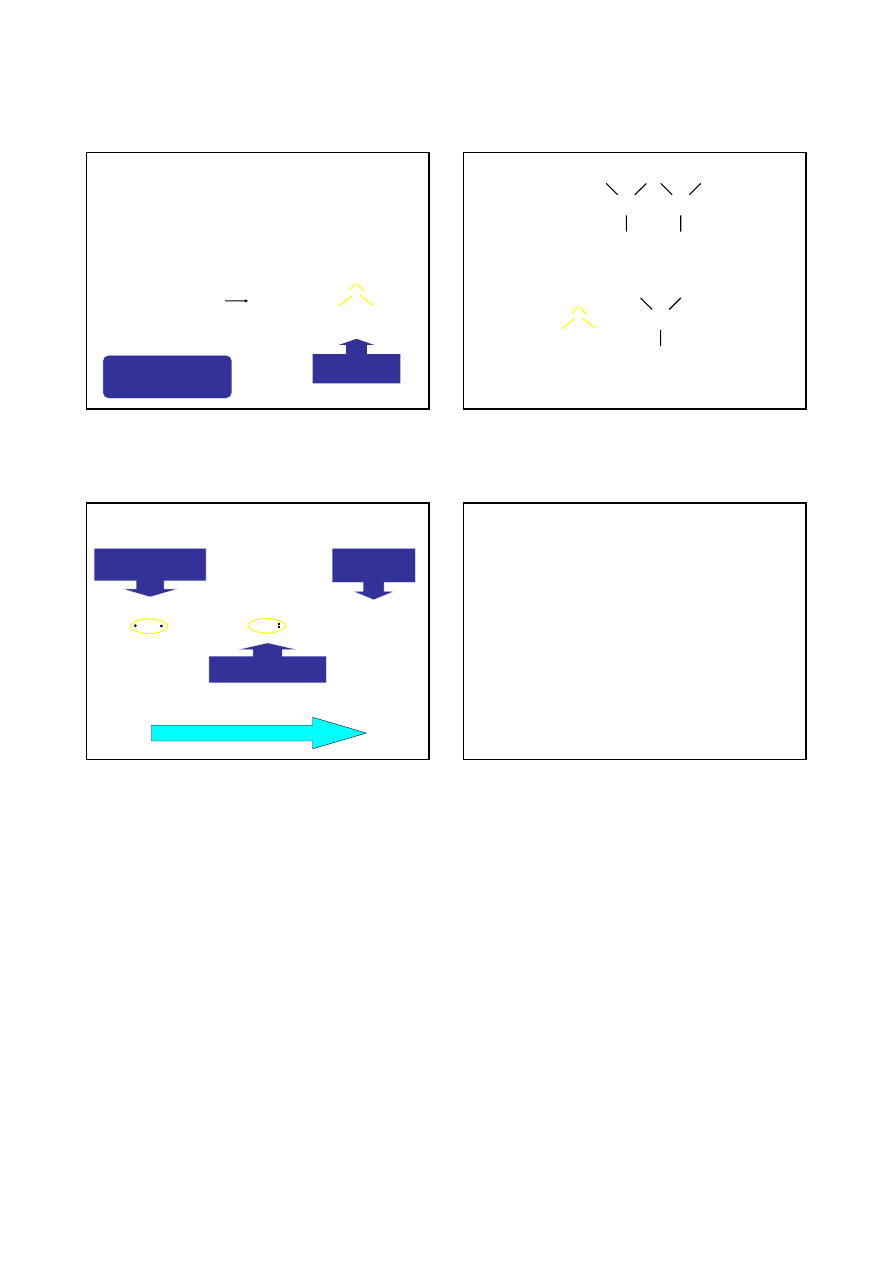
WIĄZANIA KOWALENCYJNE
tworzy się poprzez ‘uwspólnienie‘ elektronów obu atomów
biorących udział w wiązaniu chemicznym
dwa atomy tego samego pierwiastka – para elektronów należy
w równym stopniu do każdego z atomów tworzących wiązanie
:F:
+
:F:
:F:F:
··
··
·· ··
·· ··
·
·
wzór strukturalny
Lewisa
⏐
F – F
⏐
3
WIĄZANIA KOWALENCYJNE
tworzy się poprzez ‘uwspólnienie‘ elektronów obu atomów
biorących udział w wiązaniu chemicznym
dwa atomy różnych pierwiastków o zbliżonym powinowactwie
elektronowym – para elektronów jest przesunięta w stronę
atomu bardziej elektroujemnego
wzór strukturalny
Lewisa
:O:
+
2H·
:O:H
··
··
··
H
WIĄZANIE KOWALENCYJNE
SPOLARYZOWANE
H
H
O
δ+
δ+
δ−
WIĄZANIE KOWALENCYJNE SPOLARYZOWANE
⏐
N
≡ N
⏐
H
H
O
δ+
δ+
δ−
H – F
δ+
δ−
– O –
N
B
H – Cl
H – Br
δ+
B
F
F
F
δ−
δ−
δ−
– C –
⏐
⏐
δ+
δ−
δ−
O = C = O
WIĄZANIE CHEMICZNE
X X
δ+
δ−
X
Y
X
+
Y
-
CHARAKTER JONOWY WIĄZANIA
WIĄZANIE JONOWE
WIĄZANIE KOWALENCYJNE
WIĄZANIE KOWALENCYJNE
SPOLARYZOWANE
WIĄZANIE KOWALENCYJNE SPOLARYZOWANE
ELEKTROUJEMNOŚĆ – jest to zdolność atomu do
przyciągania elektronów w wiązaniu chemicznym
POLARNOŚĆ WIĄZANIA – jest spowodowana różnicą
elektroujemności atomów biorących udział w wiązaniu
chemicznym
Pauling przyjął elektroujemność równą 4 dla atomu fluoru F
2.5 dla atomu węgla C
Wyszukiwarka
Podobne podstrony:
Chemia organiczna podstawy wykład5
Chemia organiczna podstawy wykład6
Chemia organiczna podstawy wykład9
Chemia organiczna podstawy wykład4
Chemia organiczna podstawy wykład8
Chemia organiczna podstawy wykład7
Chemia organiczna podstawy wykład11
Chemia organiczna podstawy wykład12
Chemia organiczna podstawy wykład3
Chemia organiczna podstawy wykład10
Chemia organiczna podstawy wykład11
więcej podobnych podstron