
Za zespoły gruczolakowatości wewnątrzwydzielniczej
(MEN – multiple endocrine neoplasia) typu 1 i 2 odpowia-
dają zmiany genetyczne w genach supresorowych i pro-
toonkogenach. Te zespoły dziedzicznych nowotworów
charakteryzują się występowaniem transformacji no-
wotworowej w wielu docelowych tkankach endokryn-
nych, a także patologicznymi zmianami tkanek nieen-
dokrynnych. Towarzyszące im guzy endokrynne mogą
mieć charakter łagodny lub złośliwy i mogą rozwijać
się zarówno synchronicznie, jak i metachronicznie.
W obrębie dotkniętej chorobą docelowej tkanki endo-
krynnej rozwój cech mikroskopowej inwazyjności lub
makroskopowo ewidentnego wieloogniskowego raka
jest zwykle poprzedzony występowaniem rozlanego
rozrostu preneoplastycznego. W przypadku zespołów
MEN genetyczna predyspozycja do rozwoju wielu no-
wotworów endokrynnych o złośliwym potencjale doty-
czy generalnie zdrowych młodych ludzi. Co szczegól-
nie istotne, niedawne odkrycie specyficznych genów,
odpowiedzialnych za rozwój zespołów MEN 1 i 2, po-
zwoliło na opracowanie strategii badań genetycznych,
co umożliwia wczesne podjęcie leczenia operacyjnego.
Wczesna tyreoidektomia jest wskazana u chorych z ge-
netycznym rozpoznaniem MEN 2. Celem tego zabiegu
jest niedopuszczenie do dalszego rozwoju przerzutów
regionalnych lub odległych raka rdzeniastego tarczycy
(MTC – medullary thyroid carcinoma). Natomiast ostatnio
bardziej kontrowersyjny jest wybór optymalnego mo-
mentu do wczesnej interwencji chirurgicznej w celu za-
pobieżenia rozsiewowi potencjalnie złośliwych guzów
neuroendokrynnych (NET) u chorych z genetycznie
potwierdzonym zespołem MEN 1.
Zespoły MEN charakteryzuje różny wzorzec eks-
presji. Zespół MEN 1 w pełnej ekspresji charakteryzu-
je się rozwojem mnogich guzów przytarczyc, guzów
neuroendokrynnych trzustki i dwunastnicy, gruczola-
ków przedniego płata przysadki mózgowej, rakowia-
ków górnego odcinka przewodu pokarmowego i gra-
sicy oraz innych towarzyszących nowotworów. Zespół
MEN 2A charakteryzuje się rozwojem MTC, guzów
chromochłonnych i guzów przytarczyc, natomiast na
zespół MEN 2B składa się MTC, guzy chromochłonne,
nerwiaki błon śluzowych, nieprawidłowości budowy
szkieletu, ganglioneuromatoza przewodu pokarmowe-
go i wyraźna sylwetka marfanoidalna.
ZESPÓŁ GRUCZOLAKOWATOŚCI
WEWNĄTRZWYDZIELNICZEJ TYPU 1
Badania genetyczne i patogeneza
Gen MEN 1 początkowo zmapowany na chromosomie
11q13 w wyniku kombinacji sprzężenia genetycznego
i mappingu delecji guza [1] został ostatecznie zidenty-
fikowany w wyniku miejscowego klonowania w 1997
roku [2]. MEN 1 jest przypuszczalnie genem supreso-
rowym, którego białko – jak się uważa – działa hamu-
jąco na wzrost komórkowy i proliferację, stąd też cał-
kowite wypadnięcie jego funkcji powinno prowadzić
do niekontrolowanego wzrostu komórki i transformacji
nowotworowej. Zgodnie z teorią „podwójnego uderze-
nia” pierwszym czynnikiem jest mutacja odziedziczona
w linii germinalnej, która odpowiada za wrażliwość na
nowotworzenie w obrębie dotkniętych nią tkanek. Eli-
minacja pozostałej kopii czynnościowej w obrębie poje-
dynczej komórki w wyniku przypadkowej mutacji soma-
tycznej lub drugiego uderzenia (np. delecji genu) prowadzi
247
R O Z D Z I A Ł
40
Zespoły gruczolakowatości
wewnątrzwydzielniczej
Terry C. Lairmore i Jeffrey F. Moley
R o z d z i a ł
40
Zespół gruczolakowatości wewnątrzwydzielniczej typu 1
Zespoły gruczolakowatości wewnątrzwydzielniczej typu 2

do ekspansji klonalnej i rozwoju raka. Wystąpienie zin-
dywidualizowanych czynników o charakterze drugiego
uderzenia w obrębie kilku organów docelowych wyja-
śnia wieloogniskowość choroby, tak charakterystyczną
dla zajętych tkanek endokrynnych. Mutacje somatyczne
w obrębie genu MEN 1 pojawiają się często w sporadycz-
nych gruczolakach przytarczyc, guzach o typie insulino-
ma, gastrinoma, gruczolakach przysadki i rakowiakach
oskrzela, potwierdzając, że utrata genu MEN 1 przyczy-
nia się do rozwoju podgrupy niepodlegających dziedzi-
czeniu guzów endokrynnych.
Gen MEN 1 składa się z 10 eksonów o rozpiętości
9 kb genomicznego DNA i koduje 610-aminokwasowe
białko, nazywane białkiem menin [2]. Ekspresja białka
menin jest wszechobecna zarówno w tkankach endo-
krynnych, jak i nieendokrynnych. Inaczej niż w przy-
padku jądrowych mechanizmów sygnałowych, analiza
sekwencji białka menin nie wykazuje istotnej homologii
w stosunku do innych znanych rodzin białek. Sekwen-
cja białka menin jest bardzo konserwatywna z ewolu-
cyjnego punktu widzenia, bo wykazuje 98% zgodności
z mysim MEN 1. Wypadnięcie obu alleli MEN 1 prowa-
dzi u myszy do śmierci embrionu [3], co sugeruje, że
białko menin ma zasadnicze znaczenie we wczesnym
rozwoju i może odgrywać większą rolę w regulacji
wzrostu komórkowego, który nie podlega regulacji
w tkankach endokrynnych, zajętych chorobą w zespole
MEN 1. Heterozygotyczne myszy MEN 1
+/-
wykazują
utratę somatyczną dzikich odmian alleli MEN 1 w ob-
rębie komórek guza [3], co prowadzi do rozwoju kon-
stelacji guzów endokrynnych, znacząco podobnych do
zespołu MEN 1 u ludzi.
Białko menin jest dominującym białkiem jądrowym
wiążącym się z JunD, członkiem AP-1 z rodziny czyn-
ników transkrypcyjnych, i odpowiada za transkrypcję
mediowaną przez JunD. Ponadto białko menin – jak się
okazało – fizycznie wchodzi w interakcję z różnymi od-
mianami innych białek, w tym czynnikami transkryp-
cyjnymi, czynnikami obróbki DNA, białkami napraw-
czymi DNA i białkami szkieletowymi komórki (Smad3,
NF-kappaB, nm23, Pem, FANCD2, RPA2, ASK i inne)
[4,5]. Wyniki wszystkich ostatnich badań nie pozwalają
na jasne przedstawienie obrazu mechanizmów aktyw-
ności supresorowej białka menin, a także szczegółowe
określenie jego roli w tumorogenezie endokrynnej, cho-
ciaż różne interakcje tego białka sugerują kluczową rolę
w regulacji transkrypcji, obróbki i naprawy DNA oraz
zachowaniu integralności cytoszkieletu.
Wykazano, że nadekspresja białka menin osłabia fe-
notyp przekształconych komórek Ras NIH-3T3, co jest
równoznaczne z jego przypuszczalną funkcją supresoro-
wą. Ponadto wysunięto przypuszczenie co do możliwej
roli białka menin w ograniczaniu aktywności telomerazy
w komórkach somatycznych, co przynajmniej w części
tłumaczy jego właściwości supresorowe. Jak niedawno
wykazano, białko menin reguluje procesy transkrypcji
w obrębie zróżnicowanych komórek poprzez wiązanie
i modulację aktywności metylotransferazy histonowej
kompleksu białek jądrowych w kierunku aktywacji wy-
branych genów, do których należą zależne od cyklin
kinazy inhibitorowe p27
Kip1
i p18
Ink4c
[6,7], a także inne
czynniki regulatorowe cyklu komórkowego. W kilku
niedawnych badaniach zasugerowano, że poprzez pro-
mowanie modyfikacji histonu za pomocą wybranych
promotorów genów białko menin promuje podtrzymy-
wanie transkrypcji krytycznych czynników regulatoro-
wych cyklu komórkowego o zasadniczym znaczeniu dla
kontroli wzrostu normalnych komórek endokrynnych.
Odkrycia te sugerują, że białko menin może odgrywać
rolę mediatora podczas czynności supresyjnej poprzez
regulację procesu metylacji histonów w obrębie regio-
nów promotorowych genów HOX i p18
Ink4c
, p27
Kip1
, a być
może także i innych inhibitorów CDK.
Białko MML (mixed-lineage leukemia) jest zmutowaną
metylotransferazą histonową, spotykaną w pewnej gru-
pie ostrych białaczek. Wykazano, że białko supresoro-
we menin jest zasadniczym czynnikiem onkogenetycz-
nym w patogenezie białaczek związanych z MML [8,
9]. Istnieje pewien nieoczekiwany paradoks, dotyczący
interakcji między białkiem menin, które jest produk-
tem białkowym genu supresorowego, i MML, który jest
produktem protoonkogenu. W komórkach hematopo-
etycznych białko menin współdziała (zachowując się
jak zasadniczy kofaktor onkogenny) ze zmutowanym
białkiem MML, odgrywając z nim wspólnie rolę w pa-
togenezie białaczki. W komórkach neuroendokrynnych
dzika odmiana białka menin wchodzi w interakcje
z białkiem MML, by promować ekspresję inhibitorów
antyproliferacyjnych CDK (p18, p27), które odgrywają
prawdopodobnie podstawową rolę w aktywności su-
presorowej menin. Stosując metodę mikropłytkowej
analizy szerokogenowej immunoprecypitacji chroma-
tyny, wykazano ostatnio częstą bliską kolokację biał-
ka menin z kompleksem białkowym, modyfikującym
strukturę chromatyny, i potwierdzono, że może on także
wiązać wiele innych promotorów poprzez alternatyw-
ny mechanizm [10]. Utrata mysiego genu supresorowe-
go Men 1 in vitro przez mysie fibroblasty embrionalne
przyspiesza cykl komórkowy poprzez przejście z fazy
G
0
/G
1
- do fazy S, a in vivo związane allele Men 1 mogą
być wycięte w sposób kontrolowany na pewien czas, co
bezpośrednio wzmacnia proliferację komórek wysepek
trzustkowych [11]. Rola białka menin jako białka supre-
sorowego jest złożona i nie została jak dotąd całkiem
wyjaśniona, pomimo tych ostatnich odkryć.
W obrębie genu MEN 1 opisano ponad 300 niezależ-
nych mutacji (omówionych w pozycji piśmiennictwa nr
12). Dlatego też istnieje prawie tak wiele unikatowych
mutacji, jak wiele jest genetycznie niezależnych rodzin.
Wśród rozmaitych mutacji MEN 1 znajdują się mutacje
nonsensowne, zmieniające sens, zmiany ramki odczytu
i delecje, a także defekty prowadzące do rozdzielenia
RNA. Mutacje są rozrzucone po całej sekwencji kodują-
cej i w obrębie połączeń genów intron-ekson (ryc. 40-1).
Około jedna trzecia spośród opisanych mutacji w obrę-
bie genu MEN 1 prowadzi do przedwczesnego zakoń-
czenia translacji i procesu wydłużania C-końcowego
fragmentu białka menin. W zespole MEN 1 nie stwier-
dzono występowania prostej korelacji genotypowo-fe-
notypowej, chociaż opisano różne odmiany fenotypowe
tej choroby (izolowana nadczynność przytarczyc, częste
występowanie prolaktinoma).
248
Część VIII Chirurgia endokrynologiczna

Obecnie w wyspecjalizowanych ośrodkach możliwe
jest przeprowadzenie badań genetycznych, ale z pew-
nymi ograniczeniami. Wykrycie mutacji wiążącej się
z chorobą w rodzinie, w której już wcześniej zdefinio-
wano specyficzną zmianę genetyczną, jest proste. Na-
tomiast w nowej rodzinie konieczne jest pracochłonne
przebadanie kolejnych sekwencji kodujących połączenia
intron-ekson w celu dokonania oceny wszystkich moż-
liwych mutacji. Z formalnego punktu widzenia zasad-
nicze znaczenie dla wszechstronnego programu badań
genetycznych ma poradnictwo genetyczne i uzyskanie
uświadomionej zgody chorego na potencjalne wykorzy-
stanie wiedzy, pochodzącej z przeprowadzanych badań
genetycznych, w dalszym leczeniu, z zachowaniem za-
strzeżeń, wynikających z prawa do prywatności i prawa
do pełnej informacji medycznej.
Obraz kliniczny i leczenie
Podstawową cechą, która rozwija się zasadniczo
u wszystkich chorych z wrodzoną mutacją MEN 1 jest
hiperkalcemia spowodowana wielogruczołowym roz-
rostem przytarczyc. U chorych mogą także wystąpić
NET trzustki i dwunastnicy, rakowiaki oskrzeli i gra-
sicy, a także gruczolaki przedniego płata przysadki.
U chorych z zespołem MEN 1 występują ponadto
znacznie częściej rakowiaki oskrzeli i grasicy, guzki tar-
czycy, rozrost guzkowy kory nadnerczy, tłuszczaki, wy-
ściółczaki i skórne naczyniowłókniaki. Klinicznie zespół
MEN 1 jest zdefiniowany jako występowanie u chorego
nowotworów w obrębie przynajmniej dwóch docelowo
endokrynnych tkanek (w przytarczycach, wewnątrz-
wydzielniczej części trzustki, przysadce), a rodzinny
zespół MEN 1 jest zdefiniowany poprzez dodatkowe
występowanie przynajmniej jednego typu guza u krew-
nych pierwszego stopnia.
Zespół MEN 1 stwierdza się równie często u męż-
czyzn i u kobiet, co wynika z autosomalnie dominu-
jącego sposobu dziedziczenia. Zespół MEN 1 opisano
w różnych regionach geograficznych i w wielu grupach
etnicznych, nie stwierdzając predylekcji do żadnej z ras.
Gen MEN 1 wykazuje się zasadniczo 100% penetracją,
ale różnym stopniem ekspresji, tak więc każdy z chorych
może prezentować niektóre, ale niekoniecznie wszyst-
kie składowe zespołu. Najczęstszą nieprawidłowością,
występującą w MEN 1, jest wielogruczołowy rozrost
przytarczyc, który zasadniczo ma miejsce u 98–100%
chorych. Guzy neuroendokrynne trzustki i dwunast-
nicy (cechujące się złośliwym potencjałem) występują
u około 30–80% chorych, a guzy przysadki ujawniają
się klinicznie u około 15–50% chorych. W badaniach
autopsyjnych opisano zmiany patologiczne w obrębie
wszystkich trzech tkanek wewnątrzwydzielniczych
zasadniczo u wszystkich chorych. Guzy endokrynne,
rozwijające się w przebiegu rodzinnej postaci zespołu
MEN 1, w porównaniu z guzami endokrynnymi roz-
wijającymi się sporadycznie charakteryzują się pojawia-
niem się u chorych w młodszym wieku, wieloognisko-
wym zajęciem docelowych tkanek endokrynnych i rów-
noległym rozwojem nowotworów w różnych tkankach
endokrynnych.
Manifestacja kliniczna zespołu u chorych z MEN 1 za-
leży od rodzaju zajętej tkanki endokrynnej, rodzaju pro-
dukowanego w nadmiarze hormonu lub miejscowego
oddziaływania masy guza, a także od skłonności no-
wotworu do złośliwej progresji. W przeszłości najczęst-
szymi dolegliwościami zgłaszanymi przez chorych
były ciężkie dolegliwości wrzodowe lub hipoglikemia,
będące następstwem nadmiaru hormonów. W ostat-
nim czasie główną przyczyną śmiertelności u chorych
z zespołem MEN 1 jest złośliwa progresja nowotworów
neuroendokrynnych trzustki bądź też złośliwych rako-
wiaków klatki piersiowej.
Przytarczyce
Najczęstszą patologią endokrynną (>98% chorych)
w zespole MEN 1 są wielogruczołowe zmiany guzowa-
te przytarczyc. Guzy przytarczyc w zespole MEN 1 są
wynikiem rozrostu klonalnego wskutek inaktywacji
obu alleli genu supresorowego MEN 1, do czego do-
1
2
3
149Ggt
→ct
g
→a–9
g
→c–1
g
→a+1
G156D
Del 11 +1
559insC
*N527X
*210,211delACAG
*307delC
C241R
Q393X
Q349X
*W341X
Y313X
263-266del9
219insA
319delAT
4
5
6
7
8
9
10
MUTACJE GERMINALNE GENU MEN 1
W471X
464,465delGGCC
Rycina 40-1
Mutacje germinalne w obrębie genu MEN 1 w grupie 25 krewnych. Mutacje są rozmieszczone w obrębie dziewięciu
kodujących eksonów genu. Zaburzenia genetyczne mogą obejmować zmianę sensu, mutację nonsensowną, zmianę ramki od-
czytu lub defekt dzielący RNA, które mogą wystąpić gdziekolwiek w obrębie eksonów kodujących i bezpośrednio otaczających
je sekwencji intronów. Powyżej ryciny przedstawiono pięć defektów dzielących i dwie mutacje zmieniające sens genu MEN 1,
a poniżej ryciny także siedmiu mutacji nonsensownych i sześciu mutacji zmieniających ramkę odczytu. (Za: Mutch MG, Dilley
WG, Sanjurjo F et al: Germline mutations in the multiple endocrine neoplasia type 1 gene: Evidence for frequent splicing defects.
Hum Mutat 13:175-185, 1999).
Rozdział 40 Zespoły gruczolakowatości wewnątrzwydzielniczej
249
chodzi w następstwie dwóch odrębnych zdarzeń, stąd
też ze ściśle genetycznego punktu widzenia mają
charakter mnogich gruczolaków [13]. Przeciwnie jest
w przypadkach sporadycznej pierwotnej nadczynności
przytarczyc, gdy mniej niż 15% chorych ma chorobę
wielogruczołową. Powiększenie przytarczyc u chorych
z zespołem MEN 1 zwykle ma charakter asymetryczny
(ryc. 40-2), co zawsze stwierdza się w przypadku jed-
norazowej interwencji [13].
Zazwyczaj pierwszą biochemiczną nieprawidłowo-
ścią, wykrywaną u chorych z MEN 1, jest hiperkalcemia,
która może wyprzedzać o kilka lat wystąpienie klinicz-
nych objawów NET trzustki lub gruczolaka przysadki.
Bezobjawową hiperkalcemię stwierdza się u wielu cho-
rych w toku wieloletniej obserwacji. Czasem zdarzają
się kamica nerkowa lub powikłania w zakresie kośćca,
lecz niezbyt często. Zasadniczo nadczynność przytar-
czyc u chorych z MEN 1 ujawnia się we wcześniejszym
wieku i zazwyczaj powoduje łagodniejszą hiperkalce-
mię niż obserwowana u chorych ze sporadyczną po-
stacią pierwotnej nadczynności przytarczyc. Rozpozna-
nie polega na wykazaniu podwyższonego osoczowego
stężenia wapnia z towarzyszącym nieadekwatnie pod-
wyższonym stężeniem parathormonu (PTH). Chorzy
z MEN 1 mają zwykle znacznie podwyższone wyda-
lanie wapnia w 24-godzinnej zbiórce moczu. U cho-
rych z genetycznie potwierdzonym zespołem MEN 1,
przechodzących prospektywne biochemiczne badania
przesiewowe, moment wystąpienia hiperkalcemii wy-
stępuje zazwyczaj między 11 a 14 rokiem życia [14]
(ryc. 40-3).
Celem leczenia operacyjnego nadczynności przytar-
czyc u chorych z zespołem MEN 1 jest osiągnięcie moż-
OSOCZOWE STĘŻENIE WAPNIA A WIEK CHORYCH Z POTWIERDZENIEM GENETYCZNYM
11,5
11
10,5
10
9,5
9
5
0
10
15
20
25
Wiek (lata)
O
so
cz
ow
e
st
ęż
en
ie
w
ap
ni
a
(m
g/
dl
)
Pacjent 1
Pacjent 2
Pacjent 3
Pacjent 4
Pacjent 5
Pacjent 6
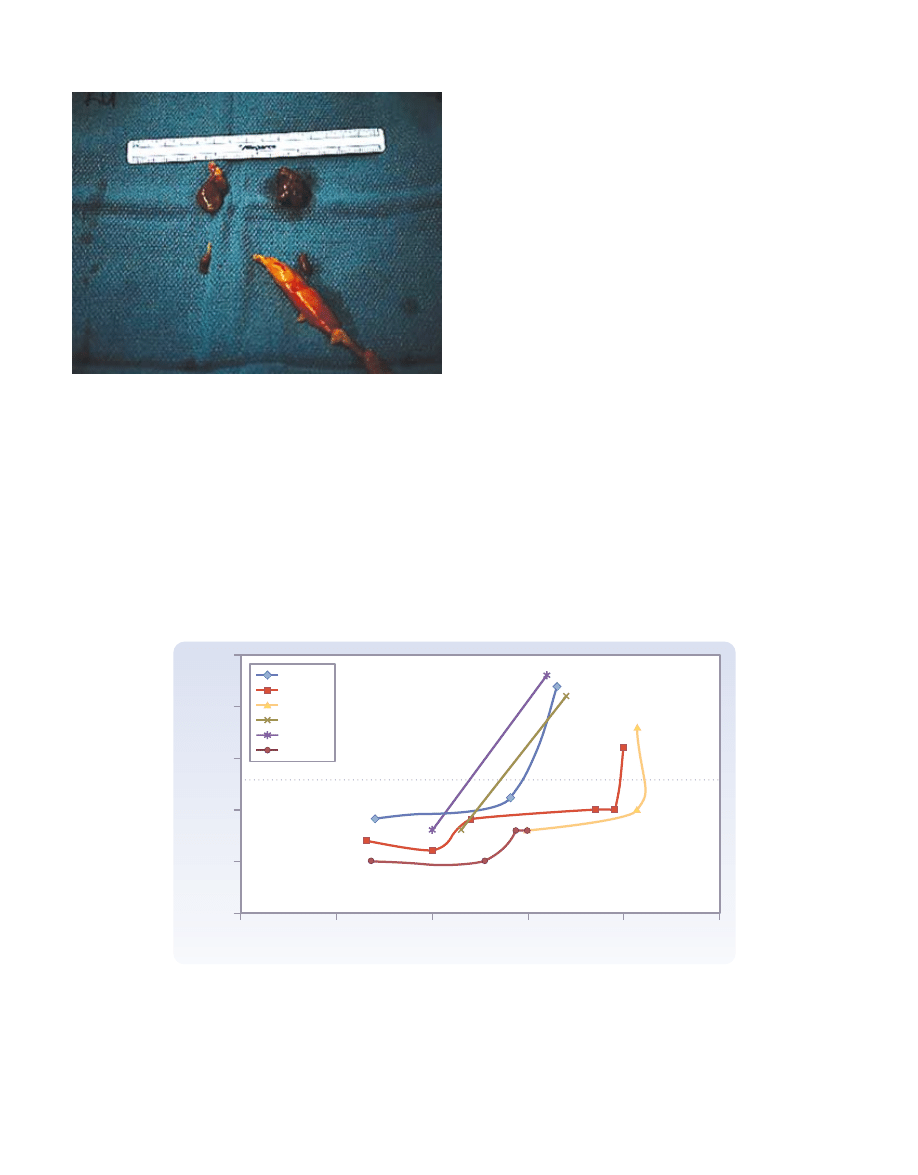
Rycina 40-2
Fotografia czterech przytarczyc, wyciętych chore-
mu z zespołem MEN 1, ułożonych zgodnie z ich lokalizacją na
szyi. Zwraca uwagę asymetria guzów przytarczyc ze znacznie
powiększonymi górnymi przytarczycami i słabiej powiększo-
nymi dolnymi przytarczycami. Przytarczyca lewa dolna była
zlokalizowana w obrębie górnego bieguna grasicy.
Rycina 40-3
Osoczowe stężenia wapnia w zależności od wieku i płci chorych genetycznie obciążonych zespołem MEN 1. Dane
te zbierano prospektywnie po genetycznym potwierdzeniu rozpoznania. Każda krzywa jest oznaczona innym kolorem i dotyczy
innego chorego zgodnie z legendą zamieszczoną w górnym lewym rogu. Osoczowe stężenie wapnia (mg/dl) przedstawiono
w odniesieniu do wieku (lata). Górna granica zakresu referencyjnego dla wapnia została oznaczona linią przerywaną. W tej wy-
selekcjonowanej podgrupie chorych z dodatnim wynikiem badań genetycznych, obserwowanych prospektywnie, ewidentny jest
gwałtowny wzrost stężenia wapnia między dziesiątym a piętnastym rokiem życia. (Za: Lairmore TC, Piersall LD, DeBenedetti
MK et al.: Clinical genetic testing and early surgical intervention in patients with multiple endocrine neoplasia type 1 [MEN1].
Ann Surg 239:637-647, 2004).
250
Część VIII Chirurgia endokrynologiczna

liwie najniższego odsetka nawrotowej hiperkalcemii
przy jednoczesnej minimalizacja ryzyka wystąpienia
utrwalonej niedoczynności przytarczyc. Ze względu na
to, że chorzy z MEN 1 mają chorobę wielogruczołową,
w grupie tej obserwuje się znacząco wyższy odsetek
nawrotowej i przetrwałej nadczynności przytarczyc
po paratyreoidektomii niż u chorych ze sporadycz-
ną pierwotną nadczynnością przytarczyc. Do ostatnio
akceptowanych zabiegów operacyjnych u chorych
z MEN 1 zalicza się albo subtotalną paratyreoidekto-
mię (usunięcie 3 i pół przytarczycy) z pozostawieniem
remnantu przytarczycy na szyi, albo całkowitą paraty-
reoidektomię (wycięcie całkowite wszystkich czterech
przytarczyc) z autotransplantacją tkanki przytarczyc
do mięśni przedramienia. Konieczne jest także wyko-
nanie tymektomii z dostępu szyjnego ze względu na
możliwość ektopowej lokalizacji tkanki przytarczyco-
wej lub obecność dodatkowej przytarczycy w jednym
z górnych biegunów grasicy. Generalnie u chorych
z MEN 1 przed pierwszym zabiegiem operacyjnym
nie ma potrzeby wykonywania przedoperacyjnych
badań obrazowych, ponieważ właściwe ich leczenie
i tak polega na wykonaniu obustronnej eksploracji
szyi ze śródoperacyjną identyfikacją wszystkich czte-
rech przytarczyc. Nieinwazyjne badania lokalizacyjne,
takie jak scyntygrafia przytarczyc i badanie USG szyi,
są natomiast pomocne w lokalizacji przytarczyc przed
zabiegiem reoperacji.
Wciąż trwa dyskusja na temat optymalnego zabiegu
operacyjnego w zakresie przytarczyc u chorych z ze-
społem MEN 1. W okresie do 5 lat po zabiegu odse-
tek nawrotowej nadczynności przytarczyc u chorych
z chorobą wielogruczołową w przebiegu MEN 1 wy-
nosi od 30–40%, co odzwierciedla genetyczne podło-
że predyspozycji, wynikającej z istnienia „pierwszego
uderzenia” w każdej komórce przytarczyc. Potencjalną
zaletą całkowitej paratyreoidektomii i heterotropowej
autotransplantacji do przedramienia jest możliwość ła-
twiejszego leczenia nawrotowej nadczynności przytar-
czyc, jeżeli dojdzie do jej wystąpienia, poprzez wycięcie
przeszczepionej tkanki, co można zrobić w znieczule-
niu miejscowym (unikając ewentualnych powikłań po-
wtórnej operacji w obrębie szyi). Subtotalna resekcja
– jak uważa wielu autorów – prowadzi do podobnych
wyników bez narażania się na ryzyko utrwalonej hi-
pokalcemii w przypadku niewydolności autoprzesz-
czepu [15, 16]. W ostatnim czasie oba sposoby leczenia
dają zasadniczo takie same rezultaty, a odpowiedź na
pytanie, która z technik jest lepsza, będzie możliwa
po uzyskaniu wyników prospektywnych badań z ran-
domizacją. Późna transplantacja autologicznej tkanki
przytarczyc, poddanej krioprezerwacji, zmniejsza od-
setek chorych z przetrwałą pooperacyjną hipokalce-
mią po obu wyżej omówionych zabiegach. W jednym
z ostatnich badań [17] w około 60% przypadków au-
toprzeszczepione tkanki krioprezerwowanych przy-
tarczyc wykazywały cechy żywotności przeszczepu
w badaniu gradientu żylnego stężenia PTH między
ramieniem po stronie przeszczepu i stronie przeciw-
nej, a w 40% przypadków autoprzeszczepy zapewnia-
ły wystarczającą suplementację.
Trzustka i dwunastnica
Drugą co do częstości składową zespołu MEN 1 są
NET dwunastnicy i trzustki. U 30–80% (w zależności
od metodyki badania) chorych z MEN 1 rozwijają się
klinicznie jawne guzy. Guzy te, razem z rakowiakami
wewnątrz klatki piersiowej, niosą ze sobą istotny poten-
cjał złośliwości i odpowiadają za większość powikłań
i śmiertelność u chorych z MEN 1. Zmiany patologiczne
są zazwyczaj wieloogniskowe, a rozlany rozrost komó-
rek wysepek trzustkowych i tworzenie mikrogruczola-
ków mogą następować w obszarach trzustki odległych
od makroskopowo widocznego guza. Guzy gastrino-
ma często występują w obrębie ściany dwunastnicy lub
w okolicy pozatrzustkowej. Guzy okolicy głowy trzust-
ki i dwunastnicy u chorych z MEN 1 powodują objawy,
wynikające albo z ich nadmiernej czynności wydziel-
niczej, albo z efektu masy guza, i cechują się dużym
potencjałem złośliwienia.
U chorych z MEN 1 najczęściej występują nieczynne
hormonalnie NET trzustki oraz NET wydzielające poli-
peptyd trzustkowy. Najczęstszym czynnym hormonalnie
guzem NET u chorych z MEN 1 jest gastrinoma. Do
objawów stwierdzanych u chorych z hipergastryne-
mią lub zespołem Zollingera-Ellisona (ZES) należą bóle
w nadbrzuszu, zapalenie refluksowe przełyku, biegun-
ka wydzielnicza i utrata masy ciała. W obecnych cza-
sach, kiedy w leczeniu rozpowszechnione są inhibitory
pompy protonowej, czynna postać choroby wrzodowej
jest stwierdzana w chwili rozpoznania u około 20% cho-
rych. Czasami chorzy mogą doświadczać ciężkiej skazy
wrzodowej, a także zwężenia lub perforacji przełyku,
spowodowanego zapaleniem refluksowym. Rozpozna-
nie gastrinoma polega na wykazaniu hipersekrecji kwa-
su żołądkowego (>15 mEg/l u nieoperowanych chorych,
lub >5 mEq/l u chorych po przebytym leczeniu opera-
cyjnym choroby wrzodowej) w powiązaniu z podwyż-
szonym osoczowym stężeniem gastryny na czczo (>100
pg/ml). Rozpoznanie może potwierdzić nieprawidłowy
wynik testu z sekretyną.
Guzy gastrinoma, rozwijające się u chorych z MEN
1, są zazwyczaj złośliwe (około 80%), co potwierdza-
ją przerzuty do regionalnych węzłów chłonnych bądź
przerzuty odległe. Dawniej uważano, że gastrinoma
lokalizują się głównie w obrębie głowy trzustki w re-
jonie tzw. trójkąta gastrinoma. Nowsze dane sugerują,
że gastrinoma u chorych z MEN 1 występują częściej
w ścianie dwunastnicy [18,19] (ryc. 40-4). Ze względu
na małą wielkość gastrinoma mogą nie zostać zlokali-
zowane w przedoperacyjnych badaniach obrazowych,
takich jak tomografia komputerowa (TK) i angiogra-
fia. Gastrinoma w obrębie ściany dwunastnicy i gło-
wy trzustki bywają z powodzeniem lokalizowane za
pomocą ultrasonografii endoskopowej. Istnieją kontro-
wersje co do możliwości rozwoju gastrinoma pierwot-
nie w obrębie węzłów chłonnych. Chociaż niekiedy
uzyskiwano biochemiczne wyleczenie po wycięciu
gastrinoma w lokalizacji węzłowej [20], to nie ma ja-
sności, czy nie są to przypadki ukrytego i niezlokali-
zowanego ogniska pierwotnego gastrinoma w obrębie
trzustki lub ściany dwunastnicy z przerzutami do wę-
złów chłonnych.
Rozdział 40 Zespoły gruczolakowatości wewnątrzwydzielniczej
251
Wyszukiwarka
Podobne podstrony:
Zespół wykrzepiania wewnątrznaczyniowego, MEDYCYNA i RATOWNICTWO, Pediatria
16. gruczoly wewnatrzwydzielnicze - pytania
Zespół zewnątrzrdzeniowy i wewnątrzrzeniowy, 38
zespol wewnatrzrdzeniowy
Patofizjologia, Nadkrzepliwość występuje w przewlekłych zespołach wewnąt, Nadkrzepliwość występuje
zespol wewnatrzrdzeniowy, Zespoły Neurologiczne
11 - Gruczoły zewnątrz- i wewnątrzwydzielnicze, Wykład 11
Zespół wzmożónego ciśnienia wewnątrzczaszkowego ppt
Stanowisko zespolu PTG na temat profilaktyki raka gruczolowego szyjki macicy 2008
Zespół nerczycowy
9 RF ZEspól 0 Środki trwałe
więcej podobnych podstron