
1
ĆWICZENIE 4
Metody rozdzielania mieszanin związków organicznych
Sposób rozdzielania związków organicznych polega głównie na wykorzystaniu
różnic w ich wielkościach fizycznych, takich jak: stan skupienia, rozpuszczalność w
różnych rozpuszczalnikach czy prężność par.
I. Oddzielanie ciał stałych od cieczy
Mieszaniny substancji stałych od ciekłych oddziela się najczęściej przez sączenie,
rzadziej przez wirowanie.
Sączenie
Sączenie przeprowadza się przy pomocy lejka, sączka i naczynia do odbierania
przesączu. Sposób wykonania zależy od celu sączenia. Gdy sączenie ma na celu
oddzielenie czystego osadu lub przy sączeniu niewielkich ilości cieczy, używane są
gładkie sączki bibułowe. Sączek gładki otrzymujemy przez dwukrotne zagięcie i
rozwarcie krążka bibuły filtracyjnej. Taki sączek umieszcza się w lejku zwykłym i
dopasowuje tak, aby cały przylegał do wewnętrznej powierzchni lejka i sięgał kilka
milimetrów poniżej jego krawędzi.
Szybkość sączenia zależy od powierzchni czynnej sączka. Dlatego przy usuwaniu
niewielkiej ilości zanieczyszczeń z dużej ilości cieczy stosuje się sączki z możliwie
największą powierzchnią czynną, sączki fałdowane.
W celu usunięcia nierozpuszczalnego osadu (zanieczyszczeń) z nasyconych
gorących roztworów i aby zapobiec krystalizacji rozpuszczonej substancji na sączku,
sączenie przeprowadza się we wcześniej ogrzanym zestawie do sączenia lub przy
użyciu lejka umieszczonego w specjalnym ogrzewaczu.
Jeżeli celem sączenia jest dobre oddzielenie powstałego w wyniku krystalizacji
osadu od roztworu zwanego ługiem pokrystalicznym, stosuje się lejki z sitkiem
porcelanowym lub lejki sitowe zwane lejkami Büchnera, a sączenie przeprowadza się
pod zmniejszonym ciśnieniem. W zestawie do sączenia pod zmniejszonym ciśnieniem
funkcje odbieralnika spełnia najczęściej kolba ssawkowa podłączona do kolby
próżniowej. Wszystkie elementy takiego zestawu muszą być szczelnie połączone za
pomocą gumowych korków i węży próżniowych.
Do
sączenia cieczy uszkadzającej bibułę (np. stężone kwasy lub zasady) używa się
szklanych lejków z porowatą płytką wykonaną ze szkła spiekanego.

2
II. Rozdzielanie ciał stałych
Adsorpcja
Pojęciem adsorpcji określa się wzrost stężenia substancji, występujący na granicy
faz pod wpływem różnic w natężeniu sił wzajemnego oddziaływania cząsteczek. Są to
siły o różnej mocy, od słabych sił Van der Waalsa odpowiedzialnych za tzw. adsorpcję
fizyczną, aż do sił o mocy bliskiej wiązaniu chemicznemu, będących przyczyną tzw.
chemisorpcji.
Do rozdzielania lub oczyszczania substancji będących w roztworach wykorzystuje
się najczęściej adsorpcję zachodzącą na granicy faz: ciało stałe — ciecz i stosuje się
adsorbenty w postaci proszków. Zdolność adsorpcyjna adsorbenta jest przede
wszystkim uzależniona od budowy jego powierzchni i jest szczególnie duża, gdy ma
on budowę porowatą. Biorąc pod uwagę różny stopień powinowactwa adsorpcyjnego
składników rozdzielanej mieszaniny do powierzchni adsorpcyjnej wyróżniamy dwa
rodzaje metod adsorpcyjnych: pozytywną i negatywną. W przypadku adsorpcji
pozytywnej, substancja oddzielana zatrzymuje się na adsorbencie, a zanieczyszczenia
nie. W przypadku adsorpcji negatywnej zatrzymywane są zanieczyszczenia, a
substancja oczyszczona pozostaje w roztworze.
Do najczęściej stosowanych adsorbentów należą:
• węgiel zwierzęcy,
• żel krzemionkowy,
• ziemia okrzemkowa.
Adsorbenty te, dodane do roztworu oczyszczanej substancji (zanieczyszczonej np.
barwnikiem), na dużej powierzchni adsorbują różne zanieczyszczenia (np. barwne).
Mieszaninę sączy się lub odwirowuje i z oczyszczonego roztworu (np. już
odbarwionego) izoluje się przez krystalizację niezaadsorbowaną substancję.
W przypadku adsorpcji pozytywnej, zaadsorbowaną substancję oddziela się od
adsorbenta przez wymywanie (elucję). Elucję prowadzi się zazwyczaj roztworem o
sile jonowej większej niż siła jonowa roztworu zastosowanego podczas adsorpcji.
Sublimacja
Sublimacja jest procesem, w którym podczas ogrzewania określone substancje
przechodzą w stan pary, a następnie oziębiona para, bez skraplanie się, przechodzi w
stan stały. Metodą sublimacji otrzymuje się związki o najwyższej czystości. Procedura
jest prostsza i przewyższa pracochłonną oraz czasochłonną metodę krystalizacji, a

3
także pozwala na oczyszczenie dowolnie małych ilości substancji zdolnych do
sublimacji.
Ekstrakcja
Ekstrakcja polega na wykorzystaniu różnic między rozpuszczalnością
wydzielanej substancji i towarzyszących jej domieszek. Substancję wyodrębnianą
można ekstrahować zarówno z mieszaniny substancji stałych, jak i z roztworów.
Ekstrahując związek łatworozpuszczalny z mieszaniny substancji stałych
nierozpuszczalnych w danym rozpuszczalniku, można stosować przemywanie
mieszaniny rozpuszczalnikiem na sączku. Jeżeli ekstrakcja jest zalecana na gorąco, to
prowadzi się ją zazwyczaj w kolbie pod pionowo zamontowaną chłodnicą (tzw.
zwrotną).
Ekstrakcja substancji z roztworów jest bardziej skomplikowana. Do tego celu
jest wykorzystywany współczynnik podziału wydzielanej substancji między dwie
nierozpuszczające się wzajemnie ciecze (współczynnik podziału trzeciego składnika,
współczynnik Nernsta). Ekstrakcję tego typu przeprowadza się najczęściej w
specjalnym naczyniu zwanym rozdzielaczem. Po wymieszaniu się dwufazowego
układu zawierającego ekstrahowaną substancję, a następnie po rozdzieleniu się
warstw ustala się stan równowagi, w którym stosunek stężeń substancji
ekstrahowanej w obu fazach jest wielkością stałą dla danego układu. Do ekstrakcji
substancji z roztworów wodnych używa się rozpuszczalników łatwo lotnych, które
następnie usuwa się za pomocą destylacji (eter etylowy, chloroform, benzen).
III. Rozdzielanie cieczy
Destylacja
Destylacja jest stosowana do rozdzielania lotnych składników, które różnią się
temperaturą wrzenia. Destylacja prosta polega na ogrzaniu destylowanej cieczy do
wrzenia, skropleniu wytworzonych par i zebraniu destylatu w odbieralniku.
Najprostszy zestaw do destylacji składa się z okrągłodennej kolby służącej do
ogrzania cieczy, połączonej z chłodnicą, w której następuje skraplanie się par,
naczynia służącego jako odbieralnik skroplonej cieczy oraz termometru. W zestawie
tym mogą być rozdzielane mieszaniny dwuskładnikowe, ale tylko wówczas, gdy ich
temperatury wrzenia różnią się co najmniej o 150°C lub gdy drugi składnik jest
nielotny i pozostaje w kolbie destylacyjnej. Podczas rozdzielania mieszaniny

4
składającej się z większej liczby składników różniących się temperaturą wrzenia,
stosuje się destylację frakcyjną (składniki są zbierane w kolejnych frakcjach o
wzrastających temperaturach wrzenia).
IV. Chromatografia
Chromatografia obejmuje metody służące do rozdzielania składników mieszanin.
Wyróżnia się kilka odmian chromatografii (adsorpcyjną, podziałową, jonowymienną i
żelową). W zależności od potrzeb i warunków można posługiwać się techniką
kolumnową, bibułową lub cienkowarstwową.
A. Podział chromatografii zależnie od dominującego mechanizmu
procesu rozdziału
1. Chromatografia adsorpcyjna
Chromatografia adsorpcyjna polega na wykorzystaniu różnic w adsorpcji związków
chemicznych na powierzchni adsorbenta. Rozdział zależy od siły, z jaką dana
substancja jest adsorbowana. Faza nieruchoma (adsorbent) jest silnie polarna i przez
nią przepływa w sposób ciągły mniej polarna faza ruchoma (ciekła lub gazowa). W ten
sposób cząsteczki rozdzielanych składników poruszają się w tym samym kierunku, w
jakim płynie zawierająca je faza ruchoma. Cząsteczki rozpuszczonych substancji
ulegają selektywnemu zagęszczeniu na powierzchni adsorbenta. Zaadsorbowane
składniki odzyskiwane są przez desorpcję (elucję) w kolejności ich wzrastającego
powinowactwa do adsorbenta.
2. Chromatografia podziałowa
Chromatografia podziałowa opiera się na prawie Nernsta – prawie podziału
trzeciego składnika między dwie niemieszające się fazy. Rozdział składników
mieszaniny jest wynikiem różnic współczynników podziału.
3. Chromatografia jonowymienna
Chromatografię jonowymienną przeprowadza się na wymieniaczach jonowych
(jonitach) techniką kolumnową lub cienkowarstwową. Jonity są to żywice naturalne
lub syntetyczne o dużych cząsteczkach nierozpuszczalnych w wodzie i w wielu innych
rozpuszczalnikach oraz w roztworach kwasów, zasad i soli. Wykazują zdolność
wymiany kationów lub anionów związanych z żywicą na odpowiednie jony znajdujące
się w roztworze.

5
4. Chromatografia żelowa (sączenie molekularne)
Sączenie molekularne jest metodą rozdziału, w której zostały wykorzystane
fizyczne i chemiczne właściwości polisacharydu dekstranowego o nazwie Sephadex.
Cząstki jego pęcznieją w wodzie i w roztworach elektrolitów, tworząc sieć
przestrzenną. Cząsteczki większe od największych „oczek” sieci przepływają przez
kolumnę bez przeszkód i zbierane są w tzw. frakcji zerowej. Pozostałe składniki
mieszaniny wnikają do wnętrza sieci przestrzennej w kolejności zwiększających się
rozmiarów. Wymywanie zatrzymanych składników odbywa się w kolejności od cząstek
większych do mniejszych.
B. Podział chromatografii w zależności od sposobu przeprowadzania
rozdziału
1. Chromatografia bibułowa
Chromatografia bibułowa jest odmianą chromatografii podziałowej, w której rolę
nośnika odgrywa odpowiednio spreparowana bibuła filtracyjna pocięta na arkusze,
paski lub krążki. Stosunek prędkości migracji badanego składnika do prędkości
migracji czoła rozpuszczalnika wyznacza współczynnik R
f
, który w określonych
warunkach jest wielkością stałą i charakterystyczną dla danej substancji. Wartość R
f
wyznacza się z wzoru:
Rf =
A
B
gdzie:
A- odległość środka plamy danego składnika od startu,
B- odległość czoła rozpuszczalnika od startu.
2. Chromatografia kolumnowa
Kolumnę (najczęściej szklaną) wypełnia się fazą nieruchomą (adsorbentem,
nośnikiem nasyconym ciekłą fazą nieruchomą, jonitem, granulowanym żelem) i na jej
szczyt wprowadza badany roztwór, a następnie fazę ruchomą (eluent). Zachodzi
rozdzielanie składników, które bądź pozostają w kolumnie (tworząc oddzielne pasma)
lub są kolejno wymagane (elucja). W poszczególnych porcjach wycieku (eluatu)
przeprowadza się oznaczenia rozdzielanych składników.

6
3. Chromatografia cienkowarstwowa
Chromatografia cienkowarstwowa jest metodą rozdzielania substancji przy
zastosowaniu nośników prostych lub mieszanych, uformowanych w postaci cienkich
warstw na płytkach ze szkła lub innego materiału.
W zależności od charakteru sił wiążących, występujących między rozdzielanymi
substancjami i nośnikami, podobnie jak w innych technikach chromatograficznych,
chromatografię cienkowarstwową można zróżnicować na:
• adsorpcyjną — nośnikiem zazwyczaj jest żel krzemionkowy lub tlenek glinu
• podziałową — najczęściej używanym nośnikiem jest sproszkowana celuloza
• jonowymienną — celuloza impregnowana (np. iminami polietylenowymi,
nadającymi właściwości jonowymieniacza)
Techniką chromatografii cienkowarstwowej można z dużym powodzeniem rozdzielać
wiele substancji organicznych: węglowodory i ich halogenowe pochodne, substancje
heterocykliczne, alkohole, fenole, węglowodany, kwasy i wiele innych.
Do zalet chromatografii cienkowarstwowej w porównaniu z innymi, a szczególnie
kolumnową, można zaliczyć:
• łatwiejsze przygotowanie płytek niż kolumny,
• lepszy rozdział i w związku z tym lepsza identyfikacja,
• wygodniejsza obserwacja procesów we wszystkich stadiach rozdziału,
• większa szybkość przepływu rozpuszczalników znacznie skraca czas rozwijania
chromatogramów (20— 120 min),
• możliwość stosowania wywoływaczy w stężonych kwasach i zasadach,
• możliwość ogrzewania płytki aż do zwęglenia substancji, co było niemożliwe w
technice bibułowej.
CZĘŚĆ PRAKTYCZNA
1. Oczyszczanie roztworu mocznika zanieczyszczonego węglanem
wapnia i fluoresceiną
a) oddzielanie węglanu wapnia
Sporządzić sączek bibułowy i dopasować do wewnętrznej powierzchni lejka w
sposób przedstawiony przez asystenta. Lejek umieścić nad kolbą Erlenmayera. Na
sączek wlać około 15 ml zawiesiny (po uprzednim dokładnym wymieszaniu
zawartości butelki), celem oddzielenia nierozpuszczalnego w wodzie węglanu wapnia.

7
b)
adsorpcja barwnika
Do klarownego przesączu dodać szczyptę węgla aktywnego i wytrząsać
mieszaninę przez ok. 5min. Przygotować sączek karbowany i umieścić w lejku
zamocowanym nad zlewką. Mieszaninę przesączyć. Jeśli przesącz jest nadal
zabarwiony, dodać ponownie węgla i powtarzać czynność, aż do otrzymania
bezbarwnego przesączu. Porównać szybkość sączenia na sączku zwykłym i
karbowanym.
2. Resublimacja naftalenu
Do kolby okrągłodennej wsypać niewielką ilość naftalenu zanieczyszczonego
węglem. Kolbę zatkać korkiem z wmontowaną probówką wypełnioną zimną wodą.
Powoli ogrzewać dno kolby, obserwując osadzanie się kryształków czystego naftalenu
na zimnym dnie probówki.
3. Wydzielanie kwasu benzoesowego z wodnego roztworu benzoesanu
sodu
a) ekstrakcja kwasu benzoesowego chloroformem
Do około 10 ml 1% roztworu benzoesanu sodu dodać 2 krople oranżu
metylowego. Następnie dodawać kroplami 1 M kwas siarkowy aż do zmiany
zabarwienia z żółtego na czerwone. Postępowanie to ma na celu wyparcie kwasu
benzoesowego z jego soli sodowej. Roztwór przenieść do rozdzielacza o pojemności
50-100 ml i dodać około 15 ml chloroformu. Mieszaninę wytrząsać przez kilka minut.
Co kilka wstrząsów należy otwierać korek rozdzielacza, aby usunąć nadmiar
wytwarzających się par chloroformu. W przeciwnym razie, może nastąpić rozerwanie
rozdzielacza na skutek powstałego wewnątrz ciśnienia! Rozdzielacz umocować w
statywie i pozostawić do całkowitego rozwarstwienia się cieczy. Rozdzielić ciecze,
zlewając przez kran do kolbki destylacyjnej dolną warstwę chloroformową,
zawierającą kwas benzoesowy (przed odkręceniem kranu należy wyjąć górny korek z
rozdzielacza).
b) usuwanie chloroformu przez destylację
Do kolbki destylacyjnej zawierającej chloroformowy ekstrakt kwasu
benzoesowego dodać kilka ziaren kaolinu, który zapobiega przegrzaniu się
destylowanej cieczy i zapewnia jej równomierne wrzenie. W szyjce kolby umieścić
termometr tak, aby zbiornik z rtęcią znajdował się na wysokości rurki
8
odprowadzającej pary. Rurkę odprowadzającej połączyć szczelnie z chłodnicą
podłączoną do sieci wodociągowej. Kolbę destylacyjną umieścić w płaszczu grzejnym i
obserwować proces destylacji. W czasie destylacji temperatura odczytana na
termometrze nie ulega zmianie i odpowiada temperaturze wrzenia charakterystycznej
dla destylowanego rozpuszczalnika (temp. wrzenia chloroformu = 61
o
C). Gdy
temperatura zaczyna gwałtownie wzrastać należy przerwać destylację i zaobserwować
tworzące się kryształy kwasu benzoesowego.
4. Chromatografia cienkowarstwowa tuszu na żelu krzemionkowym
Na płytce chromatograficznej (pokrytej żelem krzemionkowym) o wymiarach
10 cm x 2,2 cm zaznaczyć delikatnie ołówkiem wzdłuż krótszego boku płytki linię
startu w odległości 1 cm od brzegu. Na linii startu, w równych odległościach, nanieść
w postaci kropki tusz z dwóch różnych flamastrów. Płytkę włożyć do uprzednio
przygotowanej komory chromatograficznej, zawierającej mieszaninę: octanu etylu,
etanolu i wody w stosunku objętościowym 5 : 3 : 2 tak, aby dolna krawędź płytki
była w momencie zanurzania możliwie równoległa do powierzchni cieczy w komorze.
Należy zwrócić uwagę, aby krawędzie boczne nie dotykały ścian komory, gdyż
powoduje to nierówne wznoszenie się rozpuszczalnika. Komorę szczelnie zamknąć.
Płytkę należy wyjąć, gdy czoło rozpuszczalnika osiągnie wysokość około 0,5 cm od
górnego brzegu płytki. Wyciągnąć wnioski odnośnie składu rozdzielanych mieszanin.
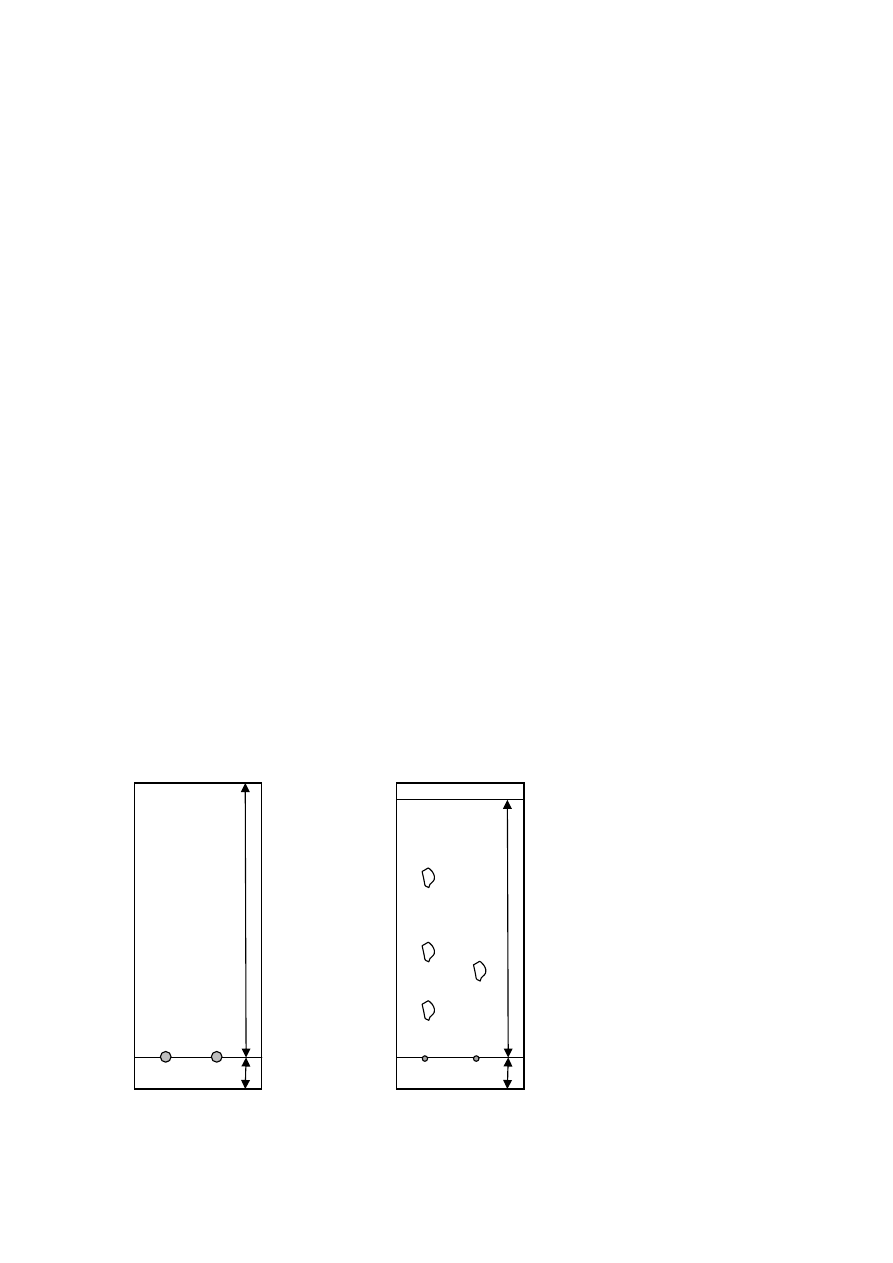
Na rysunku przedstawiono przykładowy chromatogram przed i po rozwinięciu.
8 cm
1cm
czoło rozpuszczalnika
9 cm
1cm
Wyszukiwarka
Podobne podstrony:
Ćwiczenie Chemia 1 (11 10 – 15 10 2010 r )
Ćwiczenie Chemia 1 (11.10. – 15.10.2010 r.)
kinetyka 5 11 2010 id 235066 Nieznany
Chemia 5 11 2010 Sacharydy
Cwiczenia nr 11 (z 14) id 98679 Nieznany
Rachunkowość fiansowa - ćwiczenia (4) 13.11.2010, WSFiZ Białystok - zarządzanie, Semestr III, RACHUN
Prawo karne, cz I ćwiczenia, 21 11 2010 r
7 wyklad 23 11 2010 id 44996 Nieznany (2)
8 wyklad 30 11 2010 id 46777 Nieznany (2)
Chemia 5 11 2010 Lipidy
kinetyka 5 11 2010 id 235066 Nieznany
Ćwiczenie 27 11 2010 2
E1 2010 11 zad 2 id 149115
10.11.2010, prawo administracyjne ćwiczenia(2)
K2 2010 11 zad 1 id 229705
CHEMIA SA,,DOWA WYKLAD 7 id 11 Nieznany
K1 2010 11 zad 3 id 229638
więcej podobnych podstron