
Model atomu
Model atomu

Konsekwencj
ą
odkrytego dualizmu
korpuskularno-falowego musi by
ć
rezygnacja
z mo
ż
liwo
ś
ci wykorzystania poj
ę
cia PUNKTU
MATERIALNEGO w fizyce opisuj
ą
cej
wła
ś
ciwo
ś
ci obiektów mikro
ś
wiata
Pojawia si
ę
konieczno
ść
stworzenia nowej
teorii budowy atomu
bior
ą
cej pod uwag
ę
dualizm korpuskularno-falowy

1926 - model budowy atomu
na podstawie mechaniki
kwantowej
1926 - model budowy atomu
na podstawie mechaniki
kwantowej
stan atomu opisany jest za pomoc
ą
funkcji
matematycznych
elektrony w zale
ż
no
ś
ci od ich poziomu
energetycznego zajmuj
ą
orbitale
, tj,
przestrzenie o najwi
ę
kszym
prawdopodobie
ń
stwie napotkania elektronu
badania
Heisenberga, Schrodingera i Borna
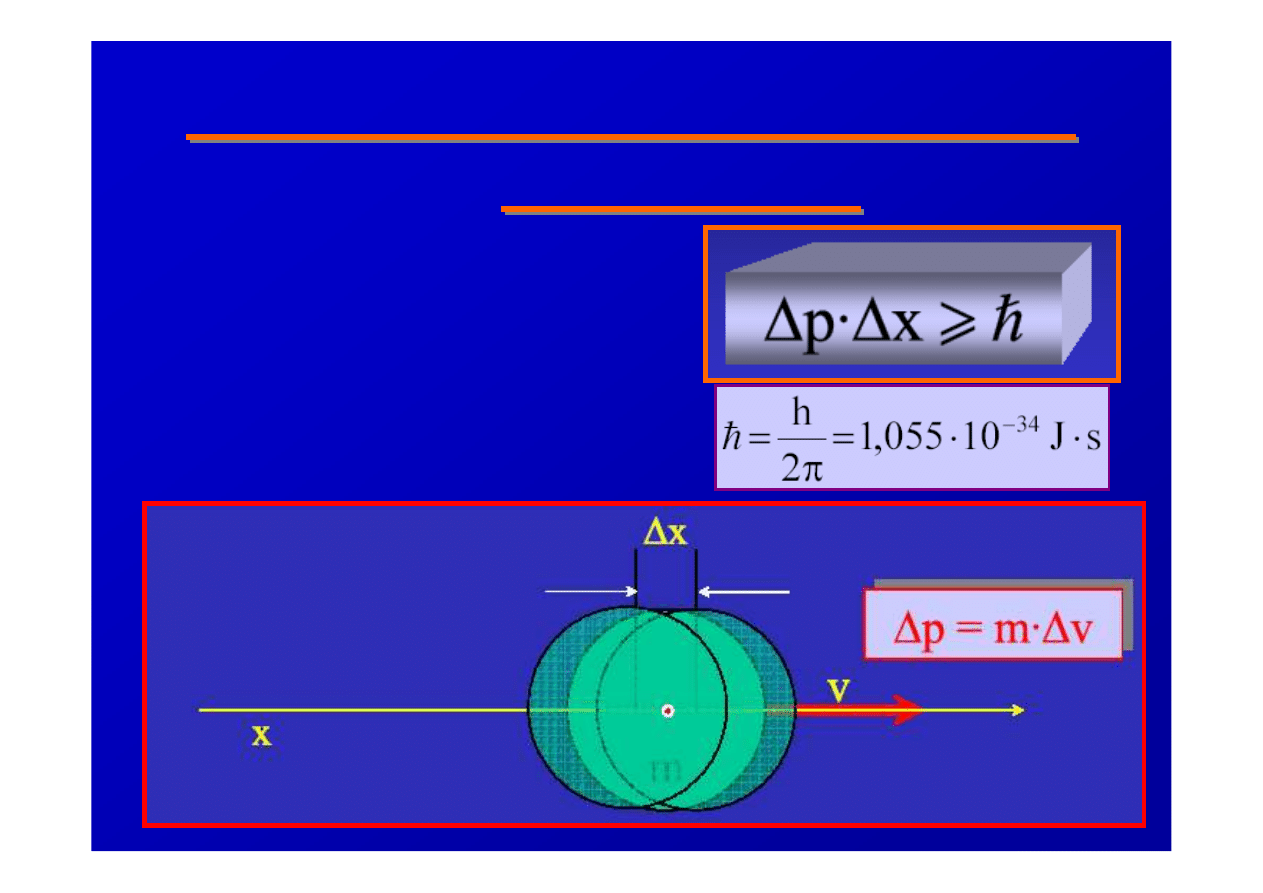
1925 - Zasada nieoznaczono
ś
ci
Heisenberga
1925 - Zasada nieoznaczono
ś
ci
Heisenberga
istniej
ą
pary wielko
ś
ci
fizycznych, których
RÓWNOCZE
Ś
NIE nie
mo
ż
na zmierzy
ć
z
absolutn
ą
dokładno
ś
ci
ą

Zasada
nieoznaczono
ś
ci
Heisenberga
Z relacji Heisenberga wynika
niemo
ż
liwo
ść
jednoznacznego
przewidywania toru
elektronu
Mechanika kwantowa podaje tylko
prawdopodobie
ń
stwo znalezienia cz
ą
stki w
okre
ś
lonym elemencie przestrzeni
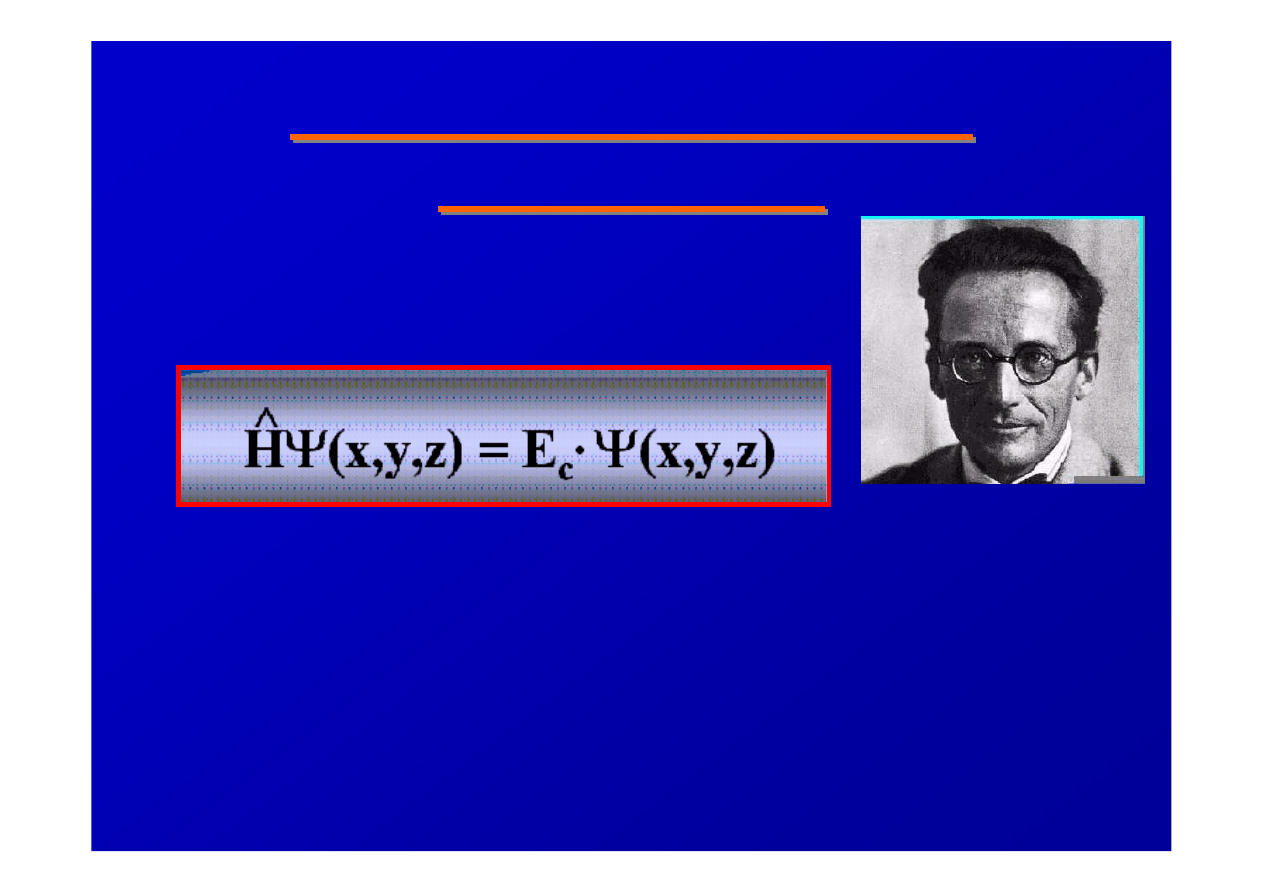
1926 - Równanie Erwina
Schrodingera
1926 - Równanie Erwina
Schrodingera
stworzył równanie, które stało
si
ę
j
ą
drem fizyki kwantowej:
H – operator Hamiltona, E – energia ca
ł
kowita
Równania tego nie mo
ż
na upro
ś
ci
ć
, dziel
ą
c jego obie
strony przez funkcj
ę Ψ
, H nie jest mno
ż
nikiem
skalarnym, podczas gdy E jest wielko
ś
ci
ą
skalarn
ą
.

Równanie Schrodingera
Rozwi
ą
zaniem równania Schrodingera s
ą
tzw.
funkcje falowe
, które mog
ą
by
ć
zastosowane
do opisu stanu elektronu w atomie
(prawdopodobie
ń
stwo znalezienia elektronu
w danym miejscu wokół j
ą
dra).
Funkcja falowa Ψ jest funkcją położenia i
czasu t:
Ψ
(x, y, z, t)
Funkcja falowa
Ψ
Funkcja falowa
Ψ
Funkcja falowa
Ψ
jest funkcj
ą
poło
ż
enia i
czasu t:
dla cz
ą
stki o
energii E
1
otrzymamy
funkcj
ę
falow
ą
Ψ
1
, dla energii
E
2
-
Ψ
2
Ψ
(x, y, z, t)

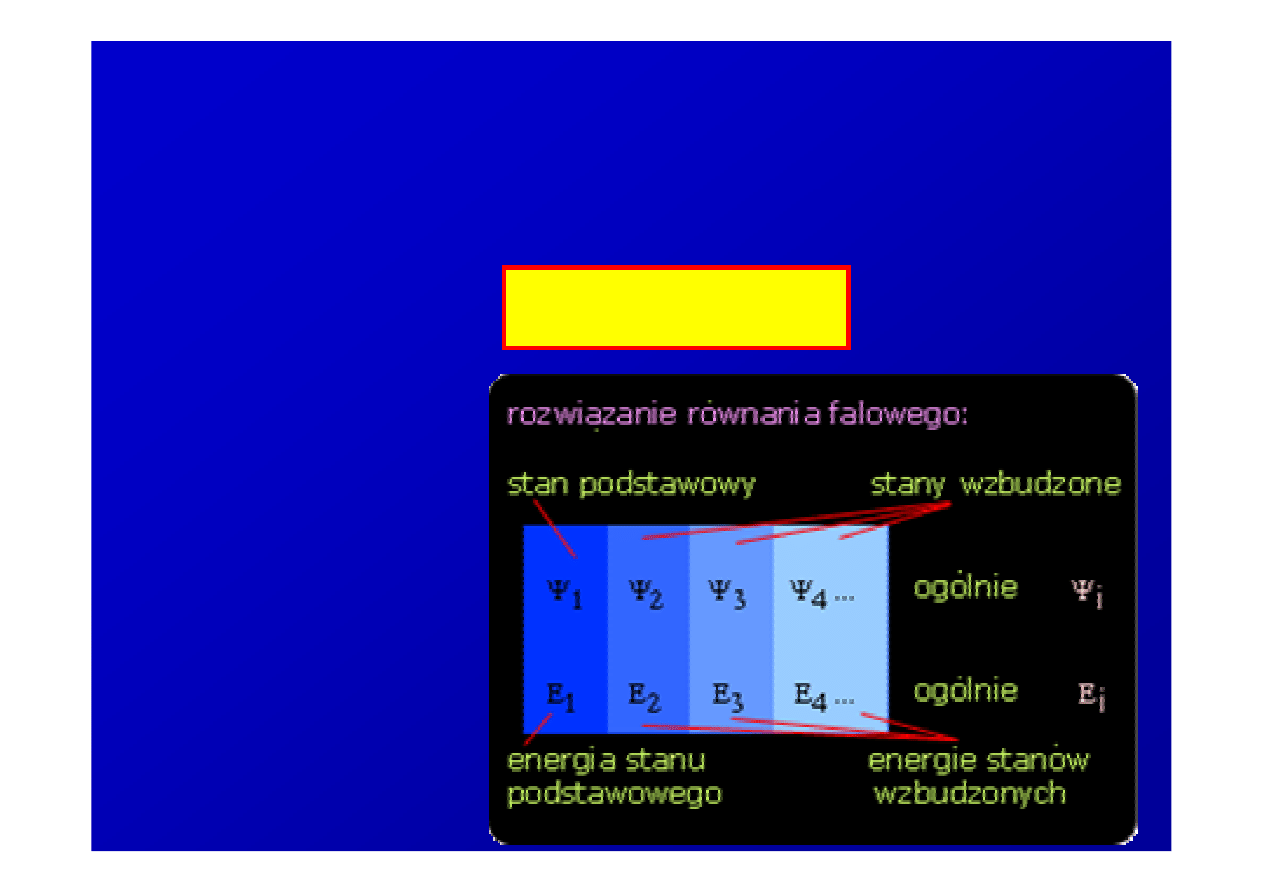
Stan stacjonarny i wzbudzony
Stan stacjonarny i wzbudzony
Stan stacjonarny o najni
ż
szej
energii (E
1
) nazywany jest
stanem podstawowym
,
pozostałe –
stanami
wzbudzonymi.
Tylko po absorpcji energii w wyniku zderzenia z
innym atomem lub fotonem atom przechodzi do
którego
ś
ze stanów wzbudzonych

Sens funkcji falowej
Sens funkcji falowej
Max Born:
kwadrat funkcji falowej |
Ψ
|
2
jest
równy g
ę
sto
ś
ci prawdopodobie
ń
stwa
lokalizacji elektronu wokół j
ą
dra:
P(∆V) = | Ψ (x, y, z)|
2
∆
V
Stosunek tego prawdopodobie
ń
stwa do obj
ę
to
ś
ci
elementu przestrzeni nazywa si
ę
g
ę
sto
ś
ci
ą
lub
chmur
ą
prawdopodobie
ń
stwa
wyst
ę
powania
elektronu w przestrzeni

Orbital atomowy
Orbital atomowy
Kształt chmury prawdopodobie
ń
stwa
wyst
ę
powania elektronu dobrze i pogl
ą
dowo
opisuje dany stan elektronowy, wskazuj
ą
c gdzie
elektron przebywa najwi
ę
cej, a których
obszarów unika.
Funkcj
ę
falow
ą Ψ
opisuj
ą
c
ą
rozkład prawdopodobie
ń
stwa
napotkania elektronu w
jakimkolwiek atomie
nazywamy
orbitalem
Orbitale atomowe
typu s
kształt sferyczny
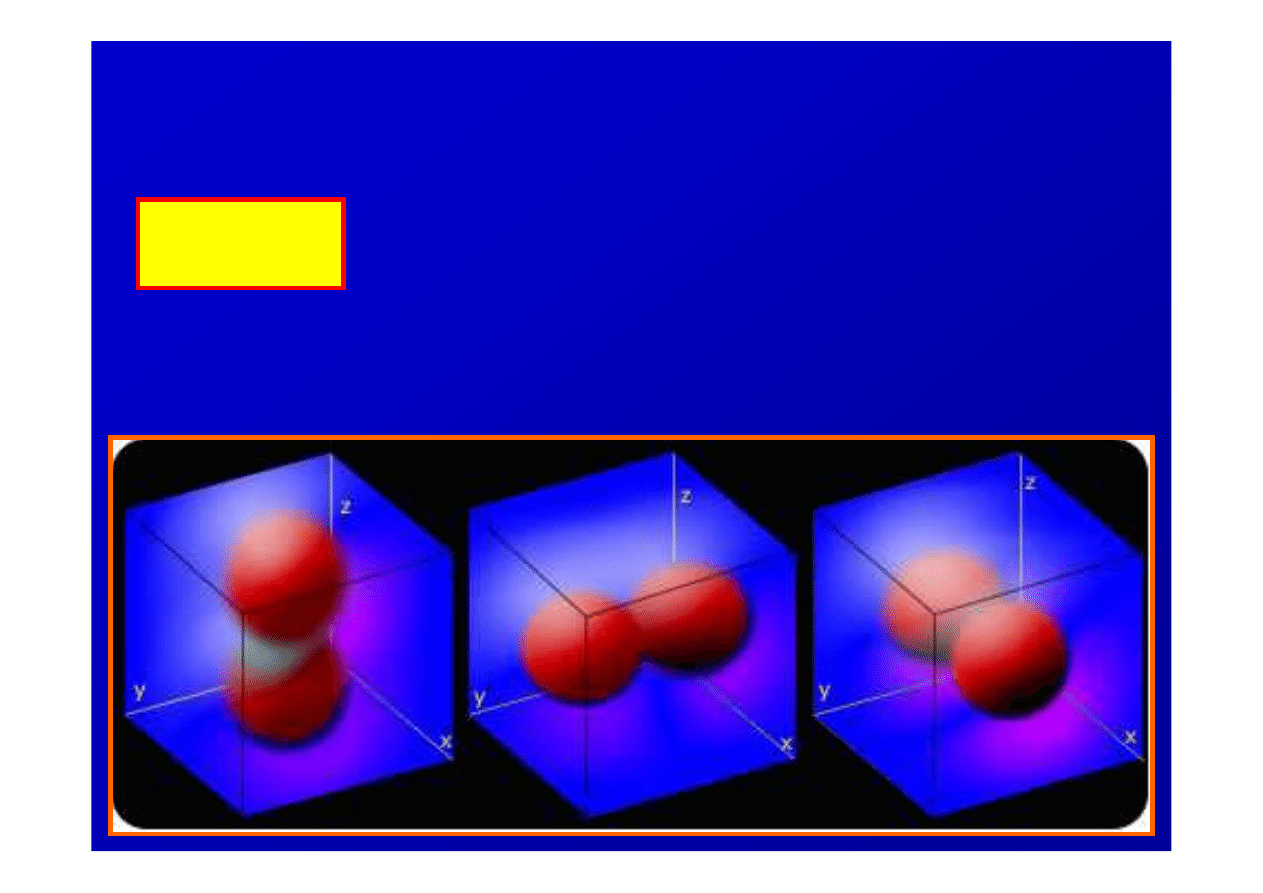
Orbitale atomowe
typu p
kształt figur powstałych przez obrót
ósemki dookoła podłu
ż
nej osi,
prawdopodobie
ń
stwo znalezienia si
ę
elektronu w
ś
rodkowej cz
ęś
ci jest
równe zeru

Orbitale atomowe
typu d
kształt
zło
ż
ony

Orbitale atomowe
typu f
symetryczny rozkład w przestrzeni, ale
jeszcze bardziej zło
ż
ony kształt
Pełn
ą
graficzn
ą
ilustracj
ę
wszystkich orbitali
mo
ż
na znale
źć
pod adresem:
http://www.orbitals.com/orb/orbtable.htm

Liczby kwantowe
Liczby kwantowe
Funkcja falowa ma w swojej postaci pewne
parametry, które nale
ż
y zna
ć
, aby obliczy
ć
jej warto
ść
. Te parametry to tzw.
liczby
kwantowe
, które przyjmuj
ą
okre
ś
lone
warto
ś
ci.

Główna liczba kwantowa
Główna liczba kwantowa
Okre
ś
lana liter
ą
n
okre
ś
la energi
ę
powłoki elektronowej
n = 1, 2, 3, ….

Orbitalna liczba kwantowa
Orbitalna liczba kwantowa
Okre
ś
lana liter
ą
l
opisuje momentu p
ę
du, charakteryzuje
kształt orbitali atomowych
l = 0, 1, 2, 3, ….(n-1)
Orbitalna liczba kwantowa
Orbitalna liczba kwantowa
liczby orbitalne oznaczone s
ą
te
ż
małymi
literami:
s, p, d, f, g , …
h
g
f
d
p
s
Symbol podpowłoki
5
4
3
2
1
0
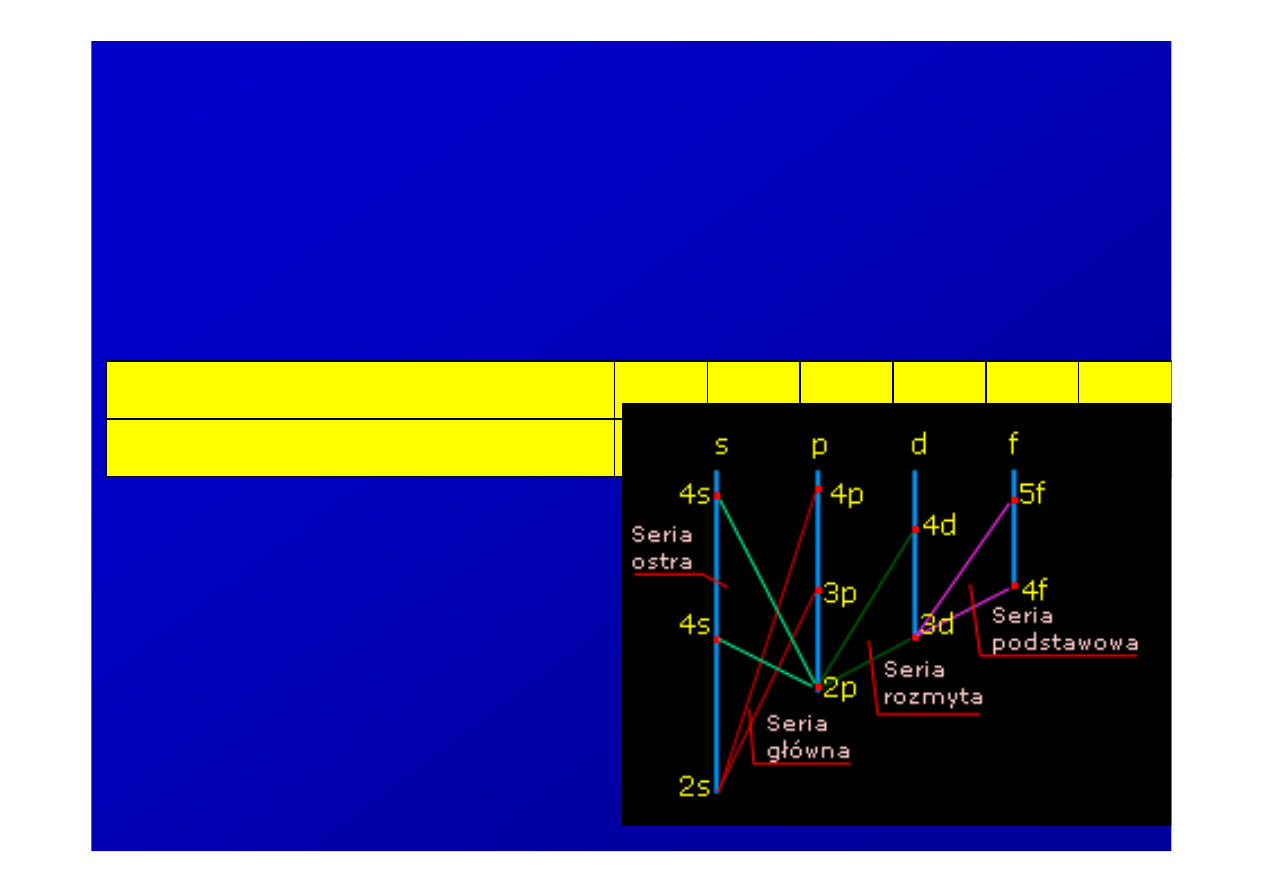
Orbitalna liczba kwantowa
s
/sharp/ ostra
•
p
/principle/ g
ł
ówna
•
d
/difusel/ rozmyta
•
f
/fundamental/ podstawowa
dalej stosuje si
ę
porz
ą
dek
alfabetyczny

Magnetyczna liczba kwantowa
Magnetyczna liczba kwantowa
Okre
ś
lana liter
ą
m
l
-l
≤
m
l
≥
l
jedna ze składowych wektora
momentu p
ę
du
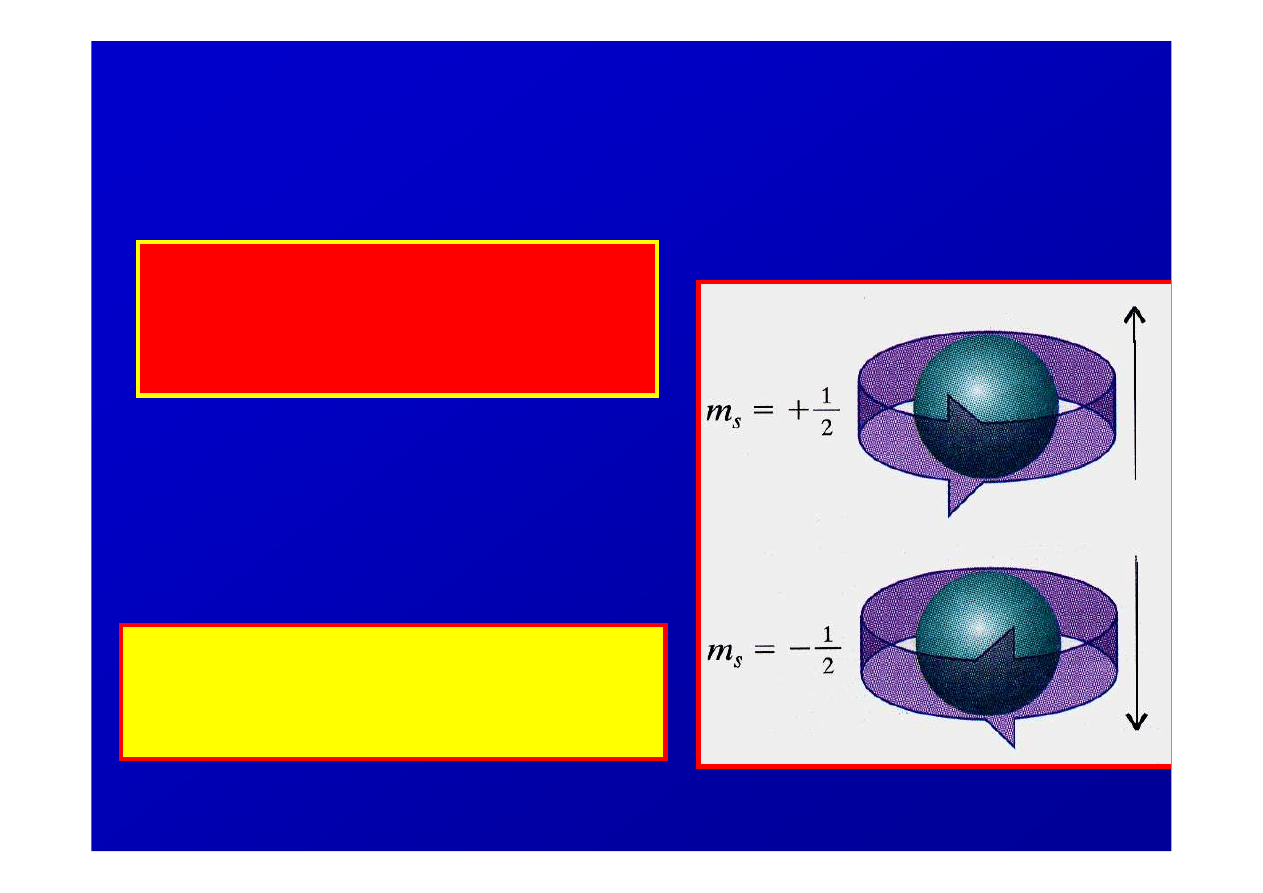
Magnetyczna spinowa liczba
kwantowa
Magnetyczna spinowa liczba
kwantowa
Okre
ś
lana liter
ą
m
s
m
s
= ± 1/2
opis ruchu
obrotowego elektronu
wokół własnej osi
Magnetyczna spinowa liczba
kwantowa
Magnetyczna spinowa liczba
kwantowa
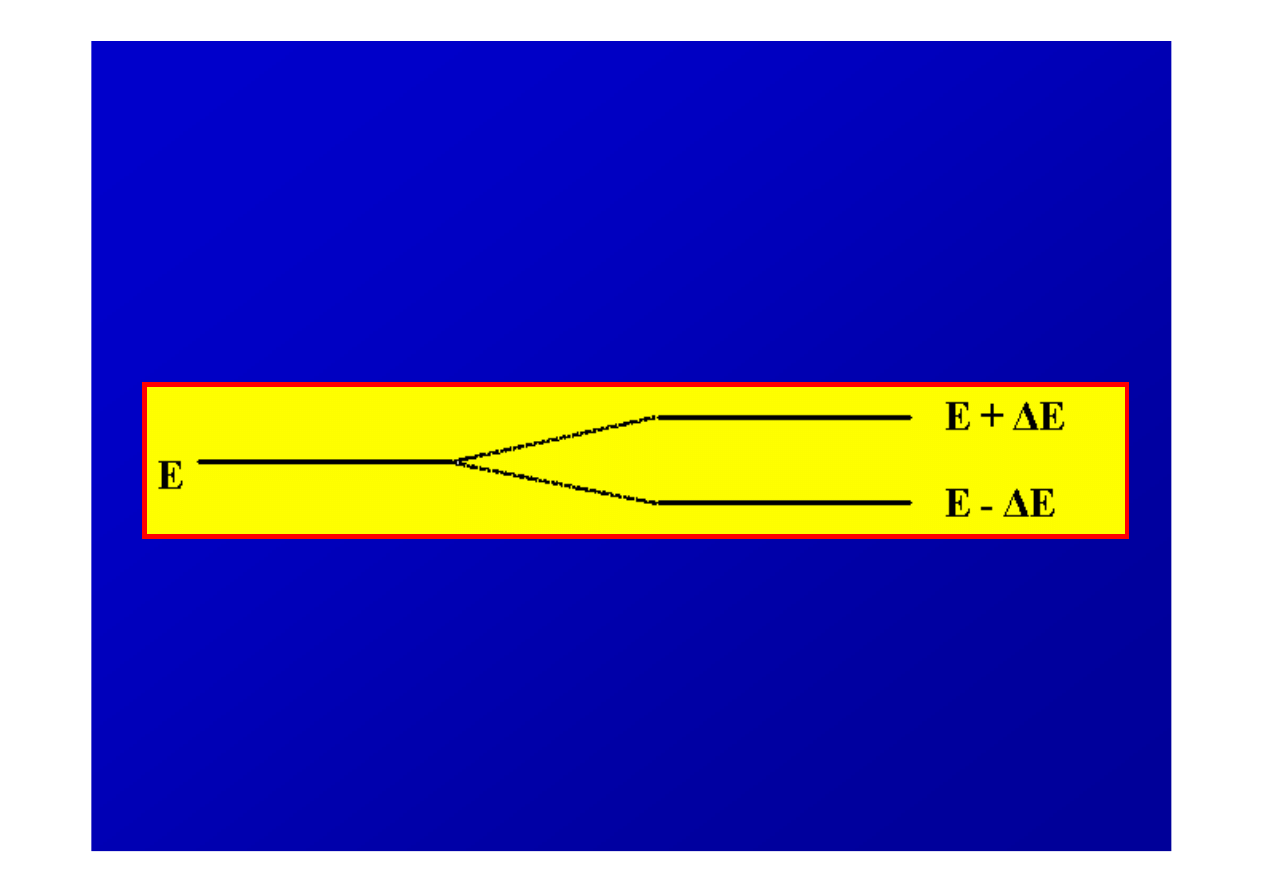
1927 r. - ka
ż
dy poziom energetyczny dozwolony dla
elektronu w atomie wodoru jest rozszczepiony na dwa
blisko siebie le
żą
ce poziomy
rozdwojenie linii widmowych tłumaczy si
ę
istnieniem
magnetycznej spinowej liczby kwantowej
W konsekwencji rol
ę
orbitalu atomowego przej
ą
ł
spinorbital atomowy
: jednemu orbitalowi
atomowemu odpowiadaj
ą
dwa spinorbitale
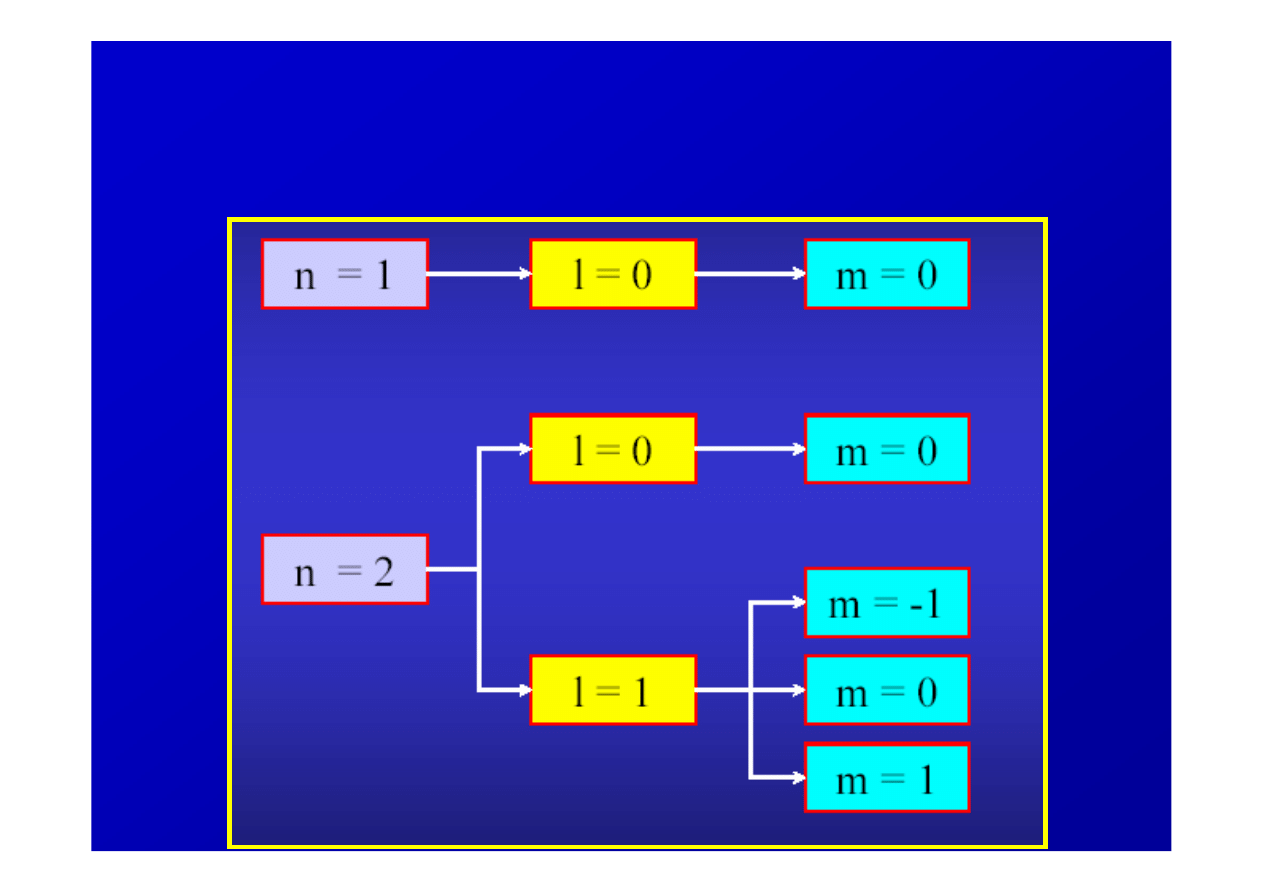
Przykładowe dozwolone zestawy
liczb kwantowych
Przykładowe dozwolone zestawy
liczb kwantowych

Analogia
Analogia
Porównanie:
atom - miasto
,
j
ą
dro - centrum miasta
,
wówczas: liczby kwantowe to adresy
orbitali
dzielnica
, w której znajduje si
ę
orbita,
jest okre
ś
lona przez
n
im mniejsze jest n, tym bli
ż
ej centrum
miasta znajduje si
ę
dzielnica
warto
ść
l
identyfikuje
ulic
ę
w
tej dzielnicy
m
l
podaje
numer
konkretnego
budynku
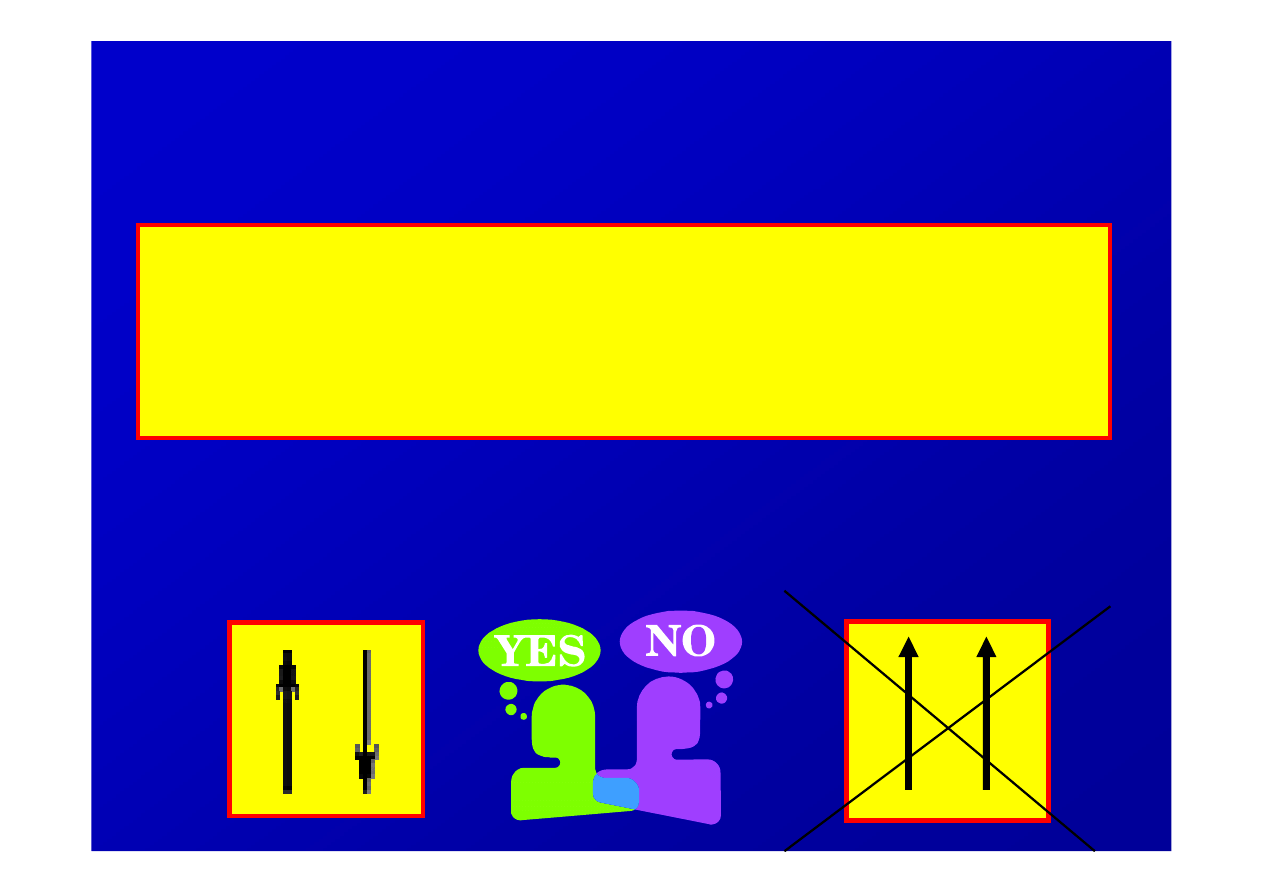
Zakaz Pauliego
Zakaz Pauliego
dwa elektrony mog
ą
zajmowa
ć
ten sam
orbital tylko wówczas, gdy ich spiny s
ą
przeciwne tj. zorientowane w
przeciwnych kierunkach
nie mog
ą
istnie
ć
dwa elektrony w identycznym
stanie kwantowym, tzn. maj
ą
ce identyczne
warto
ś
ci czterech liczb kwantowych (n, l, ml, m
s
)
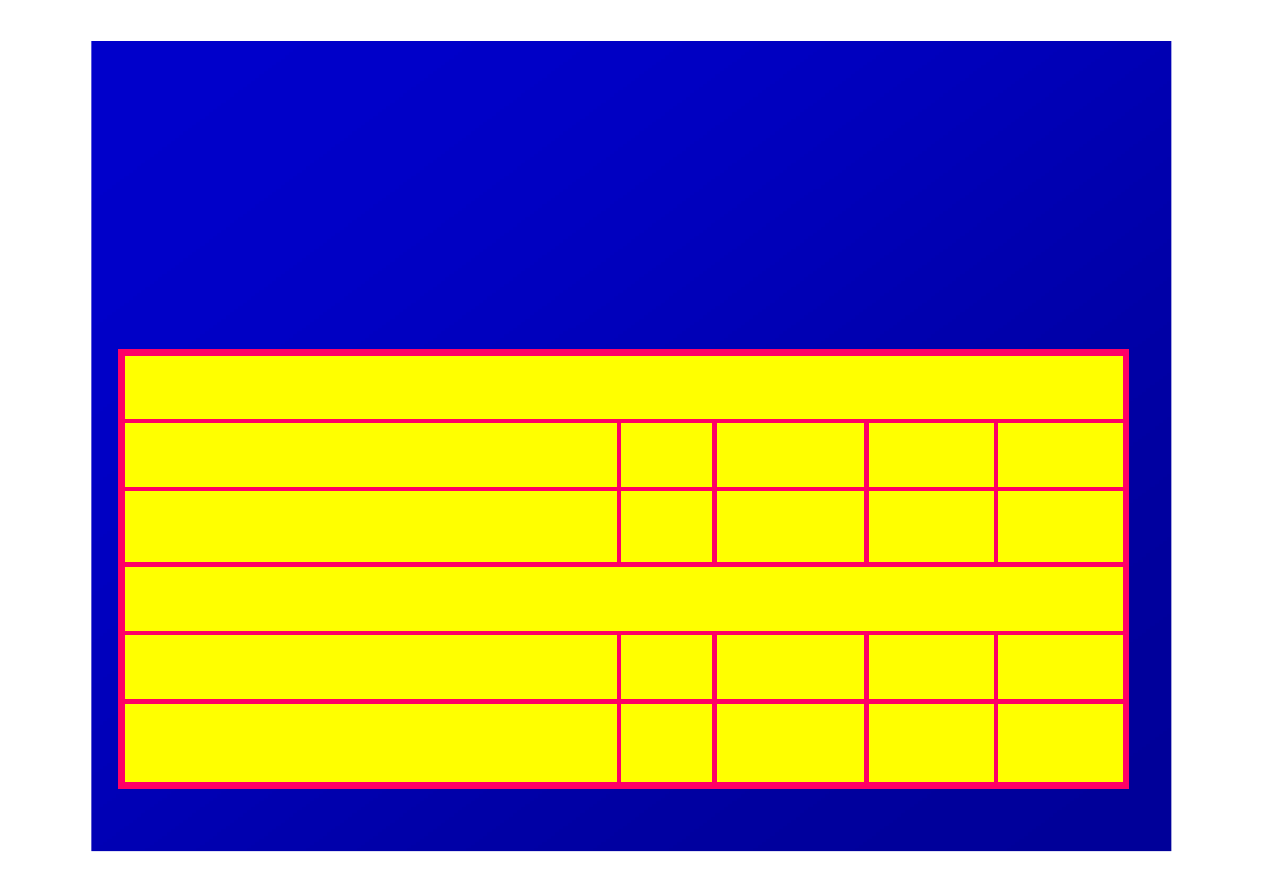
Na podstawie zakazu Pauliego łatwo mo
ż
na
wyliczy
ć
maksymaln
ą
liczb
ę
elektronów,
jaka mo
ż
e pomie
ś
ci
ć
si
ę
na
poszczególnych powłokach i
podpowłokach atomu
14
10
6
2
Max ilość elektronów
f
d
p
s
Nr podpowłoki
Podpowłoka
32
18
8
2
Max ilość elektronów
4
3
2
1
Nr powłoki
Powłoka
Wyszukiwarka
Podobne podstrony:
Budowa atomu id 94044 Nieznany (2)
Prezentacja ch Lojotokowe id 3 Nieznany
PREZENTACJA RYZYKO DYSLEKSJI id Nieznany
prezentacja separatyzmow BN id Nieznany
prezentacja z SOiSK 75017d01 id Nieznany
Prezentacja ch Lojotokowe id 3 Nieznany
ztzk prezent dla mamy id 593185 Nieznany
Prezentacja multimedialna(1) id Nieznany
karta do prezentacji zajecia id Nieznany
Budowa materii id 94290 Nieznany (2)
BCh Budowa zwiazkow id 81937 Nieznany (2)
prezentacja HIV I AIDS id 39054 Nieznany
BUDOWA DREWNA id 94109 Nieznany (2)
Budowa Drog1 id 94112 Nieznany
miareczkowanie prezentacja id Nieznany
PREZENTACJA po prostu cwicz id Nieznany
Budowa krtani id 94261 Nieznany (2)
więcej podobnych podstron